Федеральное агентство по образованию бийский технологический институт (филиал)
| Вид материала | Учебное пособие |
| 6.2 Конструирование рекомбинантных ДНК 6.3 Идентификация клеток-реципиентов, содержащих рекомбинантные гены |
- Федеральное агентство по образованию бийский технологический институт (филиал), 1531.98kb.
- Федеральное агентство по образованию Бийский технологический институт (филиал), 2694.55kb.
- Федеральное агентство по образованию бийский технологический институт (филиал), 2134.54kb.
- Федеральное агентство по образованию бийский технологический институт (филиал), 1660.78kb.
- Федеральное агентство по образованию бийский технологический институт (филиал), 1946.38kb.
- Федеральное агентство по образованию бийский технологический институт (филиал), 3460.44kb.
- Решением Ученого совета, 125.93kb.
- Федеральная целевая программа "Развитие электронной компонентной базы и радиоэлектроники", 3538.74kb.
- Бийский технологический институт (филиал), 2586.35kb.
- Министерство образования и науки федеральное агентство по образованию майкопский государственный, 102.13kb.
6.2 Конструирование рекомбинантных ДНК
Сущность генетической инженерии сводится к целенаправленному конструированию генетических систем вне организма и последующему введению их в живой организм. При этом рекомбинантные ДНК становятся составной частью генетического аппарата реципиентного организма и, кроме того, они привносят в него новые генетические и физико-биотехнологические свойства.
Один из важных этапов конструирования молекулы ДНК – лигирование (или сшивание) генов с помощью фрагмента ДНК – лигазы. Сшивание фрагментов ДНК, содержащих нужные гены, осуществляют двумя основными методами:
а) по «липким» концам;
б) с помощью искусственно достроенных «липких» концов (ферментативным путем). «Липкие» концы – взаимнокомплементарные участки, длиной из 4…6 пар нуклеотидов.
После того, как рекомбинантная ДНК сшита, ее вводят в живые клетки. Но поскольку она не способна к самовоспроизведению, ее разрушают внутриклеточные нуклеазы. Для того, чтобы рекомбинантная ДНК стала составной частью генетического аппарата клетки, она должна либо встроиться (интегрироваться) в ее геном и реплицироваться за его счет, либо быть способной к автономной репликации. Молекулы ДНК, способные акцептировать чужеродную ДНК и автономно реплицироваться, называют векторными молекулами. К числу векторов относят плазмиды, бактериофаги, вирусы животных. Векторы должны обладать следующими особенностями:
1) иметь субстратные участки для определенных эндонуклеаз рестрикции;
2) иметь свойства репликона;
3) содержать один или несколько маркерных генов, которые после проникновения вектора в клетку придают ей фенотип, свидетельствую-щий о присутствии вектора.
В частности, для бактериальных векторов в качестве маркерных генов чаще всего используются гены, вызывающие устойчивость клеток к некоторым антибиотикам.
Таким образом, все векторы обеспечивают репликацию встроенных генов, их экспрессию, интеграцию в хромосому клетки и т.д.
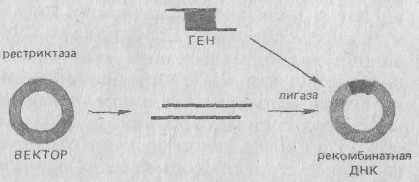
Рисунок 6 – Встраивание изолированного гена в генетический вектор
Чаще других в генетической инженерии в качестве векторов используют плазмиды.
Первый плазмидный вектор был получен С. Коэном (1973 г). Его источником была плазмида E.coli R6-5 c молекулярной массой 65 кDa. Плазмида стала родоначальником серии векторов и других структур. Особое место в генетическом манипулировании занимает плазмида, относящаяся к группе колициногенных плазмид Е.coli, Col E1, которая реплицируется независимо от хромосомы и присутствует в количестве, примерно, 24 копий на клетку. Ее широко используют благодаря селективному маркеру в качестве вектора для клонирования фрагментов про- и эукариотической ДНК в E.coli.
Плазмидные векторы в настоящее время чрезвычайно разнообразны за счет следующих свойств:
– уменьшения размеров плазмиды вследствие изъятия участков, не обязательных для репликации (чем больше плазмида содержит уникальных участков узнавания для рестриктаз, тем они универсальнее);
– гибридизации векторов одного рода с другими векторами или природными плазмидами (например, получены гибридные векторы комбинацией плазмиды и фага-λ), при этом вновь сконструированная рекомбинантная ДНК должна сохранить репликационные свойства исходной плазмиды;
– использования новых плазмид;
– применения транспозонов;
– создания векторов с генетическими маркерами, позволяющими вести отбор рекомбинантных клонов.
Векторные плазмиды и векторные вирусы со встроенными чужеродными генами часто называют гибридными или химерными плазмидами (или фагами). После конструирования рекомбинантных ДНК их с помощью трансформации вводят в реципиентный организм: бактериальную, грибную, растительную или животную клетку.
Трансформация предусматривает предварительную обработку клеток соединениями, обусловливающими проникновение ДНК внутрь клеток с последующим их помещением в среду, в которой способны существовать только клетки, получившие векторную молекулу (например, в среду с определенным антибиотиком).
Процесс инфицирования клеток с помощью чужеродных ДНК, приводящий к образованию зрелого фагового потомства, назван трансфекцией, то есть вирусные частицы развиваются в клетке, при этом она приобретает новые свойства.
При обработке клеток бактерий хлористым кальцием их клеточные стенки становятся проницаемыми для ДНК. Однако эффективность проникновения экзогенной ДНК в клетку довольно низкая, трансформируется небольшая часть клеток. Из общей массы их отделяют клонированием. Для этого бактериальную суспензию высевают в чашки Петри из расчета от 5 до 10 бактерий на 1 см3 поверхности. Одна клетка образует на поверхности маленькую колонию, называемую клоном. Из одной клетки образуется один клон, все клетки которого имеют свойства бактерии-родоначальника.
6.3 Идентификация клеток-реципиентов, содержащих
рекомбинантные гены
Необходимо идентифицировать клетки, несущие ген-мишень. После трансплантации генов лишь небольшая часть клеток содержит необходимый ген. Отбор клеток проводят в две стадии.
Первая стадия – поиск клеток, несущих вектор, например, по приобретенной способности быть устойчивыми к антибиотикам.
Вторая стадия – поиск клеток, несущих и вектор, и ген-мишень. Для этого используют две группы методов:
а) методы, основанные на непосредственном анализе ДНК клеток-реципиентов:
– определение нуклеотидной последовательности ДНК, когда из клеток, предположительно содержащих искомый ген, выделяют ДНК вектора, затем проводят секвенирование;
– гибридизация выделенной ДНК с зондом, который может быть интересующим геном или соответствующей ему м-РНК;
б) методы, основанные на определении признака, кодируемого геном:
– непосредственный отбор клеток, синтезирующих белок – продукт транскрипции и трансляции гена-мишени;
– использование селективных сред, поддерживающих рост только тех клеток, которые получили ген-мишень, например, клетки, несущие ген β-галактозидазы культивируют на среде с лактозой;
– иммунологическая детекция, например, при поиске в бактериях α-интерферона человека его связывают с антителами, то есть ген идентифицируют с помощью специфических антител к его белковому продукту.
