Муниципальное общеобразовательное учреждение
| Вид материала | Урок |
СодержаниеВариант №1 |
- Муниципальное общеобразовательное учреждение, 999.25kb.
- Муниципальное общеобразовательное учреждение, 515.34kb.
- Публичный доклад, 1547.48kb.
- Муниципальное общеобразовательное учреждение, 822.73kb.
- Муниципальное автономное общеобразовательное учреждение, 794kb.
- Муниципальное общеобразовательное учреждение, 908.15kb.
- Приказ № от 2011г. Рабочая программа учебного предмета Муниципальное общеобразовательное, 767.15kb.
- Муниципальное автономное общеобразовательное учреждение, 282.06kb.
- Департамент образования г. Братска муниципальное общеобразовательное учреждение лицей, 738.03kb.
- Департамент образования г. Братска муниципальное общеобразовательное учреждение лицей, 1002.75kb.
Муниципальное общеобразовательное учреждение
«Средняя общеобразовательная школа №7»
Левокумского района Ставропольского края



(УРОК ПОСВЯЩЕННЫЙ 175-ЛЕТИЮ СО ДНЯ РОЖДЕНИЯ Д.И.МЕНДЕЛЕЕВА)
Девиз урока:
«Развитие происходит путём скачкообразного перехода количественных изменений в качественные, от низшего к высшему, от простого к сложному.»
Основные образовательные задачи урока:
- Обобщить и закрепить знания учащихся о составе и свойствах основных классов неорганических сведений.
- Раскрыть противоположность свойств соединений типичных металлов и типичных неметаллов.
- На конкретных примерах получения одних в-в из других показать существенные связи между неорганическими веществами.
- Дать понятие о генетической связи между классами неорганических соединений. Ввести новое понятие – «генетический ряд».
- Научить учащихся и выполнять задание по составлению уравнений реакций по схеме, а также составлять схемы превращения веществ.
- Научить практически, получать новые вещества.
Межпредметные и внутрикурсовые связи:
- межпредметные: биология – классификация растительного и животного мира, использование минеральных удобрений, фотосинтез.
- Внутрикурсовые – химические свойства кислорода, водорода, оксидов, оснований, кислот.
Тип урока: урок совершенствования знаний и умений учащихся.
Основные методы обучения: беседа в сочетании с самостоятельной работой учащихся; лабораторная работа; демонстрация опытов.
В

 ид работы учащихся при получении новых знаний: составление схемы выполнение лабораторной работы запись управлений реакций.
ид работы учащихся при получении новых знаний: составление схемы выполнение лабораторной работы запись управлений реакций.Оборудование урока:
На столах учащихся (на каждом рабочем месте):
- Реактивы – простые в-ва (сера, уголь, железо, цинк, магний); оксиды (оксид магния, оксид меди (ll) , оксид кальция), основания (гидроксиды натрия, калия в кристаллическом виде), кислоты (растворы соляной, фосфорной, серной кислот); соли (карбонат магния, хлорид магния, фосфат натрия в кристаллическом виде); индикаторы – фенолфталеин, метиловый оранжевый, лакмус.
- Оборудование и материалы: 10 пробирок, ложечки для кристаллических веществ; справочная схема – классификация веществ (см.схему №1), карточки с заданиями для самостоятельных работ.
На столе учителя:
- 4 цилиндра с кислородом;
- сера, магний;
- ложечка для сжигания веществ в кислороде;
- схемы – классификация веществ, генетическая связь между оксидами, основаниями, кислотами и солями;
- штатив с подсветом;
- кодопозитивы, кодоскоп, компьютер.
Оформление стенда: «Сегодня на уроке»:
Узнаете: о связи между веществами, которая проявляется в их взаимном превращении и называется генетической; о значении и практическом применении знаний; о способах получения новых веществ.
Научитесь: получать новые вещества определенного состава, составлять схемы генетической связи между веществами.
Лабораторные опыты: Получение фосфата кальция из оксида кальция прямым и косвенным путем.
Демонстрационный эксперимент:
- Сжигание серы в кислороде и растворение оксида серы (4) в воде.
- Сжигание магния в кислороде и получение гидроксида магния.
Урок начинаем с актуализации опорных знаний учащихся. Подчеркиваю гениальность русского ученого Д.И.Менделеева, который открыл один из важнейших законов химии – периодический. В отличие от других ученых Д.И.Менделеев был глубоко уверен, что между химическими элементами существует определенная связь, объединяя их в единое целое. Периодический закон и периодическая система до настоящего времени определяют пути дальнейшего развития химии.
Напоминаем, что в процессе изучения химии учащиеся ознакомились со свойствами некоторых простых и сложных веществ: кислорода, водорода, воды, оксидов, оснований, кислот и солей.
На этом уроке полученные ранее знания необходимо привести в строиную систему, продолжить их совершенствование, установить связь между изученными веществами, выяснить причины взаимного превращения одних веществ в другие.
Важно убедить учащихся в том, что знания по химии которые они приобрели, необходимы в практической жизни, так как они помогут понять сущность многих процессов происходящих вокруг. Обращаю внимание учащихся на стенд «Сегодня на уроке», подчеркиваю, что учащиеся должны узнать и усвоить на уроке, чему научиться.
Перед тем как перейти к изучению нового материала, необходимо повторить и в дальнейшем использовать уже изученный материал о составе и свойствах сложных веществ.
Демонстрируем через кодоскоп на экран карточку №1: оксид кальция, азотная кислота, гидроксид натрия, оксид серы (4).
Предлагаю учащимся записать в столбик формулы этих веществ, указать к какому классу неорганических соединений они относятся, подчеркнуть одной чертой атомы или группы атомов, которые являются существенным признаком принадлежности данного вещества к определенному классу.
Далее предлагаю учащимся против каждой приведенной формулы записать формулы веществ, имеющих противоположные свойства.
На данном этапе работы запись может иметь следующий вид:
CaO – P2O5
HNO3 – KOH
NaOH – HCl
SO3 – MgO
На вопрос в чём состоит противоположность химических свойств оксида кальция – CaO и оксида фосфора (5) - P2O5, азотной кислоты – HNO3 и гидроксида калия – KOH учащиеся отвечают, что оксид кальция, как основной оксид, не взаимодействует с основаниями, а при взаимодействии с кислотами даёт соль и воду.
Оксид фосфора (5) как кислотный оксид при взаимодействии со щелочами дает соль и воду. Аналогично характеризуют свойства азотной кислоты и гидроксида калия. При дальнейшем выполнении этого задания учащиеся должны установить, атомы каких элементов, входящих в состав молекул оксидов и гидроксидов, явились причиной обусловливающей противоположные свойства, подчеркнуть их двумя чертами. После выполнения задания и его фронтального обсуждения процитируем общий вид выполненной работы:
CaO

HNO3

NaOH

SO3

Ученики сверяют свои записи и продумывают выводы, которые можно сделать о причинах, влияющих на проявление кислотных и основных свойств оксидов и гидроксидов:
- Если в состав оксида входит типичный металл, оксид проявляет свойства основных оксидов, если оксид образован типичным неметаллом, оксид проявляет свойства кислотных оксидов.
- Если в состав гидроксида входит типичный металл, то этот гидроксид проявляет свойства оснований, а если в состав гидроксида входит типичный неметалл, гидроксид проявляет свойства кислот.
Поясняю, что установленные причины и закономерности будем изучать, и следовательно, сможете объяснить в старших классах. А сейчас учащиеся должны запомнить, что противоположные свойства веществ зависят от качественного состава их. Именно противоположность свойств веществ лежит в основе их взаимодействия друг с другом. Сообщаю учащимся, что в природе постоянно происходят разнообразные превращения веществ из одних веществ образуются другие. Но между прежними и вновь образованными веществами существует единство, которое заключается в том, что все они состоят из атомов одних и тех же химических элементов.
На уроках биологии растений в общих чертах изучали процесс образования крахмала в зеленых растениях (фотосинтез). Предлагаю им вспомнить, из каких веществ , и при каких условиях образуется крахмал, и на основании известных им фактов предсказать качественный состав молекулы органического вещества – крахмала.
Учащиеся отмечают, что молекула крахмала должна состоять из атома углерода, водорода и кислорода, так как эти элементы входили в состав исходных неорганических веществ – углекислого газа и воды.
На этом примере подчеркиваем еще раз единство неорганического и органического мира.
ВЫВОД:
В природе все процессы взаимосвязаны и взаимообусловлены.
Продолжая урок, отмечаю, что многие химические реакции человек использует для получения новых необходимых ему веществ . Так, зная свойства водорода как восстановителя, металлурги используют это вещество при получении некоторых металлов из руд. Строители используют свойство негашеной извести CaO взаимодействовать с водой и при этом образовывать вяжущее вещество – гашеную известь Ca (OH)2 для получения вещества, необходимого при кладке и штукатурке стен.
Используя компьютер проецирую на экране карточку №2
C
 aO + H2O Ca(OH)2 + Q
aO + H2O Ca(OH)2 + QХарактеризуя процесс гашения извести и используя запись уравнения реакции, учащиеся отмечают, что оксид кальция-основной оксид, он взаимодействует с водой с образованием гидроксида кальция. Это реакция соединения.
Рассказываю учащимся, что строители проводят гашение извести очень осторожно, так как знают, что при реакции выделяется большое количество теплоты (в управлении реакции обозначен тепловой эффект), а гашеная известь Ca (OH)2 - очень едкое вещество.
Затем предлагаю учащимся восстановить в памяти классификацию неорганических веществ, используя выданную схему №1 и провожу самостоятельную работу по следующему заданию «Классифицируйте имеющие на столах вещества. Среди представителей класса солей найдите карбонат кальция, запишите его формулу. Среди простых веществ найдите родоначальников данной соли.
Используя таблицу, найдите промежуточные вещества и составьте схему постоянного перехода от угля к карбонату кальция и от кальция к карбонату кальция».
Ученики составляют схемы в тетрадях:
-

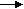 C CO2 H2CO3
C CO2 H2CO3-
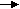
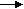
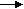 Ca CaO Ca (OH)2 CaCO3
Ca CaO Ca (OH)2 CaCO3Проверяем правильность выполнения задания и подчеркиваем, что образовались два ряда родственных веществ. Такой родственный ряд веществ, образованный от одного элемента (например, углерода, образующего уголь) называется генетическим рядом. Объясняю происхождение слова «генетический».
В генетическом ряду между различными веществами. Снова обращаю внимание учащихся на стенд «Сегодня на уроке». Ученики записывают: связь между веществами, которая проявляется, в их взаимном превращении называется генетической. Схемы, которые ученики записывают в тетрадях, отражают два генетических ряда. Одному ряду дает начало неметалл, другому – металл. Спрашиваю у учащихся: посредством, какого вещества можно установить родственные связи между двумя этими рядами? Введите это вещество в схемы.
Для проверки и уточнения записей учащихся проецирую на компьютере схему в полном виде
C

 CO2 H2CO3
CO2 H2CO3


 Ca CO3
Ca CO3



C

 a CaO Ca (OH)2
a CaO Ca (OH)2В итоге этой работы подчеркиваем, что генетическая связь существует не только между веществами одного генетического ряда, но и между генетическими рядами. Генетическую связь устанавливают и раскрывают через получение веществ одного класса из веществ другого класса при взаимодействии их друг с другом.
Закономерность генетической связи можно проследить на примерах окисления металла и неметалла и последующих реакций с продуктами окисления.
Заранее подготовленные учащиеся проводят демонстрацию опытов:
- горение серы в кислороде
- горение магния в кислород
Продукты горения растворяют в воде с помощью индикаторов определяют образование кислоты и щелочи (используют штатив для пробирок с подсветом), составляют на доске схемы проделанных реакций:
1

 / S SO2 H2 SO3
/ S SO2 H2 SO32
 / Mg MgO Mg (OH)2
/ Mg MgO Mg (OH)2Учащиеся внимательно выслушивают ответы у доски, выделяют главное в содержании вопроса и рецензируют ответы своих товарищей.
Указывают вещество, посредством которого можно установить родственную (генетическую) связь между генетическими рядами серы и магния.
S

 SO2 H2SO3
SO2 H2SO3

MgSO3



M

 g MgO Mg(OH)2
g MgO Mg(OH)2В заключении урока проводим лабораторную работу по заданию: «Используйте необходимые реактивы, имеющиеся на столах, и получите прямым и косвенным путем фосфат кальция. Составьте схемы, и используя их, выполните работу; запишите уравнение соответствующих реакций».
Учащиеся самостоятельно составляют схемы:
C
 aO Ca3(PO4)2
aO Ca3(PO4)2C

 aO Ca(OH)2 Ca3(PO4)
aO Ca(OH)2 Ca3(PO4)Получают заданное вещество двумя способами, записывают уравнения реакций.
С целью закрепления изученного на уроке предлагаю учащимся выполнить дифференцированные задания (средней трудности или усложненные). Задания даны на карточках, находящихся на каждом рабочем месте.
Карточка №3
^ ВАРИАНТ №1
Записать молекулярные уравнения переходов
1 2 3 4 5
C




 u CuO CuCl2 Cu(OH)2 CuO Cu
u CuO CuCl2 Cu(OH)2 CuO CuВАРИАНТ №2
1 2 3 4 5
S




 i SiO2 Na2SiO3 H2SiO3 SiO2 Si
i SiO2 Na2SiO3 H2SiO3 SiO2 SiКарточка №4
(усложненный вариант)
X
 Y X(OH)3 YO3
Y X(OH)3 YO3
X2O YO2 или X2O3 H2YO4


X

 OH H2YO3 X2(YO4)3
OH H2YO3 X2(YO4)3


 X2YO3
X2YO3При выполнении подобных заданий проявляется большая самостоятельность учащихся. Такой подход дает возможность организовать активную самостоятельную работу по прогнозированию св-в веществ. Так учащиеся приходят к пониманию того, что химия – это не набор фактов, а стройная логическая наука, где все обусловлено особенностям состава и свойствами вещества.
Подвожу итог изученному на уроке:
- Металлы и неметаллы образуют генетические ряды.
- Между простыми и сложными веществами, представителями разных классов, существует родственная связь, называемая генетической, которая проявляется в получении одних веществ из других.
- Знание генетической связи позволяет получать новые вещества определенного состава, необходимые человеку.
Объявляю оценки за ответы и практическое выполнение работ учащимся.
Задание на дом: § 42 упр.2,34
