Урогенитальный хламидиоз: клинико-иммунологическая характеристика, иммуногенетические маркеры, вопросы прогноза и лечения 14. 00. 11 кожные и венерические болезни
| Вид материала | Автореферат |
СодержаниеИммунологические показатели в общей группе больных урогенитальным хламидиозом |
- Клинико-лабораторная характеристика и лечение хламидийной инфекции, ассоциированной, 311.6kb.
- Обоснование применения пармелии в комплексной терапии экземы (клинико-экспериментальное, 349.46kb.
- Задачи по оказанию доврачебной помощи при неотложных состояниях 43 акушерство, 1884.21kb.
- «клинико-лабораторное обоснование эффективности лекарственной магнитотерапии хронических, 344.39kb.
- Изучение влияния клинико-социальных факторов на психические расстройства у больных, 464.61kb.
- Особенности диагностики и лечения синдрома диспепсии у детей с атопическим дерматитом, 335.95kb.
- Оптимизация лечения варикозной экземы, ассоциированной с микотической инфекцией,, 427.97kb.
- Усовершенствование метода терапии угревой болезни на основе коррекции дисфункциональных, 338.75kb.
- Комплексная терапия акне у женщин с метаболическими нарушениями 14. 01. 10 Кожные, 395.48kb.
- Выбор лечебной тактики у больных различными формами акне 14. 00. 11 кожные и венерические, 441.88kb.
Многообразие клинических форм течения УГХ позволяет предполагать наличие иммунологических сдвигов у больных. С целью дать оценку иммунологической реактивности организма больных с различными клиническими формами УГХ изучили иммунологические показатели у 317 наблюдавшихся (207 мужчин и 110 женщин) в возрасте от 18 до 55 лет. Клинические проявления заболевания отмечались у 257 обследованных (у 209 – симптомы уретрита, цервицита, аднексита; у 48 – симптомы хронического простатита), у 60 больных инфекция носила бессимптомный, скрытый характер. В качестве группы сравнения служили региональные нормативные показатели клеточного, гуморального иммунитета и факторов неспецифической резистентности 300 здоровых доноров крови. Результаты исследования показали, что при УГХ наблюдаются изменения различных показателей клеточного и гуморального звеньев иммунитета, что согласуется с данными литературы (табл.5) .
Таблица 5
^
Иммунологические показатели в общей группе больных урогенитальным хламидиозом
| Показатели | Контрольная группа (n=300) | Больные (n=317) | Р |
| Le | 6,1±0,1 | 5,5±0,1* | <0,001 |
| Лимфоциты, % | 30,4±0,8 | 34,9±0,51* | <0,001 |
| CD3+, % | 52,9±0,56 | 51,5±0,45* | <0,05 |
| CD3+, абс. | 0,94±0,03 | 0,9±0,021 | >0,05 |
| CD20+, % | 30,3±0,37 | 27±0,32* | <0,001 |
| CD20+, абс. | 0,56±0,02 | 0,5±0,11 | >0,05 |
| CD4+, % | 49,9±0,7 | 47,4±0,52* | <0,01 |
| CD8+, % | 21,96±0,4 | 23,6±0,39* | <0,01 |
| CD4+/CD8+ (ИРИ) | 2,35±0,06 | 2,2±0,05 | >0,05 |
| ФАН, % | 66,6±1,1 | 64,8±0,83 | >0,05 |
| ФИ | 7,8±0,12 | 8,7±0,13* | <0,001 |
| НСТ, % | 14,1±0,6 | 15,9±0,44* | <0,05 |
| ЦИК, ед.опт.пл. | 0,078±0,002 | 0,08±0,002 | >0,05 |
| Компл., усл.ед. | 5,08±0,05 | 5,1±0,03 | >0,05 |
| -лизины % | 20,9±0,5 | 24,1±0,39* | <0,001 |
| Лизоцим мг/мл | 6,94±0,1 | 6,9±0,07 | >0,05 |
| IgG г/л | 10,98±0,1 | 11,6±0,15* | <0,001 |
| IgA г/л | 2,3±0,06 | 2,9±0,072* | <0,001 |
| IgM г/л | 1,8±0,07 | 2,0±0,1 | >0,05 |
Выявленные изменения затрагивали в основном одни и те же показатели при разных клинических вариантах течения инфекции и не зависели от половой принадлежности больных. Однако, у пациентов с клиническими проявлениями УГХ иммунологические измененения были более выражены. В частности, это касается уровня IgG в крови обследованных больных, повышение которого было наибольшим у больных с четкой клинической симптоматикой (рис.1). Такие изменения отражают реакцию иммунной системы на инфекционный агент.
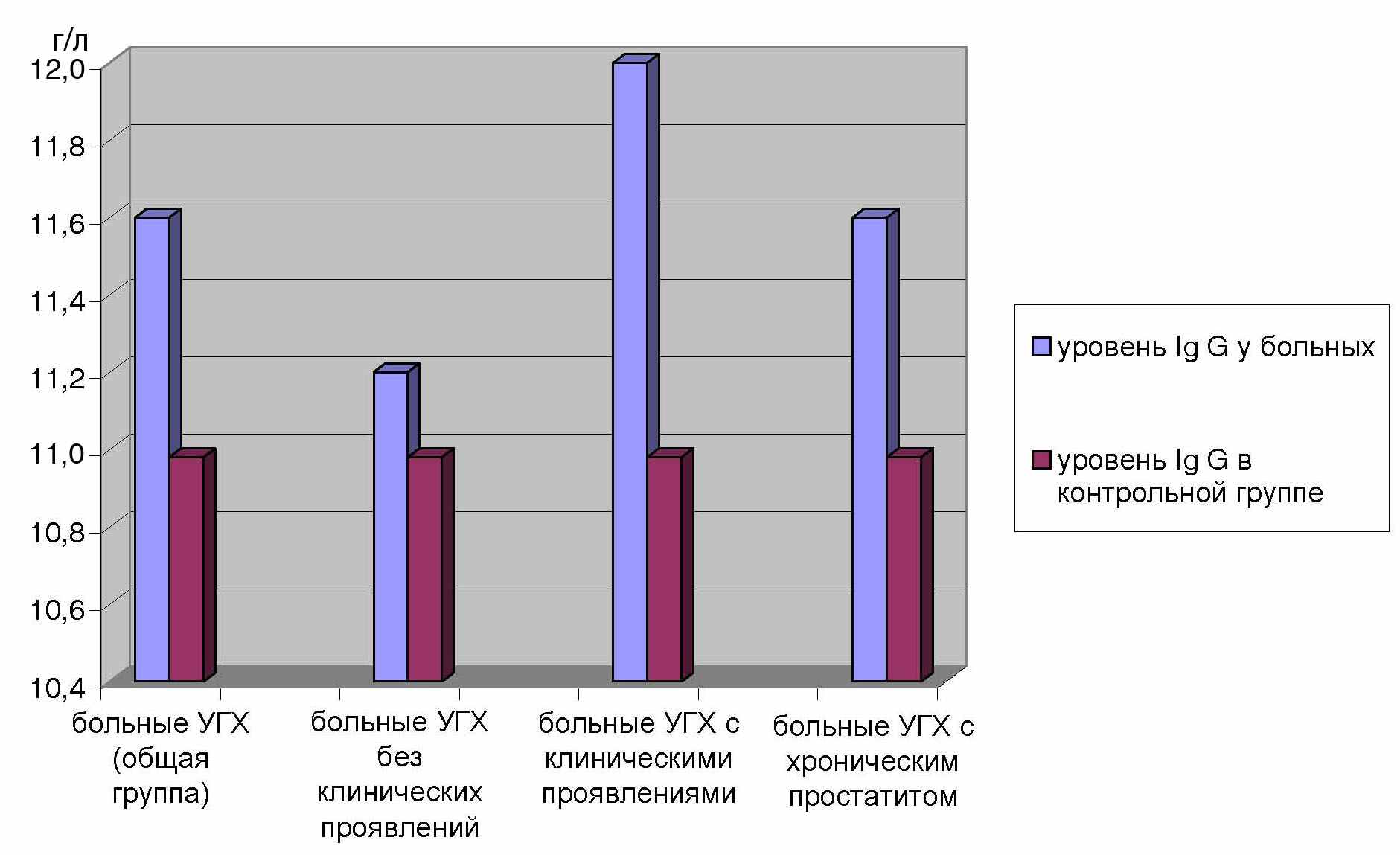
Рис.1 Уровень IgG при различных клинических формах УГХ.
Хорошо известно, что гиперпродукция цитокинов ведет к возникновению системной воспалительной реакции и может служить причиной развития ряда патологических состояний (Шестаков С.Г. и соавт., 2003; Ю.В.Раскуратов, И.В.Шебунова, 2004). Нами исследовано содержание провоспалительных цитокинов ИЛ-1β и ФНО-α в сыворотке крови 80 больных хламидиозом (44 мужчин, 36 женщин). Кроме того, у 27 больных определяли ИФН-α. Уровень ФНО- в сыворотке крови оказался повышен у 40,0% больных, ИЛ-1β – у 7,5%, ИФН- α – у 14,8% (табл.6).
Таблица 6
Распределение больных по уровню цитокинов в сыворотке крови
| ИЛ-1β (пкг/мл) n=80 | ФНО-α (пкг/мл) n=80 | ИФН-α (пкг/мл) n=27 | |||
| ≤ 50 | > 50 | ≤ 50 | > 50 | ≤ 50 | >50 |
| 74 (92,5%) | 6 (7,5%) | 48 (60,0%) | 32 (40,0%) | 23 (85,2%) | 4 (14,8%) |
Проанализировали клиническую значимость уровня ФНО-α у 44 мужчин с УГХ. Среди них выделили 2 группы: I группа (20 человек) – с уровнем ФНО-α > 50 пкг/мл, II группа (24 человека) – с активностью ФНО-α ≤ 50 пкг/мл. В первой группе у 6 (30,0%) больных уровень ФНО-α варьировал от 50 до 100 пкг/мл, у 9 (45,0%) - от 100 до 200 пкг/мл, у 1 (5%) - от 200 до 300 пкг/мл, у 4 (20,0%) – превышал 300 пкг/мл. Из этой группы у 19 (95%) пациентов выявлен хронический простатит в стадии обострения. У 24 мужчин второй группы показатели ФНО-α не превышали нормы (ФНО-α ≤ 50пкг/мл). У 16 человек (66,7%) они не достигали 1пкг/мл, у 6 (25,0%) – колебались от 1 до 10 пкг/мл, у 2 (8,3%) - от 20 до 50 пкг/мл. Среди больных этой группы у 14 (58,3%) выявлен хронический простатит. При статистической обработке данных установлено достоверное преобладание больных хроническим простатитом в первой группе (t=3,3; p<0,01).
Аналогичным образом 36 женщин, больных УГХ, были разделены на 2 группы: I группа (12 больных) – с показателями ФНО-α > 50 пкг/мл, II группа (24 больных) – с показателями ФНО-α ≤ 50 пкг/мл. У женщин I группы ФНО-α в 3 случаях (25,0%) составил 50 - 100 пкг/мл, в 5 (41,7%) - 100 - 200 пкг/мл, в 4 (33,3%) - более 300 пкг/мл. У всех пациенток данной группы диагностированы ВЗОМТ (аднексит). Полученные данные согласуются с результатами исследований Захаровой М.А. (2000), которой установлено, что поражение верхних отделов мочеполового тракта при УГХ у женщин сопровождается значительным повышением уровня ФНО-α в крови.
Из 24 женщин (второй группы) у 15 (62,5%) больных уровень ФНО-α не превышал 1 пкг/мл, у 7 (29,2%) составил 1 -10 пкг/мл, у 2 (8,3%) - > 20 пкг/мл. При этом у 16 (66,7%) выявлен цервицит, у 3 - уретрит, у 2 – аднексит; персистентная форма хламидийной инфекции диагностирована у 3 обследованных. При сравнении двух групп больных по частоте встречаемости ВЗОМТ с учетом показателей ФНО-α зарегистрировано достоверное преобладание больных с ВЗОМТ в I группе (t=16,4; p < 0,01). Следовательно, активность ФНО-α является является информативным показателем выраженности воспалительной реакции у больных УГХ. Определение указанного цитокина позволяет оценить интенсивность воспалительного процесса у больных и локализацию очага воспаления (верхние или нижние отделы мочеполового тракта). Полученные данные следует учитывать при проведении комплекса лечебно-профилактических мероприятий.
В результате определения групп крови системы АВ0 у 130 больных нам не удалось выявить различий в характере их распределения в общей группе обследованных больных от такового в популяции здоровых лиц. Полученные данные отличаются от результатов исследований Е.А. Ивашкова и соавт. (2002), которые установили, что частота обнаружения урогенитальной хламидийной инфекции коррелирует с 0(I) группой крови и отрицательным резус-фактором индивидуума. В то же время, нами констатировано, что среди мужчин с клиническими проявлениями УГХ чаще, чем у здоровых, встречается группа крови В(III), а у мужчин без клинической симптоматики - группа крови AB (IV) (табл.7).
Таблица 7
Характер распределения групп крови у пациентов-мужчин
| Группы крови | Больные с клиническими проявлениями (n=69) | Больные без клинических проявлений (n=14) | t | P | ||
| абс. | % | абс. | % | |||
| О(I) | 26 | 37,7 | 6 | 42,9 | 0,4 | >0,05 |
| А(II) | 20 | 29,0 | 2 | 14,3 | 1,4 | >0,05 |
| В(III) | 20 | 29,0 | 1 | 7,1* | 2,5 | <0,05 |
| АВ(IY) | 3 | 4,3 | 5 | 35,7* | 2,4 | <0,05 |
Учитывая ещё один важный аспект изучения проблемы, а именно, способность индивида к антителопродукции в зависимости от специфики антигенного состава тканей, изучили характер распределения групп крови у больных УГХ с различным титром специфических противохламидийных антител класса IgG. Установлено, что диагностические титры названных антител чаще регистрируются у больных с группой крови В (III), слабый специфический гуморальный ответ- с группой крови А (II) (табл.8).
Таблица 8
Характер распределения групп крови у больных УГХ
с различным уровнем специфических Ig G
| Группы крови | Титры Ig G | t | P | |||
| 1:32 – 1:512 (n=28) (диагностический) | Ig G отсутствуют (n=35) | |||||
| абс. | % | Абс. | % | |||
| О (I) | 10 | 35,7 | 11 | 31,5 | 0,4 | >0,05 |
| А (II) | 6 | 21,4 | 16 | 45,7* | 2,1 | <0,05 |
| B (III) | 11 | 39,3 | 6 | 17,1* | 2,0 | <0,05 |
| АВ (IV) | 1 | 3,6 | 2 | 5,7 | 0,4 | >0,05 |
Выявлены особенности и в распределении типов гаптоглобина, которые были определены у 140 больных: они заключались в снижении представительства типа Hp 2-1 как в общей группе обследованных (табл.9), так и среди больных с клиническими проявлениями хламидийной инфекции (табл.10).
Таблица 9
Распределение типов гаптоглобина в общей группе больных УГХ
| Типы гапто- глобина | Контрольная группа (n=624) | Больные (n=140) | t | P | ||
| абс. | % | абс. | % | | | |
| 1 - 1 | 45 | 7,3 | 18 | 12,9 | 1,9 | >0,05 |
| 2 - 1 | 253 | 40,5 | 44 | 31,4 | 2,1 | <0,05 |
| 2 - 2 | 326 | 52,2 | 78 | 55,7 | 0,7 | >0,05 |
Таблица 10
Распределение типов гаптоглобина у больных УГХ
(мужчин и женщин) с клиническими проявлениями
| Типы гапто- глобина | Контрольная группа (n=624) | Больные (n=117) | t | P | ||
| абс. | % | абс. | % | | | |
| 1 - 1 | 45 | 7,3 | 15 | 12,8 | 1,7 | >0,05 |
| 2 - 1 | 253 | 40,5 | 36 | 30,8* | 2,1 | <0,05 |
| 2 - 2 | 326 | 52,2 | 66 | 56,4 | 0,8 | >0,05 |
В доступной литературе не встретилось данных по изучению типа гаптоглобина у больных УГХ. Основываясь на результатах выполненного исследования, можно полагать, что Hp 2-1 выполняет определенную протекторную роль в отношении индивидуальной чувствительности к возбудителю.
Более полному выяснению биологической роли тканевых антигенов во многом способствовали работы по изучению генетического контроля иммунного ответа, в которых было установлено, что продукты HLA-комплекса осуществляют эффективную кооперацию всех звеньев иммунной системы. Таким образом, изучение антигенного полиморфизма тканей имеет существенное значение для понимания и расшифровки причин различной противомикробной устойчивости организма, разнообразия клинических форм и вариантов течения инфекции, выраженной вариабельности иммунного ответа.
Для установления HLA-маркеров, обусловливающих предрасположенность к УГХ и особенности его течения, исследовали характер распределения антигенов HLA класса I и их внутрилокусных и межлокусных сочетаний у 189 больных (табл.11). Среди наблюдавшихся больных были выделены группы в зависимости от клинических проявлений инфекции и половой принадлежности больных. Группу сравнения при расчёте иммуногенетических параметров класса I составили 795 практически здоровых донора.
Таблица 11
Особенности распределения некоторых HLA-антигенов и их сочетаний у больных УГХ
| HLA-антигены и их сочетания | Частота выявления | |||||||
| контрольная группа (n=795) | больные (n=189) | 2 | RR | EF | PF | |||
| абс. | % | абс. | % | |||||
| А2↓ | 374 | 47,0 | 71 | 37,6 | 5,9 | 0,7 | - | 0,9 |
| В16↑ | 61 | 7,7 | 27 | 14,3 | 7,4 | 2,0 | - | - |
| В17↑ | 56 | 7,0 | 24 | 12,7 | 5,8 | 1,9 | - | - |
| А1-В16↑ | - | 0,2 | - | 1,9 | - | 6,4 | - | - |
| А2-В7↓ | - | 3,8 | - | 1,5 | - | 0,4 | - | - |
Установлена положительная ассоциативная связь УГХ с антигенами HLA-комплекса В16, В17, сочетанием А1-В16. Присутствие в фенотипе индивида названных генетических признаков повышает риск развития УГХ в 1,9-6,4 раза. Полученные нами данные отличаются от результатов исследования Якубовича А.И. и соавт. (2000), которые выявили, что у больных УГХ достоверно чаще, по сравнению с контролем, встречаются антигены HLA-А28 и В27.
Предполагаем, что это можно объяснить, в первую очередь, популяционными особенностями в распределении HLA-антигенов. Нельзя полностью исключить влияния климатических и социальных условий, эпидемиологической обстановки. В названной работе не было оценено сочетание у больных антигенов в фенотипической и гаплотипической комбинациях, не были исследованы специфичности DR-локуса. Кроме того, в литературе отсутствуют данные об особенностях фенотипа женщин, больных УГХ.
В нашем исследовании отрицательная ассоциативная связь УГХ выявлена с антигеном А2, что согласуется с данными упомянутых авторов. Обнаружено также достоверное снижение частоты встречаемости сочетания А2-В7, то есть указанные продукты HLA-комплекса обеспечивают определенную резистентность к заболеванию.
Среди мужчин, как и в общей группе, чаще регистрировались антигены HLA-В16 и В17. У них чаще встречались сочетания В22-В35, А9-В17, тогда как у женщин - В8-В17, В12-В13, В12-В16, А1-В16, А1-В35, А19-В17. Выявлены ассоциации клинических проявлений УГХ с HLA-фенотипом (табл.12). Так, повышенный риск развития уретрита у мужчин ассоциируется с антигенами HLA-А1, В16, сочетаниями А1-В13, А1-В16, А9-В17, риск развития простатита – с антигенами В17 и В35, сочетаниями А2-В17, А3-В35, А10-В35. Выраженность клинических проявлений УГХ у женщин коррелирует с антигенными сочетаниями В8-В17, В12-В16, А1-В35. При персистирующей форме УГХ зарегистрировано увеличение частоты встречаемости лишь одного антигена В13 и сочетания В13-В15. Полученные данные могут быть использованы для прогнозирования риска развития УГХ и возможных вариантов его клинического течения.
Таблица 12
Сводные данные об особенностях распределения HLA-антигенов и их сочетаний в разных группах больных УГХ
| Группы больных | HLA-антигены и их сочетания | Частота выявления % (↓) - снижение (↑)-увеличение | 2 | p | RR | EF | PF | |
| больные | контрольная группа | | | | | | ||
| Группа I (общая) N=189 | А2 | 37,6 (↓) | 47,0 | 5,9 | < 0,05 | 0,7 | - | 0,9 |
| В16 | 14,3 (↑) | 7,7 | 7,4 | < 0,01 | 2,0 | - | - | |
| В17 | 12,7 (↑) | 7,0 | 5,8 | < 0,05 | 1,9 | - | - | |
| А1-В16 | 1,9 (↑) | 0,2 | - | - | 6,4 | - | - | |
| А2-В7 | 1,5 (↓) | 3,8 | - | - | 0,4 | - | - | |
| Группа II (мужчины) N=133 | В16 | 13,5 (↑) | 7,7 | 4,3 | < 0,05 | 1,9 | - | - |
| В17 | 12,8 (↑) | 7,0 | 4,4 | < 0,05 | 2,0 | - | - | |
| В7-В35 | 1,5 (↓) | 4,8 | 3,8 | > 0,05 | 0,3 | - | 0,7 | |
| В22-В35 | 3,8 (↑) | 0,6 | 7,7 | < 0,01 | 6,2 | 3,1 | - | |
| А2-В12 | 0,7 (↓) | 3,9 | - | - | 0,2 | - | - | |
| А9-В17 | 1,9 (↑) | 0,2 | - | - | 9,7 | - | - | |
| А10-В16 | 1,5 (↑) | 0,3 | - | - | 1,4 | - | - | |
| Группа III (женщины) N=56 | В8-В17 | 3,6(↑) | 0,4 | 4,5 | < 0,05 | 9,8 | 3,2 | - |
| В12-В13 | 5,3(↑) | 0,5 | 9,7 | < 0,01 | 11,1 | 4,8 | - | |
| В12-В16 | 5,3(↑) | 0,8 | 6,7 | < 0,01 | 7,4 | 4,5 | - | |
| А1-В16 | 3,0(↑) | 0,2 | - | - | 10,3 | - | - | |
| А1-В35 | 2,5(↑) | 0,4 | - | - | 6,4 | - | - | |
| А19-В17 | 2,5(↑) | 0,1 | - | - | 8,5 | - | - | |
| Группа IV (мужчины с клиническими проявлениями) n=115 | А1 | 32,2 (↑) | 22,9 | 4,2 | < 0,05 | 1,6 | - | - |
| В12 | 7,8 (↓) | 15,2 | 5,1 | < 0,05 | 0,5 | - | 0,8 | |
| В16 | 15,6 (↑) | 7,7 | 7,1 | < 0,01 | 2,2 | 8,5 | - | |
| В22-В35 | 4,3 (↑) | 0,63 | 9,6 | < 0,01 | 7,1 | 3,6 | - | |
| А1-В13 | 1,8 (↑) | 0,2 | - | - | 9,2 | - | - | |
| А2-В12 | 0,6 (↓) | 3,9 | - | - | 0,2 | - | - | |
| А9-В17 | 1,9 (↑) | 0,2 | - | - | 9,7 | - | - | |
| Группа V (мужчины с уретритом) n=61 | А1 | 37,7 (↑) | 22,9 | 6,1 | < 0,01 | 2,0 | - | - |
| В16 | 16,4 (↑) | 7,7 | 4,6 | < 0,05 | 2,4 | 9,5 | - | |
| А1-В13 | 3,1 (↑) | 0,2 | - | - | 8,0 | - | - | |
| А1-В16 | 3,1 (↑) | 0,2 | - | - | 8,0 | - | - | |
| А9-В17 | 1,2 (↑) | 0,2 | - | - | 6,1 | - | - | |
| Группа VI (мужчины с простатитом) n=54 | А2 | 29,6 (↓) | 47 | 6,9 | < 0,01 | 0,5 | - | 0,9 |
| В12 | 3,7 (↓) | 15,2 | 6,4 | < 0,05 | 3,3 | 2,5 | - | |
| В17 | 18,5 (↑) | 7,0 | 7,8 | < 0,01 | 3,0 | 1,2 | - | |
| В35 | 46,3 (↑) | 24,8 | 11,0 | < 0,01 | 2,6 | 2,8 | - | |
| А2-В17 | 4,0 (↑) | 0,4 | - | - | 8,3 | - | - | |
| А3-В35 | 14,7 (↑) | 5,8 | - | - | 2,8 | - | - | |
| А10-В35 | 4,4 (↑) | 0,5 | - | - | 6,5 | - | - | |
| Группа VII (мужчины и женщины без клинических проявлений) n=27 | В13 | 29,6 (↑) | 10,3 | 8,1 | < 0,01 | 3,7 | 2,1 | - |
| В13-В15 | 7,4 (↑) | 0,5 | 8,9 | < 0,01 | 8,0 | 6,9 | - | |
| Группа VIII (женщины с клиническими проявлениями) n=47 | В8-В17 | 4,3(↑) | 0,4 | 5,7 | < 0,01 | 7,7 | 3,9 | - |
| В12-В16 | 6,4(↑) | 0,8 | 8,5 | < 0,01 | 6,0 | 5,6 | - | |
| А1-В35 | 3,4(↑) | 0,4 | - | - | 8,8 | - | - | |
| А10-В16 | 3,1(↑) | 0,3 | - | - | 2,9 | - | - | |
Подобно антигенам HLA-класса I распределение аллелей класса II изучали у 46 больных (36 мужчин, 10 женщин). Группой сравнения служили 103 здоровых донора той же популяции населения. Анализ полимофизма аллелей DRB1* у больных выявил ряд специфичностей, имеющих отклонения в частоте встречаемости по сравнению со здоровыми как в сторону увеличения, так и снижения. С повышенной частотой у больных идентифицировались специфичности DRB1*13, DRB1*16, однако эти различия оказались недостоверными. Установлено достоверное снижение частоты специфичности DRB1*12 , т.е. можно полагать, что индивиды с наличием этого аллеля обладают определенной резистентностью к заболеванию УГХ.
Таблица 13
Частота встречаемости HLA-специфичностей класса II
у больных УГХ
| DRB1* | Частота встречаемости | 2 | RR | EF | PF | |||
| контрольная группа (n=103) | больные (n=46) | |||||||
| абс. | % | абс. | % | |||||
| 01 | 32 | 31,1 | 12 | 26,1 | 0,7 | 0,8 | - | 0,8 |
| 04 | 21 | 20,4 | 10 | 21,7 | 0,0009 | 1,1 | - | - |
| 07 | 31 | 30,1 | 9 | 19,6 | 2,4 | 0,6 | - | 0,9 |
| 08 | 3 | 2,9 | 1 | 2,2 | 0,7 | 0,7 | - | 0,4 |
| 09 | 2 | 1,9 | 1 | 2,2 | 0,3 | 1,2 | - | 0,5 |
| 10 | 2 | 1,9 | 0 | - | 3,0 | 0,4 | - | - |
| 11 | 26 | 25,2 | 12 | 26,1 | 0,009 | 1,1 | - | - |
| 12 | 5 | 4,9 | 0 | - | 4,1 | 0,2 | - | - |
| 13 | 14 | 13,6 | 11 | 23,9 | 1,7 | 2,0 | - | - |
| 14 | 2 | 1,9 | 0 | - | 3,0 | 0,4 | - | - |
| 15 | 38 | 36,9 | 12 | 26,1 | 2,2 | 0,6 | - | 0,9 |
| 16 | 2 | 1,9 | 2 | 4,4 | 0,1 | 2,4 | 2,5 | - |
| 17 | 15 | 14,6 | 11 | 23,9 | 1,3 | 1,8 | - | - |
Как было сказано выше, у больных УГХ отмечаются изменения отдельных показателей иммунитета и их сочетанные нарушения. При этом дисбаланс иммунитета у больных УГХ обусловлен особенностями HLA-фенотипа. Так, лабораторные признаки недостаточности клеточного звена иммунитета ассоциировались с антигеном В17 (табл.14).
Таблица 14
Частота встречаемости HLA-антигенов и их комбинаций у больных УГХ со снижением активности клеточного звена иммунитета (ИРИ ≤ 1,3)
-
Антигены
и их комбинации
Частота встречаемости
2
RR
EF
PF
контрольная группа
(n=795)
больные
(n=27)
абс.
%
абс.
%
В7
230
28,9
3
11,1
5,0
0,3
-
0,9
В17
56
7,1
6
22,2
6,6
3,8
1,6
-
А1-В8
-
5,1
-
9,7
-
2,0
-
-
А1-В17
-
1,5
-
9,4
-
0,8
-
0,7
А2-В16
-
0,5
-
5,7
-
10,0
5,2
-
А9-В12
-
2,4
-
9,2
-
4,1
6,9
-
А19-В15
-
0,4
-
3,7
-
9,6
3,3
-
Этот же антиген, а также антиген В16, чаще, чем у здоровых, регистрировались в группе больных со снижением уровня иммуноглобулинов в сыворотке крови: IgG<8,0 г/л; IgA<1,0 г/л; IgM<1,0 г/л (табл.15).
Таблица 15
Частота встречаемости HLA-антигенов и их комбинаций у больных УГХ со снижением уровня иммуноглобулинов в сыворотке крови
| Антигены и их комбинации | Частота встречаемости | 2 | RR | EF | PF | |||
| контрольная группа (n=795) | Больные (n=35) | |||||||
| абс. | % | абс. | % | |||||
| В16 | 61 | 7,7 | 8 | 22,9 | 8,3 | 3,6 | 1,6 | - |
| В17 | 56 | 7,1 | 7 | 20,0 | 6,3 | 3,3 | 1,3 | - |
| В7-В17 | 4 | 0,5 | 2 | 5,7 | 6,5 | 10,1 | 5,2 | - |
| В8-В17 | 3 | 0,4 | 2 | 5,7 | 8,3 | 11,2 | 5,3 | - |
| В22-В35 | 5 | 0,6 | 3 | 8,6 | 9,6 | 7,1 | 5,9 | - |
| А2-В17 | - | 0,5 | - | 3,0 | - | 6,2 | 2,5 | - |
| А9-В17 | - | 0,2 | - | 3,8 | - | 9,8 | 2,5 | - |
| А19-В17 | - | 0,3 | - | 3,6 | - | 10,3 | 3,7 | - |
Здесь уместно отметить, что повышение частоты антигенов HLA-В16 и В17 зафиксировано нами в общей группе больных УГХ (табл.11), а также среди больных, имевших симптомы хламидийного уретрита и простатита (табл.13). Кроме того, HLA-В16 и В17 ассоциировались с низким (<1:4) титром специфических IgG в сыворотке крови больных, то есть названные антигены были расценены нами как факторы, влияющие на активность специфической антителопродукции.
Ослабление активности поглотительной стадии фагоцитарной реакции оказалось свойственно больным, в фенотипе которых присутствовал антиген А9. Указанный антиген был определен у 50% больных с низким значением ФАН (табл.16).
Таблица 16
Частота встречаемости HLA-антигенов и их комбинаций
у больных УГХ со сниженным значением ФАН (<40%)
| Антигены и их комбинации | Частота встречаемости | 2 | RR | EF | PF | |||
| контрольная группа (n=795) | Больные (n=20) | |||||||
| абс. | % | абс. | % | |||||
| А2 | 374 | 47,0 | 4 | 20,0 | 6,9 | 0,3 | - | 0,9 |
| А9 | 216 | 27,2 | 10 | 50,0 | 4,0 | 2,7 | 3,1 | - |
| А9-А10 | 11 | 1,4 | 2 | 10,0 | 4,6 | 8,0 | 8,7 | - |
| А9-В5 | - | 0,8 | - | 6,3 | - | 8,3 | 5,5 | - |
Как видно из представленных данных, антиген HLA-В7 проявил себя как «протектор» в отношении развития у больных УГХ нарушений клеточных факторов иммунитета (табл.14), частота антигена А2 снижена среди больных с ослаблением активности фагоцитарной реакции нейтрофилов (табл.16).
Таблица 17
Частота встречаемости HLA-антигенов и их комбинаций
у больных УГХ с сочетанными нарушениями
иммунологических показателей (не менее 3-4)
| Антигены и их комбинации | Частота встречаемости | 2 | RR | EF | PF | |||
| контрольная группа (n=795) | больные (n=23) | |||||||
| абс. | % | абс. | % | |||||
| В12-В16 | 6 | 0,8 | 2 | 8,7 | 7,5 | 8,6 | 6,0 | - |
| А2-В7 | - | 3,8 | - | 0,6 | - | 0,2 | - | 0,7 |
| А2-В17 | - | 0,5 | - | 1,7 | - | 3,4 | 1,2 | - |
| А9-В5 | - | 0,8 | - | 3,9 | - | 5,0 | 3,1 | - |
| А9-В16 | - | 1,3 | - | 6,7 | - | 5,4 | 5,4 | - |
| А11-В15 | - | 0,5 | - | 4,3 | - | 8,9 | 3,8 | - |
У обследованных больных были обнаружены отличия в распределении внутрилокусных и межлокусных сочетаний антигенов: недостаточность клеточного звена иммунитета более свойственна носителям сочетаний антигенов А2-В16, А9-В12; снижение в крови уровня иммуноглобулинов основных классов ассоциируется с сочетаниями В7-В17, В8-В17, В22-В35, А2-В17, А9-В17, А19-В17; ослабление активности фагоцитарной функции нейтрофилов – с А9-А10 и А9-В5; сочетанные иммунные нарушения – с комбинациями В12-В16, А2-В17, А9-В5, А9-В16, А11-В15 (табл.17). Обращает внимание, что внутрилокусные комбинации В8-В17, В12-В16, В22-В35 чаще встречались у больных УГХ с разными клиническими вариантами течения болезни (табл.13). Так, частота В8-В17 и В12-В16 повышена в группе пациентов-женщин, в том числе у тех, кто имел выраженную клиническую симптоматику УГХ; сочетание В22-В35 – в общей группе пациентов мужчин и у мужчин с клиническими проявлениями УГХ.
Практическая значимость выявленных ассоциаций заключается в возможности использования результатов HLA-типирования для прогнозирования предрасположенности к УГХ и его осложнениям.
Учитывая данные литературы о возможной связи HLA-фенотипа с ответом на проводимое лечение при различных заболеваниях, мы проанализирован характер распределения HLA-антигенов у больных УГХ с хроническим простатитом (ХП), по-разному реагировавших на специфическую терапию. При этом резистентность к комбинированной антибактериальной терапии констатирована у 65,2% больных , имевших в фенотипе HLA-В35, Cw4. У аналогичных больных, не имевших названных антигенов, клинико-лабораторная ремиссия достигнута в 84,0% наблюдений. Следовательно, больные УГХ с диагностированным хроническим простатитом, являющиеся носителями антигенов HLA-B35,Cw4, нуждаются, как правило, в проведении повторных курсов лечения.
В последние годы большое внимание уделяется изучению закономерностей эпидемиологии многих инфекционных заболеваний, включая такие ИППП, как ВИЧ-инфекция, гонорея, хламидиоз, сифилис. Несмотря на ускоренное развитие социальных программ, пропаганду «защищенного секса», появление новейших методов исследований для диагностики и разработку современных схем терапии, заболеваемость данными ИППП, в частности, сифилисом остается в России стабильно высокой (в 2006г. – 71,2 на 100 000 населения). Достаточно хорошо известен факт сочетанного инфицирования бледной трепонемой и другими возбудителями УГИ: гонококком, хламидиями, микоуреаплазмой, трихомонадами и др. (Аковбян В.А., Резайкина А.В., Тихонова Л.И., 1998). Подобные сочетания могут приводить к более тяжелому течению сифилиса: увеличению частоты язвенных проявлений, обильной папулезной сыпи на коже туловища и конечностей, множественным эрозивным поражениям слизистых, более частым и ранним поражениям нервной системы.
Весьма актуальным является вопрос о так называемом «эпидемическом синергизме» между УГИ и ВИЧ-инфекцией. Нами впервые проведено обследование на наличие УГИ и анкетирование с целью составления социального портрета и определения поведенческих реакций 60 ВИЧ – инфицированных заключенных (рис.2).
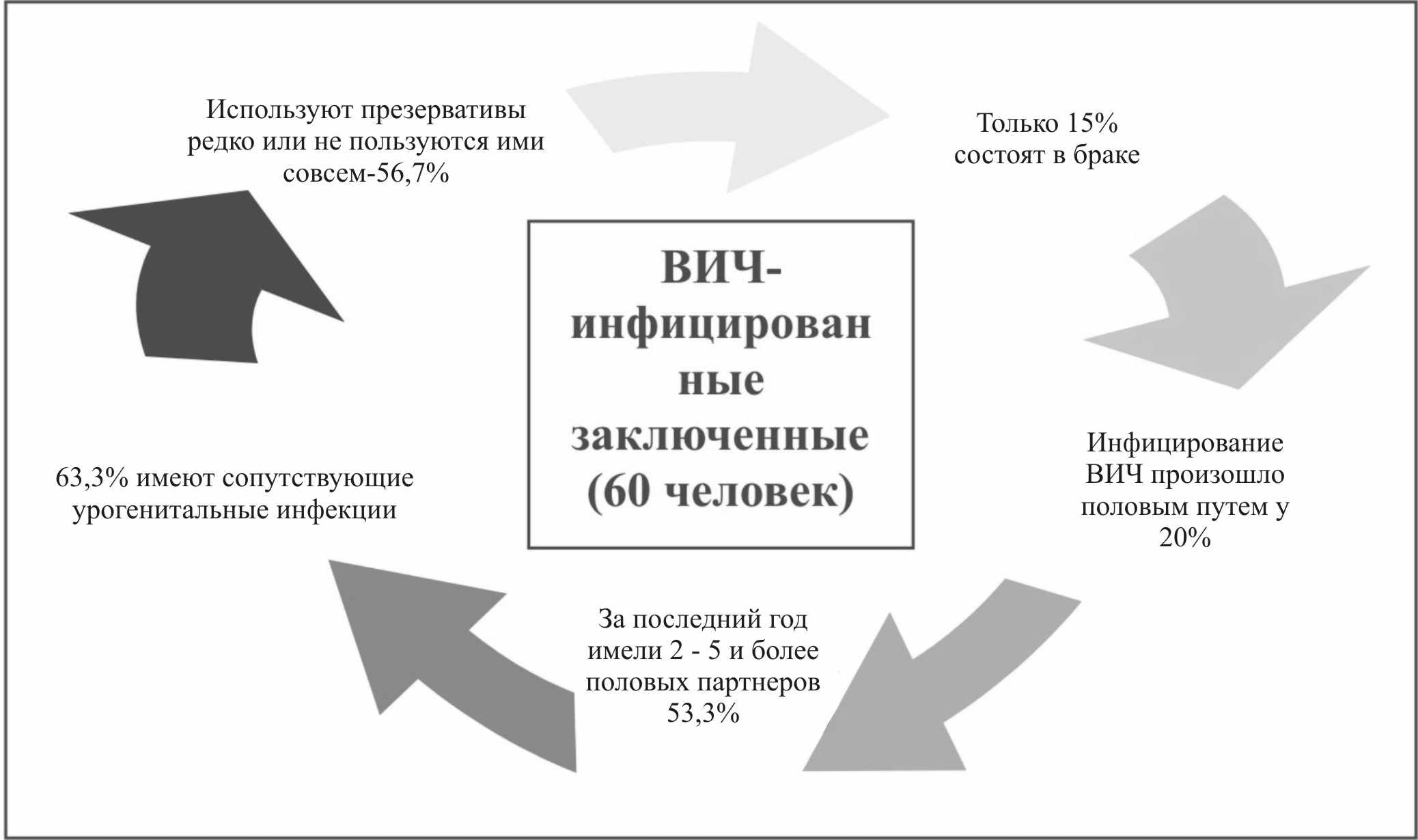
Рис.2 Схема факторов, влияющих на инфицирование ВИЧ
Данный контингент, являясь группой повышенного поведенческого риска, требует особого внимания в проведении первичной (устранение факторов риска) и вторичной (ранняя диагностика и лечение) профилактики ИППП и ВИЧ – инфекции как в период пребывания в тюрьме, так и после освобождения. Различные ИППП были выявлены у 63,3% обследованных ВИЧ-инфицированных заключенных, в том числе хламидийная инфекция – у 20,0%. Учитывая то, что урогенитальные инфекции способствуют передаче ВИЧ-инфекции и повышают восприимчивость к ней, следует рассматривать своевременное выявление и лечение УГХ в группах повышенного риска как необходимый элемент стратегии профилактики ВИЧ-инфекции.
Основная роль в комплексном лечении хронического УГХ принадлежит адекватной терапии. Несмотря на глубокое изучение проблемы, большое количество лекарственных препаратов, используемых для лечения, вопросы терапии УГХ по-прежнему остаются актуальными. Особую сложность представляет лечение хронического УГХ, осложненного хроническим простатитом. Эффективность терапии оценивалась нами по данным микробиологического и клинического исследований. Этиологическое излечение (эрадикация C.trachomatis) при использовании комбинированной терапии было зарегистрировано у 96,8% пациентов, излечение уретрита у всех больных, в 89,9 % достигнута клинико-лабораторная ремиссия хронического простатита.
Таким образом, проведенные исследования свидетельствуют, что УГХ является сложной медико-социальной проблемой. C.trachomatis может явиться причиной воспалительных заболеваний как нижних, так и верхних отделов мочеполового тракта. Несмотря на использование высокочувствительных методов исследований для диагностики (ПЦР), не всегда удается установить наличие патогена в исследуемом материале. Заболевание сопровождается изменением различных звеньев иммунитета.
Oсновываясь на полученных результатах, сопоставленных с данными литературы, можно заключить, что определение тканевых антигенов является в настоящее время весьма адекватным методом оценки иммунологической реактивности организма, доступным для практического использования. Он позволяет прогнозировать повышенную предрасположенность к развитию УГХ и тяжесть его течения с формированием групп риска по развитию вторичного иммунодефицитного состояния.
Результаты иммуногенетического анализа полезно учитывать при обследовании больных УГХ, принимая во внимание, что влияние «неблагоприятных» антигенов реализуется только при действии соответствующих провоцирующих факторов внешней среды. Своевременно устранив их, можно свести до минимума возможность проявления генетически обусловленной предрасположенности к заболеванию и развитию вторичного иммунодефицита.
Выявленные ассоциации свидетельствуют, что состояние противоинфекционной устойчивости определяется влиянием тканевых структур на гуморальные и клеточные механизмы защиты, факторы неспецифической резистентности, активность антителопродукции. При этом открывается возможность индивидуального подхода к профилактике осложнений УГХ и проведению адекватной терапии.
