Диссертация на соискание ученой степени
| Вид материала | Диссертация |
СодержаниеРазработка новых принципов контактного |
- Диссертация на соискание учёной степени кандидата юридических наук, 1614.07kb.
- М. С. Тарков Математические модели и методы отображения задач обработки изображений, 17.1kb.
- Диссертация на соискание ученой степени кандидата экономических наук, 2079.82kb.
- Диссертация на соискание ученой степени доктора психологических наук, 5248.42kb.
- Диссертация в форме научного доклада на соискание ученой степени доктора медицинских, 907.5kb.
- Диссертация на соискание ученой степени, 3924.03kb.
- Диссертация на соискание ученой степени, 2781.79kb.
- Диссертация на соискание ученой степени, 2577.32kb.
- Диссертация на соискание ученой степени, 2127.42kb.
- Диссертация на соискание ученой степени, 3107.61kb.
^ РАЗРАБОТКА НОВЫХ ПРИНЦИПОВ КОНТАКТНОГО
РАСТВОРЕНИЯ ЖЕЛЧНЫХ КАМНЕЙ
- Метод индивидуального подбора
литолитических препаратов
Уже отмечалось, что применяющиеся в настоящее время контактные растворители не в полной мере отвечают предъявленным к ним требованиям. В одних случаях это связано с их побочными эффектами (МТБЭ), в других – с отсутствием достаточной мощности и универсального характера воздействия на конкременты. Из этого следует, что пути повышения эффективности метода контактного растворения желчных камней могут лежать в двух направлениях: 1) уменьшение токсичности таких мощных препаратов, как МТБЭ; 2) усиление литолитического эффекта при использовании нетоксичных растворителей типа монооктаноина. Следует подчеркнуть, что нетоксичность препарата приобретает особое значение при лечении тяжелых больных с острыми осложненными формами ЖКБ. В свою очередь, повышение литолитического эффекта может быть достигнуто за счет изменения химических свойств вещества, но существует и другая возможность, о которой упоминается в литературе, - это подбор наиболее оптимальных комбинаций препаратов /320, 423/. Основным правилом правильности такого подбора является соответствие комбинации составу камня. Однако, как уже подчеркивалось выше, определение состава камней без исследования самих конкрементов является сложной задачей, решение которой до настоящего времени затруднительно несмотря на применение таких современных и сложных методов, как компьютерная рентгеновская томография /484, 489, 493/. Предложив для решения этой задачи метод поляризационной микроскопии желчи, мы установили, что наиболее информативными являются три вида текстур: кристаллы моногидрата холестерина, микросферолиты карбоната кальция и микролиты пигмента. Полагая, что эти структуры желчи являются микрочастицами конкрементов, мы предположили, что воздействие на них контактными растворителями под визуальным контролем позволит судить о растворении камня в целом. Логичность такого предположения была подтверждена также данными, которые мы получили с помощью сканирующей электронной микроскопии камней, выполненной вслед за поляризационной микроскопии желчи и инфракрасной спектороскопией конкрементов. Отдельные авторы, исследовавшие с помощью сканирующей электронной микроскопии структуру желчных камней, установили, что в холестериновых конкрементах чаще обнаруживаются мицеллярно-везикулярные агломераты, в известковых и смешанных – микросферолиты /289/. Отмечено также, что камни одинакового химического состава обычно имеют и одинаковую структуру.
В наших наблюдениях камни были разделены в зависимости от химического состава (согласно ИКС) на четыре группы по пять конкрементов в каждой. Первая группа была представлена холестериновыми конкрементами. В желчи больных этой группы идентифицировались только кристаллы моногидрата холестерина. Во второй группе оказались холестериново-известковые камни. Желчь больных содержала твердые кристаллы холестерина и микросферолиты карбоната кальция. Пять камней третьей группы было по составу холестериново-пигментными. В желчи обнаруживались кристаллы холестерина и гранул пигмента. В последней, четвертой группе камни все были пигментными. Желчь трех больных не содержала кристаллических структур, а в двух наблюдениях визуализировались гранулы билирубината кальция.
При сканирующей электронной микроскопии холестериновых камней были выявлены плоские пластинчатые образования, причем чрезвычайно важно, что по форме они оказались идентичными кристаллами холестерина в желчи (рис. 27 а). Исследование холестериново-пигментных камней показало, что наряду с холестериновыми структурами имеются также множественные грануло- и глыбкообразные формы, точно соответствующие по визуальным признакам гранулам билирубината кальция (рис. 27 б). микроструктура холестериново-известковых камней характеризовалась наличием как пластинчатых образований, так и сфероидных, аналогичных микросферолитам, обнаруженным в желчи (рис. 28).
Таким образом, сопоставление данных сканирующей электронной микроскопии желчных камней и поляризационной микроскопии желчи показало, что обнаруживаемые в желчных камнях структурные элементы идентичны по внешнему виду твердокристаллическим структурам, обнаруживаемым в желчи. Следовательно, последние не только отражают химический состав желчных камней, но, по-видимому, являются структурными элементами (микрочастицами), из которых образуются и состоят конкременты. В связи с изложенным можно сделать заключение, что растворение кристаллов желчи под визуальным контролем имеет важное диагностическое значение, так как позволяет еще до начала лечения осуществить индивидуальный подбор эффективного литолитического препарата и убедиться в растворимости или нерастворимости камня конкретными препаратами. Для проверки этого заключения мы применили в стендовых опытах растворение кристаллических структур желчи и камней с помощью индивидуально подобранных комбинаций холелитолитических препаратов.

а

б
Рис. 27. Микроструктура желчных камней.
Сканирующая электронная микроскопия.
Ув. х 10000
а) холестериновый конкремент;
б) холестериново-пигментный конкремент

Рис. 28. Микроструктура желчных камней.
Сканирующая электронная микроскопия.
Ув. х 10000
Холестериново-известковый конкремент
Известно, что каждый из применяющихся в настоящее время в клинической практике растворителей действует лишь на отдельные структуры, входящие в состав камней. Так, монооктаноин и МТБЭ обладают наибольшей активностью по отношению к холестерину, цитрат натрия лизирует только известковую примесь, ЭДТК обладает способностью растворять известковые и иногда пигментные элементы камня.
При постановке пробы на растворимость в качестве контактных растворителей использовались гепарин, раствор ЦН, раствор соли ЭДТК и октаглин /409/. Контролем служил физиологический раствор хлористого натрия.
Каплю осадка желчи и каплю растворителя помещали на предметное стекло и смешивали стеклянной палочкой, после чего накрывали покровным стеклом и наблюдали реакцию в поляризованном свете микроскопа. Наблюдение проводили за отдельными кристаллами в течение 30 минут с периодическими осмотрами, а при необходимости повторяли через 3 и 24 часа. Быстроту лизиса кристаллов фиксировали в минутах (рис. 29 и 30). Степень лизиса кристаллов определяли по следующей градации: первая степень – полное растворение, вторая – частичное растворение, третья – отсутствие эффекта. При отсутствии литолитического действия на кристаллы в течение суток препарат считали неэффективным для растворения данных структур. Пробу проводили с каждым из имеющихся растворителей. В зависимости от того, действие каких препаратов оказывалось наиболее эффективным, подбиралось их сочетание для последующего растворения конкрементов.
С целью оценки разработанного метода проведено 50 стендовых опытов. На первом этапе выполнялась поляризационная микроскопия желчи, полученной с помощью пункции желчного пузыря перед холецистэктомией. В процессе микроскопии подбиралась наиболее эффективная комбинация холелитолитических препаратов. Затем на стенде предпринималось растворение камней, извлеченных во время операции, подобранными композициями (см. табл. 37).
Таблица 37
Сравнительная характеристика результатов растворения
кристаллов желчи при поляризационной микроскопии
и желчных камней в стендовых условиях
| Состав желчи по данным поляризационной микроскопии желчи | Число наблю- дений | Подобранная эффективная комбинация препаратов | Число наблю- дений | Результаты растворения камней подобранной комбинацией препаратов | |
| Полное раство- рение | Нет эффекта | ||||
| Кристаллы холестерина | 30 | Октаглин | 30 | 27 | 3 |
| Кристаллы холестерина и микросферолиты | 7 | Октаглин + цитрат натрия Октаглин + ЭДТА Нет эффектив-ной комбина-ции | 2 3 2 | 2 3 - | - - 2 |
| Кристаллы холестерина и гранулы пигмента | 7 | Октаглин + ЭДТА Нет эффектив-ной комбина-ции | 3 4 | 3 - | - 4 |
| Микросферолиты | 2 | Октаглин + цитрат натрия | 2 | 2 | - |
| Гранулы пигмента | 2 | Нет эффектив-ной комбина-ции | 2 | - | 2 |
| Кристаллы холестерина, микросферолиты и гранулы пигмента | 2 | Октаглин + ЭДТА | 2 | 2 | - |
| Всего | 50 | | 50 | 39 | 11 |
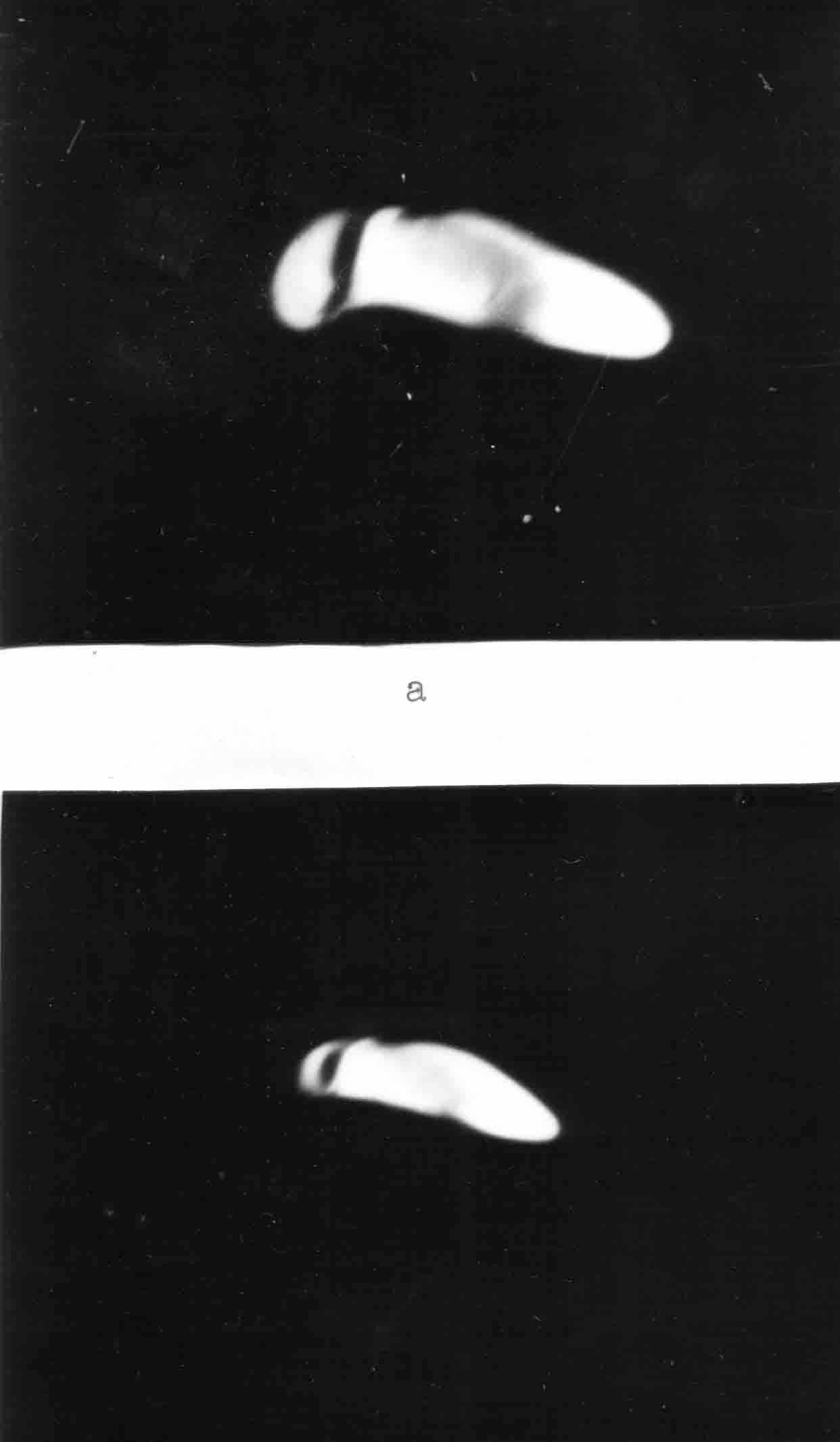
б
Рис. 29. Растворение кристаллов моногидрата холестерина октаглином.
Поляризационная микроскопия. Ув. х 120
а) исходная картина желчи;
б) картина желчи через 4 минуты после добавления октаглина
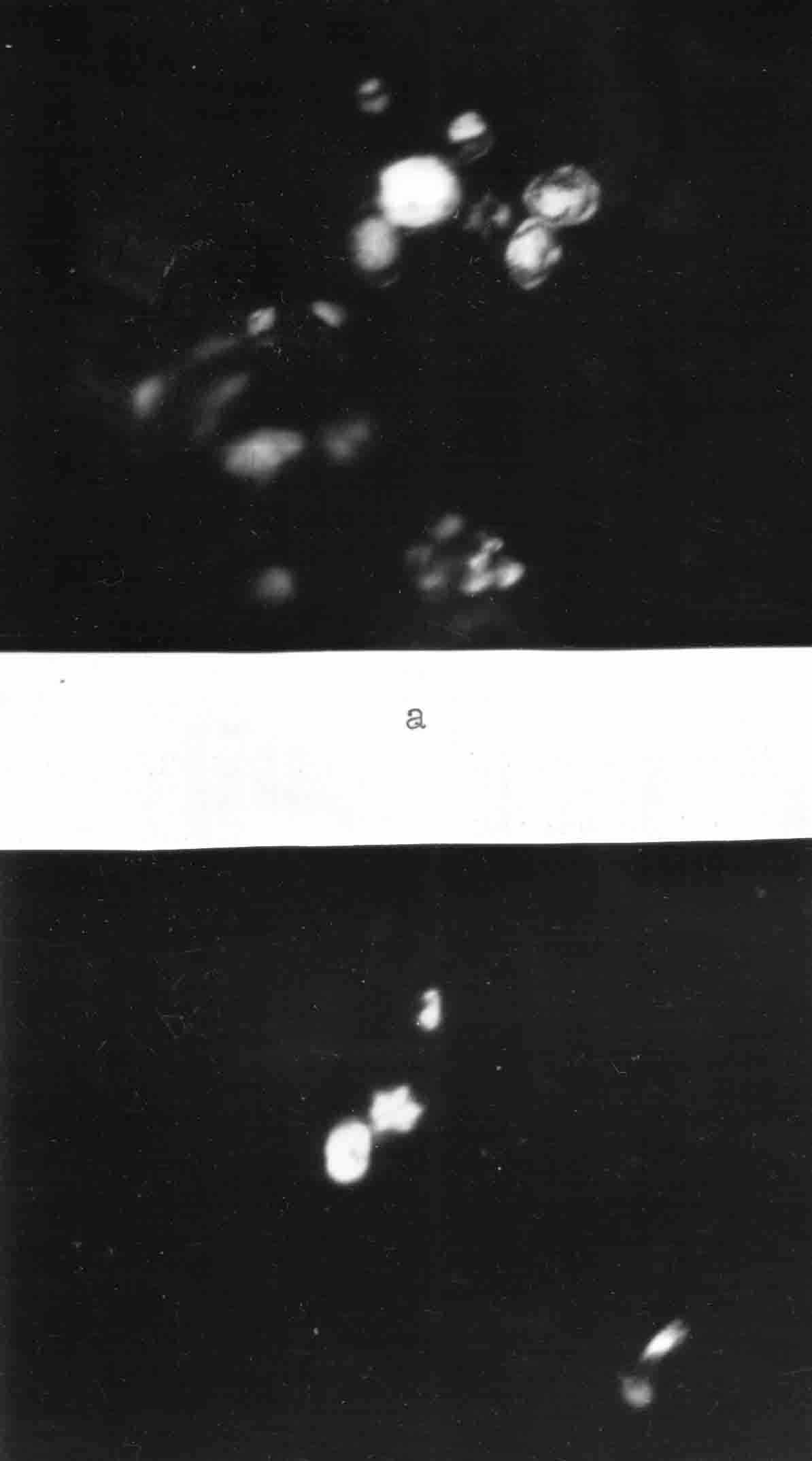
Б
Рис. 30. Растворение микросферолитов желчи цитратом натрия.
Поляризационная микроскопия. Ув. х 120
а) исходная картина желчи;
б) картина желчи через 8 минуты после добавления цитрата натрия
Полученные данные свидетельствуют о том, что результаты растворения кристаллических структур желчи и результаты растворения конкрементов в стендовых опытах почти полностью совпадают. Следует отметить, что ни в одном случае мы не наблюдали лизирующего влияния гепарина на какие-либо кристаллические структуры желчи.
Разработанный метод был апробирован в клинике при лечении нами 20 больных с желчнокаменной болезнью (заявка на изобретение № 4708482/14/086087, положительное решение от 28 мая 1990 года). В 10 наблюдениях у больных пожилого и старческого возраста проводилось растворение множественных камней желчного пузыря через лапароскопическую холецистостому. В других 10 наблюдениях осуществлялось растворение резидуальных камней холедоха через холедохостомический дренаж. Во всех случаях размер конкрементов не превышал 10-12 мм.
У больных с лапароскопической холецистостомой комбинация эффективных литолитических препаратов подбиралась при исследовании пузырной желчи. У пациентов с резидуальными камнями желчных протоков изучалась желчь, оттекающая по дренажу холедоха.
Больным с острым калькулезным холециститом комбинация растворителей вводилась фракционным способом. Сроки введения колебались от 20 до 36 суток, объем общей дозы растворителей от 530 до 1750мл. При резидуальном холедохолитиазе использовался капельный способ введения препаратов. Продолжительность курса лечения варьировала от 10 до 18 суток, объем общей дозы колебался от 800 до 14 мл. Оценка эффективности проведенного лечения представлена в табл. 38.
Таблица 38
Оценка эффективности растворения желчных камней с помощью индивидуально подобранных комбинаций
холелитолитических препаратов
| Состав желчи по данным поляризационной микроскопии желчи | Число наблю- дений | Подобранная эффективная комбинация препаратов | Число наблю- дений | Результаты растворения камней подобранной комбинацией препаратов | |
| Полное раство- рение | Нет эффекта | ||||
| Холестериновые | 11 | Октаглин | 11 | 11 | - |
| Холестериново-пигментные | 4 | Октаглин + ЭДТА Нет эффектив-ной комбина-ции | 1 3 | 1 - | - 3 |
| Холестериново-известковые | 5 | Октаглин + цитрат натрия Октаглин + ЭДТА Нет эффектив-ной комбина-ции | 3 1 1 | 3 1 - | - - 1 |
| Всего | 20 | | 20 | 16 | 4 |
Как следует из таблицы, почти у половины больных имели место камни с примесью извести или пигмента. Доказано, что такие камни плохо поддаются растворению. Использование разработанного нами метода позволили в 16 из 20 наблюдений, в том числе у 5 из 9 больных с кальцинированными и пигментными камнями подобрать эффективную комбинацию холелитолитических препаратов и добиться полного растворения камней. В качестве иллюстрации приводим следующий клинический пример.
Больная К., 74 лет (история болезни № 6841), поступила в клинику 10 марта 1989 года с диагнозом: острый холецистит, хронический бронхит, ишемическая болезнь сердца, стенокардия напряжения, мерцательная аритмия, гипертоническая болезнь II степени, хронический пиелонефрит. При ультразвуковом исследовании обнаружено в полости желчного пузыря множество эхоплотных структур диаметром 5-7 мм. В связи с неэффективностью консервативной терапии 13 марта выполнена лапароскопическая холецистостомия. При исследовании желчи обнаружены кристаллы моногидрата холестерина и микросферолиты карбоната кальция, что указывало на холестериново-известковый состав камней. При проведении пробы на растворимость установлено, что эффективной комбинацией является октаглин с цитратом натрия (рис. 31).
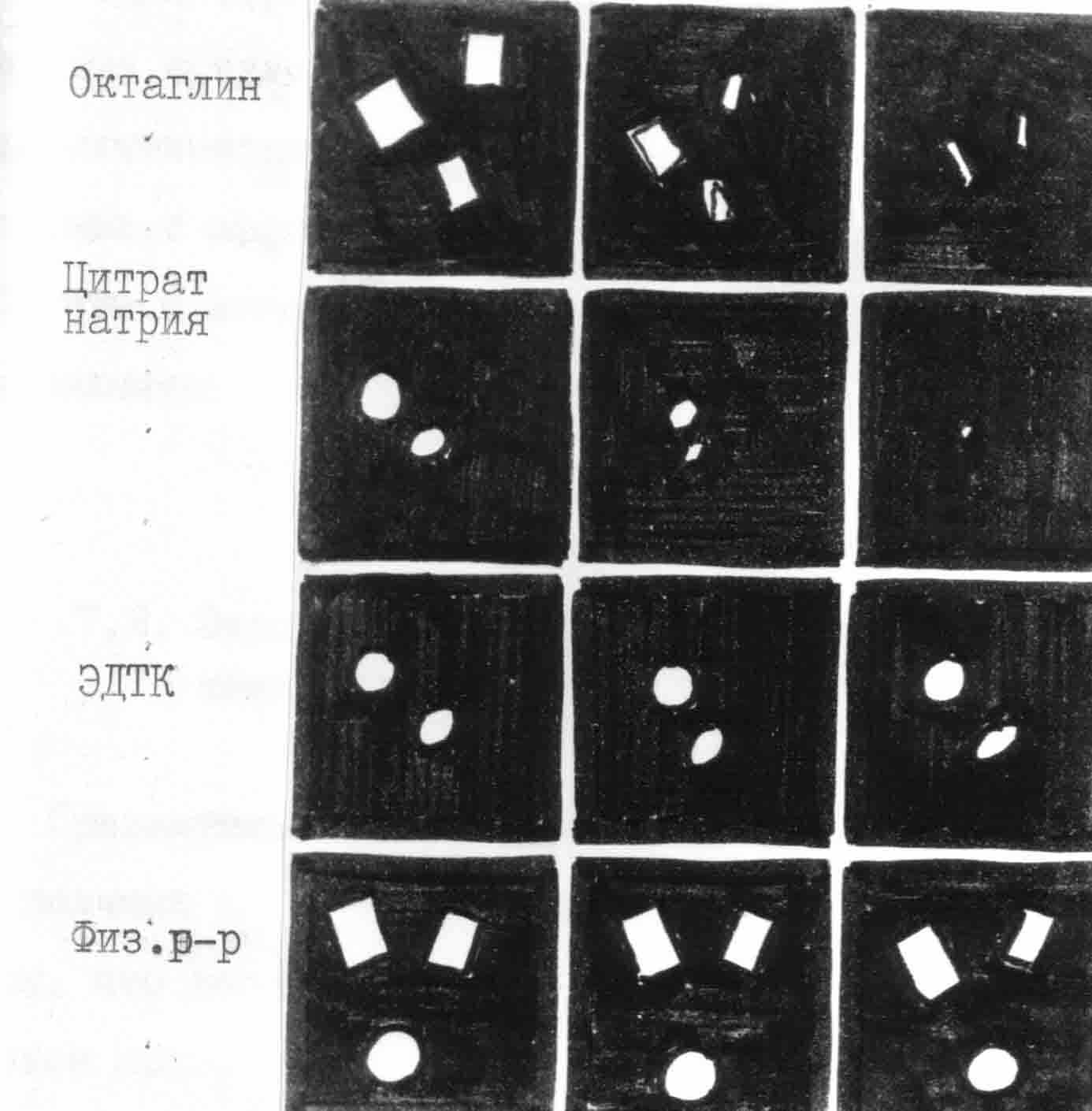
Рис. 31. Раствор кристаллических структур желчи больной К., 74 лет, по данным поляризационной микроскопии (схема)
После стихания острого воспалительного процесса в желчном пузыре выполнена холефистулография: в полости пузыря множественные конкременты 5-7 мм в диаметре. Начато введение холелитолитических препаратов, которое проводилось фракционным способом. Разовая доза составила 20 мл, суточная – 60 мл. При этом дважды за сутки вводился октаглин и один раз – цитрат натрия. При контрольной холефистулографии через 20 суток отмечено уменьшение камней в размерах, а через 35 суток достигнуто полное растворение конкрементов в желчном пузыре. Общая доза октаглина составила 990 мл, цитрата натрия – 110 мл. Осложнений не отмечено. Больная выписана на амбулаторное лечение в удовлетворительном состоянии.
Таким образом, приведенные материалы свидетельствуют о том, что предложенный нами метод индивидуально подбора холелитолитических препаратов значительно расширяет возможности и повышает эффективность контактного растворения желчных камней, что в конечном итоге позволит улучшить результаты лечения желчнокаменной болезни.
- Экспериментальное обоснование нового
принципа контактного растворения желчных камней
Сравнительные характеристики различных методов разрушения желчных камней, приводимые в литературе, свидетельствуют о том, что контактное растворение может найти гораздо более широкое применение, чем терапия желчными кислотами или литотрипсия в силу гораздо меньшего числа противопоказаний и достаточно высокой (особенно при наличии мощных растворителей) эффективности. Метод контактного растворения желчных камней часто определяют как не хирургический. Это не совсем верно, так как для его осуществления необходимо выполнение небольшого, оперативного вмешательства, выполняемого под эндоскопическим, рентгенологическим или ультразвуковым контролем. Целью такого вмешательства является установка в желчевыводящих путях катетера, по которому вводится литолитический препарат. Авторы, имеющие значительный клинический опыт контактного растворения, указывают на сложность процедуры введения катетера в желчный пузырь у больных с хроническими формами ЖКБ и риск возникновения таких осложнений, как кровотечение или подтекание в брюшную полость желчи /503/.
Таким образом, к существенным недостаткам метода относится его инвазивность и реальная угроза возникновения осложнений, для ликвидации которых необходимо полостное хирургическое вмешательство. Последнее крайне нежелательно у больных с повышенным операционным риском. Решением вопроса была бы разработка способа, сочетающего в себе неинвазивность и возможность использования контактных растворителей.
Нами совместно с сотрудниками Волгоградского противочумного научно-исследовательского института Минздрава СССР В.И.Ефименко и К.А.Ротовым было сформулировано и проверено в условиях эксперимента предположение, что подобная задача может быть решена при помощи введения в организм больного ЖКБ липосом, включающих контактный растворитель.
Липосомы – это искусственные образования, представляющие из себя мельчайшие пузырьки, состоящие из одной или многих липидных биомолекулярных мембран. За последние 20 лет липосомам посвящено огромное количество публикаций, так как эта, по мнению некоторых исследователей, область биологии к настоящему времени сформировалась в самостоятельную науку, называемую липосомологией. Ее появление связывается с тем, что в конце 50-х – начале 60-х годов была осознана ключевая роль клеточной мембраны в регуляции важнейших функций клетки /151, 174/.
Уникальные свойства липосом, ставшие причиной их интенсивного изучения, заключаются в способности взаимодействовать с клетками, перенося свое содержимое тем или иным способом через барьер плазматической мембраны клетки в цитоплазму или лизосомы. Исходя из этого применение липосом в медицине связывается прежде всего с возможностью их использования в качестве переносчиков лекарственных веществ: антибиотиков, ферментов, хелатирующих агентов и других препаратов. При этом транспортировка лекарств в липосомах дает следующие преимущества: снижение аллергических и иммунологических реакций, увеличение способности к проникновению в клетку, задержка выведения лекарств /38, 48, 227, 285/.
Так, например, известно, что полиаминополикарбонатовые кислоты типа ЭДТК обладают довольно высокой эффективностью при лечении отравлений металлами, однако, при их применении возникают трудности, связанные с тем, что хелатирующие агенты не могут проникать через клеточные мембраны. В связи с этим Н.Рахман (1983) предложил новый подход – использование липосом для транспорта хелатирующих агентов в клетки /235/. Так были получены липосомальные формы ЭДТК, и хотя их предназначение было совершенно другим, сам факт имеет для наших исследований важное значение, поскольку ЭДТК может использоваться в качестве контактного растворителя желчных камней.
Чрезвычайно важным обстоятельством явилось также то, что в результате многочисленных экспериментальных исследований было доказано, что основными областями локализации введенных в организм липосом (независимо от путей введения) являются печень и селезенка. Попадающие в печень липосомы в первую очередь включаются в купферовские клетки, а затем в гепатоциты. Клинические исследования указывают на возможность быстрого накопления липосом в гепатоцитах выведение их печенью с желчью /34, 300/. Наиболее распространенным путем введения липосом является парентеральный, однако, при этом в условиях клиники возникает необходимость их стерилизации, что сопряжено со значительными трудностями, так как при использовании термических методов липосомы разрушаются, а инкубирование их с антисептиками может вызвать побочные эффекты. Это обстоятельство является одной из причин разработки перорального пути введения липом. Так, например, удалось включить инсулин в липосомы из яичного фосфадилхолина с добавками различных количеств холестерина, дицетилфосфата или стеариламина. Максимальный уровень связывания гормона (48% от исходного количества) был получен при использовании положительно заряженных липосом. В присутствии пепсина, трипсина и панкреатина такие липосомы оказались стабильными, но под влиянием желчи они разрушались и полностью освобождали инсулин. Было показано, что степень уязвимости липосом к действию желчи при ее разбавлении значительно уменьшалась. Введение липосом с инсулином крысам с третьей фазой острого аллоксанового диабета приводило к значительному (на 30-70%) понижению уровня глюкозы крови в течение нескольких часов /48/.
Опираясь на данные литературы, мы предприняли попытку включить в липосомы контактный растворитель. В качестве последнего использовался октаглин. Учитывая возможность лизиса октаглином липидов оболочки липосом, была изучена степень его разрушающего воздействия на следующие вещества: холестерин, яичный лецитин, соевый лецитин, суммарную фракцию липидов печени, дипальмитоилфосфадилхолин, сфингомиелин. Оказалось, что октаглин полностью или частично растворяет все из них, кроме сфингомиелина. В соответствии с полученными результатами для приготовления липосом, предназначенных для транспорта октаглина, к качестве основного компонента использовали сфингомиелин.
Липосомы готовили методом обращения фаз /500/. Они состояли их хроматографически чистого сфингомиелина (Харьковский завод бактерийных препаратов), холестерина («Serva», ФРГ), дицетилфосфата («Serva», ФРГ) в молярном соотношении 7:2:1 с конечной концентрацией 20 моль липидов в 1,0 мл фосфатного буфера с pH 7,2.
В качестве включаемого метериала использовали октаглин. Раствор ОГ готовили в таком же буфере, который использовали для приготовления липосом. От невключившегося октаглина избавлялись центрифугированием при 20000 об/мин в течение часа.
Для приготовления 5 мл липосом использовали сфингомиелин – 39,6 мг, холестерин – 15,3 мг, дицетилфосфат – 1,8 мг. Липиды растворяли в 3,8 мл хлороформа. 0,5 мл октаглина смешивали с 1 мл фосфатного буфера с pH 7,2. К раствору липидов добавляли раствор октаглина. Озвучивание проводилось ультразвуковым дезинтегратором с частотой 40 кГц в течение 30 секунд. Полученную эмульсию помещали в роторный испаритель. Из образованной эмульсии извлекали липосомы.
Размеры липосом колебались от 680,7 до 1200,8 нм. Степень включения октаглина составляла 45%.
С целью проверки сохранения литолитической активности октаглина, включенного в липосомы, использовали метод поляризационной микроскопии желчи больных ЖКБ. При этом в контрольной пробе капля желчи больного, насыщенная твердыми кристаллами холестерина, смешивалась с каплей октаглина и наблюдалось его воздействие на кристаллические структуры. В основном опыте капля желчи этого же больного смешивалась с каплей липосомальной эмульсии октаглина. При этом лизиса кристаллов моногидрата холестерина не наблюдалось. Затем к смеси желчи и липосомального октаглина добавлялась капля этанола для разрушения липосом. Вслед за этим, через 30-40 секунд отчетливо прослеживалось растворение кристаллов под воздействием освободившегося из липосом октаглина. В дополнительной контрольной пробе капля желчи смешивалась с каплей этанола. Изменений в картине желчи не наблюдалось.
Для изучения фармакокинетики полученного препарата применили метод радиоактивной метки. Свободный октаглин, в том числе и перед введением его в липосомы, метили I125, применяя хлораминовый метод йодирования /404/. В качестве экспериментальных животных использовали беспородных белых мышей массой 16-18 г (по три животных в серии). В первой серии мышам вводили перорально 50-100 мкл меченного свободного октаглина. Во второй – свободный октаглин в такой же дозе вводился внутрибрюшинно. В двух других сериях аналогичным образом вводился липосомальный октаглин. Удельная радиоактивность применяемого препарата составляла около 2,5-3,3 КБК.
Через 24 часа животных забивали под фторотановым наркозом и брали на исследование кровь, печень, желчный пузырь с желчью. Полученный материал солюбилизировали в смеси, содержащей ледяную уксусную кислоту, этиловый эфир уксусной кислоты и 30% пергидроль в соотношении 1:1:1 по объему. Соотношение смеси и органа составляло 3:1 (объем : масса). Солюбилизацию препаратов проводили при 600С в течении 1 часа, после чего 0,5 мл раствора вносили в сцинтилляционные флаконы с 8 мл сцинтиллятора ЖС-8. Измерение радиоактивности выполняли на жидкостном сцинтилляционном счетчике Rack-Beta-1217 («LKB», Швеция). Результаты приведены в табл. 39 (учитывали только максимальные значения полученных величин).
Таблица 39
Распределение свободного и липосомального октаглина,
меченного I125, в органах и тканях экспериментальных
животных через 24 часа и в зависимости от способа
введения (в распадах в минуту)
-
Форма октаглина
Орган, среда
Путь введения
Пероральный
Внутрибрю-
шинный
Свободный
Кровь
1357
2205
Пузырная желчь
2873
1340
Печень
2991
4971
Липосомальный
Кровь
2074
5429
Пузырная желчь
2363
5464
Печень
4950
29837
Наибольшая концентрация октаглина наблюдалась в ткани печени, причем при внутрибрюшном введении липосомального препарата его накопление оказалось самым высоким. При пероральном введении липосомального октаглина, зафиксирована гораздо меньшая его концентрация в печени, по-видимому, в связи с частичным разрушением липосом в кишке. Следует подчеркнуть, что независимо от пути введения наибольшее интенсивное накопление октаглина в печени наблюдалось при использовании его липосомальной формы.
На основании проведенных исследований можно сделать следующее заключение. Доказана принципиальная возможность включения такого контактного растворителя, как монооктаноин (октаглин) в липосомы. Показано, что в эксперименте преимущественное накопление растворителя в печени и выделение его с желчью происходит при использовании липосомальной формы. Полученные данные можно рассматривать как разработку экспериментального обоснования нового подхода к лечению ЭКБ с помощью контактного растворения желчных камней.
