Учебное пособие санкт-петербург 2 004 удк 669. 2/8; 669. 4 (075. 80) Ббк 34. 33
| Вид материала | Учебное пособие |
- Учебное пособие Санкт-Петербург 2008 удк 005. 91: 004. 9(075. 8) Ббк 65. 291. 212., 97.7kb.
- Учебное пособие санкт-петербург 2005 удк 339. 9 (075. 80) Ббк, 703.64kb.
- Учебное пособие Санкт-Петербург 2011 удк 621. 38. 049. 77(075) Поляков, 643.33kb.
- Учебное пособие Ульяновск 2010 удк 004. 8(075. 8) Ббк 32. 813я73, 1559.86kb.
- Учебное пособие разработано в соответствии с государственным стандартом специальности, 1131.24kb.
- Учебное пособие санкт Петербург 2010 удк 001. 8 Ббк, 1217.72kb.
- Учебное пособие Санкт-Петербург 2011 удк 1(075., 3433.28kb.
- Учебное пособие Санкт-Петербург 2005 удк 662. 61. 9: 621. 892: 663. 63 Ббк г214(я7), 546.15kb.
- Учебное пособие удк 159. 9(075) Печатается ббк 88. 2я73 по решению Ученого Совета, 5335.58kb.
- Учебное пособие тверь 2008 удк 519. 876 (075. 8 + 338 (075. 8) Ббк 3817я731-1 + 450., 2962.9kb.
Цинковый концентрат
Воздух
Агломерирующий обжиг
Агломерат
Газы и пыль
Газоочистка
Газы
Пыль
На производство
H2SO4
Восстановитель
Дистилляция
Остаток
Газы с парами цинка
На специальную
переработку или
в отвал
Конденсатор
Газы с парами цинка
Черновой цинк
Рафинирование ликвацией и ректификацией
Газоочистка
Черновой
свинец
Рафинированный цинк
Пусьера
Потребителю
На свинцовый завод

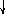





Пыль
Газы





Рис.1.1. Принципиальная технологическая схема переработки
сульфидных цинковых концентратов пирометаллургическим методом
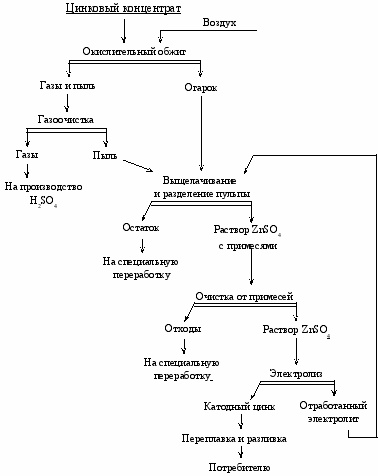
Рис.1.2. Принципиальная технологическая схема переработки
сульфидных цинковых концентратов гидрометаллургическим методом
В пирометаллургической технологии полученный агломерат в смеси с твердым углеродистым восстановителем (коксом или каменным углем) нагревают до 1200-1400 С для восстановления оксида цинка до свободного металла и отгонки цинка. Газы, содержащие пары цинка, охлаждают, получая в конденсаторе жидкий жащие пары цинка, охлаждают, получая в конденсаторе жидкий цинк. при окончательной очистке газов оставшийся цинк улавливают в виде пыли. Черновой цинк, содержащий до 2-4 % примесей (главная из них свинец), для получения товарного металла рафинируют пирометаллургическим методом.
Окислительный обжиг цинковых концентратов для последующей их переработки гидрометаллургическим способом (рис.1.2) практически повсеместно проводят только в печах кипящего слоя. Полученные в результате обжига огарок и пыль затем выщелачивают раствором серной кислоты (отработанным электролитом). Из очищенного от примесей раствора сульфата цинка электролизом с нерастворимыми анодами выделяют цинк. Электролитный цинк содержит до 99,99 % цинка.
канадскими фирмами «Шеррит Гордон» и «Коминко» разработана и внедрена в 80-х гг. ХХ в. на двух заводах безобжиговая технология переработки цинковых концентратов гидрометаллургическим методом. Головной операцией в ней является автоклавное окислительное выщелачивание концентрата раствором серной кислоты (отработанным электролитом).
Высокосортные оксидные цинковые руды (они встречаются сейчас редко) могут быть переработаны по любой из приведенных технологических схем, а для низкосортных успешно применяют технологию с вельц-процессом в качестве головной операции.
1.3. ОКИСЛИТЕЛЬНЫЙ ОБЖИГ
СУЛЬФИДНЫХ ЦИНКОВЫХ КОНЦЕНТРАТОВ
Главная цель окислительного обжига цинковых концентратов – как можно быстрее и эффективнее перевести сульфид цинка и сульфиды других металлов в форму оксидов и получить продукт обжига, удовлетворяющий требованиям его последующей переработки. Кроме того, необходимо получить газы, пригодные для последующего извлечения из них серы, а также по возможности максимально утилизировать тепло, выделяющееся в больших количествах при окислении сульфидов металлов, содержащихся в концентрате.
Цинковый огарок, направляемый на выщелачивание, должен удовлетворять следующим требованиям:
содержание сульфидной серы не более 0,5 %;
содержание сульфатной серы в пределах 2-4 % для компенсации расходования и потерь серной кислоты в цикле выщелачивания огарка и очистки раствора от примесей;
размер частиц огарка не более 0,15-0,2 мм;
минимальное содержание ферритов и силиката цинка.
В современном промышленном производстве цинка для получения огарка такого качества практически повсеместно обжиг цинковых концентратов проводят в печах кипящего слоя при температурах 900-1000 С (чаще 930-980 С).
Конечный продукт обжига концентрата для последующей переработки пирометаллургическим способом – агломерат – должен отвечать другим требованиям:
достаточная прочность и пористость;
содержание сульфидной и сульфатной серы в сумме не более 1 %;
размер частиц после дробления, соответствующий типу печи для дистилляции цинка (например, для плавки агломерата в рудно-термических электрических печах чаще всего 4-12 мм, для плавки в шахтных печах –20-60 мм).
В настоящее время при переработке пирометаллургическим методом только цинковых концентратов обжиг их проводят обычно в две стадии. Сначала концентрат обжигают частично или полностью в печах кипящего слоя при 1050-1200 оС, а затем проводит агломерирующий обжиг полученного огарка на прямолинейных спекательных машинах при температурах в зоне горения и спекания до 1200-1400 С. Потребности тепла обеспечиваются как за счет реакций окисления сульфидов, так и за счет ввода в шихту необходимого количества коксика.
Если на заводе плавкой агломерата в шахтных печах перерабатывают совместно цинковые и свинцовые концентраты, то обжиг шихты проводят в одну стадию на агломерационных машинах аналогично одноступенчатому спекающему обжигу свинцовых концентратов.
При взаимодействии сульфида цинка с кислородом возможны следующие первичные реакции:
ZnS + 2O2 = ZnSO4 + 777,4 кДж; (1.1)
ZnS + 1 ½ O2 = ZnO + SO2 + 441,8 кДж; (1.2)
ZnS + O2 = Zn + SO2 + 83,7 кДж. (1.3)
Как видно, реакции (1.1)-(1.3) являются экзотермическими*. Они имеют очень большие отрицательные значения энергии Гиббса G0 и константы равновесия Kр 1, т.е. их равновесие сильно сдвинуто в правую сторону. Это относится и к сульфидам других металлов, находящихся в цинковых концентратах. Многочисленными исследованиями установлено, что от температуры заметного окисления сульфида цинка до температур 900-1000 С основным твердым продуктом является оксид цинка, следовательно, окисление сульфида цинка до температур 900-1000 С протекает по реакции (1.2). При более высоких температурах может частично протекать реакция (1.3). Парообразный цинк затем окисляется в газовой фазе с образованием оксида цинка. В газовой фазе имеет место также реакция 2SO2 + O2
 2SO3, приводящая к образованию некоторого количества триоксида серы, который может взаимодействовать с оксидом цинка с образованием вторичного нормального (ZnSO4) или основного (3ZnO 2SO3) сульфатов цинка по реакциям
2SO3, приводящая к образованию некоторого количества триоксида серы, который может взаимодействовать с оксидом цинка с образованием вторичного нормального (ZnSO4) или основного (3ZnO 2SO3) сульфатов цинка по реакциямZnO + SO3
 ZnSO4; 3 ZnO + 2SO3
ZnSO4; 3 ZnO + 2SO3  3ZnO 2SO3.
3ZnO 2SO3.Из других вторичных процессов необходимо отметить возможность образования при обжиге феррита и силиката цинка по реакциям
ZnO + Fe2O3 = ZnFe2O4 ; 2ZnO + SiO2 = Zn2SiO4.
Таким образом, цинк в огарке или агломерате может находиться в виде следующих соединений: ZnO, ZnFe2O4, Zn2SiO4, ZnSO4, 3ZnO 2SO3, ZnS.
По реакциям, аналогичным приведенным выше, будут происходить при обжиге превращения сульфидов и других металлов, присутствующих в цинковых концентратах.
Окислительный обжиг цинковых концентратов является типичным гетерогенным процессом в системе газ – твердое и состоит из нескольких последовательных стадий, главными из которых являются следующие:
доставка кислорода к реагирующей поверхности частицы концентрата;
активированная адсорбция кислорода по поверхности сульфида;
взаимодействие сульфида металла с кислородом;
десорбция газообразных продуктов реакции (SO2 и SO3);
их отвод от реакционной поверхности в газовую фазу.
на скорость обжига влияют, в основном, следующие факторы: температура, размер и пористость частиц концентрата, пористость продукта обжига, концентрация кислорода в газовой фазе, скорость движения газового потока по отношению к твердым частицам.
Таблица 1.1
Температура воспламенения некоторых сульфидов
в зависимости от размера их частиц (по И.И. Пензимонжу), С
| Размер частиц, мм | CuFeS2 | FeS2 | Fe1-xS | ZnS | PbS |
| –0,05 + 0,0 | 280 | 290 | 330 | 554 | 505 |
| –0,075 + 0,05 | 335 | 345 | 419 | 605 | 697 |
| –0,10 + 0,075 | 357 | 405 | 444 | 623 | 710 |
| –0,15 + 0,10 | 364 | 422 | 460 | 637 | 720 |
| –0,20 + 0,15 | 375 | 423 | 465 | 644 | 730 |
| –0,30 + 0,20 | 380 | 424 | 471 | 646 | 730 |
| –0,50 + 0,30 | 385 | 426 | 475 | 646 | 735 |
| –1,0 + 0,50 | 395 | 426 | 480 | 646 | 740 |
| –2,0 + 1,0 | 401 | 428 | 482 | 646 | 750 |
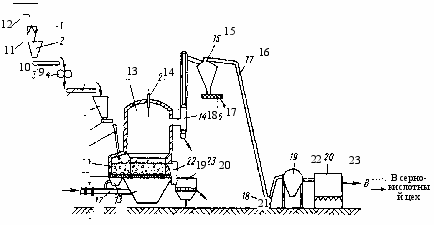
Рис.1.3. Аппаратурная схема обжига цинковых концентратов в печи КС
1 – воздушные камеры; 2 – воздухопровод; 3 – подина печи; 4 – кипящий слой; 5 –
загрузочная течка; 6 – ленточный питатель; 7 – бункер для дробленого концентрата;
8 и 10 – ленточные транспортеры; 9 – дисковая дробилка; 11 – бункер для концентрата;
12 – грейферный кран; 13 – печь КС; 14 – сводовая термопара; 15 – циклон; 16 – газоход;
17 – шнек-затвор; 18 – охлаждаемый стояк; 19 – течка для огарка; 20 – аэрохолодильник;
21 – дымосос; 22 – коллектор грязного газа; 23 – электрофильтр
Нижний предел температуры окислительного обжига сульфидного концентрата определяется температурой воспламенения входящих в состав его сульфидов, которая зависит, главным образом, от природы сульфида и размеров его частиц (табл.1.1). Верхний предел температуры окислительного обжига сульфидных материалов зависит от природы обжигаемого материала, требований к продукту обжига, конструкции обжиговой печи и других факторов.
На рис.1.3 приведена схема цепи аппаратов для обжига цинковых концентратов в печи кипящего слоя (КС). Конструктивно печи кипящего слоя различаются по форме поперечного сечения (круглое или прямоугольное), по площади пода, отношению объема надслоевого пространства к объему кипящего слоя, конструкции сопел для подачи воздуха, методу загрузки шихты в печь.
В настоящее время на цинковых заводах работают печи кипящего слоя с площадью пода от 21-35 до 72-123 м2. В них можно обжигать 100-800 т концентрата в сутки, т.е. от 5 до 10-20 т/(м2сут). На многих заводах используют избыточное тепло кипящего слоя и тепло отходящих газов для производства пара.
1.4. ДИСТИЛЛЯЦИЯ ЦИНКА
Дистилляция цинка является второй стадией технологической схемы переработки цинксодержащего сырья пирометаллургическим методом. В принципе, можно получать цинк этим способом в горизонтальных и вертикальных ретортах, в электропечах с расплавлением шихты и без него, в шахтных печах. Но только электрические печи с расплавлением шихты и шахтные печи имеют перспективу для получения цинка пирометаллургическим способом в наши дни. В обоих случаях в качестве восстановителя используется кокс, который при шахтной плавке за счет частичного сгорания в кислороде воздушного дутья дает тепло, необходимое для ведения процесса.
Процесс восстановления оксида цинка углеродом протекает главным образом в две стадии по реакциям
ZnO + CO Zn + CO2 – 67,7 кДж; (1.4)
CO2 + С 2СО – 172,4 кДж . (1.5)
Суммарная реакция этого процесса
ZnO + С = Zn + СО – 240,1 кДж (1.6)
может частично протекать и непосредственно.
Как видно, реакции (1.4)-(1.6) эндотермические и, следовательно, с повышением температуры их равновесие смещается в правую сторону.
С точки зрения термодинамики восстановления оксида цинка углеродом через участие в процессе оксида углерода (II), минимальная температура, необходимая для протекания процесса, соответствует точке пересечения кривых, отвечающих равновесному составу газовой фазы реакций (1.4) и (1.5). Из рис.1.4 следует, что эта температура составляет около 950 С. Поскольку она превышает температуру кипения цинка (906 С), то образующийся цинк будет находиться в парообразном состоянии. Так как реакция (1.4) протекает достаточно энергично лишь при температурах более 1000 С, то на практике процесс дистилляции цинка ведут при температурах 1200-1400 С. в этих условиях оксиды кадмия, меди и свинца также будут восстанавливаться до свободных металлов (рис.1.4). Поскольку температура кипения кадмия (767 С) меньше, чем температура кипения цинка, то оба металла будут находиться в газовой фазе. Оксиды железа могут также восстанавливаться до FeO или даже до свободного железа, которое может восстанавливать оксид цинка по реакции
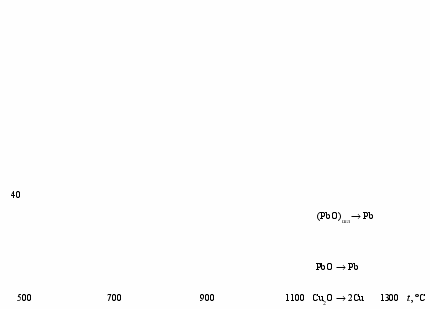
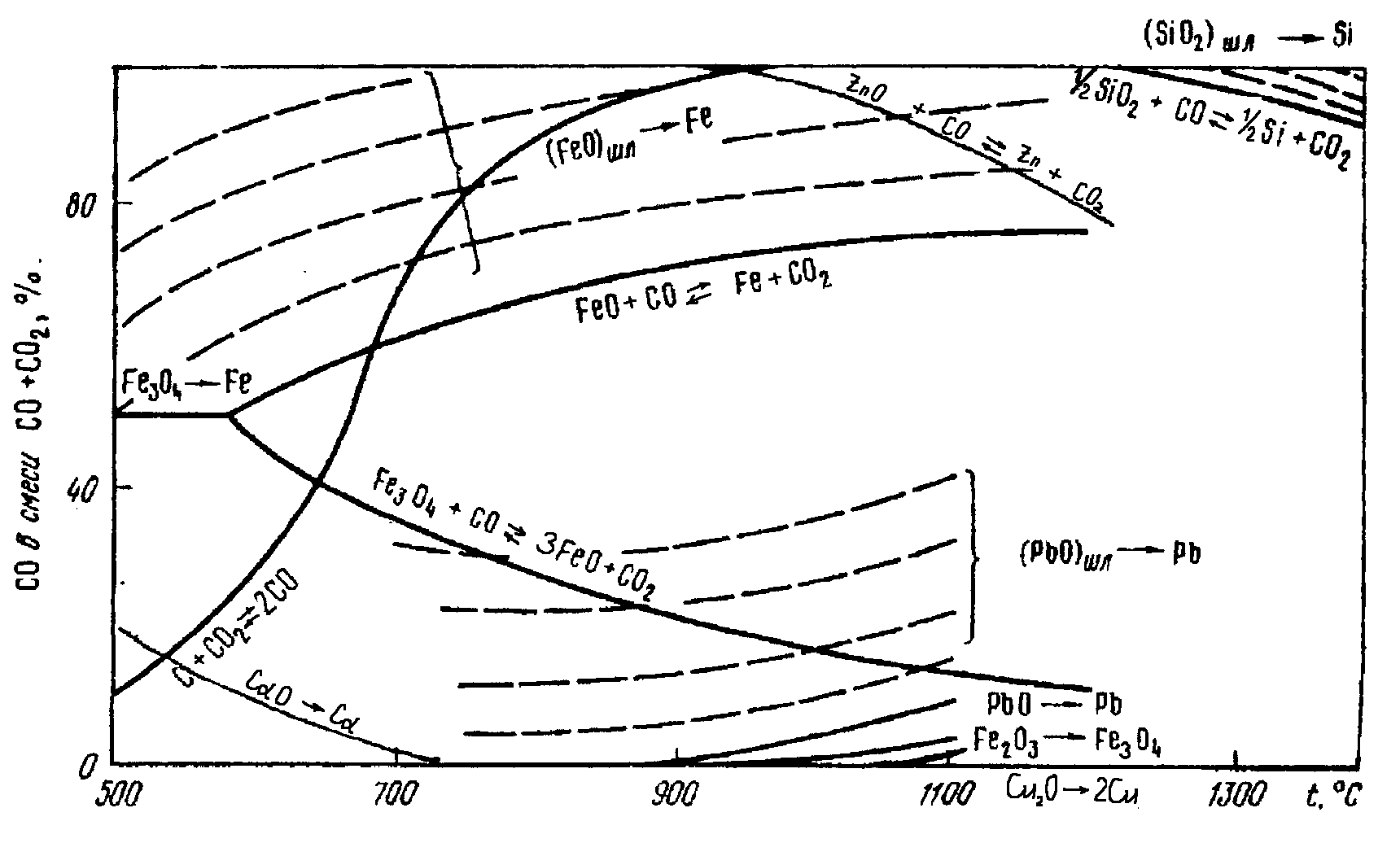
Рис.1.4. Кривые равновесия реакций восстановления оксидов металлов
оксидом углерода (II) и углеродом в зависимости от температуры t
и концентрации МеО в шлаке
ZnO + Fe = Zn + FeO. (1.7)
При осуществлении процесса дистилляции цинка в рудно-термических электропечах с расплавлением шихты достаточно большое количество оксидов железа восстанавливается до свободного металла. В этом случае в значительной степени протекает и реакция (1.7), но часть железа остается в виде самостоятельного продукта плавки.
При плавке цинково-свинцового агломерата в шахтной печи парциальное давление цинка в газовой фазе небольшое, поэтому в этих условиях можно вести процесс восстановления оксида цинка до металла без восстановления FeO до свободного железа. Оксид железа (II) в этих условиях вместе с оксидами других металлов переходит в шлак.
Поскольку реакция (1.4) обратима и с понижением температуры ее равновесие смещается в левую сторону, то возможно обратное окисление паров цинка СО2 в конденсационной системе. Чтобы этого избежать, необходимо охлаждать газы в конденсаторе как можно быстрее.
На практике при получении цинка в электропечах с расплавлением шихты быстрое охлаждение газов в конденсаторе цинка обеспечивается путем создания на их пути в конденсаторе завесы из капель цинка за счет разбрызгивания цинка импеллерами, погруженными в ванну цинка. При получении цинка в шахтных печах быстрое охлаждение газов и конденсация паров цинка достигается разбрызгиванием таким же образом свинцово-цинкового сплава, в котором растворяется сконденсированный цинк. Для выделения сконденсировавшейся части цинка из сплава его охлаждают в желобе с 550 до 450 С, а затем подают в разделительную печь, где получают черновой цинк и оборотный свинцово-цинковый сплав.
Производство цинка из цинкового агломерата в рудно-термической электропечи осуществляют на заводе в Палмертоне (США) и на некоторых других предприятиях. Печь завода имеет прямоугольную форму. Ее внутренние размеры: длина 9,7 м, ширина 4,9 м, высота 3,0 м. Печь оборудована тремя графитовыми электродами диаметром 0,6 м, расположенными в линию. Рабочая мощность печи 4500-5000 кВА. Она может работать в режиме открытой электрической дуги или в закрытом дуговом режиме. Температура в открытой дуге 3000-4000 С, но температура расплава в печи не должна превышать 1450 С во избежание восстановления пустой породы шихты и перегрева футеровки печи, что обеспечивается также загрузкой шихты вдоль стен печи и поддержанием зоны высоких температур в центре печи.
Шихта состоит из цинкового агломерата, кокса и известняка. Состав шихты должен давать отношение СаО : SiO2 в шлаке в пределах (0,81,4) : 1, которое обеспечивает достаточную жидкотекучесть шлака при температуре 1350 С. Шихта тщательно перемешивается и прокаливается в трубчатой вращающейся печи для удаления влаги и разложения известняка.
Подогретая шихта загружается в печь порциями по 2-3 т через загрузочные отверстия в своде печи. Расплавленный шлак и железный сплав накапливаются в печи и периодически выпускаются из нее через соответствующие летки. Газы, состоящие в основном из СО и паров цинка, удаляют из печи и направляют в конденсатор, где получают основную часть цинка в жидком виде, поддерживая температуру расплава около 500 С. Черновой цинк периодически выпускают из конденсатора. Суточная производительность печи по цинку 35 т. Извлечение цинка в черновой металл 95 %. Расход электроэнергии около 3000 квтч/т получаемого цинка.

В России по этой технологии работает Беловский цинковый завод.
Производство цинка в шахтных печах или процессом Imperial Smelting было впервые реализовано в промышленном масштабе в 1952 г. на заводе «Эвонмаунт» (Англия) после 25-летней работы над процессом. Сейчас процесс используется более чем на 10 заводах в разных странах. В этом процессе совместно перерабатываются цинк- и свинецсодержащие сырьевые материалы, которые сначала подвергаются спекающему обжигу на ленточных агломашинах с получением агломерата примерно следующего состава, %: Zn 35-45; Pb 15-20; SiO2 3-8; CaO 4-10; Fe 6-9; S 0,7-1,5.
Шихта шахтной печи состоит из агломерата и кокса, который предварительно прокаливается при температуре около 800 С. Чтобы улучшить тепловой баланс процесса, воздух, вдуваемый в печь через фурмы, также нагревают до 600-950 С.
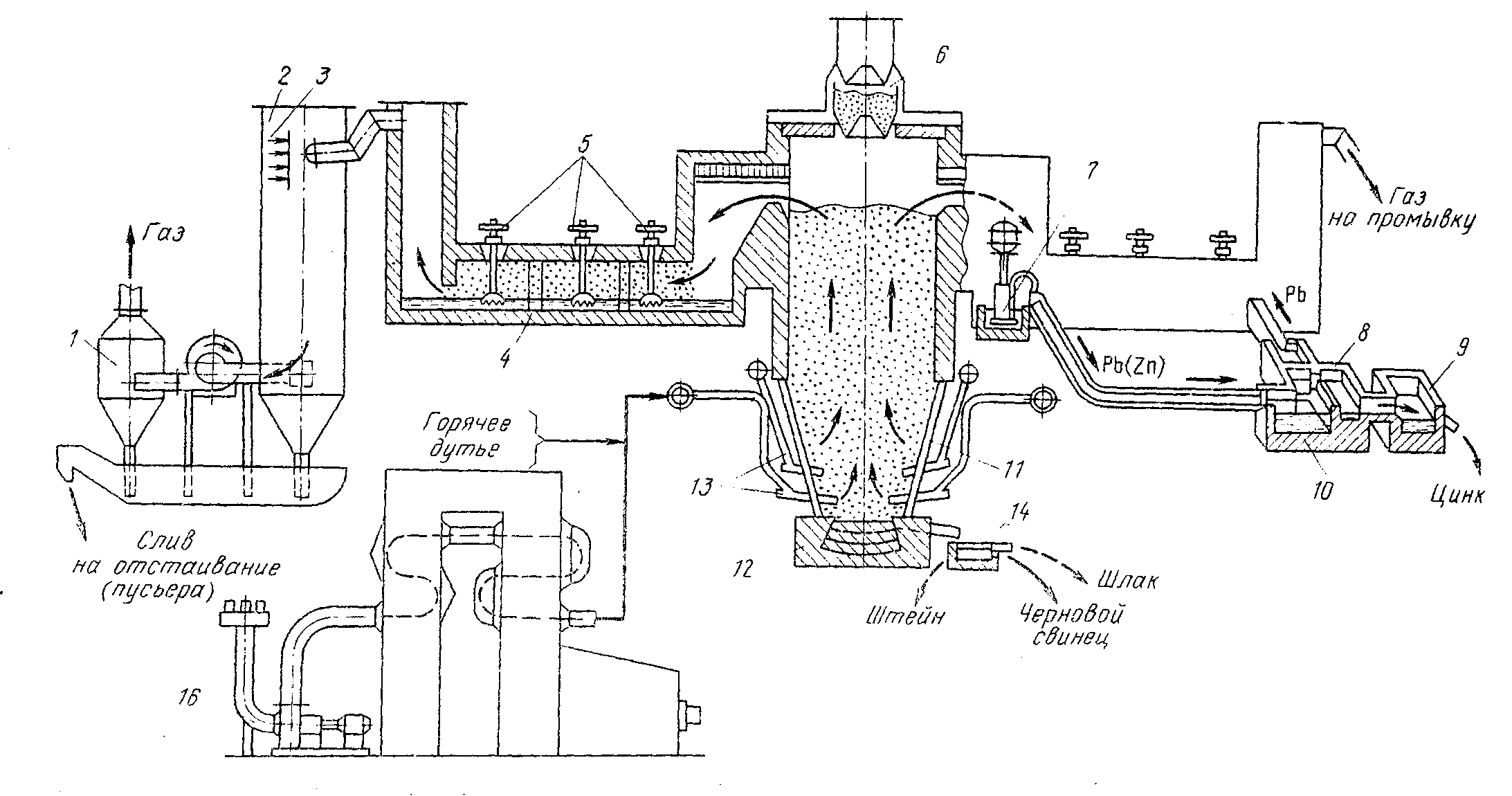
Рис.1.5. Шахтная печь для процесса Imperial Smelting
1 – циклон-брызгоуловитель; 2 – скруббер; 3 – водяные форсунки; 4 – конденсатор; 5 – роторные мешалки;
6 – загрузочное устройство; 7 – насос для перекачки свинца; 8 – сифон для выпуска оборотного свинца;
9 – приемник для цинка; 10 – ликвационная ванна; 11 – корпус шахтной печи; 12 – отстойник для разделения шлака
и чернового свинца; 13 – горн печи; 14 – фурмы; 15 – воздухонагреватель; 16 – воздуходувка
Печь (рис.1.5) имеет нижнюю водоохлаждаемую часть, где расположены также водоохлаждаемые фурмы. Верхняя часть печи выложена из огнеупорного кирпича, чтобы уменьшить потери тепла в окружающую среду. Колошник печи закрытого типа снабжен загрузочным устройством в виде затвора двухколокольного типа.
Оксид свинца восстанавливается в печи до свободного метала по реакции
PbO + CO = Pb + CO2 .
Свинец стекает во внутренний горн печи, откуда вместе со шлаком периодически выпускается в наружный горн, где оба продукта разделяются: свинец сливают в приемный ковш, а жидкий шлак выпускают в желоб для грануляции.
Газы уходят из печи при температуре около 1000 С. Они содержат около 5-7 % Zn, 8-12 % CO2, 14-18 % CO (остальное азот). Газы поступают в конденсатор, где быстро охлаждаются до температуры ниже 500 С, проходя через завесу из капель разбрызгиваемого импеллерами свинцово-цинкового сплава, в котором растворяется сконденсировавшийся цинк.
Свинцово-цинковый сплав, содержащий около 2,4 % цинка и имеющий температуру 550-560 С, насосом откачивают из конденсатора, охлаждают до 450 С в водоохлаждаемом желобе и подают в разделительную печь. С понижением температуры взаимная растворимость свинца и цинка снижается и в итоге в разделительной печи получаются два слоя: верхний – черновой цинк и нижний – оборотный свинцово-цинковый сплав, содержащий около 2,2 % цинка. Цинк после частичного или полного рафинирования от примесей разливают в слитки. При надлежащих условиях 80-89 % цинка, поступившего в виде пара в конденсатор, переходит в нем в жидкий металл. Для конденсации 1 т цинка необходимо перекачивать через конденсационную систему около 400 т свинцово-цинкового сплава. Поскольку газы, выходящие из конденсатора, содержат еще некоторое количество цинка и свинца, их направляют для очистки в скруббер. Очищенный газ используют для прокалки кокса, нагрева воздуха и просто как топливо. Шлам является оборотным продуктом.
В настоящее время по описанной технологии работают шахтные печи с площадью сечения в области фурм 17-27 м2. Удельная производительность печей по шихте составляет 20-32 т/(м2сут). Расход кокса около 40 % от массы агломерата или 90-100 % от массы чушкового цинка. Эффективность работы конденсатора жидкого цинка 79-89 %. Общее извлечение цинка и свинца из агломерата в металл соответственно 92-93 и 92-94 %. Химический состав чернового цинка следующий, %: Zn 98,5-98,8; Pb 1,1-1,3; Cd 0,03-0,15; Cu 0,01-0,05; Sn 0,005-0,015; As 0,01-0,04; Fe 0,015-0,028. Состав шлака, %: СаО 25-32; SiO2 18-25; FeO 20-38; Al2O3 5,0-11; Zn 6-9; Pb 0,5-1; Cu 0,5.
Главными достоинствами описываемого процесса являются возможность совместно перерабатывать цинк- и свинецсодержащие материалы, высокая производительность шахтных печей и большая степень механизации. Основные недостатки процесса связаны с большим расходом высококачественного кокса, необходимостью рафинирования получаемого цинка и сравнительно высоким содержанием цинка в шлаке.
1.5. РАФИНИРОВАНИЕ ЧЕРНОВОГО ЦИНКА
Основными способами рафинирования чернового цинка являются ликвация и ректификация. Ликвационный способ позволяет снизить содержание свинца в цинке примерно до 1 %, а также частично очистить цинк от железа. Процесс рафинирования цинка ликвацией проводят в небольших отражательных печах (емкостью по цинку 30-150 т), в которых расплавленный черновой цинк выдерживают при температуре 430-440 С в течение 24-48 ч. В этих условиях в ванне печи образуется три слоя: верхний слой цинка, содержащий 0,8-1 % Pb и 0,02-0,03 % Fe, средний слой «твердого» цинка, содержащий 2-5 % Fe, и нижний слой свинца с 5-6 % Zn. Эти продукты периодически удаляют из печи, а в печь заливают новую порцию чернового цинка.
Процесс ректификации позволяет получить металл с содержанием 99,99 % цинка и более. Он основан на различии температур кипения цинка (906 С) и примесей (температура кипения кадмия, свинца, меди и железа 767, 1750, 2310 и 2450 С соответственно). Рафинирование цинка ректификацией проводят в ректификационных колоннах, имеющих 40-50 тарелок специальной формы, сделанных из карборунда. Тарелки нижней части колонны обогреваются для испарения металлов, а верхняя часть колонны (дефлегматорная) не обогревается. В ней происходит частичная конденсация перешедших в паровую фазу металлов (в первую очередь, с более высокой температурой кипения). Образующийся жидкий металл стекает вниз навстречу поднимающейся вверх паровой фазе, в связи с чем паровая фаза дополнительно очищается от примесей.
Установка обычно состоит из двух свинцовых колонн, работающих параллельно, и одной кадмиевой колонны. Продуктами свинцовой колонны являются цинк с повышенным содержанием свинца и железа, выпускаемый из нижней части колонны и направляемый обычно в ликвационную печь, и паровая фаза, содержащая цинк и кадмий и отводимая из верхней части колонны. Ее конденсируют, а жидкий металл подают в кадмиевую колонну, из нижней части которой вытекает рафинированный цинк с содержанием 99,99 % цинка и более. При конденсации паров цинка и кадмия, отводимых из верхней части колонны, получают пыль («пусьеру»), содержащую до 40 % кадмия. Производительность ректификационной установки по цинку 20-30 т/сут, расход топлива около 40 % от массы цинка.
1.6. ВЫЩЕЛАЧИВАНИЕ ЦИНКОВОГО ОГАРКА
выщелачивание цинкового огарка является вторым переделом переработки цинковых концентратов гидрометаллургическим методом (см. рис.1.2) и преследует две основные цели: перевести в раствор как можно больше цинка и отделить цинк от других компонентов, присутствующих в огарке. Для достижения этих целей процесс выщелачивания проводят в одну, две или более стадий, среди которых во всех случаях есть стадия нейтрального выщелачивания.
В технологических схемах с неполным извлечением цинка в раствор наиболее часто осуществляют двухстадийное противоточное выщелачивание, при котором сначала проводят нейтральное выщелачивание огарка, а остаток от этого процесса подвергают кислому выщелачиванию. Получаемый в результате кислого выщелачивания остаток содержит 16-23 % цинка, и его необходимо перерабатывать для извлечения цинка и других металлов. Раствор от кислого выщелачивания подают в цикл нейтрального выщелачивания.
В технологических схемах с полным извлечением цинка в раствор остаток после кислого выщелачивания проходит несколько стадий выщелачивания при повышенных температурах и концентрациях серной кислоты в растворе. На практике концентрация кислоты в конечных растворах при выщелачивании цинкового огарка может быть от 200 г/л до сравнительно низкой (pH = 4,85,4), а температуру пульпы при проведении процесса при атмосферном давлении держат в интервале от 45 до 98 С.
Главной задачей нейтрального выщелачивания цинкового огарка является гидролитическая очистка раствора от железа и ряда других примесей. На этой стадии удаляют с остатком и основное количество кремнезема. Цинк же при этом переходит в раствор лишь частично.
Возможность перехода в осадок некоторых примесей при нейтральном выщелачивании обусловлена различием pH гидратообразования цинка и металлов-примесей. Осаждение гидроксида MeZ+ из сульфатных растворов начинается при повышении pH раствора до равновесного значения. Осадки обычно представляют собой основные сульфаты типа MeSO4 nMe(OH)2*. Эти соединения трудно растворимы в воде и при постоянной температуре их произведение растворимости
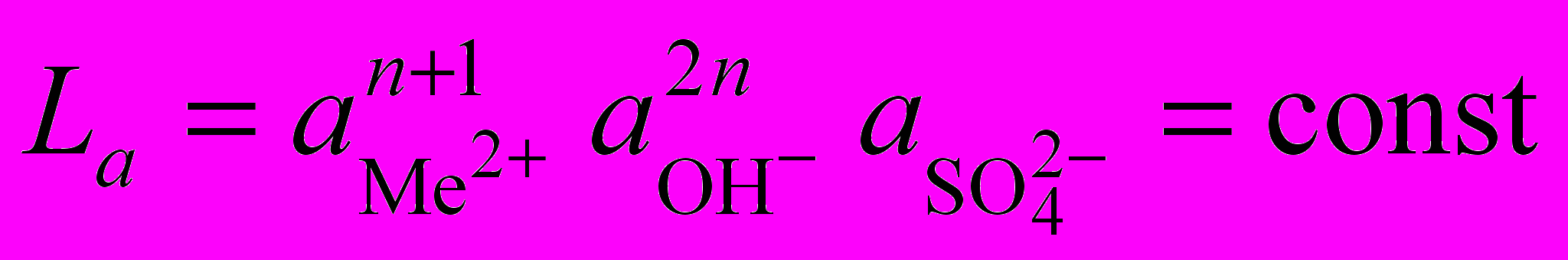 . Логарифмируя это выражение и используя ионное произведение воды
. Логарифмируя это выражение и используя ионное произведение воды 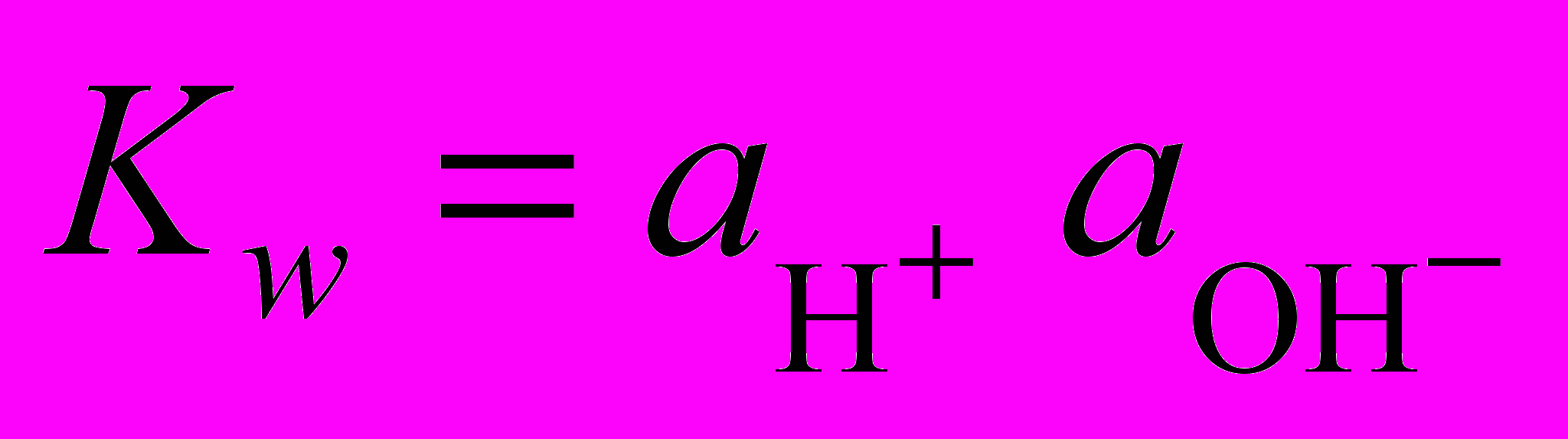 , получим выражение для равновесного значения pHравн гидратообразования:
, получим выражение для равновесного значения pHравн гидратообразования: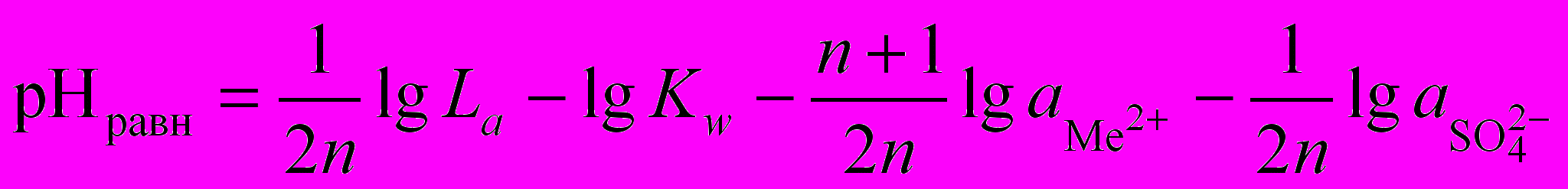 . (1.8)
. (1.8)Термодинамически осаждение Ме2+ из раствора в виде гидроксида или основной соли будет иметь место при pH pHравн. Как видно из выражения (1.8), pHравн зависит от природы металла (La), состава раствора (
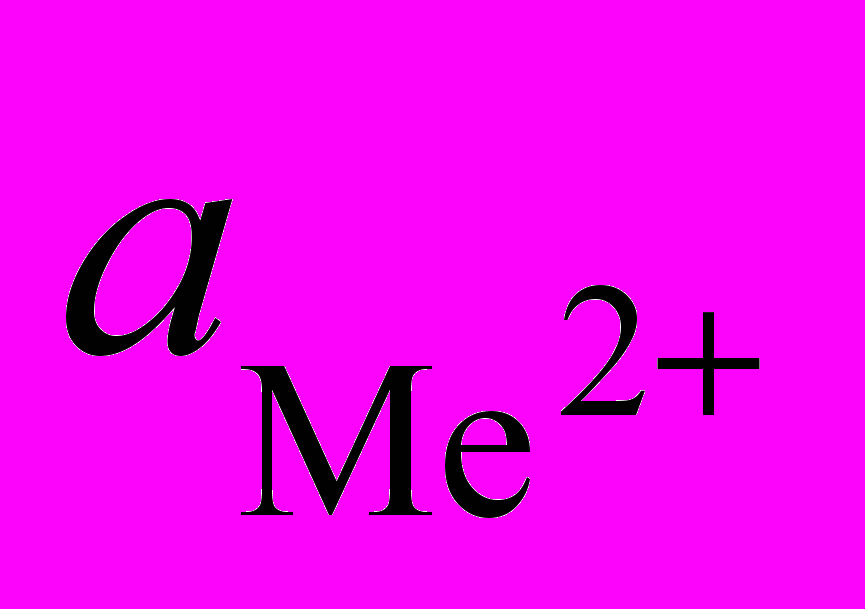 и
и 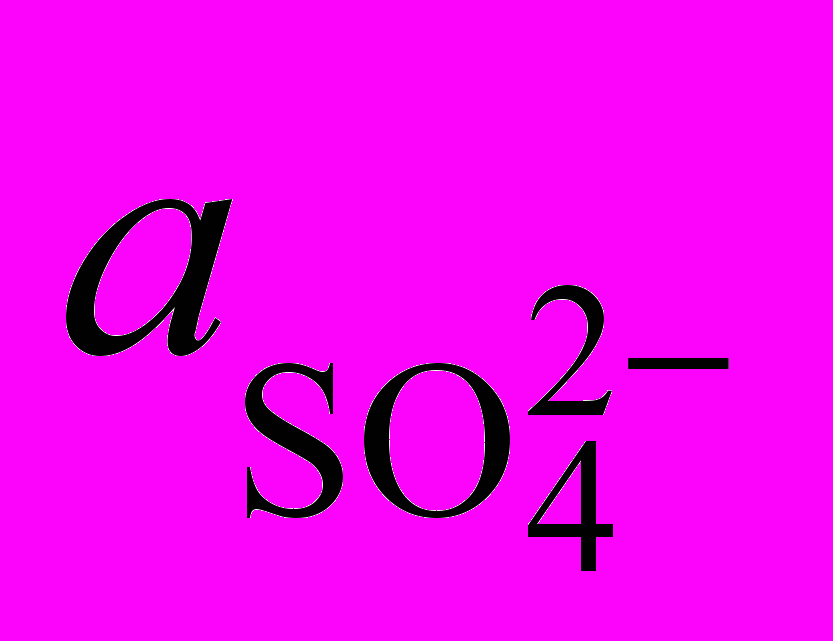 ) и температуры (La и Kw).
) и температуры (La и Kw).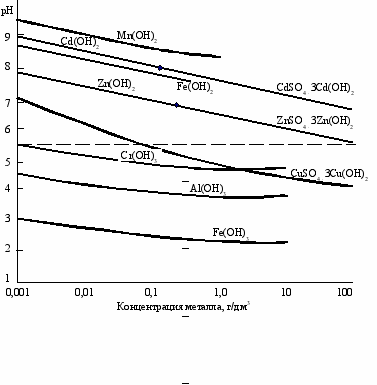
Рис.1.6. Зависимость pH осаждения (растворения) гидроксидов и основных солей
некоторых металлов в сульфатных растворах при 25 С (пунктиром обозначено
предельное значение pH растворов сульфата цинка с концентрацией цинка 100 г/дм3)
Поскольку нижний предел содержания цинка в растворах при переработке цинксодержащего сырья гидрометаллургическим методом составляет около 100 г/л, то верхний предел pH будет около 5,6 (рис.1.6). На практике чаще всего концентрация цинка в промышленных растворах составляет 130-180 г/л, а химическое равновесие обычно не достигается, поэтому при нейтральном выщелачивании цинкового огарка конечное рН = 4,85,4. Как следует из рис.1.6, при таких значениях pH можно очистить раствор от Fe3+, Al3+, Cr3+ и частично от Cu2+. Что касается Cd2+, Fe2+, Mn2+ (а также Ni2+ и Со2+), то они останутся в растворе. Для очистки растворов от железа Fe2+ его окисляют до Fe3+. Окисление железа можно провести кислородом воздуха или диоксидом марганца, используя марганцевую руду. В первом случае процесс идет в нейтральной среде (pH 2,5) и в присутствии ионов меди в растворе как катализатора. Окисление железа диоксидом марганца идет в кислой среде по реакции
2FeSO4 + MnO2 + 2H2SO4 = Fe2(SO4)3 + MnSO4 + 2H2O.
Упрощенно гидролиз Fe2(SO4)3 можно представить реакцией
Fe2(SO4)3 + 6H2O = 2Fe(OH)3 + 3H2SO4.
Для нейтрализации серной кислоты по реакции
H2SO4 + ZnO = ZnSO4 + H2O
необходимо иметь избыток цинксодержащего огарка в пульпе против того количества, которое требуется для нейтрализации содержащейся в ней серной кислоты.
При нейтральном выщелачивании вместе с железом осаждаются мышьяк, сурьма и некоторые другие примеси. Нейтральная пульпа поступает в сгустители, верхний слив из которых подвергается дополнительной очистке от примесей и затем направляется на электролиз для выделения из раствора цинка. А нижний слив сгустителей, содержащий еще много растворимого цинка в твердой его части, подвергается кислому выщелачиванию. Конечная концентрация кислоты в пульпе при этом достигает 2-10 г/л (pH 12). В этом цикле выщелачивания вместе с цинком переходит в раствор и часть примесей. Пульпу направляют в сгустители, верхний слив из которых поступает в цикл нейтрального выщелачивания, а сгущенная пульпа проходит двухстадийную фильтрацию с промежуточной репульпацией кека. На некоторых заводах перед фильтрацией проводят противоточную промывку нижнего слива водой в двух-трех сгустителях для снижения содержания водорастворимого цинка в кеке (остатке после выщелачивания).
Выщелачивание цинкового огарка – это типичный гетерогенный процесс, включающий как минимум три стадии:
подвод серной кислоты из объема раствора к реагирующей поверхности;
химическое взаимодействие кислоты с частицей огарка;
отвод продуктов реакции (сульфатов металлов) от реакционной поверхности в объем раствора.
Среди факторов, влияющих на скорость процесса выщелачивания, выделим размер и пористость частиц цинкового огарка, температуру пульпы и концентрацию в ней серной кислоты, реакционную способность частиц огарка и интенсивность перемешивания пульпы.
В технологических схемах с неполным переводом цинка из огарка в раствор извлечение его в раствор составляет 75-90 %. Основными соединениями цинка в остатке от выщелачивания являются ZnS и ZnFe2O4. Извлечение кадмия в раствор примерно такое же, как цинка. Содержание железа в растворах кислого цикла 1-2 г/л (извлечение в раствор из огарка 3-4 %). Никель и кобальт, в основном, переходят из огарка в раствор. Обычно около 50 % меди от количества ее в огарке переходит в раствор нейтрального цикла и примерно столько же остается в остатке после кислого выщелачивания (цинковом кеке). Свинец, кальций и барий в остатке от выщелачивания содержатся в виде сульфатов. Золото и серебро также остаются в цинковом кеке.
Для выщелачивания цинкового огарка используют агитаторы с пневматическим перемешиванием пульпы (пачуки) или с механическим перемешиванием пульпы. Пачук представляет собой емкость цилиндрической формы с коническим дном, корпус которой сделан из дерева или стали и футерован изнутри кислотоупорным материалом. Пачуки имеют диаметр 3-4 м, высоту 6-10 м, емкость 40-100 м3. В центре пачука расположена труба (аэролифт), в нижнюю часть которой подается под давлением воздух. Пульпа внутри аэролифта, насыщенная пузырьками воздуха, имеет меньше плотность, чем снаружи, и поэтому поднимается вверх. Это обеспечивает постоянное перемешивание пульпы.
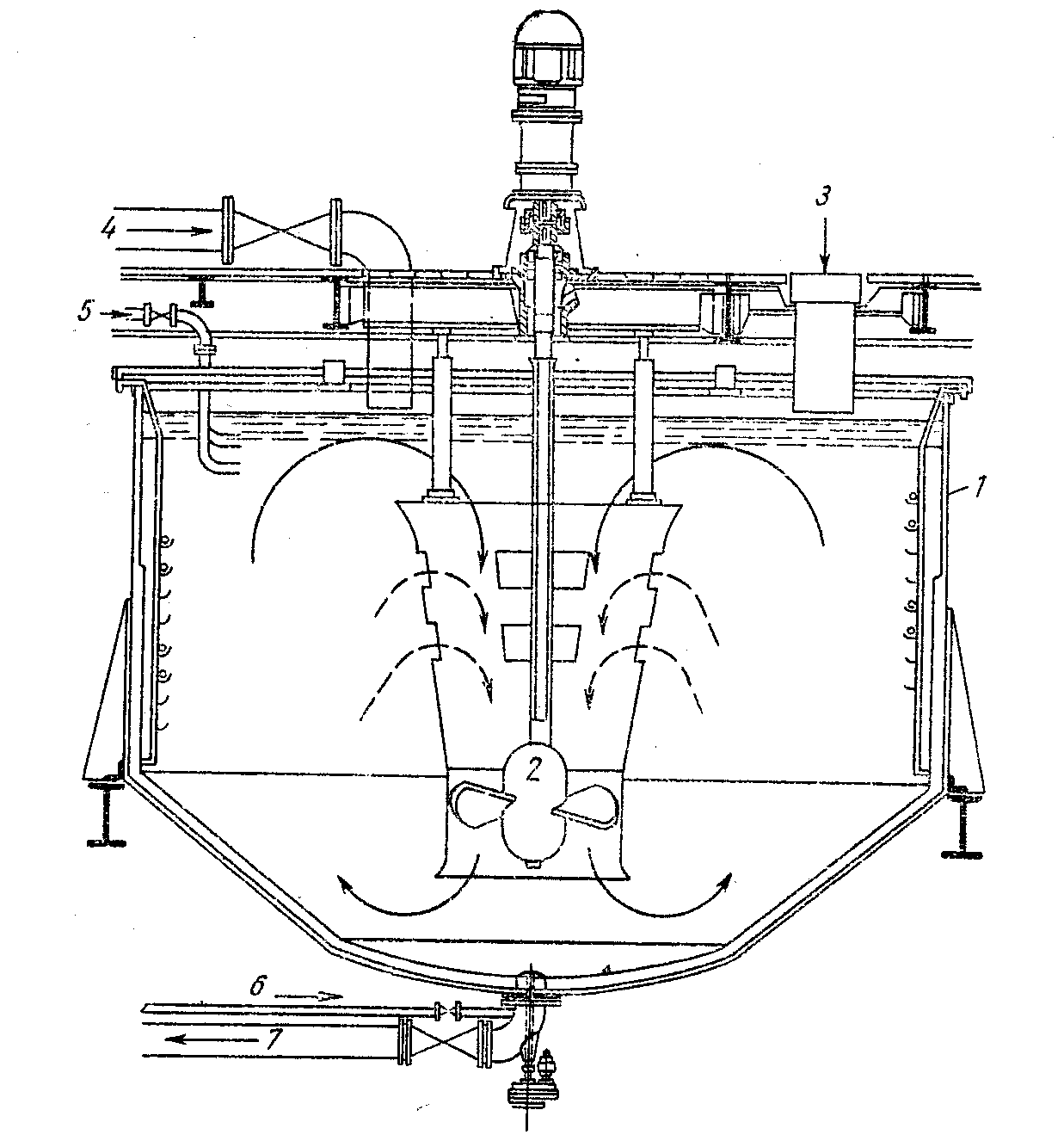
Агитатор с механическим перемешиванием (рис.1.7) имеет стальной цилиндрический корпус с полукруглым дном, который также футерован изнутри кислотоупорным материалом. Обычно эти агитаторы имеют объем 60-100 м3, но могут быть и больше. Например, агитатор объемом 100 м3 имеет диаметр 6,2 м и высоту 4,2 м. Огарок и раствор, содержащий кислоту, подают в агитатор сверху, а пульпу выпускают из агитатора снизу. При необходимости пульпу нагревают «глухим» или «острым» паром.
1
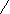
2
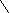
6
3
4
5
7
Рис.1.7. Бак с механическим перемешиванием
1 – труба для выпуска пульпы; 2 – труба сжатого воздуха; 3 – пропеллерная мешалка;
4 – труба для подачи пара; 5 – труба для подачи отработанного электролита; 6 –
отверстие для загрузки обожженного концентрата; 7 – бак
Пачуки используют в технологических схемах с непрерывным выщелачиванием огарка, пропуская пульпу через несколько последовательно установленных аппаратов. Агитаторы с механическим перемешиванием пульпы используют как для работы в периодическом режиме выщелачивания, так и при проведении этого процесса в непрерывном режиме.
Разделение пульпы после нейтрального или кислого выщелачивания на жидкую и твердую часть проводят в сгустителях, корпус которых делают из железобетона или стали, а изнутри футеруют кислотоупорным материалом. В производстве цинка используют сгустители диаметром 9-24 м и высотой 3-4 м. Нижний слив кислых сгустителей фильтруют сначала на рамных вакуум-фильтрах, кек затем репульпируют и фильтруют пульпу вторично на дисковых вакуум-фильтрах.
Безобжиговая технология переработки цинковых концентратов, разработанная канадскими фирмами «Шеррит Гордон» и «Коминко», предусматривает прямое автоклавное окислительное выщелачивание концентрата раствором серной кислоты (отработанным электролитом) при температуре 145-155 С и парциальном давлении кислорода 300-700 кПа в четырехкамерных горизонтальных автоклавах. Цинк при этом переходит из концентрата в раствор, в основном, по реакции
ZnS + H2SO4 + ½ O2 = ZnSO4 + H2O + So.
Элементарная сера извлекается из остатка от выщелачивания в качестве самостоятельного продукта.
Эта технология используется пока только на двух заводах в Канаде («Трейл» с 1980 г., «Тимминс» с 1983 г.) в сочетании с обычной технологией переработки цинковых концентратов гидрометаллургическим методом.
1.7. ОЧИСТКА ЦИНКСОДЕРЖАЩИХ РАСТВОРОВ ОТ ПРИМЕСЕЙ
Нейтральный цинксодержащий раствор, получаемый в результате полного завершения процесса выщелачивания цинкового огарка, содержит ряд примесей, мг/дм3: Cu 300-1800; Cd 250-700; Fe2+ 8-30; (Fe2+ + Fe3+) 15-30; Co 3-16; Ni 2-6; As 0,1-0,3; Sb 0,1-2,0; твердого 800-2000. Прежде чем этот раствор может быть направлен на электролиз, его необходимо очистить от примесей.
На практике используют три метода очистки цинксодержащих растворов от примесей: гидролитический, химический и цементационный.
Очистка гидролитическим методом основана на различии pH гидратообразования металлов, и ее обычно (см. раздел 1.6) совмещают с процессом выщелачивания огарка.
В основе очистки растворов от примесей методом цементации лежит различие электрохимических потенциалов металлов. Этот процесс может быть представлен реакцией
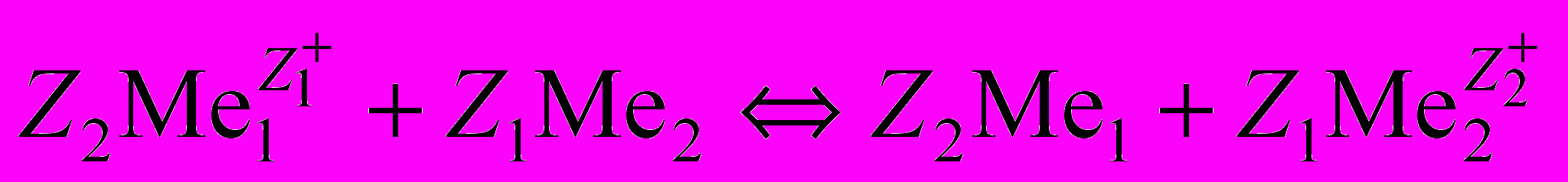 , (1.9)
, (1.9)где
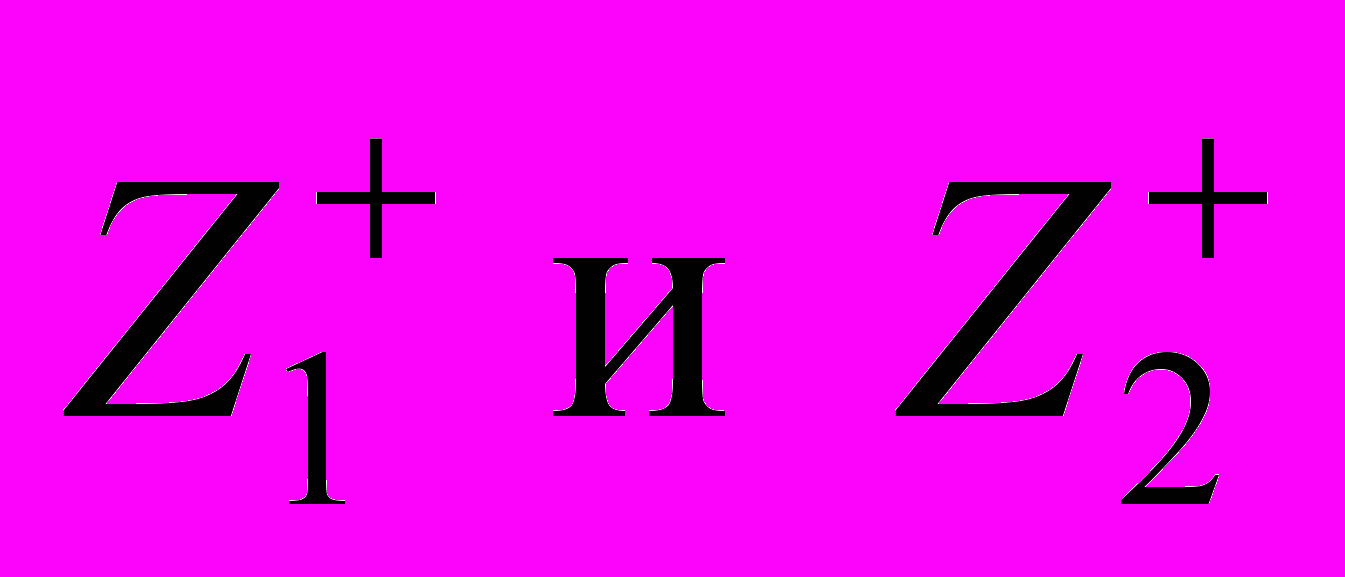 – заряды катионов металлов.
– заряды катионов металлов.Термодинамически реакция (1.9) будет протекать вправо, если
 , а ее равновесие наступит при
, а ее равновесие наступит при  =
=  или при
или при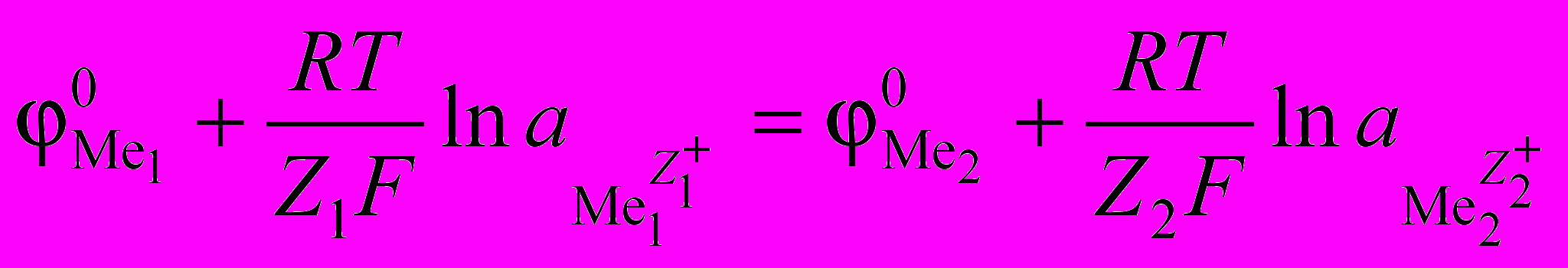 , (1.10)
, (1.10)где
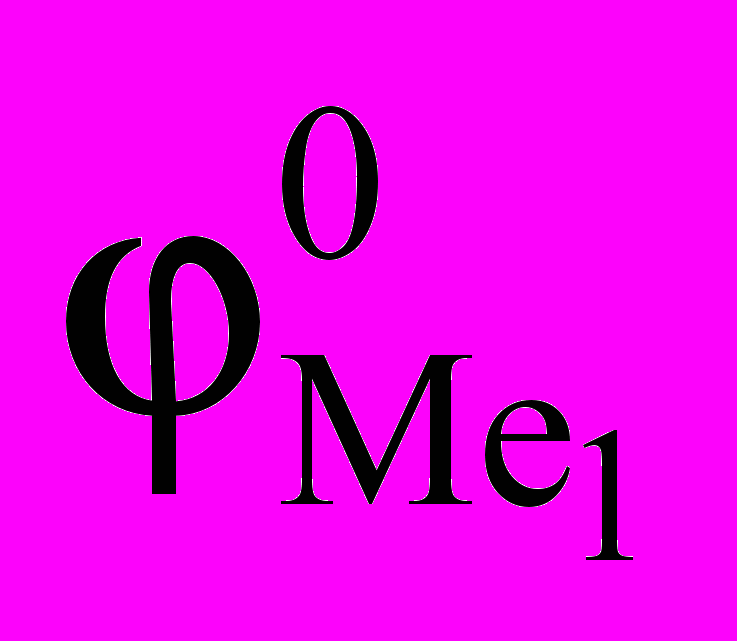 и
и 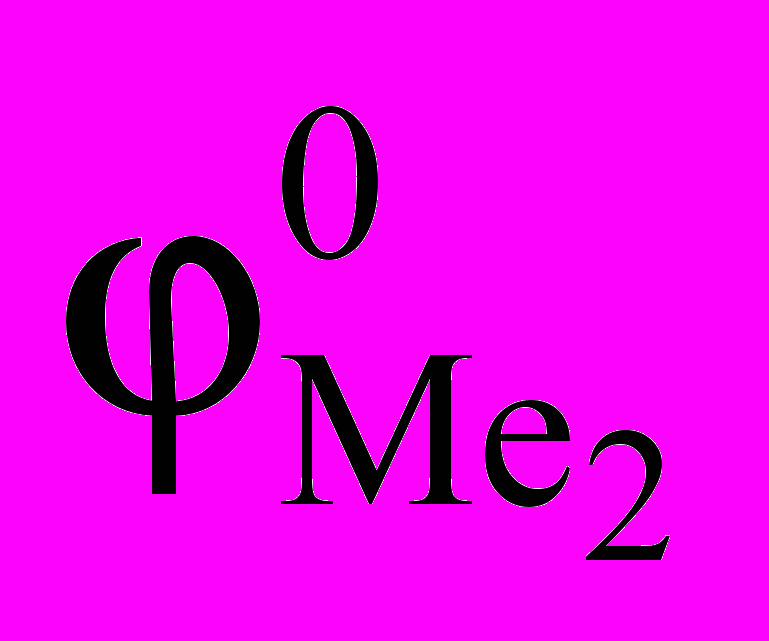 – стандартные электрохимические потенциалы металлов, В;
– стандартные электрохимические потенциалы металлов, В; 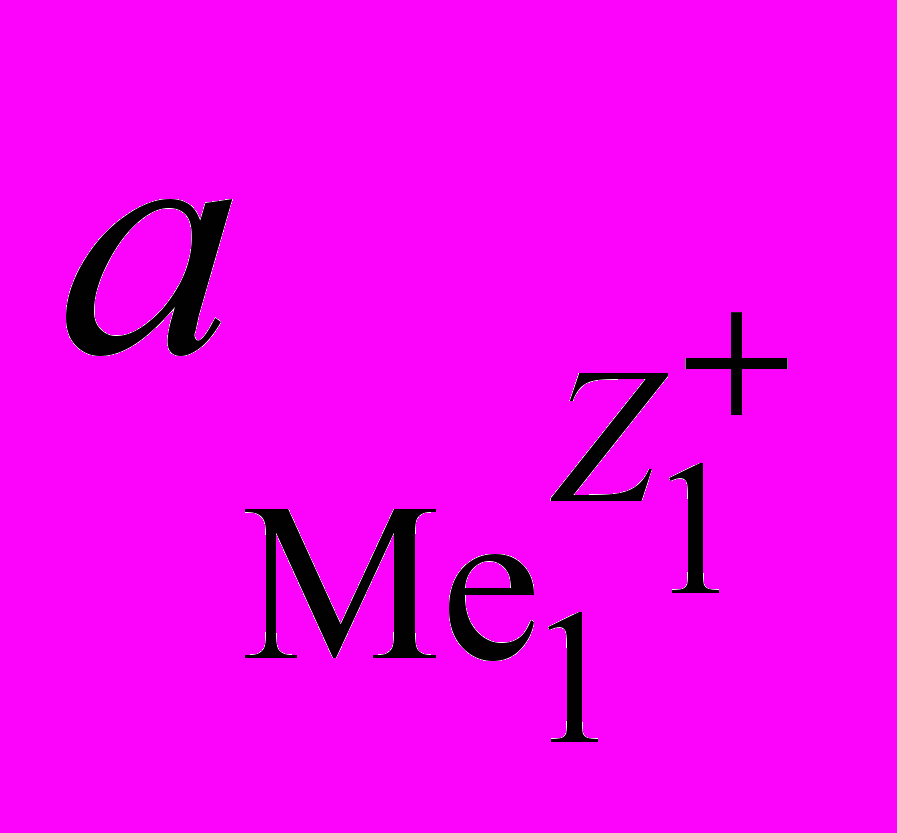 и
и 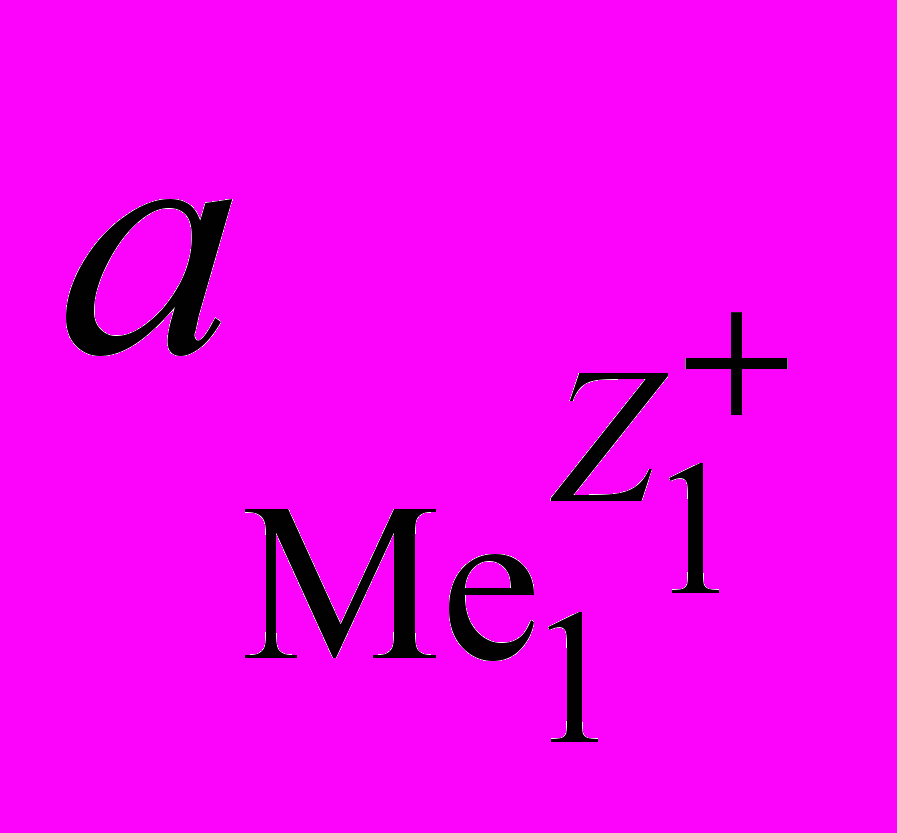 – активности ионов металлов в растворе, г-ион/л; R – газовая постоянная, R = 8,32 Дж/(мольК); F – число Фарадея, F = 96500 кл/г-экв; T – температура, К.
– активности ионов металлов в растворе, г-ион/л; R – газовая постоянная, R = 8,32 Дж/(мольК); F – число Фарадея, F = 96500 кл/г-экв; T – температура, К.Выражение (1.10) можно записать в виде
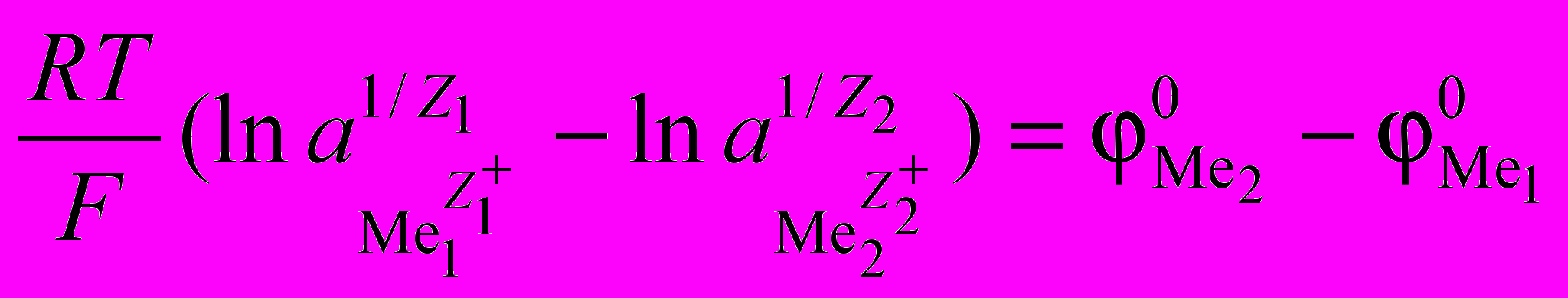 ,
,откуда
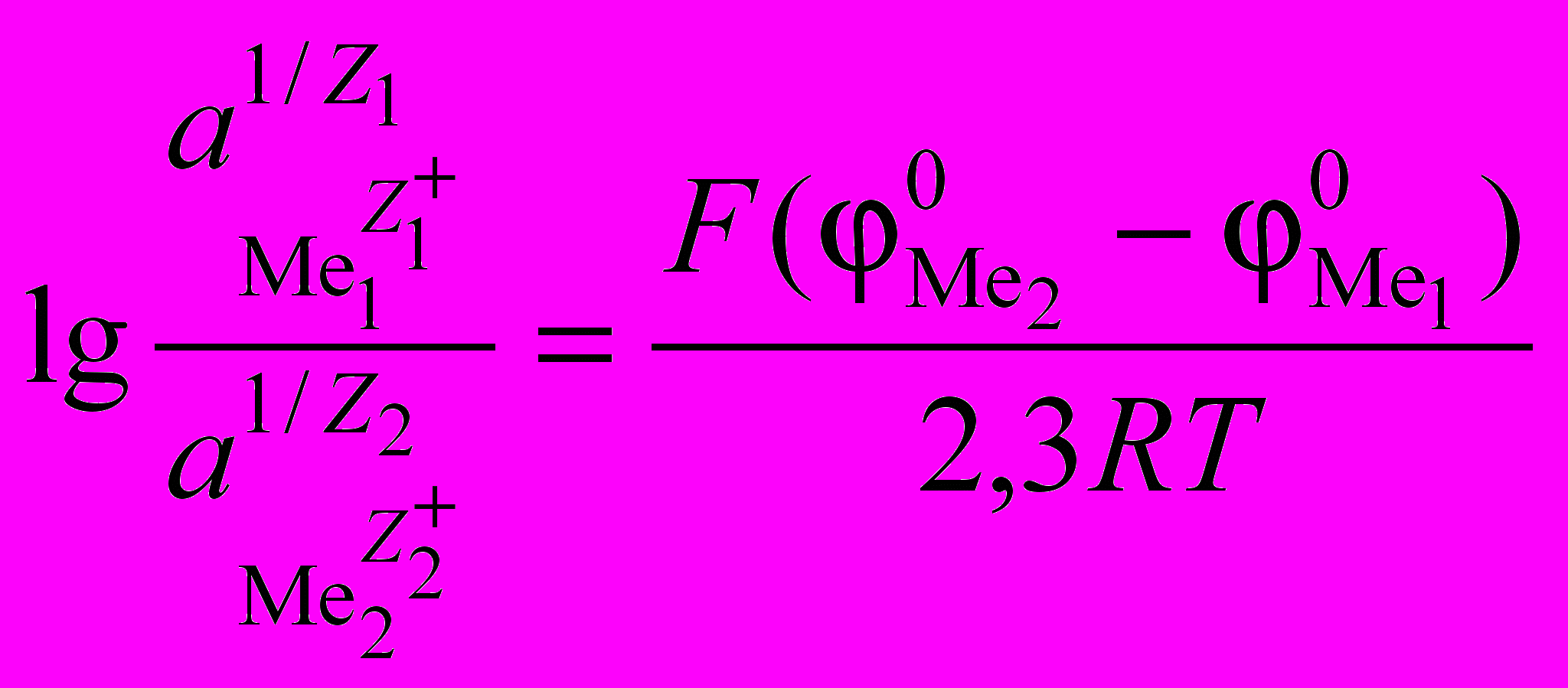 . (1.11)
. (1.11)Если известны стандартные электрохимические потенциалы металлов, то по формуле (1.11) можно рассчитать равновесное отношение активностей для различных пар металлов. Приведем значения стандартных потенциалов некоторых металлов при 25 С:
| Металл | Zn | Fe(II) | Cd | Co(II) | Ni(II) | Cu(II) |
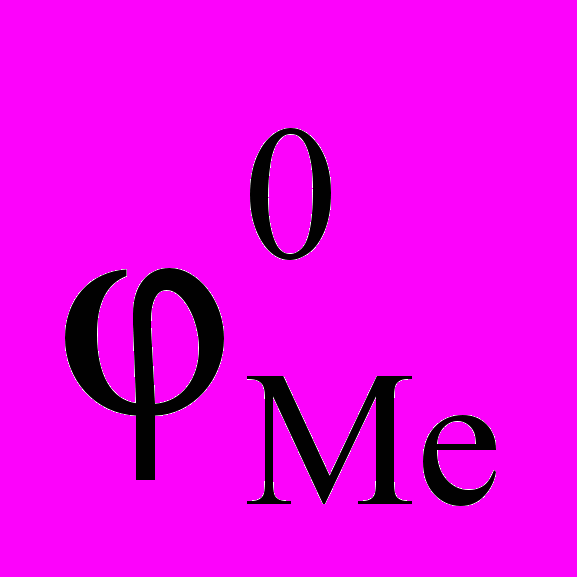 , В , В | –0,762 | –0,44 | –0,402 | –0,277 | –0,25 | +0,337 |
Расчеты по формуле (1.11) дают очень небольшие отношения активностей aМеZ+ /aZn2+ для примесей при цементации их цинком: 1 10–33 для Cu; 5 10–19 для Ni; 1,3 10–17 для Со, 3,2 10–13 для Cd и 8 10–12 для Fe.
Эти данные показывают, что термодинамически есть возможность очистить раствор цементацией цинком весьма полно. На практике, однако, степень осаждения примесей из раствора при использовании в качестве цементатора цинка гораздо ниже из-за кинетических затруднений. Железо, например, при комнатной температуре практически не осаждается цинком совсем. Никель и кобальт при низких температурах цементируется цинком хуже, чем кадмий. Сочетание влияния термодинамических и кинетических факторов на процесс цементации примесей цинком в порядке убывания скорости их осаждения позволяет расположить их при температурах 70 С в следующий ряд: Cu Cd Ni Co (Fe2+ не цементируется). Заметим, что при температурах более 80 С кадмий осаждается хуже, чем никель и кобальт.
На практике для очистки цинксодержащих растворов от примесей цементацией используют порошкообразный цинк (цинковую пыль), который чаще всего получают распылением жидкого цинка. Процесс ведут в агитаторах с механическим перемешиванием. Интенсификация процесса цементации достигается использованием более мелкой цинковой пыли, увеличением кратности ее расхода, повышением температуры до оптимальной и увеличением интенсивности перемешивания пульпы. В зависимости от состава раствора и других факторов процесс цементации проводят в две-четыре стадии. Общий расход цинковой пыли в 2-3 раза превышает теоретически необходимое ее количество. Для интенсификации процесса очистки раствора от кобальта и никеля вместе с цинковой пылью вводят в раствор соединения сурьмы или мышьяка. Процесс цементации ведут при pH = 35,4. Осадок (кек) отделяют от раствора фильтрацией.
Химический метод очистки раствора от примесей используют в металлургии цинка для вывода из раствора кобальта (в настоящее время уже изредка) и хлор-иона. Этот метод основан на образовании примесями труднорастворимых соединений с реагентами, добавляемыми в раствор. Для очистки растворов от кобальта используют в основном два вида реагентов: этиловый ксантогенат натрия или калия (С2Н5ОСS2Na или C2H5OCS2K) и -нитрозо--нафтол (C10H6NOOH). В первом случае кобальт осаждается в виде соединения (С2Н5ОСS2)3Со, во втором – (C10H6NOO)2Со. Катализатором при окислении Со2+ до Со3+ служит Cu2+.
Для очистки растворов от хлор-иона в качестве реагентов можно использовать Ag2SO4 или (CuSO4aq + Cu). В первом случае образуется труднорастворимое в воде соединение AgСl, а во втором Cu2Cl2. Контроль и поддержание в растворе на допустимом уровне содержания других примесей (Na, K, Mg) осуществляют путем вывода из общего процесса части раствора и отдельной его переработки (например, выпариванием раствора в печи кипящего слоя получают цинковый купорос).
1.8. ЭЛЕКТРОЛИЗ РАСТВОРА СУЛЬФАТА ЦИНКА
И ПЕРЕПЛАВКА КАТОДНОГО ЦИНКА
Состав очищенного от примесей раствора сульфата цинка, поступающего на электролиз, обычно следующий, мг/л: Zn (1,2-1,8) 105, Mn (2-10) 103, As 0,05-0,2, Sb 0,01-0,15, Cd 0,1-2,0, Fe 0,2-50, Cu 0,05-0,1 , Co 0,1-4,0, Ni 0,01-0,5, Cl 20-300, F 20-50.
Ванна для электролиза раствора сульфата цинка представляет собой емкость прямоугольной формы, корпус которой на современных заводах сделан из железобетона и покрыт изнутри кислотостойким материалом. В ванну помещены две группы электродов: катоды и аноды, расположенные в ней параллельно друг другу через один. Катодами служат плоские листы, сделанные из алюминия (можно использовать также титан), а анодами – плоские листы из свинца с добавкой к нему до 1 % серебра для увеличения коррозионной стойкости анодов. Размеры и число пар электродов в ванне зависят от производительности завода. Несколько электролизных ванн группируют в блок, а блоки – в серии. Катоды и аноды соединены в ванне электрически параллельно (катоды подключены к отрицательному полюсу постоянного тока, аноды – к положительному); ванны соединены последовательно.
Нейтральный раствор подают непрерывно в ванну с одной из коротких ее сторон, а отработанный электролит непрерывно вытекает из ванны с противоположного ее торца. Под действием электрического тока сульфат цинка в ванне разлагается с осаждением цинка на поверхности катода, выделением на аноде кислорода и накоплением серной кислоты в растворе. Суммарный результат электролиза можно представить реакцией
ZnSO4 + H2O = Zn + H2SO4 +
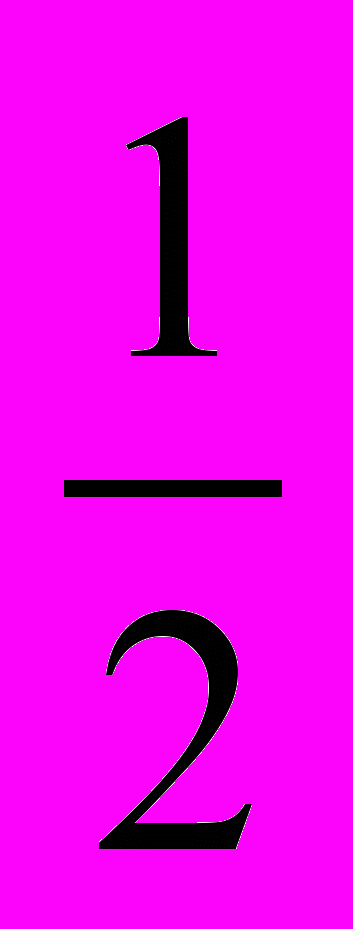 O2.
O2.Отработанный электролит, как и весь раствор в электролитной ванне, содержит 40-60 г/л Zn и 120-180 г/л H2SO4.
На катоде могут протекать следующие основные реакции:
Zn2+ + 2e = Zn0; (1.12)
2H3O+ + 2e = H2 + 2H2O; (1.13)
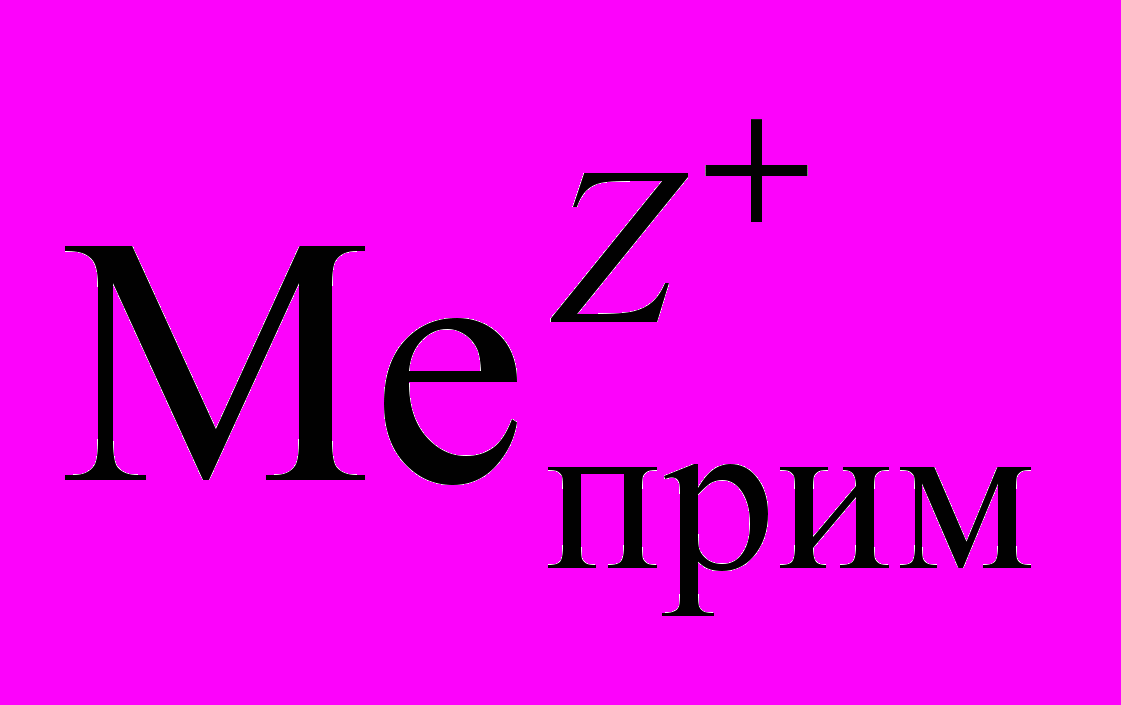 + Z e =
+ Z e = 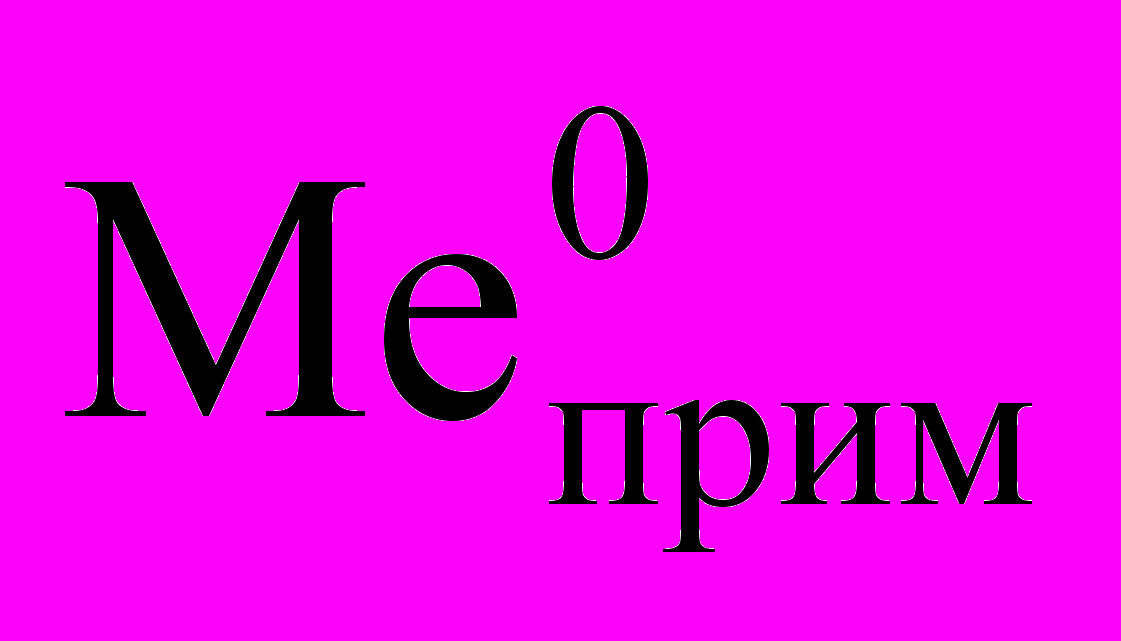 . (1.14)
. (1.14)Электродный потенциал разряда катионов на катоде
к = 0 +
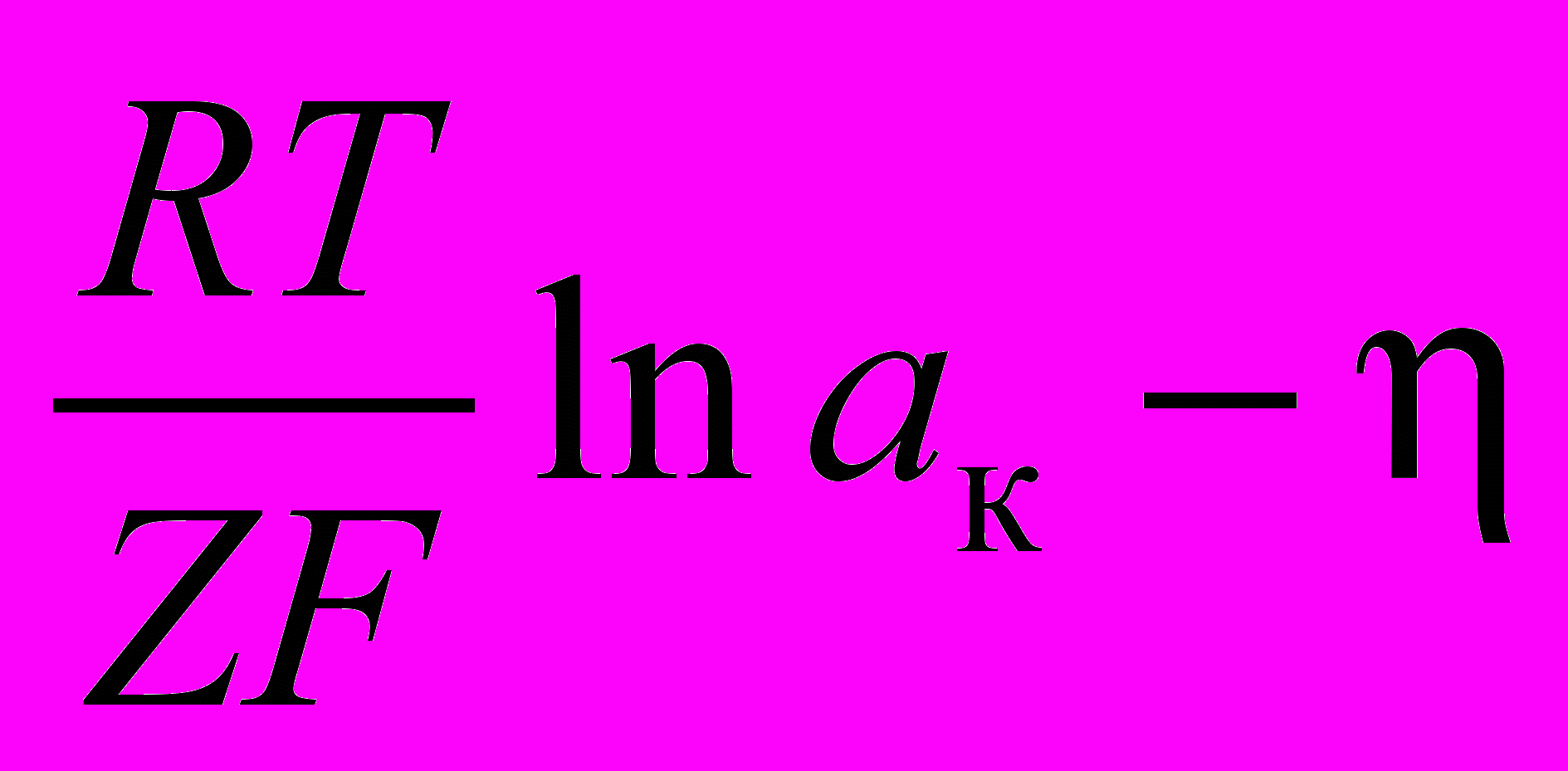 , (1.15)
, (1.15)где 0 – стандартный электродный потенциал катиона, В; aк – активность катиона в растворе, г-ион/л; – перенапряжение при разряде катиона на катоде, В.
Сравним сначала возможность протекания реакций (1.12) и (1.13). Стандартный электродный потенциал цинка –0,762 В, а водорода 0. Вклад второго члена в уравнении (1.15) относительно небольшой и примерно одинаков для обоих ионов. Что же касается перенапряжения при разряде ионов, то для Zn2+ 0,1 В, а для разряда Н3О+ 1 В. Как результат, электродный потенциал для реакции (1.12) становится более положительным, чем для реакции (1.13), следовательно, на катоде практически будет выделяться только цинк, а не водород.
Величина перенапряжения при разряде Н3О+ на катоде зависит от катодной плотности тока (повышается с ее увеличением); характера катодной поверхности (гладкая или шероховатая); наличия некоторых примесей в электролите и его температуры. Поскольку перенапряжение при разряде на катоде Н3О+ с увеличением температуры снижается, то на практике для поддержания температуры электролита в ванне в пределах 35-40 С его охлаждают. Что касается примесей, то на катоде по реакции (1.14) могут выделяться те из них, чей стандартный электродный потенциал более положителен, чем потенциал цинка. Чтобы избежать этого, растворы заранее тщательно очищают от этой группы примесей. Электроотрицательные примеси (К+, Na+, Mg2+ и др.) не разряжаются на катоде и остаются в растворе.
На аноде сначала протекают реакции
Pb0 +
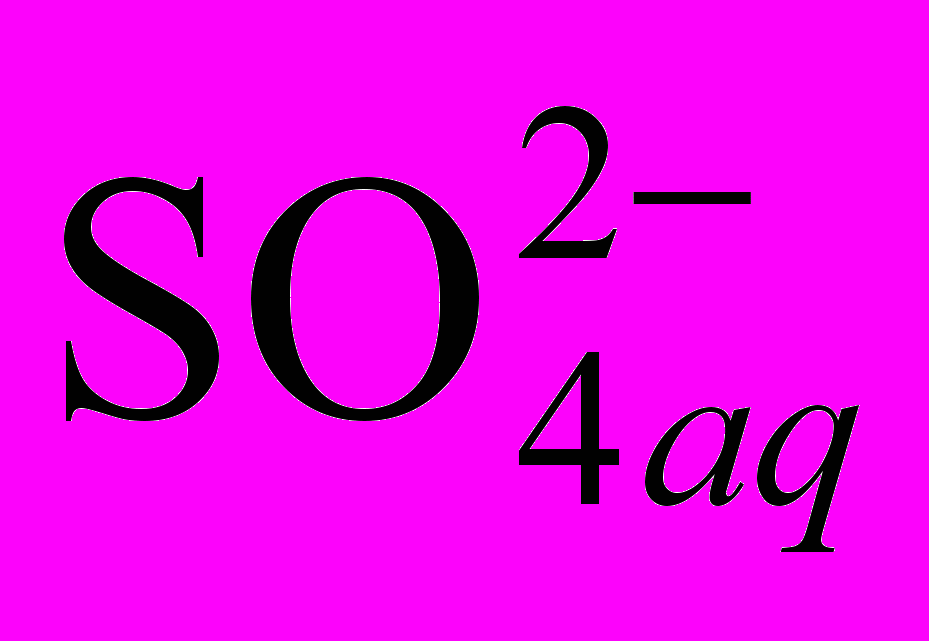 – 2e = PbSO4 (0 = –0,356 B);
– 2e = PbSO4 (0 = –0,356 B);Pb0 + 2H2O – 4e = PbO2 + 4H+ (0 = 0,655 B).
Когда вся поверхность анода покроется слоем PbO2, то потенциал электрода увеличится до потенциала реакции
6Н2О – 4e = О2 + 4Н3О+ (0 = 1,227 B). (1.16)
Из-за наличия перенапряжения при выделении кислорода по реакции (1.16) фактический потенциал анода достигает 1,6-1,8 В, поэтому на аноде может протекать и реакция
PbSO4 – 2e + 2H2O = PbO2 + H2SO4 + 2H+ (0 = 1,68 B).
Из других возможных реакций на аноде отметим реакции
Mnaq2+ – 2e + 6H2O = MnO2 + 4H3O+ (0 = 1,68 B);
2Cl-aq – 2e = Cl2 (0 = 1,35 B). (1.17)
Хлор, выделяющийся по реакции (1.17), может растворяться в электролите и оказывать корродирующее действие на электроды или выделяться в атмосферу цеха. Благодаря реакции
Cl2 + MnSO4 + 2H2O = MnO2 + 2HCl + H2SO4
ион Mn2+, находящийся в растворе, обеспечивает защиту от выделяющегося хлора.
В цехах электролиза раствора сульфата цинка рабочая поверхность алюминиевого катода 1,2-3,45 м2 (ширина 560-1100 мм). На боковых сторонах катода имеются резиновые накладки. Размеры анодов немного меньше, чем размеры катодов. Расстояние между центрами одноименных электродов зависит от их размера и составляет 60-90 мм. Размеры электролитной ванны зависят от размеров электродов и числа пар электродов в ванне (их может быть от 33 до 108). Температуру электролита в ванне (35-40 С) поддерживают с помощью алюминиевых змеевиков с циркулирующей в них водой, устанавливаемых в каждую ванну, или путем централизованного охлаждения электролита вне ванны. Для улучшения качества поверхности катодного цинка в электролит вводят коллоидные добавки, например столярный клей. Другой добавкой являются пенообразователи (в частности, экстракт мыльного корня), которые способствуют созданию на поверхности электролита устойчивого слоя пены. Это снижает возможность попадания в воздушное пространство цеха мелких капелек электролита.
Продолжительность наращивания катодного цинка (24-72 ч, иногда 96 ч) зависит от плотности катодного тока (300-700 А/м2) и чистоты раствора. Катоды с осажденным на них цинком вынимают из ванны, сдирают с них цинк вручную или механизированным способом, затем снова возвращают в ванну.
Энергетические показатели электролиза цинка следующие: напряжение на ванне 3-3,6 В, выход по току 88-93 %, расход электроэнергии 2800-3300 квтч/т цинка.
Для придания листам катодного цинка товарного вида их переплавляют, а металл разливают в слитки. В современной практике для переплавки катодного цинка обычно используют низкочастотные индукционные печи, которые могут переплавлять 100-600 т цинка в сутки. Плавку ведут при 500-520 С. Расход электроэнергии около 120 квтч/т цинка. Извлечение цинка в чушковый металл около 98 % (0,3-0,4 % составляют потери, остальной цинк уходит в дроссы и пыль).
1.9. ПЕРЕРАБОТКА ЦИНКОВЫХ КЕКОВ
Состав остатка от выщелачивания цинкового огарка (цинковый кек) следующий, %: Zn 16-23, Pb 2-10, Cu 0,3-2, Cd 0,1-0,4, Fe 18-32, S 4-10, SiO2 4-12, CaO 0,5-4, MgO 0,3-1,2. Существуют два метода переработки этого полупродукта: пирометаллургический и гидрометаллургический.
Наиболее распространенной разновидностью процесса переработки цинковых кеков пирометаллургическим методом является вельц-процесс. В этом случае шихту, состоящую из смеси кека и мелкого твердого углеродистого восстановителя (обычно коксик в количестве 35-50 % от массы кека), нагревают в трубчатой вращающейся печи до температуры 1100-1300 С. Печь состоит из стального корпуса цилиндрической формы (диаметр 2,5-4,5 м, длина 35-95 м), положенного горизонтально, футерованного внутри огнеупорным кирпичом и имеющего наклон по длине 2-4 %. Кожух печи опирается на ролики и медленно (около оборота в минуту) вращается вокруг горизонтальной оси от привода. В нижнем (разгрузочном) конце печи устанавливают мазутную форсунку или газовую горелку для подтопки печи. На противоположном (верхнем) конце печи загружают шихту и отсасывают из печи газы вместе с возгонами. За счет вращения печи шихта перемещается к разгрузочному концу печи навстречу потоку газов. В слое шихты атмосфера восстановительная, а в газовой фазе на поверхности шихты атмосфера окислительная. В верхнем конце печи из шихты удаляется влага и постепенно она нагревается. При температурах 900-1000 С и более оксид цинка и другие его соединения восстанавливаются с образованием парообразного цинка и СО. парообразный цинк над поверхностью шихты окисляется до ZnO, а СО сгорает с образованием СО2. То же самое происходит с соединениями свинца и кадмия. Образовавшиеся очень мелкие частицы оксидов цинка, свинца и кадмия уносятся газовым потоком из печи в виде возгонов. Газы уходят из печи с температурой 600-800 С. Их охлаждают, а возгоны улавливают. Тонкую очистку газов обычно проводят в рукавных фильтрах (иногда электрофильтрах). Извлечение в вельц-возгоны из кека характеризуют следующие данные, %: цинк 92-96; свинец 90-94; кадмий 94-96. Состав вельц-возгонов, %: Zn 55-70; Pb 5-15; Cd 0,6-1,1, поэтому они могут быть успешно переработаны гидрометаллургическим методом.
Вторым продуктом вельц-процесса, разгружаемым в нижнем конце печи, является клинкер. Он обычно содержит менее 1 % цинка, 15-22 % углерода, практически всю медь, благородные металлы, железо и пустую породу, содержавшиеся в исходной шихте.
Вельц-процесс используют также для переработки бедных по содержанию цинка оксидных руд и других материалов подобного типа.
Гидрометаллургический метод переработки цинковых кеков включает две основные стадии:
выщелачивание кека при повышенных температурах и повышенных концентрациях серной кислоты в растворе;
осаждение из раствора железа, поскольку на первой стадии при извлечении в раствор из кека до 99 % цинка в раствор переходит и основная масса железа.
Известны три разновидности технологии переработки цинковых кеков гидрометаллургическим методом, которые различаются, главным образом, по характеру соединений железа, которые осаждаются из раствора на второй стадии процесса: гематит ( Fe2O3), гетит ( FeOОН) и ярозит [R2Fe6(SO4)4(OH)12], где R обозначает Na+, K+ или NH4+.
В гематит-процессе и выщелачивание цинковых кеков, и осаждение железа из раствора проводят в автоклавах. В гетит- и ярозит-процессах выщелачивание цинковых кеков и очистку растворов от железа ведут при атмосферном давлении при температурах 90-98 С. Остаток от высокотемпературного выщелачивания цинковых кеков содержит практически весь свинец и благородные металлы, находившиеся в исходном материале. Его используют в производстве этих металлов.
Если на заводе все цинковые кеки текущего производства перерабатывают гидрометаллургическим методом, то технологическую схему называют схемой с полным растворением цинка. В этом случае суммарное извлечение цинка из огарка в раствор в цикле выщелачивания составляет 92-99 %
1.10. ПЕРЕРАБОТКА МЕДНО-КАДМИЕВЫХ КЕКОВ
Кадмий – металл серебристо-белого цвета. Он имеет плотность 8,63 г/см3, температуру плавления 321 С, температуру кипения 767 С. Кадмий в природе встречается, как правило, в виде сульфидного минерала – гренокита (CdS) – и чаще всего ассоциирован с минералами цинка и свинца в рудах этих металлов. Главным сырьем для производства кадмия являются медно-кадмиевые кеки, которые получают при очистке цинковых растворов от этих металлов методом цементации цинковым порошком. Основными составляющими медно-кадмиевых кеков являются три металла: кадмий (2-12 %), медь (2-18 %) и цинк (30-50 %). Для разделения этих металлов медно-кадмиевые кеки перерабатывают гидрометаллургическим методом, технологическая схема которого основана, главным образом, на различии стандартных электродных потенциалов данных металлов (см. раздел 1.7) и состоит из нескольких операций.
Сначала медно-кадмиевый кек выщелачивают отработанным электролитом цинкового производства (раствор, содержащий H2SO4). Цинк и кадмий переходят в раствор, а медь остается в остатке от выщелачивания. Из раствора кадмий осаждают цинковой пылью в виде кадмиевой губки, а полученный в этой операции раствор возвращают в цинковое производство. Кадмиевую губку растворяют в отработанном электролите кадмиевого производства или в растворе серной кислоты. Раствор сульфата кадмия очищают от примесей и направляют на выделение из него кадмия электролизом (подобно электролизу цинка, но при более низкой плотности тока) или цементацией цинком. Полученный в обоих случаях кадмий переплавляют, рафинируют и разливают в слитки. Кадмий, полученный цементацией, перед переплавкой брикетируют.
Часть 2. МЕТАЛЛУРГИЯ СВИНЦА
2.1. ОБЩИЕ СВЕДЕНИЯ
Свинец – один из древнейших металлов. Впервые его начали получать совместно с золотом и серебром в VII-V тысячелетии до н.э. на территории Египта. В III-II тысячелетии до н.э. финикийцы добывали свинцово-серебряные руды на территории Испании. Производство свинца осуществлялось также в древней Греции и в древнем Риме. Возрождение производства свинца в Европе началось на рубеже первого тысячелетия н.э.
Остатки горных выработок и шлаковые отвалы, найденные в разных регионах России, свидетельствуют о том, что свинец и на территории России получали из руд много столетий назад. Первые заводы по производству свинца появились в России в XVIII в. в Нерчинском крае и на Алтае.
Мировое производство металлического свинца в 1998 и 2002 г. оценивается соответственно в 6,0 и 6,47 млн т, увеличиваясь в среднем за этот период примерно на 2 % в год. Около половины из этого количества свинца получают из вторичных источников сырья. Главными производителями свинца являются США, КНР, Канада, Япония, Австралия, Германия, Великобритания, Мексика и др.
Напомним некоторые физические свойства свинца: атомная масса 207,2; плотность твердого свинца 11,34 г/см3; температура плавления 327,4 оС; температура кипения 1750 С.
Свинец – электроотрицательный металл (
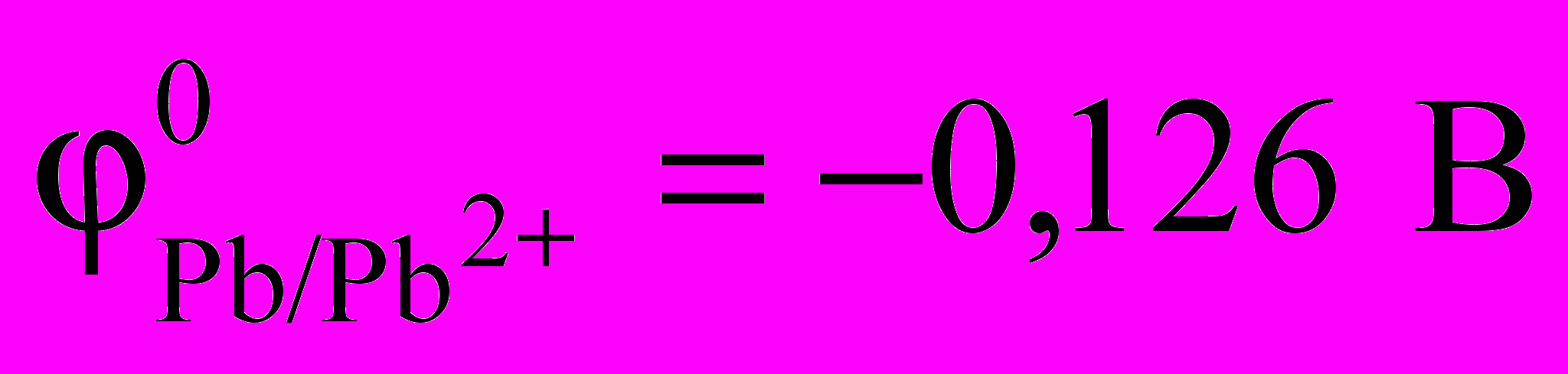 ), но при низких температурах в растворах серной и соляной кислот он не растворяется из-за образования на поверхности свинца PbSO4 или PbСl2, которые плохо растворимы в воде. Растворяется свинец в водных растворах кислот HNO3, H2SiF6, HBF4, CH3СOOH. При длительном пребывании на воздухе на поверхности свинца образуется пленка основного карбоната свинца 3PbCO3 Pb(OH)2, предохраняющая металл от дальнейшей коррозии. Свинец образует с кислородом несколько оксидов (Pb2O, PbO, Pb2O3, Pb3O4, PbO2), из которых при температурах более 600 С устойчивым является только глет (PbO), имеющий температуру плавления и кипения соответственно 883 и 1470 С. Глет легко восстанавливается СО до металла и является хорошим окислителем.
), но при низких температурах в растворах серной и соляной кислот он не растворяется из-за образования на поверхности свинца PbSO4 или PbСl2, которые плохо растворимы в воде. Растворяется свинец в водных растворах кислот HNO3, H2SiF6, HBF4, CH3СOOH. При длительном пребывании на воздухе на поверхности свинца образуется пленка основного карбоната свинца 3PbCO3 Pb(OH)2, предохраняющая металл от дальнейшей коррозии. Свинец образует с кислородом несколько оксидов (Pb2O, PbO, Pb2O3, Pb3O4, PbO2), из которых при температурах более 600 С устойчивым является только глет (PbO), имеющий температуру плавления и кипения соответственно 883 и 1470 С. Глет легко восстанавливается СО до металла и является хорошим окислителем.В больших количествах свинец используется в производстве аккумуляторов (в некоторых странах на эти цели расходуется 50-80 % от общего его потребления). Свинец используют для защиты кабельных изделий и химической аппаратуры от коррозии, в атомной энергетике – для защиты от гамма-излучения. Значительная часть свинца потребляется в виде различных сплавов. Оксиды свинца PbO и Pb3O4 используются в качестве пигментов, а также в производстве стекла, керамических изделий в резинотехнической промышленности и других производствах.
Главным промышленным минералом свинца в сульфидных рудах является галенит (PbS). Вместе с ним могут присутствовать в рудах более сложные сульфидные минералы, например, джемсонит (2PbS Sb2S3) и буланжерит (3PbS Sb2S3). Из окисленных свинцовых минералов отметим церуссит (PbCO3) и англезит (PbSO4). Имеется две разновидности свинцовых руд: сульфидные и окисленные (оксидные), первые из которых являются основным природным источником свинецсодержащего сырья. Обычно свинец в рудах ассоциирован с цинком. Имеются также свинцово-медные и полиметаллические руды. Сульфидные руды успешно обогащают флотацией с получением свинцовых, цинковых и других концентратов. Средний химический состав сульфидных свинцовых концентратов, %: Pb 40-75; Cu 0,1-9; Zn 2-14; Fe 2-15; S 14-24; SiO2 0,5-8; CaO 0,3-5; Al2O3 0,1-1,5. В концентратах обычно содержится также золото, серебро, мышьяк, сурьма и другие металлы.
2.2. МЕТОДЫ ПЕРЕРАБОТКИ СВИНЕЦСОДЕРЖАЩЕГО СЫРЬЯ
Главным природным сырьем для производства свинца являются сульфидные свинцовые концентраты, которые перерабатывают пирометаллургическим методом. В промышленном производстве свинца в настоящее время используют три разновидности этого метода:
выплавка свинца реакционным способом;
двухступенчатый способ;
автогенные процессы.
Выплавка свинца реакционным способом является старейшим методом переработки богатых по содержанию основного металла свинцовых руд и высокосортных флотационных свинцовых концентратов. В настоящее время этот метод используется в небольшом масштабе для переработки высокосортных концентратов методом горновой плавки и плавки в короткобарабанных печах. Концентрат сначала обжигают для частичного перевода сульфида свинца в оксид и сульфат свинца по реакциям
2PbS + 3O2 = 2PbO + 2SO2 + 828,7 кДж; (2.1)
PbS + 2O2 = PbSO4 + 820,8 кДж. (2.2)
Оставшийся неокисленным сульфид свинца затем взаимодействует с оксидом или сульфатом свинца с образованием свободного металла:
PbS + 2PbO 3Pb + SO2 – 238,9 кДж; (2.3)
PbS + PbSO4 2Pb + 2SO2 – 427,6кДж. (2.4)
Оксид свинца восстанавливается также за счет углерода, вводимого в шихту.
Основным способом переработки свинецсодержащего сырья является двухступенчатая технология (рис.2.1), согласно которой сульфидный свинцовый концентрат сначала подвергают окислительному обжигу для перевода PbS в форму PbO по реакции (2.1) и получения спеченного продукта обжига (агломерата). Затем шихту, состоящую из смеси агломерата и кокса, плавят в шахтной печи, где оксид свинца восстанавливается до металла по реакциям
PbO + C = Pb + CO – 107,7 кДж; (2.5)
PbO + CO = Pb + CO2 + 65,9 кДж. (2.6)
Основной продукт этого процесса – черновой свинец, который затем направляется на рафинирование.
Эта технология может быть использована для переработки любых свинецсодержащих материалов, в том числе вторичного свинецсодержащего сырья.