«Ижевская государственная медицинская академия»
| Вид материала | Автореферат |
- «Ижевская государственная медицинская академия», 964.06kb.
- «Ижевская Государственная медицинская академия», 307.6kb.
- Детерминирующих давность механической травмы, 420.46kb.
- Ижевская Государственная Медицинская Академия. Кафедра общей и клинической фармакологии, 240.32kb.
- Оптимизация системного подхода в реабилитации больных сахарным диабетом с высокой коморбидностью, 922.15kb.
- Клинико-функциональные и метаболические характеристики ишемической болезни сердца, 748.58kb.
- «профилактика донозологической формы йоддефицитного состояния у детей предпубертатного, 303.28kb.
- «Пермская государственная медицинская академия им академика Е. А. Вагнера Росздрава», 313.5kb.
- Тревожные расстройства у больных сахарным диабетом 2 типа 14. 01. 06 психиатрия (медицинские, 336.08kb.
- «Тверская государственная медицинская академия», 300.23kb.
Результаты исследования и обсуждение
У всех больных была проведена исходная (до лечения) оценка тяжести дерматоза в баллах индекса ИТПБ. Для основной группы исходные значения суммарного ИТПБ составляли 76 (62; 88), группы сравнения – 76 (57,3; 84) баллов. Повторная оценка ИТПБ, проведенная к окончанию стационарного лечения, доказала преимущество комплексного лечения с включением g-D-глутамил-D-триптофана натрия перед комплексным лечением с включением метотрексата (р<0,001). Суммарный ИТПБ в группе больных, получавших g-D-глутамил-D-триптофан натрия, составил 15 (8; 28), что на 71,2% меньше исходного, в то время как у пациентов, получавших метотрексат индекс снизился на 52% (до 32 (21; 43)) от исходного (рис. 1). Индекс ИТПБ у больных со средней степенью тяжести дерматоза, получавших g-D-глутамил-D-триптофан натрия, достоверно более значимо снижался, чем у больных, получавших метотрексат (р<0,001), при тяжелой степени достоверных отличий не было выявлено (р>0,05).
 | 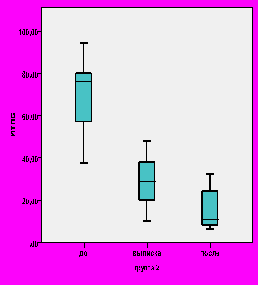 |  |
Рис. 1. Динамика суммарного ИТПБ у больных сравниваемых групп.
Однако следует учитывать, что к моменту выписки пациентов из стационара курс метотрексата являлся не завершенным. К окончанию курса лечения в амбулаторных условиях суммарный индекс ИТПБ в группе сравнения составил 12 (8; 24), что на 72,3% меньше исходного (рис. 1), и не имел достоверных различий с величиной ИТПБ после лечения у больных основной группы (р>0,05). Таким образом, включение g-D-глутамил-D-триптофана натрия в состав комплексного лечения больных ладонно-подошвенным пустулезным псориазом позволило добиться более быстрого регресса симптомов заболевания. Появление новых пустул на коже у больных основной группы купировалось уже на 5 (4; 6) день, в то время как у пациентов группы сравнения только на 7 (6; 8) день терапии (р<0,01). У больных со средней степенью тяжести заболевания в сравниваемых группах регресс высыпаний происходил быстрее, чем у пациентов с тяжелой степенью пустулезного псориаза. Так, в основной группе у больных со средней степенью тяжести свежие пустулезные элементы прекращали появляться на 5 (4; 6) день, в группе сравнения – на 7 (6; 7) день (р<0,001). У больных с тяжелой степенью дерматоза этот показатель составлял 9 (8,5; 10) и 10 (8; 11) соответственно (р>0,05). Сроки регресса пустул у пациентов со средней степенью тяжести псориаза были достоверно меньше, чем у больных с тяжелой степенью заболевания и в основной группе (р<0,001), и в группе сравнения (р<0,01).
К концу лечения в стационаре у 13 из 31 (41,9 на 100 человек) больного основной группы было достигнуто клиническое выздоровление, у 12 (38,7 на 100 человек) пациентов – значительное улучшение, у 5 (16,1 на 100 человек) – улучшение, у одного больного улучшение было незначительным. В группе сравнения клиническое выздоровление за этот же период удалось достичь у 5 (26,3 на 100 человек) пациентов, значительное улучшение - у 8 (42,1 на 100 человек), улучшение - у 6 (26,3 на 100 человек) больных, у одного пациента клинически значимого улучшения добиться не удалось. К окончанию курса метотрексата (через 6-8 недель от начала лечения) клиническое выздоровление в группе сравнения было достигнуто у 8 (42,1 на 100 человек) больных, значительное улучшение - у 7 (36,8 на 100 человек), улучшение - у 4 (15,8 на 100 человек), у одного пациента терапия эффекта не дала, таким образом, результаты лечения стали сопоставимы. Средняя длительность пребывания больных основной группы на койке (рис. 2) составляла 24,3 дня, группы сравнения – 25,9 дней (р<0,01).
 |  |
Рис. 2. Средняя длительность пребывания на койке больных сравниваемых групп.
У пациентов с отсутствием системной супрессии в анамнезе отмечался более быстрый ответ на лечение g-D-глутамил-D-триптофаном натрия (r=0,534, р<0,01). Ближайшие результаты лечения также были более благоприятными у больных, ранее не получавших иммуносупрессивных препаратов, в обеих сравниваемых группах (р<0,001) (табл. 3), что согласуется с данными Курдиной М.И. (2005) и Зубаревой Е.Ю. (2007).
Табл. 3.
Ближайшие результаты лечения больных псориазом Барбера в зависимости от наличия супрессивной терапии в анамнезе (к окончанию курсов лечения).
| Результат лечения | Группа наблюдения (n=31) | Группа сравнения (n=20) | ||
| без супрессии | с супрессией | без супрессии | с супрессией | |
| Клин.выздор | 9 | 4 | 5 | 3 |
| Знач.улучш | 2 | 10 | 1 | 6 |
| Улучшение | 0 | 5 | 1 | 3 |
| Незнач.улучш | 0 | 1 | 0 | 0 |
| Без эффекта | 0 | 0 | 0 | 1 |
Продолжительность клинической ремиссии оценивалась у больных, выписанных с клиническим выздоровлением. Анализ отдаленных результатов лечения выявил, что у 4 пациентов из 13, получавших g-D-глутамил-D-триптофан натрия, обострения пустулезного псориаза ладоней и подошв в течение года после лечения не отмечалось, у 3 из них дерматоз был выявлен впервые. Средняя продолжительность клинической ремиссии у 9 пациентов возросла с 5,1 месяцев до лечения до 8,2 месяцев после проведенной терапии (р<0,05). У больных второй группы, получавших метотрексат, в течение года после проведенного лечения обострения не развилось у 1 больного из 8, впервые болевшего псориазом. Клиническая ремиссия у 7 пациентов продолжалась в среднем 5,6 месяцев (5,2 месяцев до лечения), что было достоверно (р<0,05) меньше, чем у больных основной группы.
Проведенное нами исследование показало, что заболевание оказывает значительное влияние на качество жизни больных. Детальный анализ PDI выявил, что наибольшее влияние заболевание оказывало на повседневную и профессиональную деятельность пациентов, мероприятия, связанные с лечением дерматоза, меньше беспокоили больных. Влияние псориаза на межличностные отношения и отдых больных было наименьшим (табл. 4).
Табл. 4.
Динамика качества жизни (PDI) у больных псориазом Барбера на фоне лечения (медиана, квартили, в баллах).
| Груп-па | n | Повседнев. деятел-ть (max 15) | Работа/ Учеба (max 9) | Межличн. отнош-я (max 6) | Отдых (max 12) | Лече-ние (max3) | PDI Сумма (max 45) |
| I до леч | 31 | 6 (5; 7) | 3 (2; 5) | 2 (0; 2) | 3 (2; 4) | 1 (0; 1) | 14(10; 21) |
| I п-е леч | 31 | 2 (2; 4) | 2 (1; 2) | 1 (0; 2) | 1(0;2) | 0(0;1) | 6 (4; 10) |
| II до леч | 20 | 6 (5; 8) | 4 (3; 5) | 2 (0,3; 3) | 2,5 (2; 3) | 1 (1; 2) | 14,5 (12; 20) |
| II п-е леч | 20 | 3 (3; 4,8) | 2 (2; 3) | 1 (0,3; 2)º | 1 (1; 2) | 0,5 (0; 1) | 8 (7; 12,5) |
º - р<0,01; - р<0,001 (знаки º, – достоверные отличия до и через месяц после лечения)
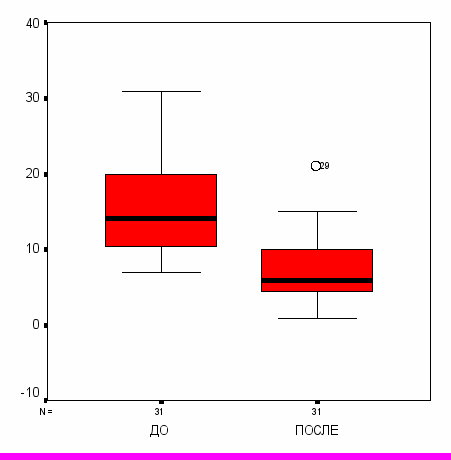
Через месяц после проведенного курса лечения качество жизни улучшилось в обеих сравниваемых группах с учетом всех видов деятельности. В основной группе наблюдения (I) регистрировалось достоверно более выраженное улучшение данного параметра (р<0,05). У больных, получавших g-D-глутамил-D-триптофан натрия, суммарный PDI снизился в 2,2 раза, у получавших метотрексат (II) – в 1,7 раз (рис. 3).
 группа наблюдения (I) группа наблюдения (I) | 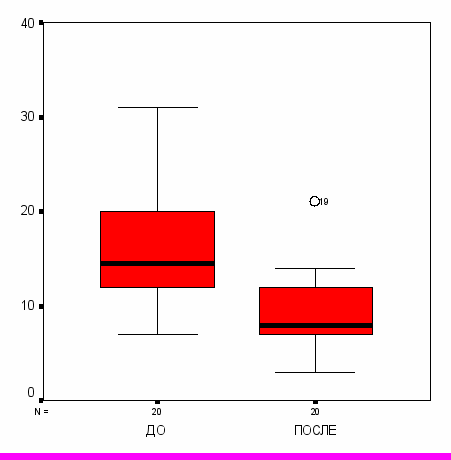 группа сравнения (II) |  |
Рис. 3. Динамика суммарного PDI в сравниваемых группах больных.
У больных ладонно-подошвенным пустулезным псориазом были выявлены изменения показателей клеточного звена иммунной системы (табл. 5): достоверное увеличение абсолютного количества зрелых лимфоцитов (CD3+), относительного и абсолютного содержания Т-хелперов (CD3+CD4+), абсолютного количества естественных (CD3-CD16/CD56+) и Т-киллеров (CD3+CD16/CD56+), иммунорегуляторного индекса, снижение уровня Т-цитотоксических клеток (CD3+CD8+), В – клеток (CD3-CD19+) клеток (р<0,05).
В обеих группах больных отмечалось повышение концентрации IgA (р<0,01) и циркулирующих иммунных комплексов (р<0,001), что свидетельствует о наличии хронического воспалительного процесса в организме больных псориазом Барбера (табл. 6). У обследованных пациентов титр комплемента не имел достоверных различий с контрольной группой (табл. 7), фагоцитарная активность нейтрофилов у больных псориазом Барбера была снижена почти в полтора раза (р<0,001). Все выявленные отклонения были достоверно выше (р<0,05) у больных с тяжелой степенью дерматоза.
К окончанию курса лечения у большинства больных отмечалась положительная динамика иммунологических показателей. Регистрировалось достоверное снижение (р<0,001) абсолютного количества зрелых Т- лимфоцитов (CD3+), относительного и абсолютного содержания CD3+CD4+ лимфоцитов (р<0,001), отмечалась тенденция к увеличению относительного количества CD3+CD8+клеток (табл. 5). Достоверно уменьшилась величина ИРИ (р<0,01). Абсолютное количество CD3+CD16+CD56+ достоверно (р<0,01) снизилось у пациентов I группы и имело тенденцию к снижению (р>0,05) у больных, получавших метотрексат. Достоверно уменьшилось относительное и абсолютное содержание CD3+CD4+CD8+- лимфоцитов в обеих сравниваемых группах (р<0,01).
У пациентов обеих сравниваемых групп относительное содержание В–клеток (CD3-CD19+) после лечения достоверно увеличилось (р<0,05), снизилась концентрация в сыворотке крови IgA и циркулирующих иммунных комплексов (р<0,001) (табл. 6).
Абсолютное количество естественных киллеров (CD3-CD16+CD56+) достоверно уменьшилось (р<0,01), фагоцитарная активность нейтрофилов достоверно увеличилась (р<0,001) и достигла контрольных значений у больных со средней степенью тяжести дерматоза (р<0,001), получавших g-D-глутамил-D-триптофан натрия. В группе сравнения абсолютное количество естественных киллеров (CD3-CD16+CD56+) имело лишь тенденцию к снижению, фагоцитарная активность нейтрофилов существенно не изменилась (р>0,05) (табл. 7).
Табл. 5.
Динамика показателей состояния клеточного иммунитета у больных псориазом Барбера на фоне лечения (медиана, квартили).
| Группа | n | CD3+ % | CD3+, кл/мкл | CD3+ CD4+, % | CD3+ CD4+, кл/мкл | CD3+ CD8+, % | CD3+ CD8+, кл/мкл | ИРИ | CD3+ CD16+, % | CD3+ CD16+, кл/мкл | CD3+ CD4+ CD8+, % | CD3+ CD4+ CD8+, кл/мкл |
| Контроль | 20 | 72,2 (68,4; 75,5) | 1604,5 (1398; 1860,5) | 44,3 (42,6; 47,4) | 995,5 (893; 1100,3) | 25,4 (20,6; 27,3) | 516,5 (454,5; 630,5) | 1,9 (1,6; 2,2) | 3,3 (2,8; 4,6) | 75 (51,5; 102,3) | 0,5 (0,3; 0,8) | 12 (7; 14,8) |
| I до лечения | 31 | 73,5 (71,5; 76,7) | 2068 (1913; 2250) | º48,6 (43,6; 53,2) | 1313 (1179; 1525) | *20,7 (17,8; 25,3) | 573 (506; 701) | º2,2 (1,8; 2,7) | 4,2 (3,1; 5,1) | º107 (75; 145) | 0,8 (0,7; 1,5) | 25 (19; 38) |
| I после лечения | 31 | 72,3 (69,5; 75,4) | 1649 (1533; 1829) | 43,3 (41,8; 46,5) | 975 (870; 1101) | 22,3 (20,6; 24,2) | 488 (432; 572) | 2 (1,8; 2,1) | 4,2 (3,2; 5,3) | 91 (76; 108) º | º0,8 (0,5; 1) | 14 (9; 16) |
| II до лечения | 20 | 74,4 (69,1; 76) | 2175 (1844,5; 2337,5) | *48,2 (44,6; 50,8) | 1326 (1168,8; 1437,3) | *20,2 (17; 25,3) | 593 (530; 703,3) | *2,3 (1,9; 3) | 4 (2,7; 4,6) | *105,5 (72,8; 143,3) | 1 (0,7; 1,5) | 31 (19; 41) |
| II после лечения | 20 | 73,2 (69,8; 74,3) | 1824 (1527,3; 1961) | 43,6 (41,1; 46,1) | 1023 (936,3; 1126,8) | 21,6 (19,9; 23,7) | 537,5 (471,8; 573,8) º | 2 (1,8; 2,4) º | 4,2 (2,9; 5,2) | 101 (66; 117) | º 0,9 (0,6; 1,1) | º 17 (9,5; 20,8) |
* - р<0,05; º - р<0,01; - р<0,001 (знаки *, º, перед числом – достоверные различия с контролем, после числа – достоверные отличия до и после лечения)
Табл. 6.
Динамика показателей состояния гуморального иммунитета у больных псориазом Барбера на фоне лечения (медиана, квартили).
| Группа | n | CD3-CD19+,% | CD3-CD19+,кл/мкл | IgA, г/л | IgM, г/л | IgG, г/л | ЦИК, ед |
| Контроль | 20 | 12,4 (10,7; 16) | 302,5 (231,3; 356,3) | 2,8 (2,3; 3,1) | 1 (0,7; 1,4) | 12,3 (11,4; 13,8) | 0,5 (0,2; 0,8) |
| I до леч | 31 | *9,8 (8,5; 11,6) | 243 (209; 334) | º3,5 (2,7; 4,5) | 1,3 (0,8; 1,56) | 11,6 (10,9; 13,7) | 1,8 (1,1; 2,5) |
| I п-е леч | 31 | *10,8(9,8;13,2)* | 263 (227; 304) | 2,7(2,2;3,3) | 1,1 (0,8; 1,5) | 12 (10,8; 13,1) | 0,8 (0,4; 1,2) |
| II до леч | 20 | *9,9 (8,5; 12,5) | 274 (236; 328,5) | 3,6(3,1; 4,3) | 1,1 (0,9; 1,4) | 12,2 (10; 13,9) | 1,7 (0,6; 3) |
| II п-е леч | 20 | 11,4 (9,3; 12,3) º | 264,5 (216,5; 304,8) | 2,7(2,4;3,2) | 1 (0,8; 1,3) | 11,7 (9,9; 13,4) | 0,8 (0,4; 1,6) |
* - р<0,05; º - р<0,01; - р<0,001 (знаки *, º, перед числом – достоверные различия с контролем, после числа – достоверные отличия до и после лечения)
Табл. 7.
Динамика показателей состояния врожденного иммунитета у больных псориазом Барбера на фоне лечения (медиана, квартили).
| Группа | N | CD3-CD16+CD56+, % | CD3-CD16+CD56+, кл/мкл | Титр комплемента, ед | ФАН, % |
| Контроль | 20 | 15,3 (10,4; 17,1) | 368 (230,8; 409,3) | 38,3 (37; 40) | 54,5 (49,5; 58) |
| I до леч | 31 | 16,9 (12; 18) | *468 (357; 576) | 38 (37; 40) | 42 (37; 46) |
| I п-е леч | 31 | 15 (13,3; 16,9) | 340 (275; 408) º | 38 (37; 39) | *51 (46; 56) |
| II до леч | 20 | 15,8 (12,9; 17,8) | *504 (338,8; 570,5) | 38,3 (37; 40) | 39 (31,3; 47) |
| II п-е леч | 20 | 16 (13,2; 18,6) | 377,5 (327; 444,8) | 38 (36,8; 39) | 41,5 (33; 49,8) |
* - р<0,05; º - р<0,01; - р<0,001 (знаки *, º, перед числом – достоверные различия с контролем, после числа – достоверные отличия до и после лечения)
У больных с тяжелой степенью псориаза Барбера в обеих сравниваемых группах изменения в иммунограмме после проведенного лечения были менее выражены, многие показатели (абсолютное количество CD3+ - клеток и CD3+CD4+- лимфоцитов, иммунорегуляторный индекс, относительное и абсолютное содержание CD3+CD8+ - лимфоцитов, содержание циркулирующих иммунных комплексов, фагоцитарная активность нейтрофилов) не достигли уровня значений лиц контрольной группы, что говорит о более низкой эффективности обоих иммуносупрессивных препаратов в лечении пациентов этой подгруппы.
По данным биохимических анализов признаки поражения печени присутствовали у 20 (39,2%) больных. Исходя из классификации синдромов поражения печени А.Ф. Блюгера (1975), синдром цитолиза, характеризующийся повышением уровня трансаминаз, был зарегистрирован у 12 (23,5%) пациентов, синдром холестаза (увеличение уровней щелочной фосфатазы, прямого билирубина, γ-глутамилтранспептидазы) – у 5 (9,8%), мезенхимально-воспалительный синдром, оцениваемый по данным тимоловой пробы, - у 7 (13,7%) больных. Средние значения тимоловой пробы в сравниваемых группах были почти в полтора раза выше контрольных значений (табл. 8), уровни трансаминаз, щелочной фосфатазы, прямого билирубина и γ- глутамилтранспептидазы в общих группах сравнения и подгруппах больных со средней степенью тяжести псориаза до лечения достоверно не отличались от контрольных. У пациентов с тяжелой степенью дерматоза до лечения почти все показатели, характеризующие функциональное состояние печени, были достоверно повышены по сравнению с контролем и аналогичными значениями у больных со средней степенью тяжести (р<0,05). Уровень альбумина был сопоставим с контрольными значениями в обеих сравниваемых группах (табл. 8).
После проведенного курса лечения показатели тимоловой пробы и уровень АСТ достоверно снизились в группе наблюдения и подгруппе больных со средней степенью тяжести псориаза Барбера, получавших g-D-глутамил-D-триптофан натрия (р<0,001). У пациентов с тяжелой степенью дерматоза из этой группы снижение всех показателей произошло в меньшей степени (р>0,05). В то же время, у обследованных в группе сравнения после проведенного курса лечения значения тимоловой пробы практически не изменились (р>0,05), а содержание трансаминаз и γ- глутамилтранспептидазы в сыворотке крови достоверно увеличилось (р<0,05).
У больных ладонно-подошвенным пустулезным псориазом в обеих сравниваемых группах до лечения лейкоцитоз в периферической крови был зарегистрирован у 38 (74,5%). Выявленный лейкоцитоз может являться отражением высокой интенсивности воспаления при обострении псориаза. Оценка формулы крови показала достоверное изменение (р<0,05) соотношения субпопуляций лейкоцитов в сторону уменьшения доли сегментоядерных нейтрофилов и увеличения лимфоцитов в обеих сравниваемых группах по сравнению с контролем. При этом лимфоцитоз, превышающий допустимые границы, был зарегистрирован у 20 (39,2%), нейтропения – у 13 (25,5%) пациентов. До лечения средние значения количества тромбоцитов у больных псориазом Барбера достоверно не превышали контрольные (р>0,05). Ни у одного пациента уровень тромбоцитов не выходил за границы нормы.
