«Пермская государственная медицинская академия им академика Е. А. Вагнера Росздрава»
| Вид материала | Автореферат |
- «Пермская государственная медицинская академия имени академика Е. А. Вагнера Росздрава», 867.24kb.
- Клинико-социальное исследование больных семейной шизофренией 14. 00. 18 «Психиатрия», 529.24kb.
- «Пермская государственная медицинская академия имени академии Е. А. Вагнера Федерального, 315.55kb.
- Особенности клинического течения и диагностики урогенитальных инфекций, обусловленнных, 284.85kb.
- На правах рукописи, 327.81kb.
- Идиопатической тромбоцитопенической, 250.8kb.
- На правах рукописи, 721.93kb.
- «Пермская государственная медицинская академия имени академика Е. А. Вагнера Федерального, 630.25kb.
- Клинико-лабораторная характеристика вич-инфекции у беременных и рожденных ими детей, 295.89kb.
- «Пермская государственная медицинская академия имени академика Е. А. Вагнера», 661.68kb.
На правах рукописи
ПАРАНДЕЙ
ОКСАНА РОСТИСЛАВОВНА
ВАРИАБЕЛЬНОСТЬ ОБЪЕМНОЙ СКОРОСТИ ВЫБРОСА КРОВИ
И ЕЕ ОСОБЕННОСТИ У БОЛЬНЫХ ИНФАРКТОМ МИОКАРДА
14.00.06 – кардиология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Пермь
2008
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Пермская государственная медицинская академия
им. академика Е.А. Вагнера Росздрава»
Научный руководитель
доктор медицинских наук профессор Зубарев Михаил Анатольевич
Официальные оппоненты:
доктор медицинских наук профессор Василец Любовь Михайловна (ГОУ ВПО
« ПГМА им. ак. Е.А.Вагнера Росздрава» )
доктор медицинских наук Щербенев Владимир Михайлович (ПККБ № 2 « Институт Сердца», филиал НЦССХ им. А.Н. Бакулева РАМН)
Ведущая организация
ГОУ ВПО «Ижевская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию»
Защита диссертации состоится «___» __________ 2008 г. в ______ час. на заседании диссертационного совета Д 208.067.02 при Государственном образовательном учреждении высшего профессионального образования «Пермская государственная медицинская академия имени академика Е.А. Вагнера Федерального агентства по здравоохранению и социальному развитию» по адресу : 614990, г. Пермь, ул. Куйбышева, 39.
С диссертацией можно ознакомиться в библиотеке Государственного образовательного учреждения высшего профессионального образования «Пермская государственная медицинская академия имени академика Е.А. Вагнера Федерального агентства по здравоохранению и социальному развитию» по адресу: 614000, г. Пермь, ул. Коммунистическая, 26.
Автореферат разослан « ___ »_______2008 г.
Ученый секретарь диссертационного совета
доктор медицинских наук, профессор В.В. Щекотов
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Вариабельность сердечного ритма (ВСР) и артериального давления (АД) интенсивно изучается на протяжении последних 30 лет во всем мире. На сегодняшний день доказано, что пониженная ВСР в острую фазу инфаркта миокарда (ИМ) является достоверным независимым предиктором развития аритмических осложнений, в том числе внезапной смерти (Вариабельность сердечного ритма. Стандарты измерения, физиологической интерпретации и клинического использования. Методические рекомендации Рабочей группы Европейского Кардиологического Общества и Северо-Американского общества стимуляции и электрофизиологии, 1996 г.). Повышенная вариабельность артериального давления (АД) у больных гипертонической болезнью (ГБ) прямо коррелирует с ранними повреждениями органов – мишеней ( Ж.Д. Кабалава, 2002).
В последние годы появились работы, посвященные изучению вариабельности ударного объема (УО) сердца ( B. Shramek, V.Valenta, 1998, К.Toska, 1993; J. Zibert, 1999; А.А. Антипова, В.В.Щекотов, М.А. Зубарев, 2004). Понятие «ударный объем сердца» эквивалентно понятию «выброс крови за одно сердечное сокращение» (А. Katz, 1977; O.Kedem, 1999; P.L.Marino, 1991). Являясь одним из важнейших параметров гемодинамики, УО не является неизменным в покое при измерении его от сокращения к сокращению сердца (beat-to-beat) (B.Shramek, V.Valenta, 1998; К.Toska, 1993). Из всех инструментальных методов мониторирования гемодинамики от сокращения к сокращению в течение определенного времени наиболее приемлемым является импедансометрический метод (R.J. Gastfriend, J.Van de Water ,1986; M.L.Appel, R.D. Berger,1989; C. Gancy , 2003). Изучение вариабельности выброса крови (ударного объема сердца) от сокращения к сокращению в покое у больных ГБ импедансометрическим методом, а именно с помощью тетраполярной грудной реографии, показало, что вариабельность УО зависит от стадии заболевания и этот показатель может быть использован с целью оценки диастолической функции сердца и степени ремоделирования (А.А. Антипова, В.В.Щекотов, М.А. Зубарев, 2004). Было доказано, что вариабельность ударного объема изменяется под влиянием терапии ГБ и определение вариабельности УО в динамике может быть использовано для оценки эффективности проводимого лечения.
Однако использованная в то время методика имеет недостаток, так как импедансометрическая формула определения УО включает в себя показатель времени изгнания крови (Ти), точность вычисления которого затруднительна (Ю.Т.Пушкарь, 1977; М.А.Зубарев, 1993; В.М. Хаютин c соавт., 2007).
Вариабельность выброса крови от сокращения к сокращению в покое при ИБС, и, в частности, при инфаркте миокарда, на сегодняшний день практически не изучена. Учитывая социальную и экономическую значимость ИМ, необходимость ранней оценки риска развития его осложнений, представляется актуальным изучение проблемы вариабельности выброса крови от сокращения к сокращению в покое у больных ИМ. Это предопределило цели и задачи нашего исследования.
Цель исследования
Разработать простой метод определения вариабельности выброса крови от сокращения к сокращению в покое и изучить ее особенности у здоровых лиц и у больных инфарктом миокарда.
Задачи исследования
1. Разработать метод оценки вариабельности выброса крови в покое «от сокращения к сокращению» ( beat-to-beat).
2. Оценить вариабельность выброса крови в покое у лиц без заболеваний сердечно-
cосудистой системы.
3. Оценить вариабельность выброса крови в покое у больных ИМ, в том числе в зависи-
мости от его локализации, наличия или отсутствия зубца Q и наличия осложнений.
- Определить вариабельность выброса крови в покое у больных ИМ в динамике
течения заболевания.
Научная новизна исследования
- Впервые разработан импедансометрический метод оценки вариабельности выброса
крови от сокращения к сокращению в покое по вариабельности объемной скорости
выброса крови (ОСВ).
- С помощью разработанного метода изучены особенности вариабельности ОСВ у здоровых лиц и больных ИМ.
- Изучены особенности вариабельности ОСВ у больных ИМ в зависимости от его локализации, наличия или отсутствия зубца Q, наличия осложнений.
- Изучены особенности вариабельности ОСВ у больных ИМ в динамике течения заболевания.
Практическая значимость исследования
Разработан импедансометрический метод оценки вариабельности объемной скорости выброса крови в покое от сокращения к сокращению. Метод может применяться для оценки динамики течения заболевания в подостром периоде ИМ и для оценки прогноза развития повторных эпизодов острого коронарного синдрома (ОКС) в течение последующего года после перенесенного первого ИМ.
Основные положения, выносимые на защиту
- Разработан и апробирован импедансометрический метод определения вариабельности объемной скорости сердечного выброса на основании изменчивости амплитуды первой производной грудной тетраполярной реограммы.
- С помощью данного метода установлено наличие вариабельности объемной скорости выброса крови в покое у здоровых лиц и больных инфарктом миокарда, при этом у больных в остром и подостром периодах инфаркта миокарда имеет место достоверно более низкая вариабельность этого показателя.
- Вариабельность объемной скорости выброса крови у больных инфарктом миокарда зависят от обширности некроза, проведения тромболитической терапии в первые сутки ИМ, от наличия осложнений в остром и подостром периодах заболевания.
- Оценка вариабельности объемной скорости выброса в динамике перед выпиской из
стационара позволяет судить о возможности развития повторных острых
коронарных событий в течение последующего года после перенесенного инфаркта
миокарда.
Внедрение в практику
Результаты работы внедрены в клиническую практику отделения для лечения больных инфарктом миокарда городской клинической больницы № 4 г. Перми и процесс преподавания на кафедре пропедевтики внутренних болезней ГОУ ВПО «ПГМА им. ак. Е.А. Вагнера Росздрава».
Степень личного участия
Вклад автора заключается в непосредственном участии в разработке методики определения вариабельности объемной скорости выброса крови импедансометрическим способом, в планировании, организации и проведении исследования, клиническом обследовании больных, проведения анализа кардиоритмограмм и анализа вариабельности объемной скорости выброса крови, статистической обработке результатов, анализе полученных данных, подготовке публикаций по теме диссертации.
Апробация
Апробация диссертации проведена на заседании научного координационного совета по кардиологии и терапии и кафедр: госпитальной терапии №1, терапии и семейной медицины ФПК и ППС, поликлинической терапии ГОУ ВПО «ПГМА им.ак. Е.А. Вагнера Росздрава» 4 июня 2008 г. Основные положения работы были изложены в материалах и обсуждены на I Всероссийском конгрессе физиологов ( Сочи, 2005 г.), заседании юбилей-ной сессии ГОУ ВПО «ПГМА им.ак. Е.А. Вагнера Росздрава» (Пермь, 2006), XIII Меж-дународной конференции по Электрическому Импедансу (Грац, Австрия, 2007), Первой Российской конференции по импедансометрии ( Пермь, 2008). Получено решение о выдаче патента от 19.05.2008 по заявке № 200 712 1030/14 от 04.06.2007 «Способ определения вариабельности сердечного выброса»
Публикации
По теме диссертации опубликовано 10 печатных работ, в том числе в журналах цитируемых ВАК - 1 статья, а также тезисы доклада - в зарубежной печати.
Объем и структура работы
Диссертация представляет собой рукопись на русском языке объемом 125 печатных страниц и состоит из введения, 5 глав, заключения, выводов, практических рекомендация и списка литературы, который содержит 182 наименования работ, в том числе 63 отечественных и 119 иностранных авторов. Работа иллюстрирована 45 таблицами, 18 рисунками, 1 схемой.
СОДЕРЖАНИЕ РАБОТЫ
Материал и методы исследования
Обследован 91 пациент, находившийся на лечении в специализированном отделении для лечения больных инфарктом миокарда городской клинической больницы № 4 г. Перми
(ГКБ № 4) за период с октября 2004 по декабрь 2006 года; а также 26 человек без признаков заболевания сердечно-сосудистой системы (ЗССС). В соответствии с поставленной целью и задачами при подборе пациентов для исследования определялись следующие критерии включения в основную группу: 1) мужской пол; 2) подтвержденный первый инфаркт миокарда; 3) синусовый ритм; 4) письменное добровольное согласие на участие в исследовании. Пациент исключался из исследования в случае: 1) несоответствия критериям включения; 2) наличия в анамнезе перенесенных ранее ИМ и/или ОНМК; 4) наличия сахарного диабета, нарушений функции щитовидной железы, тяжелой дыхательной или печеночно-почечная недостаточность, злокачественных новообразований; 5) наличия нарушений ритма и проводимости сердца на момент исследования; 6) наличия острой сердечной недостаточность II-IV ФК по Killip и Kimball (1967) или застойной сердечная недостаточности на момент включения в обследование; 7) возраста старше 66 лет; 8) отказа от участия в исследовании.
Диагноз ИМ считался достоверным при наличии 2-х из 3-х общепринятых критериев:
1) возникновение приступа боли в грудной клетке, характерной для ишемии миокарда длительностью 30 минут и более; 2) характерная динамика ЭКГ; 3) положительный тропониновый тест (Национальные Рекомендации по лечению острого коронарного синдрома, 2001).
Диагноз Q–позитивного ИМ был установлен в 71 случае (78,0 %), диагноз Q-негативного ИМ – в 20 случаях (22%). ЭКГ- признаки ИМ передней стенки ЛЖ наблюдались у 43 обследованных (47,3 %), а ЭКГ- признаки ИМ задней стенки ЛЖ – у 48 (52,7%). Течение ИМ в ранний период заболевания привело к развитию осложнений у 30 больных (33 %). У 21 больного из 91 (23,08 %), во время госпитализации течение ИМ осложнилось развитием ранней постинфарктной стенокардии (РПСт), причем чаще (в 61,9 %) это осложнение возникало у больных ИМ передней локализации, в то время, как при ИМ задней стенки ЛЖ оно было отмечено лишь в 38,1%. Замедленная динамика ЭКГ и/или появление дискинезии на ЭХО КГ как признаки формирующейся острой аневризмы сердца зарегистрированы у 6 больных (6,6%), все - при локализации ИМ на передней стенке ЛЖ. У 3 из обследованных нами пациентов течение ИМ в острейшую фазу осложнилось развитием альвеолярного отека легких, что составило 3,3%.
Все пациенты основной группы получали стандартную терапию инфаркта миокарда, включавшую в том числе и бета-адреноблокаторы ( метопролола тартрат в суточной дозе от 50 до 150 мг, под контролем ЧСС), тромболизисная терапия была выполнена 19 пациентам (20,9%) Группу сравнения составили 26 человек, не страдающих ЗССС, сопоставимых по возрасту и индексу массы тела.
Для достижения поставленной цели наряду с общеклиническими исследованиями применяли следующие методы.
Исследование центральной гемодинамики. Всем пациентам ИМ и лицам группы сравнения проводилось полиреокардиографическое исследование гемодинамики (ПРКГ). Полиреокардиографическое исследование гемодинамики осуществлялось по методике М.А. Зубарева (М.А. Зубарев, 1993) с помощью программно-аппаратного диагностического комплекса Полиреокардиограф- 01- Пермь, серийно выпускаемого АО Пермская научно- производственная приборостроительная компания (сертификат РОСС RU. ИМО 2. В08519, лицензия № 10471104). Запись и оценка ПРКГ осуществлялись непосредственно автором данного исследования под руководством проф. М.А. Зубарева и доц. А.А. Думлера. Полиреокардиограмма (ПРКГ) включает в себя синхронную регистрацию следующих кривых: 1) объемной реограммы (РЕО), 2) дифференциальной реограммы (ДР), 3) рео-граммы ускорения (РУ), 4) разностной реограммы (РР), 5) фонокардиограммы (ФКГ), 6) одного отведения ЭКГ. Анализируя кривые ПРКГ, определяли ударный объем крови по формуле гетерогенной модели грудной клетки И.А. Гундарова и соавт. ( И.А. Гундаров. 1983). Объемную скорость выброса крови определяли по формуле: ОСВ = УО/ Ти , мл/c ( С.Б. Фельдман, 1976 г., Л.Б.Иванов, В.А.Макаров, 2000 г.).
Оценка вариабельности объемной скорости выброса крови (ОСВ) проводилась на основании анализа пятиминутной записи вариабельности амплитуды систолической части кривой ДР, при этом вычислялось значение ОСВ в каждом кардиоцикле, а вариабельность ОСВ за 5 минут оценивалась с помощью математического анализа по показателям Мо, АМо, ВР и SDNN (рис 1).
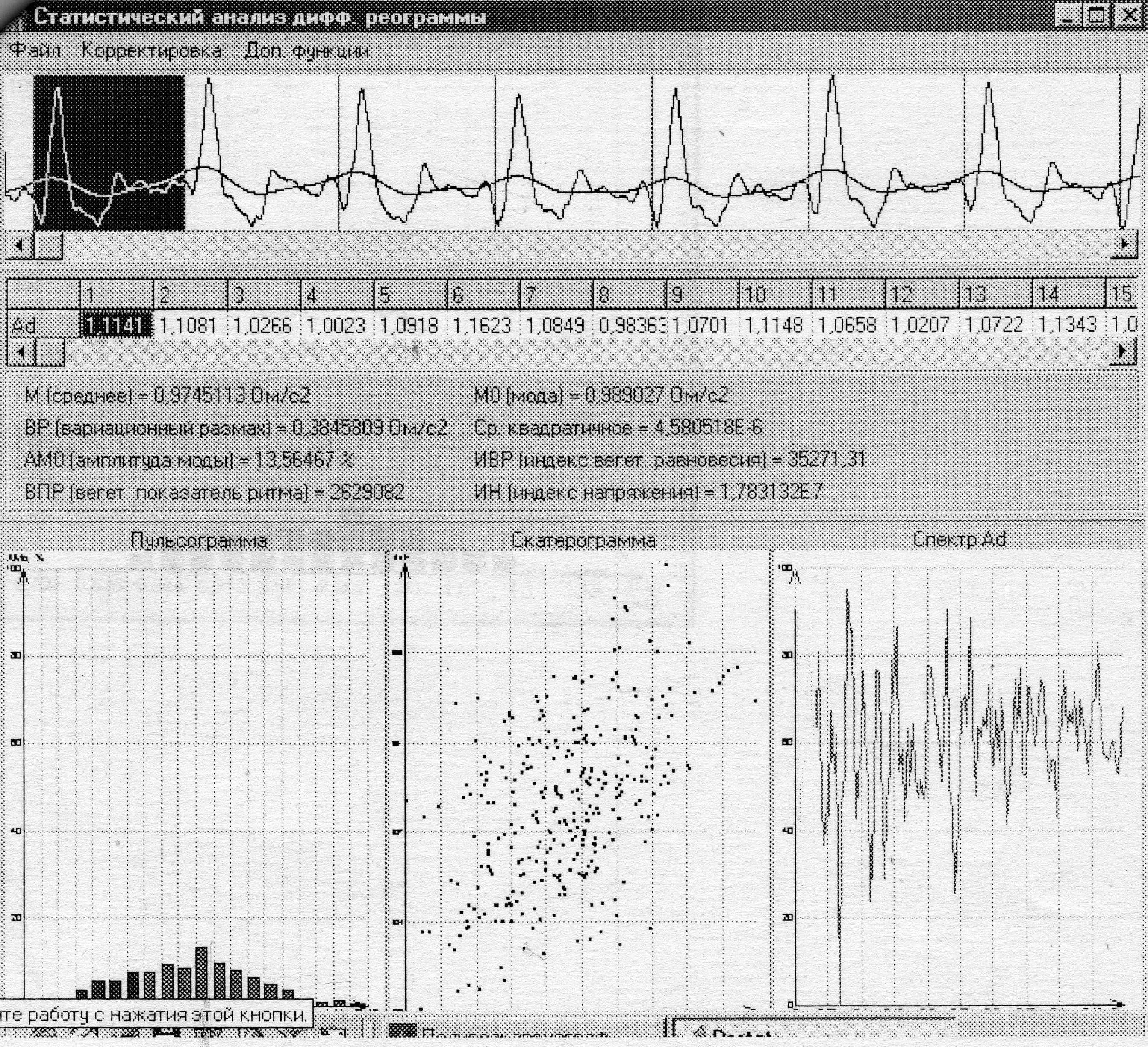
Рис. 1. Вид рабочего окна определения вариабельности ОСВ с построением ГГ и СГ
Анализ вариабельности ритма сердца методом кардиоритмографии (КРГ)
Одновременно с оценкой вариабельности ОСВ по кривой ЭКГ осуществлялся анализ продолжительности всех интервалов RR за 5 минутный период непрерывной записи. Динамический ряд значений RR, полученных за этот период, подвергался статистической обработке с помощью математического анализа ( Р.М. Баевский, 1984) по показателям Мо RR, АМо RR, ВР, SDRR. На основании полученных за 5 минут данных с помощью программного обеспечения « Полиреокардиографа- 01- Пермь» строились гистограммы (ГГ) и скатерограммы (СГ) распределения интервалов RR, а также ГГ и СГ распределения ОСВ.
Условия проведения исследования вариабельности объемной скорости выброса крови и вариабельности сердечного ритма были следующими: исследование проводили натощак или спустя 1,5 - 2 часа после еды в первую половину дня (с 11 до 13 часов), в тихом помещении, где поддерживалась постоянная температура на уровне 20-22 градусов Цельсия ( Г.В. Рябыкина, А.В. Соболев, 1996). Для достижения равномерного дыхания с частотой 16 дыхательных движений в 1 минуту использовался метроном. Перед началом исследования имел место 5 минутный период адаптации, после чего в течение следующих 5 минут производилось непосредственно исследование.
Эхокардиографическое исследование. Всем обследованным было произведено эхокардиографическое исследование (ЭХОКГ). Исследования проводились врачами ультразвуковой диагностики, специализирующимися на ЭХОКГ, использовался аппарат «Aloka-500», Япония. Обследование проводилось из общепринятых позиций по стандартным методикам, производилась оценка региональной сократимости ЛЖ методом сегментов в соответствии с рекомендациями Американской ассоциации эхокардиографии, производилась оценка клапанного аппарата (Н.Шиллер, М.А. Осипов, 1993 г.).
Тест шестиминутной ходьбы. В качестве нагрузочного теста с целью оценки функционального статуса пациентов основной группы использовался тест шестиминутной ходьбы (ТШХ) по стандартной методике. ТШХ оценивался в соответствии с рекомендациями New-York Heart Association (NYHA, 1964) и Американского Торакального Общества (ATS, 2002) .
Дизайн исследования. Исследование являлось открытым проспективным параллельным. В соответствии с поставленной целью и задачами после проведения первичного комплекса обследования, оценки критериев включении и исключения, пациентам проводился ТШХ, ПРКГ, оценивалась вариабельность ОСВ и вариабельность сердечного ритма. Методом простой рандомизации были выбраны 30 больных (33% от общего числа обследованных основной группы), у которых исследование выполнялось дважды: на 5-7 сутки и на 12-14 сутки от развития ИМ, перед выпиской из стационара, перед каждым исследованием проводился ТШХ. Контроль повторных госпитализаций в отделения кардиологического профиля по поводу развития повторных эпизодов острого коронарного синдрома (ОКС) производился в течение последующего года после перенесенного ИМ путем телефонного опроса пациентов основной группы, а также по поиску в единой компьютерной базе данных ГКБ № 4.
Статистическая обработка материалов исследования. Статистическая обработка материала проводилась с помощью программных продуктов «Biostat», «Statistica 6.0» . При выборе метода анализа учитывался характер нормальности распределения признака. Для описания данных при нормальном распределении использовались средние значения и стандартное отклонение средней (M ± σ) в случае отклонения распределения от нормального для характеристики групп и различий между ними в каждой выборке использовались непараметрические методы. Для проверки гипотезы о равенстве средних использовались: t-критерий Стьюдента при нормальном распределении, а при распределении, отличном от нормального - непараметрический критерий Манна-Уитни. Достоверность различий частот оценивали с помощью критерия χ². Различия признавались значимыми при уровне р < 0,05. Сравнение 2-х и более групп по качественному признаку, а также сравнение групп по бинарному признаку производилось с помощью построения таблиц сопряженности. Отношение шансов события в одной группе к шансам этого же события в другой группе (ОШ) вычисляли по формуле: ОШ= (а/b)/( c/d).Относительный риск (OР) рассчитывали по формуле: ОР = [a/(a+b)]/[c/(c+d). Расчет эффективности диагностического теста проводился по следующим формулам: диагностическая чувствительность (ДЧ) - доля больных, у которых выявляется признак, a/(a+c),в %; диагностическая специфичность (ДС) – частота отсутствия признака у здоровых людей, d/(d+b), в %; диагностическая эффективность (ДЭ)= (ДЧ + ДС)/ 2; прогностическая ценность положительного результата (ПЦПР) – частота совпадения с наличием события, a/(a+b) в %, прогностическая ценность отрицательного результата (ПЦОР) – частота совпадения с отсутствием события, d/(c+d) в %. В связи с тем, что референтная оценка носила альтернативный характер, а результаты исследований имели количественное выражение, использовался такой параметр, как точка разделения. Точку разделения определяли как величину оптимального сочетания чувствительности и специфичности метода, для чего были построены кривые зависимости чувствительности от вероятности ложноположительных результатов ( ROC- Curves).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Для оценки сократимости сердца мы использовали объемную скорость выброса крови (ОСВ) - один из гемодинамических показателей, отражающих сократимость миокарда и определяющийся по формуле: ОСВ = УО/Ти (Фельдман С.Б.,1976г., Иванов Л.Б, Макаров В.А., 2000г.). Импедансометрическим методом УО определяется по формуле И.А. Гундарова (1983): УО = 0,9∙К ∙ρ∙Q²· L· Ad· Ти/Z ², где 0,9 – поправочный коэффициент, обусловленный наложением электродов, К – размерный коэффициент, ρ - величина удельного сопротивления крови ( Ом ·см), Q – периметр грудной клетки ( см),
L – межэлектродное расстояние ( см), Z – базовый импеданс (Ом), Аd – амплитуда систолической части ДР ( Ом/c), Ти – длительность фазы изгнания крови (с). Таким образом, формула для определения ОСВ импедансометрическим методом может быть записана в виде : ОСВ = 0,9∙К ∙ρ∙Q²· L· Ad / Z ², где все показатели соответствуют таковым формулы И.А. Гундарова для определения УО. Исходя их вышеизложенного, величина ОСВ может быть легко оценена с помощью ПРКГ (М.А. Зубарев, 1993), так как для ее оценки не требуется определение Ти. По результатам 5-ти минутного мониторирования ПРКГ проводился анализ вариабельности ОСВ. Полученные нами результаты определения вариабельности ОСВ представлены в таблице 1. Учитывая не Гауссовский характер распределения полученных данных, для оценки достоверности различий между группами по вариабельности ОСВ был использованы непараметрический критерий Манна – Уитни. Установлено, что вариабельность объемной скорости выброса крови в покое имеет место в обеих группах, но в группе больных ИМ на 12-14 сутки от начала заболевания имеется статистически значимо более высокий показатель АМо ОСВ (р=0,001), что свидетельствует о меньшей вариабельности ОСВ у больных ИМ.
Таблица 1
Вариабельность объемной скорости выброса у больных инфарктом
миокарда и в группе сравнения
| Показатели вариабельности | Больных ИМ n = 91 | Группа сравнения n = 26 | р (Манн-Уитни) |
| ВР ОСВ, мл/c | 48,68 ± 24,86 | 47,19 ± 29,2 | NS |
| SD ОСВ, мл/ с | 8,89 ± 4,4 | 7,86 ± 4,87 | NS |
| АМо ОСВ, (%) | 38,8 ± 23,85 | 22,8 ± 10,95 | 0,001 |
Учитывая не Гауссовский характер распределения полученных данных, были определены медиана (Ме), а также верхний и нижний квартили для значений АМо в обеих группах. Результаты представлены в таблице 2.
Таблица 2
Распределение АМо в обследованных группах по медиане и квартилям
| Показатели | Больные ИМ, n = 91 | Группа сравнения, n = 26 |
| Амо, % | 38,8 ± 23,85 | 22,8 ± 10,95 |
| Медиана, % | 32,72 | 17,85 |
| Верхний квартиль, % | 18,41 | 14,25 |
| Нижний квартиль, % | 51,22 | 33,0 |
Установлено, что АМо у половины обследованных больных ИМ находилась в пределах от 18,41 до 51,22 %, при медиане равной 32,72 % и амплитуде ряда от 10,2 до 90,4 %, в то время как АМо у половины обследованных лиц без признаков заболеваний сердечно- сосудистой системы находилась в пределах от 14,25 до 33,0%, при медиане равной 17,85% и амплитуде ряда от 9,18 до 44,2%, различия достоверны ( р = 0,001).
По результатам 5-ти минутного мониторирования ЭКГ проводился анализ вариабельности сердечного ритма на коротких отрезках записи. Установлено, что вариабельность ритма сердца у больных ИМ на 12-14 сутки от начала заболевания статистически значимо ниже, чем у лиц без заболеваний сердечно- сосудистой системы по показателям ВР R-R и SDRR (р=0,0001), это соответствует данным литературы. По показателю АМо R-R различия статистически не достоверны (р = 0,66). Результаты представлены в таблице 3.
Таблица 3
Вариабельность интервалов R-R у лиц у больных инфарктом миокарда
и группы сравнения ( М ± σ)
| Показатели вариабельности | Больные ИМ n = 91 | Группа сравнения n = 26 | р |
| ВР RR, c | 0,15 ± 0,02 | 0,32 ± 0,07 | 0,0001 |
| SDRR, с | 0,02 ± 0,002 | 0,06 ± 0,004 | 0,0001 |
| АМо RR (%) | 55,11 ± 16,97 | 45,50 ± 15,06 | NS |
Изучение повторяемости разработанного нами импедансометрического метода оценки вариабельности ОСВ в покое на коротких записях показало, данный метод обладает высокой повторяемостью как у лиц без заболеваний сердечно- сосудистой системы, так и у здоровых лиц. Результаты представлены в таблице 4 и таблице 5.
Таблица 4
Оценка повторяемости метода определения вариабельности объемной скорости
выброса крови у обследованных лиц группы сравнения
| Измерение | М ( среднее) | σ | F | р |
| № 1 | 23,71 | 20,1 | < 0,0001 | 0,98 |
| № 2 | 23,58 | 18,8 |
Таблица 5
Оценка повторяемости метода определения вариабельности объемной
скорости выброса у больных ИМ
| Измерение | М ( среднее) | σ | F | р |
| № 1 | 41,69 | 18,9 | 0,002 | 0,96 |
| № 2 | 41,97 | 19,17 |
Изучение повторяемости метода оценки вариабельности сердечного ритма на 5 минутных записях также обнаружило высокую повторяемость метода в обеих группах обследованных ( р = 0,9 в группе сравнения и р = 0,73 в группе больных ИМ).
Анализ графических форм гистограмм ( ГГ) распределения ОСВ в обеих группах показал, что ГГ ОСВ больных ИМ и ГГ ОСВ лиц без патологии сердечно- сосудистой системы различались по форме. Были выделены следующие типы ГГ ОСВ: 1) тип I, cимметричные ГГ (рис.2) и 2) тип II, ассимметричные ГГ (рис.3). При этом ГГ I типа встречались преимущественно (в 96,2 %) у лиц без ЗССС, в то время как ГГ II типа – преимущественно (в 82,4 %) больных ИМ на 12-14 сутки от развития заболевания, различия статистически значимы (χ² = 51,45; p<0,0001). Результаты представлены в таблице 6.
Таблица 6
Распределение ГГ по типам у больных ИМ и в группе сравнения
| Типы ГГ | Больные ИМ, n = 91 | Лица без ЗССС, n =26 | Χ² | р |
| I тип, симметричные | 16 | 25 | 51,45 | <0,0001 |
| II тип, асимметричные | 75 | 1 |
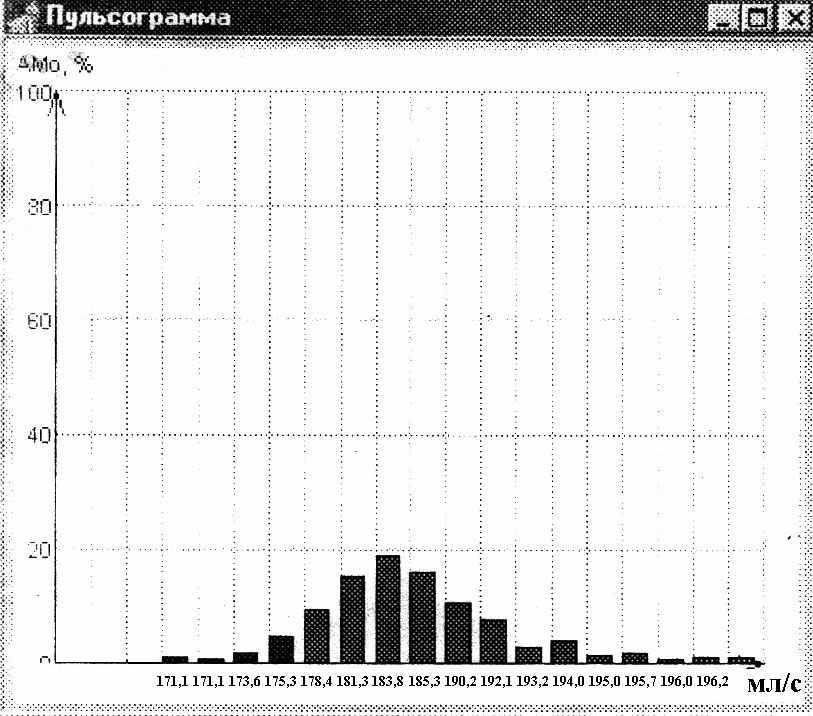
Рис.2. ГГ ОСВ I типа : симметричная ГГ
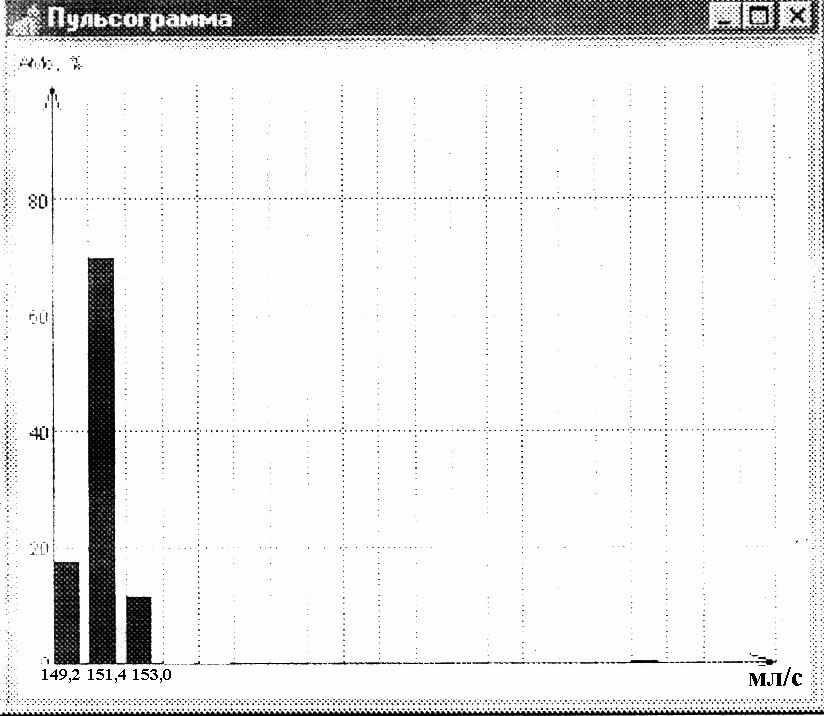
Рис.3. ГГ ОСВ II типа : ассиметричная ГГ
Ассимметричные ГГ, в свою очередь, были представлены несколькими вариантами:1)резко мономодальная (эксцессивная) ГГ, где АМо≥50%; 2) мономодальная ГГ, где 30%< АМо< 50%; 3) бимодальная ГГ, где АМо ≥ 30%; 4) полимодальная ГГ, где АМо ≤ 30%;5) амодальная безвершинная ГГ (мода отсутствует). У больных ИМ на 12-14 сутки от развития заболевания статистически значимо чаще встречались резко мономодальный ( экцессивный) ( рис.4) и амодальный (безвершинный) ( рис.5) варианты ГГ , р = 0,02 и р =0,01, соответственно (таблицы 7 и 8). Эти варианты ГГ ОСВ были названы «патологическими».
Таблица 7
Распределение патологического резко мономодального варианта ГГ II типа
у больных ИМ и в группе сравнения
| Резкомономодальный | Больные ИМ, n = 91 | Лица без ЗССС, n =26 | Χ² | Р |
| Есть | 21 | 0 | 51,45 | <0,0001 |
| Нет | 70 | 26 |
Таблица 8
Распределение патологического амодального варианта ГГ II типа у больных ИМ
и в группе сравнения
| Амодальный | Больные ИМ, n = 91 | Лица без ЗССС, n =26 | Χ² | P |
| Есть | 29 | 1 | 51,45 | <0,0001 |
| Нет | 62 | 25 |
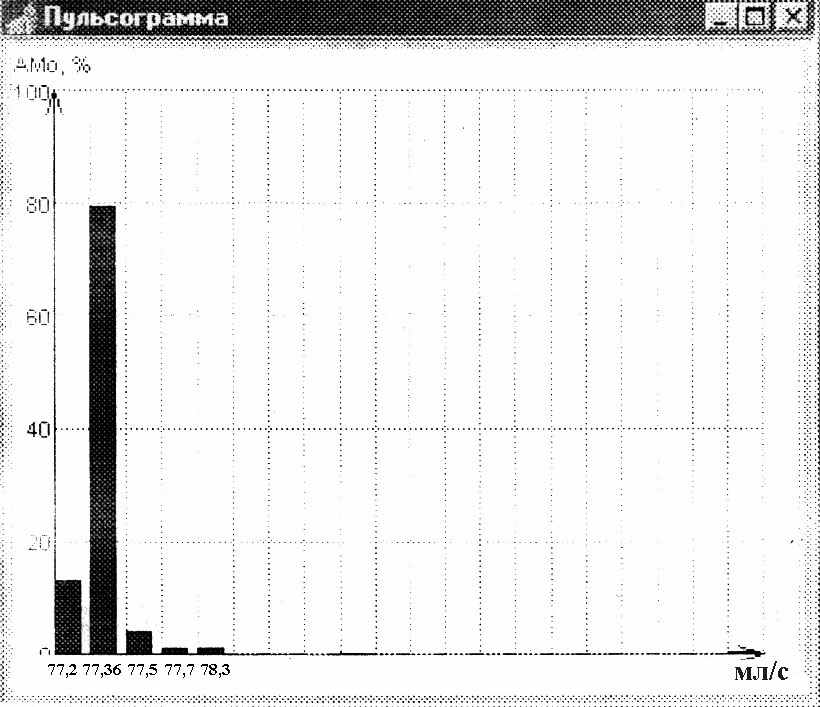
Рис.4. ГГ ОСВ II типа : резко мономодальный вариант ГГ ( АМо > 50%)
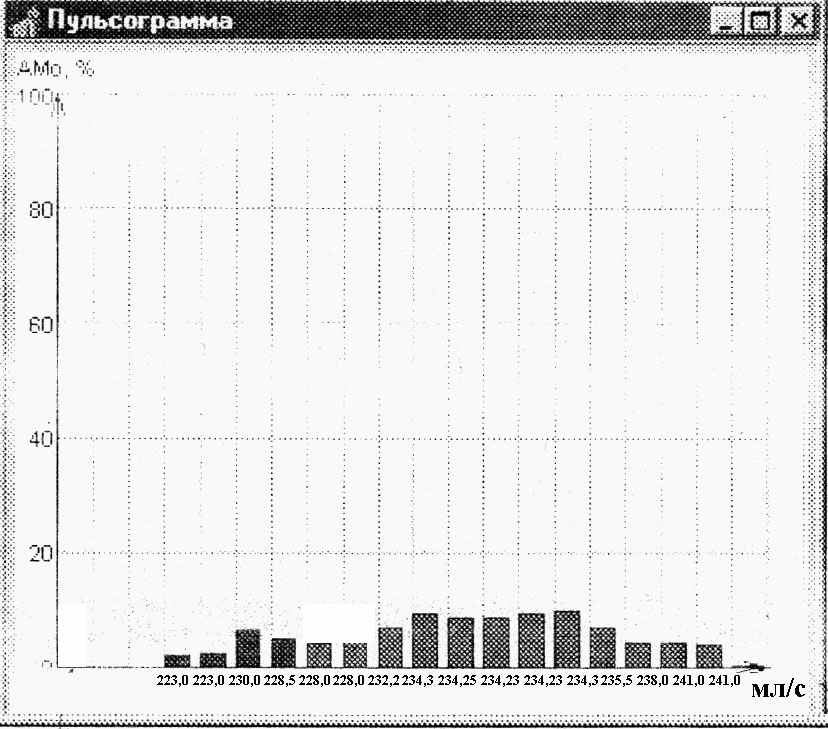
Рис.5. ГГ ОСВ II типа : амодальный вариант ГГ ( мода отсуствует)
Скатерограммы (СГ) распределения ОСВ в обеих группах также различались по форме. По аналогии с типами форм СГ RR нами были выделены следующие формы СГ ОСВ:
1) облаковидное рассеяние точек по всему полю, с нечеткими краями–облаковидная форма СГ, 2) плотное сгущение точек на периферии поля с четкими краями–точкообразная форма CГ, 3) промежуточная между облаковидной и точкообразной форма (рис.6-8).СГ облаковидной формы регистрировались чаще в группе сравнения, а точкообразные СГ регистрировались только в группе больных ИМ и не регистрировались в группе сравнения, различия статистически достоверны (p=0,006), эта форма СГ была названа «патологической».
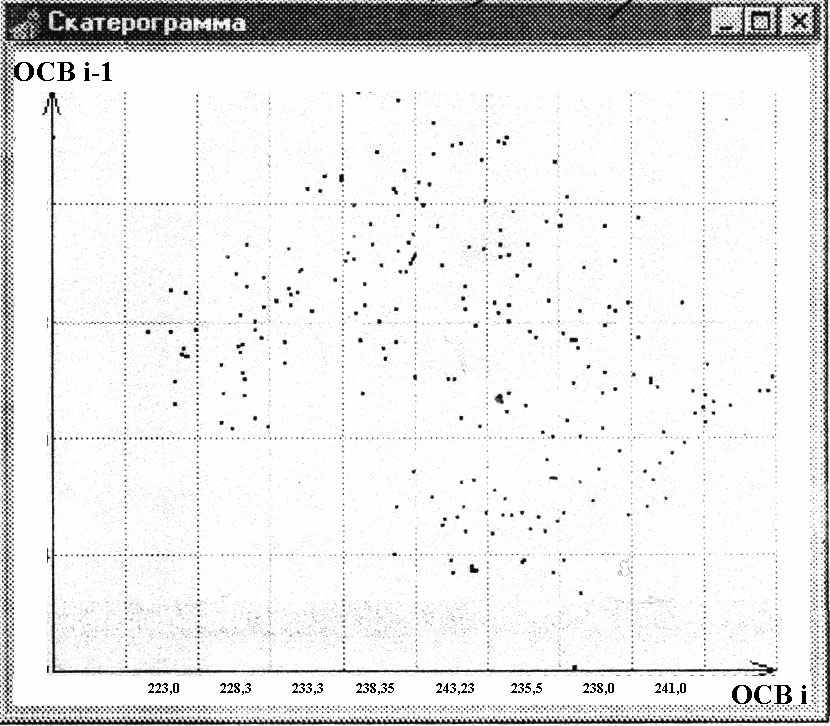
Рис.6. СГ ОСВ облаковидной формы
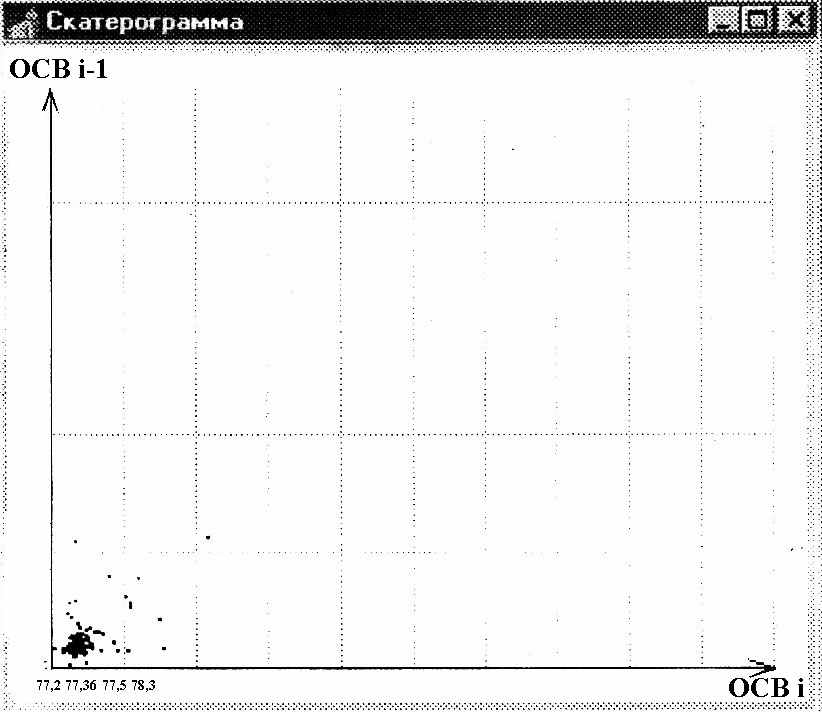
Рис.7. СГ ОСВ точкооразной формы
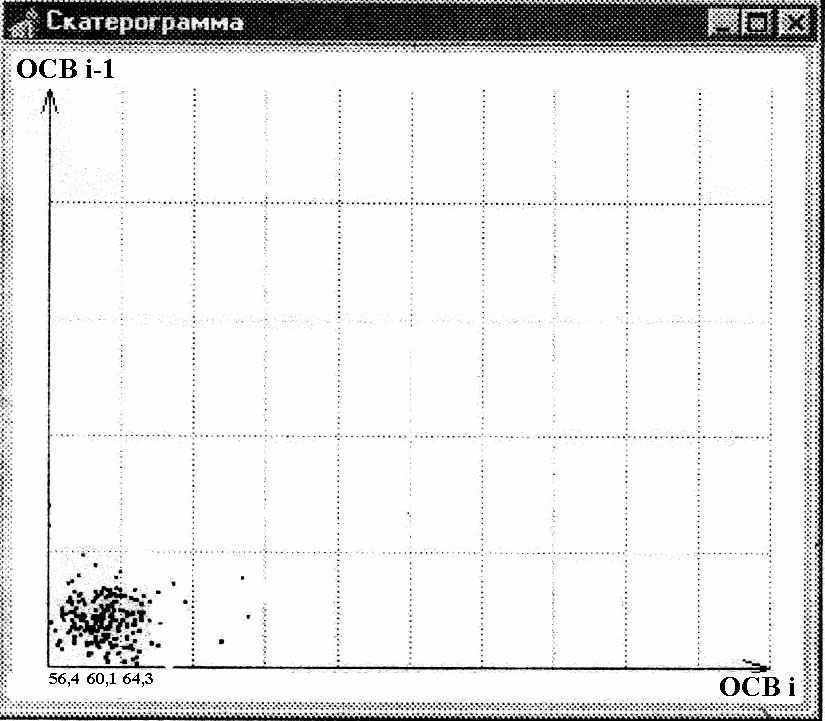
Рис.8. СГ ОСВ промежуточной формы
Проводилось изучение показателей вариабельности cердечного ритма и вариабельности ОСВ в зависимости от наличия или отсутствия зубца Q на ЭКГ. Для этого больные ИМ были разделены на 2 подгруппы: подгруппу больных с Q-позитивным ИМ (n= 71) и подгруппу с Q-негативным ИМ (n=20). Обе подгруппы были сравнимы по возрасту и величинам УО крови, выявлена статистически значимая разница по показателю ФВ. Проводилось сравнение вариабельности сердечного ритма между подгруппой больных Q-позитивным ИМ и подгруппой больных Q- негативным ИМ по показателю АМо R-R и сравнение вариабельности ОСВ по показателю АМо ОСВ. Результаты представлены в таблице 9.
Таблица 9
Сравнение АМо RR и АМо ОСВ в зависимости от наличия зубца Q на ЭКГ
| Показатель, % | ИМ с зубцом Q | ИМ без зубца Q | р |
| АМо R-R | 54,26 ± 17,89 | 56,41± 15,10 | 0,63 |
| АМо ОСВ | 42,64 ± 23,96 | 30,2 ± 20,32 | 0,04 |
Как видно из таблицы, у больных Q-позитивным ИМ АМо ОСВ достоверно выше, чем АМо ОСВ у больных Q-негативным ИМ. В то же время, статистически значимых различий по величинам АМо R-R между подгруппами выявлено не было. Анализ распределения «патологических» вариантов ГГ ОСВ II типа в зависимости от наличия или отсутствия зубца Q на ЭКГ показал, что оба «патологических» варианта ГГ ОСВ одинаково часто встречались как у больных Q-позитивным ИМ, так и у больных Q-негативным ИМ, р=0,39.
Проанализированы формы СГ ОСВ в зависимости от наличия зубца Q на ЭКГ. Установлено, что в обеих подгруппах регистрировались все формы СГ, р = 0,14.
Проводилось изучение показателей вариабельности сердечного ритма и ОСВ в зависимости от локализации ИМ, для чего обследованные основной группы были разделены на две под- группы, при этом ИМ передней стенки ЛЖ был зарегистрирован у 43 больных, ИМ задней стенки ЛЖ – у 48. Обе подгруппы были сравнимы по возрасту и ИМТ, различались по величинам УО крови, р =0,01, и по значениям ФВ, р = 0,01. Полученные нами данные свидетельствуют о том, что вариабельность сердечного ритма по показателям SD RR, ВР RR и АМо RR и вариабельность ОСВ по показателям SD ОСВ, ВР ОСВ и АМо ОСВ не зависят от локализации ИМ. Проанализированы ГГ ОСВ в зависимости от локализации ИМ на передней или задней стенках ЛЖ. вариант патологической ГГ ОСВ зависит от локализации ИМ : при ИМ передней стеки ЛЖ достоверно чаще регистрируется амодальный вариант ГГ ОСВ, при ИМ задней стенки ЛЖ – резко мономодальный вариант ГГ ОСВ, р = 0,01. В то же время, встречаемость «не патологических» вариантов ГГ ОСВ не зависит от локализации ИМ: полимодальный, мономодальный и бимодальный варианты регистрировались в обеих подгруппах, значимой разницы нет, р=0,79.
Проанализированы СГ ОСВ в зависимости от локализации ИМ, преобладания какой-либо одной формы СГ ОСВ ни в одной из подгрупп не выявлено.
Проводилось изучение показателей вариабельности ОСВ в зависимости от характера осложнений, для чего были выделены следующие подгруппы больных: 1) больные с острой левожелудочковой недостаточностью (ОЛЖН) при поступлении, 2) больные с развитием ранней постинфарктной стенокардии (РПСт), 3) больные с формирующейся аневризмой сердца (АС). Течение ИМ в ранний период заболевания привело к развитию осложнений у 30 больных (33 %), из них у 21 больного (70,0 %), во время госпитализации течение ИМ осложнилось развитием ранней постинфарктной стенокардии (РПСт), причем это осложнение возникло у 13 больных ИМ передней стенки ЛЖ ( 62%) и у 8 больных ИМ задней стенки ЛЖ ( 38 %). Замедленная динамика ЭКГ и/или появление дискинезии на ЭХО КГ как признаки формирующейся острой аневризмы сердца зарегистрированы у 6 больных (20,0 %), все - при локализации ИМ на передней стенке ЛЖ. Течение ИМ в острейшую фазу осложнилось развитием альвеолярного отека легких у 3 из обследованных нами пациентов, что составило 10,0%, столь небольшой процент ОЛЖН среди наших пациентов был обусловлен дизайном обследования. Не выявлено статистически значимой разницы между подгруппами по возрасту (р = 0,88) и по ФВ
(р = 0,06). Согласно полученным нами данным, наличие ОЛЖН в первые сутки ИМ влияет на вариабельность сердечного ритма по показателю АМо R-R и на вариабельность ОСВ по показате-лю АМо ОСВ при определении этих показателей на 12-14 сутки от развития заболевания. Наличие РПСт не влияет на вариабельность сердечного ритма по показателю АМо R-R, но влияет на вариабельность ОСВ по показателю АМо ОСВ. При наличии осложнений ИМ симметричные ГГ (I типа) не регистрируются. Наличие РПСт и формирующейся АС влияет на то, какая форма «патологической» ГГ ОСВ будет чаще регистрироваться: при РПСт ЛЖ преобладает резко мономодальный вариант, при АС - амодальный вариант. На частоту встречаемости «не патологических» вариантов ГГ ОСВ, а также на форму СГ ОСВ локализация ИМ не влияет.
Проводилось изучение показателей вариабельности ОСВ в зависимости от проведения тромболизисной терапии, для чего больные были поделены на 2 подгруппы: подгруппа больных, которым был проведен тромболизис, n=19 ( 20,9%), и подгруппу больных, которым тромболизис не был проведен , n =72 ( 79,1 %). В качестве тромболитического препарата использовалась стрептокиназа в дозе 1,5 млн ЕД. Установлено статистически значимая разница между подгруппами: на 12-14 сутки от развития заболевания АМо ОСВ у больных в подгруппе тромболиза достоверно ниже, чем АМо ОСВ у больных без такового : 36,34 ± 21,06 против 45,6 ± 18,6, р = 0.02.
У 30 больных (33 %) основной группы обследование проводилось в динамике дважды: на 5-7 сутки от начала ИМ и на 12-14 сутки (перед выпиской из стационара). По локализации ИМ эту подгруппу составили 17 больных с ИМ задней стенки ЛЖ (56,6%) и 13 больных с ИМ передней стенки ЛЖ (43,4%). В динамике оценивались результаты ТШХ, результаты исследования вариабельности ОСВ И ВСР. Установлено, что пройденная больными при выполнении ТШХ дистанция достоверно возрастает у больных ИМ задней стенки ЛЖ с первой по вторую неделю от развития заболевания, однако не смотря на наличие прироста ТШХ, в том числе – статистически значимое при задней локализации ИМ, не выявлена разница в показателях АМо ОСВ и АМо ВСР, зарегистрированных в конце первой и в конце второй недели от развития ИМ. Мы полагаем, это может быть обусловлено небольшим сроком наблюдения.
Анализировались типы ГГ ОСВ в зависимости от сроков, прошедших от момента развития ИМ. Выявлено, что у больных ИМ задней стенки ЛЖ в период с 5-7 по 12-14 сутки от развития заболевания имеет место статистически достоверная динамика ГГ распределения ОСВ в виде увеличения количества симметричных, Гаусовских, ГГ I типа. Иными словами, у этих больных к концу второй недели ( перед выпиской из стационара) имеет место процесс «нормализации» ГГ ОСВ. Проанализирована динамика облаковидной («не патологической») и точкообразной («патологической») форм СГ ОСВ по срокам обследования в зависимости от локализации ИМ. Установлено, что у больных ИМ вне зависимости от его локализации на 12-14 сутки ИМ имеет место тенденция к трансформации патологических форм СГ в непатологические, иными словами – к нормализации СГ.
Катамнестически к госпитализации проанализированы все случаи повторных госпитализаций обследованных больных в инфарктное отделение ГКБ 4 в течение года после перенесенного ИМ. Выявлено, что 17,6 % (n =16) из обследованных больных в течение года были госпитализированы повторно. Поводам явился острый коронарный синдром (ОКС) в виде рецидивирующего ИМ, повторного ИМ или нестабильной стенокардии. Ретроспективно проанализированы значения показателя АМо ОСВ, зарегистрированные на 12-14 сутки первой госпитализации у больных с повторными эпизодами ОКС и у больных без повторных эпизодов ОКС в течение последующего года. Выявлено, что значения АМо ОСВ на 12-14 сутки первого ИМ были статистически достоверно выше у тех больных ИМ, у которых в дальнейшем в течение года имели место повторные эпизоды ОКС: 54,04 ± 21,03 против 30,33 ± 15,35, p = 0,01 ( Манн-Уитни). Ретроспеспективно проанализированы значения показателя АМо ВСР, зарегистрированные на 12-14 сутки первой госпитализации у больных с повторным ОКС. Эти значения сравнивались со значениями АМо ВСР больных без повторных ОКС в течение последующего года. Не выявлено разницы в значениях АМо ВСР, зарегистрированных на 12-14 сутки первого ИМ между данными подгруппами больных: 57,35 ± 16,39 против 55,79 ± 12,19 , р =0,45 ( Манн- Уитни). Вычислено отношение шансов и относительный риск развития повторного ОКС в течение последующего года после ИМ при АМо ОСВ ≥ 40% на 12-14 сутки первого ИМ. Отношение шансов равно 123,07; относительный риск составляет 47,7. Результаты представлены в таблице 10.
Построена кумулятивная кривая, найдена точка разделения, равная 40 %, при этом диагностическая чувствительность метода (ДЧ) равна 88%, диагностическая специфичность (ДС) равна 93%, ПЦПР = 61,5%, ПЦОР = 98,7%, диагностическая эффективность метода (ДЭ) равна 90,5%.
Таблица 10
Определение отношения шансов развития повторного ОКС в течение последующего
года после перенесенного первого ИМ по величине АМо ОСВ на 12-14 сутки ИМ
| Величина АМо ОСВ | | Повторное ОКС есть | Повторного ОКС нет |
| ≥ 40% | Есть | 8 | 5 |
| Нет | 1 | 77 | |
| Всего исследований | | 91 | |
ВЫВОДЫ
1. Разработан и апробирован импедансометрический способ определения вариабельности выброса крови в покое от сокращения к сокращению по вариабельности объемной скорости выброса крови. Метод прост и обладает повторяемостью.
2. Разработанным нами методом выявлено наличие вариабельности объемной скорости выброса крови в покое у лиц без заболеваний сердечно-сосудистой системы и у больных инфарктом миокарда, при этом у последних она достоверно ниже, что было подтверждается методом временного анализа и геометрическим методом. Выявлены следующие закономерности: 1) у лиц без заболеваний сердечно- сосудистой системы гистограмма распределения ОСВ симметричная, АМо = 22,8 ± 10,95 % , скатерограмма имеет форму «облака», 2) у больных ИМ гистограмма распределения ОСВ асимметричная, АМо=38,8± 23,85%, скатерограмма имеет форму «точки» или форму, «промежуточную» между «точкой» и «облаком».
- ИМ с зубцом Q на ЭКГ ( Q-позитивные) характеризуются более низкой
вариабельностью ОСВ, чем ИМ без зубца Q на ЭКГ (Q – негативные). Локализация ИМ влияет на варианты ГГ ОСВ : при ИМ передней стенки ЛЖ преобладает амодальный вариант ГГ ОСВ, при ИМ задней стенки ЛЖ - резко мономодальный вариант. Осложненное течение ИМ снижает вариабельность ОСВ: ОЛЖН в первые сутки ИМ приводит к сохранению более низкой вариабельности ОСВ в течение последующих 12-14 дней; развитие ранней постинфарктной стенокардии сопровождается сни-жением вариабельности ОСВ с преобладанием резко мономодального варианта ГГ.
- Сохраняющаяся низкая вариабельность ОСВ к концу 2-й недели ИМ ( значение
АМо ОСВ ≥ 40%) достоверно повышает риск развития повторного эпизода острого коронарного синдрома в течение последующего года.
5. Вариабельность ОСВ не зависит от вариабельности сердечного ритма, являясь
самостоятельным физиологическим механизмом.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. Неинвазивный, простой и обладающий повторяемостью метод определения вариабельности объемной скорости выброса крови может быть внедрен в практику обследования больных ИМ во время их нахождения в стационаре.
2. Для анализа динамики течения ИМ во время нахождения в стационаре у всех больных рекомендуется оценивать вариабельность объемной скорости выброса крови в покое по показателю АМо на 5-7 и 12-14 сутки заболевания.
3. Для оценки риска развития повторных эпизодов острого коронарного синдрома в течение последующего года после перенесенного первого ИМ у всех больных рекомендуется определять АМо объемной скорости выброса крови на 12-14 сутки заболевания.
СПИСОК ПУБЛИКАЦИЙ
- Зубарев М.А. Компьютерная трансторакальная импедансная кардиография: новые подходы к массовым обследованиям работников промышленных предприятий/ М.А.Зубарев, А.А. Думлер, О.Р. Парандей // Современные аспекты промышленного здравоохранения: cборник материалов научно-практической конференции. – Пермь, 2005.- Вып.3 - С.61-63.
- Парандей О.Р. Вариабельность ударного объема сердца и ее зависимость от импедансометрических характеристик определения/О.Р. Парандей, М.А. Зубарев, А.А. Думлер// Научные труды I Съезда физиологов СНГ: в 2 т./ Под редакцией Р.И.Сепиашвили. – М. Медицина- Здоровье, 2005 г. – Том 2. - С. 72.
- Зубарев М.А. Особенности вариабельности объемной скорости выброса крови у больных инфарктом миокарда с незастойной сердечной недостаточностью /М.А.Зубарев, О.Р. Парандей, А.А. Думлер // Актуальные вопросы клинической медицины: сборник научных трудов. – Пермь: ГОУ ВПО ПГМА Росздрава, 2005. - С.137- 140.
- Парандей О.Р. Методологические и метрологические аспекты компьютерного импедансного определения вариабельности сократимости сердца в режиме beat-to-beat пятиминут-ных записей / О.Р. Парандей, М.А.Зубарев, В.В. Щекотов, А.А. Думлер // Материалы юбилейной научной сессии 2006 года : в 2 т. - Т.2. Клиничес-кие науки.- Пермь: ГОУ ВПО ПГМА им.ак. Е.А. Вагнера Росздрава, 2006 г. – С. 28-30.
- Зубарев М.А. Вариабельность сократимости сердца у больных ХСН после перене-сенного инфаркта миокарда/М.А.Зубарев, О.Р. Парандей, А.А. Думлер// Новые диагностические технологии в лучевой диагностике: материалы IX симпозиума с международным участием – Российская Академия медицинских наук, 2006 г. – С.36-37.
- Парандей О.Р. Вариабельность сократимости сердца у здоровых лиц и у больных инфаркта миокарда / О.Р.Парандей, М.А.Зубарев, А.А. Думлер // От диспансеризации к высоким технологиям: материалы Российского национального конгресса кардиологов - Приложение 1 к журналу «Кардиоваскулярная терапия и профилактика». – 2006 г.- Т.5. № 6. – С.280.
- Парандей О.Р. Вариабельность импедансометрических маркеров ударного объема крови после инфаркта миокарда – новые возможности мониторирования гемодинамики О.Р.Парандей, М.А.Зубарев // Бюллетень НЦССХ им. А.Н. Бакулева РАМН « Сердечно-сосудистые заболевания» - 2007.- №3 – С. 82-86.
- Zubarev Michael. Beat-to-beat variability of upstroke velocity, measured by an impedance cardiographic method /Michael Zubarev, Vladimir Schekotov, Oksana Parandey, Angelika Antipova, Andrey Dumler // Abstracts of 13th International Conference of Electrical Bioimpedance, 2007. – P.83.
- Зубарев М.А. Импедансная реография: возможности мониторирования вариабельности сердечного выброса в реальном времени / М.А.Зубарев,О.Р. Парандей, В.Е. Владимирский. // Научное и практическое значение импедансометрии в диагностике заболеваний внутренних органов: материалы Первой Российской конференции.- Приложение к Пермскому медицинскому журналу, 2008 – Т.25. – С. 74 -78.
- Зубарев М.А. Реокардиография: прошлое, современность, перспективы / М.А. Зубарев, В.Ю. Мишланов, О.Р. Парандей и др. // Научное и практическое значение импедансометрии в диагностике заболеваний внутренних органов: материалы Первой Российской конференции.- Приложение к Пермскому медицинскому журналу, 2008 – Т.25. – С. 7 -13.
Выражаем благодарность доктору медицинских наук профессору ГОУ ВПО
«ПГМА им. ак. Е.А. Вагнера Росздрава» В.В. Щекотову за помощь в разработке
методики и проведении исследования.
СПИСОК СОКРАЩЕНИЙ
АМо – амплитуда моды
Аd – амплитуда систолической части дифференциальной реограммы
ВСР – вариабельность сердечного ритма
ВР – вариационный размах
ГГ – гистограмма
ДР – дифференциальная реограмма
ИМ – инфаркт миокарда
КРГ - кардиоритмограмма
Мо – мода
ОКС – острый коронарный синдром
ОСВ – объемная скорость выброса крови
ПРКГ – полиреокардиография
СГ – скатерограмма
ССЗ – сердечно- сосудистые заболевания
Ти – длительность фазы изгнания крови
ТШХ – тест шестиминутной ходьбы
УО – ударный объем
