Учебное пособие к дисциплине для студентов заочной формы обучения по специальности 140211 «Электроснабжение»
| Вид материала | Учебное пособие |
СодержаниеОн, -с-н, -с-он, -nh Химическая стойкость полимерных материалов. Физически активные Химически активные |
- Учебное пособие к дисциплине для студентов заочной формы обучения по специальности, 1856.64kb.
- Методические указания к дисциплине и задания к контрольной работе для студентов заочной, 126.92kb.
- Методические указания к дисциплине и темы рефератов для студентов заочной формы обучения, 102.72kb.
- Учебное пособие для студентов заочной формы обучения Санкт-Петербург, 1247.83kb.
- Методические указания к итоговому междисциплинарному экзамену по специальности «электроснабжение», 382.82kb.
- Н. Н. Кувшинова экология учебное пособие, 1072.88kb.
- Учебное пособие для самостоятельной работы студентов специальности 040600 «Сестринское, 1354.95kb.
- Методические указания: краткий курс лекций для студентов заочной формы обучения Санкт-Петербург, 1540.61kb.
- Учебное пособие Для студентов всех специальностей Москва 1999, 1603.73kb.
- Учебное пособие для студентов специальности «Экономика и управление на предприятии», 1271.5kb.
Вещества с молекулярной массой (М) более 5000 и вплоть до многих миллионов называются высокомолекулярными (ВМС), а их молекулы – макромолекулами.
Полисахариды (целлюлоза), лигнин, белки, пектины – всё это высокомолекулярные соединения, представители органических ВМС.
Существуют и неорганические ВМС, например, кремневый ангидрид SiO2 (кремневый ангидрид, горный хрусталь, аметист), оксид алюминия Аl2О3 (рубин, сапфир, корунд) и др.
Если макромолекулы ВМС построены из многократно повторяющихся одинаковых групп атомов (звеньев), то такие вещества называются полимерами.
Число звеньев (n), входящих в состав макромолекулы, характеризуют степень полимеризации (СП). Понятно, что Мзвена . n = М полимера.
Полимеры с высокой СП называют высокополимерами, с низкой СП – олигомерами.
Различают природные, искусственные и синтетические полимеры. Наиболее известными природными полимера является натуральный каучук, гуттаперча, целлюлоза.
Искусственные полимеры – это модифицированные природные. Например, регенерированная целлюлоза, т.е. целлюлоза, полученная в виде изделия после перевода её в растворимое состояние. В этом виде она известна под названиеями вискозный и медноаммиачный щёлк.
Синтетические полимеры получают искусственным путём из низкомолекулярных соединений – мономеров.
Синтез полимеров возможен в том случае, если молекула исходного вещества способна взаимодействовать по крайней мере с двумя другими молекулами, т.е., если исходное вещество не менее, чем бифункционально.
Функциональность вещества определяется числом функциональных групп:
-ОН, -С-Н, -С-ОН, -NH2 =NH, -SO3H, -SH и т.д., содержащихся в одной молекуле.
║ ║
О О
Например, С2Н5ОН - этиловый спирт, является монофункциональным веществом.
Бифункциональное вещество НО-С2Н4-ОН - этиленгликоль;
Трифункциональное вещество НО – СН2-СН(ОН) – СН2ОН - глицерин.
Функциональность вещества может определяться также наличием в его молекулах двойных или тройных связей или подвижных атомов водорода. Например, этилен СН2=СН2 бифункционален, ацетилен СН≡СН тетрафункционален.
Бифункциональные соединения, взаимодействуя друг с другом, образуют молекулы, обладающие опять двумя функциональными группами и поэтому способные к дальнейшему взаимодействию. Молекулы полимеров, синтезированные из бифункциональных соединений, имеют линейное строение. Если же функциональность исходного соединения больше двух, то получаются разветвлённые или сетчатые полимеры.
Полимеры, макромолекулы которых построены из одинаковых по химической строению мономеров, называют гомополимерами, а построенные из разных –сополимерами.
По строению главной цепи все полимеры делятся на гомоцепные (например, карбоцепные – полиэтилен, полипропилен, полистирол, полиметилметакрилат, поливинилхлорид и т.п.), в которых основная цепь построена из одинаковых атомов, и гетероцепные, в которых основная цепь построена из различных атомов. Существует два метода синтеза полимеров: полимеризация и поликонденсация. Полимеризацией называют процесс синтеза полимеров, основанный на элементарной реакции присоединения, а поликонденсацией –основанный на элементарной реакции замещения.
Схематично процесс полимеризации можно представить следующим образом:
x R-CH=CH2 → -(-CH-CH2 -)x-
│
R
Если R является Н, то полимер → полиэтилен, если R – CH3 то полипропилен, бензольное кольцо С6Н5 → полистирол, группа ОН → поливиниловый спирт и т.д.
В соответствии с представленной схемой к реакциям полимеризации особенно склонны соединения с кратными связями (виниловые соединения). Наряду с виниловой полимеризацией существует полимеризация циклов, миграционная полимеризация и др..
Процесс поликонденсации схематично можно представить следующим образом: x a-A-a + x b-B-b → -(-A-B-)x + 2x ab
В отличие от полимеризационных полимеров элементарный состав конденсационных полимеров не совпадает с составом исходных веществ, т.к. процесс полимеризации сопровождается выделением низкомолекулярных продуктов.
Основные достижения последних десятилетий в области полимеров связаны именно с синтезом методами поликонденсации ароматических гетероцепных и, особенно, гетероциклических высокопрочных термостойких полимеров. Примером ароматических гетероцепных полимеров могут служить ароматические полиамиды, которые получают поликонденсацией ароматических дикарбоновых кислот или их хлорангидридов и диаминов:
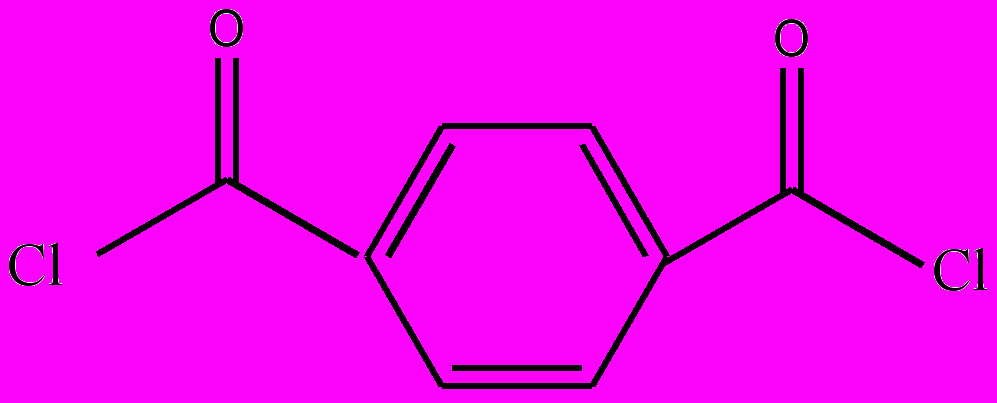 + H2N-(CH2)n-NH2 → -[- HN-(CH2)n-NH-C(O)C6H4-C(O)-]- + HCl
+ H2N-(CH2)n-NH2 → -[- HN-(CH2)n-NH-C(O)C6H4-C(O)-]- + HCl Примером гетероциклического полимера являются полиимиды, которые получают поликонденсацией диаминов с тетракарбоновыми кислотами или их хлорангидридами:
 + H2N-(R)n-NH2 →
+ H2N-(R)n-NH2 →  + H2O и т.д.
+ H2O и т.д.Свойства полимеров определяются и объясняются их цепным строением. Так, из трёх агрегатных состояний веществ – твёрдого, жидкого и газообразного, полимерам присущи только твёрдое и жидкое. Газообразное состояние для полимеров неизвестно. Это связано с тем, что суммарная величина взаимодействия макромолекул друг с другом, так называемая энергия когезии, выше, чем прочность химической связи и при нагревании испарению полимера предшествует его деструкция, т.е. распад макромолекул на фрагменты меньшей молекулярной массы.
С термодинамической точки зрения следует различать фазовые состояния вещества. Фазы отличаются друг от друга термодинамическими свойствами, например, термодинамическими потенциалами. Обычно различают фазы трёх типов: твёрдые, жидкие и газообразные. Все твёрдые фазы имеют кристаллическое строение. Для полимеров фазовые и агрегатные состояния могут не совпадать. Так, твёрдому агрегатному состоянию может соответствовать два фазовых состояния – кристаллическое (твёрдое) и аморфное (жидкое). Наоборот, жидкому фазовому состоянию могут соответствовать два агрегатных состояния: жидкое (расплав) и твёрдое (стеклообразное, аморфное, т.е. не кристаллическое).
Гибкость цепных молекул обеспечивает существование ещё и различных физических состояний аморфных полимеров. Известно три типа таких состояний: стеклообразное, высокоэластическое и вязко-текучее. Полимерный материал переходит из одного состояния в другое при изменении температуры. Каждому физическому состоянию соответствуют свои механические свойства. Наблюдая изменение соответствующих характеристик, например, модуля упругости или деформируемости, можно различать состояния, присущие данному полимеру.
При охлаждении расплава полимера, находящегося в вязко-текучем состоянии, вязкость повышается. Если по какой-либо причине полимер не закристаллизуется, то при достижении вязкости ≈ 1013 сантипуаз полимер застеклуется, т. е. превратится в твёрдое тело. Этот переход отражается на зависимости различных характеристик от температуры: на модуле упругости, деформации, электропроводности, диэлектрических показателях, теплопроводности, теплоёмкости, плотности и т.п.
Вязкотекучее и стеклообразное состояния могут наблюдаться и у низкомолекулярных веществ, однако полимерам и только полимерам присуще высокоэластическое состояние.
Химическая стойкость полимерных материалов.
Полимерные материалы отличаются от традиционных неорганических материалов типом химической связи. Атомы в полимерных макромолекулах соединяются при помощи ковалентной связи, которая может быть разрушена химическими реагентами и физическими воздействиями – температурой, излучениями, механическими воздействиям. Химические превращения, приводящие к уменьшению молекулярной массы, называются деструкцией. Эти реакции ухудшают свойства полимеров. Деструкция может проходить при любых физических воздействиях. Она ускоряется, если дополнительно имеется контакт с агрессивными средами. Разрыв связей протекает по случайному закону и каждая связь в макромолекуле рвётся независимо от другой связи. Образующиеся осколки макромолекул существуют как устойчивые молекулы. Они могут самостоятельно вступать в реакции, например, в реакции сшивания с образованием сетчатых структур, могут продолжать деструктировать вплоть до мономеров – такой вариант деструкции называется деполимеризацией. В гетероцепных полимерах, содержащих в цепях функциональные группы, возможны реакции гидролиза, ацидолиза, аминолиза и др. Особенно это характерно для полимеров, синтезируемых методом поликонденсации. Это объясняется тем, что реакция поликонденсации по своей природе обратима: одновременно протекают два процесса – образование продуктов конденсации и их деструкция. Разрыв молекул понижает среднюю молекулярную массу полимера и изменяет характер распределения фракций по молекулярной массе – молекулярно-массовое распределение. Реакции сшивания, наоборот, приводят к постепенному повышению молекулярной массы вплоть до полной потери растворимости и способности переходить в высокоэластическое и, тем более, в вязкотекучее состояние.
В реальных условиях полимеры одновременно подвергаются нескольким видам воздействия. Обычно указывают те виды воздействия, которые преобладают в выбранных условиях. Наиболее подробно изучена деструкция полимеров под влиянием различных окислительных агентов (окислительная деструкция), термического (термодеструкция), радиационного (радиационная деструкция, радиолиз), механического (механодеструкция) воздействий.
Процессы деструкции можно классифицировать не только по видам внешних воздействий на полимер, но и по характеру протекания химических реакций в полимерах под действием этих факторов. Реакции деструкции можно рассматривать как обратные реакциям синтеза полимеров. А синтез полимеров может протекать по ступенчатому или цепному механизму. Если при ступенчатом механизме наблюдаются беспорядочный, случайный разрыв химических связей, то при цепном механизме на один акт разрыва макромолекулы приходится несколько актов распада химических связей в других местах макромолекулы. Инициирование цепной деструкции происходит под влиянием факторов, вызывающих образование радикалов или ионов в цепях полимера.
Существуют общие закономерности деструкционных процессов, характерные для любых полимерных материалов.
Физико-химические основы взаимодействия полимеров с агрессивными средами.
При взаимодействии полимеров с агрессивными средами может протекать ряд физических и химических процессов, из которых наиболее важные:
- адсорбция компонентов агрессивной среды на поверхности полимера;
- диффузия агрессивной среды в объём полимера;
- химические реакции агрессивной среды с химически нестойкими связями полимера;
- диффузия продуктов реакции к поверхности полимера;
- десорбция продуктов реакции с поверхности полимера.
Сорбционно-диффузионные процессы в полимерах.
При движении отдельных сегментов макромолекул в полимере образуются микропустоты. Кроме того, полимер может содержать поры, тонкие капилляры и другие дефекты. Агрессивная среда через все эти образования может проникнуть вглубь полимера.
Для описания сорбционно-диффузионных процессов используют три параметра: коэффициент диффузии D, коэффициент проницаемости Р и коэффициент растворимости S, которые связаны между собой соотношением
Р = D . S
Полимеры обычно имеют относительно малую пористость ≈ 0,1 см3/г. Величина сорбции зависит от степени кристалличности – сорбция протекает по аморфным областям и по дефектам кристаллов.
Природа агрессивной среды, её агрегатное состояние, химический состав, размеры и конфигурация молекул влияют на интенсивность сорбционно-диффузионных процессов.
Чаще всего агрессивные среды являются многокомпонентными, например, водные растворы солей, кислот, оснований. По отношению к воде полимеры можно разделить на 3 группы:
- хорошо растворяющие воду (50% Н2О), например, поливиниловый спирт;
- ограничено растворяющие воду (1 – 50% Н2О) – полиамиды, полиэпоксиды и др.;
- плохо растворяющие воду ( 1%) – большинство промышленных полимеров.
Первые и вторые относятся к гидрофильным, третьи – к гидрофобным полимерам.
Действие агрессивных сред на полимерные материалы.
По действию на полимер агрессивные среды можно разделить на физически- и химически активные.
Физически активные вызывают адсорбцию и сорбцию. Адсорбция изменяет поверхностную энергию на границе полимер – среда, сорбция ослабляет межмолекулярное взаимодействие вплоть до растворения. В результате изменяются механические, реологические и электрические свойства. Если не произошло растрескивания полимера (эффект Ребиндера), то изменения могут быть обратимыми.
Химически активные среды вызывают необратимые изменения химической структуры – деструкцию, деполимеризацию, сшивание, структурирование. полимераналогичные превращения.
Обычно исследователей интересует, какова стойкость полимера к агрессивной среде и каков механизм взаимодействия со средой.
К окислителям (О2, О3, R–O-O-R, кислоты, соли) в принципе неустойчивы все полимеры. Этот тип взаимодействий называют «термоокислительная деструкция».
К воде и водным растворам в принципе неустойчивы гетероцепные полимеры и устойчивы карбоцепные, не имеющие кратных связей. Чистая вода очень слабо гидролизует полимеры, водные растворы обладают значительно большей активностью.
В зависимости от соотношения скоростей диффузии и химической реакции процесс может протекать:
- во внутренней диффузионно-кинетической области, т.е. реакционная зона увеличивается во времени и в итоге распространяется на весь объём полимера. V диф. V химической реакции;
- во внутренней кинетической области. Здесь V диф = V химической реакции;
- во внешней диффузионно-кинетической области, V диф. V химич. реакции. Здесь реакция протекает в тонком поверхностном слое постоянного размера.
Наиболее правильно оценивать химическую стойкость по кинетическим (Кскор, Еактив), диффузионным, сорбционным, механическим, электрическим и т.п. параметрам. Знание этих параметров позволяет определить механизм взаимодействия и, следовательно, прогнозировать изменение свойств во времени.
Однако часто идут более простым путём и производят качественную оценку с помощью балльной системы. Существуют 3-х, 4-х., 5-ти балльные системы. Так, в 3-х балльной системе используют 3 показателя: набухание (%), динамическую ползучесть (%) и долговечность (часы) в условиях многократных деформаций. Долговечность – это промежуток времени, в течение которого материал в условиях эксплуатации изменяет свои свойства до оговоренного уровня. Каждый из показателей оценивают по трём баллам, затем баллы суммируют. Устойчивость характеризуют баллом 1, неустойчивость – баллом 3.
Четырёхбалльная система оценки химической стойкости считается наиболее целесообразной. Она содержит следующие оценки: вполне стойкие (В), стойкие (С), относительно стойкие (О) и нестойкие (Н).
Вопросы для самопроверки.
1. Какие вещества называют полимерами? Олигомерами?
2. Какие виды классификации полимеров Вам известны?
3.Что такое «функциональность» молекулы? Какая функциональность у этана, этилена, ацетилена?
4. В чём отличие полимеризации от поликонденсации?
5. Агрегатные, фазовые и физические состояния полимеров.
6. Что такое деструкция полимеров? Какие виды деструкции Вам известны?
7.Каковы общие закономерности процессов деструкции? Какими путями можно влиять на кинетику деструкционных процессов?
2. Приложения
ПРИЛОЖЕНИЕ 1
Термодинамиические характеристики некоторых веществ
| Вещество | ΔН0f, 298 кДж/моль | S0298 Дж/моль К | ΔG0f, 298 кДж/моль |
| ZnO (k) | -349 | 43,5 | -318,23 |
| ZnS (k) | -201 | 57,7 | -198,21 |
| SO2 (г) | -296,9 | 248,1 | -300,2 |
| NH4Cl (к) | -315,39 | 94,56 | -203,2 |
| NH3 (г) | -46,19 | 192,5 | -16,64 |
| HCl (г) | -92,3 | 186,7 | -94,83 |
| СuO (к) | -162 | 42,63 | -129,4 |
| Cu2O (к) | -173,2 | 92,93 | -150,5 |
| О2 (г) | 0 | 205,04 | 0 |
| Н2О (ж) | -285,84 | 69,96 | -237,3 |
| СН3СООН (р) | -484,09 | 159,83 | -396,7 |
| СН3СОО- (р) | -485,64 | 87,58 | -369,36 |
| Н+ (р) | 0 | 0 | 0 |
| ОН- (р) | -230,02 | -10,71 | -157,35 |
| SO3 (г) | -395,85 | 256,69 | -371,17 |
| NO (г) | 90,37 | 210,62 | 86,69 |
| СН4 (г) | -74,85 | 186,27 | -50,85 |
| СО2 (г) | -393,51 | 210,6 | -394,47 |
| N2 (г) | 0 | 191,5 | 0 |
| Н2О (г) | 1241,84 | 188,74 | -228,66 |
| Cl2 (г) | 0 | 222,98 | 0 |
ПРИЛОЖЕНИЕ 2.
| Константы диссоциации слабых электролитов. | Произведение растворимости | Константы нестойкости комплексов. | |||
| Вещество | Кд | Тв. фаза | Кс (ПР) | Комплекс | Кн |
| CH3COOH | 1.75 10-5 | AgCl | 1 10-10 | Al(OH)4- | 1 10-33 |
| H2S (I) | 5.7 10-8 | HgI2 | 1 10-26 | Cu(OH)42- | 3 10-15 |
| (II) | 1.2 10-14 | MgCO3 | 2 10-4 | HgI42- | 1 10-30 |
| H2SO3 (I) | 1.6 10-2 | PbCO3 | 8 10-14 | AgCl2- | 1 10-5 |
| (II) | 6.2 10-8 | CuS | 4 10-38 | | |
| H2CO3 (I) | 4.45 10-7 | MnS | 2 10-15 | | |
| (II) | 4.7 10-11 | Cu(OH)2 | 2 10-20 | | |
| PbOH+ | 3.0 10-8 | Fe(OH)2 | 2 10-15 | | |
| MnOH+ | 5.0 10-4 | Pb(OH)2 | 5 10-16 | | |
| ZnOH+ | 4.0 10-5 | Al(OH)3 | 4 10-33 | | |
| NH4OH | 1.8 10-5 | Cr(OH)3 | 7 10-31 | | |
