Учебное пособие к дисциплине для студентов заочной формы обучения по специальности 140211 «Электроснабжение»
| Вид материала | Учебное пособие |
- Учебное пособие к дисциплине для студентов заочной формы обучения по специальности, 1856.64kb.
- Методические указания к дисциплине и задания к контрольной работе для студентов заочной, 126.92kb.
- Методические указания к дисциплине и темы рефератов для студентов заочной формы обучения, 102.72kb.
- Учебное пособие для студентов заочной формы обучения Санкт-Петербург, 1247.83kb.
- Методические указания к итоговому междисциплинарному экзамену по специальности «электроснабжение», 382.82kb.
- Н. Н. Кувшинова экология учебное пособие, 1072.88kb.
- Учебное пособие для самостоятельной работы студентов специальности 040600 «Сестринское, 1354.95kb.
- Методические указания: краткий курс лекций для студентов заочной формы обучения Санкт-Петербург, 1540.61kb.
- Учебное пособие Для студентов всех специальностей Москва 1999, 1603.73kb.
- Учебное пособие для студентов специальности «Экономика и управление на предприятии», 1271.5kb.
[1] Раздел 2
[2] Разделы 5 и 6.
[3] Раздел 3
Краткое содержание и методические указания к теме 2.
Основные понятия.
Наука об условиях протекания процессов, сопровождающихся изменением энергии, называется термодинамикой.
Термодинамическая система - совокупность изучаемых объектов (веществ, тел ), отделенных от окружающей среды физической или мысленной границей.
Система, которая не обменивается с окружающей средой ни веществом, ни энергией, называется изолированной.
Состояние системы характеризуется совокупностью физических величин - термодинамических параметров: температурой ( Т ), давлением ( p ), объемом ( V ), концентрациями веществ ( С ) и др., а также функциями состояния - величинами, зависящими от параметров системы. К функциям состояния относятся: внутренняя энергия ( U ), энтальпия ( H ), энтропия ( S ), энергия Гиббса ( G ).
Параметры и функции состояния системы характеризуют свойства системы и не зависят от способа достижения данного состояния, т.е. их значения определяются только начальным и конечным состояниями системы и не зависят от пути перехода из начального состояния в конечное.
Любое изменение состояния системы (т.е. изменение хотя бы одного параметра) называется термодинамическим процессом.
В зависимости от поддерживаемых постоянных параметров различают процессы: изотермические ( T = const ), изобарные ( p = const ), изохорные ( V= const ), адиабатические ( Q = 0 ). В зависимости от направления передачи теплоты процессы квалифицируют как экзотермические (выделение теплоты ) и эндотермические
( поглощение теплоты ).
Первое начало термодинамики.
Любая система обладает запасом внутренней энергии (U), которая складывается из потенциальных и кинетических энергий всех частиц, составляющих данную систему.
Первое начало термодинамики имеет много формулировок. Вот некоторые из них:
- в любой изолированной системе запас энергии остаётся постоянным;
- вечный двигатель первого рода невозможен, т.е. невозможно построить машину, которая производила бы механическую работу, не затрачивая на это соответствующего количества энергии;
- изменение внутренней энергии системы ( U = Uкон Uисх ) происходит за счет теплоты, полученной системой ( Q ), и работы ( W ), совершенной над ней :
U = Q + W ( 1 )
Внутренняя энергия зависит только от параметров системы и является функцией ее состояния, теплота и работа в общем случае зависят от пути протекания процесса и не являются функциями состояния системы.
Положительному значению теплоты соответствует теплота, полученная системой, т.е. для эндотермического процесса Q 0, для экзотермического процесса Q 0.
Химические реакции в большинстве случаев сопровождаются только механической работой расширения системы Wмех = p V. Положительному значению механической работы ( Wмех 0 ) отвечает работа системы над окружающей средой ( работа расширения, V 0 ). Если работа производится над системой ( работа сжатия, V 0 ), то Wмех 0.
Учитывая это, для систем, в которых возможна только работа расширения, выражение первого начала термодинамики принимает вид:
U = Q p V ( 2 )
Для изолированной системы: Q = 0, W = 0, следовательно U = 0, таким образом внутренняя энергия изолированной системы постоянна.
Тепловые эффекты химических реакций.
Тепловые эффекты химических реакций изучает раздел термодинамики, называемый термохимией.
Количество выделенного ( или поглощенного ) тепла в химическом процессе называется теплотой реакции.
Из уравнения (2) следует, что теплота изохорного процесса (V = const, V = 0) равна изменению внутренней энергии системы:
Qv = U ( 3 ),
теплота изобарного процесса равна изменению энтальпии системы :
Qp = U + pV = ( U + pV ) = H, ( 4 )
где H = U + pV - энтальпия системы.
Таким образом, теплота изохорного или изобарного процессов являются функциями состояния системы.
Уравнения ( 3 ) и ( 4 ) обосновывают экспериментально установленный закон Гесса:
теплота химической реакции ( в изохорном и изобарном процессе ) не зависит от пути протекания реакции, а определяется только исходным и конечным состояниями системы ( т.е. видом и состоянием исходных и конечных веществ ).
Это означает, что теплота реакции равна сумме теплоты всех ее промежуточных стадий. Пользуясь этим, можно вычислить тепловые эффекты процессов, экспериментальное изучение которых по тем или иным причинам невозможно.
ПРИМЕР 1. В реакции нейтрализации слабой уксусной кислоты:
CH3COOH + NaOH = CH3COONa + H2O
( a ) CH3COOH + OH = CH3COO + H2O, Ha
можно выделить две стадии:
( б ) диссоциация CH3COOH = CH3COO + H+, Hб
( в ) нейтрализация H+ + OH = H2O, Hв
Реакция ( а ) представляет собой сумму реакций ( б ) и ( в ), и из закона Гесса следует, что Hа = Hб + Hв.
Диссоциация слабой кислоты ( реакция ( б )) не протекает до конца, поэтому измерить теплоту этой реакции невозможно, однако, определив экспериментально теплоту нейтрализации слабой кислоты ( Hа ) и сильной кислоты ( Hв ), можно рассчитать теплоту реакции диссоциации слабой кислоты: Hб = Hа Hв.
Величины внутренней энергии, энтальпии и, следовательно, тепловых эффектов реакций зависят от состояния веществ и параметров системы, поэтому для возможности их сравнения вводятся понятия стандартного состояния вещества и стандартных условий.
Стандартным состоянием называется состояние индивидуального вещества в наиболее устойчивой его форме при давлении р = 101325 Па ( 1 атм ), для растворенного вещества - при его концентрации в растворе, равной 1 моль/л.
Стандартными условиями считаются нормальное атмосферное давление
р = 101325 Па и температура Т = 298,15 К ( 25 С ).
Стандартной теплотой ( энтальпией ) образования химического соединения называют тепловой эффект реакции образования одного моля этого соединения из простых веществ в стандартном состоянии. Обозначается Нf,298 , единицы измерения кДж/моль .
Из этого определения следует, что стандартная энтальпия образования простых веществ равна нулю. Стандартные энтальпии образования соединений приводятся в термодинамических таблицах ( см. приложение ).
Из закона Гесса следует, что
теплота реакции равна сумме энтальпий образования продуктов реакции минус сумма энтальпий образования исходных веществ.
Для химической реакции в общем виде:
a1A1 + a2A2 + = b1B1 + b2B2 +
стандартная теплота рассчитывается по уравнению:
Нх.р. = bi Нf,298( Bi ) aj Нf,298( Aj ), ( 5 )
прод исх
где аj и bi - стехиометрические коэффициенты исходных веществ
и продуктов реакции соответственно;
Нf,298( Aj ) и Нf,298( Bi ) - стандартные энтальпии образования
исходных веществ и продуктов реакции.
ПРИМЕР 2. Рассчитайте стандартную теплоту реакции:
2 ZnS(т) + 3 O2(г) = 2 ZnO(т) + 2 SO2(г)
Для расчета воспользуемся уравнением ( 5 ):
Нх.р. = 2 Нf,298( ZnO ) + 2 Нf,298( SO2 ) - 2 Нf,298( ZnS ) - 3 Нf,298( O2 )
Значения энтальпий образования веществ выписываем из термодинамической таблицы
( см. приложение 1).
Тогда Нх.р. = 2 ( -349.0 ) + 2 ( -296.9 ) - 2 ( -201.0 ) - 3( 0 ) = -889.8 кДж
Нх.р 0 - реакция экзотермическая.
Большинство физико-химических процессов обратимо, т.е. в зависимости от условий они могут протекать как в прямом, так и в обратном направлении.
Самопроизвольным процессом называют процесс, протекающий без воздействия внешних сил, в отличии от не самопроизвольного ( вынужденного ) процесса, протекающего только при поступлении в систему энергии из окружающей среды.
Любой самопроизвольный процесс стремится привести систему в состояние равновесия - состояние, из которого система не может выйти без внешнего воздействия.
Возможности, направление и предел протекания самопроизвольных процессов устанавливает второе начало термодинамики.
Второе начало термодинамики.
И для второго начала термодинамики существует несколько формулировок:
- невозможен процесс, при котором теплота переходила бы самопроизвольно от тел более холодных к телам более нагретым (формулировка Р. Клаузиса, 1830г.)
- невозможно теплоту какого-либо тела превратить в работу, не производя никакого другого действия, кроме охлаждения этого тела;
- для любого реального процесса невозможно найти способ возвращения системы в первоначальное состояние, т.е. любой реальный процесс в термодинамике считается необратимым; (формулировки У. Томсона, 1851 г.);
Существует функция состояния ( свойство ) системы - энтропия ( S ), изменение которой для самопроизвольного процесса связано с поглощенной теплотой и температурой системы соотношением:
S Q/T ( 6 )
Для изолированной системы теплообмен с окружающей средой отсутствует
(Q = 0 ), следовательно:
- в изолированной системе процессы могут протекать только в сторону возрастания энтропии ( S 0 ), равновесию соответствует максимальное значение энтропии системы (S = 0).
Энтропия связана с хаотическим ( тепловым ) движением в системе ( является мерой молекулярного хаоса ) и зависит от числа частиц в системе, температуры, объема и агрегатного состояния вещества. Величина энтропии системы определяется уравнением Больцмана:
S = k ln w ( 7 ), где k = R/NA - постоянная Больцмана, w - термодинамическая вероятность - число способов, которым общий запас внутренней энергии системы может быть распределен по доступным уровням энергии всех частиц, составляющих систему.
При температуре Т = 0 К прекращается любое тепловое движение материи. В этих условиях частицы, составляющие правильный кристалл индивидуального вещества могут быть размещены единственным способом ( w = 1 ), следовательно: энтропия правильно образованного кристалла чистого вещества при абсолютном нуле температуры равна нулю ( постулат Планка или третий закон термодинамики ).
С повышением температуры число возможных состояний быстро увеличивается, что приводит к возрастанию энтропии. При переходе твердого вещества в жидкость (плавлении) энтропия вещества возрастает на : Sпл = Hпл /Tпл 8 Дж/(моль К), при испарении вещества ( переходе жидкость пар ) возрастание энтропии более значительно: S исп = H исп /T кип 90 Дж/(моль К). Таким образом, для значений энтропии вещества в различных фазовых состояниях всегда выполняется соотношение:
S тв S жидк S газ.
Абсолютные значения энтропии веществ в стандартном состоянии S298 в Дж/(моль К) приводятся в термодинамических таблицах ( см. приложение ).
Т.к. энтропия является функцией состояния, для химической реакции:
a1A1 + a2A2 + = b1B1 + b2B2 + ( * )
изменение энтропии рассчитывается по уравнению:
Sх.р. = bi S298( Bi ) aj S298( Aj ), ( 8 )
прод исх
где аj и bi - стехиометрические коэффициенты исходных веществ
и продуктов реакции соответственно;
S298( Bi ) и S298( Aj ) - стандартные энтропии исходных веществ и продуктов реакции.
Определение направления химической реакции.
Объединяя выражения первого начала термодинамики ( U = Q + W ) и второго начала для самопроизвольного процесса ( S Q/T ), получаем:
U – W T S ( 9 )
В случае химической реакции, протекающей при постоянных давлении и температуре, а также при отсутствии всех видов работ кроме работы расширения ( W = - p V ), уравнение (4) переходит в: U + p V – T S 0 (10 )
Величина U + p V – T S = H – T S = G называется энергией Гиббса.
Таким образом, самопроизвольный процесс всегда сопровождается уменьшением энергии Гиббса системы, иными словами – условие G 0 является термодинамическим критерием возможности самопроизвольного протекания процесса (при p = const, T = const).
В состоянии равновесия энергия Гиббса системы принимает минимальное значение и не изменяется, т.е. G = 0.
Энергия Гиббса является функцией состояния системы, поэтому для реакции ( * ) стандартное изменение G можно рассчитать по уравнению:
Gх.р. = bi Gf,298( Bi ) aj Gf,298( Aj ), ( 11 )
прод исх
где аj и bi - стехиометрические коэффициенты исходных веществ
и продуктов реакции соответственно;
Gf,298( Bi ) и Gf,298( Aj ) - стандартные энергии Гиббса образования исходных веществ и продуктов реакции.
Стандартная энергия Гиббса образования соединения определяется как изменение энергии Гиббса реакции получения одного моля этого соединения из простых веществ в стандартном состоянии. Из определения следует, что стандартные энергии Гиббса образования простых веществ равны нулю. Величины стандартных энергий Гиббса образования веществ приводятся в термодинамических таблицах ( см. приложение ).
Из определения энергии Гиббса следует, что соотношение между стандартными термодинамическими функциями химической реакции выражается уравнением:
G Т = H Т – Т ST ( 12 )
Вопросы для самопроверки
- Какие параметры термодинамической системы являются функциями состояния?
- Что называется термодинамическим процессом?
- Приведите известные Вам виды термодинамических процессов.
- Является ли теплота и работа функциями состояния?
- Приведите формулировку первого начала термодинамики.
- Что является предметом изучения термохимии?
- Сформулируйте закон Гесса.
- Что такое «стандартная теплота образования химического соединения»?
- О чём говорит второе начало (второй закон) термодинамики? Как изменяется энтропия в изолированной системе?
- Что утверждает третий закон термодинамики?
- Каков критерий возможности самопроизвольного протекания термодинамического процесса?
КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
Скорости и механизмы протекания химических реакций изучает химическая кинетика
Скорость реакции ( v ) определяется числом молей вещества ( n ), превращенного за единицу времени ( t ) в единице объема ( V )
1 n
v = ( 15 )
V t
При постоянном объеме системы выражение ( 1 ) переходит в : v = C/t,
где С - молярная концентрация вещества моль/л .
При химической реакции концентрации исходных веществ убывают ( Сисх 0 ), а продуктов реакции - возрастают ( Спрод 0 ), поэтому для величины v можно записать два равноценных выражения: v = - Cисх/t = + Cпрод/t.
Однородная часть системы ( жидкая, твердая , газообразная) называется фазой.
Реакция, протекающая в системе, состоящей из одной фазы, называется гомогенной реакцией. Реакция, в которой участвует несколько фаз, называется гетерогенной.
Скорость реакций зависит от следующих основных факторов: природы реагентов, концентрации реагирующих веществ, температуры и присутствия катализаторов.
Влияние концентрации реагирующих веществ.
Зависимость скорости реакции от концентрации реагирующих веществ определяется законом действия масс ( ЗДМ ):
скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях их стехиометрических коэффициентов, если уравнение реакции соответствует механизму проходящей реакции.
В общем виде для гомогенной реакции: aA + bB продукты
скорость равна: а b
v = k CA CB , ( 16 )
где k - константа скорости реакции.
Для реакций с участием газообразных веществ принято использовать выражение ЗДМ через парциальные давления веществ РА и РВ [ Па ]: а b
v = k РА РВ
Константа скорости реакции равна скорости реакции при концентрации всех реагентов, равных единице. Константа скорости зависит от природы веществ и температуры, но не зависит от концентраций.
Сумма показателей степеней концентраций (a + b) в кинетическом уравнении ( 16 ) называется теоретическим порядком реакции.
ПРИМЕР 1. Химическая реакция H2(г) + I2(г) 2 HI(г) идет в одну стадию и в прямом и в обратном направлении, и ее механизм соответствует стехиометрическому уравнению. Как изменится скорость реакции при увеличении давления в системе в 2 раза?
Согласно ЗДМ, скорость прямой реакции: v = kпр CH 2 CI 2 ( порядок реакции = 2 ),
скорость обратной реакции: v = kобр C2 HI ( порядок реакции = 2 ).
При увеличении давления в 2 раза концентрации (парциальные давления) всех газообразных веществ увеличиваются в 2 раза, т.е. отношение скорости реакции после повышения давления к исходной скорости равно:
v2/v1 = (kпр2CH 2 2CI 2 ) /(kпрCH 2 CI 2 ) = 4.
Стехиометрическое уравнение реакции отражает лишь количественное соотношение между реагирующими веществами и не показывает механизма протекающего процесса. Реальный процесс обычно значительно сложнее, чем это отражено в стехиометрическом уравнении. Если химическая реакция протекает через несколько промежуточных стадий, то суммарная скорость реакции определяется наиболее медленной ( лимитирующей ) стадией.
ПРИМЕР 2. Реакция 2 NO(г) + 2 H2(г) = 2 H2O(г) + N2(г) идет в две стадии:
( 1 ) 2 NO + H2 = N2 + H2O2 ( медленная )
( 2 ) H2O2 + H2 = 2 H2O ( быстрая )
Первая стадия, являясь более медленной, определяет кинетическое уравнение всей реакции: v = k C2NO CH 2 , порядок реакции = 3 , а не 4 .
В гетерогенной системе с участием конденсированной ( твердой или жидкой) фазы химическая реакция идет на границе раздела фаз. Поверхностная концентрация молекул твердого (жидкого) вещества постоянна, поэтому скорость гетерогенной реакции зависит только от концентрации газообразных веществ. В связи с этим концентрации веществ, находящихся в конденсированной фазе, в кинетическое уравнение не входят.
ПРИМЕР 3. Для гетерогенной реакции CaO(к) + CO2(г) = CaCO3(к) скорость определяется кинетическим уравнением v = k CCO 2 .
Влияние температуры на скорость реакции.
С повышением температуры скорости химических реакций сильно возрастают.
Существует эмпирическое правило Вант-Гоффа:
при повышении температуры на 10 С скорость реакции ( константа скорости ) увеличивается в 2 - 4 раза.
Математически правило Вант-Гоффа можно записать следующим образом:
v2 k2 T /10
= = , ( 17 )
v1 k1
где = 2 4 - температурный коэффициент реакции,
v1 и v2 ( k1 и k2 )-скорости ( константы скорости ) реакций
при температурах Т1 и Т2 соответственно, Т = Т2 - Т1.
ПРИМЕР 4. Как изменится скорость реакции при увеличении температуры на 30 С, если температурный коэффициент скорости реакции = 3?
T = 30, т.о. скорость реакции увеличится в vT+30/vT = 330/10 = 27 раз.
Правило Вант-Гоффа приближенное. Более точно температурная зависимость скорости реакции выражается уравнением Аррениуса: ln k = ln k0 - Eакт/ (RT)
где k0 - предэкспоненциальный множитель,
Еакт - энергия активации,
R - универсальная газовая постоянная.
Энергия активации - минимальная избыточная энергия взаимодействующих частиц, необходимая для протекания реакции ( рис. 1, а ).
 E
E
Еакт
 а Рис. 1. Изменение энергии в ходе
а Рис. 1. Изменение энергии в ходе 
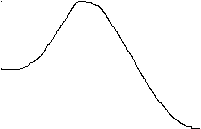
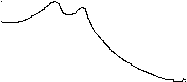 некаталитической ( а ) и
некаталитической ( а ) и  исх б каталитической ( б ) реакций.
исх б каталитической ( б ) реакций. 
прод

ход реакции
Зная температурный коэффициент реакции ( ) в интервале температур от Т1 до
Т2 = Т1+10, можно оценить величину энергии активации по уравнению:
Еакт 0,1 R T1 T2 ln ( 18 )
При увеличении температуры на 10 оС количество взаимодействующих молекул, имеющих энергию больше энергии активации, увеличивается в 2 – 4 раза. В этом заключается влияние температуры на скорость химических реакций.
Катализ.
Многие химические реакции, вполне возможные с точки зрения термодинамики, протекают с малой скоростью. В присутствии некоторых веществ скорость реакции резко возрастает, хотя в стехиометрическом уравнении реакции эти вещества отсутствуют.
Подобные вещества, оказывающие влияние на скорость процесса, но формально в нем не участвующие, называются катализаторами. ( Вещества, уменьшающие скорость реакции, называются ингибиторами).
Если катализатор находится в одной фазе с реагентами, говорят о гомогенном катализе, если реагенты и катализатор находятся в разных фазах - о гетерогенном катализе.
Скорость реакции в присутствии катализатора возрастает за счет снижения энергии активации ( рис. 1, б ). Это приводит к увеличению скоростей как прямой, так и обратной реакций. При этом не происходит изменения направления реакции и смещения состояния химического равновесия, увеличивается лишь скорость его установления.
В гомогенном катализе влияние катализатора сводится к образованию промежуточных соединений на первой стадии и конечного продукта с выделением катализатора - на второй.
ПРИМЕР 5. Реакция разложения пероксида водорода Н2О2 в присутствии хромата калия K2CrO4 протекает в две стадии, но суммарно выражается химическим уравнением следующим образом:
2 Н2О2 = 2 H2O + O2 , так как
катализатор, вступая в реакцию на первой стадии, полностью выделяется на второй ( в результате реакции катализатор не расходуется ).
При гетерогенном катализе ускорение реакции происходит за счет активирования молекул при их адсорбции на поверхности катализатора. Теория гетерогенного катализа не нашла еще своего завершения, поэтому разработка катализаторов для того или иного процесса является результатом длительных экспериментов.
Катализаторы характеризуются избирательностью ( селективностью ), т.е. ускоряют одни процессы, мало влияя на другие. В присутствии различных катализаторов превращение одного и того же вещества может идти в различных направлениях.
ПРИМЕР 6. Разложение этилового спирта может идти по трем различным механизмам.
В зависимости от природы катализатора происходит ускорение (преимущественное протекание) соответствующей реакции:
Al2O3 H3PO4
C2H4 + H2O C2H5OH (C2H5)2 + H2O
этилен Cu, Ni диэтиловый эфир
CH3CHO + H2
Ацетальдегид
Вопросы для самопроверки.
- Что такое «скорость химической реакции»?
- Какие факторы влияют на скорость химической реакции?
- Что такое «константа скорости химической реакции» и от каких факторов она зависит?
- В чём причина влияния температуры на скорость химических реакций?
- В чём отличие катализаторов от ингибиторов?
- В чём заключается действие катализаторов химических реакций?
Химическое равновесие.
Состояние химического равновесия достигается при равенстве скоростей прямой и обратной реакций ( кинетическое условие равновесия ), при этом состав системы остается постоянным, а значение энергии Гиббса достигает минимального значения и со временем не изменяется ( G = 0 - термодинамическое условие равновесия ).
Основным законом химического равновесия является закон действия масс ( ЗДМ ), который в случае гомогенной реакции можно сформулировать следующим образом:
отношение произведения равновесных концентраций ( парциальных давлений - для газовых реакций ) продуктов реакции в степени их стехиометрических коэффициентов к аналогичному произведению для исходных веществ при данной температуре есть величина постоянная.
Т.о. для химической реакции ( * ):
B1 b1 B2 b2 .... П Bi bi Р(В1)b1 Р(В2)b2 .... П Р(Вi)bi
Кc = = ; Кр = = ( 13 )
A1 a1 A2 a2 .... П Aj aj Р(A1)a1 Р(A2)a2 .... П Р(Aj)aj
где Кс и Кр – константы равновесия реакции, выраженные соответственно через
равновесные концентрации и равновесные парциальные давления веществ.
Величина константы равновесия указывает на степень протекания реакции ( слева направо ): если Кс(Кр) 1, то в равновесной смеси преобладают продукты реакции, если выполняется обратное соотношение Кс(Кр) 1 – в равновесной смеси преобладают исходные реагенты.
!!!Для гетерогенных реакций с участием газообразных веществ концентрации ( парциальные давления ) веществ, находящихся в конденсированной фазе ( жидкой или твердой ) считаются величинами постоянными и в выражение константы равновесия не входят!!!
Константа равновесия связана с термодинамическими параметрами системы уравнением изотермы химической реакции: GT - RT ln KpT = - 2.3 RT lg Kp ( 14 )
Смещение химического равновесия.
При изменении условий протекания реакции ( состава смеси, давления, температуры ) состояние равновесия смещается в сторону протекания прямой ( слева направо ) или обратной ( справа налево ) реакции.
Направление смещения равновесия в качественной форме подчиняется принципу Ле-Шателье: изменение условий в равновесной системе приводит к смещению равновесия в направлении протекания процесса, ослабляющего произведенное воздействие.
а). Влияние состава реакционной смеси.
При увеличении концентраций ( парциальных давлений ) исходных веществ или при уменьшении концентраций продуктов реакции равновесие смещается в сторону протекания прямой реакции ( вправо );
при увеличении концентраций продуктов реакции или уменьшении концентраций исходных веществ равновесие смещается в сторону протекания обратной реакции
( влево ).
б). Влияние температуры.
При увеличении температуры равновесие смещается в сторону протекания эндотермической реакции ( Н 0 );
при уменьшении температуры равновесие смещается в сторону протекания экзотермического процесса ( Н 0 ).
в). Влияние общего давления в системе.
При увеличении общего давления ( уменьшении объема ) равновесие смещается в сторону протекания той реакции, при которой уменьшается количество газообразных веществ ( в сторону уменьшения суммарного объема газов ).
ПРИМЕР 1.
Для химической реакции: 2 ZnS(т) + 3 O2(г) = 2 ZnO(т) + 2 SO2(г)
А). определите направление самопроизвольного ее протекания в стандартных условиях.
Рассчитываем энергию Гиббса реакции по уравнению ( 6 ):
Gх.р., = 2 Gf,298(ZnO) + 2 Gf,298(O2) - 2 Gf,298(ZnS) - 3 Gf,298(SO2)
стандартные значения термодинамических величин выписываем из таблицы
( приложение ):
Gх.р., = 2 (-318.23) + 2 (-300.2) – 2 (-198.21) – 3 (0) = - 845.88 кДж 0, следовательно при стандартных условиях возможна прямая реакция.
Б). Определите направление протекания реакции при Т = 1000 К.
Т.к. условия отличны от стандартных, для расчета энергии Гиббса реакции воспользуемся уравнением ( 7 ) : GТ = HТ – Т ST , где Т = 1000 К
Значения теплоты реакции и изменение энтропии слабо зависят от температуры, поэтому можно принять, что : Hf, Т Hf,289, ST S298 , тогда:
H298 = - 889.8 кДж ( см. пример 2 предыдущей л.р. )
S298 = 2 SТ(ZnO) + 2 SТ( SO2) - 2 SТ(ZnS) - 3 SТ(O2) =
= 2 43.5 + 2 248.1 – 2 37.7 – 3 205.03 = - 147.29 Дж/К - 0.1473 кДж/К ( по ур. ( 3 ))
G Т = - 889.8 – 1000 (- 0.1473 ) = - 742.5 кДж 0, следовательно при 1000 К реакция идет в прямом направлении.
В) Напишите выражение константы равновесия Кр и рассчитайте ее значение для стандартных условий и при Т = 1000 К.
В соответствии с ЗДМ ( ур-ние 8 ) для гетерогенных реакций Кр = Р2(so2)/Р3(o2), остальные участники реакции – твердые вещества.
Величина константы равновесия рассчитывается по уравнению ( 9 ): lg Kp = - Gf, Т/2.3 R T
для Т = 298 К: lg Kp = - ( - 845880 ) /2.3 8.31 298 = 148.5 , Кр 10148
для Т = 1000 К: lg Kp = - ( - 742500 )/2.3 8.31 1000 = 38.8 , Кр 1039
Г). определите температурный интервал, в котором возможно протекание данной реакции.
Процесс возможен при условии G Т 0, следовательно, для определения температурного интервала, при котором реакция возможна, необходимо решить неравенство:
GТ = HТ – Т ST 0 относительно Т. Подставляя значения HТ и ST, полученные в п.А, получим Т HТ / ST = - 889.8/- 0.1473 = 6041 К
т.е. реакция может протекать в прямом направлении при температурах ниже 6041 К. Такая температура в обычных условиях недостижима, из чего можно сделать вывод о том, что данная реакция практически необратима.
Вопросы для самопроверки
1. Каково термодинамическое условие равновесия обратимых процессов?
2. Сформулируйте закон действия масс (ЗДМ). Как изменится выражение константы равновесия для гетерогенных реакций?
3. Сформулируйте принцип Ле-Шателье и поясните его применимость на примерах.
| Тема 3. Дисперсные системы. Общие свойства растворов, химическое равновесие в растворах, принцип Ле - Шателье. Растворы электролитов, сильные и слабые электролиты. Водородный показатель. Гидролиз |
