Учебное пособие к дисциплине для студентов заочной формы обучения по специальности 140211 «Электроснабжение»
| Вид материала | Учебное пособие |
- Учебное пособие к дисциплине для студентов заочной формы обучения по специальности, 1856.64kb.
- Методические указания к дисциплине и задания к контрольной работе для студентов заочной, 126.92kb.
- Методические указания к дисциплине и темы рефератов для студентов заочной формы обучения, 102.72kb.
- Учебное пособие для студентов заочной формы обучения Санкт-Петербург, 1247.83kb.
- Методические указания к итоговому междисциплинарному экзамену по специальности «электроснабжение», 382.82kb.
- Н. Н. Кувшинова экология учебное пособие, 1072.88kb.
- Учебное пособие для самостоятельной работы студентов специальности 040600 «Сестринское, 1354.95kb.
- Методические указания: краткий курс лекций для студентов заочной формы обучения Санкт-Петербург, 1540.61kb.
- Учебное пособие Для студентов всех специальностей Москва 1999, 1603.73kb.
- Учебное пособие для студентов специальности «Экономика и управление на предприятии», 1271.5kb.
[1] Раздел 3, глава 6,
[2] Раздел 7
[3] Раздел 4
Основные понятия.
Системы, состоящие из двух и более фаз, называются дисперсными системами. В обычной жизни мы сталкиваемся с веществами в трёх агрегатных состояниях – твёрдом, жидком и газообразном. Для бинарных систем (т.е. состоящих из веществ в двух агрегатных состояниях ) можно представить 9 дисперсных систем. В дисперсных системах различают дисперсионную среду – непрерывная фаза и дисперсную фазу.
| Дисперсионная среда | Дисперсная фаза | Пример |
| Твёрдая | Твёрдая | Композиционные материалы, стеклотекстолит |
| Твёрдая | Жидкая | Твёрдые эмульсии, сливочное масло. |
| Твёрдая | Газообразная | Твёрдые пены – пемза, пенопласты. |
| Жидкая | Твёрдая | Суспензии (взвесь глины в воде) |
| Жидкая | Жидкая | Эмульсии (молоко) |
| Жидкая | Газообразная | Пены |
| Газообразная | Твёрдая | Дымы |
| Газообразная | Жидкая | Туманы |
| Газообразная | Газообразная | Система однофазная, степень диспергирования - до уровня молекул |
Однофазные системы из нескольких компонентов называются растворами. В них некоторые или все компоненты диспергированы до уровня атомов, ионов или молекул, которые в среднем равномерно распределены во всём объёме раствора. Атомное диспергирование наблюдается в металлических (и не только металлических) сплавах с так называемой структурой твёрдых растворов. В них атомы компонентов статистически расположены в узлах общей кристаллической решётки.
Примером молекулярных растворов могут служить растворы спирта в воде, сахара в чае и т.д.
Системы, в которых наблюдается ионное диспергирование хотя бы одного компонента,) являются проводниками электрического тока.
Вещества, которые в растворе или в расплавленном состоянии проводят электрический ток, называют электролитами. Электрическая проводимость возникает вследствие процесса электролитической диссоциации - распада вещества на положительно заряженные ионы ( катионы ) и отрицательно заряженные ионы ( анионы ). Процесс диссоциации выражается химическим уравнением ( в общем виде ):
KatnAnm n Katm+ + m Ann- ( * )
Возникающее ионное равновесие характеризуется константой равновесия, которая носит название константа диссоциации:
Katm+n Ann-
Кд = ———— , ( 1 )
KatnAnm]
где Katm+, Ann-, KatnAnm - равновесные концентрации катионов, анионов и недиссоциированных частиц соответственно.
Величина константы диссоциации зависит от природы электролита, растворителя и температуры, но не зависит от концентрации раствора.
Для сильных электролитов Кд 1, т.е. в разбавленных растворах они диссоциированы практически полностью ( соединения ионного типа в растворе существуют только в виде ионов ). Слабые электролиты диссоциированы в растворе лишь частично и характеризуются значениями константы диссоциации Кд 1.
Примеры сильных и слабых электролитов приведены в приложении 1. Константы диссоциации электролитов приводятся в термодинамических таблицах
( см. приложение 2 ).
Многоосновные кислоты и многокислотные основания диссоциируют ступенчато, каждая из равновесных ступеней характеризуется своей константой диссоциации.
ПРИМЕР 1.
Диссоциация ортофосфорной кислоты:
H3PO4 H+ + H2PO4- K1 = Н+ H2PO4- H3PO4
H2PO4- H+ + HPO42- K2 = Н+ HPO42- H2PO4-
HPO42- H+ + PO43- K3 = Н+ PO43- HPO42-
суммарное уравнение процесса:
H3PO4 3 H+ + PO43- Kд = К1 К2 К3 = Н+3 PO43- H3PO4
Равновесие в водных растворах слабых электролитов.
Вода, являясь наиболее важным с практической точки зрения растворителем, сама представляет собой слабый электролит, диссоциирующий на ионы в соответствии с уравнением:
2 Н2О Н3О+ + ОН-
или упрощенно: Н2О Н+ + ОН-.
Константа диссоциации воды: Кд = Н+ ОН- Н2О = 1,8 10-16 (при 22 С), в чистой воде и разбавленных водных растворах концентрацию недиссоциированных молекул принимают за постоянную величину: Н2О = m/MV = 1000/18 = 55.5 моль/л. Тогда Кд Н2О = Кв = Н+ ОН- = 10-14 ( 2 )
Выражение ( 2 ) называется ионным произведением воды и показывает, что
в разбавленных водных растворах произведение равновесных концентраций ионов водорода и гидроксила при данной температуре есть величина постоянная. Концентрацию ионов водорода в растворе часто выражают водородным показателем: рН = - lg H+ (3)
Реже пользуются величиной гидроксильного показателя: рОН = - lg ОH-, т.к. в соответствии с уравнением ( 2 ) эти функции взаимосвязаны: рН + рОН = 14.
Таким образом, для водных растворов всегда выполняются соотношения:
в нейтральной среде Н+ = ОН- = 10-7 моль/л, рН = рОН = 7,
в кислой среде Н+ 10-7 моль/л, ОН- 10-7 моль/л, рН 7, рОН 7,
в щелочной среде Н+ 10-7 моль/л, ОН- 10-7 моль/л, рН 7, рОН 7.
Значение рН растворов и, соответственно, характер среды определяют с помощью специальных приборов - рН-метров или ( более грубо ) с помощью цветных индикаторов. Кислотно – основными индикаторами могут служить некоторые органические соединения, которые при определенном значении рН (в узком интервале значений рН) резко изменяют свою окраску ( см. приложение 3 ).
Равновесие в растворах слабых электролитов иногда характеризуют величиной степени диссоциации ( ) - отношением числа диссоциированных молекул к общему числу растворенных молекул.
Степень диссоциации и константа диссоциации связаны соотношением:
Кд = 2С/(1-), ( 4 )
где С - молярная концентрация раствора.
Равновесие в растворах слабых электролитов, как и для любой другой обратимой реакции, подчиняется принципу Ле Шателье, а именно:
при уменьшении концентрации ионов в растворе ( например, путем их связывания в слабый электролит ) равновесие смещается вправо, т.е. степень диссоциации увеличивается;
при увеличении концентрации ионов ( например, путем добавления в систему сильного электролита, содержащего одноименные ионы ) равновесие смещается влево, т.е. степень диссоциации уменьшается.
ПРИМЕР 2.
А). Вычислите рН и степень диссоциации децимолярного ( Ск = 0,1 моль/л ) раствора уксусной кислоты.
Константа диссоциации уксусной кислоты СН3СООН СН3СОО- + Н+
определяется уравнением Кд = СН3СОО- Н+ СН3СООН = 1,75 10-5. Из уравнения реакции видно, что СН3СОО- = Н+, а т.к. Ск СН3СОО- то СН3СООН = Ск - СН3СОО- Ск.
Тогда Кд = Н+2/Ск, откуда: Н+ = (Кд Ск)1/2, из уравнения(3): рН = - 1/2 lg (Кд Ск), степень диссоциации по определению равна = Н+/Ск:
Для условий задачи получаем: Н+ = 1.3 10-3 моль/л, рН 2.9, 1.3 10-2 ( 1.3 % ).
Б). Вычислите рН и степень диссоциации децимолярного ( Ск = 0,1 моль/л ) раствора уксусной кислоты после добавления в него ацетата натрия в концентрации Сс = 0,1 моль/л.
В данном случае СН3СООН Ск , СН3СОО- = Сс, тогда из выражения для Кд (см п.А) получаем: Н+ = Кд Ск/Сс = 1.75 10-5, рН 4.8, 1.75 10-4 (0.017 %).
Сравнение результатов, полученных в пп. А) и В), подтверждает вывод, следующий из принципа Ле Шателье, а именно: введение в раствор слабого электролита одноименных ионов уменьшает степень его диссоциации.
Гетерогенные ионные равновесия.
Многие малорастворимые электролиты в растворе полностью диссоциированы на ионы, и в их насыщенном растворе устанавливается гетерогенное равновесие:
KatnAnm n Katm+ + m Ann-
(тв) (р-р) (р-р)
Константа равновесия этого процесса выражается уравнением
Кс = Katm+n Ann-m ( 5 )
и называется произведением растворимости . Таким образом в насыщенном растворе малорастворимого электролита произведение равновесных концентраций составляющих его ионов в степенях, равных их стехиометрическим коэффициентам есть величина постоянная ( при данной температуре ).
Качественно оценить растворимость электролита можно по таблице растворимости (см. приложение 4 ), значения произведений растворимости приводятся в термодинамических таблицах (см. приложение 2 ). Зная величину произведения растворимости, можно вычислить концентрации ионов в насыщенном растворе, т.е. определить растворимость вещества.
ПРИМЕР 3.
Равновесие в растворе роданида серебра выражается уравнением: AgCNS(тв) Ag+(р-р) + CNS-(р-р)
Произведение растворимости равно: КAgCNS = Ag+ CNS- = 1.16 10-12 .
Согласно уравнения реакции Ag+ = CNS- = КAgCNS = 1.08 10-6 моль/л.
Растворимость AgCNS равна L = Ag+ МAgCNS = 1.08 10-6 (моль/л)* 1.66 105(мг/моль) = 0,18 мг/л.
Смещение гетерогенного равновесия подчиняется принципу Ле Шателье:
при увеличении концентрации ионов в растворе ( путем добавления вещества, содержащего одноименные ионы ) равновесие смещается влево, т.е. в сторону образования осадка;
при связывании ионов равновесие смещается вправо, т.е. в сторону растворения осадка.
Таким образом, для раствора произвольного начального состава:
соотношение Katm+n Ann-m Кс является условием образования осадка;
соотношение Katm+n Ann-m Кс является условием растворения осадка.
ПРИМЕР 4.
При каком значении рН выпадает осадок Fe(OH)2 из децимолярного (Сс=0.1 моль/л) раствора FeCl2.
Равновесие между осадком Fe(OH)2 и ионами в растворе выражается уравнением :
Fe(OH)2 Fe2+ + 2 ОН-, табличное значение произведения растворимости
Кс = 1.4 10-15.
Условие образования осадка: Fe2+ ОН-2 Кс, откуда ОН-2 Кс/Fe2+. Т.к. FeCl2 - хорошо растворимый сильный электролит, Fe2+ = Сс, то ОН- ( Кс/Сс )1/2 = 1.26 10-7. Используя соотношения (2),(3) на стр.1, получаем, что осаждение возможно при Н+ 10-14/ОН- = 7,9 10-8, т.е. при рН 7.1.
Равновесие в растворах комплексных соединений.
Комплексными ( координационными ) соединениями называются соединения, в которых превышена формальная валентность ( степень окисления ) центрального атома.
В молекулу комплексного соединения входит центральный атом ( ион ) - комплексообразователь; частицы ( ионы или молекулы ), непосредственно связанные с центральным атомом ( обычно ковалентными связями по донорно-акцепторному механизму ), называются лигандами. Центральный атом и лиганды составляют внутреннюю сферу комплекса. Ионы, нейтрализующие заряд внутренней сферы, составляют внешнюю сферу комплексного соединения. Число лигандов в комплексе называется координационным числом. Оно всегда больше стехиометрической валентности ( степени окисления ) центрального атома. Внутренняя сфера выделяется квадратными скобками.
ПРИМЕР 5.
Na Al(OH)4
комплексообразователь ( центральный атом ) Аl , лиганды – ОН, Na - внешняя сфера, [Al(OH)4] - внутренняя сфера, 4 - координационное число (КЧ)
Большинство комплексных соединений - сильные электролиты и диссоциированы в растворе полностью: NaAl(OH)4 Na+ + Al(OH)4-
Комплексные ионы ( внутренняя сфера ) - слабые электролиты и диссоциируют частично:
Al(OH)4- Al3+ + 4 OH-
Константа диссоциации комплексного иона Кн = Al3+ OH-4/Al(OH)4- называется константой нестойкости комплекса ( см. приложение 2 ).
Свойства амфотерных электролитов.
Электролиты, способные к диссоциации как по кислотному, так и по основному механизму, называются амфотерными ( амфолитами ):
H+ + KatO- KatOH Kat+ + OH-
кислота основание
Устанавливающееся сложное равновесие может быть смещено согласно общим правилам смещения ионных равновесий, а именно : вправо (по основному механизму) путем связывания ионов гидроксила, влево (по кислотному механизму) путем связывания ионов водорода. В связи с этим амфолиты могут вступать в реакцию как с кислотами, так и с основаниями.
К амфотерным относятся гидроксиды бериллия, цинка, алюминия, хрома (III), олова (II), свинца(II), титана (IV) и некоторые другие.
ПРИМЕР 6.
В растворе амфотерного гидроксида хрома устанавливается гетерогенное равновесие:
Cr3+ + 3 OH- + 3 H2O Cr(OH)3 + 3 H2O Cr(OH)63- + 3H+
основание кислота
Смещение равновесия при взаимодействии с кислотой ( влево ):
Cr(OH)3 + 3 H+ = Cr3+ + 3H2O связывание ионов H+,
смещение равновесия при взаимодействии с основанием ( вправо )
Cr(OH)3 + 3 OH- = Cr(OH)63- связывание ионов ОH-.
Реакции ионного обмена - реакции связывания ионов, которое происходит при образовании слабого или малорастворимого электролита. Реакции ионного обмена подчиняются всем закономерностям химической термодинамики, т.е. они протекают самопроизвольно в сторону уменьшения энергии Гиббса системы ( G 0 ) до достижения состояния равновесия (G 0 ).
Количественной мерой степени протекания реакции "слева направо" является константа равновесия, вычисляемая по общим правилам. Если Кс 1, равновесие смещено в сторону протекания прямой реакции, при Кс 1 - в сторону обратной реакции.
Константа равновесия Кс рассчитывается через константы диссоциации слабых электролитов в общем случае по формуле: Кс=Кисх/Кпрод, (1)
где Кисх – константа диссоциации слабого электролита, вступающего в реакцию, Кпрод – константа диссоциации слабого электролита, получающегося в результате реакции.
Таким образом, реакции ионного обмена можно свести к двум взаимосвязанным процессам : диссоциации электролитов, вступающих в реакцию, и связывании ионов с образованием продуктов.
Общим выводом является то, что реакции ионного обмена протекают в направлении наиболее прочного связывания ионов, т.е. в направлении образования соединения с наименьшим значением константы диссоциации.
Для правильного отражения процессов при реакции ионного обмена уравнения записывают в ионно-молекулярной форме. При этом исходят из реального состояния каждого вещества в системе: сильные электролиты записывают в виде ионов, слабые и малорастворимые электролиты - в молекулярной форме.
ПРИМЕР 7. Реакция нейтрализации - реакция между кислотой и основанием с образованием соли и воды: CH3COOH + NaOH = CH3COONa + H2O
ионно-молекулярное уравнение: CH3COOH + OH- = CH3COO- + H2O
Расчет константы равновесия реакции:
Кс = CH3COO- H2O / CH3COOH OH- = Кд/Кв = 1.75 10-5/10 -14 = 1.75 109 1, равновесие смещено вправо – идет прямая реакция.
ПРИМЕР 8. Гидролиз солей: взаимодействие соли с водой - реакция, обратная реакции нейтрализации.
А). соли сильной кислоты и сильного основания гидролизу не подвергаются, т.к. в реакции не образуется слабого электролита. Среда в растворе таких солей нейтральная, рН = 7.
Б). соли сильной кислоты и слабого основания ( гидролиз по катиону ):
NH4Cl + H2O NH4OH + HCl
ионно-молекулярное уравнение: NH+ + H2O NH4OH + H+
Константа равновесия реакции ( константа гидролиза ):
Кг = Кв/К NH OH = 10 -14/1.8 10-5 = 5.6 10-10
Константа гидролиза Кс 1, т.о. равновесие в данной реакции смещено влево, однако возникающий избыток ионов Н+ приводит к изменению характера среды. Расчет рН : Н+ = ( Сс К NH OH )1/2 . Так, если концентрация раствора NH4Cl равна Сс = 0.3 моль/л , получим: Н+ = 1.3 10-5 моль/л,
рН = 4.9 7, т.о. возникает кислая среда.
Для растворов солей сильной кислоты и слабого многокислотного основания гидролиз протекает преимущественно по первой ступени с образованием основной соли:
CuCl2 + H2O CuOHCl + HCl
ионно-молекулярное уравнение: Cu2+ + H2O CuOH+ + H+
В). соли слабой кислоты и сильного основания ( гидролиз по аниону ):
Na2S + H2O NaHS + NaOH
ионно-молекулярное уравнение: S2- + H2O HS- + OH-
Константа гидролиза Кг = Кв/КHS = 10-14/1.2 10-14 = 0.83. Избыток ионов OH- приводит к изменению характера среды. Расчет аналогичен предыдущему примеру: ОН- = ( Сс К HS )1/2, Н+ = 10-14/ОН-.
Так, при концентрации соли Сс = 0.01 моль/л: Н+ = 1.1 10-11, рН 11 7, т.о. образуется щелочная среда.
Соли многоосновных слабых кислот гидролизуются преимущественно по первой ступени с образованием кислых солей.
Г) соли слабой кислоты и слабого основания ( гидролиз по аниону и по катиону ):
CH3COONH4 + H2O CH3COOH + NH4OH
ионно-молекулярное уравнение: CH3COO- + NH4+ + H2O CH3COOH + NH4OH
Константа гидролиза рассчитывается по уравнению: Кг = Кв/Кк Ко. В данном случае равновесие реакции как правило сильно смещено вправо, a характер среды определяется относительной силой кислоты и основания. Во многих случаях гидролиз протекает необратимо, и такие соли в растворе существовать не могут: Al2(CO3)3 + 6 H2O = 2 Al(OH)3 + H2CO3
ПРИМЕР 9. Растворение малорастворимого электролита.
CaCO3 + 2 HCl = CaCl2 + H2CO3
ионно-молекулярное уравнение: CaCO3 + 2 H+ = Ca2+ + H2CO3
Константа равновесия:
Кс = Ca2+ H2CO3 / H+2 = КCaCO /КH CO = 3.7 10-9 / 2.1 10-17 = 1.7 108 1, равновесие смещено вправо – идет процесс растворения.
ПРИМЕР 10. Образование комплексного соединения.
Al(OH)3(тв) + NaOH = NaAl(OH)4(р-р)
ионно – молекулярное уравнение: Al(OH)3 + OH- = Al(OH)4-, т.о. идет растворение осадка гидроксида алюминия. Константа равновесия Кс = К Al(OH) /КAl(OH) .
Разрушению гидроксо-комплекса в кислой среде соответствует ионно-молекулярное уравнение:
Al(OH)4- + 4Н+ = Al(OH)3 + 4Н2О.
Вопросы для самопроверки.
- Какие дисперсные системы Вам известны?
- Чем отличаются молекулярные растворы от растворов электролитов?
- Напишите выражение константы диссоциации угольной кислоты Н2СО3.
- Что такое ионное произведение воды?
- Что показывает водородный показатель рН?
- Что такое «степень диссоциации? Как связаны между собой константа диссоциации и степень диссоциации?
- Применим ли принцип Ле-Шателье к растворам электролитов? Ответ обоснуйте.
- Можно ли утверждать, что константа диссоциации слабого электролита и его произведение растворимости тождественны?
- Что такое комплексные соединения? Каково их строениие?
- Что такое «амфотерные электролиты»? Приведите примеры.
- В каком случае реакции ионного обмена могут протекать слева направо?
| Тема 4. Окислительно-восстановительные и электрохимические процессы. Электродные потенциалы. Кинетика электродных процессов. Гальванические элементы, химические источники тока. Электролиз. Коррозия металлов. Виды коррозии. Методы защиты от коррозии. |
[1] Раздел 3, главы 7 и 8
[2] Разделы 8 и 9
[3] Разделы 6 и 7
Реакции, связанные с изменением степени окисления атомов в молекулах реагирующих веществ, называются окислительно-восстановительными.
Степень окисления - условный электрический заряд атома в химическом соединении (вычисленный в предположении, что все электроны, участвующие в образовании химической связи, полностью смещены к более электроотрицательному атому).
Для определения степени окисления атомов в химическом соединении используют следующие правила:
- степень окисления атомов в простых веществах (напр.: Na , Cl2, O3 ) равна нулю;
- степень окисления одноатомного иона (напр.: Na+, Cl-, Zn2+, Al3+) равна его заряду;
- степень окисления металлов всегда положительна;
- характерные степени окисления в соединениях проявляют следующие элементы:
- щелочные металлы ( +1 ),
- щелочноземельные металлы ( +2 ),
- бор, алюминий ( +3 ), кроме боридов металлов
- фтор ( -1 ), самый электроотрицательный элемент
- водород ( +1 ), кроме гидридов металлов
- кислород ( -2 ), кроме пероксидов, надпероксидов, озонидов и соединений с фтором;
- сумма зарядов ( степеней окисления ) всех атомов в молекуле равна нулю ( условие электронейтральности ).
ПРИМЕР 1.
Определить степени окисления атомов в бихромате калия K2Cr2O7
Степень окисления щелочного металла калия ( +1 ), степень окисления кислорода
(-2), степень окисления хрома обозначим Х. Составляем уравнение электронейтральности: 2 (+1) + 2 Х+7 (-2) = 0.
Решаем уравнение относительно Х : получаем степень окисления хрома ( +6 ).
Процесс повышения степени окисления - отдачи электронов - называется окислением. Процесс понижения степени окисления - присоединение электронов - называется восстановлением.
Вещества, атомы которых окисляются (отдают электроны), называются восстановителями, вещества, присоединяющие электроны - окислителями.
Окислителем может быть вещество, атомы которого способны понижать степень окисления (принимать электроны), поэтому типичными окислителями являются вещества, содержащие атомы в наивысшей степени окисления. Типичными восстановителями являются вещества, содержащие атомы в низшей степени окисления. Вещества с атомами в одной из промежуточных степеней окисления для данного элемента могут проявлять как окислительные, так и восстановительные свойства.
ПРИМЕР 2.
H2SO4 - максимальная степень окисления серы (+6): только окислитель.
H2S - минимальная степень окисления серы (-2): только восстановитель.
H2SО3 - промежуточная степень окисления серы (+4): и окислитель и восстановитель.
Составление уравнений окислительно-восстановительных реакций.
Для окислительно-восстановительных реакций, протекающих в водных растворах, используют метод ионно-электронных уравнений ( рассмотрим на примере реакции бихромата калия с нитритом натрия в кислой среде ).
Метод ионно-электронных уравнений включает следующий порядок составления уравнений:
1) записываем схему реакции в молекулярной форме:
K2Cr2O7 + NaNO2 + H2SO4 Cr2(SO4)3 + NaNO3 + K2SO4 + H2O
2) составляем схему реакции в ионно-молекулярной форме по общим правилам
( сильные электролиты записываем в виде ионов, слабые электролиты, газы и осадки - в виде молекул ):
2K+ + Cr2O72- + Na+ + NO2- + 2H+ + SO42- 2Cr3+ + 3SO42- + Na+ + NO3- + 2K+ + SO42- + H2O
3) определяем элементы, изменяющие степени окисления, из ионно-молекулярной схемы реакции выписываем частицы (выделены), содержащие атомы этих элементов
(т.е. окислитель и восстановитель) и составляем схемы отдельно процессов окисления и восстановления:
Cr2O72- 2 Cr3+
NO2- NO3-
4) составляем уравнения отдельно процессов окисления и восстановления, пользуясь следующими правилами:
для реакции в кислой среде: в ту часть уравнения, которая содержит меньшее число атомов кислорода, прибавляем эквивалентное число молекул воды, в противоположную часть - удвоенное количество ионов Н+;
для реакции в щелочной ( и нейтральной ) среде: в ту часть уравнения, которая содержит меньше атомов кислорода, прибавляем ионы ОН- из расчета два иона ОН- на каждый недостающий атом кислорода , в противоположную часть - вдвое меньшее количество молекул воды;
в рассматриваемом случае реакция идет в кислой среде, поэтому получаем:
Cr2O72- + 14 H+ 2Cr3+ + 7 H2O
NO2- + H2O NO3- + 2 H+
5) рассчитываем суммарный заряд левых и правых частей уравнений и прибавляем необходимое количество электронов в соответствующую часть уравнения с тем, чтобы суммарное число и знак электрических зарядов слева и справа от знака равенства в каждом уравнении были равны:
+12 + 6
х 1 Cr2O72- + 14 H+ + 6 е- = 2 Cr3+ + 7 H2O восстановление
х 3 NO2- + H2O = NO3- + 2 H+ + 2 е- окисление
- 1 +1
6) подбираем наименьшие коэффициенты для полученных уравнений, руководствуясь тем, что общее число электронов, отдаваемых восстановителем, должно быть равно числу электронов, присоединяемых окислителем; с учетом этих коэффициентов складываем полученные уравнения:
Cr2O72- + 14 H+ + 3 NO2- + 3 H2O = 2 Cr3+ + 7 H2O + 3 NO3- + 6 H+
7) производим сокращение одинаковых членов в левой и правой частях уравнения, при этом получаем сокращенное ионное уравнение заданной реакции:
Cr2O72- + 8 H+ + 3 NO2- = 2 Cr3+ + 4 H2O + 3 NO3-
8) по полученному ионному уравнению составляем молекулярное уравнение реакции ( расставляем коэффициенты в исходном молекулярном уравнении ):
K2Cr2O7 + 3 NaNO2 + 4 H2SO4 = Cr2(SO4)3 + 3 NaNO3 + K2SO4 + 4 H2O
9) проверяем правильность полученных коэффициентов; рекомендуется делать проверку "по кислороду" ( число атомов кислорода в правой и левой частях уравнения должно быть одинаково ).
Направление реакций окисления-восстановления.
Процессы окисления и восстановления неразрывны друг от друга и протекают всегда одновременно. Окислитель, присоединяя электроны, превращается в соответствующий восстановитель, и каждому восстановителю соответствует определенный окислитель. Таким образом, окислитель ( О ) и восстановитель ( В ) образуют сопряженную окислительно-восстановительную пару, равновесие между компонентами которой выражается схемой: О + n e- B
Можно сформулировать общий принцип, определяющий окислительно-восстановительные свойства пары О/В: чем сильнее окислитель, тем слабее восстановитель и, наоборот.
Относительная активность различных окислителей и восстановителей количественно характеризуется величиной стандартного электродного потенциала Ео/в*): чем выше значение Ео/в, тем сильнее окислитель и тем слабее восстановитель пары О/В. (Стандартный электродный потенциал определяется как электродвижущая сила гальванического элемента, построенного из электрода, содержащего компоненты данной окислительно-восстановительной пары при их концентрациях 1моль/л и стандартного водородного электрода, потенциал которого по определению равен нулю. О водородном электроде будет изложено несколько позже. )
Кроме этого, окислительно-восстановительные свойства пары зависят от концентраций окислителя (Со), восстановителя (Св) и температуры в соответствии с уравнением Нернста:
Eо/в = Eо/в + (RT/n) ln Cо/Cв = E + (0.059/n) lg Cо/Cв, ( 1 )
Окислительно-восстановительные процессы подчиняются общим законам термодинамики, т.е. могут протекать самопроизвольно при выполнении условия:
G 0.
Изменение энергии Гиббса реакции связано с ЭДС ( Е ) гальванического элемента, в котором идет данная окислительно-восстановительная реакция, соотношением:
G = - n F E , ( 2 )
где F = 96500 Кл/моль - постоянная Фарадея.
Учитывая это, условие возможности самопроизвольного протекания окислительно-восстановительной реакции может быть записано в виде:
Е = Еок - Евос 0 или Еок Евос ( 3 )
Иными словами, окислительно-восстановительная реакция возможна, если электродный потенциал пары, содержащей данный окислитель, больше электродного потенциала пары, содержащей данный восстановитель.
Значения стандартных электродных потенциалов приводятся в термодинамических таблицах ( см. ПРИЛОЖЕНИЕ 5).
ПРИМЕР 3.
Определить возможность протекания реакции между растворами бихромата калия и нитритом натрия ( разобрана в предыдущем разделе ).
Выписываем уравнения отдельно процессов окисления и восстановления и величины электродных потенциалов, соответствующие этим окислительно-восстановительным парам:
окислитель Cr2O72- + 14 H+ + 6 е- = 2 Cr3+ + 7 H2O
восстановление Е0Cr O +14H /2Cr +7H O = 1,33 В
восстановитель NO2- + H2O = NO3- + 2 H+ + 2 е-
окисление Е0 NO +2H / NO +H O = 0,84 В
Сопоставляя значения потенциалов ( см. соотношение 3 ), делаем вывод, что Cr2O72- более сильный окислитель, чем NO3-, следовательно данная реакция может протекать самопроизвольно в прямом направлении.
Теперь рассмотрим становление и основные положения электрохимии.
Первые опыты, демонстрирующие химическое действие электрического тока, были известны с 1769 года. В качестве источника тока использовались лейденские банки (в современном понимании – конденсаторы) и электростатические машины. Под действием электрического разряда восстанавливали окислы некоторых металлов, получили азотный и азотистый ангидриды, разложили воду. После электро-физиологических опытов Луиджи Гальвани в 1780 г начались экспериментальные работы Алесандро Вольта – итальянского учёного-физика, в результате чего им в 1796 – 1797 годах была создана первая батарея элементов – родоначальник современных электрических элементов и аккумуляторов.
В настоящее время теория гальванических элементов исходит из особенностей кристаллической структуры металлов. Как известно, в узлах кристаллической решётки находятся атомы, связанные друг с другом делокализованными электронами. При погружении металлической пластины в воду под действием полярных молекул воды атомы металла из поверхностного слоя отрываются и в виде гидратированных катионов переходят в водную среду. После отрыва катиона на поверхности металла остаются «лишние» электроны, придающие ему отрицательный заряд. Между отрицательно заряженной пластиной и слоем адсорбированных металлов катионов создаётся разность потенциалов, которую принято называть электродным потенциалом металла.
По мере перехода ионов металла в водную среду увеличивается как отрицательный заряд металла, так и положительный заряд раствора, всё чаще ионы металла притягиваются обратно на металлическую пластину - наступает динамическое равновесие. Электродный потенциал металла при динамическом равновесии называется равновесным потенциалом металла. Естественно, что разные металлы обладают различными равновесными потенциалами. Если две пластины, обладающие различными равновесными потенциалами и находящиеся в растворе, соединить друг с другом проводником, то электроны от более отрицательной пластины потекут к менее отрицательной – возникнет электрический ток. При этом равновесие на обеих пластинах нарушится.
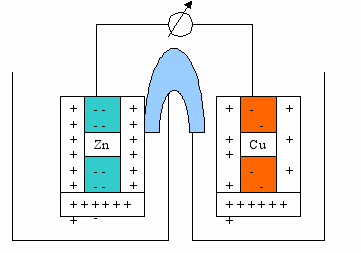
На цинковой пластине отрицательный заряд уменьшается, следовательно, для восстановления равновесия Zn может послать в раствор новые порции катионов. На медной пластине увеличение концентрации свободных электронов увеличивает притяжение Cu+2 и часть катионов вернётся на пластину и станут вновь электронейтральными атомами. Этот процесс происходит непрерывно до тех пор, пока весь Zn не растворится или все ионы Cu+2 не восстановятся. Таким образом, в гальваническом элементе за счёт химической реакции получается электрический ток.
На практике, конечно, пластины опускают не в воду, а в раствор соответствующей соли, например, Zn в ZnSO4, а Cu - в CuSO4.
Со временем в одной банке будут накапливаться ионы Zn+2, а в другой – ионы SO4-2, что воспрепятствует дальнейшему течению процесса. Во избежание этого оба раствора соединяют с помощью трубки, заполненной раствором электролита, что делает возможным диффузию катионов Zn+2 и анионов SO4-2 из одного сосуда в другой. Тот же эффект достигается применением пористых перегородок. При наличии диффузии беспрепятственно будет протекать как окислительный, так и восстановительный процесс:
Zno - 2e = Zn+2 (окислительный процесс)
Cu+2 + 2e = Cu0 (восстановительный процесс)
Суммарно: Zno + Cu+2 = Zn+2 + Cuo
Суммарное уравнение представляет и процесс, протекающий в гальваническом элементе Вольта, в котором вместо раствора солей использована Н2SO4.
Двухэлектродная система, в которой самопроизвольно протекает окислительно-восстановительный процесс, называется гальваническим элементом.
Чем больше разница в электродных потенциалах металлов, тем большее напряжение будет давать гальванический элемент. Это позволило А. Вольта в 1801 году расположить различные электропроводящие материалы в некоторый ряд по их активности – в «ряд напряжений»: Zn – Sn (фольга) – Sn (слиток) – Pb – латунь и различные сорта бронзы – Cu – Pt – Au – Ag – Hg – графит – уголь. Были предложены и другие ряды, порою почти современного вида. Проще сего казалось бы можно было создать такой ряд, измерив абсолютные значения электродных потенциалов. К сожалению, это невозможно. Вследствие этого пользуются их относительными значениями. В качестве электрода сравнения, с потенциалом которого сравнивают потенциалы металлов, принят стандартный водородный электрод, потенциал которого принят равным нулю.
Стандартный водородный электрод представляет собой платиновую пластину, покрытую рыхлым слоем мелкораздробленной Рt и опущенную в раствор H2SO4 c активной концентрацией ионов водорода, равной 1 г-ион/л. Через этот раствор под давлением 1 атм при 250С пропускают газообразный водород Н2, который в большом количестве поглощается платиной. В результате с раствором H2SO4 будет соприкасаться не платиновая пластина, а адсорбированный на ней Н2 и установится равновесие: 2 Н+ + 2e- H2.
Разность потенциалов, возникающая в гальваническом элементе, построенном из нормального водородного электрода и испытуемого металла, погружённого в раствор своей соли с активностью ионов металла равной 1 г-ион/л, называется нормальным электродным потенциалом металла или, иначе, стандартным электродным потенциалом металла.
Электродный потенциал зависит от химической природы окислителя и восстановителя, температуры и концентраций ионов в растворе. Для металлических электродов, равновесие в которых можно выразить общим уравнением Men+ + ne- Me, электродный потенциал рассчитывается по уравнению Нернста.
Окислительно-восстановительный процесс, протекающий на электродах, называется электрохимическим.
В зависимости от условий на любом электроде может быть осуществлен как окислительный, так и восстановительный процесс.
Электрод, на котором протекает процесс окисления, называется анодом.
Электрод, на котором протекает процесс восстановления, называется катодом.
Если материал электрода не принимает участия в окислительно-восстановительном процессе, электрод называется инертным ( к ним относятся электроды из графита и благородных металлов ).
Если материал электрода участвует в электрохимическом процессе, электрод называется активным или растворимым ( большинство металлических электродов ).
Электрохимический процесс, как и любая окислительно-восстановительная реакция, представляет собой совокупность процессов окисления и восстановления, протекающих одновременно. Поэтому он может осуществляться только при наличии двух электродов: анода, на котором идет окисление, и катода, на котором идет восстановление.
ПРИМЕР 4. Гальванический элемент с железным и серебряным электродами.
Гальванический элемент состоит из двух электродов, каждый из которых представляет собой металлическую пластинку, помещенную в раствор соли соответствующего металла.
Электрическая цепь гальванического элемента состоит из внешнего и внутреннего участков. Внешний участок цепи соединяет металлические пластинки электродов через потребителя электрической энергии или электроизмерительный прибор. Внутренний участок цепи соединяет растворы солей через “солевой мостик”-трубки, заполненной раствором сильного электролита ( в промышленных гальванических элементах для этой цели используется полупроницаемая мембрана ).
Схема гальванического элемента включает в себя последовательное обозначение фаз, находящихся в непосредственном контакте. Граница раздела фаз обозначается вертикальной чертой. Для рассматриваемого гальванического элемента: FeFe(NO3)2AgNO3Ag
Характер электродных процессов определяется значениями электродных потенциалов. Окисление протекает на электроде, включающем более сильный восстановитель, т.е. анодом ( отрицательным полюсом гальванического элемента ) является электрод с меньшим значением электродного потенциала. Электрод с большим значением электродного потенциала является катодом гальванического элемента ( положительным полюсом ).
Разность потенциалов катода и анода представляет собой электродвижущую силу
( ЭДС ) гальванического элемента: Е = Ек - Еа
( величина всегда положительная !).
Таким образом, полная схема рассматриваемого гальванического элемента, включающая уравнения электродных процессов выглядит так:
Анод - Fe Fe2+ Ag- Ag + Катод
ЕFe /Fе = - 0.44 В ЕAg /Ag = 0.8 В
Анодный процесс: Fe = Fe2+ + 2e- окисление
Катодный процесс: Ag+ + e- = Ag восстановление
Суммарное уравнение: Fe + 2 Ag+ = Fe2+ + 2 Ag
Стандартная ЭДС: Е = Ек – Еа = ЕAg /Ag - ЕFe /Fе = 0,8 – (- 0,44) = 1,24 В
Для условий, отличных от стандартных, электродные потенциалы рассчитываются по уравнению Нернста ( см. ур. 1 ).
ЭДС возникает также и в элементах, где электроды приготовлены из одного и того же металла, погружены в растворы одной и той же соли, но с различной концентрацией. Такие гальванические элементы называются концентрационными.
Описанные выше электродные реакции связаны с переносом электронов между элементом и его ионом. Возможны также реакции между двумя различными состояниями окисления одного и того же элемента. К таким реакциям относится обратимое окисление хлорида олова SnCl2 хлоридом железа FeCl3
Sn+2 + 2Fe+3 = Sn+4 + 2Fe+2
Sn+2 - 2е- = Sn+4 окисление
2Fe+3 – 2е- = 2Fe+2 восстановление
Каждую из этих реакций можно осуществить отдельно, если опустить в каждый электролит электрод из инертного материала, например, платины или графита, и собрать таким образом гальванический элемент
(Рt) Sn+2 , Sn+4 ║ 2Fe+2 , Fe+3 (Рt)
Такие гальванические элементы называются редокс – элементами.
Потенциал каждого редокс – электрода можно измерить, сравнив с водородным электродом. В результате получим так называемые нормальные окислительно-восстановительные потенциалы. Так, для
Sn+2 - 2е- = Sn+4 (+0,15 В)
Fe+3 – е- = Fe+2 (+0,77 В)
ЭДС этого элемента составляет +0,77 – 0,15 = +0,62 В.
Иногда, помимо электронов е- в реакцию вступают и протоны Н+ , образующие с атомом кислорода воду, и сама вода, давая в результате ОН-1 .
MnO2 + 4OH- = MnO4- + 2H2O + 3e (+0,57 B)
Mn+2 + 4H2O = MnO4- + 8H+ + 5e (+1,52 B)
ЭДС любого гальванического элемента с течением времени уменьшается вследствие изменения потенциалов анода и катода. Анод становится менее отрицательным (анодная поляризация), катод – менее положительным (катодная поляризация). Различают физическую поляризацию, вызванную уменьшением концентрации электролита вблизи металлического электрода (устраняется перемешиванием) и химическую поляризацию. Например, в элементе Вольта
Zn │H2SO4│ Cu на медном катоде разряжаются ионы водорода 2Н+ + 2е = Н2 ↑. Молекулы Н2 адсорбируются на поверхности меди и медный электрод превращается в водородный. Соответственно уменьшается ЭДС.
Для уменьшения химической поляризации в качестве активной массы катода применяют окислители – деполяризаторы. Это могут быть MnO2, O2, K2Cr2O7, и др. Примером может служить марганцево-цинковый элемент (элемент марганцевой деполяризации). Положительным электродом в этом элементе служит MnO2, уплотнённый вокруг угольного стержня, а отрицательным электродом является цинковый корпус элемента. Электролитом служит NH4Cl – им пропитывают опилки.
- Zn │NH4Cl │ MnO2 +
Zn – 2e = Zn+2
MnO2 + 2H2O + e = Mn(OH)3 + OH- ; NH4Cl диссоциирует на NH4+ и Cl¯ .
NH4+ cвязывает образующиеся ионы OH¯ в NH4ОН
NH4+ + OH¯ = NH4ОН, который, в свою очередь, разлагается на NH3 и Н2О.
Выделяющийся NH3 связывается ионами Zn+2 в комплексный ион [Zn(NH3)4]+2 .
Эти процессы эффективно препятствуют поляризации.
К электрохимическим источником тока относятся также топливные элементы (ТЭ), или, более точно, - электрохимические генераторы (ЭХГ) – элементы, в которых происходит окисление обычного топлива или продуктов его переработки (водорода, оксида углерода, водяного газа и т.п.). В топливных элементах активные вещества, участвующие в токообразующей реакции, в процессе работы элемента непрерывно подаются извне к электродам.
В современных теплосиловых установках при получении электрической энергии теплота сгорания топлива используется лишь на 30 – 40 %. В топливных элементах коэффициент использования теоретически может достигать 100 %. Кроме того, топливные элементы бесшумны, не содержат движущихся частей, при работе не выделяют вредных веществ, обладают большой удельной мощностью.
В простейшем водородно-кислородном топливном элементе (Грове, 1839 г.) происходит окисление водорода кислородом. В щелочном электролите протекают реакции
2Н2 + 4ОН- -4е = 4Н2О
О2 + 2Н2О + 4е = 4 ОН-
2Н2 + О2 = 2Н2О
в кислом электролите протекают иные реакции:
2Н2 – 4е = 4Н+
О2 + 4Н+ + 4е = 2Н2О
2Н2 + О2 = 2Н2О
Как видно, независимо от природы электролита суммарная реакция и в том и в другом случае одинакова.
Сам аппарат для осуществления этой реакции представляет собой ёмкость, разделённую двумя пористыми платиновыми электродами, между которыми находится электролит. В поры платинового электрода введён катализатор – никель рения. С одной (сухой) стороны электродов, на анод, подаётся газообразный водород, Он адсорбируется на пористой поверхности анода, диссоциирует на атомы Н2 ↔ 2Н. Атомарный водород дифффундирует через анод в электролит, где взаимодействует с гидроксильным ионом ОН- , образуя воду и ‾е
Н + ОН‾ = Н2О + е‾
С другой стороны электродов, на катод, подаётся кислород, который также адсорбируется на электроде, диссоциирует на атомарный кислород, диффундирует в электролит, где взаимодействует с водой, образуя гидроксильные ионы
О + Н2О + 2е‾ = 2ОН‾
Для эффективного окисления в топливных элементах природных видов топлива – нефти, природного газа и особенно каменного угля, необходимы температуры 500 0С и выше. В таких элементах в качестве электролита используются расплавленные соли или твёрдые ионные проводники, например, смесь ZrO2 и СаО. Обычно природные виды топлива подвергают специальным обработкам для получения электрохимически активных веществ. Так, в результате конверсии метана получают газ, содержащий водород, который подаётся в топливный элемент.
СН4 + Н2О = СО + 3Н2
СО + Н2О = СО2 + Н2
Вообще, производство водорода для топливных элементов – это отдельная проблема.
В настоящее время ЭХГ принято классифицировать по типу используемого при его изготовлении ТЭ. Различают щелочные топливные элементы (ЩТЭ), ТЭ с протонообменной мембраной (ПОМТЭ), фосфорнокислые (ФКТЭ), ТЭ с электролитом на основе расплава карбонатов (РКТЭ), твёрдооксидные топливные элементы (ТОТЭ). Различия в природе электролитов этих ТЭ приводит к различным рабочим температурам и максимально достигаемой мощности.
| Тип ТЭ | Природа электролита | Рабочая температура, 0С | Максимальная мощность, кВт. |
| ЩТЭ | Водный раствор КОН | 60 – 90 | 200 |
| ПОМТЭ | Сульфированная фторсодержащая полимерная плёнка | 60 – 120 | 250 |
| ФКТЭ | Орто-фосфорная кислота | 160 – 220 | 11000 (100–250) |
| РКТЭ | Расплав К2СО3 + Li2CO3 | 600 – 700 | 3000 |
| ТОТЭ | Твёрдый раствор ZrO2 + Y2O3 (8 мол.%) | 850 – 1000 | 250 |
Топливные элементы типа ЩТЭ хорошо разработаны, просты в эксплуатации и недороги в производстве, но широкому их применению препятствуют высокие требования к чистоте водорода и кислорода – концентрация в них СО и СО2 не должны превышать 10-3 и 10-4 об. % соответственно.
ПОМТЭ имеют невысокую рабочую температуру из-за ограниченной теплостойкости полимерной мембраны, что даёт возможность быстрого запуска и остановки, но, как и ЩТЭ, имеют ограничения по концентрации СО в водороде – 10-3 об.%. В последних разработках благодаря использованию многокомпонентных электродов-катализаторов на основе Pt-Ru - сплавов удалось снизить допуски по содержанию СО до 10-2 об. %. Предполагается их использование в автотранспорте вместо двигателей внутреннего сгорания, в сотовых телефонах, компьютерах и пр. Широкому применению препятствует стоимость электролита и электродов.
ФКТЭ не требуют соблюдения жёстких условий по чистоте водорода – допускается содержание СО до 0,5 об.%. В настоящее время это самые широко используемые ТЭ.
Рассмотренные ТЭ работают при температуре, не превышающие 250оС, поэтому их относят к низкотемпературным. РКТЭ и ТОТЭ работают при более высоких температурах и относятся квысокотемпературным.
В РКТЭ электролит находится внутри пористой изолированной и химически инертной керамической матрице (LiAlO2), анод изготавливают из никеля, сплавов никеля с хромом или алюминием, а катод – из оксида никеля. Высокие температуры позволяют использовать не только чистый водород, но и синтез-газ СО + Н2. Синтез-газ образуется в реакции 4СН4 + 2Н2О + О2 (воздух) = 4СО + 10Н2. Основная область применения РКТЭ – стационарная энергетика.
В ТОТЭ анод изготавливают из кермета на основе Ni и твёрдого раствора ZrO2 + Y2O3 , а катод – из допированного стронцием Sr и манганита лантана La(MnO4)3 .
Считается, что ТОТЭ будут применяться в качестве стационарных автономных источников электроэнергии и тепла. Не исключена возможность их использования на транспорте. Препятствует их быстрому и широкому применению сложная технология их изготовления и высокая стоимость.
Электролиз растворов.
В первом гальваническом элементе – элементе Вольта Zn │H2SO4│ Cu химическая реакция протекает и при разомкнутой внешней цепи:
Zn + H2SO4 = ZnSO4 + H2↑
Такие элементы называются необратимыми. Гальванический элемент, рассмотренный в примере 4, является обратимым, т.е. если к его внешней цепи подключить противоположно направленную ЭДС, по величине превышающую собственную ЭДС элемента, то реакция в элементе пойдёт в обратном направлении. Это явление носит название электролиз.
Электролиз – процесс окисления-восстановления, протекающий на электродах при действии постоянного электрического тока.
При электролизе электроды включаются в цепь внешнего источника постоянного тока. Под действием приложенной разности потенциалов положительные ионы- катионы - перемещаются к отрицательному полюсу внешнего источника, отрицательные ионы – анионы - к положительному. На аноде и катоде протекают процессы окисления и восстановления соответственно.
Электролизу могут подвергаться как расплавы, так и растворы электролитов. Характерным для электролиза водных растворов является то, что в электродных процессах могут участвовать кроме ионов растворенных электролитов молекулы растворителя – воды, а также материал самого электрода ( если электрод активный ).
Таким образом, на электродах теоретически могут протекать несколько окислительно-восстановительных процессов. Однако, в первую очередь будут протекать энергетически выгодные процессы, а именно:
на аноде окисляется наиболее сильный восстановитель ( с наименьшим значением электродного потенциала );
на катоде восстанавливается наиболее сильный окислитель ( с наибольшим значением электродного потенциала ).
Масса вещества, получающегося в результате процесса электролиза, рассчитывается по уравнению ( закон Фарадея ):
m = MЭ Q/F , ( 2 )
где MЭ – эквивалентная масса вещества ( М/n ), Q – количество электричества ( I ),
F – постоянная Фарадея, 96500 Кл/моль.
ПРИМЕР 5. Электролиз раствора сульфата никеля (с активным - никелевым анодом ).
Напишем уравнение диссоциации соли и укажем направление движения ионов к электродам: NiSO4 SO42- + Ni2+
Анод + SO4-2 Ni+2 - Катод
Составляем уравнения возможных электродных процессов и выписываем из справочных таблиц значения соответствующих электродных потенциалов:
Анод ( окисление ): Катод ( восстановление ):
2SO42- = S2O82- + 2e- E = 2.01 B Ni2+ + 2e- = Ni E = -0.25 B
2H2O = 4H+ + O2 + 4e- E = 1.23 B 2H2O + 2e- = 2OH- + H2 E = -0.83 B
Ni = Ni2+ + 2e- E = -0.25 B
Сопоставляя значения электродных потенциалов для анодного и катодного процессов, делаем вывод о преимущественном протекании процесса электролиза на каждом электроде:
на аноде идет окисление никеля ( наименьший потенциал ), на катоде идет выделение металлического никеля ( наибольший потенциал ).
Так же, как и в гальваническом элементе, процесс электролиза может вызвать существенные изменения электродов. Например, при электролизе НСl на платиновых электродах выделяющиеся водород и хлор активно поглощается платиной и через некоторое время вместо нерастворимых Рt - электродов образуются 2 газовых электрода Н2 | НСl | Сl2. ЭДС этого гальванического элемента составляет 1,36 В. Эта ЭДС направлена в противоположную сторону, чем ЭДС источника тока. Этот ток, эта ЭДС называется током поляризации – он препятствует электролизу. Чтобы электролиз продолжался, к электродам нужно прикладывать напряжение несколько выше, чем ток поляризации.
Наименьшая разность потенциалов, необходимая для непрерывного электролиза, называется потенциалом разложения.
Потенциал разложения V всегда несколько выше, чем ЭДС поляризации Еп. Разница между ними V – Еп = ΔV называется перенапряжением. Величина перенапряжения ΔV зависит от материала электродов, состояния поверхности электродов, агрегатного состояния веществ, выделяющихся на электродах, от плотности тока, от температуры раствора.
В обратимых гальванических элементах при подключении к внешней цепи элемента ЭДС противоположного направления по величине, большей на величину ΔV, чем ЭДС элемента, реакция пойдёт в обратном направлении. На этом основан принцип работы аккумуляторов.
Аккумуляторы различаются между собой химической природой электродов и электролита, а также конструкцией. Наиболее часто встречающиеся – кислотные (свинцовые) и щелочные (железо-никелквые).
Свинцовый аккумулятор содержит свинцовые решётчатые пластины, заполненные пастой из PbO, погружённые в 25 – 30%-ную серную кислоту с плотностью ≈ 1,24 г/см3.
PbO + Н2SO4 = ↓ PbSO4 + H2O
