Молодежь XXI века: шаг в будущее материалы
| Вид материала | Документы |
- Молодежь XXI века: шаг в будущее материалы, 4335.34kb.
- Молодежь XXI века: шаг в будущее материалы, 6027.56kb.
- Молодежь XXI века: шаг в будущее материалы, 5286.69kb.
- Приказ 28. 10. 2011 №164-7/о Об итогах XVIII научно-практической конференции «Шаг, 108.32kb.
- Положение о школьной конференции учебно-исследовательских работ обучающихся 1-11 классов, 140.62kb.
- Программы «Шаг в будущее Инникигэ хардыы» Начальникам муниципальных управлений образования, 359.34kb.
- Программа для молодёжи и школьников «шаг в будущее», 263.02kb.
- Основные тенденции развития мирового хозяйства в начале XXI века, 49.08kb.
- Методические материалы по проектной деятельности, 27.05kb.
- Секретариат программы «Шаг в будущее» Почтовый адрес, 1818.72kb.
Заключение
Особенностями пневмоний развившихся на фоне агранулоцитоза является их атипичное, тяжелое и затяжное течение, часто осложняющееся сепсисом и бактериально-токсическим шоком. В период агранулоцитоза в легких вследствие дефицита нейтрофилов не формируется плотный воспалительный инфильтрат, дающий четкую клиническую и рентгенологическую картину пневмонии. Поэтому у таких больных часто отсутствует характерная аускультативная картина пневмонии, при традиционном рентгенологическом исследовании выявить инфильтрацию в легких также не представляется возможным. У этих больных при наличии лихорадки следует выполнять компьютерную томографию легких независимо от аускультативной картины и без предварительной рентгенографии. Предложен алгоритм эмпирической антибактериальной терапии пневмонии развившейся на фоне агранулоцитоза, в период до выявления возбудителя и определения его чувствительности к антибиотикам, а также для тех ситуаций, когда установить этиологический диагноз пневмонии не представлялось возможным. При повышении количества лейкоцитов более 1 × 109/л отмечается положительная динамика основных клинических симптомов пневмонии.
РЕТРОСПЕКТИВНЫЙ АНАЛИЗ РЕЗУЛЬТАТОВ ЛЕЧЕНИЯ ПАЦИЕНТОВ
С МНОЖЕСТВЕННОЙ МИЕЛОМОЙ
Суворова И.В., студентка 6 курса.
Научный руководитель: Войцеховский В.В., д.м.н., доцент.
ГБОУ ВПО «Амурская государственная медицинская академия» Министерства здравоохранения и социального развития Российской Федерации
Актуальность исследования обусловлена высокой заболеваемостью множественной миеломой населения земного шара, Российской Федерации и Амурской области.
Материалы и методы исследования. Проведен анализ заболеваемости и результатов лечения пациентов с множественной миеломой находившихся на лечении в гематологическом отделении Амурской областной клинической больницы в 1995 – 2011 гг.
Результаты исследования и их обсуждение. По распространенности среди гемобластозов ММ находится на 4-м месте после острых лейкозов, хронического лимфолейкоза и лимфогранулематоза. В общей структуре гемобластозов ММ занимает 11%. В Амурской области с середины 90-х годов отмечается увеличение случаев впервые выявленной ММ. Если в 1994 г. заболеваемость ММ составляла 0,5 на 100 тыс. населения, то в 2011 г. она составила 2,2 на 100 тыс. Среднегодовая заболеваемость ММ за изученный период составила 1,6 на 100 тыс. населения. Распределение больных ММ по возрасту на момент заболевания представлено в таблице 17. Наиболее часто заболевание выявляется в возрастной группе 50-70 лет. Средний возраст больных составил 57± 5,8 лет. Отмечено незначительное преобладание мужчин над женщинами - 52 и 48%.
Анализируя иммунохимические варианты ММ отмечено, что наиболее часто регистрируется миелома G - 102 человека (59% от общего количества больных ММ), реже миелома А - 35 человек (20%), миелома Бенс-Джонса - 20 человек (11%), несекретирующая миелома - 17 пациентов – (10%). Исследование клинико-анатомических особенностей миеломы показало, что наиболее часто встречаются диффузно-очаговая (115 человек -66%,) диффузная (30 человек – 17,5%) и множественно-очаговая (19 человек – 10,5%) формы ММ. Солитарная миелома диагностирована у 9 (5,5%) больных. Диагноз преимущественно висцеральной формы ММ выставлен 1 пациенту (0,5%).На момент выявления заболевания у 32 пациента (21%) была диагностирована IА стадия, у 15 (10%) -IIА стадия, у 77 (50%) -IIIА стадия. У 30 больных на момент постановки диагноза была выявлена миеломная нефропатия, осложнившаяся хронической почечной недостаточностью: IВ стадия диагностирована у 3 (1,7%),IIВ - у 5 (2,3%),IIIВ - у 22 (15%) пациентов. Стадирование проводилось по классификации В. Durie и S.Salmon.
Для лечения солитарноймиеломы применяли радикальное хирургическое или лучевое лечение (иногда сочетание обоих методов), химиотерапия в данной ситуации не проводилась. В дальнейшем у 5 пациентов отмечена генерализация солитарной миеломы. Четверо больных находятся на диспансерном учете, и каких либо данных за возможную генерализацию плазмоцитомы, в настоящее время, у них нет. У 20 пациентов с “тлеющей” миеломой (11,5% от общего числа больных ММ), длительно преобладала выжидательная тактика. При появлении признаков нарастания опухолевой массы (нарастание сывороточного и/или мочевого парапротеина, появление анемии и т.д.) назначалась цитостатическая терапия. Продолжительность жизни больных с “тлеющей” миеломой составляла от 10 до 17 лет.
Среди пациентов, лечение которых при первичной диагностике ММ было начато по протоколу МР у 60 % была достигнута фаза “плато”. С назначения курсов полихимиотерапии (ПХТ) 1-й линии (М2-VBMCP, AVBMCP, VMCP/VBAP, СВМР,AVMP,АВСМР,АВСМ) начиналось лечение больных с первично диагностированной ММ, при наличии у них патологических переломов, массивных опухолевых разрастаний, значительного ограничения движений. ПХТ 1-й линии проводилась всем пациентам с первичной и вторичной резистентностью к протоколу МР. Фазу “плато” удалось достичь у 68% пациентов взятых на лечение первично, у 59% больных с первичной и у 50% пациентов с вторичной резистентностью к протоколу МР. При отсутствии эффекта от вышеуказанных протоколов или при вторичной резистентности к ним лечение проводилось по протоколам ПХТ резерва (VAD,VAMP, VCAD, CEVAD, пульс-терапия дексаметазоном).
Для пациентов с IА стадией медиана выживаемости равнялась 79 месяцам. В группе пациентов со IIА стадией медиана выживаемости составила: для больных леченных по протоколу МР – 47,6 месяцев, для больных леченных по протоколам полихимиотерапии 1-й линии – 53 месяца. В группе пациентов с IIIА стадией медиана выживаемости составила: для больных леченных по протоколу МР – 33,9 месяцев, для больных леченных по протоколам ПХТ 1-й линии – 50 месяцев. Так как протоколы полихимиотерапии резерва проводились больным с агрессивным течением ММ, больным с первичной и вторичной резистентностью к другим протоколам, выживаемость таких больных редко превышала 36 месяцев.
С весны 2006 г. для лечения рецидивирующих и резистентных форм ММ велкейд стал использоваться в гематологическом отделении Амурской областной клинической больницы. В качестве второй линии терапии лечение этим препаратом было проведено 20 пациентам с ММ. В 13 случаях имел место рецидив заболевания, у 7 пациентов констатирована первичная резистентность к проводимой терапии. Миелома G диагностирована у 12 больных, миелома А у 5, миелома Бенс-Джонса у 1, несекретирующая миелома у 2 пациентов. В 17 случаях имела место IIIА, в 3 случаях IIIB стадия (по классификации B. Durie и S. Salmon, 1975). Продолжительность заболевания пациентов взятых на лечение бортезомибом составила от семи лет до шести месяцев. В зависимости от возраста и соматического статуса больных, велкейд назначался как в качестве монотерапии, так и в комбинации с другими цитостатиками (протоколы VMP, Velc+dexa, PAD). У 4 пациентов констатирован летальный исход, вследствие прогрессирования основного заболевания. У 10 больных удалось достигнуть фазы «плато». У 6 пациентов достигнута полная ремиссия заболевания. Особенно обнадеживало то, что полную ремиссию удалось добиться у больных с длительностью заболевания более 5 и 7 лет. Комбинированная терапия оказалась гораздо более эффективной, чем монотерапия бортезомибом. Из 6 пациентов, у которых удалось добиться полной ремиссии, четырем проводилась комбинированная терапия.
С июня 2008 г. в гематологическом отделении Амурской областной клинической больницы велкейд используется в качестве первой линии терапии в комбинации с другими препаратами (протоколы VMP, Velc+dexa, PAD). По этим протоколам пролечено 50 больных с ММ впервые выявленной в 2008 – 2009 гг. Миелома G диагностирована у 30, А у 10, миелома Бенс-Джонса у 6 и несекретирующая миелома у 4 пациентов. 43 пациента в подстадии А и 7 с наличием хронической почечной недостаточности. Полная ремиссия достигнута у 18 и частичная ремиссия у 20 человек, минимальный ответ у пяти больных. У четырех пациентов поступивших в отделение с признаками ХПН отмечена прогрессия заболевания. Троим пациентам, на момент написания данной работы, только начата терапия по бортезомиб-содержащим протоколам. Таким образом, у 38 больных (76%) получавших протоколы содержащие бортезомиб в качестве первой линии терапии отмечена полная либо частичная ремиссия заболевания, что является очень хорошим результатом по сравнению с эпохой «до велкейда». Поскольку лечение по протоколам, содержащим велкейд, в качестве первой терапии мы проводим с 2008 г, медиана общей выживаемости в этой группе еще не достигнута.
Установлено влияние следующих показателей на общую выживаемость больных: 1) миеломная нефропатия осложнившаяся хронической почечной недостаточностью; 2) тяжелая панцитопения диагностированная в дебюте заболевания; 3) миелемия в дебюте заболевания; 4) возраст больных старше 70 лет; 5) плазмоцитоз в костном мозге > 40%, при незрелой плазмобластной морфологии плазматических клеток; 6) повышение лактатдегидрогеназы (> 300 МЕ/л), β2 – микроглобулина (> 60 мг/л) в крови. Указанные выше показатели могут быть использованы в качестве прогностических критериев у больных ММ.
ХЛАМИДИЙНАЯ ИНФЕКЦИЯ КАК ПРИЧИНА МУЖСКОГО БЕСПЛОДИЯ
Теплякова Е.Д., студентка 4 курса.
Научные руководители: Корнеева Л.С., к.м.н., ассистент; Величко Д.Н., доцент.
ГБОУ ВПО «Амурская государственная медицинская академия» Министерства здравоохранения и социального развития Российской Федерации
Актуальность проблемы хламидийной инфекции определяется высокой распространённостью, поражением лиц молодого возраста, асимптомностью клинического течения, рядом серьёзных осложнений и причиной бесплодия.
Хламидийная инфекция является наиболее распространённой во всём мире инфекцией, передаваемой половым путём. Ежегодно в мире регистрируется 90 миллионов новых случаев заражения хламидийной инфекцией. В России регистрация урогенитального хламидиоза началась лишь в 1993 году. Эта инфекция является основным этиологическим агентом воспалительных заболеваний органов малого таза, хроническое течение которых оказывает неблагоприятное влияние на репродуктивное здоровье и вызывает ряд серьёзных осложнений.
Chlamydiatrachomatis относится к роду Chlamydia семейства Chlamydiaceae. Они представляют собой мелкие грамотрицательные патогенные облигатные внутриклеточные микроорганизмы.
Заражение хламидийной инфекцией происходит половым путем от человека к человеку. Инкубационный период заболевания в среднем составляет 7-10 дней (по некоторым источникам 15-35дней). Входными воротами возбудителя инфекции служат слизистые оболочки мочеполовых органов. Передача возбудителя инфекции не ограничивается кругом половых партнёров , она также реализуется при родах – заражение новорождённых при прохождении через инфицированный родовой канал. При этом у новорожденных развиваются конъюнктивиты, поражение носоглотки, среднего уха, легких и других органов.
Особенностью клинического течения воспалительного процесса при хламидиозе мочеполовых органов являются асимптомность или малосимптомное течение. У мужчин при хламидийной инфекции развиваются воспалительные изменения в простате и придатке яичка, что может приводить к нарушению репродуктивной функции и бесплодию. У женщин хламидийная инфекция может вызвать первичное и вторичное бесплодие, как результат сальпингоофоритов хламидийной этиологии и окклюзионных процессов в маточных трубах. Хламидиоз обусловливает значительный процент осложнений у беременных – преждевременные роды, неразвивающаяся беременность, спонтанный выкидыш. Хламидии могут прикрепляться к сперматозоидам и достигать не только маточных труб, вызывая их непроходимость, но и попадать в брюшную полость, обусловливая заболевания внутренних органов.
В нашей работе отражена клиническая картина, диагностика, лечение и профилактика урогенитальной хламидийной инфекции.
Целью нашей работы было определить какой процент приходится на хламидиоз среди заболеваний передающихся половым путём у лиц мужского пола и выявить среди больных тех, у кого имеются нарушения половой потенции и бесплодие по данным урологического стационара 3 городской больницы.
Нами было обследовано 47 мужчин с ИППП, средний возраст которых составил 28,7 лет. У них не было выявлено патогенной микрофлоры (E. coli, Klebsiella и др). Основу ИППП составляли уреаплазмы, микоплазмы, трихомонады и хламидии. Идентификация возбудителей проводилась путем микробиологического исследования отделяемого из уретры, секрета простаты, эякулята (ПИФ, бак. посевы, ПЦР-ДНК). Уреаплазмы были обнаружены у 10 больных (21,3%), микоплазмы у 4 (8,5%), трихомонады у 12 (25,5%), хламидии у 6 (12,7%). Число пациентов с сочетанными инфекциями составило 15 человек (32%). У 16 мужчин (34%), страдающих хламидиозом, наблюдалось нарушение половой потенции (ослабление эрекции, оргазма, преждевременное извержение семени) и бесплодие. У них отмечалась выраженная патология спермы. Все обследованные нами 47 пациентов были подразделены на 2 группы. В 1-ую вошли 23 (49%) человека, которым применялись традиционные методы лечения (антибиотики тетрациклинового ряда и макролидного спектра в сочетании с иммуномодуляторами). 2-ая группа составила 24 (51%) пациента, которым наряду с общепринятыми методами было назначено вспомогательное физиолечение курсом в 10 сеансов по 15 минут ежедневно или через день. У пациентов второй группы процент излечиваемости был выше, чем у пациентов первой группы. Из 47 больных у 28 (59,6%) наступило выздоровление после проведённой терапии, у 14 (29,8%) – возникли рецидивы заболевания и 5 больным (10,6%) потребовалось назначить повторный курс терапии.
Детально изучив влияние хламидийной инфекции на различные органы и ткани человеческого организма, можно сделать вывод, что залогом выздоровления является раннее выявление и лечение этой инфекции. Поэтому хламидийная инфекция должна рассматриваться во взаимодействии врачей дерматовенерологов, урологов, терапевтов, инфекционистов, педиатров и других специалистов.
КЛИНИКО – СТАТИСТИЧЕСКАЯ ХАРАКТЕРИСТИКА ОСЛОЖНЕНИЙ В РАННЕМ ПЕРИОДЕ ОСТРОГО НАРУШЕНИЯ МОЗГОВОГО КРОВООБРАЩЕНИЯ ПО ДАННЫМ РЕГИОНАЛЬНОГО СОСУДИСТОГО ЦЕНТРА АМУРСКОЙ ОБЛАСТНОЙ КЛИНИЧЕСКОЙ БОЛЬНИЦЫ ЗА 2010-2011ГГ.
Хомколова Анна, ординатор кафедры неврологии АГМА
Научный руководитель: Карнаух В.Н., д.м.н., доц.
ГБОУ ВПО «Амурская государственная медицинская академия» Министерства здравоохранения и социального развития Российской Федерации
Инсу́льт — острое нарушение мозгового кровообращения (ОНМК), характеризующееся внезапным (в течение нескольких минут, часов) появлением очаговой и/или общемозговой неврологической симптоматики, которая сохраняется более 24 часов или приводит к смерти больного в короткий промежуток времени вследствие цереброваскулярной патологии. К инсультам относят инфаркт мозга, кровоизлияние в мозг и субарахноидальное кровоизлияние, имеющие этиопатогенетические и клинические различия. С учётом времени регрессии неврологического дефицита, особо выделяют преходящие нарушения мозгового кровообращения (неврологический дефицит регрессирует в течение 24 часов, в отличие от собственно инсульта) и малый инсульт (неврологический дефицит регрессирует в течение трёх недель после начала заболевания). Отмеченный в последние годы рост распространенности сосудистых заболеваний обусловил увеличении частоты острых нарушений мозгового кровообращения. Ежегодно в Российской Федерации переносят инсульт более 450 тысяч человек, т. е. каждые 1,5 минут у кого-то из россиян впервые развивается инсульт. Наблюдается «омоложение» инсульта с увеличением его распространенности у лиц трудоспособного возраста – до 65 лет. Сосудистые заболевания мозга занимают второе место в структуре смертности от болезней системы кровообращения (39%) и в общей смертности населения (23,4%). Ежегодная смертность от инсульта в России – одна из наиболее высоких в мире.
Инсульт также является лидирующей причиной инвалидизации населения, снижающей трудовой потенциал, ухудшающий прогноз и качество жизни. Важная роль в этом принадлежит осложнениям, развивающимся в ранний период ОНМК, и влияющим на дальнейшее течение и исход заболевания.
Все осложнения ОНМК можно разделить на церебральные (отек головного мозга с развитием дислокационного синдрома, геморрагическая трансформация инфаркта мозга, постгеморрагическая констриктивно - стенотическая артериопатия и ишемия мозга при разрыве внутричерепных аневризм) и соматические (гнойно-воспалительные осложнения, тромбоз глубоких вен н/конечностей, тромбоэмболия легочной артерии (ТЭЛА), острые пептические язвы, трофические поражения кожи, кардиальная патология).
Одним из опасных церебральных осложнений является отек головного мозга и возникновение дислокационного синдрома с поражением дыхательных и сердечно-сосудистых центров. По патогенезу отёк разделяют на вазогенный, цитотоксический, интерстициальный и фильтрационный. Клинические проявления отёка мозга одинаковы вне зависимости от его патогенетического типа. Они состоят из сочетания трёх групп симптомов: обусловленных синдромом внутричерепной гипертензии, очаговых и стволовых симптомов. Присоединение стволовой симптоматики в клинике проявляется нарушениями дыхания, кровообращения, угнетением реакции зрачков и является жизнеугрожающим.
Геморрагическая трансформация (ГТ) инфаркта мозга часто осложняет течение кардиоэмболического инсульта. Основной ее причиной является нарушение микроциркуляции в перифокальной зоне и нарушение функции гематоэнцефалического барьера, возникающие при реперфузии, особенно при высоком АД и обширных зонах инфаркта. Непременным условием, способствующим ГТ, является повышенная проницаемость стенок мелких церебральных артерий, обусловливающая процесс диапедеза. Постгеморрагическая констриктивно-стенотическая артериопатия при разрыве внутричерепных аневризм часто осложняет течение субарахноидального кровоизлияния, вызывая формирования отсроченных очагов ишемии мозга, значительно утяжеляя состояние больного.
К гнойно-воспалительным осложнениям ОНМК относятся гипостатические и аспирационные пневмонии с развитием дистресс-синдрома, и инфицирование мочевыводящих путей. Пневмония – наиболее частое соматическое осложнение, развивающееся у 50-70% больных с угнетением сознания и(или) нарушениями дыхания, кровообращения и глотания. Пневмония развивается вследствие инфицирования ткани легких из-за нарушения механизма кашля, аспирации слизи и ротоглотки, а также трофических изменений в альвеолах, обусловленных дезорганизацией иннервации диафрагмы и легких, а также нозокомиальной инфекции. Дистресс – синдром осложнение наиболее тяжело протекающих пневмоний, обусловленный резким повышением проницаемости сосудистой стенки альвеол с накоплением жидкости в паренхиме легких и развитием отека. Инфицирование мочевыводящих путей возникает вследствие отсутствия или угнетения рефлекса, обеспечивающего нормальное опорожнение мочевого пузыря.
Тромбоз глубоких вен н/конечностей является фактором высокого риска развития ТЭЛА, и развивается вследствие длительной обездвиженности больного, вызывающей застой крови в венах, особенно при хроническом тромбофлебите или атеросклеротическом поражении вен. ТЭЛА – как результат заноса тромба (тромбов) из периферических вен в легочную артерию, является жизнеугрожающим состоянием.
Острые пептические язвы (стресс-язвы) – эрозивные (петехиальные) повреждения слизистой оболочки желудочно-кишечного тракта, возникают на фоне своеобразного стресса, обусловленного остро возникшим неотложным состоянием и проявляется выбросом в кровь избыточных количеств стрессовых медиаторов, повреждающих слизистую оболочку.
Трофические повреждения кожи и подкожной клетчатки (пролежни) возникают при длительной обездвиженности больных, формируются в участках тела наиболее плотно прилегающих к постели (в области костных выступов). Инфицирование пролежней, их длительное незаживление, является дополнительным фактором утяжеляющим состояние неврологического больного, способствующим развитию сепсиса и смерти больного. Применение антибактериальных препаратов при лечении гнойно-воспалительных осложнений нередко становится причиной дисбактериоза и развитием антибиотикоассоциированной диареи.
Данные осложнения ОНМК были рассмотрены и оценены на примере неврологического отделения для больных ОНМК Регионального сосудистого центра Амурской областной клинической больницы за период с декабря 2010г по декабрь 2011г. Всего за это время было пролечено 775 пациентов, их них 387 женщины и 388 мужчин.
В процентном соотношении большую часть в общей структуре осложнений ОНМК составили соматические - 78%, из которых преобладали – гнойно-септические (нозокомиальная и гипостатическая пневмония с развитием гидроторакса – 23%,), отек легких вследствие развития дистресс - синдрома и острой левожелудочковой недостаточности – 26%, полиорганная недостаточность при тяжело протекающих ОНМК – 7,3%, эрозивные гастриты, осложненные желудочно-кишечным кровотечением – 2,76%, тромбоз глубоких вен и ТЭЛА – 3%, трофические поражения кожи и подкожной клетчатки – 2%, на другие соматические осложнения в совокупности приходилось около 6%. Наиболее часто осложнения, такие как отек мозга с дислокационным синдромом и отек легких вследствие развития острой коронарной патологии возникали на 4-6 сутки от начала заболевания, другие частые осложнения (гипостатическая пневмония, тромбоз глубоких вен, эрозивные гастриты, пролежни) – наблюдались в более отсроченное время – на 2-3 недели от начала развития ОНМК.
Наибольший процент соматических осложнений наблюдался в возрастной группе от 70 лет и старше, что составило 35% от общего числа пролеченных в отделении больных. Преобладание данной группы пациентов связано с наличием у этой категории больных большого количество факторов риска (ИБС, нарушения сердечного ритма, гипертоническая болезнь, сахарный диабет, диффузный атеросклероз) недостаточная коррекция которых по месту жительства является причиной возникновения инсультов.
Доля церебральных осложнений составила 32%, из которых большее место принадлежит отеку головного мозга и развитию дислокационного синдрома, он же занимал ведущее место в общей структуре осложнений ОНМК, и являлся одной из основных причин летальности. Данное осложнение чаще отмечалось при геморрагических инсультах и обширных ишемических инсультах.
Высокий процент смертности в структуре ОНМК занимал ишемический инсульт – 70%, возраст умерших был от 60 лет и старше, что составило 79% от общего числа умерших.
Вывод. Полученные статистические данные показывают, что значение церебральных и соматических осложнений в течении ОНМК не должно быть недооценено, т.к. их предупреждение и ранняя терапия оказывают непосредственное влияние как на исход ОНМК, так и на возможность проведения реабилитационных мероприятий.
Благодаря созданию центров специализированной помощи больным с острой сосудистой патологией, где осуществляется высококлассная диагностика и высокотехнологичное лечение ОНМК, появилась возможность проведения специалистами междисциплинарных бригад комплекса реабилитационных и профилактических мероприятий, направленных на ускорение восстановления утраченных функций и улучшение качества жизни больных цереброваскулярной патологией.
ПРОГРЕССИРУЮЩАЯ ЛЕГОЧНАЯ ДИСТОРОФИЯ, КАК ОДИН ИЗ ВАРИАНТОВ
БУЛЛЕЗНОЙ ЭМФИЗЕМЫ ЛЕГКИХ. ДЕМОНСТРАЦИЯ СОБСТВЕННОГО НАБЛЮДЕНИЯ
Шелудько Е.Г., клинический ординатор; Ильин А.В., аспирант.
Научный руководитель: Леншин А.В., д.м.н., профессор.
ФГБУ «Дальневосточный научный центр физиологии и патологии дыхания» Сибирского отделения РАМН
Буллы и кистоподобные образования легких встречаются очень часто, однако, многие вопросы, связанные с их патогенезом, классифицированием и лечебной тактикой, остаются открытыми. В номенклатуре полостных образований легких существует большая путаница. Любая полость, заполненная воздухом, жидкостью или тканевым детритом, независимо от ее генеза и строения называется буллой или кистой. К буллам легких относят полости бронхиального происхождения - врожденные бронхоэктазы, эмфизематозные буллы, полости, возникающие после травм, абсцессов, туберкулеза.
Таким образом, воздушные полости в легких возникают по разным причинам, имеют разное морфологическое строение, разный исход и, следовательно, требуют разного подхода к выбору рациональной лечебной тактики. Одно из основных сложностей ранней диагностики эмфиземы заключается в том, что человек длительное время не ощущает своей болезни. В поле зрения врачей эти больные начинают попадать, когда болезнь приобретает инвалидизирующее течение и эмфизема сочетается с признаками хронической дыхательной недостаточности.
В 1937 году, Burke описал случай «исчезающего лёгкого» у 35-летнего мужчины, с прогрессирующей одышкой, дыхательной недостаточностью и рентгенологически подтверждёнными гигантскими буллами, занимающими более 2/3 обоих лёгких. Этиологии буллезной эмфиземы легких (БЭЛ) посвящена обширная литература. На современном этапе существует ряд теорий, пытающихся объяснить природу возникновения булл: генетическая, ферментативная, обструктивная, механическая, инфекционная, сосудистая. Одной из форм БЭЛ является прогрессирующая лёгочная дистрофия. L. Heilmeyer и F. Schmid (1956) описали клиническую картину болезни, склонной к прогрессированию, которая характеризовалась исчезновением легочной ткани, включая бронхи и сосуды в части легкого (сегменте, доле) или во всем легком. Этиология и патогенез болезни в настоящее время еще неясны.
В качестве примера приводится клинический случай наличия гигантских булл при отсутствии явной причины их возникновения в молодом возрасте, с уникальными компенсаторными возможностями человеческого организма.
Больной П.,26 лет, работающий водителем-экспедитором, поступил в ДНЦ ФПД СО РАМН, с жалобами на одышку при умеренной физической нагрузке, малопродуктивный кашель, боль в грудной клетке при глубоком дыхании, повышение температуры тела до 37,5 С0, дискомфорт в эпигастральной области. Из анамнеза известно, что впервые по поводу заболевания лёгких получал лечение с 2005 года, когда при выполнении флюорографии (ФЛГ) было выявлено увеличение внутригрудных лимфатических узлов, выставлен диагноз туберкулёз внутригрудных лимфоузлов слева. При обследовании больной жалоб не предъявлял. В дальнейшем, в течение 3-х лет получал противотуберкулёзную терапию, В 2009 г. снят с учета по туберкулезу, в связи с выздоровлением. С 2010 года отмечает ухудшение состояния, появилась одышка при умеренной физической нагрузке, малопродуктивный кашель. Обратился в ДНЦ ФПД, где была выполнена мультиспиральная компьютерная томография (МСКТ) органов грудной клетки, выявлены двухсторонние кистозно-буллёзные дистрофические изменения в лёгких.
При поступлении в клинику общее состояние удовлетворительное. Рост – 166 см, вес – 78 кг. Кожный покров бледный, прослеживается акроцианоз, грудная клетка бочкообразная, межрёберные промежутки расширены, эпигастральной угол тупой. Перкуторно - коробочный звук. Аускультативно - дыхание в лёгких везикулярное ослабленное, сухие рассеянные хрипы по всем полям. ЧД 22 в мин. Тоны сердца ритмичные, шумы не выслушиваются. ЧСС – 82 в минуту, АД 120 и 70 мм рт.ст. Дополнительные методы исследования: в клиническом анализе крови эритроцитоз, общий анализ мочи без патологии. В биохимическом анализе крови показатели в пределах нормы. По данным спирометрии ОФВ1 31,6%; ФЖЕЛ 32,3%; ЖЕЛ 40,2%; МОС50 21,4%; МОС75 2,56%; ПОС 83%; ИТ 78%. Данные показатели свидетельствуют о резком нарушении вентиляционной функции легких (ВФЛ) по рестриктивному типу. По данным бодиплетизмографии общая емкость лёгких (ОЁЛ) резко снижена, вследствие крайне резкого снижения остаточного объема легких (ООЛ) и жизненной ёмкости лёгких (ЖЕЛ). Бронхиальное сопротивление значительно повышено на вдохе. При форсированном дыхании отмечается нарушение ВФЛ на уровне дистальных бронхов. При бронхоскопии выявлен двухсторонний диффузный эндобронхит, интенсивность воспаления 1 степени. Сатурация крови на момент поступления в покое составляла 88%. На электрокардиограмме ЧСС 70 в мин, синусовая нормокардия. Повышена нагрузка на оба желудочка. При эхокардиографическом исследовании сердца: толщина передней стенки правого желудочка 4 мм, диастолический размер правого желудочка 26 мм, ФВ 58%,камеры сердца не расширены, клапанный аппарат без структурных изменений, сократительная способность левого желудочка не снижена, среднее давление в легочной артерии 19,0 мм.рт.ст.
П
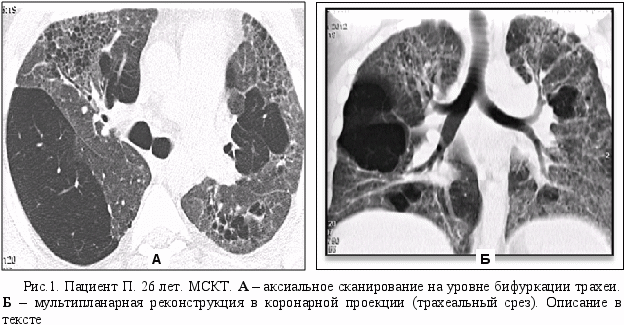
ри мультиспиральной компьютерной томографии (МСКТ) органов грудной клетки отмечается субтотальное поражение обоих лёгких начиная от верхушечных сегментов и до базальных, больше справа. (рис. 1). Определяются множественные буллёзно-кистозные структуры, мелкие полости диаметром 5-10 мм., которые прилегая друг к другу, образуя картину сотового лёгкого. Более крупные полости располагаются в основном изолированно, наибольшая часть из них (диаметром до 12 см) проецируется на среднюю зону правого лёгкого. При изучении структуры полостных образований, в них отмечается резкое обеднение лёгочного рисунка, а в неизмененных участках лёгких - его обогащение с гипопневматозом по типу «матового стекла».
Обращает на себя внимание, что при столь обширных (практически субтотальных) поражениях легочной ткани, состояние больного вполне компенсировано. Он свободно поднимается без остановок на пятый этаж, квалифицированно выполняет свою работу, связанную тяжелыми физическими нагрузками. Такое несоответствие характера и объема рентгеновских изменений в легких и скудности клинической картины, доказывает врожденную природу данного заболевания. Пораженные участки легкого эффективно компенсируются неизмененными, нормально функционирующими бронхолегочными структурами.
Дифференциально-диагностические затруднения успешно преодолены при использовании таких высокотехнологичных методов диагностики, как МСКТ, дополненных мультипланарной и трехмерной реконструкцией, инспираторно-экспираторными тестом, пробами с физической нагрузкой
Прогноз для жизни у таких пациентов сомнительный. Необходимо диспансерное наблюдение и поддерживающая симптоматическая терапия. Единственным кардинальным методом лечения, является трансплантация лёгких.
Медицинские науки. Секция хирургия
