«Белки. Нуклеиновые кислоты»
| Вид материала | Исследование |
- Лекция Нуклеиновые кислоты. Атф нуклеиновые кислоты, 119.07kb.
- Нуклеиновые кислоты, 296.24kb.
- Нуклеиновые кислоты, 122.08kb.
- Современные методы исследования бас выделение и анализ бас, 65.85kb.
- Белки составляют основу жизнедеятельности всех организмов, известных на нашей планете, 482.65kb.
- Современные методы исследования бас выделение и анализ бас, 182.61kb.
- «Нуклеиновые кислоты», 105.98kb.
- Урок 5 (9). Нуклеиновые кислоты и их роль в жизнедеятельности клетки. Атф и другие, 199.62kb.
- Нуклеиновые кислоты и атф. Автор(ы):, 111.28kb.
- Имд «Амины, аминокислоты, белки», 40.89kb.
Глава II. ТЕМА «БЕЛКИ. НУКЛЕИНОВЫЕ КИСЛОТЫ» В КУРСЕ ХИМИИ СРЕДНЕЙ ШКОЛЫ И ВУЗА
2.1 Программные требования к преподаванию темы «Белки. Нуклеиновые кислоты» в средней школ
| № урока | Тема занятия | Вводимые опорные понятия и представления. Формирование специальных навыков | Актуализация опорных знаний, умений, навыков по химии и междисциплинарным наукам |
| 1. | Белки – строение и свойства (2 часа) | Знать основные аминокислоты, образующие белки; понятие о первичной, вторичной и третичной структуре белков; свойства белков – гидролиз, денатурация, цветные реакции; превращения белков пищи в организме; иметь представление об успехах в изучении строения и синтезе белков. | Закрепление и углубление знаний об азотсодержащих органических соединениях, изомерии органических соединений, роли белков как биополимеров и нуклеиновых кислот в жизнедеятельности организмов. |
| 2. | Нуклеиновые кислоты (1 час) | Знать состав нуклеиновых кислот (ДНК, РНК); строение нуклеотидов; принцип комплементарности в построении двойной спирали ДНК. |
Демонстрации. Доказательство наличия функциональных групп в растворах аминокислот.
Лабораторные опыты. Решение экспериментальных задач на получение и распознавание органических веществ.
Практические занятия. Распознавание органических веществ по характерных реакциям; установление принадлежности вещества к определенному классу [45, 46].
2.2 Программные требования к преподаванию темы «Белки. Нуклеиновые кислоты» в вузе
| № пп | Тема лекции | Содержание | Объем в час. |
| 1 | Белки. Нуклеиновые кислоты (НК). | Белки и НК как биополимеры. Состав, структура, свойства и функции белков. Ферменты – биокатализаторы. ДНК и РНК, их состав, свойства и функции. Принцип комплементарности. Биосинтез белка. | 2 |
Согласно программе по химии высокомолекулярных соединений после изучения темы «Белки. Нуклеиновые кислоты» студент должен знать:
- иметь представление о белках и биологически активных веществах, структуре и свойствах важнейших типов биомолекул;
- основные физические свойства, способы идентификации и физико-химические методы исследования аминокислот, белков и нуклеиновых кислот;
- химические свойства аминокислот, белков и нуклеиновых кислот;
- нахождение в природе, использование в промышленности и народном хозяйстве аминокислот, белков и нуклеиновых кислот.
должен уметь:
- теоретически обосновать методы получения данных соединений;
- синтезировать, исследовать и идентифицировать аминокислоты, белки и нуклеиновые кислоты;
- выносить научно-обоснованное суждение об изученных закономерностях [47].
2.3 Теоретическая поддержка темы
2.3.1 Аминокислоты
Аминокислоты – органические соединения, в молекулах которых содержатся одновременно аминогруппа -NH2 и карбоксильная группа -COOH.
Их можно рассматривать как производные карбоновых кислот, получающихся замещением одного или нескольких атомов водорода в углеводородном радикале аминогруппами. Например:

Все аминокислоты, которые содержатся в белках любого происхождения, делят на 2 группы: ациклические (нециклические) и циклические.
Алициклические подразделяются на 3 подгруппы:
1) Моноаминомонокарбоновые – аминокислоты, содержащие одну амино- и карбоксильную группу.

б-аминоуксусная кислота (глицин) б-аминопропионовая кислота (аланин)

б-амино-в-гидроксопропионовая б-амино-в-меркаптопропионовая
кислота (серин) кислота (цистеин)

б-амино-в-оксимасляная кислота б-амино-в-тиометилмасляная
(треонин) кислота (цистеин)


б-амино-в-изовалерьяновая кислота б-амино-в-изокапроновая кислота изолейцин
(валин) (лейцин)
2) Диаминомонокарбоновые – аминокислоты, содержащие две амино- и одну карбоксильную группу.

аспаргин диаминокапроновая кислота (лизин)

аргинин глутамин
3) Моноаминодикарбоновые – аминокислоты, содержащие одну амино- и две карбоксильные группы.

аспарагиновая кислота (аминоянтарная) глутаминовая кислота (аминоглутаровая)
Циклические:

б-амино-в-фенилпропионовая б-амино-в-параоксифенилаланин кислота (фенилаланин) (тирозин)


б-амино-в-имидазолпропионовая б-амино-в-индолилпропионовая пролинкислота (гистидин) кислота (триптофан)
Номенклатура
Названия аминокислот производятся от названий соответствующих кислот с добавлением приставки амино-.
Тривиальная номенклатура. Аминокислоты, входящие в состав белков, имеют исторически сложившиеся практические названия. Например: аминоуксусная кислота – гликокол или глицин H2N-CH-COOH и т.д [48, 49–51].
Изомерия
Изомерия аминокислот зависит от расположения аминогруппы и строения углеводородного радикала. По расположению аминогруппы (по отношению к карбоксилу) различают: - аминокислоты (аминогруппа находится у 1 атома углерода), - аминокислоты (аминогруппа находится у 2 атома углерода), - аминокислоты (аминогруппа находится у 3 атома углерода) и т.д.
Например: CH3-CH2-COOH пропионовая кислота;


- аминопропионовая кислота; - аминопропионовая кислота.
Изомерия, обусловленная разветвлением углеводородного радикала – например, формулы изомерных соединений состава C3H6(NH2)COOH:

б-аминомасляная кислота в-аминомасляная кислота

в-аминоизомасляная кислота
Все природные аминокислоты не ароматического ряда, за исключением глицина, являются оптически активными и относятся к L-ряду, т.е. все вращают плоскость поляризации света влево:
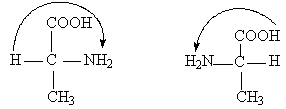
D-аланин L-аланин
Организм животных и человека усваивает только L-аминокислоты [48, 49–51, 53-57].
Получение аминокислот
1. Общий уровень синтеза аминокислот любого строения – замена на аминогруппу галогена в галогензамещенных кислотах, например:

б-бромпропионовая к-та б-аминопропионовая к-та

-хлормасляная кислота -аминомасляная кислота
2. Удобный метод получения -аминокислот предложен Н.Д. Зелинским. Исходными веществами служат альдегиды или кетоны:

3. Для получения -аминокислот можно воспользоваться присоединением аммиака к двойной связи - , - непредельных кислот:

кротоновая кислота в-аминомасляная кислота
4.Восстановлением оксимов и гидрозонов кетокислот:

ацетоуксусный эфир
5. Ароматические аминокислоты могут быть получены восстановлением нитропроизводных карбоновых кислот аренов:

Физические свойства
Аминокислоты – бесцветные кристаллические вещества с высокой температурой плавления (150 – 330С). Плавятся с разложением, нелетучи. Хорошо растворяются в воде и плохо в органических растворителях.
Химические свойства
Аминокислоты являются амфотерными соединениями, сочетающими в себе свойства кислот и оснований [49–51, 53-57].
Аминокислоты взаимодействуют со щелочами и кислотами с образованием солей:

2. Способность вступать в реакцию конденсации друг с другом с отщеплением воды и образованием линейных, циклических и линейно- циклических полимеров.
а) - аминокислоты могут образовать циклические амиды, построенные из двух молекул - аминокислот, такие соединения называются дикетопиперазинами:
 б) - аминокислоты легче других теряют молекулы аммиака и превращаются в непредельные кислоты:
б) - аминокислоты легче других теряют молекулы аммиака и превращаются в непредельные кислоты:
в-аминомасляная кислота кротоновая кислота
в) - аминокислоты образуют внутримолекулярные циклические амиды- лактамы:

-аминомасляная кислота лактам--аминомасляной кислоты
Применение
Аминокислоты необходимы для построения белков живого организма. Человек и животные получают их в составе белковой пищи. Многие аминокислоты применяются в медицине как лечебные средства, а некоторые используются в сельском хозяйстве для подкормки животных. Неразветвленные аминокислоты, как содержащие две функциональные группы, используются для производства синтетических волокон, в том числе капрона и энанта [49–51, 53-57].
2.3.2 Белки
Белки (полипептиды) – биополимеры, построенные из остатков -аминокислот, соединенных пептидными (амидными) связями.
Формально образование белковой макромолекулы можно представить как реакцию поликонденсации -аминокислот :

При взаимодействии двух молекул -аминокислот происходит реакция между аминогруппой одной молекулы и карбоксильной группы - другой. Это приводит к образованию дипептида.
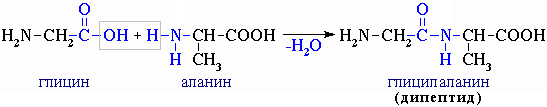
Из трех молекул -аминокислот (глицин+аланин+глицин) образуется трипептид: H2N-CH2CO-NH-CH(CH3)-CO-NH-CH2COOH
Аналогично происходит образование тетра-, пента- и полипептидов. Молекулярные массы различных белков составляют от 10 000 до нескольких миллионов. Макромолекулы белков имеют стеререгулярное строение, исключительно важное для проявления ими определенных биологических свойств.
Несмотря на многочисленность белков, в их состав входят остатки лишь 22 -аминокислот.
Функции белков в природе универсальны:
- каталитические (ферменты);
- регуляторные (гормоны);
- структурные (кератин шерсти, фиброин шелка, коллаген);
- двигательные (актин, миозин);
- транспортные (гемоглобин);
- запасные (казеин, яичный альбумин);
- защитные (иммуноглобулины) и т.д.
Разнообразные функции белков определяются -аминокислотным составом и строением их высокоорганизованных макромолекул. Выделяют 4 уровня структурной организации белков [57 60].
| Первичная структура – определенная последовательность -аминокислотных остатков в полипептидной цепи. | 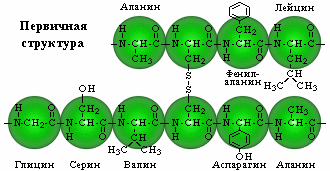 |
 | Вторичная структура - конформация полипептидной цепи, закрепленная множеством водородных связей между группами N-H и С=О. Одна из моделей вторичной структуры - -спираль, обусловленная кооперативными внутримолекулярными Н-связями. Другая модель - b-форма ("складчатый лист"), в которой преобладают межцепные (межмолекулярные) Н-связи. |
| Третичная структура – форма закрученной спирали в пространстве, образованная главным образом за счет дисульфидных мостиков -S-S-, водородных связей, гидрофобных и ионных взаимодействий. |  |
 | Четвертичная структура - агрегаты нескольких белковых макромолекул (белковые комплексы), образованные за счет взаимодействия разных полипептидных цепей |
