Белки составляют основу жизнедеятельности всех организмов, известных на нашей планете
| Вид материала | Документы |
- Белки, 41.04kb.
- Ед обитания человека, животных и растений (земли, воды и воздуха), катастрофическое, 98.33kb.
- Лекция 9 Концепция биосферы и экология, 46.18kb.
- Одной из актуальных задач ветеринарной науки является решение проблемы лейкоза крс, 43.16kb.
- Рабочая программа дисциплины «Эколого-физиологические основы адаптации животных» Код, 124.95kb.
- Тест Рокича "Ценностные ориентации", 780.46kb.
- Название сайта, 214.71kb.
- Доклад на тему, 158.48kb.
- Лана Александрова, 43.18kb.
- План Введение 1 Действие тяжелых металлов на растительные организмы 3 Химическая природа, 600.02kb.
Предисловие
Белки составляют основу жизнедеятельности всех организмов, известных на нашей планете. Это сложноорганизованные орга–нические молекулы, которые имеют большую молекулярную массу и представляют собой биополимеры, состоящие из аминокислот. К биополимерам клетки также относятся нуклеиновые кислоты – ДНК и РНК, которые являются результатом полимеризации нуклеотидов.
Метаболизм белков и нуклеиновых кислот включает их синтез из структурных компонентов аминокислот и нуклеотидов соответ–ственно и распад до указанных мономеров с последующей их деградацией до конечных продуктов катаболизма - СО2, Н2О, NН3, мочевой кислоты и прочих.
Эти процессы химически сложно организованы и практически не существует альтернативных обходных путей, которые могли бы нормально функционировать при возникновении нарушений метаболизма. Известны наследственные и приобретенные заболевания, молекулярной основой которых являются изменения обмена аминокислот и нуклеотидов. Некоторые из них имеют тяжелые клинические проявления, но, к сожалению, в настоящее время не существует эффективных методов их лечения. Речь идет о таких заболеваниях, как подагра, синдром Леша-Нихана, ензимопатии аминокислотного обмена. В связи с этим детальное изучение обмена аминокислот и нуклеотидов в норме и их возможных нарушений имеет большое значение для формирования арсенала теоретических знаний, необходимых в практической деятельности врача.
При написании конспекта лекций «Метаболизм аминокислот и нуклеотидов» авторы не ставили перед собой задачу подробно описать все химические процессы и превращения аминокислот и нуклеотидов, которые любознательный студент может найти в любом учебнике по биохимии. Основной задачей было изложить материал так, чтобы сложные биохимические реакции воспринимались легко, доступно, понятно, с выделением главного. Для «сильных» студентов материалы лекций могут стать отправным пунктом в последующем, более глубоком изучении биохимических превращений. Для тех, кому биохимия не стала любимым предметом, лекции помогут сформировать основу биохимических знаний, необходимых при изучении клинических дисциплин. Авторы выражают надежду, что предлагаемый конспект лекций станет для студентов добрым помощником на пути к их будущей профессии.
Лекция 1
Тема. Метаболизм аминокислот: общие пути метаболизма. Синтез мочевины
^ План
1 Пути превращения аминокислот в тканях.
2 Трансаминирование аминокислот.
3 Дезаминирование аминокислот. Непрямое дезаминирование.
4 Декарбоксилирование аминокислот.
^ 5 Обмен аммиака. Биосинтез мочевины. Некоторые клинические аспекты.
1 Пути превращения аминокислот в тканях
Аминокислоты - основной источник азота для организма млекопитающих. Они являются связующим звеном между процессами синтеза и распада азотсодержащих веществ, в первую очередь белков. За сутки в организме человека обновляется до 400 г белка. В целом период распада всех белков организма человека составляет 80 суток. Необратимо распадается четвертая часть белковых аминокислот (около 100 г). Эта часть возобновляется за счет пищевых аминокислот и эндогенного синтеза - синтеза заменимых аминокислот.
В клетках постоянно поддерживается определенный стационарный уровень аминокислот - фонд (пул) свободных аминокислот. Этот фонд обновляется за счет поступления аминокислот и используется для синтеза биологически важных химических компонентов клетки, т.е. можно выделить пути поступления и использования клеточного пула аминокислот.
Пути поступления свободных аминокислот, образующих аминокислотный фонд в клетке:
1 ^ Транспорт аминокислот из внеклеточной жидкости - транспортируются аминокислоты, которые всасываются в кишечнике после гидролиза пищевых белков.
2 Синтез заменимых аминокислот - в клетке из промежуточных продуктов окисления глюкозы и цикла лимонной кислоты могут синтезироваться аминокислоты. К заменимым аминокислотам относятся: аланин, аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин, пролин, глицин, серин.
- ^ Внутриклеточный гидролиз белков - это основной путь поступления аминокислот. Гидролитическое расщеп–ление тканевых белков катализируют лизосомальные протеазы. При голодании, онкологических и инфекцион–ных заболеваниях этот процесс усиливается.
^ Пути использования аминокислотного фонда:
1) Синтез белков и пептидов - это основной путь потребления аминокислот - 75-80% аминокислот клетки идет на их синтез.
2) ^ Синтез небелковых азотсодержащих соединений:
- пуриновых и пиримидиновых нуклеотидов;
- порфиринов;
- холина;
- креатина;
- меланина;
- некоторых витаминов и коферментов (НАД, КоА, фолиевая кислота);
- биогенных аминов (гистамин, серотонин);
- гормонов (адреналин, тироксин, трийодтиронин);
- медиаторов (норадреналин, ацетилхолин, ГАМК).
3) ^ Синтез глюкозы с использованием углеродных скелетов гликогенных аминокислот (глюконеоге–нез).
4) Синтез липидов с использованием ацетильных остатков углеродных скелетов кетогенных аминокислот.
5) ^ Окисление до конечных продуктов обмена (СО2, Н2О, NH3) - это один из путей обеспечения клетки энергией - до 10% общих энергетических потребностей. Все аминокислоты, которые не используются в синтезе белков и других физиологически важных cоединений, подвергаются расщеплению.
Существую общие и специфические пути метаболизма аминокислот. К общим путям катаболизма аминокислот относятся:
1) трансаминирование;
2) дезаминирование;
- декарбоксилирование.
2 Трансаминирование аминокислот
Трансаминирование аминокислот - основной путь дезаминирования аминокислот, который происходит без образования свободного NH3. Это обратимый процесс переноса NH2–группы с аминокислоты на –кетокислоту. Процесс открыли А.Е. Браунштейн и М.Б. Крицман (1937).
В трансаминировании могут принимать участие все аминокислоты, кроме треонина, лизина, пролина и гидроксипролина.
Реакция трансаминирования в общем виде выглядит следующим образом:








 СООН СООН СООН СООН
СООН СООН СООН СООН 




 НС — NH2 + C = O C = O + НС — NH2
НС — NH2 + C = O C = O + НС — NH2 R1 R2 R1 R2
аминокислота -кетокислота
Ферменты, которые катализируют реакции этого типа, называются аминотрансферазами (трансаминаза–ми). В организме человека функционируют аминотрансфе–разы L–аминокислот. Акцептором аминогруппы в реакции являются -кетокислоты – пируват, оксалоацетат, -кето–глутарат. Наиболее распространенные аминотрансферазы – АлАТ (аланинаминотрансфераза), АсАТ (аспартатамино–трансфераза), тирозинаминотрансфераза.
Реакция, которую катализирует фермент АлАТ, представлена ниже:
СООН СООН CООН СООН
│ │ АлАТ │ │
НСNH2 + C = O C = O + HCNH2
│ │ │ │
CH3 CH2 CH3 CH2
Ала │ ПВК │
CH2 CH2
│ │
COOH COOH
-кетоглутарат глу
Реакцию, которую катализирует фермент АсАТ, схематически можно изобразить следующим образом:
^ Асп + -кетоглутарат Оксалоацетат + Глу.
Кофермент трансаминаз – пиридоксальфосфат (В6) – входит в состав активного центра фермента. В процессе трансаминирования кофермент выполняет роль перенос–чика аминогруппы, и происходит взаимопревращение двух коферментных форм ПАЛФ(пиридоксаль–5–ф) и ПАМФ (пиридоксамин–5–ф):
+ NH2–группа
ПАЛФ ПАМФ.
- NH2–группа
Трансаминирование активно протекает в печени. Это позволяет регулировать концентрацию любых амино–кислот в крови, в том числе и поступивших с пищей (за исключением тре, лиз, про). Благодаря этому оптимальная смесь аминокислот переносится с кровью во все органы.
Некоторые клинические аспекты
В ряде случаев может происходить нарушение трансаминирования аминокислот:
1) при гиповитаминозе В6;
2) при лечении туберкулеза антагонистами трансами–аз – фтивазидом и его аналогами;
3) при голодании, циррозе и стеатозе печени наблюда–ется недостаток синтеза белковой части трансами–наз.
Для диагностики имеет значение определение активности аминотрансфераз в плазме крови. При патологических состояниях происходит усиление цитолиза в том или ином органе, что сопровождается повышением активности этих ферментов в крови.
Отдельные трансаминазы находятся в различных тканях в неодинаковом количестве. АсАТ больше в кардиомиоцитах, печени, скелетных мышцах, почках, поджелудочной железе. АлАТ – в рекордном количестве в печени, в меньшей степени - в поджелудочной железе, миокарде, скелетной мускулатуре. Следовательно, повышение активности АсАТ в крови более характерно для инфаркта миокарда (ИМ), а повышение активности АлАТ может свидетельствовать о цитолизе в гепатоцитах. Так, при остром инфекционном гепатите в крови активность АлАТ > АсАТ; но при циррозе печени - АсАТ > АлАТ. Незначительное повышение активности АлАТ имеет место также при ИМ. Поэтому определение активности сразу двух трансаминаз является важным диаг–ностическим тестом. В норме соотношение активностей АсАТ/АлАТ (коэффициент де Ритиса) составляет 1,330,42. При ИМ величина этого коэффициента резко возрастает, у больных инфекционным гепатитом, напротив, происходит снижение этого показателя.
^ 3 Дезаминирование аминокислот. Непрямое дезамини–рование
С трансаминированием тесно связан процесс окислительного дезаминирования, в результате которого происходит отщепление NH2 -группы с образованием NH3, Н2О и -кетокислоты. Дезаминирование аминокислот наиболее активно происходит в печени и почках.
Процесс катализируют ферменты оксидазы, кото–рые являются флавопротеинами. Существуют оксидазы L- и D-аминокислот. Оксидазы L–аминокислот ФМН–зависи–мые, D-аминокислот ФАД–зависимые.
Реакцию окислительного дезаминирования L-ами–нокислот схематически можно представить следующим образом:
^ ФМД ФМН·Н+ Н2О NH3

L

 –АК L–иминокислота -кетокислоты.
–АК L–иминокислота -кетокислоты.В организме человека активность оксидаз аминокислот крайне низкая.
Наиболее активно в клетках происходит окислительное дезаминирование L–глутаминовой кислоты:
^ НАД НАДН·Н+ Н2О

L



 –глутамат L–иминоглутарат -КГ + NH3.
–глутамат L–иминоглутарат -КГ + NH3.1 2
1 - Глутаматдегидрогеназа (может использовать как НАД+, так и НАДФ+);
2 - Эта стадия протекает неферментативно.
Схематически общее уравнение реакции (эта реакция обратима):
L-Глу + НАД + Н2^ О -КГ + НАДН·Н+ + NH3
L–глутаматдегидрогеназа – фермент, катализирую-щий эту реакцию, который имеет высокую активностью и широко распространен в тканях млекопитающих.
Глутаматдегидрогеназа печени – регуляторный фермент, который локализован в митохондриях. Активность этого фермента зависит от энергетического статуса клетки. При дефиците энергии реакция происходит в направлении образования -кетоглутарата и НАДН.Н+, которые направляются в ЦЛК и окислительное фосфо–рилирование соответственно. В результате происходит усиление синтеза АТФ в клетке. Поэтому для глутамат–дегидрогеназы ингибиторы – АТФ, ГТФ, НАДН, а активатор – АДФ.
Большинство аминокислот дезаминируются путем не–прямого дезаминирования – это процесс сопряжения 2 ре–акций:
1) трансаминирование с образованием глутамата;
2) глутаматдегидрогеназная реакция.
а


 минокислота -КГ НАДН·Н+
минокислота -КГ НАДН·Н+ 
NH3 1 2 NH3
-кетокислота Глутамат НАД
В этом случае биологический смысл трансаминирования (1) состоит в том, чтобы собрать аминогруппы всех распадающихся аминокислот в виде аминокислоты одного вида - глутамата. Далее глутаминовая кислота транспортируется в митохондрии, где подвергается окислительному дезаминированию под действием глутаматдегидрогеназы (2).
Наиболее активно непрямое дезаминирование происходит в печени. Здесь образующийся NH3 поступает в цикл мочевинообразования для обезвреживания.
Направленность равновесных процессов трансами–нирования, непрямого дезаминирования во многом зависит от наличия и концентрации аминокислот и -кетокислот. При избытке аминного азота усиливается превращение аминокислот в соответствующие кетокислоты с последую-щей их энергетической и пластической утилизацией.
^ 4 Декарбоксилирование аминокислот
Это процесс отщепления карбоксильной группы, которая находится в -положении аминокислоты, с образо-ванием аминов и СО2. В результате декарбоксилирования аминокислот образуются:
- биогенные амины (гистамин, дофамин, тирамин, –аминомасляная кислота - ГАМК и др).
Например:
СООН СН2NH2


СНNH2 СО2 СН2


 СН2 СН2
СН2 СН2

СН2 СООН

СООН
Глу ГАМК
Декарбоксилирование аминокислот с образованием биогенных аминов наиболее активно происходит в печени, мозге и хромаффинной ткани.
2) продукты «гниения белков в кишечнике», которые являются результатом декарбоксилирование ами–нокислот под действием микрофлоры кишечника. Из аминокислот образуются токсические продукты, например:
 -СО2
-СО2лизин кадаверин
-СО2
 орнитин путресцин
орнитин путресцинВсего в организме человека образуется более 40 различных аминов. Усиление синтеза аминов наблюдается при гипоксии и голодании. Местное увеличение синтеза, освобождение и инактивации катехоламинов, гистамина и серотонина свойственно очагам воспаления.
Злокачественные опухоли апудоцитарного проис–хождения, находящиеся в кишечнике, бронхах, поджелу–дочной железе, могут синтезировать большое количество серотонина (используя для этой цели до 60% суточной потребности триптофана).
^ Биогенные амины инактивируются под действием окислительных ФАД–зависимых ферментов - моноамино–оксидаз (МАО). Происходит окислительное дезаминиро–вание аминов до альдегидов.
O
║
R–CH2–NH2 + ФАД + Н2О R–CH + NH3 + ФАДН2
Продукты дезаминирования биогенных аминов – альдегиды – окисляются до органических кислот с помощью альдегиддегидрогеназ. Эти кислоты экскрети–руются с мочей или подвергаются дальнейшей окисли–тельной деградации. Кроме того, в деградации катехолами-нов принимает участие катехол–О–метилтрансфераза.
Некоторые клинические аспекты
В условиях блокады МАО (при терапии антидеп–рессантами) снижается способность разрушать амины. В этом случае организм может стать чувствительным к действию аминов. Например, прием в пищу сыра и употребление некоторых сортов красного вина, которые богаты тирамином, на фоне терапии ингибиторами МАО ведет к гипертензии.
Снижение активности МАО наблюдается при избытке тиреоидных гормонов.
Повышение активности МАО может происходить при авитаминозе В1, т.к. один из продуктов обмена В1 является ингибитором МАО.
^ 5 Обмен аммиака. Биосинтез мочевины. Некоторые клинические аспекты
Аммиак – это один из конечных продуктов обмена азотсодержащих веществ. Это составляющая фракции остаточного азота сыворотки крови (наряду с мочевиной, мочевой кислотой, креатинином, индиканом). В крови концентрация аммиака невелика - 25-40 мкмоль/л. При более высоких концентрациях он оказывает токсическое действие на организм.
Аммиак токсичен, в первую очередь для ЦНС. Токсичность аммиака связана с его способностью нарушать функционирование ЦЛК, т.к. NH3 выводит из ЦЛК –кетоглутарат:
–КГ + NH3 + НАДН.Н+ Глу + НАД+ + Н2О.
В итоге восстановительного аминирования –кето–глутарата происходит снижение активности ЦЛК в клетках ЦНС, что, в свою очередь, угнетает активность аэробного окисления глюкозы. В результате нарушается энергопро–дукция и развивается гипоэнергетическое состояние, т.к. глюкоза – это основной источник энергии для головного мозга.
NH3 образуется в ходе следующих процессов:
1) окислительного дезаминирования аминокислот – это основной путь продукции NH3 ;
- дезаминирования биогенных аминов;
- дезаминирования пуриновых оснований (аденин, гуанин);
- катаболизм пиримидиновых нуклеотидов.
В головном мозге основной источник образования NH3 – дезаминирование АМФ до инозинмонофосфата (ИМФ):
АМФ + Н2О ИМФ + NH3.
Фермент, который катализирует эту реакцию, - аденозиндезаминаза.
Аммиак транспортируется кровью к печени и почкам для обезвреживания в составе аминокислот, среди которых основными являются глутамин, аспарагин, аланин.
Обезвреживание NH3 происходит практически сразу после его образования, т.к. в тканях он сразу же включается в состав аминокислот, главным образом глутамина. Однако для дальнейшей детоксикации и выведения амиака существуют биохимические процессы в печени и почках, которые и являются основными путями обезвреживания NH3.
Выделяют следующие механизмы обезвреживания NH3:
1) восстановительное аминирование –кетоглутарата;
2) образование амидов аминокислот – аспарагина и глутамина;
^ 3) образование аммонийных солей в почках;
4) синтез мочевины.
В тканях аммиак подлежит немедленной нейтрализа–ции. Это достигается путем сочетания процессов (1) и (2).
- ^ Восстановительное аминирование –кетоглутарата:
NH3 + –КГ + НАДН.Н+ Глу + НАД + Н2О.
Фермент - глутаматдегидрогеназа
Для этого процесса необходимы значительные концентрации –КГ. Для того чтобы не было перерасхода –КГ и работа ЦЛК не была нарушена, –КГ пополняется за счет превращения ПВК ОА –КГ .
2) ^ Образование амидов – это важный вспомогательный механизм обезвреживания NH3 в тканях путем его связывания с Глу или Асп.
Асп + АТФ + NH3 Асн + АМФ + ФФнн
Фермент - аспарагинсинтаза
Глу + АТФ + NH3 Глн + АМФ + ФФнн
Фермент - глутаминсинтаза
Этот процесс наиболее активен в ЦНС, мышцах, почках, печени (для поддержания внутренней концентрации NH3). Главным образом глн является транспортной формой нетоксичного NH3 из мозга, мышц и др. тканей. Глутамин легко проникает через мембрану, т.к. при физиологических значениях рН он не имеет заряда. При физической нагрузке аланин активно транспортирует NH3 от мышц к печени. Кроме того, большое количество аланина содержит кровь, оттекающую из кишечника. Этот аланин также направляется в печень для глюконеогенеза.
3) Глн и асн с током крови попадают в почки, где подвергаются гидролизу с помощью специальных ферментов – глутаминазы и аспарагиназы, которые есть и в печени:
Асн + Н2О Асп + NH3.
Глн + Н2О Глу + NH3.
Освободившийся в канальцах почек NH3 нейтрализуется с образованием солей аммония, которые выводятся с мочей:
NH3 + Н++ Сl- NH4Cl.
4) ^ Синтез мочевины - это основной путь обезвреживания аммиака. На долю мочевины приходится 80% экскретируемого азота.
Процесс образования мочевины происходит в печени и представляет собой циклический процесс, который называется «орнитиновый цикл» (цикл Кребса–Гензелайта).
В цикле принимают участие две аминокислоты, которые не входят в состав белков – орнитин и цитруллин, и две протеиногенные аминокислоты – аргинин, аспарагин.
Процесс включает пять реакций: первые две протекают в митохондриях, остальные - в цитозоле гепатоцитов. Некоторые ферменты мочевинообразования есть в мозге, эритроцитах, сердечной мышце, однако весь набор ензимов есть только в печени.
І реакция – это синтез карбамоилфосфата:
СО2 + NH3 + 2АТФ NH2^ –CО–Ф + 2АДФ + Фн.
Фермент - карбамоилфосфатсинтаза І (митохонд–риальный). Существует также карбамоилфосфатсинтаза ІІ (в цитозоле), которая участвует в синтезе пиримидиновых нуклеотидов.
Карбамоилфосфатсинтаза І - регуляторный фермент, для которого активатором является N–ацетилглутамат.
ІІ реакция – включение карбамоилфосфата в циклический процесс. В этой реакции происходит его конденсация с орнитином), в результате чего образуется цитруллин (реакция также происходит в митохондриях).
^ III реакция - образование аргининосукцината. Это вторая реакция, в которой используется энергия АТФ.
IV реакция - расщепление аргининосукцината с образованием аргинина и фумарата. Последний может поступать в ЦЛК, усиливая его работу. Т.о. это анаплеротическая (пополняющая) реакция для ЦЛК.
^ V реакция - регенерация орнитина с образованием мочевины.
Схема синтеза мочевины
С
 О2 + NH3 + 2АТФ карбамоилфосфат + 2АДФ + Фн
О2 + NH3 + 2АТФ карбамоилфосфат + 2АДФ + Фн1
 NH2–CО–NH2
NH2–CО–NH2 
 (мочевина) Орнитин
(мочевина) Орнитин  Фн
Фн5 2



Аргинин Цитруллин
 4 3 АТФ
4 3 АТФ 
 Фумарат АМФ
Фумарат АМФАргининосукцинат ФФн
Ферменты:
1 - карбамоилфосфатсинтаза;
2 - орнитинкарбамоилтрансфераза;
3 - аргининосукцинатсинтаза;
4 - аргининосукцинатлиаза;
5 - аргиназа (сильными ингибиторами фермента являются орнитин и лизин, конкурирующие с аргинином, активаторы - Са2+ и Мn2+).
Орнитин, который восстанавливается в ходе цикла, может запускать новый цикл мочевинообразования. По своей роли орнитин аналогичен оксалоацетату в ЦЛК. Для прохождения одного цикла необходимо 3 АТФ, которые используются в 1–й и 3–й реакциях.
Орнитиновый цикл тесно взаимосвязан с ЦЛК.
Схематически взаимосвязь можно представить так:



 2 АТФ
2 АТФ 
 Орнити- СО2
Орнити- СО2
 новый ЦЛК
новый ЦЛКцикл
 ОА
ОА
 Фумарат АТФ
Фумарат АТФ
Аспартат

Это «двухколесный велосипед» Кребса – ни одно колесо не способно «вращаться» без исправного функционирования второго.
Экскреция синтезированной мочевины обеспечивается почками. За сутки выделяется 20-35 г мочевины. При изменении количества белка в пище с целью поддержания азотистого равновесия скорость синтеза мочевины в организме изменяется:
белка с пищей синтез ферментов цикла синтез мочевины,
если катаболизм белков синтез мочевины количество
выводимого азота.
Усиление катаболизма белков и, следовательно, повыше–ние экскреции мочевины наблюдаются при голодании и сахарном диабете.
При заболеваниях печени, которые сопровождаются нарушением синтеза мочевины, увеличивается концентра–ция аммиака в крови (гипераммониемия) и, как следствие, развивается печеночная кома.
Генетические дефекты ферментов синтеза мочевины
Известны врожденные метаболические нарушения, обусловленные недостатком каждого из пяти ферментов цикла.
При нарушении синтеза мочевины наблюдается повышение концентрации аммиака в крови - гипераммониемия, которая наиболее выражена при дефекте 1–го и 2–го ферментов.
^ Клинические симптомы - общие для всех нарушений орнитинового цикла: рвота (у детей), отвращение к богатым белками продуктам, нарушение координации движений, раздражительность, сонливость, умственная отсталость. В некоторых случаях может наступить смерть в течение первых месяцев жизни.
Диагностирование нарушений проводят:
1) путем определения концентрации аммиака и промежуточных продуктов орнитинового цикла в крови и моче;
2) путем определения активности ферментов в биоптатах печени.
К наследственным энзимопатиям орнитинового цикла относятся:
- гипераммониемия І типа – недостаток карбамоил–фосфат–синтазы І (немногочисленные случаи, тяжелая гипераммониемия);
- гипераммониемия ІІ типа – недостаток орнитин–карбамоилтрансферазы (многочисленные случаи). В крови, спинномозговой жидкости и моче повышается концентрация аммиака и глутамина, Увеличение концентрации аммиака приводит к повышению активности глутаминсинтазы;
- цитруллинемия – дефект аргининосукцинатсинтазы (редкое заболевание). С мочой экскретируется большое количество цитруллина, повышается концентрация цитруллина в плазме и спинномозковой жидкости;
- аргининосукцинатная ацидурия – дефект аргинино–сукцинатлиазы (редкое заболевание). Повышается концентрация аргининосукцината в крови, спинномозговой жидкости и моче. Болезнь, как правило, развивается рано и приводит к фатальному исходу в раннем возрасте. Для диагностики этого заболевания используют определение наличия аргининосукцината в моче (хроматография на бумаге) и эритроцитах (дополнительно). Раннюю диагностику проводят путем амниоцентеза;
- аргининемия - дефект аргиназы. Наблюдается повышение концентрации аргинина в крови и спинномозговой жидкости (в эритроцитах низкая активность аргиназы). Если больного перевести на малобелковую диету, то концентрация аммиака в крови снижается.
Лекция 2
Тема. Специализированные пути метаболизма
аминокислот и циклических аминокислот.
Наследственные энзимопатии
аминокислотного обмена
План
1 Пути метаболизма безазотистого скелета аминокис–лот. Гликогенные и кетогенные аминокислоты.
^ 2 Метаболизм глицина и серина.
3 Метаболизм серусодержащих аминокислот. Синтез креатина.
4 Метаболизм аминокислот с разветвленной цепью.
5 Метаболизм циклических аминокислот (фенилала–нина, тирозина, триптофана и гистидина).
^ 6 Наследственные нарушения обмена аминокислот.
1 Пути метаболизма безазотистого скелета аминокис–лот. Гликогенные и кетогенные аминокислоты
Безазотистые скелеты аминокислот (–кетокисло–ты) образуются в результате реакций трансаминирования и дезаминирования.
Углеродные скелеты протеиногенных аминокислот после отщепления NH2–группы превращаются в конечном итоге в 5 продуктов, которые вовлекаются в ЦЛК: ацетил–КоА, фумарат, сукцинил–КоА, –кетоглутарат, оксало–ацетат.
В ЦЛК происходит полное окисление углеродных скелетов аминокислот с высвобождением значительного количества энергии, которое соизмеримо количеством энергии, высвобождающимся при аэробном окислении 1 молекулы глюкозы.
Схематически пути вхождения -кетокислот в ЦЛК показаны ниже:
Ала, Цис, Тре
Гли, Сер,
Лей, Иле,
Трп
ПВК
Ацетил–КоА

 ацетоацетил-КоА
ацетоацетил-КоААсн, Асп
ОА



Лей, Лиз,
Тир, Фен, Трп
ЦЛК
Фумарат
–КГ

Фен, Тир
Глн, Глу, Арг, Гис, Про
Сукцинил-КоА
Иле, Вал, Мет
Гликогенные и кетогенные аминокислоты
Гликогенные аминокислоты – это аминокислоты, которые могут быть субстратами для синтеза глюкозы, т.к. мо–гут превращаться в пируват, оксалоацетат, фосфоенол–пируват - это соединения–предшественники глюкозы при глюконеогенезе. К таким аминокислотам относятся все протеиногенные аминокислоты за исключением Лей, Лиз.
^ Кетогенные аминокислоты – это субстрат для кетогенеза и синтеза липидов. К ним относятся Лей, Лиз, Иле, Тир, Трп, Фен. Лей и Лиз - это истинно кетогенные аминокислоты, т.к. Иле, Трп, Фен могут быть одновременно и гликогенными.
^ 2 Метаболизм глицина и серина
Глицин - это заменимая аминокислота, которая в организме человека может образовываться из серина, треонина, холина и др. веществ. Глицин входит в совтав многих биологически важных пептидов и белков (инсулина, тиреоглобулина, альбуминов, глобулинов, коллагена и др.) В организме человека эта аминокислота используется для синтеза ряда метаболитов. Схематически эти процессы изображены ниже:
Белки Глутатион
 Треонин
Треонин
 Гиппуровая кислота
Гиппуровая кислота

 Глицин Порфирины Гемоглобин
Глицин Порфирины Гемоглобин 
Желчные кислоты
Пуриновые основания
Серин Креатин Пируват
^ Холин Глюкоза
Серин - это также заменимая аминокислота, общая схема метаболизма которой приводится ниже:
Триптофан
Глицин
 Ацетилхолин
Ацетилхолин


 Холин Сфингомиелин
Холин Сфингомиелин  Фосфотидилхолин
Фосфотидилхолин Серин

 Пируват
Пируват Глюкоза
 Аминокислоты
АминокислотыБелки
Серин в организме образуется из глюкозы, глицина и аланина.
Глицин превращается в серин с участием коферментной формы фолиевой кислоты (Вс) - тетрагидрофолиевая кислота, или ТГФК (Н4–фолат).
^ 3 Метаболизм серусодержащих аминокислот. Синтез креатина
Метионин – это незаменимая аминокислота, которая является основным донором метильных групп в реакциях метилирования.
Активная форма – S-аденозилметионин (SAM), реакция образования которого показана ниже:
^ Мет + АТФ S-Аденозилметионин + ФФн + Фн.
Фермент - метионинаденозилтрансфераза.
SAM участвует в реакциях метилирования при синтезе: холина, креатина, адреналина, меланина, нуклеотидов, растительных алкалоидов. После переноса СН3 -группы SAM превращается в S-аденозилгомоцистеин, который в результате последовательности реакций восстанавливается до метионина:
S
 -аденозилметионин S-аденозилгомоцистеин
-аденозилметионин S-аденозилгомоцистеин 
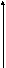
аденозин
м
 етионин пищи
етионин пищим
 етионин гомоцистеин.
етионин гомоцистеин.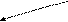
сукцинил–КоА
Этот циклический процесс не может функционировать без постоянного поступления Мет, т.к. Мет расходуется в реакциях катаболизма.
Мет как донор метильных груп принимает участие в синтезе креатина.
Синтез креатина
Креатин – основной субстрат для образования креатинфосфата в мышцах и нервной ткани. Синтез креатина происходит последовательно в почках и печени (некоторая часть его может синтезироваться в поджелудочной железе).
Выделяют две стадии синтеза:
1 Происходит в почках:
^ Арг + Глн Орнитин + Гликоциамин.
(Гуанидинацетат)
Фермент - глицинамидинотрансфераза (трансами–наза).
2 Происходит в печени после транспорта из почек гликоциамина:
S–Аденозилметионин S–Аденозилгомоцистеин

 ^ Гликоциамин Креатин
^ Гликоциамин КреатинФермент - гуанидинацетатметилтрансфераза.
Далее креатин фосфорилируется с образованием макроэргического фосфата - креатинфосфата, который является формой депонирования энергии в мышцах и нервной системе. Фермент, катализирующий эту реак–цию, - креатинфосфокиназа (КФК):
КФК
^ К
 реатин + АТФ Креатин–ф + АДФ
реатин + АТФ Креатин–ф + АДФ 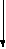
неферментативно
к
 реатинин с мочой.
реатинин с мочой.Цис - это заменимая аминокислота, основная роль которой состоит в следующем:
1) принимает участие в стабилизации структуры белков и пептидов - образует дисульфидные связи;
- является структурным компонентом трипептида глутатиона (глу-цис-гли), который в качестве кофермента и принимает участие в функционировании антиоксидантной системы организма, транспорте некоторых аминокислот через мембраны, восстановле–нии аскорбиновой кислоты из дегидроаскорбиновой и т.д.
Глутатион – это кофермент такой оксидоредуктазы, как глутатионпероксидаза. Этот селенсодержащий фермент катализирует реакцию детоксикации органических пероксидов. Это важный механизм предотвращения перекисного окисления липидов, которое может быть стимулировано под действием радиации или ксенобиотиков. Т.о. глутатион является внутриклеточным антиоксидантом;
3) при катаболизме цис образуется пируват, который используется как субстрат для глюконеогенеза, т.е. цис - гликогенная аминокислота;
- принимает участие в синтезе таурина - физиоло–гически важного соединения, которое необходимо для образования парных желчных кислот, может выполнять функцию медиатора в ЦНС и важен в функционировании миокарда.
Таурин образуется в реакции:
-СО2
 Цис Цистеиновая кислота Таурин
Цис Цистеиновая кислота Таурин


 СН2 – СН – СООН СН2 – СН2
СН2 – СН – СООН СН2 – СН2HO3S NH2 SH NH2
Таурин способствует снижению уровня холестерина при атеросклерозе, т.к. участвует в синтезе желчных кислот.
Его рекомендуют при заболеваниях сердца, печени, алкогольной интоксикации, химических отравлениях, оказывает противолучевое действие.
^ 4 Метаболизм аминокислоты с разветвленной цепью
Аминокислоты с разветвленной цепью (АКРЦ) -валин, лейцин, изолейцин - при катаболизме превращаются в –кетокислоты (оксикислоты с разветвленной цепью - ОКРЦ). -NH3
АКРЦ ОКРЦ
Этапы окисления АКРЦ:
1) трансаминирование:
АКРЦ + –КГ ОКРЦ + Глу.
Фермент - АКРЦ–аминотрансфераза.
Наибольшая активность этого фермента наблюдается в сердце, почках, меньше – в скелетных мышцах, самая низкая – в печени;
2) дегидратация ОКРЦ до промежуточных продуктов ЦЛК. Фермент - дегидрогеназа ОКРЦ – локализован во внутренней мембране митохондрий и катализирует реакцию окислительного декарбоксилирования, в результате которой образуются промежуточные продукты ЦЛК:
^ Лей ацетил–КоА и ацетоацетат.
Вал, Иле сукцинил–КоА.
Катаболизм Вал и Иле (как и Мет) до сукцинил–КоА сопровождается образованием пропионил–КоА и метилмалонил–КоА:
^
Вал, Иле, Мет
 СО2 , вит. Н
СО2 , вит. НП
 ропионил–КоА Метилмалонил–КоА
ропионил–КоА Метилмалонил–КоА  1
1вит. В12
2
Сукцинил–КоА.
Ферменты, которые катализируют указанные реакции:
^ 1) пропионил КоА–карбоксилаза (кофермент - биотин);
2) матилмалонил КоА–мутаза (кофермент -дезоксиаденозилкобаламин).
При дефиците В12 нарушается превращение метилмалонил-КоА в сукцинил-КоА, следствием которого является выведение большого количества метилмалоновой кислоты с мочей - метилмалоновая ацидурия. Метилмалоновая кислота токсична для нервной ткани и при отсутствии лечения вызывает дегенерацию заднебоковых столбов спинного мозга.
^ 5 Метаболизм циклических аминокислот - фенилала–нина, тирозина, триптофана и гистидина
Фен, Тир – ароматические аминокислоты.
Трп, Гис – гетероциклические аминокислоты.
Фен - это незаменимая кислота, которая под действием фенилаланин-4-гидроксилазы необратимо превращается в Тир. Метаболизм Фен и Тир схематически показан ниже:
Тир
Фен


 Тироксин
Тироксин

 NH3 ДОФА Тирамин
NH3 ДОФА Тирамин
ф
 енил ПВК меланин адреналин
енил ПВК меланин адреналинф
 енилацетат Гомогентизиновая
енилацетат Гомогентизиновая к
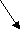 ислота
ислотафенилацетил-глутамин
(
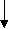 выводится с мочей) фумарат ацетоацетат
выводится с мочей) фумарат ацетоацетат 
Ц
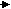 ЛК СО2, Н2О, АТФ
ЛК СО2, Н2О, АТФ Трп – незаменимая аминокислота, основными продуктами метаболизма которой в организме человека являются серотонин и никотиновая кислота (вит РР):
 5-гидрокситриптофан серотонин
5-гидрокситриптофан серотонин
к
Трп


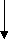
 инуренин антраниловая кислота
инуренин антраниловая кислота 
кинурениновая и никотиновая
ксантуреновая кислота (РР)
кислоты
(выводятся с мочой)
 индол
индол  индикан
индиканобразуются (в печени)
в кишечнике под
действием микрофлоры
«гниение белков в
кишечнике»
скатол
Гис – незаменимая аминокислота, входит в состав многих белков: гемоглобина, миоглобина, цитохромов, белков печени и почек. Метаболизм этой аминокислоты схематически показан ниже:
г
 истамин
истаминГис
ансерин

 карнозин(в мышцах)
карнозин(в мышцах)
 Глу
Глуимидазол- уроканиновая кислота
у
 ксусная кислота муравьиная кислота
ксусная кислота муравьиная кислота Гис и его производные являются хорошими комплексообразователями. Они могут связывать ионы тяжелых металлов и тем самым «защищать» ферменты (гликолиза, ЦЛК) от их повреждающего действия.
^ 6 Наследственные нарушения обмена аминокислот
Существуют наследственные и приобретенные нарушения метаболизма отдельных аминокислот.
Следует отметить, что в норме наибольшая скорость обмена характерна для нервной ткани. Поэтому разнообразные наследственные нарушения обмена аминокислот являются одной из причин изменения функционирования в первую очередь ЦНС.
К числу наиболее серьезных и достаточно распространенных нарушений обмена относятся аномалии метаболизма фенилаланина и тирозина:
1) фенилкетонурия.
Открыта в 1934 г. Х. Феллингом.
Причина заболевания - врожденный дефицит печеночной фенилаланин–4–гидроксилазы. Это приводит к повышению концентрации Фен в крови, возникает дефицит тирозиновых и триптофановых производных (меланина, катехоламинов, серотонина). При этом в крови и моче значительно увеличиваются концентрации фенилацетилглутамина, фенилпирувата, фенилацетата. В крови повышается концентрация веществ, которые практически полностью отсутствуют в норме (фенилэтиламин, фенилпируват, фениллактат). Это нейротоксические соединения, они нарушают метаболизм липидов в мозге. В сочетании с дефицитом нейромедиаторов (н.р., серотонина) этот механизм считают ответственным за прогрессирующее снижение интеллекта у больных и развитие фенилпировиноград–ной олигофрении.
В настоящее время доказано, что избыток Фен и его метаболитов – тератогены. У беременных женщин с фенилкетонурией фенилаланин может оказать пагубное воздействие на плод и вызвать возникновение множественных пороков развития.
Наиболее простым методом ранней диагностики считается реакция Феллинга. Зеленое окрашивание мочи при добавлении FeCl3 является положительной реакцией на наличие фенилПВК.
Лечение – диетотерапия - ограничение потребления пищи, содержащей Фен до полового созревания;
- алкаптонурия.
Причиной заболевания является врожденный дефект оксидазы гомогентизиновой кислоты, которая участвует в метаболизме Фен и Тир и катализирует реакцию расщепления гомогентизиновой кислоты до фумарата и ацетоацетата (см.схему выше).
У больных накопление гомогентизиновой кислоты приводит к образованию хиноновых полифенолов (составляют основу «охронозного пигмента» - алкаптона), которые выводятся с мочой. Это обуславливает потемнение мочи на воздухе и при подщелачивании. Кроме того, гомогентизиновая кислота ингибирует лизилгидроксилазу, которая участвует в синтезе коллагена.
Охронозный пигмент (алкаптон) не полностью экскретируется с мочой и откладывается в основном веществе хрящей и делает их хрупкими. Это со временем вызывает кальцификацию и дегенеративный артрит позвоночника и крупных суставов конечностей.
Первые проявления болезни – пигментация склер и хрящей ушных раковин. Радикально болезнь не лечится. Степень остеохондропатии можно уменьшить введением больших доз аскорбиновой кислоты, которая защищает активность лизилгидроксилазы;
- альбинизм - это еще одно наследственное нарушение обмена тирозина, которое связано с дефектом тирозиназы - фермента, который катализирует реакцию образования пигмента меланина из тирозина. Основные проявления патологии - депигментация, ускоренное расщепление родопсина, следствием чего является плохое зрение днем и фотофобия. Малые дозы солнечного света могут привести к развитию фотодерматоза. Альбинизм поражает представителей всех рас.
Среди наиболее распространенных нарушений метаболизма других аминокислот выделяют следующие:
Гомоцистинурия. Заболевание развивается как результат дефекта цистатион––синтазы, которая участвует в метаболизме метионина. При этом гомоцистеин и серин не могут с должной скоростью образовывать цистатион. Гомоцистеин превращается в гомоцистин, концентрация этих веществ в крови повышается, и они быстро выводятся из организма почками. Кроме того, в крови повышается концентрация метионина, т.к. в норме часть его переходит в гомоцистеин.
Заболевание чувствительно к терапии В6, который активирует метаболизм гомоцистеина до гомосерина и цистеина.
К накоплению в организме гомоцистеина могут приводить и дефекты других ферментов.
Эта наследственная патология характеризуется развитием умственной отсталости, остеопатии, остеопороза, сколиоза, патологических переломов, эктопии хрусталика, тромбоза сосудов, атеросклероза.
Болезнь Хартнупа – наследственная патология, обусловленная нарушением обмена триптофана. Заболевание получило название по фамилии семьи, в которой эта патология впервые была обнаружена у четверых из 8 детей.
Это расстройство касается нарушения процессов всасывания Трп в кишечнике и реабсорбции этой и других нейтральных аминокислот в почках. В результате развиваются: дефицит витамина РР (клиническая картина пеллагры), общая аминаацидурия без увеличения содержания аминокислот в крови, повышение чувствительности к солнечным лучам, двигательная атаксия, характерная для дисфункции мозжечка, усиление образования метаболитов индола в кишечнике под действием микрофлоры. Для лечения используют ниацин как необходимый компонент пищи. Больным рекомендуют защиту от солнечных лучей и периодическую стерили–зацию желудочно-кишечного тракта антибиотиками для подавления образования токсических продуктов метаболизма Трп под действием бактерий.
^ Лейциноз (болезнь кленового сиропа). Заболевание обусловлено дефицитом дегидрогеназы разветвленных –кетокислот, которая катализирует реакцию окислительного декарбоксилирования. В результате нарушается окисление оксикислот с разветвленной цепью - ОКРЦ, которые образуются при катаболизме аминокислот с разветвленной цепью (лей, иле, вал).
У больных моча имеет специфический запах кленового сиропа, который является традиционным лакомством детей в Северной Америке и Новой Зеландии.
При данном заболевании особенно патогенно накопление лейцина. Это истинно кетогенная аминокислота. Кетоновые тела играют большую роль в энергообеспечении мозга, особенно при гипогликемии. Нарушение обмена лейцина приводит к развитию умственной отсталости, судорогам, мышечной ригидности, летаргии, рвоте. Отмечаются гипогликемия и кетоацидоз. Основным методом лечения ребенка является специальная диета.
Лекция 3
^ Тема. Метаболизм нуклеотидов
