Клинико-иммунологическая характеристика и иммунотерапия пневмонии у новорожденных, инфицированных внутриутробно 14. 00. 36 Аллергология и иммунология 14. 00. 09 Педиатрия
| Вид материала | Автореферат диссертации |
- Клинико-лабораторная характеристика и лечение хламидийной инфекции, ассоциированной, 311.6kb.
- Сравнительный и исторический анализ методического прогресса в аллергологии: аллерген-специфическая, 383.99kb.
- Клинико иммунологические особенности аллергодерматозов на фоне урогенитальной инфекции, 335.48kb.
- Образовательный стандарт послевузовской профессиональной подготовки специалистов Специальность:, 1035.98kb.
- Урогенитальный хламидиоз: клинико-иммунологическая характеристика, иммуногенетические, 872.18kb.
- Клинико-функциональные и иммунопатогенетические механизмы формирования усиления рефракции, 788.74kb.
- Расписание занятий на элективе для студентов 6 курса «Клиническая аллергология», 41.99kb.
- Клинико-иммунологическая характеристика обострений бронхиальной астмы 14. 00. 43 пульмонология, 423.16kb.
- Адаптация недоношенных новорожденных детей при церебральной ишемии (клинико-функциональное, 394.95kb.
- Рабочая программа учебной дисциплины клиническая иммунология и аллергология для специальности:, 1167.83kb.
Достоверность отличий от здоровых новорожденных: *р 0,05, **р 0,01
Таблица 6.
Субклассы IgG в сыворотке крови при герпесвирусной и
герпесвирусно-хламидийной пневмонии у новорожденных.
| Вид инфекции | n | IgG | IgG1 | IgG2 | IgG3 | IgG4 | ||||
| | | г/л | г/л | % | г/л | % | г/л | % | г/л | % |
| ЦМВ+ ВПГ | 23 | 10,0 1,1** | 8,1 0,7** | 76,4 4,0 | 1,0 0,1 | 17,6 1,0 | 0,4 0,1 | 3,6 1,2* | 0,2 0,1 | 2,4 0,3 |
| ЦМВ+ВПГ + Хл | 38 | 12,7 0,6* | 11,3 0,6** | 84,2 3,6** | 0,5 0,1* | 9,5 1,1* | 0,5 0,1 | 3,8 0,9 | 0,2 0,1 | 2,5 0,6 |
| Здоровые новорожден-ные | 22 | 4,3 0,8 | 2,5 0,4 | 69,8 5,8 | 0,9 0,05 | 19,4 1,3 | 0,32 0,05 | 3,8 0,4 | 0,10,05 | 2,5 0,7 |
Достоверность отличий от здоровых новорожденных *р 0,01, **р 0,05; между группами р 0,05
Судя по данным, представленным в табл. 6, при пневмонии, вызванной герпесвирусной (ЦМВ+ВПГ) и герпесвирусно-хламидийной (ЦМВ+ВПГ+Хл) инфекцией имеется достоверное повышение концентрации IgG и IgG1 в сыворотке крови, а при герпесвирусно-хламидийной пневмонии, кроме того, снижение IgG2.
Обнаруженные нами характерные сдвиги концентрации субклассов IgG - нарастание IgG1с одновременным падением содержания IgG2, как и увеличение концентрации лактоферрина - могут служить прогностическими критериями тяжести неонатальных пневмоний, в частности герпесвирусно-хламидийной. и ИВЛ*-обусловленной, и предпосылкой присоединения к этиотропному лечению иммунотерапии для компенсации неонатальной иммунодефицитности.
Иммунотерапия неонатальных пневмоний Аффинолейкином
Экспериментальные доказательства неонатальной безвредности и иммунопотенцирующих свойств Аффинолейкина были получены в эксперименте на мышатах (CBA × C57BL/6J)F1 в первые дни жизни. Установлено, что подкожное введение новорожденным мышам в первый день жизни АЛ в дозе, в 1000 раз превышающей разовую для новорожденных детей, не оказывало негативного влияния на их жизнеспособность, но вызывало двухфазное изменение динамики привеса (рис. 2)
Исходным материалом для приготовления Аффинолейкина служит лейкоцитарная масса доноров, которые во время прошедшей в России эпидемии дифтерии были неоднократно проиммунизированы дифтерийной вакциной. Поэтому в готовом препарате содержались ТФ-белки, способные, как выяснилось по результатам реакции конгломерации мышиных лейкоцитов [Matz A.N. et al., 1971; Fudenberg H.H., 1989], индуцировать клеточный иммунитет, специфичный к дифтерийному анатоксину. Поэтому, через месяц после инъекций мышатам Аффинолейкина у них взяли кровь и определили пороговую концентрацию дифтерийного анатоксина, вызывающую конгломерацию циркулирующих лейкоцитов (таблица 7). Она была в 8 раз ниже в группе Аффинолейкина, по сравнению с интактными мышами того же возраста из группы контроля.
Первые 3 - 4 недели жизни мыши находятся в состоянии физиологически пониженной иммунизабельности в отношении многих антигенов, в том числе бактериальных анатоксинов . В этих условиях формирование приобретённого иммунитета осуществляется путём переноса материнских секреторных антител и антигенспецифичных цитокинов (ТФ-белков) при грудном кормлении, если мать обладает соответствующей иммунологической памятью. Однако мыши не
относятся к природным хозяевам Corynebacterium diphtheriae, , поэтому естественный перенос иммунологической памяти к дифтерийному анатоксину исключён. Следовательно, усиленная иммунореактивность мышат на этот антиген, наступающая одновременно с развитием гиперчувствительности замедленного типа
(ГЗТ) к нему (судя по снижению пороговой концентрации анатоксина в реакции конгломерации лейкоцитов), по-видимому, свидетельствует о ранней индукции противодифтерийного грундиммунитета.
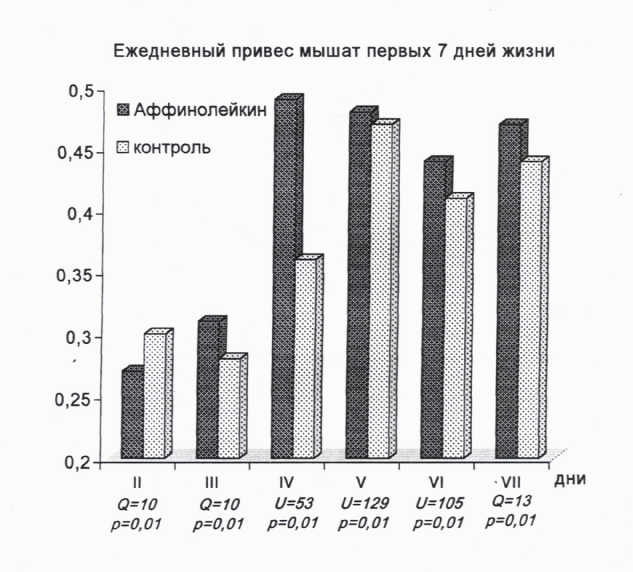
Рис. 2. Аффинолейкин, введённый мышатам в первый день жизни, вызывает
задержку привеса на второй день и достоверное увеличение привеса в
последующие дни (напоминает эффект анаболических стероидов)
Таблица 7
Пороговые концентрации дифтерийного
анатоксина (мкг/мл), вызывающие конгломерацию мышиных лейкоцитов
через 1 мес после инъекции Аффинолейкина
| Группа мышей | n | Медиана | 95%-й доверительный интервал по Ван дер Вардену | Отличие от контроля |
| Аффинолейкин | 20 | 0,8 | 0,4 ÷ 1, 6 | p < 0,05 |
| Контроль | 23 | 6,4 | 3,2 ÷ 12,8 | |
Чтобы подтвердить это предположение, через месяц после введения Аффинолейкина мышей подкожно проиммунизировали дифтерийным анатоксином. Ещё через месяц взяли кровь из ретроорбитального венозного сплетения и определили антитоксическую активность индивидуальных сывороток, как описано в разделе «Материалы и методы» (таблица 8). Содержание антитоксических антител в группе Аффинолейкина примерно втрое превышало тот же показатель у мышей контрольной группы, предварительно не подготовленных Аффинолейкином.
Таблица 8.
Дифтерийный антитоксин в мышиных
сыворотках (МЕ/мл) после вакцинации дифтерийным анатоксином
| Группа мышей | n | Медиана | 95%-й доверительный интервал по Ван дер Вардену | Отличие от контроля |
| Аффинолейкин | 20 | 0,23 | 0,16 ÷ 0,3 | p < 0,01 |
| Контроль | 23 | 0,07 | 0,04 ÷ 0,09 | |
Таким образом, нам удалось в эксперименте создать искусственный
противодифтерийный грундиммунитет путем переноса ГЗТ Аффинолейкином в первый день жизни. Полученные экспериментальные результаты открыли клиническую перспективу применения Аффинолейкина как средства иммуноспецифической поддержки при иммунизации рефрактерных и низкоиммунизабельных индивидов и иммунотерапии неонатальных пневмоний.
Иммунотерапевтическое применение Аффинолейкина при неонатальных пневмониях имеет ряд предпосылок:
- реализация пренатальных и интранатальных факторов риска, приводящая к
рождению недоношенного и маловесного ребёнка с глубокой неонатальной
недостаточностью как врождённого, так и приобретённого иммунитета;
- пренатальное и интранатальное инфицирование плода сексуально-
трансмиссивной условнопатогенной микрофлорой и возникновение
пневмонии;
- относительно частая безуспешность современной этиотропной фармакотерапии
при лечении инфекций, вызванных персистирующими условнопатогенными
возбудителями, особенно вирусами;
- вынужденное частое применение инвазивных медицинских вмешательств:
ИВЛ, катетеризации сосудов, полостной хирургии и т.п.
- зарубежный опыт лечения неонатальных пневмоний аналогами
Аффинолейкина и его безвредность как изогенного натурального
«биологического модификатора иммунного ответа».
- установленная полиспецифичность Аффинолейкина в отношении
условнопатогенной персистирующей микрофлоры - герпесвирусов, стрепто- и
стафилококков, дрожжеподобных грибов и других широко распространённых
инфекционных возбудителей.
Аффинолейкин был применён нами при неонатальных пневмониях в дополнение к общепринятой фармакотерапии в двух лекарственных формах - инъекционной (подкожно) и сублингвальной ( в каплях под язык) на четырёх группах новорожденных. Препарат вводили, как указано в разделе «Материалы и методы».
I группа (30 детей) - Аффинолейкин в инъекциях; IA группа (30 детей) –
контрольная для I, получали общепринятую терапию без Аффинолейкина
II группа (18 детей) - Аффинолейкин сублингвально; IIA группа (18 детей) - контрольная для II группы (IIA группу пришлось ввести из-за того, что IA группа включала больше тяжёлых больных, чем II группа);
Таблица 9.
Сокращение сроков (дни) проявления клинической симптоматики
при вспомогательной иммунотерапии неонатальных пневмоний Аффинолейкином
| | Аппликация Аффинолейкина | |||||
| подкожные инъекции | капли под язык | |||||
| Симтоматика или виды лечения | I n=30 | IA n=30 | p | II n=18 | IIA n=18 | p |
| Кислородная зависимость | 8,21,1 | 16,61,2 | 0,01 | 8,20,9 | 10,81,4 | 0,05 |
| Необходимость ИВЛ | 5,70,7 | 9,00,8 | 0,01 | 3,10,7 | 5,00,8 | 0,05 |
| Дыхательная недостаточность | 8,90,9 | 15,01,1 | 0,01 | 7,40,8 | 11,31,2 | 0,05 |
| Стабильная прибавка массы | 13,51,1 | 21,41,2 | 0,01 | 10,50,8 | 14,91,2 | 0,01 |
| Пребывание в отделении реанимации | 12,00,9 | 15,81,3 | 0,05 | 5,70,9 | 8,31,4 | 0,05 |
| Отсутствие сосательного рефлекса | 10,40,7 | 17,90,9 | 0,01 | 9,11,1 | 10,91,4 | 0,05 |
| Отсутствие физиологических рефлексов | 21,51,2 | 28,51,1 | 0,01 | 18,31,3 | 20,41,4 | 0,05 |
| Пребывание в стационаре | 26,61,3 | 31,91,4 | 0,05 | 17,81,3 | 23,11,6 | 0,05 |
