Клинико-иммунологическая характеристика обострений бронхиальной астмы 14. 00. 43 пульмонология
| Вид материала | Автореферат |
- На правах рукописи, 694.38kb.
- Эффективность галотерапии в комплексе реабилитации при атопическом дерматите у детей, 61.6kb.
- Отдаленные результаты применения моноклональных анти-ige антител в комплексной терапии, 508.34kb.
- Применение нутрицевтиков при комплексном санаторном лечении бронхиальной астмы и атопического, 248.85kb.
- Мурзова ольга анатольевна клинико-цитохимические особенности течения бронхиальной астмы, 256.73kb.
- Константинович клинико-диагностические особенности и возможности контроля лекарственной, 246.76kb.
- В. А. Кельцев общая характеристика работы, 342.39kb.
- Президента Российской Федерации (по адресу: 103875, Москва, ул. Воздвиженка, д ) Сдиссертацией, 601.79kb.
- Урогенитальный хламидиоз: клинико-иммунологическая характеристика, иммуногенетические, 872.18kb.
- Астматическое состояние, 2961.29kb.
1 2
На правах рукописи
Захарова Инна Александровна
КЛИНИКО-ИММУНОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА
ОБОСТРЕНИЙ БРОНХИАЛЬНОЙ АСТМЫ
14.00.43 – пульмонология
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Самара – 2009
Работа выполнена на кафедре терапии, фтизиопульмонологии и профпатологии Государственного образовательного учреждения дополнительного профессионального образования «Уральская государственная медицинская академия дополнительного образования».
Научный руководитель:
доктор медицинских наук, профессор Игнатова Галина Львовна
Официальные оппоненты:
доктор медицинских наук, профессор Кочетков Сергей Георгиевич
доктор медицинских наук, профессор Бельтюков Евгений Кронидович
Ведущая организация: ГОУ ВПО Сибирский государственный медицинский университет Росздрава (г.Томск)
Защита диссертации состоится «18 ноября» 2009 года
в_______часов на заседании диссертационного совета Д 208.085.03 при ГОУ ВПО Самарский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию Российской Федерации (443079, г. Самара, пр. К.Маркса, 165 «Б»)
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО Самарский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию Российской Федерации по адресу: 443001, г. Самара, ул. Арцыбушевская, 171
Автореферат разослан «16 октября» 2009 года
Учёный секретарь
диссертационного совета
доктор медицинских наук, профессор В.А. Кельцев
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Бронхиальная астма (БА) является одной из важнейших проблем пульмонологии, что связано с ее значительной распространенностью, результаты эпидемиологических исследований свидетельствуют об увеличении заболеваемости (Попова И.В., 2004, Авдеев С.Н., 2007). Современная концепция БА, основанная на воспалительной природе, была сформулирована в начале 90-х годов XX века и представлена в докладе экспертов ВОЗ (1995) «Глобальная инициатива по борьбе с бронхиальной астмой». Согласно рекомендациям GINA в пересмотре 2006 года, основной задачей лечения БА является достижение контроля над заболеванием, который предусматривает, что у пациентов отсутствуют или умеренно выражены симптомы болезни, нет ограничений в повседневной деятельности, отсутствуют (или минимальна) потребность в препаратах неотложной помощи и частота обострений крайне низка. Однако, исследования, предпринятые для оценки результатов лечения БА, показывают, что они в настоящее время далеки от идеала, даже в развитых странах (Огородова Л.М., 2004, Латышева Е.А., 2006, Коробко Е.А., 2007).
Существует множество пусковых факторов, посредством которых стабильное течение бронхиальной астмы переходит в фазу обострения путем стимуляции воспаления или провоцирования острого бронхоспазма, или того и другого (Чучалин А.Г., 2000, Рябова А.Ю., 2007, Tillie-Leblond I., 2005). Аллергены внешней среды рассматриваются как наиболее важные причины обострения бронхиальной астмы, поскольку они могут первоначально сенсибилизировать дыхательные пути и провоцировать начало бронхиальной астмы; в дальнейшем поддерживать развитие заболевания, вызывая появление астматических приступов. Кроме воздействия различных аллергенов на организм человека большой вклад в обострение заболевания также вносит присоединившаяся инфекция (GINA, 2006). Инфекционные агенты могут выполнять роль триггеров, стимулируя клиническое проявление неинфекционной аллергии, играть роль аллергенов с формированием аллергического воспаления и вызывать обструкцию бронхов путем неспецифической либерации биологически активных веществ бронхоконстрикторного действия (Ноников В. Е., 2002, Ключева М.Г., 2005). Одним из важнейших факторов, вызывающих обострения бронхиальной астмы, является недостаточная терапия заболевания (Авдеев С.Н., 2005, Моногарова Н.Е., 2008). Кроме того, обострения бронхиальной астмы могут вызвать болезни верхних дыхательных путей: риниты, синуситы, полипоз носа (Жестков А.В., 2008, Kraft M., 2000), гастроэзофагеальный рефлюкс (Сидорова Л.Д., 2006; Harding S.M., 2000), менструация и беременность, лекарственные препараты (Купаев В.И., Косарев В.В., 2003, Юдина Л.В., 2007, Schatz M., 2001). К триггерам также относятся воздействие физических нагрузок, холодного воздуха, раздражающих газов (ирритантов), аэрополлютантов, изменение погоды, чрезмерные эмоциональные нагрузки (Авдеев С.Н., 2005).
Известно, что в большинстве случаев БА связана с атопией (Mamessier E., 2003) и является аллергическим заболеванием, где атопия рассматривается как иммунопатология, лежащая в основе формирования БА (Герасин В.А., 2006; Shirakawa T., 2000). Т-лимфоциты являются центральным звеном аллергического воспаления при БА (Мамонтова Т.В., 2004, Нестерова И.В., 2007, Humbert M., 2003). По мнению авторов, иммунный дисбаланс Th1/Th2 с нарушением в системе цитокинов является инициирующим механизмом хронического воспаления (Намазова Л.С., 2000, Феденко Е.С., 2005, Просекова Е.В., 2007). Вовлекаемые в воспаление тучные клетки и эозинофилы, которые являются одними из наиболее агрессивных эффекторных клеток, также секретируют цитокины Th2-профиля, индуцируя Th2-лимфоциты (Рязанцева Н.В., 2007). Таким образом, создается порочный круг, поддерживающий характерное воспаление в стенке дыхательных путей, но, несмотря на достигнутые успехи в этой области иммунологии, окончательные механизмы персистенции Т-лимфоцитов в очаге воспаления до сих пор остаются невыясненными (Кайдашев И.П., 2006, Barnes P. J., 2003).
Часть исследований реагирования иммунной системы посвящена изменениям ее в зависимости от различных факторов: степени тяжести болезни (Никонорова Т.А., 2005; Петрова О.В., 2005), гормоночувствительности или гормонорезистентности (Ильина Н.И., 2003, Шапорова Н.Л., 2003, Wenzel S., 2003), периодов обострения или ремиссии, вне зависимости от вызвавшей обострение причины (Порядин Г.В.,2002; Салмаси Ж.М., 2005), от сроков возникновения болезни (Конощук Т.З., 2002, Куделя Л.М., 2003, Рябова Л.В., 2004), наличия избыточной массы тела (Царев В.П., 2002), использования в лечении длительной терапии ИГКС (Bаrnes P. J., 1996, Wenzel S., 2006), возраста пациентов (Нугманова Д.С., 2007), длительности заболевания (Никитина Ю.Н., 2003), беременности (Цигулева О.А., 2007). При сопоставлении результатов определяются значительные различия, которые возможно, связаны с неодинаковым возрастно-половым составом, количественным соотношением исследуемых больных по этиопатогенетическому признаку БА, тяжести ее течения, сроков исследования. Кроме того, существуют диаметрально противоположные мнения. Так, по мнению А.И. Ячника (2005), изменения параметров иммунограммы у больных БА с разными этиологическими моментами ее возникновения (атопическая, инфекционно-зависимая и смешанная) существенно не различаются между собой.
Таким образом, несмотря на то, что в последние годы были получены данные, которые значительно расширяют представления о механизмах патогенеза аллергических заболеваний, в настоящее время не существует единой достоверной точки зрения на изменения иммунитета при возникновении БА, ее течении, обострениях, вызванных различными причинами.
Цель исследования
Определить клинико-иммунологические особенности обострения бронхиальной астмы в зависимости от вызвавших его причин.
Основные задачи работы
- Изучить причины госпитализации пациентов в терапевтический стационар в связи с обострением бронхиальной астмы.
- Выявить особенности клинического статуса при обострениях, вызванных различными триггерами.
- Определить спектр микроорганизмов, имеющих этиологическую значимость в обострении заболевания.
- Оценить влияние различных причин обострения бронхиальной астмы на степень нарушения функции внешнего дыхания.
- Провести анализ динамики показателей иммунной системы в зависимости от фазы заболевания и триггерных механизмов, вызвавших обострение заболевания
Научная новизна
Определены причины, наиболее часто вызывающие тяжелые обострения бронхиальной астмы, приводящие к госпитализации пациентов и клинико-иммунологические характеристики обострений с различными механизмами. Выявлены микроорганизмы, имеющие наибольшую значимость при обострениях, вызванных различными триггерами.
В работе впервые применен системный подход с применением клинических, лабораторно-инструментальных, математических методов оценки клинико-иммунологических особенностей обострений бронхиальной астмы в зависимости от их этиопатогенетических факторов.
Практическая значимость
Практическое значение результатов исследования заключается в выявлении клинических, иммунологических и инструментальных особенностей обострений БА, вызванных различными триггерными механизмами
Основные положения, выносимые на защиту
- Наиболее частыми причинами, приводящими к обострению заболевания, требующего госпитализации, являются проведение недостаточной базисной терапии на амбулаторном этапе, а также присоединение острых респираторных инфекций.
- В клинической картине обострения астмы, вызванного контактом с причинным аллергеном, преобладают приступы удушья, в то время как при бактериальном обострении чаще встречается продуктивный кашель и увеличение количества мокроты.
- Ведущую роль в этиологии обострения бронхиальной астмы играют Грам-положительные микроорганизмы; Грам-отрицательная флора имеет меньшее значение; в качестве второго патогена в ассоциациях часто встречаются грибы рода Candida.
- Наиболее выраженные обструктивные нарушения функции внешнего дыхания наблюдаются в группах пациентов с дебютом заболевания, недостаточной базисной терапией и бактериальной инфекцией, а наименьшее влияние на проходимость дыхательных путей оказывает контакт с причинно-значимым аллергеном.
- Иммунологическим признаком обострения бронхиальной астмы является снижение общего числа Т-лимфоцитов и Т-цитотоксических клеток у больных, триггерным моментом которых служили вирусная инфекция и избирательное снижение Т-лимфоцитов у пациентов, причиной обострения у которых являлся контакт с аллергеном.
- В фазу ремиссии заболевания наблюдается нарастание количества CD3+CD4+лимфоцитов у больных с обострением, ассоциированным с инфекцией, а также недостаточной базисной терапией. У пациентов с недостаточной терапией и контактом с аллергеном в фазу ремиссии отмечено увеличение количества и CD3-CD19+ лимфоцитов.
Внедрение результатов исследования в практику
Основные положения, разработанные в диссертации, внедрены в практической работе терапевтических отделений МУЗ ГКБ №4, городской поликлиники №8 ОАО «ЧТЗ», городского консультативно-диагностического отделения для больных пульмонологического профиля МУЗ ГКБ № 4 г. Челябинска, учебный процесс кафедры терапии, фтизиопульмонологии и профпатологии Уральской государственной медицинской академии дополнительного образования.
Апробация диссертации
Основные результаты исследований, представленные в диссертации, докладывались и обсуждались на XIX Конгрессе Европейского Респираторного Общества (Вена, 2009), XVIII Российском Национальном Конгрессе по болезням органов дыхания (Екатеринбург, 2008), на заседании общественной организации «Ассоциация врачей пульмонологов Челябинской области» (Челябинск, 2009).
Публикации
Материалы диссертации опубликованы в девяти научных работах, из них одна – в рецензируемом научном журнале, рекомендованном ВАК РФ.
Объём и структура диссертации
Работа состоит из введения, четырёх глав, выводов, практических рекомендаций, списка используемой литературы. Объём диссертации – 156 страниц, в том числе 33 таблицы, пять рисунков. Список литературы включает 310 источников, из них 197 на русском языке, 113 – иностранных авторов.
Клиническая характеристика обследованных групп, материалы,
методы исследования и статистической обработки
В соответствии с целями и задачами работы было проведено динамическое рандомизированное обследование всех больных, поступающих в терапевтическое отделение ГОУ ВПО Клиники ЧелГМА Росздрава с обострением бронхиальной астмы за 2007 год, а также ретроспективный анализ историй болезни пациентов, поступивших в эту же клинику за период 2003-2006 годы. Всего изучены данные 315 больных бронхиальной астмой, среди которых было 217 (69,1%) женщин и 98 (30,9%) мужчин, средний возраст пациентов составил 54,9±2,3 года. У большинства пациентов длительность БА превышала 5 лет и в среднем составила 8,6±0,6 года. Критериями включения пациентов в группы наблюдения являлись наличие у пациентов клинико-лабораторных проявлений обострений бронхиальной астмы: учащение приступов удушья, прогрессивное нарастание экспираторной одышки, кашля, появление свистящих хрипов, а также прогрессивное нарастание бронхиальной обструкции (снижение объема форсированного выдоха за 1 секунду или пиковой скорости выдоха) и/или повышение вариабельности ПСВ при суточном мониторировании этого показателя, письменное согласие на участие в исследовании. Критериями исключения на момент поступления в стационар служили наличие пневмонии, ХОБЛ, онкопатологии, хронического алкоголизма, наркомании, токсикомании, психических заболеваний, беременности, заболеваний крови, хронической почечной и печеночной недостаточности.
После определения критериев включения в исследование, все пациенты были разделены на 5 анализируемых групп в зависимости от ведущего триггерного механизма обострения. Для сравнительного анализа показателей клинических, инструментальных и иммунологических показателей у больных бронхиальной астмой была сформирована группа из пациентов, не имеющих в анамнезе заболеваний бронхолёгочной системы. В составе группы был 31 человек. Средний возраст лиц группы контроля – 50,7±0,7 лет.
Распределение пациентов в зависимости от степени тяжести заболевания осуществилось следующим образом: больных с интермиттирующей астмой оказалось 32 человека (10%), с легкой персистирующей – 71 человек (23%), средней степени – 99 человек (31%), а пациентов, страдающих тяжелой астмой – 113 (36%). У 241 человека (76,6%) ведущим механизмом был 1 триггер, у 66 пациентов (20,9 %) – 2, а у 8 больных (2,5%) было выявлено 3 фактора, которые привели к обострению БА.
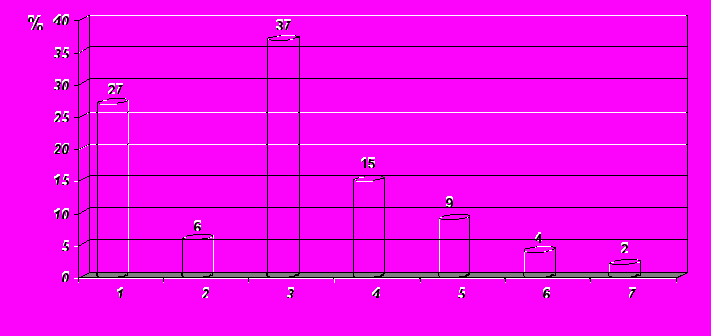
Примечание: 1- вирусная инфекция 5 - контакт с аллергеном
2 –бактериальная инфекция 6 - изменение метеоусловий
3 –недостаточная терапия 7 - контакт с аэрополлютантами
4 – дебют болезни
Рисунок 1
Причины обострений бронхиальной астмы
Как видно из данных, представленных на рис.1, в первую группу вошли больные астмой, где триггером послужила острая респираторная вирусная инфекция, присоединение которой вызвало обострение заболевания у 77 пациентов (27%). Вторую группу составили больные с бактериальной инфекцией – 17 человек (6%). В третью группу вошли больные с проведением недостаточной базисной терапии или отказом от нее заболевания на амбулаторном этапе – 99 человека (37%). Четвертую группу составили лица, чье обострение заболевания было связано с причинно-значимым аллергеном – 16 человек (9%). Дебют болезни, проявившийся тяжелым обострением – пятая группа – зафиксирован у 32 больных (15%). Группы больных, обострение астмы у которых вызвали изменение метеоусловий и взаимодействие с аэрополлютантами, составили 10 (4%) и 5 (2%) человек и вследствие малочисленности совокупностей анализу не подвергались.
Клинические, функциональные, иммунологические исследования у больных БА, производились дважды в динамике – в период обострения заболевания и после проведенного стационарного лечения, через 21 день от начала госпитализации, в период достижения клинического контроля над процессом.
Диагноз бронхиальной астмы устанавливался на основании рекомендаций Глобальной стратегии лечения и профилактики бронхиальной астмы (GINA, 2004). Критериями диагностики заболевания служили характерные клинико-анамнестические данные: жалобы больного на приступы удушья, эпизодическую одышку, свистящие хрипы, ощущение сдавления грудной клетки и кашель, которые особенно усиливаются в ночные и ранние утренние часы; объективные данные: экспираторные свистящие хрипы, удлинение фазы выдоха; функциональные показатели: признаки обратимой обструкции, установленные по положительному бронходилатационному тесту – увеличение прироста ОФВ1 более, чем на 15% и/или 200 мл после проведения ингаляции ß2-агонистом (сальбутамол в дозе 400 мкг). Критерии обострения бронхиальной астмы включали в себя указание в анамнезе на контакт с каким-либо триггерным агентом (аллергены, вирусные инфекции, ирританты и т.д.) и появление и/или учащение приступов удушья или их эквивалентов.
Среди основных факторов риска оценивались частота респираторных заболеваний, табакокурение, аллергологический анамнез, наличие профессиональных вредностей и их сочетание. Расчёт индекса курения проводился по формуле: количество выкуренных сигарет в день, умноженное на число месяцев в году (Чучалин А.Г., 2007). Во время обследования изучались жалобы пациентов и осуществлялся общий осмотр. Выраженность клинических симптомов оценивалась в баллах (Borgе G., 1982).
Бактериологическое исследование мокроты проведено в бактериологической лаборатории Клиники ЧелГМА по методу Вишняковой Л.А. (1990). Микробиологическому изучению подвергались утренняя порция мокроты, полученная после глубокой экспекторации у 110 больных (34,9%) больных бронхиальной астмой в фазе обострения. На культуры микроорганизмов исследовали образцы мокроты, удовлетворяющие критериям Murrey-Washington. Диагностически значимым являлись выделение бактериальных микроорганизмов в концентрации 106 , а для грибковой флоры 103 КОЕ/мл мокроты.
Исследование функции внешнего дыхания проводилась на аппарате «Диамант». Определялись следующие параметры: форсированная жизненная ёмкость лёгких (ФЖЕЛ), объём форсированного выдоха за первую секунду (ОФВ1) и расчётное соотношение этих параметров ОФВ1/ФЖЕЛ. Все показатели оценивались в процентном отношении к должным величинам. Для исследования обратимости обструкции использовались пробы с ингаляционным бронходилататором (сальбутамол 400 мкг) и их влияние на ОФВ1 (Айсанов З.Р. с соавт., 2003).
Иммунофенотипирование лимфоцитов проводилось проводилось на базе Клиники ЧелГМА методом лазерной проточной цитофлуометрии (EPICS XL, COULTER, США). Образцы крови были отобраны для определения уровня CD3+CD19-, CD3+CD4+, CD3+CD8+, CD4+/СD8+, CD3-CD19+, CD3+CD25+, TNK(CD3+CD(56+16+)+), NK(CD56+16+)+.
Статистическая обработка полученных данных была выполнена с использованием пакета программ прикладной статистики «Statistica for Windows», версия 6. Используемые методы: критерий Шапиро-Уилка, межгрупповое сравнение данных по t-критерию Стъюдента для связанных и несвязанных выборок, критерий Манна-Уитни для непараметрических величин, по точному критерию Фишера для оценки различий данных, выражаемых в альтернативной форме (качественные признаки), корреляционный анализ Спирмена (Реброва О.Ю., 2003).
Результаты исследования и их обсуждение
Учитывая цели и задачи исследования, нами был проведен сравнительный анализ анамнестических, клинических, лабораторных и инструментальных результатов, полученных при комплексном обследовании пациентов в зависимости от ведущего триггерного механизма обострения. Проведен анализ соотношения причин обострения и пола пациентов. Количество женщин преобладало над числом мужчин вне зависимости от триггерного фактора (р<0,05): процентное соотношение больных женского пола составило 24,8% , мужского – 5,9% у больных с вирусной инфекцией, 4,8% и 1,9% соответственно – при бактериальном обострении бронхиальной астмы, 33,5% и 9,9% у лиц с недостаточной терапией, 5,2% у женщин и 1,2% у мужчин, триггером обострения которых был контакт с причинно-значимым аллергеном, и 7,25 и 5,6% соответственно – в дебюте заболевания. Обращает на себя внимание, что при преобладании больных женского пола с вирусным обострением в 4,2 раза, у больных с бактериальным обострением БА – в 2,5 раз, у пациенток с недостаточной базисной терапией – в 3,4 раза, при контакте с аллергеном – в 4,3 раза, среди лиц, причиной госпитализации которых послужило начало заболевания, данное соотношение составило
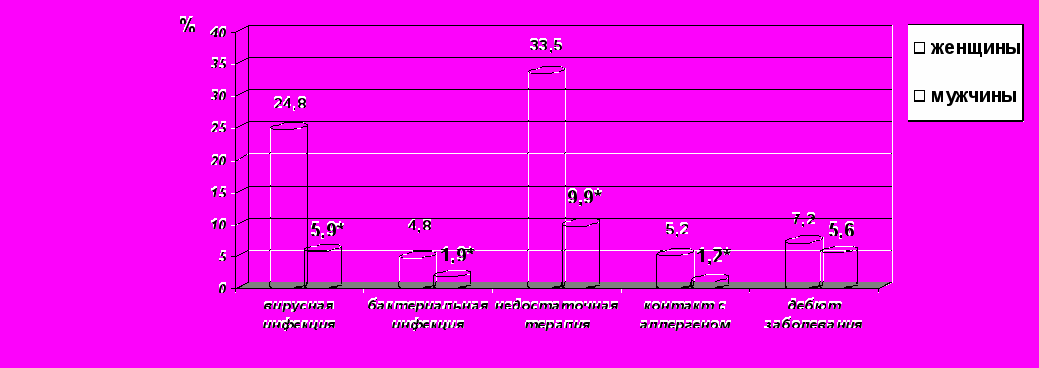
Примечание: для анализа различия частот в двух независимых группах использовался критерий Фишера: *- р < 0,05 относительно данных в группе женщин
Рисунок 2
Соотношение пола пациентов и триггерных механизмов заболевания
всего 1,2. Незначимое половое различие (р>0,05) при возникновении бронхиальной астмы в нашем исследовании согласуется с регламентирующими документами по астме, в которых указано, что во взрослом возрасте корреляции между заболеваемостью бронхиальной астмой и полом не выявлено (Чучалин А.Г., 2005). В процентном соотношении число мужчин с бактериальным обострением БА почти в два раза превышает больных, триггерами у которых послужили ОРВИ и экспозиция аллергена. Данная закономерность может быть связана с большим числом курильщиков среди мужчин, и, как следствие, большей распространенностью хронического бронхита среди этих пациентов.
Таблица 1
Распределение пациентов по возрасту
в зависимости от триггерных механизмов (M±m)
| | Причины обострений | ||||
| Вирусная инфекция | Бактериальная инфекция | Недостаточная терапия | Контакт с аллергеном | Дебют болезни | |
| | 1 | 2 | 3 | 4 | 5 |
| n | 77 | 17 | 99 | 16 | 32 |
| Возраст | 46,83±2,24 | 57,76±4,15 | 53,34±1,62 | 46,25±4,66 | 52,03±3,34 |
| р | р1-2<0,05 р1-3<0,05 | | | | |
Примечание: достоверность различий оценивалась с помощью t-критерия Стъюдента для независимых групп
По данным, представленным в таблице 1, выявлена взаимосвязь возраста и причин обострения бронхиальной астмы: оказалось, что при обострении БА, вызванном присоединением вирусной инфекции возраст пациентов был наименьшим (46,83±2,24 года), а достоверно наибольший возраст был отмечен в группе больных с бактериальным обострением (57,76±4,15). По данным Г.Б. Федосеева (2006), существует патогенетическая связь между возникновением «поздней астмы», возникшей у лиц старше 40 лет: у 91% больных возникновению астмы предшествовал длительный анамнез хронического бронхита, а микрофлора в мокроте обнаруживалась в 88,1% случаев.
При изучении соотношения триггерных механизмов и стажа болезни была отмечена следующая закономерность (табл. 2): средний стаж болезни пациентов,
Таблица 2
Соотношение триггерных механизмов и стажа болезни
| | Причины обострений | |||
| Вирусная инфекция | Бактериальная инфекция | Недостаточная терапия | Контакт с аллергеном | |
| Группы | 1 | 2 | 3 | 4 |
| n | 77 | 17 | 99 | 16 |
| Стаж, лет | 10,41±1,15 | 7,76±2,34 р2-4<0,05 | 10,97±0,89 | 15,06±2,36 |
Примечание: достоверность различий оценивалась с помощью t-критерия Стъюдента для независимых групп
обострение астмы которых было вызвано контактом с аллергеном, в 1,9 раз превышает длительность заболевания тех пациентов, чье поступление в стационар, в связи с обострением БА, обусловлено бактериальной инфекцией (15,06± 2,36 и 7,76±2,34 года соответственно); указанные различия статистически значимы (р<0,05). Стаж болезни пациентов с вирусной инфекцией и недостаточной базисной терапией оказался сопоставим, и составил 10,41±1,15 и 10,97±0,89 лет соответственно. Длительность течения астмы пациентов, поступление которых было вызвано дебютом процесса – 0,06±0,01 года – при расчете достоверности показателей не учитывалась.
Таблица 3
Соотношение длительности стационарного лечения
и триггерных механизмов обострения
| | Причины обострений | ||||
| Вирусная инфекция | Бактериальная инфекция | Недостаточная терапия | Контакт с аллергеном | Дебют болезни | |
| | 1 | 2 | 3 | 4 | 5 |
| n | 77 | 17 | 99 | 16 | 32 |
| Койко-день | 12,41±0,62 | 17,65±1,78 | 11,71±0,45 | 10,88±0,93 | 12,47±0,78 |
| р | р1-2<0,05 | | р2-3<0,00001 | р2-4<0,05 | р2-5<0,05 |
Примечание: достоверность различий оценивалась с помощью t-критерия Стъюдента для независимых групп
При анализе соотношения длительности стационарного лечения и триггерных механизмов (табл.3) выявлено, что для достижения ремиссии БА, обострение которой было вызвано бактериальной инфекцией, требуется статистически значимо большее число дней (17,65±1,78 дня), чем при других причинах: при вирусной инфекции данный показатель составил 12,41±0,62 дней, у пациентов с недостаточной терапией – 11,7±0,45 дней, у лиц с аллергенным воздействием – 10,88±0,93 дней, у больных с дебютом заболевания – 12,47±0,78 дней. По данным литературы, так называемая инфекционно-зависимая астма, имеет более тяжелое течение: присоединение инфекции приводит к более тяжелому и длительному течению обострений (Счетчикова О.С., 2001).
Впервые в 2006 году в руководстве GINA ожирение выделено как самостоятельный фактор риска возникновения БА. Среди обследованных нами пациентов были получены следующие результаты: пациентов с нормальной массой тела оказалось 198 человек (62,7%), а лиц с ожирением – 117 (38,1%) (табл. 4).
Таблица 4
Особенности течения бронхиальной астмы
у больных с различной массой тела
| | Степени ожирения | |||
| | норма | 1 степень | 2 степень | 3 степень |
| n | 198 | 70 | 28 | 19 |
| Группы | 1 | 2 | 3 | 4 |
| ИМТ | 24,24±0,28 | 32,22±0,23 | 37,48±0,34 | 43,46±0,38 |
| Возраст, лет | 45,93±1,71 р1-2<0,05 | 54,78±1,73 | 55,05±3,29 | 55,31±3,28 |
| Стаж болезни, лет | 7,87±0,79 р1-2<0,05 | 11,91±1,67 | 8,10±2,23 | 8,30±1,87 |
| Койко-день | 11,9±0,42 р 1-3<0,0005 | 13,10±0,69 р 2- 3<0,05 | 16,30±1,34 | 13,77±1,68 |
Примечание: достоверность различий оценивалась с помощью t-критерия Стъюдента для независимых групп
При распределении по степеням тяжести заболевания 70 человек (60,2%) страдали ожирением 1 степени, 28 (24,1%) – 2 степени, а 18 человек (15,7%) – 3 степени. Как показано в таблице 4, лица с нормальной массой тела были достоверно моложе (45,93±1,71 года), стаж болезни их был на 4 года меньше, чем у больных с ожирением 1 степени (р<0,05), для достижения ремиссии болезни требовалось на 6 дней меньше, чем у пациентов страдающих ожирением 2 степени (р<0,0005). Хотя, по мнению авторов, механизм взаимосвязи между астмой и ожирением полностью не ясен (Царев В.П., 2002, Chinn S., 2006), в настоящее время показано, что астма у пациентов, имеющих избыточную массу тела, протекает более тяжело, чем у больных с нормальной массой тела (Туев, А.В., 2001, Кузьмина Я.С., 2008, Bel E.H., 2006, Peters-Golden M., 2006, Taylor B., 2007), а лечение, направленное на снижение массы тела у тучных больных, улучшает показатели функции внешнего дыхания (Hakala, K., 2000, Varner, A. E., 2000, Gunnbjörnsdóttir M.I., 2004, Bråbäck L., 2005). По данным нашего исследования, в 62% случаев наличие ожирения предшествовало развитию БА, что соответствует данным литературы, где установлена положительная взаимосвязь между частотой заболевания и индексом массы тела у детей, подростков и взрослых, причем как у мужчин, так и женщин (Hedberg, A., 2000, Weiss, S.T, 2004, Beuther D.A., 2007).
При оценке динамических изменений данных величин в зависимости от триггерного механизма выявлено, что в клинической картине у пациентов с бактериальным обострением астмы статистически значимо преобладает кашель и количество мокроты (3,25±0,25 и 3,27±0,24 соответственно), тогда как число приступов удушья почти в 2 раза выше у тех пациентов, обострение заболевания у которых было вызвано контактом с аллергеном (9,67±2,22). Уровень одышки оказался сопоставим во всех группах и достоверно не отличался между собой (табл.5).
Таблица 5
Выраженность клинических симптомов у больных БА в зависимости от причины обострения заболевания по шкале Borgе (1982) (M±m)
| Клинические симптомы, баллы | Причины обострений | ||||
| | Вирусная инфекция | Бактериальная инфекция | Недостаточная терапия | Контакт с аллергеном | Дебют болезни |
| Группы | 1 | 2 | 3 | 4 | 5 |
| n | 77 | 17 | 99 | 16 | 32 |
| Кашель | 3,18±0,18 Р1-3<0,05 Р1-4<0,05 | 3,25±0,25 Р2-4<0,05 | 2,53±0,19 | 2,44±0,24 Р4-5<0,05 | 3,06±0,17 |
| Мокрота | 2,14±0,25 | 3,27±0,24 Р2-3<0,05 | 2,18±0,19 | 2,43±0,29 Р2-4<0,05 | 2,20±0,22 Р2-5<0,05 |
| Одышка | 2,47±0,17 | 2,50±0,19 | 2,15±0,14 | 2,33±0,33 | 2,59±0,12 |
| Приступы удушья | 5,31±0,74 Р1-4<0,05 | 8,29±4,09 | 8,06±1,19 Р3-5<0,05 | 9,67±2,22 Р4-5<0,05 | 3,69±0,86 Р2-5<0,05 |
| Кумулятивный индекс | 13,10±0,67 | 17,31±1,12 Р2-5<0,05 | 14,92±0,82 | 16,87±0,37 Р4-5<0,05 | 11,54±0,47 |
Примечание: кумулятивный индекс симптомов (КИ) – определялся по сумме всех признаков в баллах.
Таким образом, основную часть госпитализированных пациентов составляют лица с 3 и 4 степенью тяжести течения заболевания; среди пациентов преобладают женщины, утяжеление астмы отмечалось по мере увеличения возраста пациентов. При оценке клинического течения обострений с различными триггерными механизмами выявлено, что наиболее тяжелое течение отмечено у пациентов, обострение которых было вызвано присоединением бактериальной инфекции: у этих лиц был отмечен достоверно наибольший возраст, для достижения ремиссии БА, потребовалось статистически значимо большее число дней, в этой же группе отмечен самый высокий кумулятивный индекс (р<0,05).
Нами проведено бактериологическое исследование мокроты только у тех пациентов, в клинической картине которых имелся продуктивный кашель. Забор исследуемого материала был осуществлен у 110 (34,9%) больных в период обострения заболевания для выявления этиологически значимых микроорганизмов.
В монокультуре микрофлора высевалась у 46,4% больных. Ведущее место в структуре патогенов занимает Грам-положительная флора, представленная родом Streptococcus (43,1%), Staphylococcus (23,5%) и Enterococcus (3,9%). На втором месте по частоте встречаемости – 13,6% – находится Грам-отрицательная флора, представленная семейством Echerichia (7,8%), родом Klebsiela (1,9%) и Corinobacter (3,9%). 13,7% в монокультуре занимает грибковая обсемененность рода Candida. Анаэробная флора – Pseudomonas aureginosa – выделена в 1,9% случаев.
В 53,6% случаев выявлены ассоциации микроорганизмов, причем в 84,1% встречалось сочетание 2-х патогенов, а в 15,9% случаев – 3-х микроорганизмов. Основным бактериальным возбудителем в ассоциациях являлся Streptococcus spp (51,9%), у 25 пациентов (38,4%) в качестве второго сочетанного микроорганизма обнаружен Staphylococcus spp. В 6,1% случаев был высеян Enterococcus spp. Грам-отрицательная флора присутствовала в 7,1% случаев, а в 2,7% выявлена Pseudomonas aureginosa. Обращает на себя внимание, что при достаточно редкой частоте встречаемости грибковой флоры в монокультуре, в роли второго возбудителя она обнаруживается в 62% случаев.
Значительное преобладание колонизированной патогенной микрофлорой в диагностическом титре мокроты выявлено у пациентов, обострение БА у которых было вызвано инфекционным агентом: микроорганизмы, представленные в основном Грам-положительной флорой, при бактериологическом исследовании определялись в 58,4% при вирусном и в 47,1% – при бактериальном обострении астмы. В этих же группах у большинства пациентов были высеяны грибы рода Candida. В 39,8% патогены были обнаружены у больных с недостаточной базисной терапией на амбулаторном этапе, в 34,3% – в дебюте болезни. У лиц, обострение процесса которых было вызвано контактом с причинно-значимым аллергеном, микроорганизмы были высеяны лишь в 12,5 случаев, что в 2,8 и 4,7 раз меньше больных дебютом заболевания и вирусного обострения соответственно.
Таким образом, в структуре этиологических факторов по-прежнему сохраняет свою актуальность Streptococcus spp, причем, в большинстве случаев, в виде ассоциаций нескольких видов микроорганизмов, преимущественно с наличием грибов. Чаще всего патогенная микрофлора обнаруживается при инфекционном обострении бронхиальной астмы.
Таблица 6
Динамика показателей ФВД в зависимости от фазы болезни
при обострении, вызванном вирусной инфекцией (M±m)
| Показатели ФВД | Обострение | Ремиссия | Контроль |
| n | 18 | 18 | 31 |
| ФЖЕЛ % от должного | 71,72±6,43 р<0,05* р<0,05** | 86,53±6,78 | 100,56±3,75 |
| ОФВ1 % от должного | 64,96±6,74 р<0,05* р<0,05** | 81,65±7,78 | 92,63±2,72 |
| Тест с сальбутамолом, % | 29,47±4,21 р<0,05* р<0,05** | 13,14±3,76 | 6,20±1,03 |
Примечание: * - р<0,05 при сравнении пациентов с обострением / ремиссией БА
со здоровыми лицами
** - р<0,05 при сравнении пациентов при обострении и ремиссии
Как видно из представленной таблицы 6, показатель ФЖЕЛ в фазу обострения был снижен до уровня средней степени тяжести (71,72±6,43%) с достоверным увеличением до уровня нормальных значении в ремиссию процесса (86,53±6,78%). Также, у этих пациентов произошло статистически значимое увеличение показателя ОФВ1 с 64,96±6,74% до 81,65±7,78% в зависимости от фазы заболевания. При проведении бронходилатационной пробы у больных с вирусным генезом обострения астмы достигнут положительный прирост после ингаляции сальбутамола в фазу обострения (29,47±4,21%), в то время как по достижении ремиссии постбронходилатационный результат стал отрицательным (13,14±3,76%).
При изучении динамики показателей функции внешнего дыхания у пациентов, чье поступление в стационар было связано с проведением недостаточной базисной терапии на амбулаторном этапе (табл. 7), до начала лечения выявлены нарушения вентиляционной функции легких по смешанному типу средней степени тяжести: ФЖЕЛ составила
Таблица 7
Динамика показателей ФВД в зависимости от фазы болезни при обострении, вызванном проведением недостаточной базисной терапии (M±m)
| Показатели ФВД | Обострение | Ремиссия | Контроль |
| n | 21 | 21 | 31 |
| ФЖЕЛ % от должного | 68,01±5,94 р<0,05* р<0,05** | 79,24±5,55 р<0,05* | 100,56±3,75 |
| ОФВ1 % от должного | 59,82±5,47 р<0,05* р<0,05** | 74,92±4,85 р<0,05* | 92,63±2,72 |
| Тест с сальбутамолом, % | 37,15±6,19 р<0,05* р<0,05** | 15,48±4,22 | 6,20±1,03 |
Примечание: * - р<0,05 при сравнении пациентов с обострением / ремиссией БА
со здоровыми лицами
** - р<0,05 при сравнении пациентов при обострении и ремиссии
68,01±5,94%, ОФВ1 – 59,82±5,47%. В фазу ремиссии данные показатели достоверно увеличились относительно периода обострения, но не достигли уровня референсных значений (79,24±5,55% и 74,92±4,85% соответственно). При сравнении результатов бронходилатационной пробы оказалось, что в обе фазы болезни результат был положительным (37,15±6,19% и 15,48±4,22% соответственно), хотя его уменьшение при достижении ремиссии было статистически значимым.
Таблица 8
Динамика показателей ФВД в зависимости от фазы болезни
при обострении, вызванном контактом с аллергеном (M±m)
| Показатели ФВД | Обострение | Ремиссия | Контроль |
| n | 7 | 7 | 31 |
| ФЖЕЛ % от должного | 75,76±8,74 р<0,05* р<0,05** | 98,52±11,54 | 100,56±3,75 |
| ОФВ1 % от должного | 64,75±8,16 р<0,05* | 90,91±10,96 | 92,63±2,72 |
| Тест с сальбутамолом, % | 26,02±6,76 р<0,05* | 17,83±5,59 | 6,20±1,03 |
Примечание: * - р<0,05 при сравнении пациентов с обострением / ремиссией БА
со здоровыми лицами
** - р<0,05 при сравнении пациентов при обострении и ремиссии
При достижении ремиссии болезни у лиц с обострением, спровоцированным контактом с причинно-значимым аллергеном, произошло статистически значимое увеличение ФЖЕЛ с 75,76±8,74% при обострении, до 98,52±11,54% в ремиссию процесса, и ОФВ1 с 64,75±8,16% до 90,91±10,96% соответственно (табл. 8). Результат теста с сальбутамолом также был положительным в обе фазы заболевания с достоверным снижением в ремиссию процесса.
Таблица 9
Динамика показателей ФВД в зависимости от фазы болезни
в дебюте заболевания (M±m)
| Показатели ФВД | Обострение | Ремиссия | Контроль |
| n | 8 | 8 | 31 |
| ФЖЕЛ % от должного | 56,13±8,95 р<0,05* р<0,05** | 67,81±8,77 | 100,56±3,75 |
| ОФВ1 % от должного | 48,53±8,64 р<0,05* р<0,05** | 58,31±7,89 | 92,63±2,72 |
| Тест с сальбутамолом, % | 34,53±5,76 р<0,05* р<0,05** | 21,82±5,75 | 6,20±1,03 |
Примечание: * - р<0,05 при сравнении пациентов с обострением / ремиссией БА
со здоровыми лицами
** - р<0,05 при сравнении пациентов при обострении и ремиссии
Наиболее выраженные нарушения функции внешнего дыхания по всем регистрируемым параметрам отмечены в дебюте заболевания (табл. 9): ФЖЕЛ составила 56,13±8,95%, а уровень ОФВ1 – 48,53±8,64%, что соответствует тяжелым обструктивным нарушениям, причем в фазу клинической ремиссии показатель ФЖЕЛ достиг только 67,81±8,77%, а ОФВ1 58,31±7,89%. В обе фазы болезни тест с бронхолитиком был положительным (34,53±5,76% и 21,82±5,75% сответственно).
Таблица 10
Динамика показателей ФВД в зависимости от фазы болезни
при обострении, вызванном бактериальной инфекцией (M±m)
| Показатели ФВД | Обострение | Ремиссия | Контроль |
| n | 8 | 8 | 31 |
| ФЖЕЛ % от должн | 63,44±10,42 р<0,05* р<0,05** | 73,85±11,83 | 100,56±3,75 |
| ОФВ1 % от должн | 54,74±9,19 р<0,05* р<0,05** | 70,52±11,37 | 92,63±2,72 |
| Тест с сальбутамолом, % | 44,01±15,14 р<0,05* р<0,05** | 7,51±5,55 | 6,20±1,03 |
Примечание: * - р<0,05 при сравнении пациентов с обострением / ремиссией БА
со здоровыми лицами
** - р<0,05 при сравнении пациентов при обострении и ремиссии
Значительное снижение показателей ФЖЕЛ и ОФВ1 отмечено и у тех пациентов, обострение астмы которых было вызвано присоединением бактериального процесса в трахеобронхиальном дереве (табл. 10). Уровень ФЖЕЛ у этих пациентов составил 63,44±10,42% в фазу обострения и 73,85±11,83% в период ремиссии (р<0,05). Обструктивные нарушения в обе фазы процесса колебались в пределах средней степени, хотя разница между фазами процесса была статистически значима. Самый высокий уровень прироста ОФВ1 после ингаляции 400 мкг сальбутамола отмечен у этих пациентов (44,01±15,14%); при достижении клинической ремиссии заболевания данный показатель, аналогично пациентам с вирусным обострением астмы, стал отрицательным (7,51±5,55%).
Учитывая различия в клинической картине, нами прослежена зависимость нарушения дыхательной функции от массы тела пациентов. В результате нашего исследования выявлено существование обратной корреляционной связи между массой тела пациентов и уровнем объема форсированного выдоха за первую секунду; причем с нарастанием степени ожирения увеличивается сила корреляции: если при 1 степени отмечена обратная слабая корреляционная связь (r = - 0,21), то у лиц с 3 степенью ожирения имеется сильная корреляция (r = - 0,96).
Таким образом, при оценке функции внешнего дыхания инструментальными методами исследования, в частности, проведением спирографии, при анализе дыхательных нарушений в зависимости от степени тяжести выявлено, что у всех пациентов в фазу обострения выявлялись обструктивные нарушения средней степени тяжести, причем в период ремиссии лишь при интермиттирующей бронхиальной астме объем форсированного выдоха за первую секунду восстановился до нормальных показателей, а при более тяжелом течении процесса обструктивные изменения сохранялись на момент выписки из стационара даже при достижении клинической ремиссии (отсутствие приступов удушья, сухих хрипов в легких).
В литературе встречаются единичные описания зависимости дыхательных нарушений от триггерных механизмов обострения. Так, T.N. Harju (2006) описывает большее снижение значения ОФВ1 в ремиссию у риновирус-положительных пациентов, чем у вирус-отрицaтельных. В нашем исследовании при анализе выраженности нарушений проходимости дыхательных путей при распределении групп по механизму обострения наиболее тяжелая обструкция зафиксирована в группе дебюта заболевания, во всех остальных группах наблюдались обструктивные нарушения средней степени. При достижении ремиссии восстановление параметров до референсных величин отмечено у больных с вирусным обострением и у тех пациентов, обострение которых было вызвано контактом с аллергеном; у больных с дебютом, недостаточной базисной терапией и бактериальной инфекцией нормализации показателей не произошло и в фазу ремиссии заболевания.
Учитывая проведенный нами анализ ведущих триггерных механизмов обострения бронхиальной астмы, были проанализированы изменения показателей иммунограммы больных в периоды обострения и ремиссии заболевания в зависимости от причины, вызвавшей потерю контроля над заболеванием. В период обострения бронхиальной астмы, триггерным механизмом которого послужило присоединение острой респираторной вирусной инфекции достоверно снижены показатели CD3+CD8+ до 309,81±38,20 uL относительно 542,12±44,65 uL у здоровых лиц и общее количество Т-лимфоцитов, вероятнее всего, за счет фракции цитотоксических лимфоцитов. Значительные изменения в параметрах иммунной системы наблюдаются при сравнении крови больных между собой в разные фазы болезни: в период обострения снижены все исследуемые показатели Т- и В-клеточного звена (р<0,05). В период ремиссии заболевания наблюдается достоверное увеличение количества Т-хелперов более чем в два раза относительно здоровых. В соответствии с этим, коэффициент CD4+/CD8+ составил 2,77±0,24 относительно 1,59±0,14 в группе контроля. Кроме того, в период ремиссии заболевания, отмечено повышение числа Т-клеток, экспрессирующих рецепторы ранней активации CD3+СD25+.
В группе больных, триггером обострения БА у которых явилась бактериальная инфекция, в фазу неконтролируемого течения отмечено увеличение иммунорегуляторного индекса до 2,48±0,42 относительно здоровых, где этот показатель составил 1,59±0,14. При достижении ремиссии болезни изменение клеточного звена зафиксировано в числе цитотоксических лимфоцитов, где выявлено повышение абсолютного количества до 1280,0±352,23 uL относительно 806,56±64,56 uL результатов здоровых лиц и иммунорегуляторного индекса, который составил 2,94±0,61. В исследованиях Т.В. Латышевой (2007) и А.У. Шагалиной (2006), напротив, показано, что у больных, страдающих инфекционно-зависимой бронхиальной астмой, уменьшено количество CD3+CD8+, CD3+CD4+, и CD3+CD19- лимфоцитов. При сравнении иммунограмм пациентов между собой в различные фазы болезни статистически значимых отклонений не выявлено.
Исследуемые показатели иммунитета при обострении БА, вызванном недостаточной базисной терапией, статистически значимо не отличаются от показателей иммунограммы здоровых лиц. В период ремиссии, напротив, отмечен более высокий уровень Т-лимфоцитов (1780,77±99,77 uL), В-клеток (457,31±94,02 uL), Т-хелперов (1167,23±66,84 uL), а также иммунорегуляторного индекса 2,34±0,20 по сравнению со здоровыми пациентами. При сравнении наблюдаемых пациентов между собой в разные фазы болезни имеются достоверные различия между показателями Т-лимфоцитов и Т-хелперов, уровень которых в период обострения оказался ниже, чем при достижении ремиссии заболевания.
В период обострения БА, вызванного контактом с причинным аллергеном, наблюдается статистически значимое снижение общего количества Т-лимфоцитов, в период ремиссии их число повысилось до уровня показателей условно здоровых лиц. Также выявлено достоверное повышение соотношения CD4+/CD8+ в период ремиссии до 2,25±0,21 относительно 1,59±0,14 в контрольной группе. По данным ряда авторов показано, что при достижении лекарственного контроля над процессом показатели клеточного иммунитета достигали нормы, за исключением иммунорегуляторного индекса, который и после купирования обострения оставался на более высоком уровне (Садовничая Л.Т., 2007). Отмечается достоверное снижение численности NK(CD56+16+)+ в обе фазы болезни, а также увеличение В-лимфоцитов в период ремиссии заболевания. При сравнении показателей между собой в разные фазы заболевания подтверждается закономерность, которая была обнаружена при исследовании общей группы больных: более низкие показатели CD3+CD19-, CD3+CD4+ и CD3-СD19+ клеток в период обострения БА и более высокие – в фазе ремиссии заболевания.
В дебюте заболевания в период обострения заболевания существенных различий с контрольной группой здоровых не выявлено, кроме достоверного повышения иммунорегуляторного индекса, который составил 2,77±0,47. В период ремиссии отмечено снижение общего количества Т-лимфоцитов (1053,8±202,04), Т-цитотоксических клеток (271,00±78,05) и увеличение соотношения CD4+/CD8+ до 3,0±0,49.
Таким образом, подводя итог вышеизложенному, обострение бронхиальной астмы характеризуется снижением числа Т-лимфоцитов у больных, триггерным моментом которых служили вирусная инфекция и контакт с аллергеном, и снижением количества Т-цитотоксических клеток у больных с вирусным обострением астмы, что, вероятно обусловлено прямым цитотоксическим действием на клетки лимфоцитарного звена. У больных с другими причинными факторами в фазу обострения показатели иммунитета достоверно не отличаются от результатов исследования условно здоровых пациентов. Более значимые отклонения в показателях системного иммунитета выявлены в фазу ремиссии заболевания в виде достоверного увеличения CD3+CD19-клеток, Т-хелперов у больных с инфекционным обострением, недостаточной базисной терапией. Исследуемые показатели В-лимфоцитарного звена оказались интактными при вирусном, бактериальном обострении БА и у пациентов в дебюте заболевания. У пациентов с недостаточной терапией и контактом с аллергеном в фазу отмечено повышение В-лимфоцитов у лиц с недостаточной терапией на догоспитальном этапе и обострением, спровоцированном контактом с причинно-значимым аллергеном против группы контроля. У пациентов с вирусным и стрептококковым обострением в фазу ремиссии отмечен рост CD3+CD25+, а у больных, триггером обострения которых послужил контакт с аллергеном, в обе фазы болезни выявлено статистически значимое снижение NK(CD56+16+)+ клеток.
