Н. Н. Алипова, канд биол наук О. В. Левашова и канд биол наук М. С. Морозовой под редакцией акад. П. Г. Костюка москва «мир» 1996 ббк 28. 903 Ф50
| Вид материала | Документы |
- Приглашение и программа разнообразие почв и биоты северной и центральной азии, 521.14kb.
- М. А. Ляшко доц., канд физ мат наук; Т. Н. Смотрова доц., канд, 2299.13kb.
- Современные направления развития физической культуры, спорта и туризма, 4493.6kb.
- Отчет о проведении Международной научной конференции-семинара «Современные методы психологии», 97.76kb.
- Образовательная программа дошкольного образования Москва «Просвещение», 5670.3kb.
- Пособие для врачей и среднего медицинского персонала Минск, 5480.63kb.
- Ббк 63. 3(0) Н72, 4378.93kb.
- Тезисы докладов, 4290.75kb.
- Строительные нормы и правила нагрузки и воздействия сниП 01. 07-85* министерство строительства, 1162.86kb.
- Ббк 63. 3(0) Н72, 5546.58kb.
16.2. Центральная организация спинномозгового и стволового отделов вегетативной нервной системы
Общий конечный пре- и постганглионарный пути вегетативной нервной системы; локализация преганглионарных нейронов
Возбуждение преганглионарных симпатических и парасимпатических нейронов, расположенных в спинном мозгу и в стволе мозга, происходит в результате интегративных процессов, протекающих
356 ЧАСТЬ IV. ПРОЦЕССЫ НЕРВНОЙ И ГУМОРАЛЬНОЙ РЕГУЛЯЦИИ
 |
| Рис. 16.10. Нейронный субстрат общего конечного пути вегетативной нервной системы |
в ЦНС. Далее это возбуждение передается через соответствующие синапсы на преганглионарные нейроны и затем на эффекторные органы. В настоящее время накоплено довольно много прямых и непрямых экспериментальных данных в пользу того, что многие эффекторные вегетативные органы иннервируются функционально (а может быть, и анатомически) различными пре- и постганглионарными нервными путями. Так, регуляция потоотделения и кожного кровотока осуществляется разными преи постганглионарными нейронами; разные симпатические нейроны отвечают также за торможение моторики желудочно-кишечного тракта (рис. 16.9) и регуляцию просвета резистивных и емкостных сосудов внутренних органов. Экспериментальные данные последних лет позволяют утверждать, что пре- и постганглионарные нейронные пути, идущие к внутренним органам, могут по аналогии с мотонейронами скелетных мышц рассматриваться как общие конечные пути вегетативной нервной системы (рис. 16.10). Подобная концепция не противоречит представлениям о протекании в симпатических (см. рис. 16.9) и некоторых парасимпатических (см. с. 352) ганглиях интегративных процессов. Она не исключает и того, что деятельность многих внутренних органов регулируется не только постганглионарными нейронами, но также гормональными и метаболическими факторами, механическими процессами и другими влияниями (например, температурными) (см. рис. 16.10). Так, сопротивление сосудов скелетных мышц кровотоку зависит от активности соответствующих постганглионарных сосудосуживающих нейронов, миогенной активности гладких мышц этих сосудов, метаболического состояния скелетных мышц и содержания катехоламинов в крови.
Клеточные тела преганглионарных симпатических и крестцовых парасимпатических нейронов залегают в промежуточной зоне пояснично-грудного и крестцового отделов спинного мозга. В пояснично-грудном отделе к этой зоне относится промежуточно-боковое (интермедиолатералыюе) ядро (ПБЯ), вставочное ядро (ВЯ) и центральное вегетативное ядро (ЦВЯ) (рис. 16.12). Тела большинства преганглионарных симпатических нейронов располагаются
в канатиковой (в белом веществе) и в главной частях ПБЯ (на рис. 16.12-ПБк и ПБг). Возможно, что в различных частях промежуточной зоны локализованы функционально различные преганглионарные нейроны. Так, тела симпатических преганглионаров, иннервирующих эффекторные структуры скелетных мышц и кожи, занимают в ИЛЯ более латеральное положение, а тела нейронов, управляющих внутренними органами,-более медиальное. Тела преганглионарных парасимпатических нейронов, идущих к мочевому пузырю, залегают в крестцовом отделе латерально (на границе с белым веществом), а иннервирующих толстый кишечник-более медиально.
Тела преганглионарных парасимпатических нейронов, регулирующих деятельность сердца, гладкой мускулатуры трахеи и бронхов и желудочно-кишечного тракта, расположены в продолговатом мозге в дорсальном ядре блуждающего нерва и в обоюд- · ном ядре. Тела преганглионарных парасимпатических нейронов, иннервирующих слюнные и слезные железы, залегают в слюноотделительном ядре продолговатого мозга, а гладкие мышцы глаз-в ядре Эдингера-Вестфаля среднего мозга [4, 39, 42].
Тонус вегетативных нервов в покое
Значение тонуса покоя вегетативных нервов для регуляции функции внутренних органов. Многие преи постганглионарные вегетативные нейроны, в частности снабжающие кровеносные сосуды и сердце, обладают спонтанной активностью, или тонусом покоя. Этот тонус имеет важнейшее значение для регуляции функции внутренних органов. Так, в результате тонуса сосудосуживающих нервов гладкая мускулатура сосудов находится в состоянии относительного сокращения. От степени этого сокращения зависит поперечное сечение сосудов и, следовательно, их гидродинамическое сопротивление. Изменения тонуса сосудосуживающих нервов могут приводить к увеличению либо к уменьшению кровотока через орган по сравнению с уровнем покоя. Таким образом, одни и те же постганглионарные нейроны могут оказывать разнонаправленные влияния на просвет сосудов.
ГЛАВА 16. ВЕГЕТАТИВНАЯ НЕРВНАЯ СИСТЕМА 357
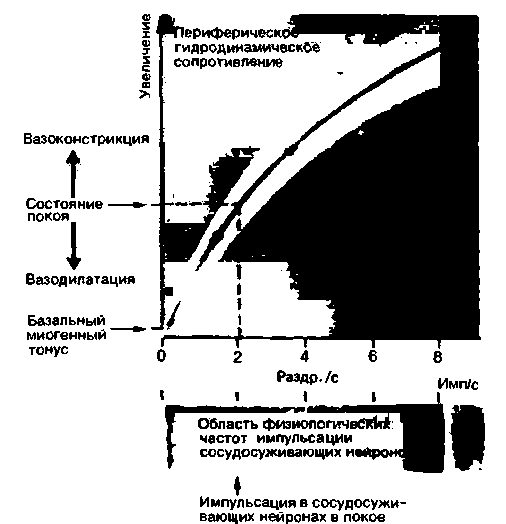 |
| Рис. 16.11. Зависимость гидродинамического сопротивления сосудов скелетных мышц задней конечности кошки (по оси ординат) от частоты надпороговых электрических раздражений преганглионарных волокон поясничного отдела симпатического ствола. Область, закрашенная красным, соответствует диапазону полученных значений (по Meilander. Acta Physiol. Scand., 50, Suppl. 176, 1 (1960) с изменениями) |
На рис. 16.11 изображена схема тонических влияний постганглионарных нейронов на сосудистое сопротивление. Видно, что гидродинамическое сопротивление артериального русла в лапе кошки возрастает при увеличении частоты раздражения поясничного отдела симпатического ствола. Периферическое сопротивление, равное сопротивлению покоя in vivo, соответствует частоте раздражений порядка двух стимулов в секунду. Снижение частоты раздражения приводит к вазодилатации и уменьшению периферического сопротивления; повышение же частоты стимуляции сопровождается вазоконстрикцией и увеличением периферического сопротивления. После фармакологического или хирургического выключения тонуса сосудосуживающих нервов на величину периферического сопротивления продолжают оказывать влияние только спонтанные сокращения гладких мышц сосудов (базальный миогенный тонус) и катехоламины крови (норадреналин и адреналин) (см. с. 349). На рис. 16.11 красным цветом показаны физиологические границы, в пределах которых кровоток может изменяться под действием сосудосуживающих нервов (см. также рис. 20.24, с. 526).
Аналогичным образом регулируются функции
многих органов. Тонус покоя периферических вегетативных нейронов можно измерить либо непрямыми методами (например, путем оценки реакции эффекторного органа при электрическом раздражении вегетативных нервов), либо посредством прямой регистрации активности пре- и постганглионарных нейронов. Величина этой активности колеблется от 0,1 до 4 Гц; в кожных и мышечных сосудосуживающих волокнах в покое и при нейтральной температуре окружающей среды она составляет, по-видимому, около 1-2 Гц [39, 41].
Очевидно, уровень тонической активности вегетативных нервов соответствует физиологическим свойствам гладких мышц. Поскольку сокращение этих мышц характеризуется длительным и медленным нарастанием и расслаблением, низкочастотная тоническая импульсация в вегетативных нервах приводит к постоянному небольшому сокращению (тонусу) гладкомышечных структур [8].
Спинальные вегетативные рефлексы
Сегментарная организация вегетативных рефлексов. Афферентные и вегетативные эфферентные структуры, синаптически связанные на уровне сегментов спинного мозга, образуют дугу вегетативного рефлекса. В отличие от дуги моносинаптического рефлекса растяжения даже простейшие спинальные вегетативные рефлексы, по-видимому, не содержат прямых переключений афферентных волокон (висцеральных и соматических) на преганглионарных нейронах; самый короткий путь между этими структурами включает два синапса. Таким образом, в дуге вегетативного рефлекса между афферентными и постганглионарными нейронами имеется по меньшей мере три синапса (рис. 6.12), два из которых лежат в сером веществе спинного мозга, а один-в вегетативном ганглии.
Для чувствительной и вегетативной иннервации некоторых органов характерна довольно четкая сегментарная организация. Афферентные волокна от сердца и выделительных органов переключаются в пределах сегментов спинного мозга на преганглионарные симпатические и парасимпатические нейроны, иннервирующие эти же органы (кишечно-кишечные рефлексы, кардио-кардиальные рефлексы; эвакуаторные рефлексы, см. с. 360). Возможно, что существуют подобные сегментарные спинальные рефлексы и для других внутренних органов.
Проявления сегментарной организации вегетативной иннервации внутренних органов можно наблюдать и в клинике. При заболевании этих органов (например, холецистите или аппендиците) возникает напряжение мускулатуры в области, соответствующей локализации патологического процесса, и, кроме того, наблюдается покраснение кожи в участке (дерматом), иннервируемом афферентами и эф-
358 ЧАСТЬ IV ПРОЦЕССЫ НЕРВНОЙ И ГУМОРАЛЬНОЙ РЕГУЛЯЦИИ
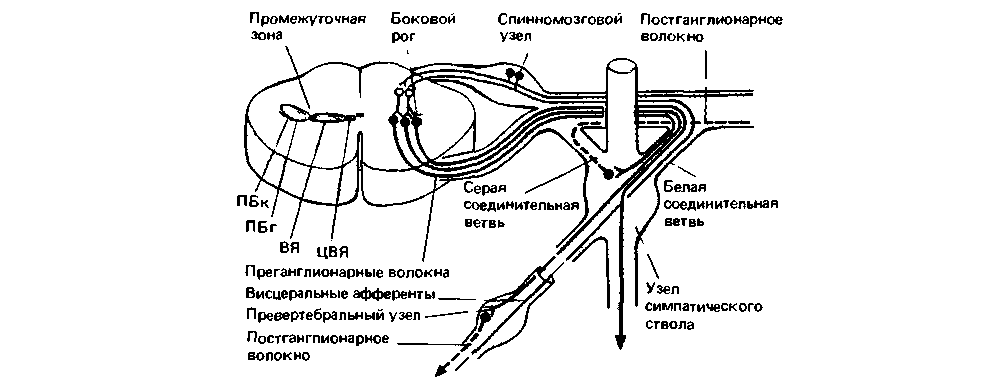 |
| Рис. 16.12. Строение спинальной вегетативной рефлекторной дуги. Слева: ядра промежуточной зоны, в которых располагаются преганглионарные симпатические нейроны. ПБк и Π Бг-соответственно канатчиковая и главная части промежуточно-бокового ядра; ВЯ -вставочное ядро; ЦВЯ центральное вегетативное ядро (по Ranson, Clark. The Anatomy of the Nervous System, 1959; Petras, Cumminas. J. Comp. Neural. 146, 189 (1972)) |
ферентами одноименного сегмента спинного мозга. Покраснение кожи обусловлено тормозным действием афферентных волокон от пораженного органа на симпатические сосудосуживающие кожные волокна того же сегмента. Защитное же напряжение мышц брюшной стенки (дефанс) связано с возбуждающим действием этих чувствительных волокон на мотонейроны. Вместе с тем раздражение терморецепторов кожи через симпатические нейроны приводит к торможению активности внутренних органов, иннервируемых из одноименных сегментов.
Важным диагностическим критерием для врача служит повышение тактильной (гиперестезия) и болевой (гипералгезия) чувствительности в ограниченных участках кожи, наблюдающееся при заболеваниях внутренних органов. Возможно, что болевые и неболевые кожные афферентные волокна и висцеральные афференты, принадлежащие определенному сегменту спинного мозга, конвергируют на одних и тех же нейронах спиноталамического пути (с. 219). При этом в какой-то степени теряется информация о том, от каких внутренних органов поступило возбуждение, и кора головного мозга «приписывает» это возбуждение раздражению соответствующих областей кожи. Подобные кожные боли, наблюдающиеся при заболеваниях внутренних органов, называются отраженными болями, а области, где возникают эти боли,- зонами Геда (см. рис. 9.18 и с. 230).
Многие больные, страдающие заболеваниями внутренних органов (например, стенокардией, связанной с недостаточностью коронарного кровотока, холециститом, язвенной болезнью желудка), жалуются на боли в этих зонах, что помогает в диагностике (см. гл. 10).
Роль симпатической нервной системы в возникновении гиперпатии. У некоторых больных наблюдаются постоянные крайне неприятные жгучие боли, возникающие в результате обычных неболевых воздействий на кожу. Эти боли появляются лишь спустя длительный латентный период после воздействия и угасают также спустя некоторое время после его окончания; они распространяются на соседние области кожи и часто на всю конечность. Подобные состояния носят название гнперпатпи. Гиперпатия часто сопровождается гиперестезией, нарушением сосудодвигательных реакций и потоотделения и главным образом трофическими расстройствами в пораженных тканях. Кожные покровы у таких больных могут быть истонченными, потливыми, холодными либо, наоборот, горячими; иногда наблюдаются трофические изменения подкожной жировой клетчатки и деминерализация костей. Подобные симптомы могут появиться после повреждения срединного, седалищного, берцового нерва или шейно-плечевого сплетения в отделах, расположенных дистальнее места травмы. В невропатологии различные проявления таких состояний называют каузалгией, синдромом Зудека, посттравматическим болевым синдромом, рефлекторной симпатической дистрофией и т.д. Блокада симпатической иннервации пораженных конечностей, произведенная путем либо нарушения проведения в симпатическом стволе, либо применения препаратов, истощающих запасы норадреналина в окончаниях симпатических волокон, либо хирургической симпатектомии, часто приводит к исчезновению постоянных нестерпимых болей и улучшению кровотока, потоотделения и трофики тканей в пораженных участках. В связи с этим считают, что хронические боли при гиперпатии обусловлены влияниями эфферентных адренергических симпатических нейронов. Однако о механизмах гиперпатии и сопровождающих ее трофических нарушений и расстройствах кровоснабжения и потоотделения мы можем лишь догадываться. Возможно, при нарушении поступления афферентных сигналов возрастает тонус симпатических нервов, что может приводить к возбуждению или повышению возбудимости рецепторов тол-
ГЛАВА 16. ВЕГЕТАТИВНАЯ НЕРВНАЯ СИСТЕМА 359
стых и тонких афферентных волокон. Это в свою очередь может сопровождаться аномальными реакциями таких волокон на обычные неболевые воздействия. В результате обработка информации в спинном мозгу может нарушаться, что и приводит, возможно, к возникновению патологических болевых ощущений и расстройств вегетативной регуляции [15, 40].
Вегетативные рефлексы после перерыва спинного мозга. Перерыв спинного мозга приводит к параличу в тех областях тела, которые находятся ниже места травмы (см. с. 102). При этом у человека вегетативные рефлексы в соответствующих отделах исчезают на 1-6 месяцев. В течение первых 1-2 месяцев кожа в этих областях сухая и покрасневшая, поскольку тонус симпатических волокон, иннервирующих потовые железы и сосуды, сильно снижен. В дальнейшем в течение нескольких месяцев наблюдается постепенное усиление сосудосуживающих и потоотделительных соматосимпатических рефлексов в ответ на болевые или безболевые раздражения кожи; в конечном счете это усиление приводит к гиперрефлексии.
Рефлексы эвакуации мочевого пузыря и толстого кишечника и половые рефлексы (см. с. 363 и 364) также восстанавливаются лишь спустя длительное время после перерыва спинного мозга [11, 44]. После исчезновения явлений спинального шока спинной мозг, отделенный от головного, может выполнять ряд регуляторных функций. Так, при переходе из горизонтального положения тела в вертикальное или при кровопотере наступает генерализованное рефлекторное сужение артерий и вен, что препятствует опасному падению артериального давления. Вместе с тем генерализованное рефлекторное возбуждение сосудосуживающих нервов может возникать также в результате активации глубинных соматических и висцеральных афферентов (например, при рефлекторном спазме мышц-сгибателей или при сокращении мускулатуры переполненного мочевого пузыря); это может приводить к генерализованному сужению сосудов, сопровождающемуся опасным повышением артериального давления, пилоэрекции и потоотделению. На рис. 16.13 приведен типичный пример подобных явлений у больного с параплегией (перерыв спинного мозга на уровне Τ 2/3). Медленное наполнение мочевого пузыря сопровождается его изоволюмическими сокращениями, при которых повышается давление в его просвете. Это приводит к возбуждению поясничных и крестцовых висцеральных афферентов от мочевого пузыря, вызывающему рефлекторное (через центры спинного мозга) сужение сосудов скелетных мышц, внутренних органов и кожи (на рисунке видно снижение пульсового объема в пальце руки), и выделению катехоламинов из мозгового слоя надпочечников. Все это вызывает повышение систолического и диастолического артериального давле-
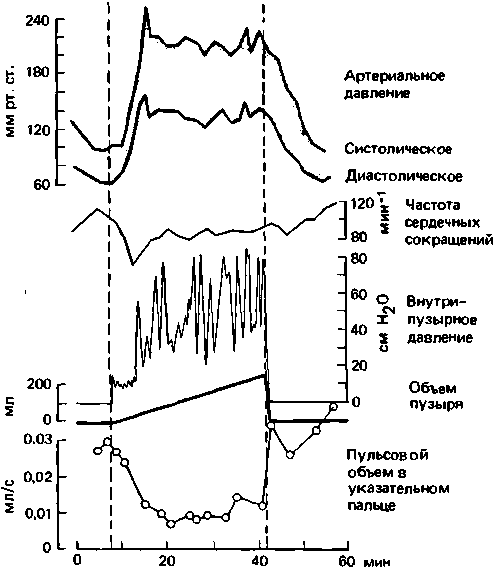 |
| Рис. 16.13. Изменения показателей гемодинамики (артериального давления, частоты сердечных сокращений, кожного кровотока и пульсового объема в указательном пальце) при медленном наполнении мочевого пузыря у больного хронической параплегией (перерыв спинного мозга на уровне Τ 2/3). Видно, что мочевой пузырь сокращается (по [11] с изменениями) |
ния. Частота сердечных сокращений при этом снижается, так как рефлекторная дуга с артериальных барорецепторов, замыкающаяся на уровне продолговатого мозга и парасимпатических (вагусных) сердечных нервных путей, остается незатронутой (рис. 16.14, справа).
Исчезновение вегетативных спинальных рефлексов после перерыва спинного мозга является одним из проявлений спинального шока (см. с. 102). Возможно, что оно связано с перерывом нисходящих путей от ствола мозга (см. рис. 16.14, слева), оказывающих регуляторное влияние на эти рефлексы. Поскольку такие нисходящие влияния у приматов выражены больше, чем у низших позвоночных (например, у лягушки), торможение спинальных рефлексов после перерыва спинного мозга у приматов носит более глубокий и длительный характер.
Восстановление спинномозговых рефлексов после спинального шока может быть обусловлено двумя факторами: более интенсивным протеканием постсинаптических процессов в имеющихся синапсах или развитием новых синапсов на вставочных, преганглионарных и двигательных нейронах.
360 ЧАСТЬ IV. ПРОЦЕССЫ НЕРВНОЙ И ГУМОРАЛЬНОЙ РЕГУЛЯЦИИ
 |
| Рис. 16.14. Слева: нисходящие пути от ствола мозга и гипоталамуса, конвергирующие на преганглионарных нейронах промежуточной зоны пояснично-грудного отдела спинного мозгв. Справа: схема нервной регуляции артериального давления. «+», «—»-соответственно возбуждающие и тормозные эффекты раздражения артериальных барорецепторов (Б). ЯОТ-ядро одиночного тракта; ДЯ -дорсальное ядро блуждающего нерва; ОЯ —обоюдное ядро; ПВЯ-паравентрикулярноеядро гипоталамуса; РВЛ - рострально-вентролатеральная область продолговатого мозга. Х-блуждающий нерв; IX-языкоглоточный нерв [31] |
Регуляция вегетативных функций на уровне ствола головного мозга
Расположение в стволе головного мозга (продолговатом мозгу; см. рис. 5.13) вегетативных «центров», управляющих через периферический отдел вегетативной нервной системы деятельностью внутренних органов и систем (сердечно-сосудистой системы, пищеварительного тракта, а также эвакуаторными рефлексами; см. соответствующие главы), установлено лишь весьма приблизительно. Данные о локализации этих центров были получены в опытах по изучению деятельности различных органов до и после перерезки на уровне ствола головного мозга, разрушения некоторых ядер или путей, а также при электрическом раздражении определенных групп нервных клеток. Об организации вегетативных центров ствола головного мозга на клеточном уровне практически ничего не известно.
Ограниченность наших знаний о вегетативных центрах ствола головного мозга связана, с одной стороны, с чисто техническими трудностями, так как относящиеся к этим центрам нейроны или группы нейронов обычно очень невелики и различить их при нейрофизиологическом либо нейроанатомическом исследовании трудно. С другой стороны, возникают и методологические затруднения: по-видимому, представление о том, что вегетативная регуляция определенных органов связана с конкретными функциональными группами нейронов, объединенными морфологически («центрами»), справедливо лишь частично. Более вероятной представляется такая организация, при которой одиночные нейроны и небольшие их группы отвечают за вегетативную регуляцию совокупности органов, функционально связанных друг с другом (например, рефлекторную регуляцию актов глотания и рвоты, деятельности слюнных желез и желудочно-кишечного тракта). Из этого вытекает,
что все нейроны, управляющие деятельностью какого-либо одного органа, не обязательно должны быть расположены рядом. Следовательно, понятие «центр» можно употреблять лишь с некоторыми оговорками.
Управление вегетативными структурами спинного мозга со стороны ствола мозга и гипоталамуса.
Стволовые и гипоталамические центры оказывают возбуждающие и тормозные нисходящие влияния на симпатические и парасимпатические образования спинного мозга. Именно в этих центрах происходит объединение спинномозговых систем, отвечающих за отдельные вегетативные функции, в функциональные комплексы высшего порядка [4, 15, 39, 42]. В качестве примеров таких комплексов, отвечающих за координацию отдельных функций с целью выполнения каких-то общих программ, можно привести: 1) систему терморегуляции, управляющую сопротивлением кожных сосудов и потоотделением; 2) систему регуляции артериального давления, влияющую на сопротивление резистивных сосудов скелетных мышц и внутренних органов, а также - через симпатические нервы - на сердце и мозговое вещество надпочечников; 3) систему регуляции мочеиспускания и дефекации, управляющую парасимпатической и симпатической иннервацией мочевого пузыря и нижних отделов толстого кишечника, и 4) систему управления репродуктивными органами, контролирующую парасимпатическую и симпатическую иннервацию этих органов. Такому большому разнообразию функций и спинальных вегетатив-
ГЛАВА 16. ВЕГЕТАТИВНАЯ НЕРВНАЯ СИСТЕМА 361
ных структур соответствует и наличие самых разных нисходящих путей к спинному мозгу от ствола мозга и гипоталамуса, идущих к преганглионарным нейронам в промежуточной зоне (рис. 16.14, слева). Функции этих систем пока до конца не изучены, однако известны их происхождение и биохимические свойства. Так, серотонинергические нейроны начинаются от ядер шва, адренергические-от рострально-вентролатеральных отделов продолговатого мозга, норадренергические-от моста, а пептидергические (вазопрессинергические и окситоцинергнческие)-от паравентрикулярных ядер гипоталамуса. Каждый из этих путей заканчивается на преганглионарных нейронах или соответствующих интернейронах. Пока неизвестно, являются ли все перечисленные выше вещества медиаторами, модуляторами или и теми, и другими.
Роль продолговатого мозга в регуляции кровообращения. Значение продолговатого мозга в регуляции артериального давления особенно четко выявляется при сравнении спинальных животных с высокой перерезкой (на уровне верхних шейных позвонков) и децеребрированных животных (см. с. 103), имеющих интактный продолговатый мозг. Сразу после перерыва спинного мозга у животных резко падает артериальное давление, так как исчезает тонус покоя симпатических нейронов, иннервирующих кровеносные сосуды, сердце и мозговое вещество надпочечников. У таких животных остается возможной лишь регуляция сердца, сохраняющего связи с продолговатым мозгом посредством блуждающих нервов (см. рис. 16.14). Что касается децеребрированных животных, то у них артериальное давление остается нормальным, так как в ответ на изменение положения тела в пространстве возникают координированные реакции резистивных и емкостных сосудов внутренних органов, в результате которых перфузионное давление в тканевых сосудах не изменяется. Давление остается стабильным у подобных животных с сохраненным продолговатым мозгом даже после перерезки всех афферентных волокон блуждающих и языкоглоточных нервов, играющих важную роль в регуляции кровообращения. Это свидетельствует о том, что дуги рефлексов, отвечающих за поддержание центрального артериального давления, проходят через продолговатый мозг, и что именно этот отдел отвечает за постоянные тонические влияния, которые симпатические нервы оказывают на сердце и сосуды в покое (см. выше). Область продолговатого мозга, в которой располагаются нейроны, участвующие в поддержании и регуляции артериального давления, получила название сердечно-сосудистого (кардиоваскулярного) центра.
Важную роль в регуляции гемодинамики играют рострально-вентролатеральные отделы продолговатого мозга (на рис. 16.14-РВЛ). Местное раздраже-
ние нейронов этого отдела сопровождается повышением артериального давления, частоты сердечных сокращений и выделения катехоламинов из мозгового слоя надпочечников. Разрушение же данной области приводит к такому же падению давления, как после высокой перерезки спинного мозга. Аксоны нейронов, расположенных в РВЛ, идут в составе заднебоковых столбов спинного мозга непосредственно к симпатическим преганглионарным нейронам в промежуточной зоне (рис. 16.14). Афферентные волокна от артериальных баро- и хеморецепторов и от сердца, играющие важную роль в нервной регуляции гемодинамики, направляются в составе блуждающих и языкоглоточных нервов к ядрам одиночного тракта (ЯОТ); нейроны этих ядер посылают сигналы к различным ядрам ствола мозга и гипоталамуса, в том числе к РВЛ. Аксоны от этого последнего отдела в свою очередь идут к симпатическим преганглионарным нейронам промежуточной зоны спинного мозга (рис. 16.14, справа). Нейроны медиальных отделов ЯОТ возбуждаются при естественном раздражении афферентов от артериальных барорецепторов. Волокна от них идут к нейронам РВЛ, на часть которых эти волокна оказывают ингибирующее влияние. Таким образом, за ингибирование влияния симпатических нейронов на сердце и резистивные сосуды, возникающее в результате раздражения артериальных барорецепторов (см. с. 533), отвечают, по крайней мере частично, образования продолговатого мозга. В правой части рис. 16.14 показаны основные нервные структуры, расположенные между сердечно-сосудистыми афферентными входами к ЯОТ и эффекторами и входящие в состав системы управления артериальным давлением в большом кругу кровообращения. Преганглионарные парасимпатические нейроны, посылающие волокна к сердцу, залегают в дорсальных ядрах блуждающих нервов (ДЯ) и обоюдных ядрах (ОЯ). Само собой разумеется, что ядра продолговатого мозга (ЯОТ, ОЯ, ДЯ и РВЛ) (см. рис. 16.14) находятся под контролем со стороны других нервных структур ствола мозга, гипоталамуса и лимбической системы [4, 24, 31].
