Н. Н. Алипова, канд биол наук О. В. Левашова и канд биол наук М. С. Морозовой под редакцией акад. П. Г. Костюка москва «мир» 1996 ббк 28. 903 Ф50
| Вид материала | Документы |
- Приглашение и программа разнообразие почв и биоты северной и центральной азии, 521.14kb.
- М. А. Ляшко доц., канд физ мат наук; Т. Н. Смотрова доц., канд, 2299.13kb.
- Современные направления развития физической культуры, спорта и туризма, 4493.6kb.
- Отчет о проведении Международной научной конференции-семинара «Современные методы психологии», 97.76kb.
- Образовательная программа дошкольного образования Москва «Просвещение», 5670.3kb.
- Пособие для врачей и среднего медицинского персонала Минск, 5480.63kb.
- Ббк 63. 3(0) Н72, 4378.93kb.
- Тезисы докладов, 4290.75kb.
- Строительные нормы и правила нагрузки и воздействия сниП 01. 07-85* министерство строительства, 1162.86kb.
- Ббк 63. 3(0) Н72, 5546.58kb.
Влияние симпатических и парасимпатических волокон на эффекторные органы
Влияние периферической вегетативной нервной системы на различные органы можно исследовать в опытах с электрическим раздражением вегетативных нервов. Изучение этого влияния необходимо: 1) для понимания механизмов деятельности органов, имеющих вегетативную иннервацию, в физиологических условиях, а также взаимодействия между двумя отделами вегетативной нервной системы in vivo; 2) для оценки реакции этих органов при патологии; 3) для понимания механизмов влияния лекарственных препаратов, имитирующих либо блокирующих эффекты симпатических или парасимпатических нервов.
Многие внутренние органы получают как симпатическую, так и парасимпатическую иннервацию (табл. 16.1). Влияния этих двух отделов часто носят антагонистический характер. Так, раздражение симпатических нервов приводит к увеличению частоты сокращений сердца, снижению двигательной активности кишечника, расслаблению желчного пузыря
346 ЧАСТЬ IV. ПРОЦЕССЫ НЕРВНОЙ И ГУМОРАЛЬНОЙ РЕГУЛЯЦИИ
| Таблица 16.1. Влияние симпатических и парасимпатических нервов на различные органы | |||
| Орган или система | Стимуляция | Адренорецепторы | |
| парасимпатических нервов | симпатических нервов | | |
| Сердце | Уменьшение частоты | Увеличение частоты |  |
| | сокращений | сокращений | 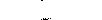 |
| | Уменьшение силы | Увеличение силы |  |
| | сокращений (предсердий) | сокращений | 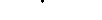 |
| Кровеносные сосуды | | |  |
| Артерии кожи и слизистых | — | Сужение |  |
| Артерии брюшиой полости | - | » |  |
| Артерии скелетных мышц | — | » |  |
| | | Расширение (только под |  |
| | | действием адреналина крови) |  |
| | | Расширение (холинергическое) |  |
| Артерии сердца (коронарные) | Расширение (?) | Сужение | 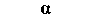 |
| | | Расширение (только под |  |
| | | действием адреналина крови) |  |
| Артерии полового члена, а также, | Расширение | ? |  |
| возможно, клитора и малых половых | | |  |
| губ | | |  |
| Вены | - | Сужение | 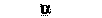 |
| Сосуды мозга | Расширение (?) | » |  |
| Желудочно-кишечный тракт | | |  |
| Продольные и циркулярные мышцы | Усиление моторики | Ослабление моторики |  |
| Сфинктеры | Расслабление | Сокращение |  |
| Капсула селезенки | — | » |  |
| Мочевой пузырь | | |  |
| Детрузор | Сокращение | Расслабление |  |
| Внутренний сфинктер | - | Сокращение |  |
| Половые органы | | |  |
| Семенные пузырьки | — | » | 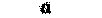 |
| Семявыносящий проток | | |  |
| Матка | | » |  |
| | | Расслабление (в зависимости | 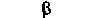 |
| | | от вида животного и |  |
| | | гормонального фона) |  |
| Внутренние глазные мыщцы | | |  |
| Мышца, расширяющая зрачок | - | Сокращение (мидриаз) |  |
| Сфинктер зрачка | Сокращение (миоз) | — |  |
| Цилиарная мышца | Сокращение (аккомодация) | Незначительное расслабление | 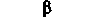 |
| Трахео-бронхиальные мышцы | Сокращение | Расслабление (в основном под действием адреналина) Сокращение | 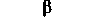 |
| Мышцы, поднимающие волосы | _ | 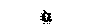 | |
| Экзокринные железы | | |  |
| Слюнные железы | Обильное выделение | Небольшое выделение | 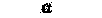 |
| | серозного секрета | слизистого секрета |  |
| | | (из подчелюстной железы) |  |
| Слезные железы | Секреция | - |  |
| Пищеварительные железы | » | Снижение секреции или — | 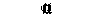 |
| Железы носоглотки | » | — |  |
| Бронхиальные железы | » | ? |  |
| Потовые железы | ■г- | Секреция (холинергическая) |  |
| Метаболизм | | |  |
| Печень | | Гликогенолиз |  |
| | | Глюконеогенез |  |
| Жировые клетки | | Липолиз (повышение уровня |  |
| | | свободных жирных кислот |  |
| | | в крови) |  |
| Секреция инсулина (ß-клетками | - | Снижение |  |
| островка Лангерганса) | | |  |
ГЛАВА 16. ВЕГЕТАТИВНАЯ НЕРВНАЯ СИСТЕМА 347
и бронхов и сокращению сфинктеров желудочнокишечного тракта. Стимуляция же парасимпатических волокон (например, электрическое раздражение блуждающего нерва; см. рис. 16.1) оказывает противоположный эффект: частота сокращений сердца и сила сокращений предсердий снижаются, моторика кишечника усиливается, желчный пузырь и бронхи сокращаются, а сфинктеры желудочно-кишечного тракта расслабляются. В физиологических условиях деятельность всех этих органов зависит от преобладания тех или иных влияний.
В то же время в большинстве случаев оба отдела вегетативной нервной системы действуют «синергично». Эта функциональная синергия особенно хорошо видна на примере рефлексов на сердце с барорецепторов (см. рис. 20.27). Возбуждение барорецепторов в результате повышения артериального давления приводит к снижению частоты и силы сокращений сердца. Этот эффект обусловлен как увеличением активности парасимпатических сердечных волокон, так и снижением активности симпатических волокон (в связи с этим интересно сравнить данные табл. 16.1 и рис. 20.28).
Во многих органах, имеющих и симпатическую, и парасимпатическую иннервацию, в физиологических условиях преобладают регуляторные влияния парасимпатических нервов. К таким органам относятся мочевой пузырь и некоторые экзокринные железы (см. табл. 16.1). Существуют также органы, снабжаемые только симпатическими или только парасимпатическими нервами; к ним относятся почти все кровеносные сосуды, селезенка, гладкие мышцы глаза, некоторые экзокринные железы и гладкие мышцы волосяных луковиц (см. табл. 16.1).
Под действием симпатических нервов может усиливаться гликогенолиз в печени и липолиз в жировых клетках, что приводит к увеличению концентрации глюкозы и свободных жирных кислот в крови. Парасимпатические нервы не влияют на эти процессы. Метаболические эффекты симпатической системы рассматриваются ниже. Вегетативная иннервация отдельных органов подробно описывается в соответствующих главах.
Нейрогуморальная передача в периферическом отделе вегетативной нервной системы
Возбуждение от преганглионарных нейронов к постганглионарным и от постганглионарных нейронов к эффекторным органам передается при помощи химических медиаторов. По-видимому, механизмы медиаторной передачи в периферическом отделе вегетативной нервной системы те же, что в нервно-мышечной концевой пластинке (с. 51) и в центральных синапсах (с. 57). Однако в отличие от нервно-мышечного соединения пре- и постсинаптические образования вегетативной нервной системы
чрезвычайно вариабельны; к ним относятся клетки миокарда, гладкомышечные и железистые клетки и нейроны. Кроме того, плотность и характер иннервации различных гладкомышечных органов также могут быть совершенно разными (с. 87).
Ацетилхолин. По-видимому, ацетилхолин высвобождается в окончаниях всех преганглионарных вегетативных волокон и большинства постганглионарных парасимпатических нейронов (рис. 16.2). Некоторые симпатические постганглионарные клетки-нейроны потовых желез и, возможно, нейроны, вызывающие расширение резистивных сосудов скелетных мышц,-также являются холинергическими.
Действие ацетилхолина на постсинаптическую мембрану постганглионарных нейронов может быть воспроизведено никотином, а действие ацетилхолина на эффекторные органы—мускарином (токсин мухомора, Amanita muscaria). В связи с этим возникла гипотеза о наличии двух типов макромолекулярных («фармакологических») рецепторов ацетилхолина, и влияния на них этого медиатора были названы никотиноподобным и мускариноподобным (рис. 16.2).
Существуют препараты, избирательно блокирующие то или иное влияние. Эти препараты конкурируют с ацетилхолином за связывание с постсинаптическими холинорецепторами, препятствуя тем самым его действию; сами они при этом не оказывают агонистического (холинергического) эффекта. Никотиноподобное действие ацетилхолина на постганглионарные нейроны может блокироваться четвертичными соединениями аммония, которые поэтому называют ганглиоблокаторами. Мускариноподобный эффект ацетилхолина избирательно блокируется атропином (ядом красавки).
Вещества, действующие на клетки эффекторных
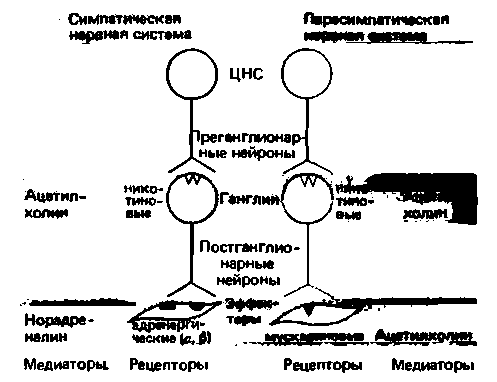 |
| Рис. 16.2. Медиаторы периферической вегетативной нервной системы |
348 ЧАСТЬ IV. ПРОЦЕССЫ НЕРВНОЙ И ГУМОРАЛЬНОЙ РЕГУЛЯЦИИ
органов так же, как холинергические постганглионарные парасимпатические нейроны, называются в фармакологии парасимпатомиметическими. Вещества же, выключающие или ослабляющие влияние ацетилхолина на эти органы, называются парасимпатолитическими. Парасимпатолитические вещества, типичным примером которых служит атропин, обладают «антимускариновым» действием.
Норадреналин и адреналин. Представление об аи ß-рецепторах. Поскольку окончания симпатических постганглионарных нейронов выделяют в качестве нейромедиатора норадреналин, эти нейроны называются адренергическими (см. рис. 16.2). Клетки мозгового слоя надпочечников высвобождают в кровоток главным образом адреналин (см. с. 348). Эти два вещества относятся к катехоламинам (см. с. 54). Синтетическим катехоламином, не образующимся в организме, является изопротеренол.
Существуют вещества, воспроизводящие действие симпатических адренергических нейронов,симпатомиметические вещества, и блокирующие это действие симпатолитические вещества. (Эти агенты действуют на адренергические механизмы так же, как парасимпатолитики и парасимпатомиметикина холинергические.)
Реакции различных органов на норадреналин и адреналин, так же как на ацетилхолин и другие медиаторы, опосредованы взаимодействием катехоламинов с особыми структурами в составе клеточных мембран. Эти гипотетические мембранные структуры называют адренергическими рецепторами. На основании двух чисто фармакологических критериев были выделены а- и ß-адренорецепторы (которые обычно называют просто а- и ß-рецепторами). Эти критерии следующие: 1) относительная эффективность действия эквимолярных доз различных катехоламинов (обычно адреналина, норадреналина и изопротеренола; рис. 16.3, А) при возбуждении αи ß-адренергических эффектов; 2) эффективность симпатолитических веществ при выключении этих двух эффектов. О молекулярном строении а- и β-peцепторов известно мало.
Эффект считается а-адренергическим, если он удовлетворяет следующим критериям: 1) эффективность катехоламинов в возбуждении этого эффекта убывает в ряду: норадреналин, адреналин, изопротеренол (НА ≥ А ≥ И); 2) эффект избирательно блокируется специфическими ингибиторами - а-адреноблокаторами в низких концентрациях (рис. 16.3, 5).
ß-Адренергический эффект с фармакологической точки зрения характеризуется следующими особенностями: 1) эффективность эквимолярных доз изопротеренола убывает в порядке И ≥ Α ≥ НА; таким образом, синтетический катехоламин изопротеренол оказывает более выраженный ß-адренергический эффект, чем естественные катехоламины; 2)
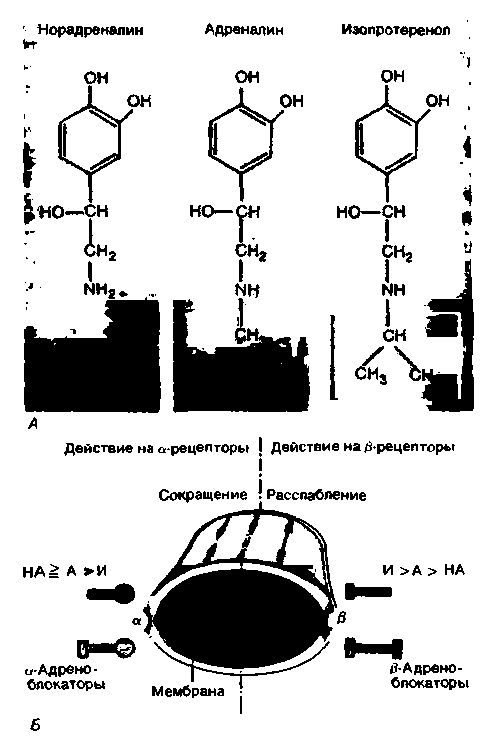 |
| Рис. 16.3. А. Молекулярная структура норадреналина (НА), адреналина (А) и иэопротеренола (И). Б. Действие катехоламинов на адренорецепторы. Значками > или = обозначены соответственно более сильное и одинаковое действия |
эффект блокируется специфическими ß-адреноблокаторами (рис. 16.3,5) типа производного изопротеренола-дихлоризопротеренола (см. рис. 16.3, А). Представление об эффектах а- и ß-рецепторов дает рис. 16.4, где приведены кривые действия адреналина на артерии сосудов скелетных мышц. В гладкой мускулатуре этих сосудов содержатся оба типа рецепторов (см. табл. 16.1). Возбуждение α-рецепторов приводит к сужению сосудов, а возбуждение ß-рецепторов - к их расширению (см. рис. 16.3,5). При высоком уровне адреналина в крови мышечные сосуды суживаются в результате преобладания α-адренергического действия (рис. 16.4, А). После выключения α-рецепторов специфическим блокатором наблюдается расширение мышечных сосудов (снижение периферического сопротивления) в ответ на введение адреналина (рис. 16.4,5), поскольку в этом случае возбуждаются только β-pe-
ГЛАВА 16. ВЕГЕТАТИВНАЯ НЕРВНАЯ СИСТЕМА 349
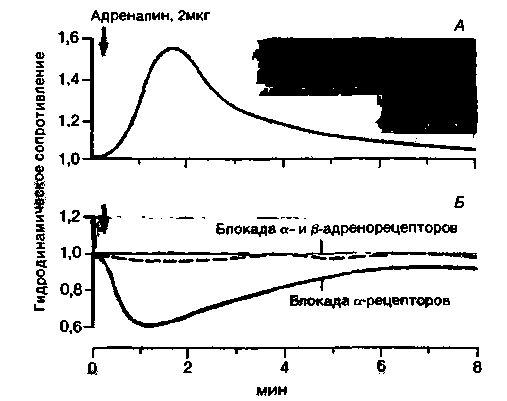 |
| Рис. 16.4. Влияние а- и ß-адреноблокаторов на изменение гидродинамического сопротивления в сосудах изолированной перфузируемой скелетной мышцы (по оси ординат), вызванное внутриартериальным введением адреналина (по Schmidt-Vanderheyen Koepchen. Pflugers Arch., 298, 1 (1967)) |
цепторы (так называемая парадоксальная реакция на адреналин). После блокирования этих рецепторов ß-адреноблокаторами адреналин практически не оказывает влияния на мышечные сосуды (рис. 16.4, Б). Полагают, что в физиологических условиях при нормальном достаточно низком уровне адреналина в крови он оказывает расширяющее действие на мышечные артерии, поскольку преобладает эффект ß-рецепторов (см. рис. 16.5).
В большинстве органов, реагирующих на катехоламины, клеточные мембраны содержат как а-, так и ß-рецепторы, и эффекты возбуждения рецепторов этих двух типов, как правило, бывают противоположными (антагонистическими). В физиологических условиях реакция какого-либо органа на адреналин и норадреналин, поступающие с кровью либо выделяющиеся при возбуждении симпатических нервов, зависит от преобладания а- или ß-адренергического эффекта.
В табл. 16.1 указаны рецепторы, опосредующие физиологические эффекты двух катехоламинов в наиболее важных органах. В связи с тем что норадреналин очень сильно активирует ß-рецепторы миокарда, но вызывает лишь слабую реакцию ß-рецепторов гладких мышц сосудов, бронхов и трахеи, сердечные ß-рецепторы называют рецепторами типа
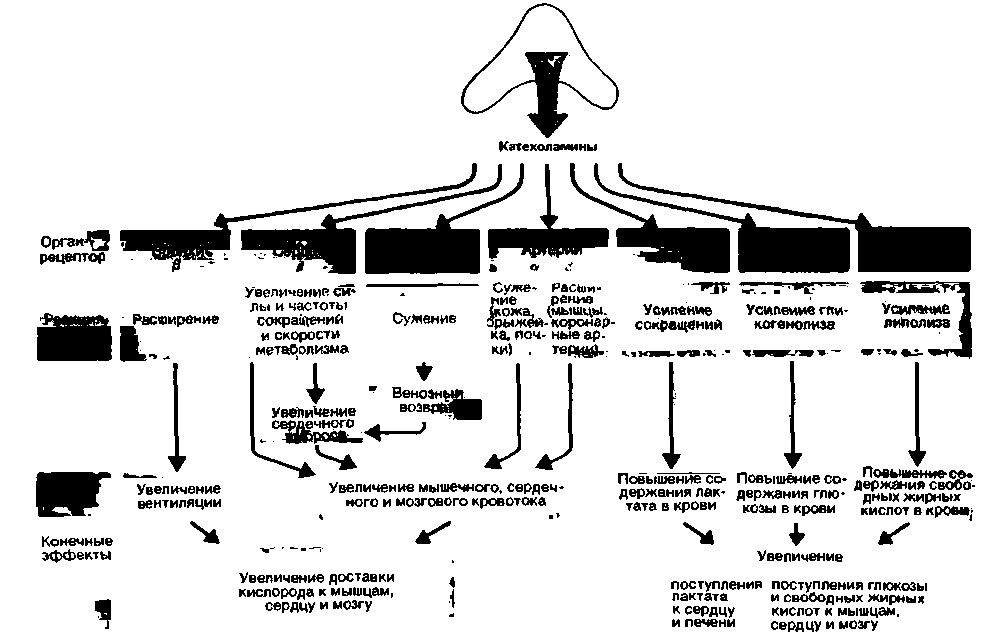 |
| Рис. 16.5. Влияние адреналина-гормона мозгового вещества надпочечников-на различные органы |
351 ЧАСТЬ IV. ПРОЦЕССЫ НЕРВНОЙ И ГУМОРАЛЬНОЙ РЕГУЛЯЦИИ
ß1, а ß-рецепторы сосудов и бронхов-типа ß2. Пока еще разделить все ß-рецепторы организма по категориям ß1 и ß2 не представляется возможным [10]. Другие медиаторы в периферических отделах симпатической и парасимпатической систем. По-видимому, норадреналин и ацетилхолин не являются единственными медиаторами в периферическом отделе вегетативной нервной системы. В экспериментальных условиях было показано, что эффекты, возникающие во многих органах в результате активации вегетативных нервов, не элиминируются ни адренолитическими, ни холинолитическими препаратами. Так, у млекопитающих кожные сосуды иннервируются постганглионарными сосудорасширяющими нейронами, медиатором которых не служит ни адреналин, ни ацетилхолин. Стимулирующее действие нейронов на экзокринные железы (потовые и слюнные) приводит к расширению сосудов, расположенных рядом с этими железами (т.е. к увеличению в них кровотока). Эти железы активируются ацетилхолином, а их вазодилатацию, как полагают, вызывает вещество, относящееся к классу нейропептидов, - вазоактивный интестинальный пептид (ВИП). Обнаружено, что ацетилхолин и ВИП одновременно присутствуют в расширениях иннервирующих эти железы постганглионарных нейронов и оба выделяются при возбуждении последних. Во многих преганглионарных нейронах спинного мозга также содержится не только ацетилхолин, но и какой-либо нейропептид (например, метэнкефалин, нейротензин, ВИП, холецистокинин, вещество Р). Однако роль медиаторов вегетативной нервной системы пока еще убедительно не доказана ни для одного из этих веществ [26, 32].
Мозговое вещество надпочечников. Общее действие адреналина и норадреналина
Мозговое вещество надпочечников представляет собой видоизмененные симпатические ганглии. С онтогенетической точки зрения клетки мозгового вещества гомологичны постганглионарным симпатическим нейронам. Преганглионарные волокна образуют на этих клетках возбуждающие холинергические синапсы (рис. 16.1). Выделение катехоламинов из мозгового вещества надпочечников регулируется исключительно со стороны нервной системы. При возбуждении преганглионарных волокон у человека в кровоток обычно выбрасывается смесь катехоламинов, состоящая из адреналина (немногим более 80%) и норадреналина (чуть меньше 20%). У различных животных соотношение адреналина и норадреналина в мозговом веществе надпочечников значительно варьирует. Так, доля норадреналина в мозговом веществе надпочечника кита составляет 70-80%; у кролика же надпочечники содержат почти исключительно адреналин. Эти два катехо-
ламина вырабатываются различными клетками мозгового вещества.
Катехоламины, выделяемые мозговым веществом надпочечников, действуют на те же эффекторные органы, что и постганглионарные симпатические нейроны. Однако в норме, по-видимому, они оказывают выраженное влияние лишь на те органы или участки органов, которые не иннервируются либо слабо иннервируются симпатическими нервами (например, среднюю оболочку артерий; рис. 16.6, А, В). Действие катехоламинов крови на органы с богатой симпатической иннервацией (например, семявыносящий проток; см. рис. 16.6, Б, Г), по-видимому, незначительно. Очевидно, катехоламины мозгового вещества надпочечников участвуют главным образом в регуляции обменных процессов. Они усиливают высвобождение свободных жирных кислот из подкожной жировой ткани и образование глюкозы и лактата из гликогена (см. табл. 16.1). Таким образом, катехоламинам мозгового вещества надпочечников следует приписывать главным образом функцию метаболических гормонов (см. с. 411). Эти метаболические эффекты катехоламинов
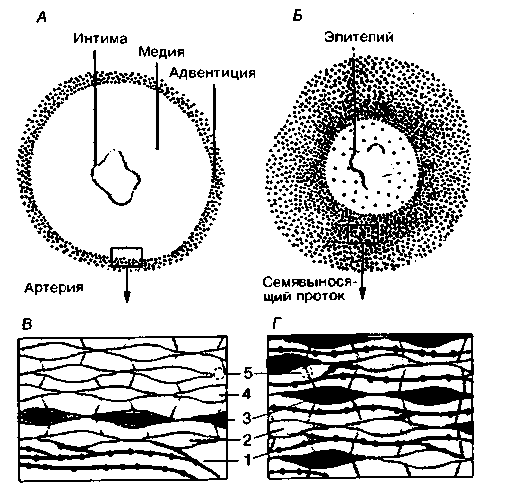 |
| 1. Нервные волокна с расширениями 2. Непосредственно иннервируемые мышечные клетки 3. Мышечные клетки с прямой связью и электротонической передачей синаптических потенциалов 4. Мышечные клетки с непрямой связью; возбуждение передается лишь посредством потенциалов действия 5. Нексус (область контакта с низким сопротивлением) |
| Рис. 16.6. Нейроэффекторная передача в периферическом отделе вегетативной нервной системы. Распределение адренергических окончаний (показано красным) в гладкомышечных слоях резистивного сосуда (артерии уха кролика) (А, Б) и семявыносящего протока {Б, Г) [2] |
ГЛАВА 16. ВЕГЕТАТИВНАЯ НЕРВНАЯ СИСТЕМА 351
опосредованы преимущественно ß-рецепторами (табл. 16.1).
У человека в состоянии покоя из мозгового вещества надпочечников выделяется приблизительно 8-10 нг катехоламинов на 1 кг массы в минуту. Эта величина обусловлена исходным тонусом преганглионарных симпатических волокон; таким образом, высвобождение катехоламинов из мозгового слоя надпочечников зависит от влияния ЦНС. При таких экстремальных состояниях, как кровопотеря, гипотермия, гипогликемия, гипоксия, ожоги или большая физическая нагрузка, скорость высвобождения катехоламинов увеличивается. В последнем случае благодаря влиянию симпатической нервной системы, опосредованному выделением катехоламинов из мозгового вещества надпочечников и из окончаний постганглионарных нейронов, возрастает доставка кислорода и субстратов окисления к скелетным мышцам, сердцу и головному мозгу. Через ß-адренорецепторы катехоламины мозгового слоя вызывают повышение содержания свободных жирных кислот, глюкозы и лактата в крови. Кроме того, при действии адреналина на ß-рецепторы происходит расширение артерий скелетных мышц и сердца (рис. 16.5). Одновременно (главным образом в связи с возбуждением постганглионарных симпатических нейронов) возрастает сердечный выброс, наступает генерализованное сужение вен, а также артерий кожи и внутренних органов; бронхи при этом расширяются. Все эти эффекты могут быть опосредованы либо а-, либо ß-рецепторами (рис. 16.5) [13].
Главным фактором, влияющим на деятельность мозгового вещества надпочечников, служит (кроме описанных выше экстремальных ситуаций) эмоциональное состояние организма. При эмоциональном стрессе интенсивность высвобождения катехоламинов может временно увеличиваться более чем в 10 раз по сравнению с уровнем покоя. Этот выброс гормонов мозгового вещества связан с влияниями гипоталамуса и лимбической системы. Центральные механизмы, лежащие в основе активации всех этих структур, мало изучены. Возможно, что при постоянных стрессорных воздействиях, часто встречающихся в условиях современной жизни (и у представителей некоторых профессий), повышенное содержание катехоламинов в крови может способствовать развитию некоторых заболеваний.
Реакции эффекторных органов на экстремальные воздействия и сильный эмоциональный стресс, связанные с возбуждением постганглионарных симпатических нейронов и мозгового вещества надпочечников, могут быть названы стрессорными реакциями. Они включают одинаковые ответы почти всех отделов симпатической нервной системы, и в связи с этим можно говорить о симпатоадреналовой системе [4]. Такое общее возбуждение всей симпати-
ческой нервной системы при внешних и внутренних экстремальных условиях связано главным образом с влиянием гипоталамуса.
Хирургическое удаление периферической симпатической нервной системы у животного (например, у кошки или собаки) не приводит к тяжелым нарушениям его нормальной жизнедеятельности в покое и при постоянных условиях окружающей среды. Однако такое животное теряет возможность приспосабливаться к экстремальным нагрузкам, например температурным воздействиям или физической деятельности, так как у него отсутствует механизм быстрой доставки больших количеств кислорода, глюкозы и свободных жирных кислот к головному мозгу, сердцу и скелетным мышцам (рис. 16.5) [3].
Синаптическая организация периферического отдела вегетативной нервной системы
Адренергический нейрон. Нейроэффекторная передача. Большинство адренергических нейронов обладает длинными тонкими аксонами (рис. 16.1), многократно ветвящимися в органах и образующими так называемые адренергические сплетения. Согласно подсчетам, общая длина конечных ветвей такого нейрона может достигать 10-30 см. На этих ветвях имеются многочисленные (250-300 на 1 мм) расширения, в которых синтезируется, запасается и инактивируется норадреналин. При возбуждении адренергических нейронов норадреналин высвобождается из этих расширений во внеклеточное пространство. Поскольку при этом он выбрасывается из большого количества расширений, возбуждение адренергических нейронов действует не столько на одиночные гладкомышечные клетки, сколько на всю гладкомышечную ткань в целом. Отдельные гладкомышечные волокна соединяются друг с другом посредством контактов с низким электрическим сопротивлением (рис. 16.6) Благодаря таким «плотным контактам», или нексусам, постсинаптические потенциалы и потенциалы действия могут электротонически передаваться от клетки к клетке (на рис. 16.6, В и Г-клетки с прямой связью). Более удаленные клетки возбуждаются лишь под влиянием потенциалов действия, возникающих в том случае, когда постсинаптические потенциалы в непосредственно иннервируемых гладкомышечных клетках превышают пороговый уровень. Потенциалы действия распространяются в виде волны возбуждения по всей гладкомышечной ткани (рис. 16.6,5, Г, клетки с непрямой связью). Таким образом, деполяризация нескольких гладкомышечных клеток под действием медиатора приводит к одновременному сокращению всех клеток гладкой мышцы.
Плотность иннервации различных гладкомышечных органов значительно колеблется. В органах, характеризующихся особенно богатой иннервацией, на многих клетках имеются прямые нервно-мышечные соединения. В таких соединениях расстояние между расширением симпати-
352 ЧАСТЬ IV. ПРОЦЕССЫ НЕРВНОЙ И ГУМОРАЛЬНОЙ РЕГУЛЯЦИИ
ческого аксона и мембраной гладкомышечной клетки равно примерно 20 нм (рис. 16.6, Б, Г). Примером подобных органов могут служить семенной проток и ресничная мышца. В этом случае гладкомышечные клетки находятся целиком под нервным контролем; катехоламины крови на них, как правило, не действуют. Напротив, в большинстве кровеносных сосудов иннервируются почти исключительно адвентициальная оболочка и лишь внешние слои средней оболочки (расстояние между расширениями аксонов и гладкомышечными волокнами в нервно-мышечных соединениях сосудистой стенки составляет примерно 80 нм или более). На большую часть гладких мышц средней оболочки симпатические нервы оказывают непрямое влияние, опосредованное электротоническими воздействиями (рис. 16.6, А. Б). В результате такого неравномерного распределения иннервации на мускулатуру сосудов оказывают значительное влияние катехоламины, диффундирующие из крови в их стенки, так как эти катехоламины не инактивируются в результате поглощения их расширениями симпатических волокон.
На гладкие мышцы, прямая иннервация которых со стороны постганглионарных симпатических аксонов либо слабо выражена, либо отсутствует в связи с большим нервно-мышечным расстоянием, катехоламины крови оказывают более сильное действие. Примером могут служить гладкомышечные волокна крупных артерий эластического типа, циркулярных и продольных мышечных слоев кишечника и мускулатуры матки [2].
Гиперчувствительность вегетативных эффекторов после денервации. Органы, иннервируемые вегетативной системой, могут в какой-то мере атрофироваться в результате бездействия, но не подвергаются дегенерации при гибели снабжающих их нервов. Спустя 2-30 дней (для разных органов по-разному) после денервации или децентрализации (путем перерезки преганглионарных волокон) развивается гиперчувствительность органов к медиаторам вегетативной нервной системы и веществам медиаторного типа. Так, если разрушить симпатическую иннервацию зрачка животного путем удаления верхнего шейного ганглия, то сначала наблюдается сужение зрачка в результате преобладания парасимпатического тонуса (табл. 16.1). Через несколько недель зрачок вновь расширяется, причем степень его расширения увеличивается при эмоциональном возбуждении. Это явление связывают с гиперчувствительностью, или сенситизацией денервированной мышцы, расширяющей зрачок, к адреналину и норадреналину, выделяемым мозговым веществом надпочечников (см. с. 350). При эмоциональном возбуждении и испуге содержание этих веществ в крови повышается. После денервации гиперчувствительность обычно более выражена, чем после децентрализации.
Механизм денервационной гиперчувствительности до конца не ясен. Возможно, он связан с измене-
ниями электрофизиологических свойств мембран (уменьшением мембранного потенциала и порога возбуждения) и распределения кальция (увеличением кальциевой проницаемости мембран, повышением внутриклеточной концентрации кальция) в клетках денервированных органов. Все эти изменения вызваны отсутствием медиаторов, выделяемых обычно постганглионарными нейронами. Денервационную гиперчувствительность можно считать результатом адаптации чувствительности вегетативных эффекторов к уровню активности иннервирующих их постганглионарных нейронов. Если этот уровень постоянно понижен, то чувствительность эффектора повышается, и наоборот [1, 33].
Симпатические ганглии. Как уже указывалось, передача возбуждения от преганглионарных нейронов к постганглионарным в симпатических ганглиях осуществляется при помощи ацетилхолина (рис. 16.2). На каждом постганглионарном нейроне конвергирует множество преганглионарных аксонов, и, с другой стороны, ветви каждого преганглионарного аксона дивергируют к нескольким постганглионарным нейронам. Степень такой конвергенции и дивергенции чрезвычайно широко варьирует у животных разных видов и в разных симпатических ганглиях. Постганглионарных нейронов обычно значительно больше, чем преганглионарных аксонов. Так, в состав верхнего шейного ганглия человека входит 1 млн. постганглионарных нервных клеток, к которым подходит 10 тыс. преганглионарных волокон; таким образом, каждый преганглионарный аксон снабжает по меньшей мере 100 постганглионарных нейронов. Дивергенция и конвергенция обеспечивают высокую надежность проведения возбуждения в ганглиях. Большую роль играет пространственная и временная суммация постсинаптических потенциалов, так как одиночные импульсы, поступающие по преганглионарным волокнам, обычно не могут вызвать сверхпороговые постсинаптические потенциалы в постганглионарных нейронах. Кроме никотиноподобного эффекта, обеспечивающего передачу возбуждения в симпатическом ганглии, ацетилхолин и другие вещества, выделяемые пресинаптическими окончаниями, вызывают медленно нарастающие длительные деполяризующие и гиперполяризующие постсинаптические потенциалы. Эти медленные синоптические холинергические потенциалы связаны главным образом с мускариноподобным эффектом ацетилхолина (с. 347). Функциональное значение медленных постсинаптических потенциалов до сих пор неизвестно. Не исключено, что они участвуют в регуляции возбудимости постганглионарных нейронов, т.е. порога возникновения в них потенциалов действия. В этом случае симпатические ганглии следует считать простейшими интегративными центрами [9, 32].
ГЛАВА 16. ВЕГЕТАТИВНАЯ НЕРВНАЯ СИСТЕМА 353
Пресинаптическая регуляция выделения медиаторов. Медиаторы вегетативной нервной системы оказывают не только постсинаптическое действие на мембраны эффекторных клеток и (в вегетативных ганглиях) постганглионарные нейроны. Они влияют также на высвобождение медиаторов из самих пресинаптических окончаний. Эти пресинаптические эффекты медиаторов опосредованы адреиергическими и холинергическими рецепторами пресинаптических окончаний.
При действии норадреналина на пресинаптические α-адренорецепторы выделение медиатора падает, а при возбуждении пресинаптических ß-рецепторов возрастает (рис. 16.7). Возможно, в физиологических условиях значительное повышение концентрации норадреналина в синаптической щели при сильном возбуждении постганглионарных нейронов приводит к торможению выделения норадреналина вследствие активации пресинаптических α-рецепторов (по механизму отрицательной обратной связи).
Адреналин крови, выделяемый мозговым веществом надпочечников, может реагировать с пресинаптическими ß-рецепторами; при этом выброс норадреналина увеличивается (по механизму положительной обратной связи).
В органах, иннервируемых и симпатическими, и парасимпатическими волокнами (например, в сердце, мышцах бронхов и желудочно-кишечном тракте), может наблюдаться реципрокное торможение высвобождения медиаторов из адренергических и холинергических пресинаптических окончаний (рис.
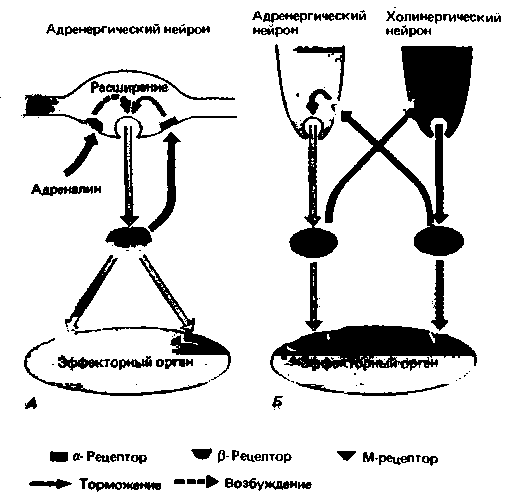 |
| Рис. 16.7. Пресинаптическая медиаторная регуляция высвобождения медиаторов. НА норадреналин, АХацетилхолин |
16.7, Б), обусловленное взаимодействием этих окончаний. Показано, что при одновременном возбуждении симпатических и парасимпатических сердечных нейронов выделение ацетилхолина последними уменьшается. Этот эффект опосредован а-адренорецепторами, расположенными на пресинаптических холинергических окончаниях (рис. 16.7, Б). Вместе с тем возбуждение парасимпатических сердечных нейронов приводит к снижению выделения норадреналина постганглионарными симпатическими нейронами. В осуществлении этого тормозного эффекта принимают участие мускариновые холинорецепторы (см. с. 347; рис. 16.7). Эти ингибиторные взаимодействия между холинергическими и адренергическими пресинаптическими окончаниями свидетельствуют о том, что антагонизм между двумя отделами вегетативной нервной системы может проявляться на уровне пресинаптических волокон [45, 52].
В фармакологических исследованиях было показано, что в периферическом отделе вегетативной нервной системе существуют пресинаптические и постсинаптические рецепторы, не относящиеся к холино- и адренорецепторам. Это рецепторы дофамина, опиатов, ангиотензина и других пептидов и простагландина Е. Возможно, что все эти рецепторы не играют какой-либо роли в физиологических условиях, хотя имеют большое значение для медикаментозной терапии. Все виды рецепторов, обнаруженные в вегетативной нервной системе, были также найдены в преи постсинаптических мембранах нейронов ЦНС. В последнем случае эти рецепторы имеют большое физиологическое значение для регуляции нервных процессов (см. с. 381), а также служат участками действия многих нейротропных вешеств.
Энтеральная нервная система
В состав желудочно-кишечного тракта входят самые разные эффекторные системы гладкомышечные и эпителиальные образования, кровеносные сосуды и эндокринные клетки (с. 740). За регуляцию и координацию всех этих структур отвечает энтеральная нервная система, парасимпатический и симпатический отделы вегетативной нервной системы и висцеральные афференты - спинальные и вагальные. Большинство простейших функций желудочнокишечного тракта не нарушается при разрыве экстраорганных (парасимпатических и симпатических) нервных путей. Клеточные тела большинства нейронов энтеральной нервной системы залегают в межмышечном (ауэрбаховом) и подслизистом (мейсснеровом) нервных сплетениях. К этой системе относятся афферентные нейроны (т.е. нейроны, дендриты которых обладают рецепторными свойствами), вставочные и двигательные нейроны. У человека в состав энтеральной нервной системы входит около 108 нейронов-примерно столько же, сколько их содержится в спинном мозгу. Это число
354 ЧАСТЬ IV. ПРОЦЕССЫ НЕРВНОЙ И ГУМОРАЛЬНОЙ РЕГУЛЯЦИИ
значительно превышает количество преганглионарных парасимпатических волокон блуждающих нервов (около 2000), иннервирующих внутрикишечные нервные клетки.
Общие принципы деятельности энтеральной нервной системы могут быть проиллюстрированы схемой, приведенной на рис. 16.8. В этой системе заложены сеисомоторные программы регуляции и координации эффекторных структур. Программы «записаны» в афферентных, вставочных (интер-) и мотонейронах, а также тормозных и возбуждающих связях между ними. Из подобных программ (на рис. 16.8 они изображены комбинацией из прямоугольника, круга и овала) складывается интегративная деятельность энтеральной нервной системы. ЦНС через экстраорганные эфферентные нервы может влиять на активность интрамуральных нейронных контуров, однако это влияние направлено в основном на модуляцию их автономной активности. Некоторые двигательные нейроны энтеральной нервной системы (особенно в стенках желудка и дистальных отделов толстого кишечника) служат одновременно постганглионарными парасимпатическими нейронами (см. рис. 16.9). Постганглионарные симпатические нейроны, не иннервирующие кровеносные сосуды, не оказывают прямого влияния на эффекторные клетки; исключение составляют лишь гладкомышечные сфинктеры (см. рис. 16.9). Информация о процессах, происходящих в желудочно-кишечном тракте, поступает в ЦНС по висцеральным афферентам, идущим к спинному и про-
долговатому мозгу. Кроме того, имеется и обратная афферентная связь к постганглионарным симпатическим нейронам превертебральных ганглиев (3-на рис. 16.9). В целом энтеральная нервная система функционирует подобно интеллектуальному компьютерному терминалу. В непосредственной близости от эффекторных органов располагаются рефлекторные контуры, отвечающие за постоянное приспособление деятельности эффекторных систем к условиям, создающимся в просвете кишечника. ЦНС же работает подобно центральному компьютеру, получая через висцеральные афференты информацию о функциональном состоянии желудочно-кишечного тракта и изменяя это состояние в соответствии с потребностями организма. Иными словами, ЦНС выполняет функции стратегического управления, при этом не столько непосредственно управляя отдельными мотонейронами, сколько модулируя программы, заложенные в нейронных контурах, и их выполнение энтеральной нервной системой. Прямое же влияние со стороны ЦНС должно быть более выражено в начальном и в конечном участках желудочно-кишечного тракта, где осуществляется управление процессами приема пищи и дефекации.
На основании электрофизиологических, фармакологических, биохимических, гистохимических и ультраструктурных критериев в энтеральной нервной системе были выделены более 10 различных типов нейронов. Интернейроны и мотонейроны оказывают на другие нервные или эффекторные клетки
 |
| Рис. 16.8. Эвристическая модель организации энтеральной нервной системы (по Wood. Am. J. Physiol., 247, G585 (1984)) |
ГЛАВА 16. ВЕГЕТАТИВНАЯ НЕРВНАЯ СИСТЕМА 355
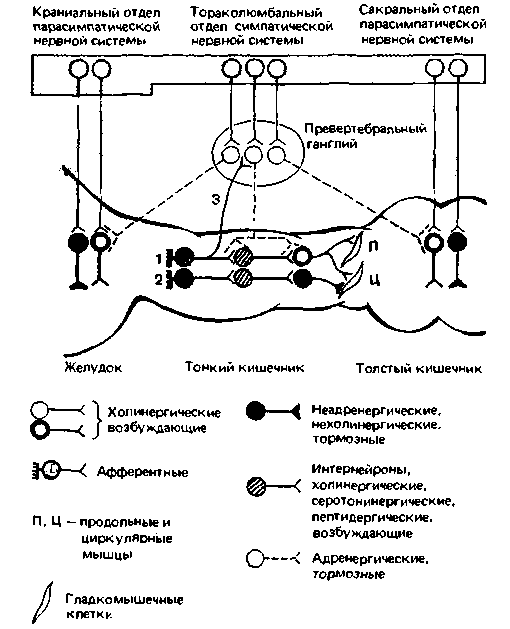 |
| Рис. 16.9. Организация энтеральной нервной системы и экстраорганных симпатических и парасимпатических путей, управляющих ее деятельностью. 1, 2 возбуждающие и тормозные пути, отвечающие за перистальтические рефлексы; 3 коллатерали афферентного нейрона, идущие к постганглионарным симпатическим нейронам в превертебральном ганглии (по Burnstock. Pharmacol. Rev., 24, 509 (1972) и Holman в [1] с изменениями) |
как возбуждающее, так и тормозное действие. В интрамуральных нейронах кишечника обнаружены кроме ацетилхолина около 10 различных веществ (типа серотонина, АТФ и нейропептидов), которые могут играть роль нейромедиаторов или нейромодуляторов либо выполнять паракринные функции. О строении рефлекторных дуг, отвечающих за регуляцию отдельных функций желудочно-кишечного тракта (например, перистальтики, сегментации, маятникообразных движений, местного кровотока), известно мало. Нейронный контур, управляющий пропульсивной перистальтикой, возможно, состоит из двух рефлекторных дуг-тормозной (2-на рис. 16.9) и возбуждающей (1 на рис. 16.9), расположенных в стенке кишечника в орально-анальном направлении. Первичная реакция на растяжение стенки кишечника - это рефлекторное торможение круговой мускулатуры (на рис. 16.9-дуга 2), приводящее к расслаблению кишечной стенки. Затем возникает рефлекторное возбуждение круговой и про-
дольной мускулатуры (дуга 1), проявляющееся в нисходящем сокращении кишечника. По своей медиаторной природе тормозные нейроны не являются ни холинергическими, ни адренергическими; возможно, они выделяют АТФ или какой-либо нейропептид (например, ВИП; см. с. 54). Афферентные нейроны, по-видимому, пептидергические. Некоторые возбуждающие нейроны выделяют ацетилхолин; определенную роль в качестве медиаторов играют и другие вещества, например серотонин и соматостатин.
Симпатические постганглионарные (адренергические) волокна, иннервирующие кишечник, непосредственно влияют на его резистивные и емкостные сосуды, а также на гладкомышечные сфинктеры (например, внутренний сфинктер заднего прохода). В то же время они оказывают довольно слабый эффект на гладкую мускулатуру, не относящуюся к сфинктерам. Эти волокна ингибируют высвобождение медиаторов из пресинаптических окончаний преганглионарных парасимпатических аксонов (с. 352) и, возможно, других аксонов. В превертебральных симпатических ганглиях на постганглионарных симпатических нейронах переключаются не только преганглионарные волокна; к ним через холинергические синапсы поступают сигналы от афферентных нейронов, тела которых расположены в стенке кишечника (3-на рис. 16.9). Кроме того, они могут образовывать пептидергические синапсы с коллатералями первичных афферентных нейронов, тела которых залегают в спинномозговых узлах.
Парасимпатические преганглионарные аксоны переключаются в энтеральной нервной системе не только на мотонейронах, возбуждающих гладкие мышцы кишечника, но также на тормозных мотонейронах (рис. 16.9). Такое центральное торможение более выражено в области орального и анального концов пищеварительного тракта. Возможно, оно играет важную роль в рефлекторном расслаблении желудка после приема пищи и в регуляции сдерживания каловых масс в прямой кишке [1, 26, 36. 53].
