Н. Н. Алипова, канд биол наук О. В. Левашова и канд биол наук М. С. Морозовой под редакцией акад. П. Г. Костюка москва «мир» 1996 ббк 28. 903 Ф50
| Вид материала | Документы |
- Приглашение и программа разнообразие почв и биоты северной и центральной азии, 521.14kb.
- М. А. Ляшко доц., канд физ мат наук; Т. Н. Смотрова доц., канд, 2299.13kb.
- Современные направления развития физической культуры, спорта и туризма, 4493.6kb.
- Отчет о проведении Международной научной конференции-семинара «Современные методы психологии», 97.76kb.
- Образовательная программа дошкольного образования Москва «Просвещение», 5670.3kb.
- Пособие для врачей и среднего медицинского персонала Минск, 5480.63kb.
- Ббк 63. 3(0) Н72, 4378.93kb.
- Тезисы докладов, 4290.75kb.
- Строительные нормы и правила нагрузки и воздействия сниП 01. 07-85* министерство строительства, 1162.86kb.
- Ббк 63. 3(0) Н72, 5546.58kb.
17.6. Гормоны поджелудочной железы
Гормоны, участвующие в поддержании постоянного уровня сахара в крови,- инсулин, глюкагон и соматостатин - секретируются островками Лангерганса в поджелудочной железе. Эти структуры представляют собой скопления эндокринных клеток, так называемых альфа-, бета- и дельта-клеток, разбросанных в виде групп по несколько тысяч клеток среди экзокринной ткани, составляющей основную массу поджелудочной железы. Около 60% островковых клеток приходится на бета-клетки, вырабатывающие инсулин, 25% - на альфа-клетки, секретирующие глюкагон, и остальные 15% - на дельта-клетки, выделяющие соматостатин. Регуляторные эффекты, определяющие секрецию перечисленных гормонов и зависящие от питательных веществ и паракринных влияний, схематически изображены на рис. 17.19. Для нормального функционирования островковых клеток необходим нормальный уровень тиреоидных и половых гормонов, а также кортикостероидов.
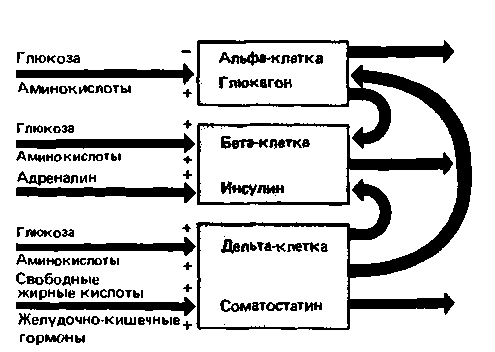 |
| Рис. 17.19. Регуляция активности островковых клеток. Продуктами секреции клеток островков Лангерганса являются глюкагон, инсулин и соматостатин, секретируемые альфа-, бета- и дельта-клетками соответственно. Секреция инсулина стимулируется высокой концентрацией в крови глюкозы и аминокислот и угнетается адреналином. Секреторная активность альфа-клеток, вырабатывающих глюкагон, подавляется высокой концентрацией глюкозы в крови и стимулируется ее падением; аминокислоты оказывают противоположное действие. Секретируемый альфа-клетками глюкагон, действуя паракринным путем, угнетает секрецию инсулина бета-клеткам и. Секреция соматостатина дельта-клетками стимулируется высоким уровнем глюкозы, аминокислот и жирных кислот, а также гормонами желудочно-кишечного тракта. Паракринным путем соматостатин угнетает секрецию инсулина бета-клетками |
406 ЧАСТЬ IV. ПРОЦЕССЫ НЕРВНОЙ И ГУМОРАЛЬНОЙ РЕГУЛЯЦИИ
Инсулин
Химическое строение и действие на уровень сахара в крови. Инсулин, образующийся в бета-клетках поджелудочной железы, представляет собой полипептид, состоящий из двух пептидных цепей. А-цепъ, состоящая из 21 аминокислотного остатка, соединена дисульфидным мостиком с B-цепью, состоящей из 30 аминокислотных остатков. Инсулины животных разных видов лишь слегка различаются по аминокислотной последовательности и обладают одинаковым биологическим действием.
Суммарный результат различных метаболических эффектов инсулина сводится к понижению концентрации глюкозы в крови, составляющей в норме 0,8-1,0 г/л. При повышении уровня сахара в крови после приема углеводов происходит выброс инсулина. Под влиянием инсулина увеличивается поглощение глюкозы почти всеми клетками тела, и ее концентрация в крови опять снижается (рис. 17.20).
Действие на обмен глюкозы в печени. Печень это один из наиболее важных органов тела, запасающих глюкозу. Глюкоза может свободно диффундировать в клетки печени и выходить из них, когда ее содержание в крови снижается. В клетках печени глюкоза под влиянием инсулина превращается в гликоген, и ее содержание в крови снижается. Один из главных биохимических эффектов инсулина состоит в активации фермента глюкокиназы, катализирующей фосфорилирование глюкозы, которая поступает в клетки печени. Инсулин активирует и другие ферменты, в том числе фосфофруктокиназу и гликогенсинтетазу, катализирующую полимеризацию фосфорилированной глюкозы с образованием гликогена. Наконец, инсулин ингибирует ферменты, расщепляющие гликоген (фосфорилазы), бла-
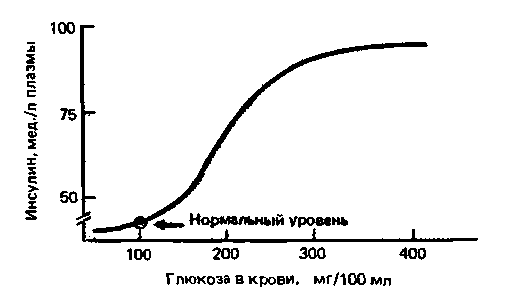 |
| Рис. 17.20. Зависимость концентрации инсулина в крови от содержания в ней глюкозы. При нормальной концентрации глюкозы (около 100 мг/100 мл) инсулин в плазме практически не определяется, но при повышении уровня сахара в крови в физиологических условиях концентрация инсулина резко возрастает |
годаря чему высокий уровень инсулина способствует консервации гликогена. За счет быстрого синтеза гликогена и подавления гликогенолиза концентрация глюкозы в крови, повышающаяся после приема пищи, быстро возвращается к нормальному уровню. В результате удаляется основной стимул секреции инсулина, и содержание последнего в крови также нормализуется.
Когда организму требуется энергия в промежутках между приемами пищи, гликоген опять превращается в глюкозу. Концентрация инсулина в крови в этот период очень мала, поэтому фосфорилаза находится в активном состоянии и превращает гликоген в глюкозофосфат, который дефосфорилируется глюкозофосфатазой. Образующаяся при этом глюкоза может свободно выходить из клетки путем диффузии. Таким образом поддерживается постоянный уровень глюкозы в крови между приемами пищи. При нормальном питании около 60% глюкозы, потребляемой человеком с пищей, временно запасается в печени, с тем чтобы затем быстро высвобождаться за счет расщепления гликогена [3, 5, 6, 11].
Действие на обмен глюкозы в мышечных клетках.
При низком содержании инсулина в крови мышечные клетки в норме непроницаемы для глюкозы и всю необходимую энергию получают за счет окисления жирных кислот. Увеличение концентрации инсулина, вызванное повышением уровня глюкозы в крови после приема пищи, делает мышечные клетки проницаемыми для глюкозы, которая используется затем в качестве источника энергии. Однако при очень высокой мышечной активности мембраны клеток становятся проницаемыми для глюкозы и в отсутствие инсулина. В этом случае потребность работающей мышцы в глюкозе как энергетическом субстрате удовлетворяется даже при базальном уровне инсулина. Детально этот механизм еще не изучен. Когда мышца находится в неактивном состоянии, в ней сразу после приема пищи, т. е. при высоких концентрациях инсулина и глюкозы, тоже образуется и сохраняется небольшое количество гликогена. При острой необходимости этот гликоген опять превращается в глюкозу, которая используется мышечными клетками (с. 84 и 698). Как правило, глюкоза не выделяется обратно в кровь и не играет никакой роли в регуляции уровня сахара в крови после приема пищи.
Связываясь с рецептором на поверхности мышечных клеток, инсулин активирует механизм транспорта глюкозы через мембрану. Пока неизвестно, служит ли белком-переносчиком сам инсулин-рецепторный комплекс или он активирует другую транспортную систему.
ГЛАВА 17. ЭНДОКРИНОЛОГИЯ 407
Обмен глюкозы в нервных клетках. Клетки центральной нервной системы свою довольно высокую потребность в энергии почти целиком покрывают за счет глюкозы, причем ее потребление не зависит от инсулина. Он не влияет на проницаемость мембран для глюкозы и не активирует ферментные системы этих клеток. Тот факт, что центральная нервная система получает необходимую ей энергию только за счет окисления глюкозы, позволяет понять, почему снижение концентрации последней в крови ниже критического уровня (0,5-0,2 г/л) может привести к гипогликемическому шоку с помутнением сознания или даже комой. Большинство других клеток тела отвечает на инсулин подобно мышечным клеткам.
Действие на жировой обмен. Печень может запасать под действием инсулина лишь ограниченное количество гликогена. Излишки поступившей в печень глюкозы подвергаются фосфорилированию и таким путем удерживаются в клетке, но затем превращаются не в гликоген, а в жир. Это превращение в жир также является результатом прямого действия инсулина, а образующиеся при этом жирные кислоты транспортируются кровью в жировую ткань, где они поглощаются клетками, в которых и хранятся. В крови жиры находятся в составе липопротеинов, играющих важную роль в развитии атеросклероза и связанного с ним риска эмболии и инфаркта.
Действие инсулина на клетки жировой ткани в принципе сходно с его действием на клетки печени, однако в печени образование жирных кислот идет более интенсивно, поэтому они переносятся из нее в жировую ткань описанным выше путем. В клетках жирные кислоты хранятся в форме триглицеридов. Еще одно очень важное воздействие инсулина на жировые клетки состоит в обеспечении их глицеролом, необходимым для синтеза триглиперидов. Каждая молекула глицерола может этерифицироваться тремя молекулами жирных кислот.
Описанное выше влияние инсулина на жировой обмен обратимо, и при низкой его концентрации триглицериды опять расщепляются на глицерол и свободные жирные кислоты. Связано это с тем, что инсулин ингибирует чувствительную к гормонам липазу и при снижении его концентрации липолиз активируется. Свободные жирные кислоты, образующиеся при гидролизе триглицеридов, поступают одновременно с глицеролом в кровь и используются в качестве источника энергии в других тканях. Окисление свободных жирных кислот возможно во всех клетках тела, кроме нервных. Большая часть жирных кислот, освобождающихся при недостатке инсулина из жировых депо, опять поглощается печенью. Клетки печени способны синтезировать три-
глицериды даже в отсутствие инсулина, поэтому при его недостатке освобождающиеся из депо жирные кислоты накапливаются в печени в виде триглицеридов. Именно по этой причине у больных с дефицитом инсулина, т.е. при сахарном диабете, несмотря на общее похудание, развивается ожирение печени.
Высокое содержание в печени жирных кислот приводит к образованию активированной уксусной кислоты {ацетил-КоА). Поскольку печень не может использовать весь ацетил-КоА в качестве источника энергии, он превращается в ацетоуксусную кислоту, которая выделяется в кровь. При достаточно высокой концентрации инсулина периферические клетки способны превращать ацетоуксусную кислоту опять в ацетил-КоА, который служит им источником энергии. Но в отсутствие инсулина этого превращения не происходит, и некоторая часть ацетоуксусной кислоты превращается в ß-гидроксимасляную кислоту и ацетон. Эти три метаболита называются кетоновыми телами, а возникающее при этом нарушение обмена - кетозом. Вследствие кетоза у больного в состоянии диабетической комы выдыхаемый воздух пахнет ацетоном, а анализ крови выявляет метаболический ацидоз.
Действие на белковый обмен. Получаемые с пищей белки расщепляются до аминокислот, которые служат затем субстратом для синтеза собственных белков тела. Этот процесс протекает оптимально только при условии действия инсулина. Инсулин обеспечивает активный транспорт в клетки многих, хотя и не всех, аминокислот. Сходным действием обладает гормон роста, но он активирует поглощение других групп аминокислот. Повышение концентрации аминокислот в клетках после приема пищи приводит к стимуляции синтеза белка на рибосомах. Инсулин стимулирует синтез белка и косвенным путем, повышая скорость транскрипции ДНК в ядре и тем самым образование РНК. В сумме все эти эффекты инсулина способствуют синтезу белка. Соответственно отсутствие инсулина дает противоположный эффект и приводит к истощению белковых ресурсов организма. В этом случае аминокислоты используются либо непосредственно в качестве энергетического субстрата, либо в процессе глюконеогенеза. Поскольку для синтеза белка инсулин имеет почти такое же важное значение, как гормон роста, ребенок может нормально расти только при оптимальном соотношении обоих гормонов.
Глюкагон
Глюкагон, образующийся в альфа-клетках островков Лангерганса, подобно инсулину представляет собой полипептид. Он состоит из 29 ами-
408 ЧАСТЬ IV. ПРОЦЕССЫ НЕРВНОЙ И ГУМОРАЛЬНОЙ РЕГУЛЯЦИИ
 |
| Рис. 17.21. Зависимость содержания глюкагона в крови от концентрации в ней сахара. В нормальных условиях и при гипергликемии концентрация глюкагона в крови находится на низком уровне, но при гипогликемии значительно возрастает |
нокислотных остатков. По своим функциям глюкагон является антагонистом инсулина. Он стимулирует расщепление гликогена в печени (гликогенолиз), обеспечивая таким образом быстрое повышение концентрации глюкозы в крови при чрезмерном ее падении (гипогликемии) (рис. 17.21).
Образуя комплекс с рецептором, расположенным на поверхности плазматической мембраны, глюкагон активирует аденилатциклазу, которая превращает АТФ в цАМФ. цАМФ служит вторым, внутриклеточным посредником глюкагона, стимулируя каскад биохимических реакций, приводящих к расщеплению гликогена. Основной органмишень глюкагона - это печень, главное депо гликогена. При хронической гипогликемии продолжительное воздействие глюкагона может привести к истощению запасов гликогена в печени, но глюконеогенез в ней тем не менее будет продолжаться. Причина последнего эффекта заключается в том, что под действием глюкагона клетки печени более активно поглощают аминокислоты из крови, и эти аминокислоты используются для синтеза глюкозы.
Соматостатин
Соматостатин - это пептид, состоящий из 14 аминокислотных остатков. Впервые он был обнаружен в гипоталамусе. Образующийся здесь соматостатин угнетает синтез в гипофизе гормона роста (с. 395), чем и обусловлено его название. Впоследствии соматостатин был найден во многих тканях, где он преимущественно выполняет роль ингибитора. В островках Лангерганса он образуется в дельта-клетках и, действуя паракринным путем, угнетает секрецию инсулина и глюкагона. Кроме того, он угнетает перистальтику желудочно-кишечного тракта и желчного пузыря и уменьшает секрецию пищеварительных соков, вследствие чего замедляется вса-
сывание пищи. Таким образом, действие соматостатина направлено в целом на подавление пищеварительной активности и, следовательно, на предотвращение слишком больших колебаний уровня сахара в крови.
Регуляция уровня глюкозы
Повышенное содержание глюкозы в кровиэто наиболее сильный стимул для секреции инсулина бета-клетками. При нормальной концентрации глюкозы преобладает базальная скорость секреции инсулина, а при концентрации глюкозы ниже 0,9 г/л инсулин в крови не обнаруживается. После приема через рот 100 г глюкозы ее концентрация в крови быстро возрастает, что вызывает резкий выброс инсулина. Последующее падение уровня глюкозы и инсулина характеризуется четкой динамикой (рис. 17.22). При недостатке инсулина снижение концентрации глюкозы в крови замедлено. Такие
 |
| Рис. 17.22. Проба на толерантность к глюкозе. В норме концентрация глюкозы в крови составляет около 100 мг/100 мл плазмы, а содержание инсулина находится при этом на базальном уровне. После приема раствора, содержащего 100 г глюкозы, уровень глюкозы в крови резко возрастает. В ответ на сахарную нагрузку с некоторым запозданием повышается содержание инсулина |
ГЛАВА 17. ЭНДОКРИНОЛОГИЯ 409
пробы на толерантность к глюкозе позволяют получить информацию о способности бета-клеток регулировать уровень сахара в крови. Недавно было показано, что аминокислоты и свободные жирные кислоты тоже стимулируют секрецию инсулина, хотя и менее эффективно, чем глюкоза. Следует сказать, что бета-клетки могут активироваться не только этими компонентами пищи, но и определенными пептидными гормонами желудочно-кишечного тракта, а также парасимпатической нервной системой. Этим эффектам противодействует активность симпатической нервной системы, угнетающей секрецию инсулина при участии ß-адренергических рецепторов. В этом противодействии парасимпатической и симпатической систем заключен определенный смысл. В состоянии покоя преобладает действие парасимпатической системы, что способствует перевариванию пищи. При стрессе необходима энергия; следовательно, глюкоза не должна превращаться в гликоген. При этом важное значение имеет тот факт, что катехоламины угнетают секрецию инсулина: это способствует непосредственному использованию глюкозы в качестве источника энергии.
Секреция глюкагона альфа-клетками регулируется прямо противоположным образом. Она сильно повышается при гипогликемии, что вполне закономерно, поскольку гликоген служит источником глюкозы и его расщепление противодействует гипогликемии.
Секреция соматостатина островковыми дельта-клетками возрастает при высоких концентрациях глюкозы, аминокислот и жирных кислот в крови. Таким образом, - соматостатин тормозит секрецию инсулина, предотвращая его перепроизводство при гипергликемии.
Патофизиологические аспекты
Детальное обсуждение патофизиологических аспектов регуляции секреции инсулина выходит за рамки настоящего раздела, но основные нарушения следует кратко рассмотреть. Если инсулина вырабатывается слишком мало или он не может действовать на клетки-мишени, устанавливается высокий уровень сахара в крови, и развивается сахарный диабет. Название этого заболевания связано с тем, что моча становится сладкой на вкус, поскольку часть избыточного сахара крови выводится с мочой. При большом дефиците инсулина вся неиспользованная глюкоза уже не может выводиться с мочой. Кроме того, недостаток инсулина приводит к стимуляции липолиза, вследствие чего образуются кетоновые тела (с. 407). Если заболевание прогрессирует, у больного может наступить диабетическая кома. Если же секретируется слишком много инсулина (например, при опухоли островковых клеток) или по назначению врача вводится слишком большая доза инсулина, уровень глюкозы в крови падает, и наступает гипогликемический шок. Оба состояния могут привести к смерти, если вовремя не будет введена глюкоза (при гипогликемическом шоке) или инсулин (при диабетической коме).
17.7. Гомеостаз баланса кальция и фосфата
Гомеостаз ионов Са2+ поддерживается за счет очень тонкой регуляции, осуществляемой главным образом тремя следующими гормонами: паратгормоном, который состоит из 84 аминокислотных остатков и вырабатывается двумя парами паращитовидных желез (эпителиальных тел); кальцитонином (тиреокальцитонином), состоящим из 32 аминокислотных остатков и образующимся в С-клетках, разбросанных в ткани щитовидной железы, а также (витамин D)-гормоном, образующимся в почках из витамина D.
Действие этих трех гормонов схематичски изображено на рис. 17.23 и кратко описано в подписи к нему.
Гормональная регуляция
Паратгормон (паратиреоидный гормон, ПТГ).
Физиологическим стимулом секреции паратгормона служит понижение концентрации ионов Ca2 + в крови [21, 35]. Паратгормон действует на кости и активирует остеокласты, которые вызывают резорбцию костей и высвобождение кальция и фосфата в кровь. Одновременно паратгормон стимулирует выделение фосфата почками, препятствуя тем самым связыванию с ним кальция. Кроме того, паратгормон акта-
 |
| Рис. 17.23. Регуляция гомеостаза кальция паратгормоном, кальцитонином и (витамин D)-гормоном. Низкое содержание ионое кальция в крови стимулирует секрецию паратиреоидного гормона, вызывающего остеолизис. и одновременно способствует образованию в почках (витамин D)-гормона, усиливающего всасывание ионов кальция в кишечнике. Высокие концентрации кальция вызывают высвобождение кальцитонина, который подавляет остеолизис и всасывание кальция в кишечнике. Гормоны желудочно-кишечного тракта стимулируют секрецию кальцитонина |
410 ЧАСТЬ IV. ПРОЦЕССЫ НЕРВНОЙ И ГУМОРАЛЬНОЙ РЕГУЛЯЦИИ
вирует в почках фермент, катализирующий превращение 25-гидроксикальциферола [25(ОН)-витамин D3] в 1,25-дигидроксикальциферол, или (витамин D3)-гормон. Этот гормон обладает более высокой биологической активностью и играет важную роль в регуляции равновесия кальция (см. ниже). Задержке кальция в организме способствует также прямое действие паратгормона на почки, в результате которого уменьшается экскреция ионов Ca2 + . Повышение концентрации ионов Са2+ в крови приводит к уменьшению секреции паратгормона.
Калльцитонин. При повышении концентрации кальция в крови секреция кальцитонина С-клетками щитовидной железы всегда возрастает [15, 35], вследствие чего уменьшается резорбция костей и повышается содержание в них кальция. Иными словами, кальцитонин действует как антагонист паратгормона. Другим физиологическим стимулом для секреции кальцитонина служит прием пищи и связанное с ним повышение содержания в крови желудочно-кишечных гормонов гастрина, холецистокинина (панкреозимина) и глюкагона, стимулирующих С-клетки (см. также [7]). В результате повышенного выделения кальцитонина поступивший с пищей кальций быстро откладывается в костях. Одновременно кальцитонин угнетает процесс пищеварения, замедляя опорожнение желудка и секрецию желудочного и панкреатического соков. Благодаря этому действию всасывание кальция происходит более равномерно, и после приема пищи не возникает резкого увеличения его концентрации в крови. Этот эффект имеет важное значение, так как иначе сильное повышение концентрации кальция подавляло бы секрецию паратгормона и кальций не задерживался бы в почках, а терялся с мочой сразу после его поступления в организм. Таким образом, замедление пищеварения кальцитонином в сочетании с действием паратгормона способствует запасанию кальция.
(Витамин D)-гормон. Третьим важным фактором, участвующим в поддержании постоянного уровня кальция в крови, служит гормон, образующийся из витамина D [13]. Витаминами называют вещества, которые в организме не образуются. В случае витамина D с пищей должны поступать предшественники провитамина D-эргостерол (препровитамин D3) или дегидроксихолестерол (препровитамин D2), имеющие соответственно растительное и животное происхождение. При воздействии на кожу солнечных лучей в молекулах этих предшественников разрывается связь между двумя углеродными атомами и образуются провитамины D2 и D3. Последние подвергаются в печени гидроксилированию в 25-м положении с образованием 25-гидроксикалышферола. Попадая в почки, это соединение подвергается
еще одному гидроксилированию, теперь в 1-м положении (как уже отмечалось, фермент, катализирующий эту реакцию, активируется паратгормоном). Образующийся при этом 1,25-дигидроксикальциферол и представляет собой (витамин D)-гормон, который обладает биологической активностью и участвует в поддержании гомеостаза кальция в крови. Таким образом, поступающий с пищей витамин D-это на самом деле прогормон. При сильном снижении концентрации в крови ионов Са2 + увеличивается секреция паратгормона. Он стимулирует синтез (витамин 0)-гормона, а последний способствует всасыванию ионов Cα2 + в эпителии кишечника. По механизму отрицательной обратной связи (витамин D)-гормон угнетает секрецию паратгормона. Таким образом, эти два гормона образуют замкнутую регуляторную систему.
Патофизиология гомеостаза кальция
Первичный гиперпаратиреоз. Существует крайне редкое заболевание, при котором образуются аденомы паращитовидных желез. Оно сопровождается избыточной секрецией паратгормона, приводящей к резорбции костей и гиперкальциемии. Наиболее резко при этом заболевании выражены почечные симптомы-полиурия и полидипсия. Кроме того, у больных нередко развиваются такие неврологические симптомы, как астения, ослабление рефлексов и неспецифические изменения ЭЭГ.
Вторичный гиперпаратиреоз. При хронической почечной недостаточности нарушается образование (витамин D)-гормона, поэтому кальций плохо всасывается в кишечнике. В результате хронической гипокальциемии постоянно секретируется паратгормон, что приводит к декальцификации костей разной степени тяжести - от слабых остеопатических изменений до сильного повреждения скелета.
Гипопаратиреоз. Случаи гипопаратиреоза встречаются значительно реже. Прежде наиболее частой причиной нарушения считалось удаление паращитовидных желез во время тиреоидэктомии, однако в последнее время гипопаратиреоз чаще всего развивается в результате аутоиммунных заболеваний. Характерными клиническими симптомами заболевания являются гипокальциемия и гиперфосфатемия, которые приводят к повышенной мышечной возбудимости. Типичное проявление гипокалыщемических спазмов (тетании) -сильное сгибание рук в запястье. У детей иногда развивается спазм гортани, при котором сокращение голосовых связок может привести к смерти от удушья.
Нарушение секреции кальцитонина. Возможны ситуации, когда С-клетки щитовидной железы вырабатывают слишком много или слишком мало кальцитонина. Избыточное образование кальцитонина может быть связано со злокачественным перерождением С-клеток. В этом случае остеолизис подавляется, но концентрация ионов Са2+ в крови не снижается. Однако развивающаяся гиперкальциемия практически не имеет каких-либо клинических проявлений. Диагноз заболевания может быть надежно поставлен только путем определения кальцито-
ГЛАВА 17. ЭНДОКРИНОЛОГИЯ 411
нина в крови радиоиммунологическим методом. Чрезвычайно редко встречаются эктопические опухоли, секретирующие кальцитонин.
Дефицит (витамин D)-гормона. При дефиците (витамин D)-гормона развиваются признаки рахита. Поскольку всасывание кальция в кишечнике нарушено, кости становятся недостаточно кальцифицированными, а концентрация кальция в крови сильно понижается. Из-за низкой концентрации в крови кальция повышается секреция паратгормона, который должен стимулировать образование (витамин D)-гормона в почках. В связи с тем что предшественники (витамин (D)-гормона могут поступать лишь с пищей, одной из причин дефицита (витамин D)-гормона служит недостаток их в продуктах питания. Однако рахит может также развиться вследствие заболевания почек или генетических нарушений.
17.8. Гормоны мозгового слоя надпочечников
Катехоламины
Распространение. Катехоламины синтезируются из аминокислоты тирозина. Один из них - норадреналин - продуцируют в качестве нейромедиатора постсинаптические нейроны симпатической нервной системы; пресинаптическим медиатором в данной цепи передачи служит ацетилхолин (см. ниже). Мозговой слой надпочечников содержит клетки, которые в процессе эмбриогенеза мигрировали из нервных складок. Несмотря на такое происхождение, эти клетки дифференцируются не в нейроны, а в клетки, лишенные дендритов и аксонов. Они вырабатывают норадреналин или адреналин и, подобно симпатической нервной системе, иннервируются холинергическими волокнами. В центральной нервной системе также присутствуют и норадренергические, и адренергические нейроны. Все эти три адренергические/норадренергические системы часто функционируют синергично.
Действие при стрессе. В состоянии покоя клетки мозгового слоя надпочечников постоянно секретируют небольшие количества адреналина и, вероятно, норадреналина. Однако большая часть норадреналина, присутствующего в крови, выделяется терминалами симпатических нейронов. Под влиянием внешнего или внутреннего стрессового фактора, например в ситуациях, требующих большого физического или умственного напряжения, а также при инфекции, травме или гипокликемии, резко повышаются секреция адреналина и норадреналина клетками мозгового слоя надпочечников и выделение их симпатической нервной системой. Во время стресса эти гормоны выполняют важную регуляторную роль. Они усиливают сердечную деятельность (с. 351), вызывают сужение сосудов внутренних органов и расширение сосудов, снабжающих
мышцы. Кроме того, они угнетают перистальтику желудочно-кишечного тракта и вызывают расширение бронхов. Сосудистые эффекты приводят к соответствующему изменению физиологического состояния организма. Когда человек или животное находится в опасности, продолжение переваривания пищи становится необязательным и активность пищеварительных процессов может быть уменьшена. В то же время для борьбы или бегства мышцам нужны кислород и глюкоза, поэтому требуется расширение бронхов и сосудов, снабжающих кровью мышцы.
Метаболические эффекты. Катехоламины оказывают метаболические эффекты, обеспечивающие снабжение организма энергией, когда возникает необходимость борьбы или бегства [6]. Основным источником энергии в организме служит глюкоза, поэтому катехоламины индуцируют расщепление гликогена в печени и мышцах, а также способствуют глюконеогенезу в печени, причем в основном эти эффекты вызывает адреналин. Оба катехоламина стимулируют также липолиз в жировой ткани и протеолиз в печени, обеспечивая таким путем восполнение энергетического материала. Эти метаболические эффекты катехоламинов имеют также важное значение для предотвращения гипогликемии. При быстром падении уровня сахара в крови секреция катехоламинов мозговым слоем надпочечников резко повышается, и они ликвидируют гипогликемию, действуя синергично с глюкагоном. Кроме того, оба катехоламина угнетают секрецию инсулина островковыми клетками, благодаря чему тормозятся все инсулин-зависимые процессы. Этот же эффект служит для поддержания повышенной концентрации глюкозы в экстремальных ситуациях.
Рецепторные системы. Существуют по меньшей мере два типа рецепторов адреналина и норадреналина - а- и ß-рецепторы [6]. Каждый из этих типов может быть далее подразделен по сродству к фармакологическим препаратам на а1-, а2-, ß1- и ß2-рецепторы. Такое разнообразие видов рецепторов объясняет высокую специфичность действия катехоламинов на определенные органы. Так, например, сужение сосудов в брюшной полости опосредовано α-рецепторами, тогда как метаболические эффекты и расширение сосудов, снабжающих мышцы,- ß-рецепторами. Угнетение секреции инсулина происходит с участием α-рецепторов, а липолитическое действие и влияние на сердечную мышцу-с участием ß-рецепторов. Действие катехоламинов, опосредуемое ß-рецепторами, связано с активацией аденилатциклазы и образованием цАМФ - второго внутриклеточного посредника. Существование различных типов рецепторов имеет важное значение для клиники, так как многие ве-
412 ЧАСТЬ IV. ПРОЦЕССЫ НЕРВНОЙ И ГУМОРАЛЬНОЙ РЕГУЛЯЦИИ
щества, блокирующие эти рецепторы, используются для лечения сердечно-сосудистых заболеваний и нарушений кровоснабжения органов.
Пептиды мозгового слоя надпочечников. Недавно было показано, что помимо адреналина и норадреналина клетки мозгового слоя надпочечников вырабатывают пептиды, выполняющие регуляторную функцию в центральной нервной системе и желудочно-кишечном тракте. Из этих пептидов к настоящему времени идентифицированы вещество Р, интестинальный вазоактивный полипептид, соматостатин, ß-энкефалин и вещества, подобные холецистокинину. Катехоламины секретируются клетками двух типов, но каждый из них может быть далее подразделен на подтипы в зависимости от содержащихся в них пептидов. Существует ли раздельная регуляция для этих подтипов клеток, пока неизвестно.
17.9. Дополнительные эндокринные системы
Пинеальное тело (эпифнз). Эпифиз представляет собой вырост крыши третьего желудочка мозга. Он выполняет у животных множество функций. У филогенетически более древних видов эпифиз обладает светочувствительностью и опосредует влияние света на половые и циркадианные ритмы. У млекопитающих прямое воздействие света имеет, вероятно, второстепенное значение, но его нельзя не учитывать, так как фотоны могут, по-видимому, проникать в железу даже через кожу и череп. У млекопитающих эпифиз тоже участвует в регуляции циркадианных ритмов [37]. Свет воспринимается сетчаткой, и эта информация передается по нервным путям непосредственно в гипоталамус (ретиногипоталамический тракт). Из гипоталамуса сигналы передаются через цепь нейронов в шейный отдел симпатической нервной цепочки и переключаются на восходящие симпатические волокна, которые проходят через верхний шейный ганглий внутрь черепа и в конечном счете иннервируют эпифиз. Нейромедиатором в данном случае, как и во всех остальных структурах с симпатической иннервацией, служит норадреналин. Таким сложным путем клетки эпифиза получают информацию о ритмичном чередовании света и темноты. Наиболее важный продукт секреции эпифиза -мелатонин. Синтез и высвобождение мелатонина уменьшаются на свету и увеличиваются в темноте. Эти четко выраженные суточные колебания можно выявить при определении концентрации мелатонина в крови здоровых людей. У животных многие функции мелатонина связаны с размножением, но у человека существование такой связи пока не установлено.
Тимус. Этот расположенный за грудиной орган вырабатывает ряд пептидов. Считается, что эти пептиды участвуют в механизмах иммунологической защиты, но детально этот вопрос не изучен.
Почки. Выше уже отмечалось, что почки являются эндокринным органом, поскольку они секретируют ренин и (витамин D )-гормон. (с. 787 и 410). В главе, посвящен-
ной функциям крови (с. 424), рассматривается образование в почках эритропоэтина и его роль в эритропоэзе.
Тканевые гормоны. В начале настоящей главы отмечались трудности, связанные с разграничением между гормонами эндокринных желез и веществами, образующимися в разных тканях и обладающими гормоноподобным действием на соседние клетки той же ткани (с. 386). В эту группу веществ, обладающих паракринным действием, входят, как теперь считают, главным образом простагландины, простациклины и тромбоксаны. Они играют важную роль в различных функциях организма и усиливают или угнетают действие других гормонов. Более подробные сведения имеются в учебниках биохимии.
Можно не сомневаться, что кроме обсуждавшихся существует целый ряд других, еще не открытых гормонов. Судя по имеющимся данным, во многих органах, вероятно, существуют структуры, вырабатывающие гормоны. Так, например, недавно было установлено, что сердце является эндокринным органом, поскольку в нем образуется пептид, стимулирующий выведение натрия почками [16]. Этот пептид получил название предсердный натрийуретический фактор.
17.10. Литература
Учебники и руководства
- Besser G.Μ., ReesL.H. Clinics in Endocrinology and Metabolism. Vol. 14, No. 4. The Pituitary-Adrenocortical Axis. W.B. Saunders Co., 1985.
- Franchimont R. Clinics in Endocrinology and Metabolism. Vol. 15, No. 1. Paracrine Contr. W.B. Saunders Co., 1986.
- Cuyton A. C. Textbook of Medical Physiology. W. B. Saunders Co. 7th Edition, 1986.
- Hakanson R., Thorell J. Biogenetics of Neurohormonal Peptides. New York, Academic Press, 1985.
- Johnston D. G., Alberti K. M. M. Clinics in Endocrinology and Metabolism. Vol. 11, No. 2. New Aspects of Diabetes. W. B. Saunders Co., 1982.
- Jungermann К., Mäkler Η. Bioshemie. Springer. BerlinHeidelberg-New York, 1980.
- Krieger D. Т., Brownstein M. J.. Martin J. B. Brain Peptides. Wiley and Sons. New York, 1971.
- Robinson G. Α., Butcher К W., Sutherland E. W. Cyclic AMP. New York. Academic Press, 1971.
- Shearman R. P. Clinical Reproductive Endocrinology. Churchill Livingstone Edinburgh London Melbourne and New York, 1985.
- Toft A.D. Clinics in Endocrinology and Metabolism. Vol. 14, No. 2. Hyperthyroidism. W.B. Saunders Co., 1985.
- Wilson J.D.. Foster D. W. William's Textbook of Endocrinology. W. B. Saunders Co. 7th Edition, 1985.
- WuttkeW.. Weindl Α., Vogt Κ. Η.. Dries R.-R. Brain and Pituitary Peptides. S. Karger, 1980.
Оригинальные статьи и обзоры
- Brommage R., DeLucaH.F. Evidence that 1,25-Dihydroxyvitamin D3 is the Physiologically Active Metabolite of Vitamin D3. Endocr. Rev., 6/4, 491 -511 (1985).
- Brownstein M.J., Russelc J.T., Gainer H. Biosynthesis of Posterior Pituitary Hormones. (Eds: Ganong, Martini). In:
Frontiers in Neuroendocrinology, Vol. 7, pp. 31-43, Raven Press NY, 1982.
15. Canalis E. The Hormonal and Local Regulation of Bone Formation, Endocr. Rev., 4/1, 62-77 (1983).
ГЛАВА 17. ЭНДОКРИНОЛОГИЯ 413
- Cantin Μ., Genest J. The Heart and the Atrial Natriuretic Factor. Endocr. Rev., 6/2, 107-127 (1985).
- DeLuca H.F. Recent Advances in the Metabolism of Vitamin D. Ann. Rev. PhysioL, 44, 141-162 (1981).
- Eipper B.A., Mains R.E. Structure and Biosynthesis of Pro-Adrenocorticotropin/Endorphin and Related Peptides. Endocr. Rev., 1/1, 1-27 (1980).
- Froesch E.R., Schtnid Chr., Schwander J., Zapf J. Actions of Insulin-like Growth Factors. Ann. Rev. Physiol., 47, 443-467 (1985).
- Guillemin R. Peptides in the Brain: the New Endocrinology of the Neuron (Nobel Lecture). Science, 202, 390-402 (1978).
- Habener J.F. Regulation of Parathyroid Hormone Secretion and Biosynthesis. Ann. Rev. Physiol., 43, 211-223 (1981).
- Herbert E., Roberts J.. Phillips M.. Allen R., Hinman M., Budarf M., Policastro P., Rosa P. Biosynthesis, Processing and Release of Corticotropin, p-Endorphin, and Melanocyte-Stimulating Hormone in Pituitary Cell Culture Systems. In: Frontiers in Neuroendocrinology, Vol. 6, pp. 67-101. Raven Press, 1980.
- Hughes J. P., Friesen Η. G. The Nature and Regulation of the Receptors for Pituitary Growth Hormone. Ann. Rev. Physiol., 47, 469-482 (1985).
- Imura H.. Nakai Y. "Endorphins" in Pituitary and Other Tissues. Ann. Rev. Physiol., 43, 265-278 (1981).
- Isaksson O. G. P., Eden S.. Jansson J.-O. Mode of Action of Pituitary Growth Hormone on Target Cells. Ann. Rev. Physiol., 47, 483-499 (1985).
- Jacobson D. H., Gorman C. A. Endocrine Ophthalmopathy: Current Ideas Concerning Etiology, Pathogenesis, and Treatment. Endocr. Rev., 5/2, 200-220 (1984).
- Jensen E. V, Greene G. L·., Closs L. E., DeSombre E. R. Nadji M. Receptors Reconsidered: A 20-Year Perspective Recent Progress in Hormone Research, Vol. 38, 1-40. Academic Press (1982).
- Keller-Wood M.E., Dallman M.F. Corticosteroid Inhibition of ACTH Secretion. Endocr. Rev., 5/1, 1-24 (1984).
- KotchenT.A., Guthrie G. P. Renin-Angiotensin-Aldosterone and Hypertension. Endocr. Rev., 1/1, 78-99 (1980).
- lenzen S., Bailey C.J., Thyroid Hormones, Gonadal and
Adrenocortical Steroids and the Function of the Islets of Langerhans. Endocr. Rev., 5/3, 411-434 (1984).
- Leong D. Α., Frawley L.S., Neill J.D. Neuroendocrine Control of Prolactin Secretion. Ann. Rev. Physiol., 45, 109 127 (1983).
- McEwen В. S., Biegon Α., Davis P. G., Krey L. C. Luine V. N.. McGinnis Μ. Y, Paden С. М., Parsons В., Rainbow Т. С Steroid Hormones: Humoral Signals Which Alter Brain Cell Properties and Functions. Rec. Progr. Horm. Res., 38, 41-92(1982).
- Mehned S., Braunstein G. D., Horvath E., Ezrin C. Kovacs K. Pathophysiology of Acromegaly. Endocr. Rev., 4/3, 271-290(1983).
- Neill J. D. Neuroendocrine Regulation of Prolactin Secretion. Frontiers in Neuroendocrinology, Vol. 6, pp. 129-155. Raven Press NY, 1980.
- Roue F., Ziegler R. Pathophysiologie der Nebenschilddrüsen und der Calciumhomöostase. Endokrinologie der Kindheit und Adoleszenz, Georg Thieme Verlag Stuttgart, 1986.
- Rechter M. M, Missley S. P. The Nature and Regulation of the Receptors for Insulin-like Growth Factors. Ann. Rev. Physiol., 47, 425-442 (1985).
- Reiter R. J. Neuroendocrine Effects of the Pineal Gland and of Melatonin. Frontiers in Neuroendoctinology, 7, 287-316 NY (1982).
- Schally A. V. Aspects of hypothalamic regulation of the pituitary gland (Nobel Lecture) Science, 202, 18-28 (1978).
- Ser "N-Ferru M., Joffe R. B. The Fetal Adrenal Gland. Ann. Rev. Physiol., 43, 141-162 (1981).
- SiiteriP.K., Murai J.T., Hammond G.L.. NiskerJ.A.. Raymoure W.J., Kuhn R. W. The Serum Transport of Steroid Hormones. Rec. Progr. Horm. Res., 38, 457 -510 (1982).
- Straus D. S. Growth-Stimulatory Actions of Insulin in Vitro and in Vivo. Endocr. Rev., 5/2, 356-369 (1984).
- Vemey E. B. The antidiuretic hormone and the factor which affect its release. Proc. R. Soc. Lond., 135, 25-106 (1947).
- Wakerley J. В., Lincoln D. W. The milk-ejection reflex in the rat. A 20 to 40-fold-acceleration in the firing of paraventricular neurons during Oxytocin release. J. Endocr., 57, 477-493 (1973).
- Wuttke W.. Horowski R. Gonadal Steroids and Brain Function. Exp. Brain Res. Suppl., 3, 182-199 (1981).
