Н. Н. Алипова, канд биол наук О. В. Левашова и канд биол наук М. С. Морозовой под редакцией акад. П. Г. Костюка москва «мир» 1996 ббк 28. 903 Ф50
| Вид материала | Документы |
- Приглашение и программа разнообразие почв и биоты северной и центральной азии, 521.14kb.
- М. А. Ляшко доц., канд физ мат наук; Т. Н. Смотрова доц., канд, 2299.13kb.
- Современные направления развития физической культуры, спорта и туризма, 4493.6kb.
- Отчет о проведении Международной научной конференции-семинара «Современные методы психологии», 97.76kb.
- Образовательная программа дошкольного образования Москва «Просвещение», 5670.3kb.
- Пособие для врачей и среднего медицинского персонала Минск, 5480.63kb.
- Ббк 63. 3(0) Н72, 4378.93kb.
- Тезисы докладов, 4290.75kb.
- Строительные нормы и правила нагрузки и воздействия сниП 01. 07-85* министерство строительства, 1162.86kb.
- Ббк 63. 3(0) Н72, 5546.58kb.
19.2. Основные механизмы возбуждения и электромеханического сопряжения в сердце
Функциональным элементом сердца служит мышечное волокно -цепочка из клеток миокарда, соединенных «конец в конец» и заключенных в общую саркоплазматическую оболочку (основную мембрану). В зависимости от морфологических и функциональных особенностей в сердце различают два типа волокон.
- Волокна рабочего миокарда предсердий и желудочков, составляющие основную массу сердца и обеспечивающие его нагнетательную функцию.
- Волокна водителя ритма (пейсмекера) и проводящей системы, отвечающие за генерацию возбуждения и проведение его к клеткам рабочего миокарда.
Возникновение и распространение возбуждения
Мышца сердца (миокард), подобно нервной ткани и скелетным мышцам, принадлежит к возбуди-
456 ЧАСТЬ V. КРОВЬ И СИСТЕМА КРОВООБРАЩЕНИЯ
мым тканям. Это означает, что волокна миокарда обладают потенциалом покоя, отвечают на надпороговые стимулы генерацией потенциалов действия и способны проводить эти потенциалы без затухания (бездекрементно). Межклеточные соединения в сердце (к которым относятся, в частности, так называемые вставочные диски, выявляемые при микроскопии) не препятствуют проведению возбуждения [24]. Мышечная ткань предсердий и желудочков ведет себя как функциональный синцитий: возбуждение, возникающее в каком-либо из этих отделов, охватывает все без исключения невозбужденные волокна. Благодаря этой особенности сердце подчиняется закону «все или ничего»: на раздражение оно либо отвечает возбуждением всех волокон, либо (если раздражитель подпороговый) не реагирует вовсе. Этим оно отличается от нервов и скелетных мышц, где каждая клетка возбуждается изолированно, и поэтому только в тех клетках, на которые наносят надпороговые раздражения, возникают потенциалы действия.
Автоматизм. Ритмические сокращения сердца возникают под действием импульсов, зарождающихся в нем самом. Если изолированное сердце поместить в соответствующие условия, оно будет продолжать биться с постоянной частотой. Это свойство называется автоматизмом. В норме ритмические импульсы генерируются только специализированными клетками водителя ритма (пейсмекера) и проводящей системы сердца, различные отделы которой схематично показаны на рис. 19.3.
Геометрия распространения возбуждения в сердце. В норме водителем ритма служит синоатриальный (CA) узел, расположенный в стенке правого предсердия у места впадения в него верхней полой вены. Частота разрядов СА-узла в покое составляет около 70 в 1 мин. От этого узла возбуждение распространяется сначала по рабочему миокарду обоих предсердий. Единственный путь, по которому импульсы могут пройти к желудочкам, изображен на рис. 19.3 красным; остальные участки атриовентрикулярного соединения состоят из невозбудимой соединительной ткани. При распространении возбуждения по проводящей системе оно на короткое время задерживается в атриовентрикулярном (AB) узле. Остальные отделы специализированной системы - пучок Гиса с его левой и правой ножками и их конечные разветвления - волокна Пуркинье - проводят импульсы довольно быстро (со скоростью примерно 2 м/с), поэтому различные отделы желудочков достаточно синхронно охватываются возбуждением. Скорость распространения импульса от субэндокардиальных окончаний волокон Пуркинье по рабочему миокарду составляет около 1 м/с.
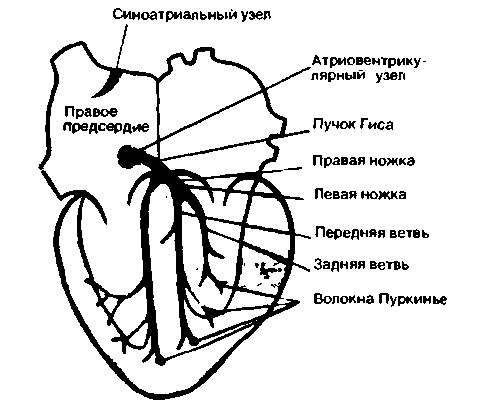 |
| Рис. 19.3. Схема расположения водителя ритма (пейсмекера) и проводящей системы на фронтальном раэреэе сердца |
Соподчинение водителей ритма. Автоматические сокращения сердца зависят не только от деятельности СА-узла. Как указывалось выше, остальные отделы проводящей системы также способны спонтанно генерировать импульсы, однако собственная частота разрядов клеток этих отделов мала; она тем ниже, чем дальше от пейсмекера расположены клетки. Благодаря этому в нормальных условиях потенциал действия в этих клетках возникает в результате прихода возбуждения от более-часто разряжающихся верхних отделов, и их собственный автоматизм «не успевает» проявиться. Поскольку наибольшей частотой спонтанной активности обладает СА-узел, он служит пейсмекером первого порядка (ведущим).
Заместительные ритмы. Если по той или иной причине возбуждение СА-узла не возникает либо (при синоатриальной блокаде) не может перейти на предсердие, роль водителя ритма берет на себя АВ-узел-пейсмекер второго порядка (частота АВ-ритма равна 40-60/мин). Если же проведение возбуждения от предсердий к желудочкам полностью нарушено-полная (поперечная) блокада, то желудочки сокращаются в ритме пейсмекера третьего порядка, расположенного в вентрикулярной проводящей системе. СА-узел называют номотопным (нормально расположенным) центром, а очаги возбуждения в остальных отделах проводящей системы гетеротопными (ненормально расположенными) центрами.
В случае полной поперечной блокады предсердия и желудочки сокращаются независимо друг от друга-предсердия в ритме СА-узла, а желудочки со значительно меньшей частотой, присущей пейсмекерам третьего порядка (3040/мин). При внезапном возникновении полной поперечной блокады желудочковые центры автоматизма начинают функционировать лишь через несколько секунд. Во время этой предавтоматической паузы кровоснабжение головного мозга ухудшается, что может привести к потере
ГЛАВА 19. ФУНКЦИЯ СЕРДЦА 457
сознания и судорогам (приступ Эдемса-Стокса). Если вентрикулярные водители ритма не включаются, то остановка желудочков может привести к необратимому повреждению мозга и даже к смертельному исходу.
Искусственные водители ритма. Даже в том случае, если автоматизм сердца полностью исчезает, возбудимость рабочего миокарда в течение некоторого времени сохраняется. Благодаря этому можно поддерживать кро-
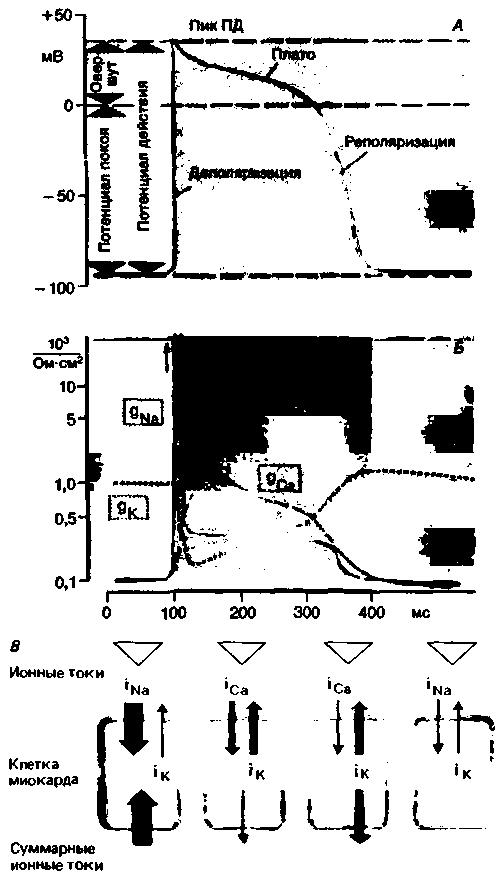 |
| Рис. 19.4. А. Конфигурация потенциала действия клетки миокарда. Б. Изменения проницаемости для Na+, Са2+ иК+ в процессе возникновения потенциала действия сердца. В. Величина и направление ионных потоков и истинный поток во время потенциала действия. Величина (показана толщиной стрелок) потока ионов зависит от проницаемости и от разницы между мембранным потенциалом Еm и равновесным потенциалом для данного иона [т.е. iNa. = gNa.(Еm — ENa); см. с. 30] |
вообращение путем искусственного электрического раздражения желудочков. При необходимости импульсы тока можно подавать через интактную грудную клетку. В случае частых приступов Эдемса-Стокса, а также при полной поперечной блокаде с низкой частотой сокращений желудочков искусственное раздражение сердпа иногда применяют годами. В этом случае импульсы подаются к сердцу по проволочным электродам от миниатюрных водителей ритма, имплантируемых под кожу и работающих от батареек.
Блокада ножек пучка Гиса. Если проведение по одной из ножек пучка Гиса нарушено, а вторая ножка или одна из ее ветвей функционирует нормально, возникает неполная блокада. Возбуждение при этом распространяется на миокард обоих желудочков от терминалей непораженных ветвей. Разумеется, при этом процесс охвата возбуждением более длителен, чем в норме.
Характеристики процесса возбуждения на клеточном уровне
Как в нервных клетках и в волокнах скелетных мышщ, потенциал действия (ПД) в кардиомиоцитах начинается с быстрой реверсии мембранного потенциала от уровня покоя (примерно —90 мВ) до пика ПД (примерно +30 мВ) (рис. 19.4). За этой фазой быстрой деполяризации, продолжительность которой составляет лишь 1-2 мс, следует более длительная фаза плато - специфическая особенность клеток миокарда. Затем наступает фаза реполяризации, по окончании которой восстанавливается потенциал покоя. Длительность потенциала действия кардиомиоцитов составляет 200-400 мс, т. е. более чем в 100 раз превышает соответствующую величину для скелетных мышц и нервных волокон. Как будет показано ниже, это имеет большое функциональное значение.
Ионные механизмы возбуждения. Потенциал действия возникает в результате изменений мембранного потенциала, проницаемости для различных ионов и ионных потоков. Основы ионной теории возбуждения подробно рассмотрены в гл. 1; здесь же мы кратко остановимся на некоторых положениях этой теории применительно к особенностям клеток миокарда [2, 9, 20, 23]. Потенциал покоя этих клеток создается преимущественно за счет К+ -потенциала, поддерживаемого благодаря работе электрогенного натриевого насоса. Как и в нервных клетках, быстрая восходящая фаза ПД кардиомиоцитов обусловлена коротким, но значительным повышением проводимости для натрия (gNa), что приводит к лавинообразному входу Na+ (рис. 19.4). Однако этот начальный входящий ток Na+ быстро инактивируется (в этом кардиомиоциты также сходны с нервными клетками), поэтому значительное замедление реполяризации в клетках миокарда обусловлено иными механизмами. К ним относятся Π медленно развивающееся увеличение проводимости для Ca2 + (gCa), в результате которого возникает деполяризующий входящий ток кальция (медленный входящий ток) [21]; 2) снижение проводимости для К+ (gK), возникающее при деполяризации и уменьшающее реполя-
458 ЧАСТЬ V. КРОВЬ И СИСТЕМА КРОВООБРАЩЕНИЯ
ризуюший выходящий ток К+ [2, 23].
Реполяризация в клетках миокарда обусловлена постепенным уменьшением gCa, а также тем, что при увеличении отрицательного мембранного потенциала повышается gK. Уменьшение gCa приводит к снижению медленного входящего тока, а повышение gK - к увеличению выходящего тока К+. В состоянии покоя деполяризующие и реполяризующие токи находятся в равновесии.
Механизмы, лежащие в основе этого медленного входящего тока Са2+ и быстрого входящего тока Na+, различаются по многим параметрам, в том числе по временному ходу, зависимости от потенциала и чувствительности к блокирующим агентам. Так называемый быстрый натриевый канал блокируется тетродотоксином, а медленный кальциевый ионами Cd2+ и органическими антагонистами Са2+ (например, верапамилом, нифедипином, дилтиаземом) [5]. Порог активации натриевого канала равен примерно —60 мВ, а кальциевого - около —30 мВ. При деполяризации мембраны до —40 мВ быстрый натриевый канал инактивируется. При этом под действием сверхпороговых раздражителей могут возникать так называемые кальциевые потенциалы действия, имеющие более пологий передний фронт (так как медленный входящий ток в этом случае обусловливает не только плато, но и передний фронт ПД) и меньшую скорость распространения («медленный ответ» [3]).
Период рефрактерности. Определенным фазам цикла возбуждения в сердце, как и в других возбудимых тканях, соответствуют периоды невозбудимо-
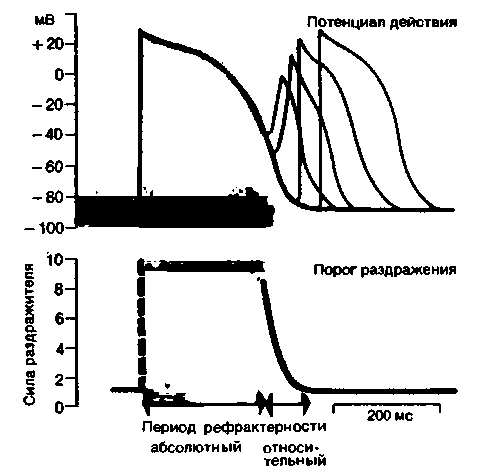 |
| Рис. 19.5. Периоды абсолютной и относительной рефрактерности в цикле возбуждения миокардиоцита. Значения порогов во время периода относительной рефрактерности указаны в единицах, кратных минимальному порогу. Во время периода абсолютной рефрактерности (от начала потенциала действия и примерно до конца плато) порог раздражения бесконечно высок |
сти (абсолютной рефрактерности) и сниженной возбудимости (относительной рефрактерности). На рис. 19.5 показаны эти периоды и их связь с различными фазами ПД. Во время периода абсолютной рефрактерности клетка невозбудима; затем следует период относительной рефрактерности, в течение которого возбудимость постепенно восстанавливается. Таким образом, чем больше сила повторного стимула, тем раньше можно вызвать очередной потенциал действия. ПД, возникающие в начальной стадии периода относительной рефрактерности, нарастают более полого, имеют меньшую амплитуду и длительность (рис. 19.5).
Рефрактерность связана главным образом с инактивацией быстрых натриевых каналов, наступающей при длительной деполяризации (с. 33). Эти каналы начинают восстанавливаться лишь после того, как мембрана реполяризуется примерно до уровня —40 мВ. Таким образом, продолжительность рефрактерного периода, как правило, тесно связана с длительностью потенциала действия. Если ПД укорачивается или удлиняется, этому соответствуют такие же изменения периода рефрактерности. Однако препараты, обладающие местным анестезирующим действием, могут подавлять быстрые натриевые каналы и замедлять восстановление проницаемости после инактивации, вызывая тем самым удлинение рефрактерного периода, но не влияя на продолжительность потенциала действия.
Функциональное значение периода рефрактерности. Длительный рефрактерный период предохраняет миокард от слишком быстрого повторного возбуждения. Такое возбуждение могло бы нарушить нагнетательную функцию сердца. Вместе с тем фаза рефрактерности препятствует круговому движению возбуждения по миокарду, которое привело бы к нарушению ритмичного чередования сокращения и расслабления. В норме рефрактерный период клеток миокарда больше, чем время распространения возбуждения по предсердиям или желудочкам. Поэтому после того, как волна возбуждения из САузла или гетеротопного очага охватит полностью весь миокард, она угасает; обратный вход этой волны невозможен, так как все сердце находится в состоянии рефрактерности.
Зависимость длительности потенциала действия от частоты. Как показано на рис. 19.5, потенциал действия, возникающий сразу после окончания периода относительной рефрактерности предыдущего цикла возбуждения, характеризуется обычной крутизной переднего фронта и амплитудой. Однако длительность ПД значительно уменьшена. Таким образом, существует тесная связь между продолжительностью потенциала действия и длительностью интервала между началом этого ПД и концом предыдущего, т. е. между длительностью и частотой ПД. На рис. 19.6 приведена оригинальная запись для поло-
ГЛАВА 19. ФУНКЦИЯ СЕРДЦА 459
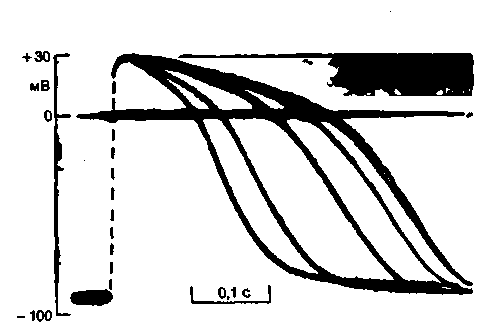 |
| Рис. 19.6. Наложение потенциалов действия одиночного волокна изолированной трабекулярной мышцы желудочка человека, полученной при операции на сердце. При ступенчатом увеличении частоты раздражения от 24 до 162 имп/мин потенциал действия укорачивается [по Trautwein et al. Circul. Rec, 10, 306 (1962)] |
ски желудочка человека, иллюстрирующая эту зависимость.
Описанный эффект обусловлен главным образом тем, что gK после окончания реполяризации еще повышена и лишь через некоторое время постепенно возвращается к исходному уровню (рис. 19.4). В том случае, если интервал между ПД мал. это повышение проницаемости для К+ приводит к ускорению реполяризации в очередных циклах возбуждения.
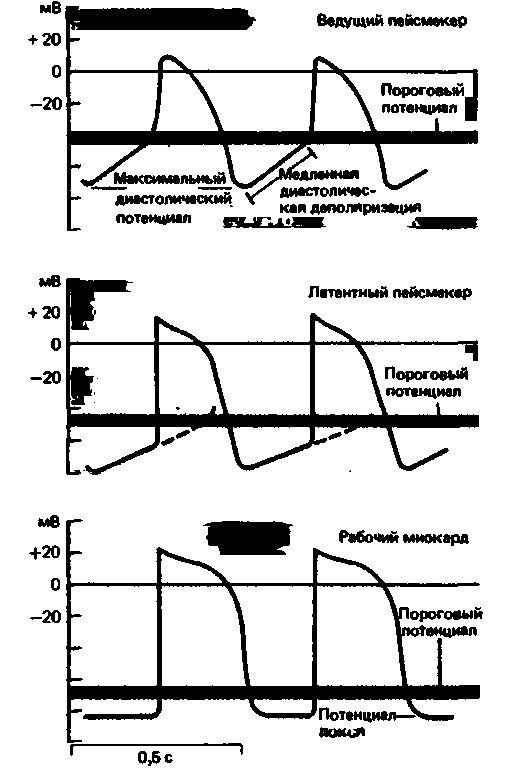
Клеточные механизмы возникновения возбуждения в сердце. Клетки рабочего миокарда предсердий и желудочков не обладают автоматизмом. Потенциалы действия в них возникают лишь под влиянием распространяющегося возбуждения: от возбужденных участков к невозбужденным течет ток, вызывающий деполяризацию последних. Когда в результате этой деполяризации мембранный потенциал достигает критического (порогового) значения, возникает потенциал действия (с. 30). Что же касается клеток сердца, обладающих автоматизмом, то они спонтанно деполяризуются до критического уровня. Это явление можно наблюдать при прямой внутриклеточной регистрации мембранных потенциалов клеток пейсмекера. Как видно из рис. 19.7, в таких клетках за фазой реполяризации следует фаза медленной диастолической деполяризации, начинающаяся сразу по достижении максимального диастолического потенциала и приводящая к снижению мембранного потенциала до порогового уровня и возникновению ПД. В отличие от потенциала действия медленная диастолическая деполяризация (пейсмекерный потенциал. препотенциал) - это местное, нераспространяющееся возбуждение.
Истинные и латентные водители ритма. В норме ритм сердечных сокращений задают лишь несколько клеток синоатриального узла - так называемые истинные водители ритма. Все остальные клетки проводящей системы разряжаются, как и рабочий миокард, под действием распространяющегося возбуждения. Эти клетки называют латентными (скрытыми, потенциальными) водителями ритма. Потенциал действия в них возникает под влиянием токов от возбужденных участков до того, как в результате их собственной медленной диастолической деполяризации их мембранный потенциал достигнет порогового уровня. На рис. 19.7, где приведены потенциалы действия истинного и латентного пейсмекеров, показано, каким образом латентный водитель ритма может взять на себя ведущую функцию при выключении истинного водителя ритма. В связи с тем что в латентных водителях ритма медленная диастолическая деполяризация позже достигает порогового уровня, частота их разрядов ниже. Клетки же рабочего миокарда не обладают спонтанной деполяризацией, и их потенциалы действия, возникающие под влиянием внешних токов, характеризуются крутым передним фронтом на фоне постоянного потенциала покоя (рис. 19.7, нижняя кривая).
Ионные механизмы пейсмекерного потенциала. В соответствии с современными представлениями медленная диастолическая деполяризация в синоатриальиом узле обусловлена иными механизмами, нежели в желудочковой проводящей системе [17]. Во-первых, для клеток СА-узла характерен более высокий постоянный фоновый натриевый ток, препятствующий достижению равновесного калиевого потенциала Ек. В связи с этим мембранный потенциал этих клеток постоянно низок, и быстрые натриевые каналы (даже если они в этих клетках имеются) инактивированы. Во время фазы реполяризации потенциала действия проницаемость мембраны для калия увеличивается, становясь выше уровня покоя. В результате мембранный потенциал приближается к равновесному калиевому потенциалу ЕK и достигает максимального диастолического значения (рис. 19.7). Затем gK постепенно снижается до уровня покоя и мембранный потенциал все более отличается от ЕK, достигая в конечном счете уровня, при котором активируется медленный входящий ток. отвечающий за передний фронт ПД в данных клетках (таким образом, их потенциалы действия сходны с ПД деполяризованных клеток желудочков", см. выше). Сходные механизмы действуют и в АВ-узле.
Что же касается клеток желудочковой проводящей системы, то у них фоновая натриевая проницаемость в норме мала. В связи с этим мембранный потенциал сразу после окончания ПД достигает довольно высокого уровня, что обусловливает значительное восстановление быстрого натриевого тока. Далее начинается диастолическая деполяризация, которая в этих клетках обусловлена особым ионным каналом, не действующим в клетках СА-узла; этот канал активируется лишь при существенной поляризации и пропускает как Na+, так и К+ [16]. Передний фронт ПД в этих клетках крутой, так как создается быстрым входящим натриевым током.
460 ЧАСТЬ V. КРОВЬ И СИСТЕМА КРОВООБРАЩЕНИЯ
 |
| Рис. 19.7. Конфигурация потенциалов действия различных отделов проводящей системы и рабочего миокарда |
Эктопические водители ритма. Способностью к спонтанному возбуждению обладают более примитивные клетки, а не высокоспециализированные рабочие кардиомиоциты. На ранних стадиях эмбрионального развития этой способностью обладают все клетки закладки сердца. По мере дифференцировки клеток предсердий и желудочков автоматизм у них исчезает и появляется устойчивый высокий потенциал покоа. Однако при некоторых патологических состояниях, связанных с частичной деполяризацией мембран (катэлектротон, растяжение, гипокалиемия, действие ионов Ва2+), стабильность потенциала покоя у этих клеток утрачивается, и в результате в них может появляться диастолическая деполяризация, характерная для водителей ритма. При определенных условиях их разряды могут влиять на ритм сердца. Вместе с тем деполяризация, вызванная повышением уровня К+, не приводит к повышению автоматизма, так как одновременно увеличивается проводимость для К+, что подавляет спонтанную активность. Центр автоматизма, не относящийся к проводящей системе, называется эктопическим очагом (или фокусом).
Разновидности ПД в клетках сердца. В различных участках сердца потенциалы действия характеризуются определенными особенностями. ПД для некоторых отделов сердца приведены на рис. 19.8, причем потенциалы верхних отделов изображены в верхней части рисунка, а нижних-в нижней. Интервал от нулевой вертикальной линии до переднего фронта ПД соответствует времени задержки возбуждения того или иного отдела по отношению к синусному узлу. По мере удаления от синусного узла того или иного отдела проводящей системы наклон кривой медленной диастолической деполяризации клеток становится все менее крутым. Крутизна переднего фронта и амплитуда потенциала действия в клетках CA- и АВ-узлов существенно ниже, чем в остальных отделах проводящей системы. Длительность плато и соответственно рефрактерного периода в рабочих клетках предсердий меньше, чем в миокарде желудочков. Окончания волокон Пуркинье обладают весьма длительными потенциалами действия и поэтому играют роль «частотного фильтра», препятствующего слишком
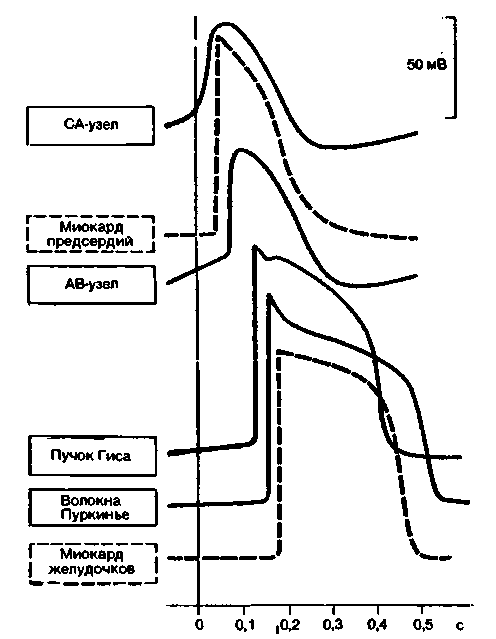 |
| Рис. 19.8. Типичная конфигурация потенциалов действия (ПД) различных отделов сердца. Сплошными линиями изображены ПД пейсмекера и проводящей системы. Проекция начала ПД того или иного отдела нв горизонтальную шкалу соответствует времени прихода волны возбуждения в этот отдел |
ГЛАВА 19. ФУНКЦИЯ СЕРДЦА 461
частым сокращениям желудочков при чрезмерно высокой частоте возбуждения предсердий.
Связь между возбуждением и сокращением (электромеханическое сопряжение)
Сокращение сердца, как и скелетных мышц
(с. 73), запускается потенциалом действия. Тем не менее временные соотношения между возбуждением и сокращением в этих двух типах мышц различны. Длительность потенциала действия скелетных мышц составляет лишь несколько миллисекунд, и сокращение их начинается тогда, когда возбуждение уже почти закончилось. В миокарде же возбуждение и сокращение в значительной степени перекрываются во времени (рис. 19.9, А). Потенциал действия клеток миокарда заканчивается только после начала фазы расслабления. Поскольку последующее сокращение может возникнуть лишь в результате очередного возбуждения, а это возбуждение в свою очередь возможно только по окончании периода абсолютной рефрактерности предшествующего потенциала действия, сердечная мышца в отличие от скелетной не может отвечать на частые раздражения суммацией одиночных сокращений, или тетанусом (с. 79).
Это свойство миокарда - неспособность к состоянию тетануса-имеет большое значение для нагнетательной функции сердца; тетаническое сокращение, продолжающееся дольше периода изгнания крови, препятствовало бы наполнению сердца. Вместе с тем сократимость сердца не может регулироваться путем суммации одиночных сокращений, как это происходит в скелетных мышцах, сила сокращений которых в результате такой суммации зависит от частоты потенциалов действия. Сократимость миокарда в отличие от скелетных мышц не может изменяться и путем включения различного числа двигательных единиц (с. 77), так как миокард представляет собой функциональный синцитий, в каждом сокращении которого участвуют все волокна (закон «все или ничего»). Эти несколько невыгодные с физиологической точки зрения особенности компенсируются тем, что в миокарде гораздо более развит механизм регуляции сократимости путем изменения процессов возбуждения либо за счет прямого влияния на электромеханическое сопряжение.
Механизм электромеханического сопряжения в миокарде. У человека и млекопитающих структуры, которые отвечают за электромеханическое сопряжение в скелетных мышцах, в основном имеются и в волокнах сердца (рис. 19.9, внизу; см. также с. 69). Для миокарда характерна система поперечных трубочек (Т-система); особенно хорошо она развита в желудочках, где эти.трубочки образуют продольные ответвления. Напротив, система продольных
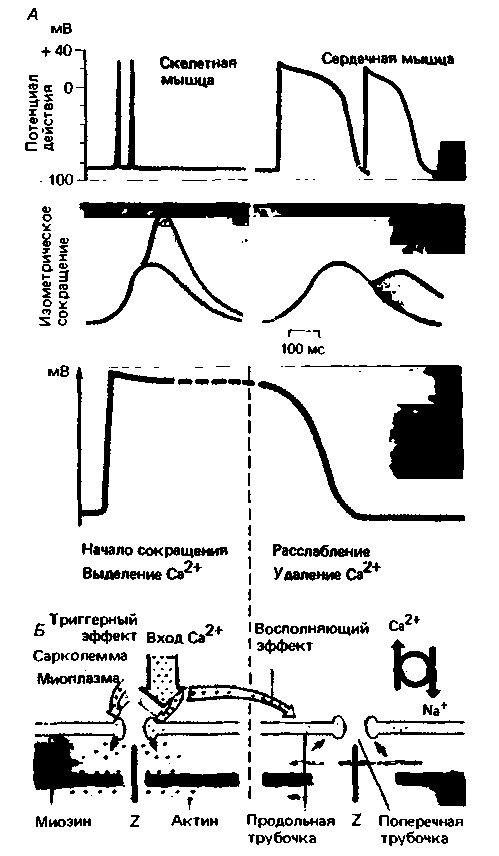 |
| Рис. 19.9. А. Сопоставление во времени потенциала действия и сокращения скелетной и сердечной мышц. Б. Схема соотношения между возбуждением, движением Са2 + и активацией сократительного аппарата |
трубочек, служащих внутриклеточным резервуаром Са2+, в мышце сердца развита в меньшей степени, чем в скелетных мышцах. Как структурные, так и функциональные особенности миокарда свидетельствуют в пользу тесной взаимосвязи между внутриклеточными депо Са2+ и внеклеточной средой. Ключевым событием в сокращении служит вход в клетку Са2+ во время потенциала действия. Значение этого кальциевого тока состоит не только в том, что он увеличивает длительность потенциала действия и вследствие этого рефрактерного периода (см. выше): перемещение кальция из наружной среды в клетку создает условия для регуляции силы
462 ЧАСТЬ V. КРОВЬ И СИСТЕМА КРОВООБРАЩЕНИЯ
сокращения. Однако количество кальция, входящего во время ПД, явно недостаточно для прямой активации сократительного аппарата; очевидно, большую роль играет выброс Ca2 + из внутриклеточных депо, запускаемый входом Са2+ извне [24]. Кроме того, входящий в клетку Са2+ пополняет запасы Са2+, обеспечивая последующие сокращения.
Если путем приложения кратковременного анодного тока уменьшить длительность одного потенциала действия, чтобы входящий ток Са2+ прекратился раньше, то сокращение, соответствующее этому ПД, изменится незначительно, но последующие сокращения, возникающие уже при нормальных потенциалах действия, будут существенно ослаблены. При искусственном увеличении потенциала действия наблюдается обратный эффект, т.е. усиление последующих сокращений. Если уменьшить или увеличить продолжительность нескольких ПД, то через 5-7 циклов установится равновесие, при котором сокращения будут соответственно значительно ослаблены или усилены [14].
Таким образом, потенциал действия влияет на сократимость по меньшей мере двумя путями. Он
- играет роль пускового механизма («триггерное действие»), вызывающего сокращение путем высвобождения Са2+ (преимущественно из внутриклеточных депо);
- обеспечивает пополнение внутриклеточных запасов Са2+ в фазе расслабления, необходимое для последующих сокращений.
Механизмы регуляции сокращений. Целый ряд факторов оказывает косвенное влияние на сокращение миокарда, изменяя длительность потенциала действия и тем самым величину входящего тока Са2+. Примеры такого влияния-снижение силы сокращений вследствие укорочения ПД при повышении внеклеточной концентрации К+ или действии ацетилхолина и усиление сокращений в результате удлинения ПД при охлаждении (табл. 19.1). Увеличение частоты потенциалов действия влияет на сократимость так же, как и повышение их длительности (ритмоинотропная зависимость, усиление сокращений при нанесении парных стимулов, постэкстрасистолическая потенциация). Так называемый феномен лестницы (нарастание силы сокращений при их возобновлении после временной остановки) также связан с увеличением внутриклеточной фракции Са2+ [14].
Учитывая эти особенности сердечной мышцы, не приходится удивляться тому, что сила сокращений сердца быстро изменяется при изменении содержания Са2 + во внеклеточной жидкости. Удаление Ca2+ из внешней среды приводит к полному разобщению электромеханвческого сопряжения: потенциал действия при этом остается почти неизменным, но сокращений не происходит.
Можно было бы ожидать, что в среде без кальция длительность потенциала действия будет уменьшаться, поскольку
при этом нет входящего Ca2 + тока, продлевающего ПД. Однако этого не происходит по нескольким причинам. Во-первых, медленный канал пропускает не только Са2 + , но и Na+. При нормальной внеклеточной концентрации Са2+ вклад Na+ в медленный входящий ток невелик, однако в отсутствие кальция этот ток обеспечивается ионами Na+. Во-вторых, внутриклеточная концентрация Са2+ влияет на проницаемость для К+: при ее снижении (например, вследствие удаления Са2+ из внеклеточной среды) проницаемость для К + уменьшается, и реполяризация ПД задерживается [20, 21].
Ряд веществ, блокирующих вход Са2+ во время потенциала действия, оказывает такой же эффект, как и удаление кальция из внешней среды. К таким веществам относятся так называемые антагонисты кальция (верапамил, нифедипин, дилтиазем) [5].
Напротив, при повышении внеклеточной концентрации Са2+ или при действии веществ, увеличивающих вход этого иона во время потенциала действия (адреналин, норадреналин; см. с. 465), сократимость сердца увеличивается. В клинике для усиления сердечных сокращений используют так называемые сердечные гликозиды (препараты наперстянки, строфанта и т.д.).
В соответствии с современными представлениями сердечные гликозиды повышают силу сокращений миокарда преимущественно путем подавления Na+/K+ - ATФазы (натриевого насоса), что приводит к повышению внутриклеточной концентрации Na+. В результате снижается интенсивность обмена внутриклеточного Са2+ на внеклеточный Na+, зависящего от трансмембранного градиента Na+, и Са2 + накапливается в клетке. Это дополнительное количество Ca2 + запасается в депо и может быть использовано для активации сократительного аппарата [И].
Вегетативная иннервация сердца; основные механизмы действия медиаторов вегетативной нервной системы
Сердечные центры продолговатого мозга и моста (с. 542) непосредственно управляют деятельностью сердца. Их влияния передаются по симпатическим и парасимпатическим нервам и касаются частоты сокращений (хронотропное действие), силы сокращений (инотрошюе действие), а также скорости атриовентрикулярного проведения (дромотропное действие). Как и в остальных органах, передатчиками нервных влияний на сердце служат химические медиаторы - ацетилхолин в парасимпатической нервной системе и норадреналин-в симпатической.
Парасимпатическая иннервация сердца. Преганглионарные парасимпатические сердечные волокна идут в составе ветвей, отходящих от блуждающих нервов с обеих сторон в области шеи. Волокна от
ГЛАВА 19. ФУНКЦИЯ СЕРДЦА 463
правого блуждающего нерва иннервируют преимущественно правое предсердие и особенно обильно синоатриальный узел, К атриовентрикулярному узлу подходят главным образом волокна от левого блуждающего нерва. Вследствие этого правый блуждающий нерв влияет преимущественно на частоту сокращений сердца, а левый - на атриовентрикулярное проведение. Парасимпатическая иннервация желудочков выражена слабо и оказывает свое влияние косвенно - за счет торможения симпатических эффектов.
Симпатическая иннервация. Симпатические нервы в отличие от блуждающих практически равномерно распределены по всем отделам сердца. Преганглионарные симпатические сердечные волокна берут начало в боковых рогах верхних грудных сегментов спинного мозга. В шейных и верхних грудных ганглиях симпатического ствола, в частности в звездчатом ганглии, эти волокна переключаются на постганглионарные нейроны. Отростки последних подходят к сердцу в составе нескольких сердечных нервов. Кроме того, симпатоадреналовая система влияет на сердце посредством катехоламинов, выделяющихся в кровь из мозгового слоя надпочечников [4].
Хронотропия. Раздражение правого блуждающего нерва или непосредственное воздействие ацетилхолином на СА-узел приводит к снижению частоты сокращений сердца (отрицательный хронотропный эффект). При сильных воздействиях возможна даже остановка сердца. Раздражение симпатических нервов или воздействие норадреналином сопровождается ускорением ритма сердца (положительный хронотропный эффект). При одновременном раздражении симпатических и блуждающих нервов обычно преобладает действие последних. Вегетативные нервы влияют на автоматизм СА-узла прежде всего путем изменения временного хода медленной диастолической деполяризации (рис. 19.10, А). Под действием блуждающих нервов диастолическая деполяризация замедляется, поэтому мембранный потенциал достигает порогового значения позже. При сильных раздражениях блуждающих нервов диастолическая деполяризация исчезает и наступает гиперполяризация клеток водителя ритма (рис. 19.11, А). Под· влиянием симпатических волокон, напротив, медленная диастолическая деполяризация ускоряется, и порог достигается раньше. На оригинальных записях внутриклеточных потенциалов венозного синуса лягушки, представленных на рис. 19.11, видны эффекты блуждающих и симпатических нервов.
Симпатические нервы повышают автоматизм всех отделов проводящей системы сердца, поэтому при угнетении ведущего пейсмекера именно от влияния этих нервов может зависеть, как скоро функции водителя ритма возь-
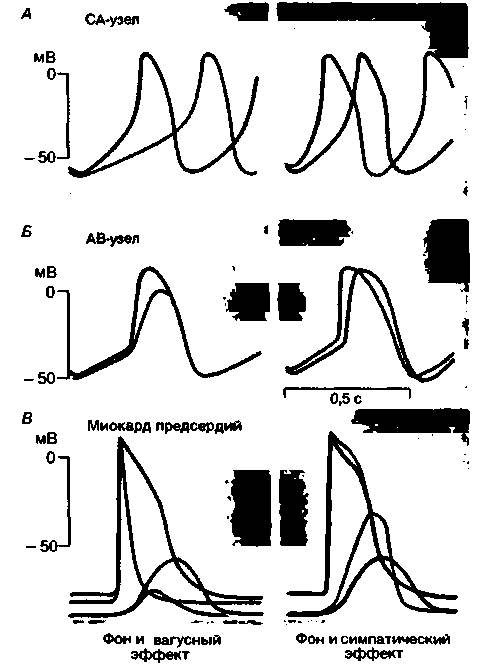 |
| Рис. 19.10. Типичные изменения потенциалов действия СА-узла (А), АВ-узла (Б) и миокарда предсердий (В) под влиянием эфферентных вегетативных сердечных нереов или их медиаторов. Приведены также кривые изометрических сокращений предсердий. На миокард желудочков симпатические нервы оказывают такой же эффект, как и на предсердия; блуждающие же нервы либо не оказывают влияния на желудочки, либо влияют незначительно |
мет на себя пейсмекер второго порядка и насколько действенным будет его эффект. Кроме того, симпатические нервы оказывают положительное хронотропное действие на пейсмекерные клетки, спонтанная активность которых была угнетена каким-либо экзогенным фактором, например избытком К+ или передозировкой препаратов, влияющих на автоматизм. В то же время под влиянием этих нервов может возрастать активность эктопических очагов возбуждения и увеличиваться опасность возникновения аритмий.
Тонус блуждающих и симпатических нервов. У
большинства млекопитающих, включая человека, деятельность желудочков контролируется преимущественно симпатическими нервами. Что касается предсердий и особенно синоатриального узла, то они находятся под постоянными антагонистическими воздействиями со стороны блуждающих и сим-
464 ЧАСТЬ V. КРОВЬ И СИСТЕМА КРОВООБРАЩЕНИЯ
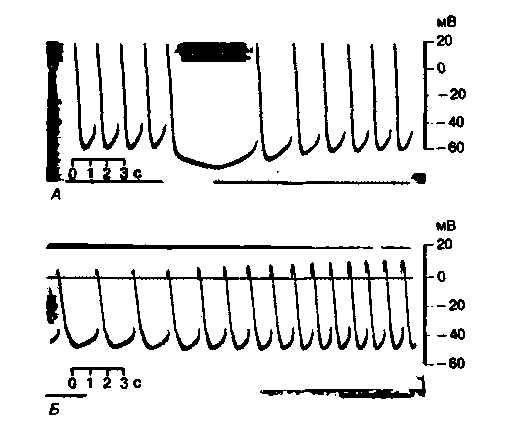 |
| Рис. 19.11. Влияние блуждающего {А) и симпатического (Б) нервов на активность ведущего пейсмекера сердца лягушки. Длительность раздражения соответствует перерыву в нижней прямой. Частота раздражения 20 Гц [по Hutter О. F., Trautwein W. J. Gen. Physiol. 39. 715 (1956)] |
патических нервов. Этот антагонизм можно выявить, например, путем перерезки или фармакологической блокады тех или иных нервов (при этом остаются лишь влияния «противоположных» нервов). При выключении парасимпатических влияний частота сокращений сердца у собаки возрастает со 100 ударов в 1 мин (приблизительно таков ритм сердца у собаки в состоянии покоя) до 150 и более. При подавлении же симпатической активности частота падает до 60 ударов в 1 мин. Эти постоянные влияния блуждающих и симпатических нервов называются их тонусом. Поскольку ритм полностью денервированного сердца (собственный ритм) существенно выше, чем частота сокращений сердца в состоянии покоя, считается, что в покое тонус блуждающих нервов преобладает над тонусом симпатических.
Инотропия. Изменения ритма сердца сами по себе оказывают значительное влияние на силу сокращений (см. выше). Кроме того, на сократимость могут непосредственно влиять сердечные нервы (рис. 9.10). Под действием блуждающих нервов сила сокращений предсердий уменьшается, и одновременно на механокардиограмме увеличивается длительность восходящей фазы (интервал от начала восходящего участка кривой до максимума). Этот отрицательный инотропный эффект обусловлен укорочением потенциала действия (рис. 19.10,5). Под действием симпатических нервов усиливаются сокращения как предсердий, так и желудочков (поло-
жительный инотропный эффект). Наклон восходящего участка кривой сокращения становится круче, интервал от начала сокращения уменьшается, и скорость расслабления увеличивается. В то же время форма кривой потенциала действия изменяется весьма незначительно (рис. 19.10,5).
Дромотропия. В норме сердечные нервы влияют на проведение возбуждения только в области АВузла (рис. 19.12). Симпатические нервы стимулируют атриовентрикулярное проведение и тем самым вызывают сокращение интервала между сокраще-
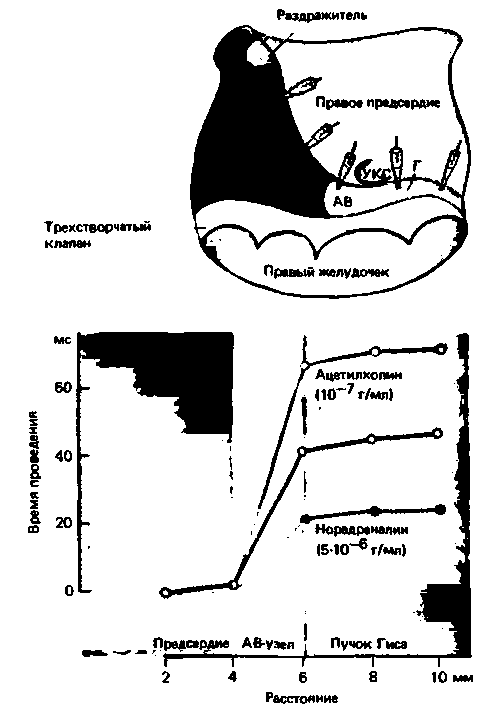 |
| Рис. 19.12. Измерение времени проведения (т.е. интервала между нанесением раздражения и возбуждением участка под электродом) на препарате изолированного предсердия кролика. АВ-атриовентрикулярный узел; Г-пучок Гиса. УКС устье коронарного синуса. В нижней части рисунка приведены кривые зависимости времени проведения от расстояния между раздражающим и регистрирующим электродами в контроле и при действии ацетилхолина и норадреналина. Видно, что медиаторы вегетативных нервов влияют только на время атриовентрикулярного проведения-увеличение времени проведения соответствует снижению скорости проведения, и наоборот [по Hoffman В. F. et al. Circul Res., 7, 11 (1959)] |
ГЛАВА 19. ФУНКЦИЯ СЕРДЦА 465
ниями предсердий и желудочков (положительный дромотропный эффект). Под действием же блуждающих нервов, особенно левого, атриовентрикулярная задержка увеличивается вплоть до полной преходящей атриовентрикулярной блокады (отрицательный дромотропный эффект). Такие влияния вегетативных нервов и их медиаторов объясняются особыми свойствами клеток АВ-узла. Как уже говорилось, клетки АВ-узла по своим свойствам весьма сходны с клетками СА-узла: в них нет быстрого натриевого тока, поэтому крутизна нарастания ПД, а соответственно и скорость распространения возбуждения сравнительно низки. Из рис. 19.10, Б видно, что блуждающие нервы еще больше снижают крутизну нарастания ПД, а симпатические нервы, напротив, повышают ее, что соответствующим образом отражается на скорости проведения в АВ-узле (рис. 19.12).
Батмотропия. Батмотропией называют влияние на возбудимость ткани, выражающееся в снижении или повышении порога раздражения. Убедительных данных, свидетельствующих о батмотропном влиянии медиаторов вегетативных нервов на сердце, не получено. Твердо установлено то, что симпатические нервы повышают возбудимость в случае, если она была снижена (потенциал покоя уменьшен). Понятие «батмотропный эффект» внесло не столько ясность, сколько путаницу, поэтому от него следует отказаться.
Механизм действия медиаторов. Считается, что в основе действия блуждающих нервов и их медиатора ацетилхолина лежит прежде всего повышение проницаемости возбудимых мембран для калия. В результате такого влияния мембранный потенциал стремится достичь равновесного потенциала для калия, что препятствует деполяризации. Этот эффект проявляется и в запаздывании медленной диастолической деполяризации в СА-узле (см. выше), и в укорочении потенциала действия миокарда предсердий, сопровождающемся ослаблением сокращений. Уменьшение крутизны нарастания потенциалов действия в АВ-узле, очевидно, также связано с этим эффектом, так как усиленный выход калия противодействует медленному входящему току кальция.
Обсуждается также возможность прямого ингибирующего действия ацетилхолина на медленный вход Са2+ (т.е. снижения кальциевой проницаемости) в клетках предсердий. Что же касается желудочков, то в них эффект ацетилхолина связан преимущественно с блокадой симпатического влияния, т. е. выделения норадреналина из окончаний симпатических нервов [30] 1.
Относительно действия симпатических нервов и их медиаторов к настоящему времени получены
1
 } По современным представлениям, подавление симпатического влияния ацетилхолином происходит на внутриклеточном уровне: ацетилхолин блокирует активацию сАМР-зависимых реакций катехоламинами.- Прим. перев.
} По современным представлениям, подавление симпатического влияния ацетилхолином происходит на внутриклеточном уровне: ацетилхолин блокирует активацию сАМР-зависимых реакций катехоламинами.- Прим. перев.убедительные экспериментальные данные о том, что они усиливают медленный входящий кальциевый ток (т. е. повышают кальциевую проницаемость). При этом сила сокращений увеличивается, поскольку возрастает эффективность электромеханического сопряжения. Влияние катехоламинов на АВ-узел по вышеизложенным соображениям также, очевидно, обусловлено усилением медленного входящего кальциевого тока. Что касается ускорения расслабления сердечной мышцы, сопровождающего положительный инотропный эффект, то его связывают со стимуляцией поступления Са2+ во внутриклеточные депо. Для положительного хронотропного эффекта симпатических нервов удовлетворительного объяснения пока нет: в СА-узле он связан, возможно, с усилением медленного кальциевого тока, но в волокнах Пуркинье более вероятно влияние на особый активируемый гиперполяризацией пейсмекерный ток [16, 20].
Фармакологические механизмы действия медиаторов на сердце. Считается, что действие медиаторов вегетативной нервной системы включает их связывание с определенными молекулярными структурами эффекторных клеток (эти структуры, как и чувствительные клетки, называют рецепторами). Влияние иа сердце норадреналина и адреналина опосредовано возбуждением так называемых ß-рецепторов (с. 348). Эффекты симпатических нервов и их медиаторов выключаются ß-адреноблокаторами, например дихлоризопротеренолом и неталидом (с. 348). Антагонистом парасимпатических эффектов ацетилхолина в сердце, как и в других органах, служит алкалоид из белладонны атропин.
Афферентные нервы сердца. Сердце иннервируется не только эфферентными, но и большим количеством афферентных волокон, идущих в составе блуждающих и симпатических нервов. Большая часть афферентных путей, принадлежащих блуждающим нервам, представляет собой миелинизированные волокна с чувствительными окончаниями в предсердиях и левом желудочке. При регистрации активности одиночных предсердных волокон были выделены два типа механорецепторов: В-рецепторы, отвечающие на пассивное растяжение, и А-рецепторы, реагирующие на активное напряжение.
Наряду с этими миелинизированными волокнами от специализированных рецепторов, существует еще одна большая группа чувствительных нервов, отходящих от свободных окончаний густого субэндокардиального сплетения безмякотных волокон. Эта группа афферентных путей идет в составе симпатических нервов. Полагают, что именно эти волокна отвечают за резкие боли с сегментарной иррадиацией, наблюдающиеся при полемической болезни сердца (стенокардии и инфаркте миокарда).
Влияние ионного состава среды иа функцию сердца.
Из всех характеристик внеклеточной жидкости,
466 ЧАСТЬ V. КРОВЬ И СИСТЕМА КРОВООБРАЩЕНИЯ
влияющих на работу сердца, наибольший эффект оказывает концентрация ионов К + . При повышении содержания К+ в наружной среде наблюдаются: 1) снижение потенциала покоя вследствие уменьшения градиента концентрации К +; 2) увеличение проницаемости возбудимых мембран для К+ (как при действии ацетилхолина на миокард предсердий). Увеличение концентрации К+ вдвое, т. е. до 8 ммоль/л (при норме 4 ммоль/л), приводит к незначительной деполяризации, сопровождающейся повышением возбудимости и скорости проведения, а также к подавлению гетеротопных очагов возбуждения. При значительном возрастании концентрации К+ (выше 8 ммоль/л) возбудимость, скорость проведения и длительность потенциала действия падают, в результате чего уменьшается сократимость и СА-узел фактически перестает функционировать как водитель ритма. Снижение же внеклеточной концентрации К+ (ниже 4 ммоль/л) приводит главным образом к повышению активности пейсмекера, при этом активируются также гетеротопные очаги возбуждения, что может сопровождаться нарушениями ритма.
Снижение возбудимости под действием растворов с высокой концентрацией К+ (кардиоплегических растворов) используют в хирургии сердца, чтобы вызвать его временную остановку; кровообращение в этих условиях поддерживается специальным насосом (аппаратом искусственного кровообращения). Изменения функций сердца при сдвигах в содержании К+ в крови, наступающих при большой физической нагрузке или при некоторых заболеваниях, могут существенно компенсироваться влиянием симпатических нервов.
В табл. 19.1 приведены важнейшие физические и химические факторы, влияющие на возбудимость и сократимость сердца (рассмотрены только преобладающие эффекты этих факторов).
