Н. Н. Алипова, канд биол наук О. В. Левашова и канд биол наук М. С. Морозовой под редакцией акад. П. Г. Костюка москва «мир» 1996 ббк 28. 903 Ф50
| Вид материала | Документы |
- Приглашение и программа разнообразие почв и биоты северной и центральной азии, 521.14kb.
- М. А. Ляшко доц., канд физ мат наук; Т. Н. Смотрова доц., канд, 2299.13kb.
- Современные направления развития физической культуры, спорта и туризма, 4493.6kb.
- Отчет о проведении Международной научной конференции-семинара «Современные методы психологии», 97.76kb.
- Образовательная программа дошкольного образования Москва «Просвещение», 5670.3kb.
- Пособие для врачей и среднего медицинского персонала Минск, 5480.63kb.
- Ббк 63. 3(0) Н72, 4378.93kb.
- Тезисы докладов, 4290.75kb.
- Строительные нормы и правила нагрузки и воздействия сниП 01. 07-85* министерство строительства, 1162.86kb.
- Ббк 63. 3(0) Н72, 5546.58kb.
18.6. Остановка кровотечения и свертывание крови
Гемостаз
Адгезия тромбоцитов. У здорового человека кровотечение из мелких сосудов при их ранении останавливается за 1-3 мин (так называемое время кровотечения). Этот первичный гемостаз почти целиком обусловлен сужением сосудов и их механической закупоркой агрегатами тромбоцитов. Адгезия (прилипание) тромбоцитов к волокнам соединительной ткани по краям раны обусловлена олигомерным гликопротеином, содержащимся в субэндотелии и кровяных пластинках,— фактором Виллебранда [40].
Фактор Виллебранда содержится также в плазме, где с ним связан фактор свертывания VIII (поэтому фактор Виллебранда раньше называли антигеном, связанным с фактором VIII). Фактор Виллебранда образует мостики между субэндотелиальными структурами и специфическими рецепторами (гликопротеином Ib) в мембране тромбоцитов. У больных с наследственным дефицитом гликопротеина Ib процесс адгезии тромбоцитов нарушается (синдром Бернара-Сулье).
В процессе адгезии форма тромбоцитов меняется - они становятся округлыми клетками с шиловидными отростками. Под влиянием АДФ (это вещество частично выделяется из поврежденных клеток) и адреналина повышается способность тромбоцитов к агрегации (вначале обратимой). При этом выделяются и начинают действовать агенты, содержащиеся в электроноплотных и α-гранулах (табл. 18.6). К этим веществам относятся серотонин (сосудосуживающий агент), катехоламины, хранящиеся в гранулах, и АДФ (в том числе образующийся из АТФ). В результате действия сосудосуживающих веществ просвет поврежденных сосудов уменьшается (возникает функциональная ишемия) и перекрывается массой тромбоцитов, прилипших к коллагеновым волокнам.
432 ЧАСТЬ V. КРОВЬ И СИСТЕМА КРОВООБРАЩЕНИЯ
Необратимая агрегация тромбоцитов. Практически одновременно с вышеописанными процессами тромбин, образующийся в небольших количествах на этой стадии гемостаза под действием тканевого тромбопластина (см. ниже), инициирует необратимую агрегацию тромбоцитов. Реагируя со специфическими рецепторами в мембране тромбоцитов, тромбин вызывает фосфорилирование внутриклеточных белков и высвобождение ионов Са2+ . Этот эффект усиливается в присутствии АДФ и коллагена. В результате активируется Ca2+-зависимая фосфолипаза А2, катализирующая выделение арахидоновой кислоты. Последняя под действием фермента циклооксигеназы превращается в циклические эндопероксиды PGG2 и PGH2, из которых образуются сравнительно малоэффективные тромбоксаны А2 и В2 (рис. 18.9 и 18.11). Эндопероксиды и тромбоксан А2 инициируют необратимую агрегацию и распад еще большего числа тромбоцитов, из которых выделяются при этом вместе с содержимым биологически активные вещества. Кроме того, тромбоксан А2 усиливает суживание сосудов. При распаде тромбоцитов в среду выходят фосфолипопротеины их мембраны [35]. Ниже мы рассмотрим важную роль этих липопротеинов, называемых в совокупности тромбоцитарным фактором 3, в свертывании крови.
Точная последовательность событий, происходящих при активации тромбоцитов, пока не выяснена. Это связано, в частности, с тем, что на некоторых этапах реакций существует положительная обратная связь-активированные тромбоциты выделяют вещества, которые в свою очередь вызывают активацию тромбоцитов. В качестве примеров можно привести действие АДФ и петлю обратной связи, включающей активацию тромбоцитарного фактора 3 и эффект тромбина (рис. 18.11). Эти взаимодействия приводят к лавинообразному усилению процесса, т.е. тромбоциты все быстрее вовлекаются в реакцию.
Для необратимой агрегации тромбоцитов необходим также фибриноген. Это вещество не только служит предшественником фибрина, образующего сеть, в которой запутываются тромбоциты в ходе образования сгустка («вторичный гемостаз», см. ниже), но также вступает в специфическую реакцию с рецепторами активированных кровяных пластинок (гликопротеинами IIb и IIIа). У больных с недостатком этих рецепторов наблюдается повышенная кровоточивость, хотя количество тромбоцитов у них не снижено (тромбастения Гланцмана-Негели). Полагают, что подобно фибриногену действуют гликопротеины фибронектин и тромбоспондин, содержащиеся в α-гранулах кровяных пластинок (табл. 18.6).
К агрегации тромбоцитов даже в отсутствие внешних повреждений могут приводить дефекты эндотелиальной оболочки сосудов. С целью предупреждения тромбозов назначают препараты, снижающие ферментативную активность циклооксигеназы и тем самым тормозящие син-
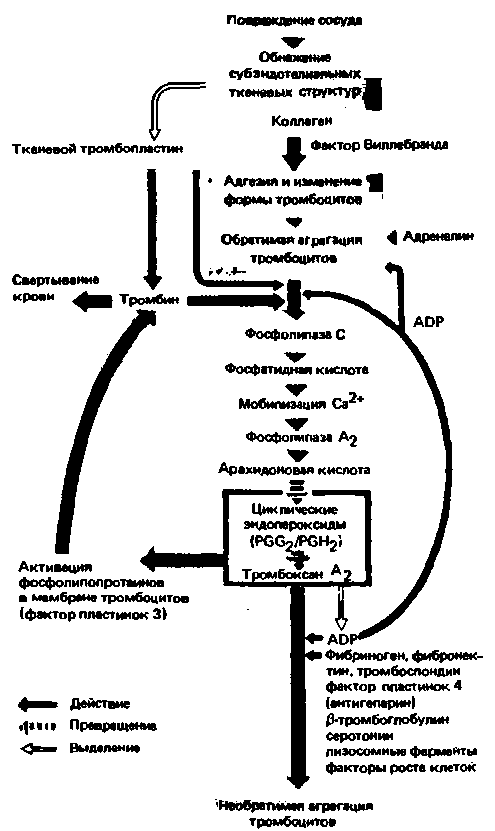 |
| Рис. 18.11. Схема активации и агрегации тромбоцитов |
тез тромбоксанов, (например, ацетилсалициловую кислоту) (рис. 18.9). Антиагрегационную активность ингибиторов циклооксигеназы следует также иметь в виду при лечении воспалительных ревматических заболеваний.
Свертывание крови. После того как образуется тромбоцитарный сгусток, степень сужения поврежденных сосудов уменьшается, что могло бы привести к вымыванию сгустка и возобновлению кровотечения. Однако к этому времени уже набирают достаточную силу процессы коагуляции фибрина в ходе вторичного гемостаза, обеспечивающего плотную закупорку поврежденных сосудов тромбом (красным кровяным сгустком), содержащим не только тромбоциты, но и другие клетки крови, в частности эритроциты.
Основные этапы свертывания крови были известны давно. Еще в 1905 г. Моравиц описал в
ГЛАВА 18. ФУНКЦИЯ КРОВИ 433
основном последовательность этих этапов, и его схема верна и поныне (рис. 18.12). Вне организма кровь свертывается за несколько минут. Под действием «активатора протромбина» (тромбокиназы), выделяющегося при разрушении тромбоцитов, белок плазмы протромбин превращается в тромбин. Последний вызывает расщепление растворенного в плазме фибриногена с образованием фибрина, волокна которого образуют основу тромба. В результате этого кровь превращается из жидкости в студенистую массу.
Последующие этапы. Через несколько часов волокна фибрина сжимаются (происходит ретракция фибрина), и из него как бы выдавливается светлая жидкость-сыворотка, т.е. лишенная фибриногена плазма. На месте сгустка остается плотный красный тромб, состоящий из сети волокон фибрина с захваченными ею клетками крови. В этом процессе также участвуют тромбоциты. В них содержится тромбостенин - белок, сходный с актомиозином и способный сокращаться за счет энергии АТР. Благодаря ретракции сгусток становится более плотным и стягивает края раны, что облегчает ее закрытие клетками соединительной ткани.
Спустя некоторое время после свертывания крови может наступить фаза фнбринолиза, при которой сгусток растворяется и сосуд снова становится проходимым для крови.
Свертывание крови и факторы свертывания
Основная последовательность этапов свертывания крови, представленная на рис. 18.12, в на-
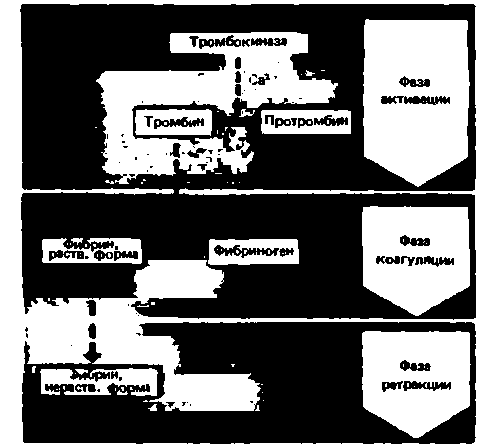 |
| Рис. 18.12. Классическая схема свертывания крови (по Моравицу) |
стоящее время существенно дополнена благодаря выявлению многих дополнительных факторов, необходимых для нормального свертывания. Отсутствие любого из этих факторов может привести к нарушению образования тромбина и процесса коагуляции (табл. 18.7). Различные факторы обозначаются соответствующими названиями или, более просто, римскими цифрами. В основном они представляют собой протеолитические ферменты (факторы XII, XI, X, IX, VII, II и калликреин-это сериновые протеазы), присутствующие в крови в неактивной форме в виде проферментов. В процессе свертывания они активируют друг друга в каскадной последовательности реакций. Активированные факторы обозначаются с прибавлением буквы «а» (например, На).
Начальные этапы свертывания. В результате разрушения тканевых клеток и активации тромбоцитов высвобождаются фосфолипопротенны, которые вместе с факторами плазмы Ха и Va, а также ионами Са2+ образуют ферментный комплекс, выполняющий функцию активатора протромбина. В зависимости от происхождения липопротеинов различают кровяной и тканевой активаторы протромбина. Когда процесс свертывания начинается под действием фосфолипопротеинов, выделяемых из клеток поврежденных сосудов или соединительной ткани, говорят о внешней системе свертывания крови; если же инициация происходит под влиянием факторов свертывания, присутствующих в плазме, используют термин внутренняя система свертывания. В организме обе эти системы дополняют друг друга (рис. 18.13).
Внешняя система активируется, когда липопротеины, выделяемые из тканевых клеток (тканевой тромбопластин), соединяются с фактором VII, который способен после этого в присутствии ионов кальция активировать фактор X.
Первый этап активации внутренней системы состоит в том, что фактор XII вступает в контакт с отрицательно заряженными поверхностями, например с коллагеном или in vitro со стеклом. В активации и действии фактора XII участвуют также высокомолекулярный кининоген и протеолитические ферменты, например калликреин, тромбин или трипсин. Далее следует активация факторов XI и IX. Фактор 1Ха после образования ферментного комплекса с тромбоцитарным фактором 3 и ионами Cα2 + активирует путем протеолиза фактор X. Эта реакция существенно ускоряется в присутствии фактора VIII, который в свою очередь активируется тромбином.
На нескольких из этих этапов существуют перекрестные взаимодействия между внешней и внутренней системами свертывания, благодаря чему обеспечиваются «альтернативные» пути для процессов коагуляции [33, 36). Так, фактор внешней системы Vlla и тканевой тромбо-
| Таблица 18.7. Факторы свертывания крови (а-активная форма [19, 25, 40] | |||||||
| Фактор | Название, синоним | Наиболее важное место образования | Мол. масса масса (х 10~3) | Средняя концентрация в плазме, мкмоль/мл | Свойства и функции | Синдром недостаточности | |
| | название | причины | |||||
| I | Фибриноген | Печень | 340 | 8,8 | Растворимый белок, предшественник фибриногена | Афибриногенемия, недостаточность фибриногена | Наследование по аутосомно-рецессивному типу; коагулопатия потребления, поражения печеночной паренхимы |
| II | Протромбин | Печень [(витамин К)зависимый синтез] | 72 | 1,4 | а1-Глобулин, профермент тромбина (протеаза) | Гипопротромбинемия | Наследование по аутосомно-рецессивному типу; поражения печени, недостаточность витамина К, коагулопатия потребления |
| III | Тканевой тромбопластин | Клетки тканей | | | Фосфолипопротеин; активен во внешней системе свертывания | | |
| IV | Са 2 + | | | 2500 | Необходим для активации большинства факторов свертывания | | |
| V | Проакцелерин, АК-глобулин | Печень | 330 | 0,03 | Растворимый ß-глобулин, связывается с мембраной тромбоцитов; активируется фактором IIа и Са2 + ; V, служит компонентом активатора протромбина | Парагемофилия, гипопроакцелеринемия | Наследование по аутосомно-рецессивному типу; поражения печени |
| VI | Изъят из классификации (активный фактор V) | | | | | | |
| VII | Проконвертин | Печень [(витамин К)зависимый синтез] | 63 | 0,03 | α-Глобулин, профермент (протеаза); фактор VII, вместе с фактором III и Са2+ активирует фактор X во внешней системе | Гипопроконвертинемия | Наследование по аутосомно-рецессивному типу; недостаточность витамина К |
| VIII | Антигемофильный глобулин, АГГ | ? (фактор Виллебранда (ФВ): эндотелий, мегакариоциты) | 260-10000 (полимерные комплексы с ФВ) | < 0,0004 | ß2-Глобулин, образует комплекс с фактором Виллебранда; активируется фактором II и Са2 + ; фактор VIIIa | Гемофилия А (классическая гемофилия); синдром Виллебранда | Наследование по рецессивному типу, сцепление с Х-хромосомой; наследование (обычно по аутосомно-доми- |
| | | | | | служит кофактором в превращении фактора X в фактор X, | | нантному типу) |
| IX | Фактор Кристмаса | Печень [(витамин К)зависимый синтез] | 57 | 0,09 | а1-Глобулин, контактчувствительный профермент (протеаза); фактор IX, вместе с фактором пластинок 3, фактором VIIIa и Са2 + активирует фактор X во внутренней системе | Гемофилия В | Наследование по рецессивному типу, сцепление с Х-хромосомой |
| χ | Фактор Стюарта- Прауэра | Печень [(витамин К)зависимый синтез] | 60 | 0,2 | а1-Глобулин, профермент (протеаза); фактор Ха служит компонентом активатора протромбина | Недостаточность фактора X | Наследование по аутосомно-рецессивному типу |
| XI | Плазменный предшественник тромбопластина (ППТ) | ? | 160 | 0,034 | γ-Глобулин, контактчувствительный профермент (протеаза); фактор XI, вместе с Са2+ активирует фактор IX | Недостаточность ППТ | Наследование по аутосомно-рецессивному типу, коагулопатия потребления |
| XII | Фактор Хагемана | ? | 80 | 0,45 | ß-Глобулин, контактчувствительный профермент (протеаза) (например, изменяет форму при контакте с поверхностями); активируется калликреином | Синдром Хагемана (обычно не проявляется клинически) | Наследование, обычно по аутосомно-рецессивному типу; коагулопатия потребления |
| XIII | Фибрин-стабилизирующий фактор | Мегакариоциты | 320 | 0,1 | ß-Глобулин, профермент (трансамидаза); фактор ХШа вызывает переплетение нитей фибрина | Недостаточность фактора XIII | Наследование по аутосомно-рецессивному типу, коагулопатия потребления |
| | Прекалликреин, фактор Флетчера | ? | 90 | 0,34 | ß-Глобулин, профермент (протеаза); активируется фактором ХПа; калликреин способствует активации факторов XII и XI | Обычно не проявляется клинически | Наследование |
| | Высокомолекулярный кининоген, фактор Фитцджеральда | ? | 160 | 0,5 | α-Глобулин; способствует контактной активации факторов XII и XI | То же | » |
436 ЧАСТЬ V. КРОВЬ И СИСТЕМА КРОВООБРАЩЕНИЯ
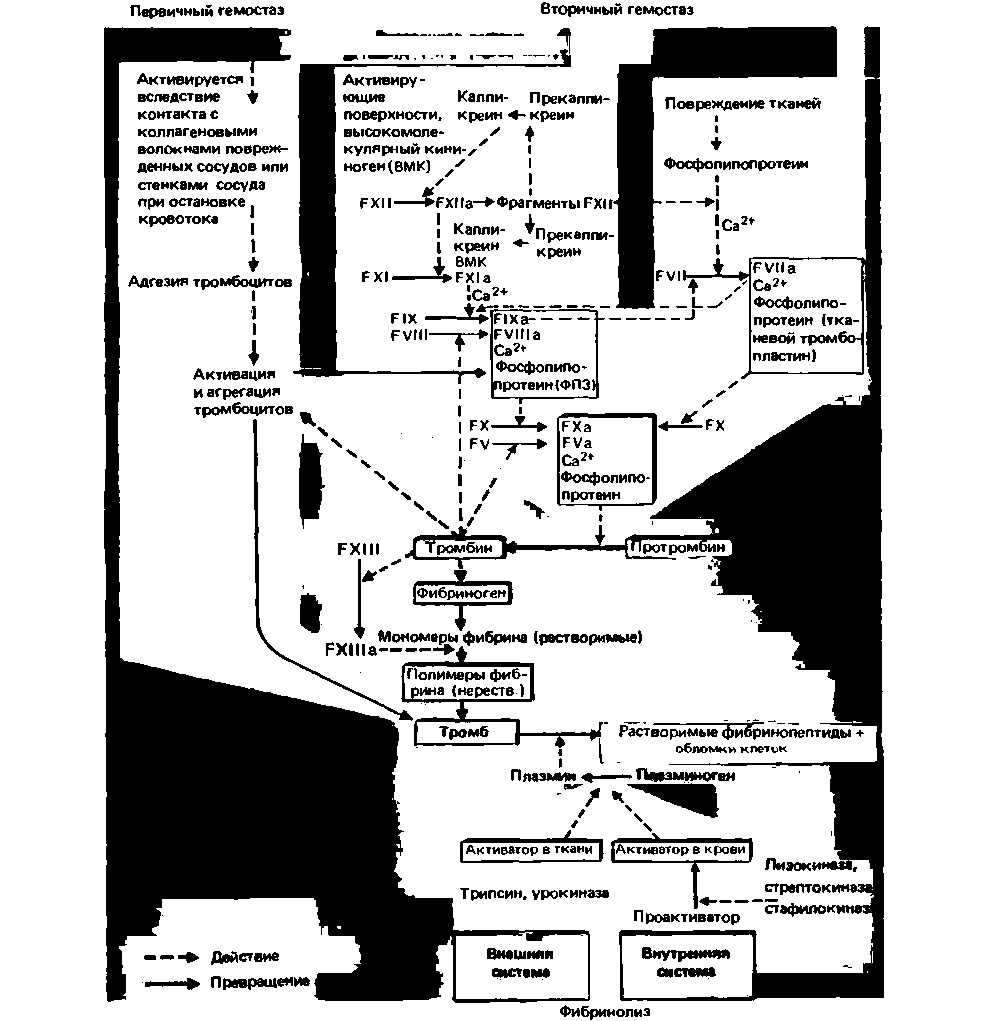 |
| Рис. 18.13. Схема свертывания крови и фибринолиза. Факторы свертывания охарактеризованы в табл. 18.7 (ТФЗ тромбоцитарный фактор 3) (по [14, 26, 35, 36] с изменениями) |
пластин также могут активировать фактор внутренней системы IX. Поэтому при недостатке факторов VIII или IX наблюдаются более тяжелые кровотечения, чем при дефиците факторов XI или XII: в последнем случае фактор IX может активироваться фактором VII.. С другой стороны, фактор VII может активироваться продуктами расщепления фактора XI и фактором IX, внутренней системы. Многие факторы свертывания, присутствующие в плазме, обнаружены также в тромбоцитах (табл. 18.6 и 18.7).
Образование тромбина. Активатор протромбина протеолитически расщепляет неактивный предшественник протромбин (мол. масса 72000), в результате чего образуется активный фермент тромбин (мол. масса 35000). Содержание протромбина в плазме здорового человека составляет 0,10-0,15 г на 1 л. Для образования протромбина в печени необходим витамин К, поэтому недос-
ГЛАВА 18. ФУНКЦИЯ КРОВИ 437
таток этого витамина (например, при нарушении всасывания жиров в кишечнике) приводит к расстройствам свертывания крови. Период полувыведения протромбина из плазмы равен 1,5-3 сут. Тромбин представляет собой пептидазу, особенно эффективно расщепляющую аргиниловые связи. Под действием тромбина наступает частичный протеолиз молекулы фибриногена.
Образование фибрина. Первый этап в образовании фибрина-это расщепление димера фибриногена (мол. масса 340000) на две субъединицы, каждая из которых состоит из трех полипептидных цепей (α, β, γ). При этом в результате действия тромбина разрушаются четыре аргинил-глициновые связи (по одной в каждой из двух α-цепей и в каждой из двух ß-цепей) и освобождаются два фибринопептида-А и В. Оба этих фибринопептида обладают сосудосуживающим действием. Мономеры фибрина, которые остаются после отделения фибринопептидов, вначале выстраиваются параллельно друг другу под действием электростатических сил, образуя так называемые полимеры фибрина. Для такой полимеризации необходимы фибринопептид А (фактор плазмы) и кальций. Образующийся при этом гель способен к обратному превращению в жидкую форму под действием веществ, разрывающих водородные связи, например мочевины. Для того чтобы между мономерами фибрина установились ковалентные связи, обусловливающие физико-химические свойства фибриновых нитей, необходим фибринстабилизирующнй фактор XIIIтрансглутаминаза, активируемая тромбином в присутствии ионов Са2+. Этот фактор обнаружен в цитозоле тромбоцитов и в плазме (табл. 18.7). Однако на этой стадии трехмерная сеть волокон фибрина, которая удерживает в больших количествах клетки крови и кровяные пластинки, все еще относительно рыхлая; свою окончательную форму она принимает после ретракции (см. выше).
Фибринолиз
Значение фибринолиза. Растворение кровяного сгустка-это такой же сложный процесс, как и его образование (рис. 18.14). В настоящее время считается, что в крови даже в отсутствие повреждения сосудов постоянно происходит превращение небольшого количества фибриногена в фибрин. Это превращение уравновешивается непрерывно протекающим фибринолизом. Лишь в том случае, когда свертывающая система дополнительно стимулируется в результате повреждения ткани, выработка фибрина в области повреждения начинает преобладать и наступает местное свертывание крови.
Активация фибринолиза. Один из глобулинов плазмы -плазминоген (профибринолизин, мол. масса 81000), как и протромбин, может под действием факторов тканей или крови (фибринолизокиназ) превращаться в активную форму -плазмин (фибринолизин). Активация плазмина обеспечивается механизмами, аналогичными внешней и внутренней свертывающим системам. Плазмин представляет собой сериновую протеазу. Тромболитическое действие плазмина обусловлено его сродством к фибрину. Плазмин отщепляет от фибрина путем гидролиза растворимые пептиды, которые тормозят действие тромбина и таким образом препятствуют дополнительному образованию фибрина. Плазмин расщепляет также другие факторы свертывания-фибриноген, факторы V, VII, IX, XI и XII. Благодаря этому он не только обладает тромболитическим эффектом, но и снижает свертываемость крови.
Активаторы плазмнногена, содержащиеся в тканях (особенно много их в мышечном слое матки), способны непосредственно превращать плазминоген в плазмин (рис. 18.13 и 18.14). Высокоактивным тканевым активатором является урокиназа, присутствующая в моче. Неизвестно, играет ли это вещество какую-либо роль в предупреждении образования или в растворении тромбов в мочевых путях или же просто экскретируется почками. Действие активаторов, имеющихся в крови (к ним относится и фактор свертывания VIIJ, проявляется лишь в присутствии так называемых проактиваторов. Важнейшие из проактиваторов (один из нихпрокалликреин)-это лизокиназы, высвобождающиеся из клеток крови при травматических или воспалительных повреждениях тканей. Для лечения тромбозов используют лизокиназу, вырабатываемую гемолитическим стрептококком,-стрептокиназу [14].
Протнвосвертывающие и фибрннолитнческие факторы в организме. В плазме содержится несколько сериновых протеаз-ингибиторов, подавляющих активность фибринобразующих и фибринолитических ферментов [19]. Особо важную роль в качестве противосвертывающего агента играет антитромбин III. Это вещество влияет на факторы Па, Ха, 1Ха, Х1а, ХПа и калликреин, препятствуя тем самым образованию и действию тромбина. К противосвертывающим веществам плазмы относятся также протеин С (тормозит факторы Va и VIHa), α1-макроглобулин (тормозит фактор IIа, калликреин и плазмин) и инактиватор CI (тормозит факторы Х1а и ХНа и калликреин).
Главный фактор, подавляющий фибринолитическую активность плазмина,—это а2-антиплазмин. Присутствуя в плазме, плазмин может свободно оказывать свой фибринолитический эффект только
438 ЧАСТЬ V. КРОВЬ И СИСТЕМА КРОВООБРАЩЕНИЯ
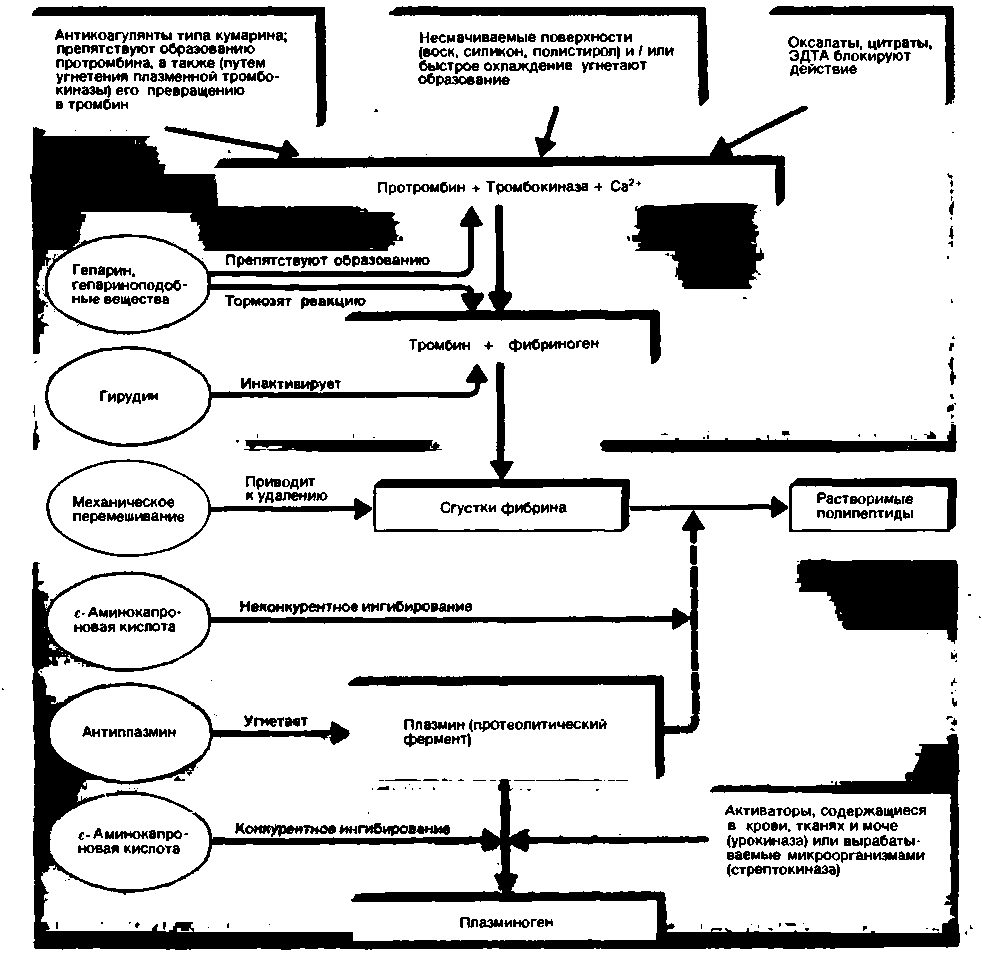 |
| Рис. 18.14. Механизм действия некоторых антикоагулянтов и фибринолитических препаратов (по [3] с изменениями) |
во внутренних слоях тромба, где плазминоген связывается с фибрином. В этих слоях концентрация плазмина высока, а концентрация а2-антиплазмина мала, гак как последний проникает из крови в сгусток лишь путем медленной диффузии из крови. В качестве лекарственных препаратов, тормозящих фибринолиз, используют синтетические ингибиторы протеаз типа ε-аминокапроновой кислоты. Их действие проиллюстрировано на рис. 18.14.
Нарушения и предупреждение свертывания крови; анализ свертывающей активности крови
Для того чтобы кровоток в обычном состоянии не нарушался, а при необходимости наступало эффективное свертывание крови, необходимо поддержание равновесия между факторами плазмы, тромбоцитов н тканей, способствующими свертыванию и тормозящими его. Если это равновесие нарушается, возникает либо кровоточивость, либо повышенное тромбообразование. Последнее состояние в клинике встречается чаще.
К симптомам нарушений свертывания относятся кро-
ГЛАВА 18. ФУНКЦИЯ КРОВИ 439
воизлияния (гематомы) и тяжелые неостанавливающиеся кровотечения, чаще в области суставов; они связаны с отдельными сравнительно крупными сосудами и обычно вызваны травмой. В отличие от этого при тромбоцитарной патологии спонтанно возникают мелкие капиллярные кровоизлияния (см.- выше).
Наследственная недостаточность факторов свертывания в плазме (обычно нескольких) может проявляться после тяжелых кровотечений (коагулопатия потребления) или при инфекционных заболеваниях. Свертывание крови нередко нарушается при тяжелых воспалительных и дегенеративных заболеианиях печени в результате резкого подавления синтеза протромбина и факторов II, VII, IX и X. Нарушение свертывания наступает также при недостатке витамина К (жирорастворимый витамин, содержащийся в растительной пище и синтезируемый микрофлорой кишечника) в отсутствие каких бы то ни было поражений печени. Эндогенный дефицит витамина К наблюдается при угнетении всасывания жиров в кишечнике, например при снижении желчеобразования, а также при подавлении кишечной микрофлрры антибиотиками. Этот витамин необходим для нормального синтеза факторов II, VII, IX и X в печени.
Существуют врожденные состоянии дефицита-заболевания, при которых нарушена активность, как правило, только одного фактора свертывания (см. табл. 18.7). Сцепленное с полом рецессивно наследуемое заболевание гемофилия (оно поражает мужчин, а женщины являются носителями) обусловлено в большинстве случаев отсутствием фактора VIII (гемофилия А). В некоторых случаях наблюдается дефицит фактора IX (гемофилия В). По клинической картине, характеру наследования и патологии две формы неразличимы, как показывают пробы на свертывание крови.
Предотвращение свертывания крови (рис. 18.14). Свертывание вытекшей из сосуда крови замедляется, хотя и не подавляется полностью, при охлаждении. Свертывание взятой для анализа крови можно также замедлить, используя иглы и сосуды с несмачиваемым силиконовым или парафиновым покрытием. В отличие от шероховатых поверхностей такие покрытия не вызывают агрегации тромбоцитов с их последующим разрушением, вследствие чего образование тромбина значительно замедляется. Свертывание in vitro подавляют также вещества, удаляющие из раствора ионы кальция, необходимые на многих этапах свертывания. Эти вещества связывают кальций и переводят его в относительно нерастворимую или слабо диссоциирующую форму. К ним относятся оксалаты натрия, калия или аммония, цитрат натрии и хелатобразующее соединение -этилендиаминтетраацетат (ЭДТА). Чаще всего используют цитрат натрия, так как это вещество в малых дозах нетоксично, и поэтому случайное попадание его в кровоток при взятии крови не представляет опасности.
Гепарин тормозит свертывание как in vivo, так и in vitro. Этот антикоагулянт представляет собой смесь полисульфатированных эфиров гликозаминогликанов; его особенно много в печени, легких, сердце и мышцах, а также в тучных клетках и базофилах. Гепарин образует комплекс (называемый антитромбином II) с антитромбином III, повышая тем самым эффективность антитромбина III и подавляя образование и действие тромбина.
Кроме того, гепарин служит активатором фибрииолиза и поэтому способствует растворению сгустков крови. При передозировке гепарина в качестве антагониста можно использовать основной хлорид протамина, связывающийся с гепарином с образованием неактивного комплекса.
Поскольку гепарин приходится вводить парентерально и, кроме того, он очень быстро разрушается и выводится из организма (действие его продолжается всего 4-6 ч), в клинике предпочитают для длительной антикоагулянтной терапии использовать производные кумарина. Эти препараты, эффективные при приеме внутрь, действуют как антагонисты витамина К: они препятствуют связыванию этого витамина с его апоферментом (γ-глутамилкарбоксилазой) в печени. Действие производных кумарина подавляется при повышении концентрации витамина К по принципу конкурентного ингибирования.
Другие антикоагулянты. Существуют не только противосвертывающие вещества общего действия, но также местные агенты. Одним из них является гирудин - вещество с антитромбиновой активностью, содержащееся в слюне медицинской пиявки. Противосвертываюшее действие некоторых змеиных ядов связано с тем, что они подавляют образование фибрина. Слюна кровососущих насекомых также обладает антикоагулянтной активностью: так, из слюнной железы слепня (Tahanus) было выделено антитромбиновое вещество табанин.
Анализ иа свертываемость крови. Для определения времени рекальцификации кровь, смешанную с цитратом натрия, помещают в пробирку со стеклянной бусиной. Пробирку оставляют медленно вращаться в наклонном положении в водяной бане при 37 "С. После выравнивания температур в кровь добавляют в избытке хлористый кальций и измеряют время до начала образования сгустка (момент, когда стеклянная бусина начинает вращаться вместе с пробиркой). В норме это время равно 80-130 с.
Тромбопластиновое время (проба Квика) это наиболее распространенный тест на эффективность терапии препаратами кумарина. При постановке пробы к плазме, обработанной оксалатами либо цитратами, добавляют смесь, содержащую в избытке тканевой тромбопластин и хлорид кальция, после чего определяют время свертывания. Отклонение этого времени от нормы (~ 14 с) связано с пониженным содержанием факторов внешней свертывающей системы, протромбина или фибриногена.
При определении частичного тромбопластинового времени (ЧТВ) к плазме, обработанной цитратами, добавляют в избытке тромбоцитарный фактор 3 и хлорид кальция, после чего определяют время свертывания. С помощью этого теста исследуют активность внутренней системы свертывания (например, факторов VIII и IX), а также протромбина и фибриногена. Норма составляет 40-50 с.
Для определения тромбинового времени (ТВ) измеряют время свертывания после добавления к плазме, содержащей цитрат, стандартного раствора тромбина. Этот тест используют для определения недостатка фибриногена или эффективности фибринолитической терапии с применением стрептокииазы. Норма составляет 17-24 с.
440 ЧАСТЬ V. КРОВЬ И СИСТЕМА КРОВООБРАЩЕНИЯ
