Дипломная работа
| Вид материала | Диплом |
- Дипломная работа по истории, 400.74kb.
- Дипломная работа мгоу 2001 Арапов, 688.73kb.
- Методические указания по дипломному проектированию дипломная работа по учебной дисциплине, 620.15kb.
- Дипломная работа выполнена на тему: «Ресторанный комплекс при клубе знаменитых людей:, 638.16kb.
- Дипломная работа: выполнение и защита методические рекомендации, 248.83kb.
- Дипломная работа Антона Кондратова на тему «Интернет-коммуникации в деятельности предприятия, 1083.86kb.
- Итоги VII всероссийского конкурса «Лучшая студенческая дипломная работа в области маркетинга», 99.02kb.
- Выпускная квалификационная (дипломная) работа методические указания по подготовке,, 629.59kb.
- Дипломная Работа на тему Аспекты взаимодействия категорий Языковая одушевленность неодушевленность, 908.09kb.
- Дипломная работа тема: Анализ удовлетворенности потребителей на рынке стоматологических, 187.27kb.
ГЛАВА III. РЕЗУЛЬТАТЫ ИСЛЕДОВАНИЯ
1. Влияние окситоцина на болевую чувствительность белых крыс при 5-ти дневном введении препарата в дозе 0,001 мг/кг
В ходе проведённого исследования на первом этапе эксперимента было обнаружено изменение болевой чувствительности под действием окситоцина. В результате 5-ти дневного системного введения окситоцина в дозе 0,001 мг/кг выявлен двухфазный характер ответной реакции белых беспородных крыс. Впервые два дня наблюдалось повышение болевой чувствительности, характеризующиеся снижением латентного периода (ЛП) реакции одёргивания хвоста. Так в первый день наблюдается снижение эффекта на 1,2 сек по сравнению с контролем на 40-й минуте. На 2-й день достоверные отличия наблюдались уже на 20-й минуте после введения и были более выражены (рис.№1) .Далее полученные данные указывают на то, что начиная с 3-го дня инъекций окситоцина меняется ответная реакция организма белых крыс на болевой стимул. На 4-й день инъекций наблюдается достоверное увеличение ЛП реакции одёргивания хвоста на 30-й минуте после введения пептида на 1,5; а на 5-й день с 20 по 50 минуты и максимуме составило 2 секунды (рис. №1).
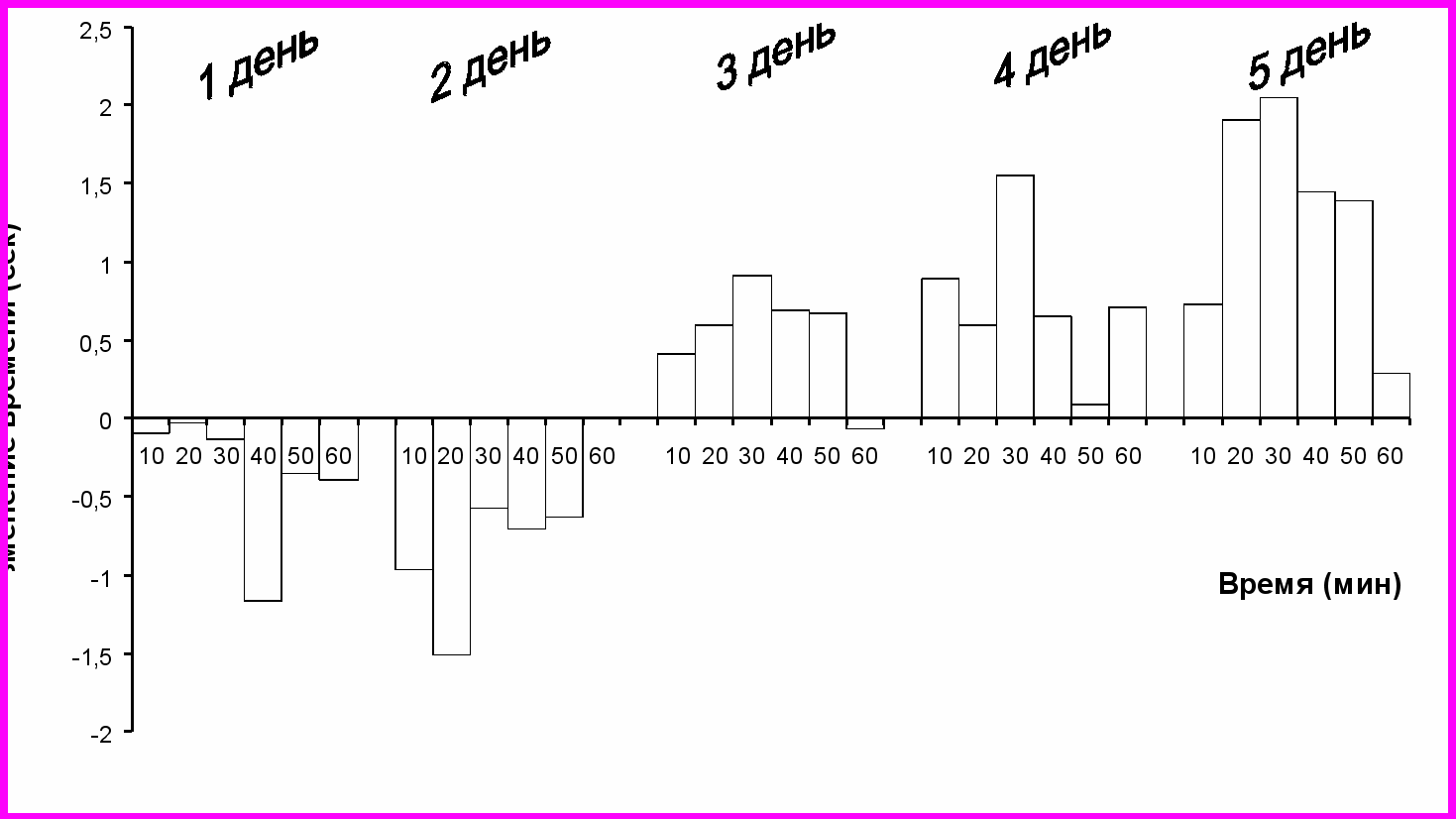 Рисунок 1. Динамика изменения латентного периода в тесте "tail-flick" при хроническом введении окситоцина в дозе 0,001мг/кг (*- различия достоверны при р<0,05)
Рисунок 1. Динамика изменения латентного периода в тесте "tail-flick" при хроническом введении окситоцина в дозе 0,001мг/кг (*- различия достоверны при р<0,05) 2. Влияние окситоцина на болевую чувствительность белых крыс после 5-ти дневного введении препарата в дозе 0,001 мг/кг
Исследование динамики болевой чувствительности в последующий период, т.е. на 6-й день после 1-й инъекции и на 1-й после прекращения фармакологического воздействия показал, что эффект сохранился и после окончания инъецирования крыс окситоцинjv в течении одного дня.(рис №2), в этот день наблюдается достоверное увеличение латентного периода реакции отдергивания хвоста на 30 и 60 минуте и в максимуме составило 3,7 секунды на 30 минуте. В последующие дни достоверных изменений болевой чувствительности не обнаружено.
3. Влияние окситоцина на болевую чувствительность белых крыс при однократном введении препарата в дозе 0,05 мг/кг
В следующей серии экспериментов было исследовано 50-ти кратное увеличение дозы при однократном введении. Как видно из рисунка №3 окситоцинв дозе 0,05 мг/кг приводит к достоверному пролонгированному анальгетическому эффекту. Достоверное увеличение латентного периода реакции отдергивания хвоста по сравнении с контролем при этом наблюдается с 20 по 90 мин эксперимента и в максимуме ЛП реакции одёргивания хвоста увеличился на 5,2 сек по сравнению с контролем на 20 минуте (рис. №3).
Анальгетический эффект ОТ при однократном введении препарата в дозе 0,05 мг/кг на 60% выше чем при хроническом введении ОТ в дозе 0,001 мг/кг
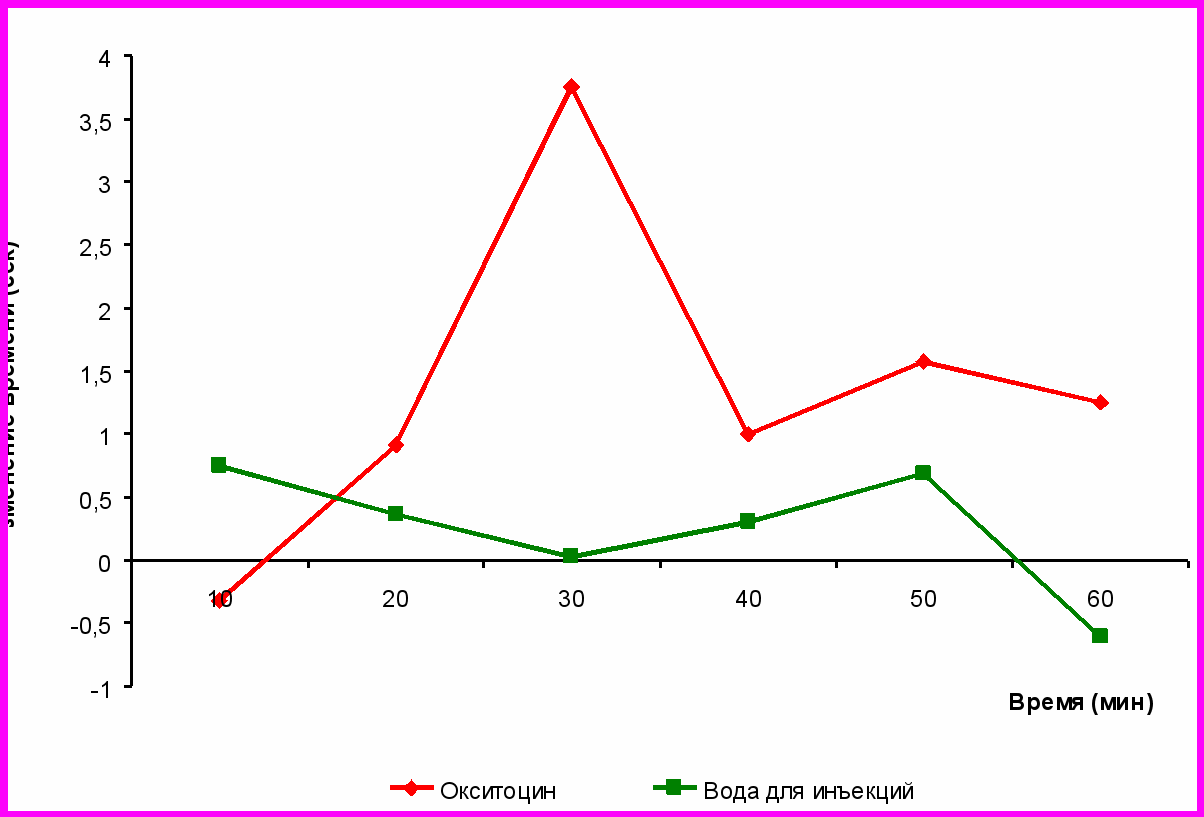
Рисунок 2. Изменение латентного периода реакции в тесте tail-flick на 5 день хронического введения окситоцина в дозе 0,001 мг/кг (* - различия достоверны при р < 0,05).
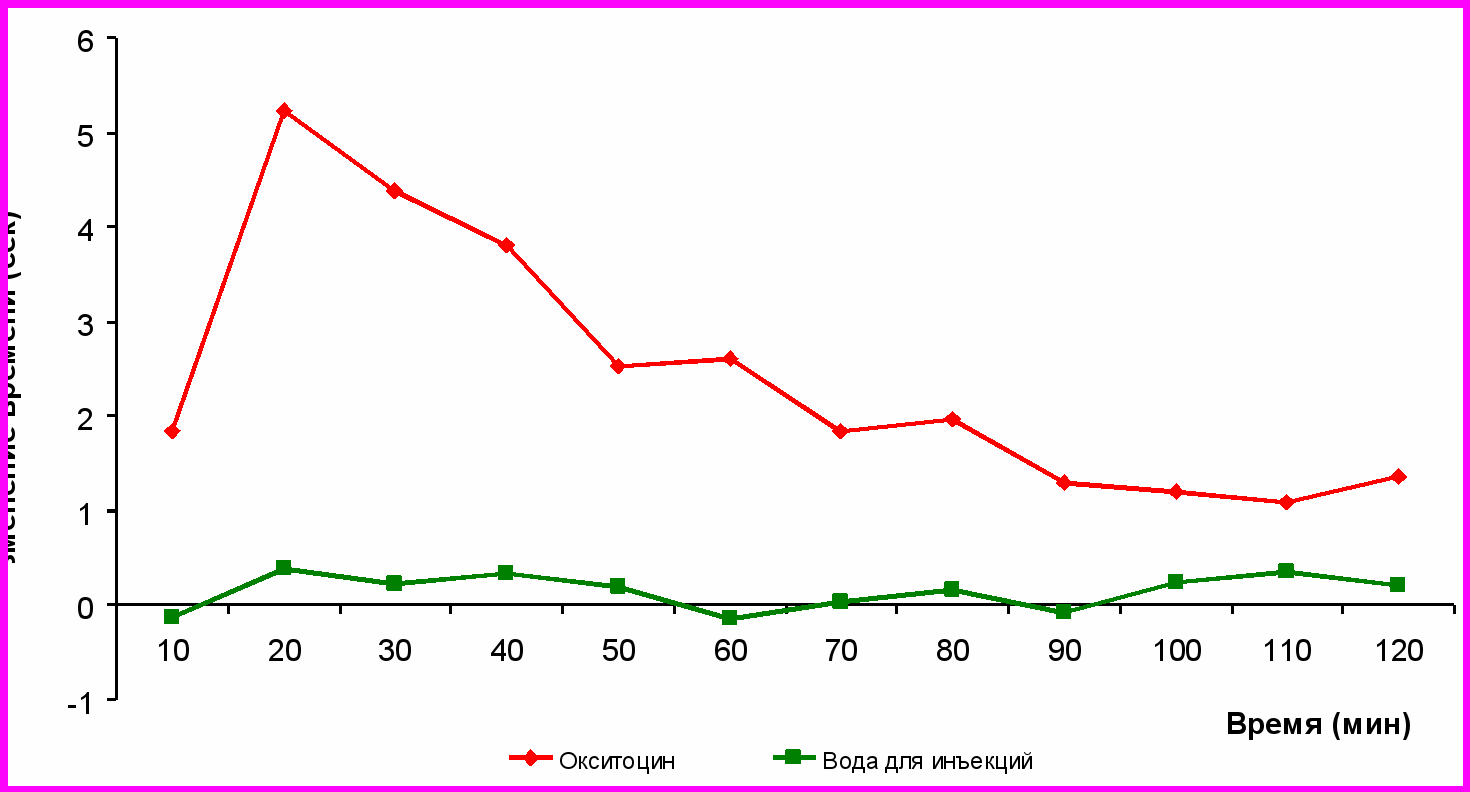
Рисунок 3. Изменение латентного периода реакции в тесте tail-flick под влиянием однократного введения окситоцина в дозе 0,05 мг/кг (*- различия достоверны при р<0,05)

Рисунок 4. Изменение латентного периода реакции в тесте tail-flick (*- различия достоверны при р<0,05)
4. Определение возможного механизма анальгетического действия окситоцина
В ходе третьего этапа эксперимента выявлено увеличение латентного периода реакции отдёргивания хвоста на 25 – 39 % с 20 по 90 минуту под воздействием инъекций окситоцина в дозе 0,05 мг/кг Данный эффект полностью блокировался предварительной инъекцией налоксона. О чем свидетельствует отсутствие достоверных отличий измеряемого показателя по отношению к контролю у второй группы животных, которым осуществляли совместные инъекции налоксона и окситоцина (рис. 4.). Среди групп животных, которым вводили налоксон и окситоцин, налоксон и воду для инъекций, двукратно воду для инъекций достверных отличий не обнаружено. Из этого следует, что налоксон блокирует анальгетический эффект окситоцина.
ГЛАВА III. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Возможно, что усиление эффекта при 5-ти дневном введении (I этап эксперимента) в первые 2 дня введения связанно с повышением чувствительности рецепторных структур, с которыми связывается ОТ. Известно, что характер влияния на болевую чувствительность может зависеть от способа введения и дозировки вводимого пептида (Agren G. et al. 1997). Таким образом можно предположить, что используемая доза ОТ 0,001мг/кг вызывает ноцицептивный эффект. Дальнейшие введение ОТ вызывает аккомуляцию и активацию окситоциновых структур. Подобный антиноцицептивный эффект отмечен и в литературе при однократном введении, однако доза вводимого вещества составляла 0,1 и 1,0 мг/кг(Xu XJ., Wiesenfeid-Halin Z.,1994; Agren G. et al. 1997). Можно предположить, что изменение эффекта на третий и последующие дни связано либо с увеличением количества активных рецепторов, чувствительных к ОТ, либо развитием сенсибилизации в уже имеющихся окситоциновых структурах. Не предоставляется возможным связать наблюдаемый эффект с повышением концентрации ОТ в организме, т.к. период его полураспада составляет 30 - 60 мин(Машковский М.Д.,2004).
Сохранение анальгетического эффекта в течение суток после прекращения инъекций можно объяснить возможной опосредованной активацией окситоцином эндогенной опиоидной системы организма, которая обладает способностью внутренней регуляции болевой чувствительности (Petersson, Alster, 1996).
Возможно усиление анальгетического эффекта окситоцина на II этапе эксперимента зависит от увеличения дозы препарата, что может указывать на его дозозависимость, но потлвержление данного факта требует дополнительных исследований. Длительность наблюдаемого эффекта, возможно, связана с запуском сложного каскада реакций, определяющих уровень активности как медиаторных (например серотонинергических) (Lundeberg T. et al.,1994), так и опиоидных структур(Petersson, Alster, 1996).
В ходе третьего этапа исследования выявлено увеличение латентного периода реакции отдёргивания хвоста на 25 – 39 % с 20 по 90 минуту под воздействием инъекций окситоцина. Данный эффект полностью блокировался предварительной инъекцией налоксона. О чем свидетельствует отсутствие достоверных отличий измеряемого показателя по отношению к контролю у второй группы животных, которым осуществляли совместные инъекции налоксона и окситоцина.
Известно, что налоксон используется при реанимации больных в случае передозировки наркотических средств, как антагонист опиатных рецепторов. Таким образом, можно предположить, что обнаруженный анальгетический эффект окситоцина опосредуется через опиатные рецепторы. Этот факт подтверждается результатами исследований Galina Z. и Kastin A.(1988) по данным которых фрагмент окситоцина выступает компонентом эндогенной антиопиоидной системы. Имеются также литературные данные о том, что окситоцин и опиаты вступают в конкурентные взаимоотношения друг с другом (Ибрагимов Р.Ш. 1990, You ea 2000), так опиоидные пептиды оказывают ингибиторное влияние на функцию окситоциновых нейронов (Басиева О.З. 1999)
