«Уральской государственной медицинской академии дополнительного образования Федерального агентства по здравоохранению и социальному развитию»
| Вид материала | Автореферат |
- «Ставропольской государственной медицинской академии Федерального агентства по здравоохранению, 531.55kb.
- Неспецифический остеомиелит позвоночника у взрослых (клиника, диагностика и лечение), 646.42kb.
- У населения крайнего севера, 1162.99kb.
- Российской Медицинской Академии последипломного образования по адресу: 123995, г. Москва,, 527.38kb.
- «Челябинской государственной медицинской академии Федерального агентства по здравоохранению, 754.08kb.
- «Санкт-Петербургская медицинская академия последипломного образования Федерального, 272.02kb.
- Особенности кардио-респираторной системы у больных зрелого возраста с воронкообразной, 306.11kb.
- «Санкт-Петербургской медицинская академия последипломного образования Федерального, 273.93kb.
- «Санкт-Петербургская медицинская академия последипломного образования Федерального, 365.8kb.
- «Санкт-Петербургская медицинская академия последипломного образования Федерального, 462.12kb.
Таким образом, данные эхокардиографии выявили у больных АГ всех стадий, осложненной НПНКМ и ДЭП I ст. более выраженные структурно-функциональные изменения сердца по сравнению с больными изолированной кардиальной АГ и группой контроля. Это, прежде всего, проявляется в динамике ИММЛЖ (рис. 6.).
Нарастание ИММЛЖ происходит уже у пациентов с изолированной кардиальной АГ I стадии и с АГ I, сочетанной с НПНКМ и ДЭП I ст., хотя достоверность различий отсутствует. Достоверно увеличивается ИММЛЖ при изолированной кардиальной АГ II и III стадий (р<0,05), наиболее выражен при АГ III в сочетании с НПНКМ и ДЭП I ст. (р<0,05) по сравнению с контрольной группой и изолированной кардиальной АГ I стадии, что подтверждает соответствие группированию больных по стадиям АГ.
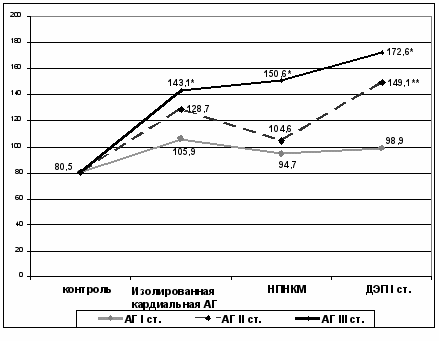
Примечание: * Р < 0,01 – достоверность различий АГ III ст. с АГ I ст. и АГ II ст. у больных с изолированной кардиальной и сочетанной с НПНКМ и ДЭП I.
** Р < 0,01 – достоверность различий АГ II ст. с АГ I ст. сочетанной с ДЭП I.
Рис. 6. ИММЛЖ по данным ЭХОКГ у больных АГ изолированной и сочетанной с НПНКМ и ДЭП I ст., и контрольной группы (гр/м2).
Прогрессивное снижение ФВ от I стадии к III стадии изолированной кардиальной АГ и при всех стадиях АГ, сочетанной с НПНКМ и ДЭП I ст. (р<0,05) позволяет сделать заключение о том, что одним из механизмов формирования НПНКМ и ДЭП I ст. у больных АГ является не только ГЛЖ, но и хроническая сердечная недостаточность.
Корреляционный анализ в группе контроля выявил прямую линейную связь ИММЛЖ с САД (R=0,63; p<0,05) и ДАД (R=0,66; p<0,05).
При изолированной кардиальной АГ I стадии выявлена прямая линейная зависимость между толщиной МЖП и ЗСЛЖ (R=0,51; p<0,05); ФВ имеет сильную обратную линейную связь с церулоплазмином (R=– 0,87; p<0,05), и сильную прямую связь с МДА (R=0,88; p<0,05); толщина ЗСЛЖ имеет прямую линейную связь с ОХ (R=0,69; p<0,05).
При I стадии АГ, сочетанной с НПНКМ выявлена сильная обратная линейная зависимость ИММЛЖ с САД (R=– 0,88; p<0,05), ДАД (R=– 0,88; p<0,05), АД ср. (R=– 0,92; p<0,05) и АТ III (R=– 0,97; p<0,05); выявлена прямая пропорциональная линейная зависимость ФВ и PI ОСА (R=1,0; p<0,05); ИММЛЖ с ТВ (R=0,83; p<0,05), Е 220 (R=0,81; p<0,05), Е 232 (R=0,79; p<0,05), индексом Кердо (R=0,76; p<0,05),а S с КА (R=0,82; p<0,05)
При I стадии АГ, сочетанной с ДЭП I ст. ФВ имеет обратную линейную связь с PI ОСА (R=– 0,70; p<0,05), PI ВСА (R=– 0,80; p<0,05), PI ПА (R=– 0,70; p<0,05) и прямо пропорциональную линейную зависимость с Е 278 (R=1,0; p<0,05). Утолщение МЖП обратно пропорционально Е 232/ Е 220 (R=– 1,0; p<0,05). Увеличение ЗСЛЖ прямо пропорционально Е 278/ Е 220 (R=1,0; p<0,05) и имеет сильную прямую связь с Pi ВСА (R=0,80; p<0,05). Кроме того, наличие обратной линейной зависимости выявлено между размерами ЗСЛЖ и показателем SDNN (R=– 0,70; p<0,05). ИММЛЖ имеет сильную обратную линейную зависимость с гипертоническим типом РЭГ (R=–0,80; p<0,05; R=– 0,90; p<0,05; R=– 0,80; p<0,05 соответственно) и прямую линейную связь с АПТВ (R=0,80; p<0,05), САД и ДАД (R=0,60; p<0,05; R=0,60; p<0,05).
Клинико-функциональные характеристики цереброваскулярных расстройств
Ультразвуковая диагностика (УЗДГ) магистральных артерий головы и транскраниальная допплерография (ТКДГ). При изолированной АГ I стадии установлены изменения систолической линейной скорости кровотока (ЛСК) по экстра- и интракраниальным артериям (табл. 4), снижение индекса цереброваскулярной реактивности (рис. 7.), гемодинамически не значимый стеноз артерий у 27% с асимметричность кровотока у 45%, в системе магистральных артерий головы (МАГ) регистрируются явления вазоконстрикции в каротидном бассейне.
Таблица 4
Показатели систолической линейной скорости кровотока в экстракраниальных и интракраниальных сосудах при АГ I стадии по данным УЗДГ и ТКДГ
| Показатели | Контроль (n=23) | АГ I стадии | Р | ||
| Неослож-ненная АГ I (n=28) | АГ I, осложненная: | ||||
| НПНКМ (n=52) | ДЭП I стадии (n=28) | ||||
| 1 | 2 | 3 | 4 | ||
| Показатели кровотока в экстракраниальных сосудах по данным УЗДГ | |||||
| Систолическая ЛСК см/сек По ОСА | 81,23±0,69 | 73,11±1,41 | 80,43±0,97 | 80,04±0,64 | р1-2<0,01 р2-3<0,05 р2-4<0,05 |
| Систолическая ЛСК см/сек По ВСА | 72,75±0,35 | 74,58±1,61 | 67,43±0,39 | 59,17±0,84 | р1-3<0,01 р1-4<0,01 р2-3<0,05 р2-4<0,05 р3-4<0,05 |
| Систолическая ЛСК см/сек По НСА | 76,82±0,40 | 80,42±1,68 | 81,29±0,69 | 72,50±0,41 | р1-4<0,05 р3-4<0,05 |
| Систолическая ЛСК см/сек По ПА (1) | 66,30±0,84 | 60,98±1,49 | 69,43±0,44 | 62,83±0,67 | р1-2<0,01 р1-4<0,01 р2-3<0,05 р3-4<0,05 |
| Показатели кровотока в интракраниальных сосудах по данным ТКДГ | |||||
| Систолическая ЛСК см/сек По ОА | 54,37±0,42 | 56,00±1,42 | 57,90±0,94 | 49,17±0,34 | р1-4<0,01 р2-4<0,05 р3-4<0,01 |
| Систолическая ЛСК см/сек По СМА | 86,50±0,76 | 81,52±2,74 | 73,40±0,68 | 70,21±0,42 | р1-3<0,01 р1-4<0,01 р2-3<0,05 р2-4<0,05 |
| Систолическая ЛСК см/сек По ПМА | 86,91±0,39 | 75,87±1,64 | 75,11±0,68 | 61,52±0,97 | р1-2<0,01 р1-3<0,01 р1-4<0,01 р2-4<0,05 р3-4<0,05 |
| Систолическая ЛСК см/сек По ЗМА | 51,75±0,27 | 58,18±3,71 | 58,22±0,48 | 48,50±1,07 | р1-2<0,05 р1-3<0,05 р2-4<0,05 р3-4<0,05 |
| Систолическая ЛСК см/сек По ПА (4) | 48,53±0,45 | 54,44±2,81 | 47,25±0,37 | 41,50±0,89 | р1-2<0,05 р2-4<0,05 |
Эти данные представляют особый интерес поскольку при отсутствии клинических признаках поражения сердца и головного мозга, и признаков ГЛЖ по стандартным критериям, уже имеются морфологические изменения экстра- и интракраниальных сосудов с изменением кровотока. Это характеризует скрытую стадию цереброваскулярных расстройств при изолированной АГ I ст.
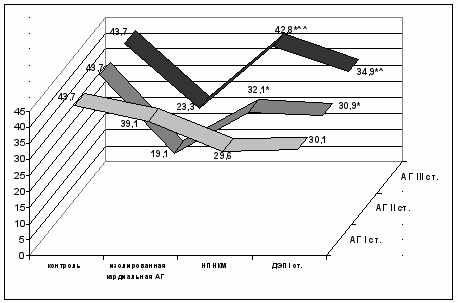
* Р < 0,05 – достоверность различий изолированной кардиальной АГ с АГ сочетанной с НПНКМ и ДЭП I.
Р < 0,05 – достоверность различий АГ, сочетанной с НПНКМ и АГ в сочетании с ДЭП I у больных АГ III ст.
Р < 0,05 – достоверность различий АГ I ст. и АГ III ст. в сочетании с НПНКМ.
Рис. 7. Индекс цереброваскулярной реактивности у больных с АГ, изолированной и сочетанной с НПНКМ или ДЭП I ст., и контрольной группы по показателям ТКДГ
При изолированной кардиальной АГ II и III стадий наблюдается дальнейшее усугубление структурно-функциональных нарушений в цереброваскулярной системе. Несмотря на снижение ИЦВР и ангиодистонические явления в микроциркуляторном русле, в системе МАГ регистрируются явления вазоконстрикции как в системе каротид, так и в вертебро-базилярном бассейне (р < 0,05). Это сопровождается стабилизацией церебральной гемодинамики, что отражается на нормализации линейных скоростей в интрацеребральных сосудах (табл. 4).
Все это свидетельствует о сохранности компенсаторных возможностей у больных изолированной кардиальной АГ, поскольку первым эффекторным звеном регулирования мозгового кровотока являются МАГ. Пиальные же артерии осуществляют второй этап регулирования в тех случаях, когда изменения АД очень значительны или механизмы МАГ несовершенны (Г.И. Мчедлишвили, 1980). Однако в условиях внекризового состояния АГ эти данные, вероятнее всего, свидетельствуют о начальной стадии ремоделирования церебральной сосудистой системы на уровне первого эффекторного звена ауторегуляции мозгового кровотока, а именно МАГ, т.к. это артерии крупного калибра мышечного типа.
При АГ I стадии, сочетанной с НПНКМ по сравнению с контрольной группой, достоверно увеличивается ЛСК и индекс пульсации Гослинга (PI) по ПА (1) и снижается по ВСА; повышается ЛСК по ОА, ЗМА и PI по СМА, снижается ЛСК СМА, ПМА и индекс цереброваскулярной реактивности (ИЦВР); выявляется асимметричность кровотока у 40%, повышен коэффициент асимметрии по ВСА; у 42% дефицит мозгового кровотока в вертебро-базилярном бассейне (ВББ); наблюдается гиперрезистивность микроциркуляторного русла в КБ и гипорезистивность дистального русла в ВББ. При АГ II и III стадий, осложненных НПНКМ происходит нарастание всех показателей структурно-функциональных нарушений цереброваскулярной системы, возникает несоответствие между метаболическими потребностями мозговой ткани и уровнем ее кровоснабжения, когда первичным звеном регулирования церебрального кровотока становится система пиальных артерий. Инициируется это только в условиях дополнительных нагрузок, сопровождающихся активацией неспецифических регуляторных систем головного мозга, но это не обеспечивает оптимального кровоснабжения коры головного мозга, что обуславливает в этих условиях клиническую манифестацию НПНКМ в виде синдрома субъективных ощущений, ауторегуляция мозгового кровотока становится несовершенной, имеет тенденцию к ее срывам при стрессовых ситуациях.
При АГ I стадии, сочетанной с ДЭП I ст. по сравнению с АГ I стадии, сочетанной с НПНКМ достоверно снижена ЛСК по всем экстра- и интракраниальным артериям, выражена извитость, ангиоспазм у 64%, явления атеросклероза у 53% и асимметричности кровотока у 14%, дефицит мозгового артериального кровотока у 86%, причем у половины сочетание в каротидном и вертебро-базилярном бассейнах; наблюдается гиперрезистивность микроциркуляторного русла в каротидном бассейне и гипорезистивность дистального русла в вертебро-базилярном бассейне. При АГ II и III стадий, сочетанных с ДЭП I ст. достоверно нарастает степень выраженности структурно-функционального ремоделирования сердца и цереброваскулярной системы. У больных АГ, осложненной ДЭП I ст. уже при первой стадии повышен тонус всех прецеребральных артерий, при этом у 75% больных сохраняется механизм экстракраниального демпфирования, поддерживающий каротидный градиент. Нарастает асимметрия кровотока по общим и внутренним сонным артериям, достигая уровня 25%. При второй и третьей стадиях АГ увеличивается до 40% число больных с нарушением каротидного градиента, что значительно снижает защитные механизмы постоянства мозговой гемодинамики и повышает риск церебральных осложнений. Значительно снижаются скоростные показатели по позвоночным артериям. Нарастает межполушарная асимметрия по средним, передним и задним мозговым артериям и особенно по позвоночным артериям. Микроциркуляция в вертебробазилярной системе с признаками патологической вазодилатации артериол. Нарастает артерио-венозное равновесие в виде затруднения венозного оттока. Анатомический резерв регуляции мозгового кровотока в виде целостного виллизиевого круга сохранен только у 40% больных, что определяет возможность нарушения механизма демпфирования на основании мозга в случаях значительного повышения АД. Ауторегуляторный ответ снижен на 15-20%, что вероятно связано с атеросклеротическими изменениями церебральных сосудов. Метаболический перфузионный резерв значительно снижен, что подтверждает участие биохимических изменений в формировании церебральных дисгемий.
Детекция микроэмболических сигналов (рис. 8.) выявляет достоверное увеличение последних при всех стадиях АГ, сочетанной с ДЭП I ст. Вызывает беспокойство тот факт, что значительное количество микроэмболов (около 43%) зарегистрировано при АГ I стадии, сочетанной с ДЭП I ст., число которых нарастает при II и III стадиях до 68% и 72% (соотв.), что достоверно выше, чем в группе контроля (р < 0,05), изолированной кардиальной АГ и АГ, сочетанной с НПНКМ всех стадий (р < 0,05).
Корреляционный анализ показателей УЗДГ и ТКДГ в группе контроля выявил прямую линейную связь ИММЛЖ с Pi ВСА (R=0,63; p<0,05). При I стадии АГ, сочетанной с НПНКМ выявлена прямая пропорциональная линейная зависимость ФВ и PI ОСА (R=1,0; p<0,05). При I стадии АГ, сочетанной с ДЭП I ст. ФВ имеет обратную линейную связь с PI ОСА (R=– 0,70; p<0,05), PI ВСА (R=– 0,80; p<0,05), PI ПА (R=– 0,70; p<0,05). ФВ имеет сильную прямую связь с Pi ВСА (R=0,80; p<0,05).
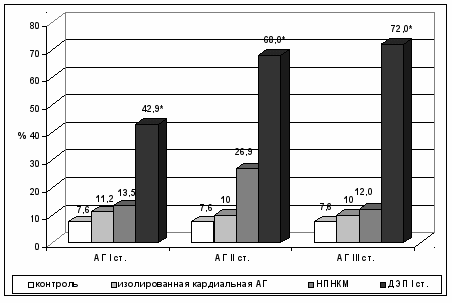
Примечание: * Р < 0,05 – достоверность различий АГ, осложненной ДЭП I с изолированной кардиальной АГ и АГ, осложненной НПНКМ.
Рис. 8. Микроэмболические сигналы у больных с АГ, изолированной и сочетанной с НПНКМ и ДЭП I ст.
Таким образом, в результате комплексного клинико-функционального исследования установлены особенности формирования поражения основных органов-мишеней (сердце и головной мозг) на ранних стадиях заболевания, когда еще нет клинических проявлений. При 1 стадии изолированной кардиальной АГ можно выделить две фазы течения АГ: 1 фаза характеризуется отсутствием клинических и функциональных проявлений поражения органов-мишеней, 2 фаза характеризуется наличием начальных признаков поражения сердца (ИММЛЖ ≥105 г/м2) , наличием безболевой ишемии миокарда по данным суточного мониторирования ЭКГ, снижением двойного произведения, увеличением доли лиц «нон-дипперов», «овер-дипперов», «найт-пиккеров» по данным суточного мониторирования АД), цереброваскулярной системы (снижением индекса цереброваскулярной реактивности, появлением гемодинамически не значимого стеноза МАГ с ассиметрией артериального кровотока у 45%, выявлением микроэмболических сигналов у 11,2%).
Метаболические и гемостазиологические аспекты
Показатели липидного обмена при изолированной АГ I стадии достоверных отличий с группой контроля не обнаруживают (табл. 5), хотя наблюдалась тенденция к повышению всех показателей. При АГ I стадии, в сочетании с НПНКМ выявлено достоверное снижение липопротеидов низкой плотности и повышение коэффициента атерогенности по сравнению с неосложненной АГ I стадии. При АГ I стадии, в сочетании с ДЭП I ст. в отличии от предыдущей группы достоверно повышен общий холестерин и липопротеиды низкой плотности, а в сравнении с группой контроля выше еще и триглицериды.
Корреляционный анализ показателей липидов, что при изолированной кардиальной АГ I стадии толщина ЗСЛЖ имеет прямую линейную связь с ОХ (R=0,69; p<0,05); при I стадии АГ, сочетанной с НПНКМ выявлена прямая линейная зависимость между а ∆ S и КА (R=0,82; p<0,05).
Таблица 5
Показатели липидного обмена при АГ I стадии
| Показатели | Контроль (n= 29) | АГ I стадии | ||
| изолированная кардиальная (n= 25) | в сочетании с НПНКМ (n=62) | в сочетании с ДЭП I (n= 28) | ||
| ОХС | 4,74±0,10 | 5,45±0,23 | 4,92±0,14 | 5,61±0,15 * |
| ТГ | 1,20±0,08 | 1,77±0,16 | 1,42±0,08 | 1,93±0,24* |
| ЛПНП | 2,44±0,08 | 3,01±0,11 | 2,52±0,14** | 3,07±0,14 * |
| ЛПВП | 1,15±0,03 | 1,22±0,08 | 1,22±0,05 | 1,27±0,05 |
| КА | 3,29±0,14 | 3,81±0,26 | 4,96±0,16** | 4,15±0,49 |
Примечание:
* Р<0,05 – достоверность различий между контрольной группой и АГ I ст. в сочетании с ДЭП I;
** Р<0,05 – достоверность различий между изолированной кардиальной АГ I ст. и АГ I ст, в сочетании с НПНКМ;
Р<0,05 – достоверность различий между АГ I ст. в сочетании с НПНКМ и АГ I ст. в сочетании с ДЭП I.
Перекисное окисление липидов (ПОЛ). При изолированной кардиальной АГ I стадии достоверно повышены первичные продукты ПОЛ (относительное содержание диеновых коньюгатов), снижена активность антиоксидантной защиты (АОЗ) (снижение пероксидазы) в сравнении с контрольной группой (табл. 6).
Таблица 6
Показатели перекисного окисления липидов при АГ I стадии
| Показатели | Контроль (n= 19) | АГ I стадии | ||
| изолированная кардиальная (n= 22) | в сочетании с НПНКМ(n= 50) | в сочетании с ДЭП I(n= 28) | ||
| Е 220 | 3,81 ±0,15 | 3,53 ±0,17 | 3,62 ±0,03 | 3,90 ±0,11* |
| Е 232 | 2,13 ±0,09 | 2,13 ±0,02 | 2,26 ±0,02 | 2,69 ±0,09*# ** |
| Е 278 | 1,16 ±0,05 | 1,08 ±0,06 | 1,36 ±0,01* | 1,39 ±0,06* # |
| Е 232/220 | 0,57 ±0,006 | 0,60 ±0,001* | 0,60 ±0,002* | 0,69 ±0,005* # ** |
| Е 278/220 | 0,35 ±0,004 | 0,31 ±0,007* | 0,37 ±0,002* | 0,36 ±0,006 # |
| МДА | 3,70 ±0,08 | 2,86 ±0,12 | 3,68 ±0,03 | 3,54 ±0,004* # |
| Каталаза | 21,04 ±1,40 | 20,13 ±1,20 | 19,18 ±1,50 | 17,65 ±0,34* |
| Пероксидаза | 3,62 ±0,04 | 3,14 ±0,09* | 3,57 ±0,03 | 2,95 ±0,12* |
| Церулоплазмин | 249,91 ±3,59 | 249,03 ±4,50 | 161,41 ±1,61* | 230,87 ±4,41* # ** |
Примечание:
* Р<0,05 – достоверность различий между контрольной группой и АГ I ст. изолированной и сочетанной с НПНКМ и ДЭП I.
Р<0,05 – достоверность различий между изолированной кардиальной АГ I ст. и АГ I ст. в сочетании с НПНКМ
# Р<0,05 – достоверность различий между изолированной кардиальной АГ I ст. и АГ I ст , в сочетании с ДЭП I
* *Р<0,05 – достоверность различий между АГ I ст. в сочетании с НПНКМ и ДЭП I.
При АГ I стадии, в сочетании с НПНКМ, в отличии от предыдущей группы, снижается церулоплазмин. При АГ I стадии, в сочетании с ДЭП I ст. происходит достоверное повышение первичных и вторичных продуктов ПОЛ и более выраженное снижение активности АОЗ (увеличение церулоплазмина при снижении каталазы и пероксидазы).
При изолированной кардиальной АГ II и III ст. усугубляются процессы ПОЛ (повышается уровень кетодиенов и сопряженных триеновых, при снижении общих полиеновых и диеновых коньюгатов) и АОЗ ( увеличение каталазы и пероксидазы и снижение церулоплазмина). При АГ II и III ст. в сочетании с НПНКМ повышаются диеновые конбюгаты и снижаются кетодиены и сопряженные триеновые. При АГ II и III ст. в сочетании с ДЭП I ст. в отличии от предыдущей группы снижается МДА.
Корреляционный анализ показателей ПОЛ в группе контроля выявил прямую линейную связь ИММЛЖ с пероксидазой (R=0,81; p<0,05), и сильную обратную линейную связь с МДА (R=– 0,91; p<0,05).
При изолированной кардиальной АГ I стадии существует прямая сильная обратная линейную зависимость ЗСЛЖ с Е 220 (R=–1,0; p<0,05)и МДА (R=– 0,86; p<0,05); ФВ имеет сильную обратную линейную связь с церулоплазмином (R=– 0,87; p<0,05) и сильную прямую связь с МДА (R=0,88; p<0,05).
При I стадии АГ, в сочетании с НПНКМ выявлена прямая линейная зависимость между ИММЛЖ и Е 220 (R=0,81; p<0,05), Е 232 (R=0,79; p<0,05)
При I стадии АГ, в сочетании с ДЭП I ст. ФВ имеет прямо пропорциональную линейную зависимость с Е 278 (R=1,0; p<0,05). Утолщение МЖП обратно пропорционально Е 232/ Е 220 (R=– 1,0; p<0,05). Увеличение ЗСЛЖ прямо пропорционально Е 278/ Е 220 (R=1,0; p<0,05).
Гемостаз при изолированной кардиальной АГ I стадии характеризуется умеренной гипокоагуляцией, что проявляется увеличением активированного времени рекальцификации плазмы (АВР), активированного парциального тромбопластинового времени (АПТВ), международного отношения (МНО) (р<0,05) и снижением фибрина (Фб) и фибринолитической активности (ФА) (р<0,05), при этом фибриноген (Фг), тромбиновое время (ТВ) и антитромбина III (АТ III) в пределах нормы, а растворимые фибрин-мономерные комплексы (РФМК) повышены (р<0,01) (табл. 7).
Таблица 7.
Показатели гемостаза при АГ I стадии
| Показатели | Контроль (n= 29) | АГ I стадии | ||
| изолированная кардиальная (n= 28) | в сочетании с НПНКМ (n= 42) | в сочетании с ДЭП I (n= 27) | ||
| АВР сек | 63,92 ±0,49 | 66,14 ±0,85* | 55,17 ±0,64* | 66,60 ±1,26#** |
| АПТВ сек | 32,52 ±0,32 | 35,86 ±1,02* | 35,47 ±0,25* | 39,64 ±0,54*#** |
| МНО | 0,91 ±0,01 | 1,04 ±0,04* | 1,00 ±0,02* | 1,00 ±0,008* |
| Фибрин мг | 14,68 ±0,71 | 11,71 ±1,13* | 10,74 ±0,17* | 13,06 ±0,66** |
| Фибриноген г/л | 2,66 ±0,03 | 2,34 ±0,09 | 2,58 ±0,02 | 2,41 ±0,09 |
| РФМК мг/мл | 3,97 ±0,42 | 13,29 ±1,96* | 10,90 ±0,33* | 26,38 ±0,98*#** |
| ТВ сек | 15,08 ±0,74 | 15,33 ±0,91 | 14,24 ±0,14 | 16,00 ±0,20** |
| АТ III % | 98,40±0,52 | 98,75 ±0,67 | 87,55 ±0,45 | 97,60 ±0,68** |
| ФА мин | 240,65±1,96 | 235,71 ±5,53* | 183,59 ±1,98* | 246,92 ±3,84** |
Примечание:
* Р<0,05 – достоверность различий между контрольной группой и АГ I ст. в сочетании с ДЭП I
Р<0,05 – достоверность различий между изолированной кардиальной АГ I ст. и АГ I ст в сочетании с НПНКМ
# Р<0,05 – достоверность различий между изолированной кардиальной АГ I ст. сочетанной с ДЭП I**
**Р<0,05 – достоверность различий между АГ I ст. сочетанной с НПНКМ и ДЭП Iст.
Показатели гемостаза при АГ I стадии, сочетанной с НПНКМ характеризуются начинающим проявляться повышением показателей Фб и РФМК. А при АГ I стадии, сочетанной с ДЭП I ст. выявляются признаки гиперкоагуляции (повышение показателей Фб и РФМК) с одновременным усилением противосвертывающих механизмов (повышение показателя ФА и АТ III).
У лиц с АГ II и III стадий, как изолированной кардиальной, так и сочетанной с НПНКМ и ДЭП I ст. сохраняется общая закономерность нарастания выраженности нарушений гемостаза от второй стадии АГ к третьей. Однако, РФМК-тест увеличен более чем в 9 раз по сравнению с группой контроля при с АГ II и III, осложненной НПНКМ (р<0,01) и при АГ I, II и III, сочетанной с ДЭП I ст.(р<0,001), кроме того у них же наблюдается повышение Фг и Фб, что свидетельствует о развитии гиперкоагуляционного синдрома и усилении процессов внутрисосудистого свертывания крови. Одновременно у пациентов этих групп повышена ФА (р<0,001) и АТ III (р<0,05), что указывает на включение механизма, поддерживающего жидкое состояние крови, которое предупреждает тромбообразование и действует как компенсаторный процесс, обеспечивающий динамическое равновесие гемостаза.
Корреляционный анализ показателей гемостаза при I стадии АГ, сочетанной с НПНКМ выявляет сильную обратную линейную зависимость ИММЛЖ с АТ III (R=– 0,97; p<0,05) и прямую линейная зависимость между ИММЛЖ с ТВ (R=0,83; p<0,05).
При I стадии АГ, сочетанной с ДЭП I ст ИММЛЖ имеет сильную прямую линейную связь с АПТВ (R=0,80; p<0,05), САД и ДАД (R=0,60; p<0,05; R=0,60; p<0,05).
В показателях гемостаза выявлены выраженные изменения всех фаз свертывающей системы крови, нарастающие с увеличением стадии АГ. Но если для пациентов с изолированной кардиальной АГ в основном эти изменения наблюдались при третьей стадии, то у лиц с АГ, сочетанной с НПНКМ регистрировались при второй и третьей стадии , а у больных с АГ, сочетанной с ДЭП I ст. патологические сдвиги в системе гемостаза отмечены уже при первой стадии АГ, которые существенно нарастали к третьей. Полученные в настоящем исследовании данные являются основой для дифференцированного подхода к управлению системой гемостаза для профилактики тяжелых кардиальных и цереброваскулярных осложнений у больных с АГ на ранних стадиях поражения «органов-мишеней».
Показатели оксида азота (NO) при изолированной кардиальной АГ I стадии уровень NO как в контрольной группе, при сочетании с НПНКМ уровень NO достоверно повышается, при сочетании с ДЭП I ст. напротив снижается по отношению к группе контроля (рис. 9.).
При изолированной кардиальной АГ II стадии отличий уровня NO от показателей в контрольной группе нет, при сочетании с НПНКМ достоверное значительное повышение уровня NO, при сочетании с ДЭП I ст. происходит снижение уровня NO до значений как при АГ I стадии, в сочетании с ДЭП I ст.
При АГ III стадии как изолированной кардиальной, так и при сочетании с НПНКМ и ДЭП I ст. уровень NO достоверно превышает проанализированные показатели всех вышеописанных групп.
Отличительной особенностью при АГ, сочетанной с ДЭП I ст. является достоверное снижение уровня NO при I и II стадиях АГ по сравнению с группой контроля, изолированной кардиальной АГ и АГ, сочетанной с НПНКМ этих же стадий. Корреляционным анализом при АГ II стадии, сочетанной с НПНКМ выявлена прямая линейная зависимость между SDNN и NO (R=0,78; p=0,003).
Нарастание уровня NO, выявленное при всех стадиях АГ, сочетанной с НПНКМ вероятно связано с включением компенсаторно-приспособительных механизмов в ответ на нарастающую вазоконстрикцию. При АГ I и II стадий, сочетанной с ДЭП I ст. наступает фаза истощения приспособительных механизмов, что выражается в достоверном снижении уровня NO.
Полученные данные свидетельствуют о том, что у пациентов как с изолированной кардиальной, так и с сочетанной кардио-цереброваскулярной патологией имеются нарушения эндотелиальной регуляции сосудистого тонуса, которые, на наш взгляд могут являются одним из патогенетических механизмов «синдрома взаимного отягощения». Возможно, это объясняется тем, что именно при таком сочетании наблюдается наибольшее воздействие на эндотелиальные клетки различных повреждающих факторов (длительно существующая гипоксия, атеросклеротическое поражение сосудов, гемодинамическая перегрузка), что приводит к нарушению их функционирования. Недостаточная продукция или ускоренный распад NO обусловливает развитие тяжелой сочетанной кардио-цереброваскулярной патологии.
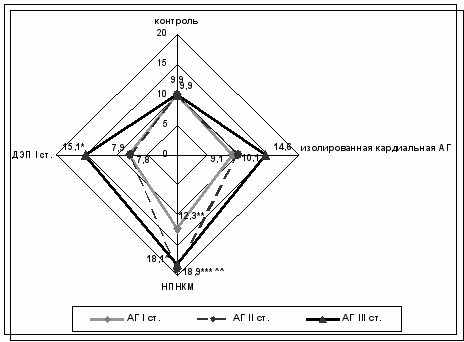
* Р < 0,05 – Достоверность различий между АГ III ст с АГ I и II ст. у больных с АГ сочетанной с ДЭП I ст.
** р < 0,05 – Достоверность различий между АГ I ст с АГ II и III ст. у больных с АГ сочетанной с НПНКМ.
*** р < 0,05 – Достоверность различий изолированной АГ с АГ, сочетанной с НПНКМ у больных с АГ II ст.
р < 0,05 – Достоверность различий изолированной АГ с АГ, сочетанной с НПНКМ у больных с АГ III ст.
р < 0,05 – Достоверность различий АГ II ст. сочетанной с НПНКМ с контролем.
Рис.9. Динамика показателей NO у больных АГ изолированной и сочетанной с НПНКМ и ДЭП I ст., и контрольной группы.
Все это позволяет сделать заключение о различных механизмах, лежащих в основе развития начальных проявлений недостаточности кровоснабжения мозга и дисциркуляторной энцефалопатии I ст. у больных с различными стадиями артериальной гипертонии. НПНКМ развиваются по механизму кардио-церебральной недостаточности с компенсаторным увеличением уровня оксида азота, а ДЭП I ст. – по механизму прогрессирующей кардио-церебральной недостаточности в сочетании с дефицитом оксида азота.
