Функционально адекватные анастомозы при гастрэктомии и резекции желудка (клинико-экспериментальное исследование) 14. 00. 27 хирургия
| Вид материала | Исследование |
| Методика исследования Результаты исследования Хирургические технологии создания функционально адекватных анастомозов при гастрэктомии, проксимальной и дистальной резекции жел |
- Обоснование способов хирургической коррекции нарушений углеводного обмена (клинико-экспериментальное, 502.51kb.
- Система комплексной интраоперационной профилактики спаечной болезни брюшины (клинико-экспериментальное, 626.28kb.
- Способ формирования арефлюксного пищеводно-желудочного соустья при рефлюкс-эзофагитах, 209.78kb.
- Программа научно-практической конференции, 105.1kb.
- Обоснование применения пармелии в комплексной терапии экземы (клинико-экспериментальное, 349.46kb.
- Методы оценки и клиническое значение биомеханических свойств роговицы (клинико-экспериментальное, 429.56kb.
- Реферат: Вглавном военном клиническом госпитале проведено 43 операции трансуретральной, 62.24kb.
- На правах рукописи, 458.44kb.
- Автореферат диссертации на соискание ученой степени, 634.76kb.
- Бандин Артем Александрович Владимир Васильевич Макарчук Содержание курсовой работы:, 28.4kb.
Структура и объем работы. Диссертация изложена на 572 страницах и состоит из введения, обзора литературы, 6 глав с описанием методики и результатов исследования, обсуждения результатов исследования и заключения, выводов, библиографии (291 источник на русском и 314 на иностранных языках) и приложений. Работа иллюстрирована 211 рисунками и содержит 57 таблиц.
МЕТОДИКА ИССЛЕДОВАНИЯ
В соответствии с поставленными задачами программа исследования состояла из экспериментального и клинического разделов.
В экспериментах использованы 81 беспородная собака (весом 14,5-19,0 кг). Первая серия экспериментов (n=46) была направлена на морфологическую и морфометрическую оценку выраженности процессов воспаления и регенерации кишечной раны концевых тонко- и толстокишечных анастомозов, сформированных различными видами кишечного шва. Изучению подвергнуты 3 вида однорядного субмукозного шва: непрерывный шов по F.Harder и Ch. Kull, узловой шов Пирогова, узловой шов с расширенным сопоставлением подслизистой основы по разработанной методике. В качестве контроля служили анастомоза, сформированные двухрядным швом Пирогова-Ламбера. Сроки наблюдения 7, 13, 20, 45 сут. после операции. Каждой собаке формировали 4 анастомоза на тонкой кишке и 2 анастомоза на толстой кишке. Помимо традиционных методов окраски гистологических срезов (гематоксилином и эозином, пикрофуксином по ван Гизону), применялись комбинированные способы окраски, разработанные в лаборатории функциональной морфологии РЦФХГ: альдегид – фуксином – хромотропом – анилиновым синим, альциановым синим – нейтральным красным, гематоксилин – основной фуксин – пикриновая кислота (ГОФП) [Н.Л.Сычева, В.А.Сычев, 2002; Л.А.Фаустов и соавт., 2007]. С помощью винтового окуляр-микрометра МОВ-1-15х (ГОСТ 7865-56) измеряли протяженность неэпителизированного дефекта слизистой оболочки в области соустья, а также ширину грануляционной ткани (рубца) между сопоставленными слоями кишечной стенки.
Вторая серия хронических экспериментов преследовала своей целью моделирование анастомозов и оценку их функциональных характеристик. Изучение гидродинамических характеристик анастомозов проводили при помощи разработанной нами системы (патент РФ на изобретение № 2289854 от 20.12.2006 г.), обеспечивающей прохождение жидкости через изолированный участок пищеварительной трубки, включающей соустье, с изменяемыми скоростями в антеградном и ретроградном направлениях. При этом проводили регистрацию внутриполостного давления на различных уровнях пищеварительной трубки методом открытых катетеров. Первую серию составили животные (n=12) с ДРЖ: с формированием концево-петлевого гастроэнтероанастомоза (КПГЭА) (n=7) и с анастомозом по Бильрот-II (Б-II) (n=5). У животных 2-й серии (n=7) аналогичным образом изучали функциональные свойства пищеводно-кишечных анастомозов: группу 1 (n=4) составили животные с концево-петлевым эзофагоэнтероанастомозом (КПЭЭА), группу 2 (n=3) – с эзофагоэнтероанастомозом «конец в конец» на мобилизованной по Ру петле тощей кишки (ЭЭА по Ру). После выведения животных из эксперимента проводилось гистологическое исследование пищевода, желудка, области ГЭА, ЭЭА и постанастомотических отделов. Исследование двигательной функции верхних отделов ЖКТ выполнено в хроническом эксперименте на 16 беспородных собаках, которым выполнялась ДРЖ по Б-II (n=5) и с КПГЭА (n=6). Группу контроля составили животные (n=5) с интактным желудком. Манометрическое исследование проводили методом открытых катетеров, имплантированных дистальнее и проксимальнее ГЭА, а в контрольной группе дистальнее и проксимальнее пилорического жома.
Клиническая часть работы основана на результатах хирургического лечения 645 пациентов, оперированных в период с 1992 по 2006 гг. Основную группу пациентов (635 человек) составили больные с раком желудка. Помимо этого в исследование включены 7 больных с синдромом Золлингера-Элиссона, 1 пациент с болезнью Менетрие и 2 – с гигантской язвой желудка с подозрением на малигнизацию. Все оперированные пациенты разделены на группы в зависимости от вида «основного» анастомоза: в I группу включены пациенты, которым выполнялась ГЭ и экстирпация культи желудка (n=315), группу II составили пациенты после ДРЖ (n=240), группу III – пациенты после ПРЖ (n=90). В отдаленном периоде, в сроки не менее 6 месяцев, после различных операций обследовано 309 пациентов (108 после ДРЖ, 133 после ГЭ и 68 – после ПРЖ). Критериями включения являлся радикальный характер хирургического вмешательства и отсутствие рецидива и прогрессирования злокачественной опухоли на момент обследования. Средний возраст пациентов на момент обследования составил 56,8±10,4 лет. Комплекс обследования включал эндоскопическое исследование верхних отделов ЖКТ, ультразвуковое исследование органов брюшной полости, контрастную рентгеноскопию/-графию эзофагогастродуоденального комплекса, морфологическое и гистохимическое исследование биоптатов слизистых оболочек верхних отделов ЖКТ, исследование HP-контаминации, пристеночную и суточную рН-метрию, исследование моторики верхних отделов ЖКТ методом открытых катетеров.
Полученные данные были подвергнуты обработке по общепринятым методам вариационной статистики [С. Гланц, 1999; О.Ю. Реброва, 2002] с использованием статистического пакета программ «Microsoft Excel» и «Statistica 6.0» в среде «Microsoft Windows XP» на компьютере IBM PC.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Морфологическая характеристика репаративных процессов в ранах кишечных соустий, сформированных однорядными прецизионными швамиразличного типа. Поскольку кишечная рана является одним из обязательных структурных компонентов любого соустья, от способа формирования этой раны зависит исход воспалительного и регенераторного процессов и, в конечном итоге, структурная состоятельность и функциональная активность анастомоза.
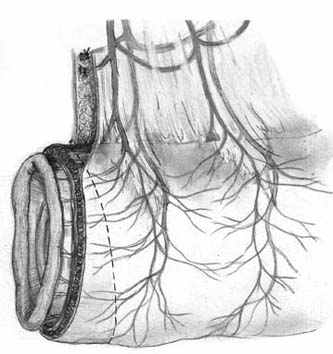
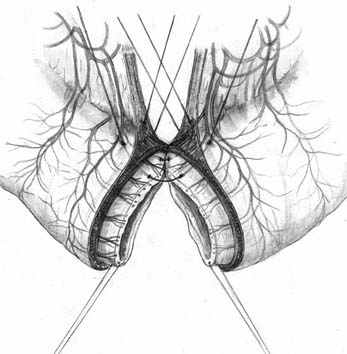
Нами разработана технология формирования раны концевого кишечного анастомоза (патент на изобретение № 2328229 от 10.07.2008 г.), которая включает следующие принципы: 1) оптимальная мобилизация и пересечение концов кишки, учитывающие особенности кровоснабжения; 2) анатомически обоснованная мобилизация подслизистых слоев; 3) наложение серозно-мышечно-подслизистых швов в условиях четкой визуализации сосудов строго в межсосудистых промежутках; 4) динамическое моделирование формы кишечной раны в процессе формирования соустья; 5) применением приема двух парных, или «шагающих» швов, предусматривающего завязывание шва в условиях точного сопоставления одноименных слоев кишечных стенок (рис. 1).
 А | 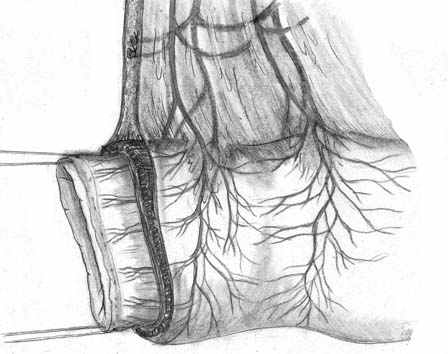 Б | 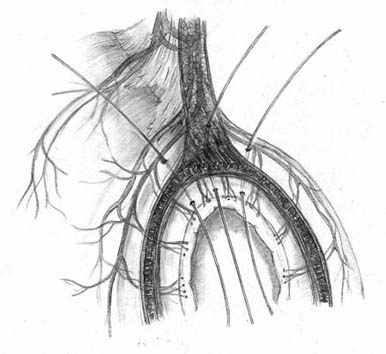 В |
 Г | 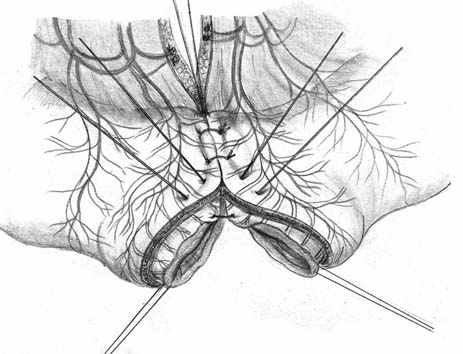 Д | 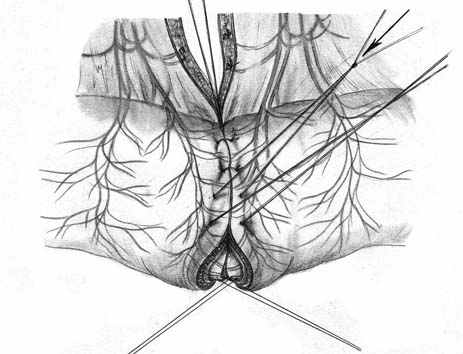 Е |
| Рис. 1. Формирование концевого кишечного анастомоза однорядным серозно-мышечно-подслизистым швом с широким сопоставлением подслизистой основы. А – линия пересечения конца кишки; Б – мобилизация подслизистого слоя; В – схема топографии первых трех швов, адаптирующих брыжеечные края кишечной раны; Г – адаптация брыжеечных краев кишки и формирование геометрии раны; Д – формирование передней стенки анастомоза; Е – завязывание «фиксирующего» шва после наложения следующего (сопоставляющего) - правило парных швов. | ||
Сравнительный морфометрический анализ регенерации одноименных слоев кишечных ран, сформированных однорядными субмукозными швами и двухрядным швом показал, что на 7 сутки после операции во всех наблюдениях определялись морфологические признаки краевой эпителизации, однако эпителизация не была полной.
Таблица 1.
Морфометрические показатели протяженности неэпителизированного участка ран концевых тонко- и толстокишечных анастомозов на 7 сутки после операции
| Тип кишечного шва | Протяженность неэпителизированного участка, мм | |
| тонкой кишки | толстой кишки | |
| Непрерывный шов по F. Harder & Ch. Kull (n=10) | 1,22±0,13*+ | 1,52±0,16*+ |
| Узловой шов по Н.И.Пирогову (n=10) | 1,01±0,13*+ | 1,36±0,12*+ |
| Узловой шов с расширенным сопоставлением подслизистой основы (n=10) | 0,55±0,14+ | 0,73±0,08+ |
| Двухрядный шов Пирогова-Ламбера (n=10) | 2,77±0,23* | 3,10±0,26* |
Примечание: *– p<0,05 в сравнении с швом с расширенным сопоставлением подслизистой основы; + – p<0,05 в сравнении с двухрядным швом.
Протяженность участка с незавершенной эпителизацией была наименьшей для шва с расширенным сопоставлением подслизистой основы и наибольшей для двухрядного шва (табл. 1).
Непрерывность подслизистого слоя в прецизионных однорядных кишечных соустьях восстанавливалась за счет развития узкой полосы рыхлой неоформленной соединительной ткани. Заживление двухрядных соустий, как правило, протекало путем рубцевания (по типу вторичного натяжения). В этих соустьях нередко имели место глубокие язвенно-некротические дефекты слизистой оболочки и подлежащих тканей. В подслизистом и мышечном слоях встречались обширные воспалительные клеточные инфильтраты на фоне выраженных расстройств микроциркуляции. В отдаленном послеоперационном периоде имели место вторичные диастазы слизистой оболочки, лигатурные гранулемы и свищи, что в связи с избыточным развитием рубцовой ткани способствовало сужению просвета кишки в зоне анастомоза.
В однорядных прецизионных анастомозах формирующийся рубец между сопоставленными концами циркулярного слоя мышц был обусловлен созреванием грануляционной ткани, а также заместительным атрофическим фиброзом мышечной ткани в связи с ее хронической гипоксией от сдавления межмышечных кровеносных капилляров шовным материалом.
Рубец между сопоставленными концами продольного слоя мышц в основном был результатом организации погибшей травмированной мышечной ткани в концах анастомозируемых мышечных слоев. В анастомозах, сформированных двухрядным швом Пирогова-Ламбера мышечные слои срастались через обширный рубец, что связано с большей травматизацией анастомозируемых тканей. Сравнительный морфометрический анализ кишечных анастомозов показал, что ширина полосы грануляционной, а затем и рубцовой ткани в ранах концевых тонко- и толстокишечных анастомозов с расширенным сопоставлением подслизистой основы во все исследованные сроки и во всех слоях кишечной стенки была статистически значимо меньшей по сравнению с таковой при других шовных конструкциях (табл. 2, 3).
Таблица 2.
Морфометрические показатели ширины полосы грануляционной и рубцовой ткани в зоне тонкокишечных анастомозов в различные сроки после операции
| Тип однорядного шва | Сутки | Ширина полосы рубцовой ткани, мм | ||
| Подслизистый слой | Циркулярный мышечный слой | Продольный мышечный слой | ||
| 1. Непрерывный шов по F.Harder и Ch.Kull (n=10) | 7 | 1,87±0,11 | 1,44±0,16 | 1,33±0,17 |
| 13 | 1,72±0,19 | 1,43±0,12 | 1,34±0,14 | |
| 20 | 1,46±0,14 | 1,22±0,12 | 1,37±0,14 | |
| 45 | 1,34±0,13 | 1,15±0,10 | 1,28±0,11 | |
| 2. Узловой шов по Н.И.Пирогову (n=10) | 7 | 1,66±0,13 | 1,35±0,14 | 1,36±0,12 |
| 13 | 1,73±0,13 | 1,36±0,14 | 1,22±0,20 | |
| 20 | 1,27±0,15 | 1,04±0,08 | 1,05±0,12 | |
| 45 | 1,10±0,11 | 0,86±0,09 | 0,87±0,10 | |
| 3. Узловой шов с широким сопоставлением подслизистой основы (n=10) | 7 | 1,07±0,14**+ | 0,81±0,08*+ | 0,71±0,07*+ |
| 13 | 0,94±0,10*++ | 0,93±0,08*+ | 0,75±0,07*+ | |
| 20 | 0,72±0,11**+ | 0,72±0,12*+ | 0,64±0,06** + | |
| 45 | 0,61±0,08**+ | 0,62±0,07**+ | 0,58±0,06**+ | |
Примечание: статистически значимые различия между 1 и 3 группами: *– p<0,05; ** p<0,001; между 2 и 3 группами: + – p<0,05; ++ – p<0,001.
Таблица 3.
Морфометрические показатели ширины полосы грануляционной и рубцовой ткани в зоне толстококишечных анастомозов в различные сроки после операции
| Тип однорядного шва | Сутки | Ширина полосы рубцовой ткани, мм | ||
| Подслизистый слой | Циркулярный мышечный слой | Продольный мышечный слой | ||
| 1. Непрерывный шов по F.Harder и ChKull (n=10) | 7 | 2,21±0,24 | 1,95±0,2 | 1,87±0,19 |
| 13 | 2,20±0,21 | 1,91±0,17 | 1,97±0,21 | |
| 20 | 2,01±0,19 | 1,88±0,18 | 1,90±0,16 | |
| 45 | 1,96±0,21 | 1,84±0,20 | 1,99±0,19 | |
| 2. Узловой шов по Н.И.Пирогову (n=10) | 7 | 2,02±0,19 | 1,84±0,17 | 1,75±0,21 |
| 13 | 2,11±0,22 | 1,85±0,15 | 1,92±0,18 | |
| 20 | 1,87±0,17 | 1,74±0,19 | 1,68±0,20 | |
| 45 | 1,82±0,27 | 1,72±0,17 | 1,81±0,25 | |
| 3. Узловой шов с широким сопоставлением подслизистой основы (n=10) | 7 | 1,36±0,15*+ | 1,11±0,10*+ | 0,99±0,08**+ |
| 13 | 1,25±0,25*+ | 1,18±0,22*+ | 1,11±0,24*+ | |
| 20 | 0,95±0,14**++ | 0,91±0,15**+ | 0,84±0,11**++ | |
| 45 | 1,01±0,22*+ | 1,10±0,13*+ | 0,96±0,15**+ | |
Примечание: статистически значимые различия между 1 и 3 группами: *– p<0,05; ** p<0,001; между 2 и 3 группами: + – p<0,05; ++ – p<0,001.
Таким образом, морфологическое изучение ран анастомозов, выполненных прецизионными однорядными серозно-мышечно-подслизистыми швами с расширенным сопоставлением подслизистой основы позволило констатировать более благоприятно протекающие регенерационные процессы в сравнении с двухрядными швами и другими видами однорядных кишечных швов.
Хирургические технологии создания функционально адекватных анастомозов при гастрэктомии, проксимальной и дистальной резекции желудка. Функционально адекватный анастомоз - это вновь созданная хирургическим путем сложная анатомическая структура, предельно точно воссоздающая факторы, ответственные за преемственный пассаж пищи по ЖКТ и препятствующая патологическому обратному транзиту пищевого содержимого из нижележащих отделов в вышележащие.
 А | 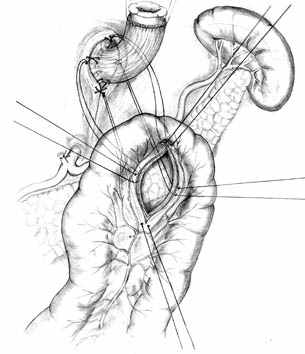 Б | 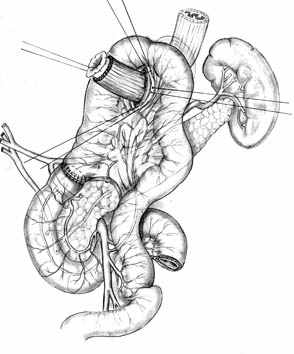 В |
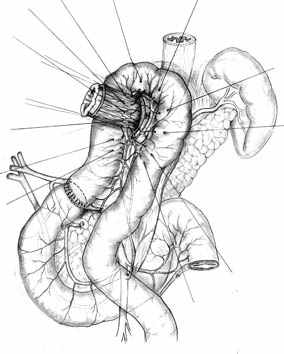 Г | 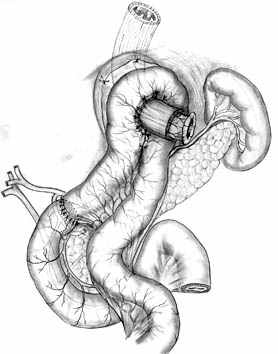 Д | 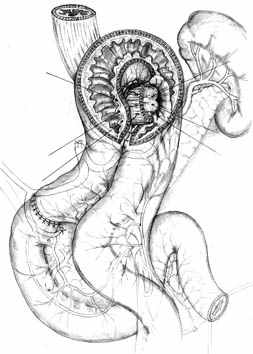 Е |
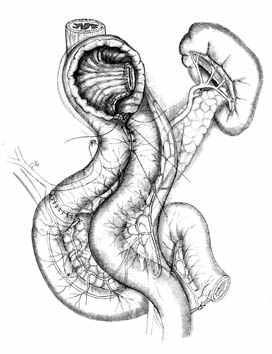 Ж | 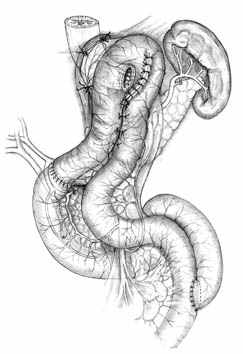 З | |
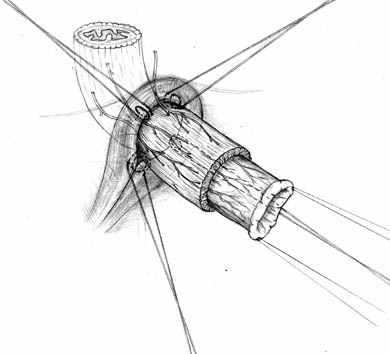
| Рис. 2. Этапы формирования концево-петлевого эзофагоэнтероанастомоза с включением ДПК. | ||
Основными структурными и функциональными компонентами КПЭЭА являются (рис. 2): 1) диафрагмально-пищеводный искусственный связочный аппарат, прочно фиксирующий всю конструкцию анастомоза во внутрибрюшном положении (рис. 2, А, Б, В); 2) хиатальная петля, усиленная за счет швов-связок (рис. 2, А, Б); 3) активный мышечный компонент, образованный за счет циркулярно охватывающей пищевод петли тощей кишки (рис. 2, Г, Д); 4) рана анастомоза, сформированная одним рядом прецизионных субмукозных швов (рис. 2, Е, Ж); 5) полость анастомотической камеры, которая при наполнении ее газом или жидкостью способствует гидродинамическому «захлопыванию» створок клапана (рис. 2, З). Сохранение функциональной активности кишечной петли обеспечивается вынесением мышечного компонента клапана за пределы зоны регенерации раны анастомоза.
В хирургической технологии ДРЖ важнейшее значение имеет формирование самой культи, включающее: 1) формирование псевдопилорической трубки из большой кривизны строго цилиндрической формы, шириной 2,0 – 2,5 см, длиной 6,0 – 8,0 (рис. 3,А); 2) создание пищеводно-диафрагмального связочного аппарата и восстановление арефлюксной функции кардии путем формирования эзофаго-кардио-фундального клапана методом боковой инвагинации (рис. 3, Б, В).
 | 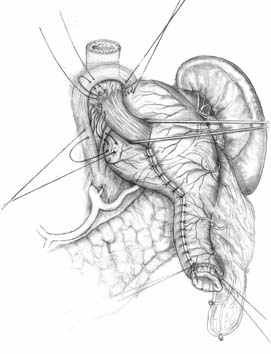 | 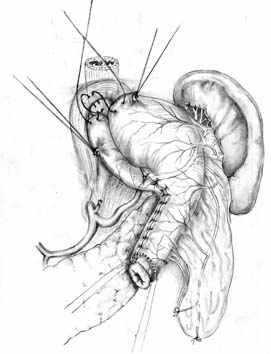 В А Б |
| Рис. 3. Формирование культи желудка при ДРЖ. | ||
Методика формирования функционально адекватного желудочно-кишечного соустья основывается на тех же принципах, что и пищеводно-кишечного. Одним из основных структурных компонентов при этом выступает желудочная трубка. Активный мышечный компонент в желудочно-кишечном анастомозе, так же образуется за счет циркулярно охватывающей желудочную трубку петли тощей кишки. Закрытию анастомоза способствует формирование в полости анастомотической камеры газового пузыря (рис. 4).
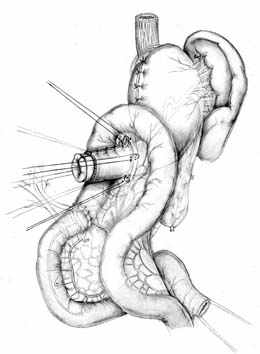 А Б В | 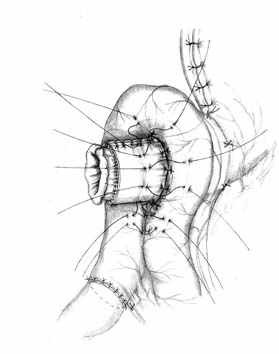 | 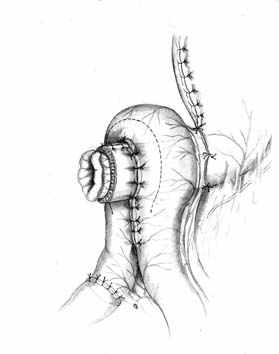 |
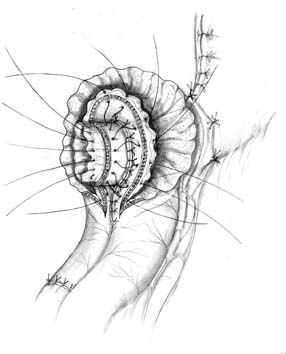 Г | 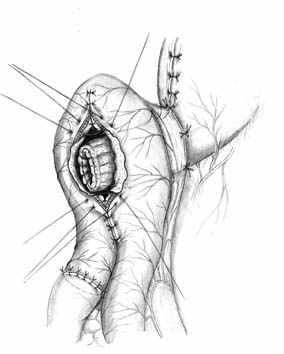 Д | 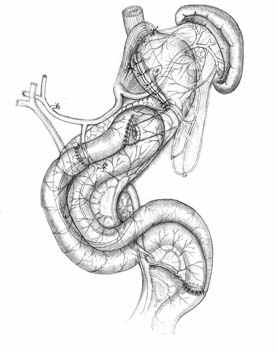 Е |
| Рис. 4. Этапы формирования концево-петлевого функционально адекватного гастроэнтероанастомоза. | ||
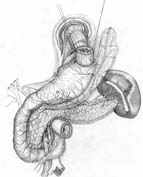
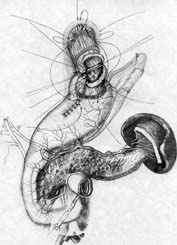
Общие принципы построения анастомоза реализованы и при проксимальной резекции желудка. Технология 1 варианта ПРЖ (патент РФ № 2209599 от 10.08.2003 г.) включает пластическое формирование культи желудка (рис. 5, А), создание связочного аппарата (рис. 5, Б, В), формирование прецизионного субмукозного пищеводно-желудочного анастомоза (рис. 5, Г) и инвагинацию его в просвет желудочной культи (рис. 5, Д). Активный мышечный компонент при этом образуется из удвоенной стенки культи желудка, а из подслизисто-слизистых слоев пищевода и желудка создается подвижный клапан с избыточной складчатостью, который смыкается за счет газового пузыря (рис. 5, Е).
 А | 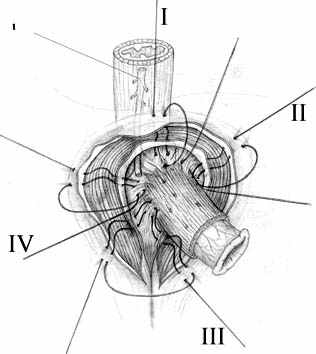 Б | 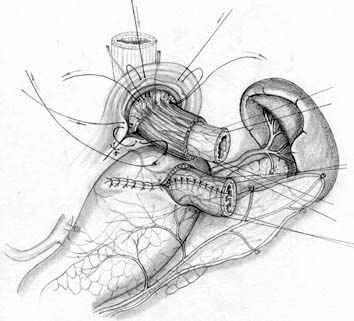 В |
 Г | 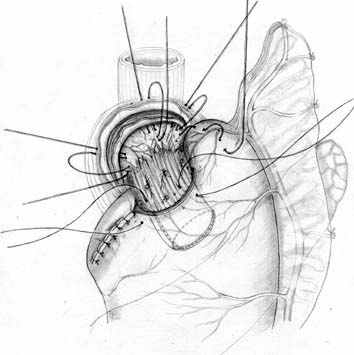 Д | 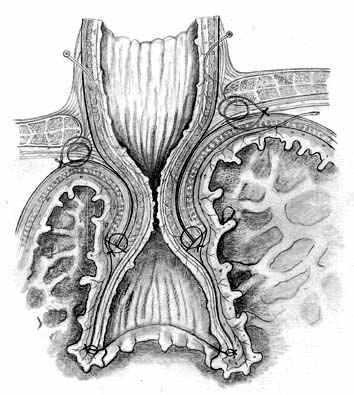 Е |
| Рис. 5. Этапы субтотальной проксимальной резекции желудка с формированием функционально адекватного пищеводно-желудочного анастомоза (1 вариант). | ||
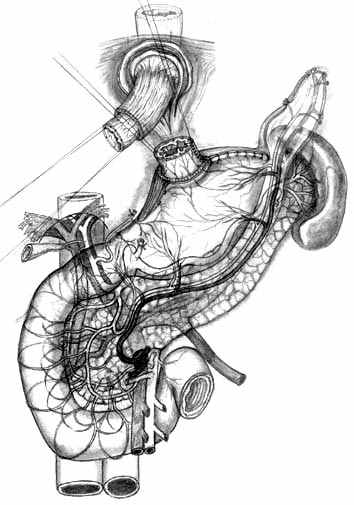
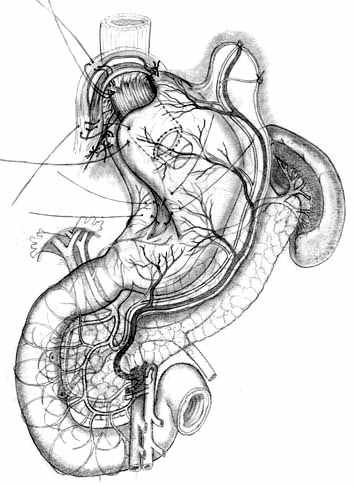
При втором варианте ПРЖ, разработанном для экономной проксимальной резекции (патент РФ №2217067 от 27.11.2003 г.), производят выкраивание подслизисто-слизистой трубки по малой кривизне культи желудка, ушивают культю со стороны большой кривизны однорядным прецизионным швом мононитью, формируя таким образом «искусственное дно» резецированного желудка (рис. 6, А). Далее формируют собственно пищеводно-желудочный анастомоз субмукозными швами (рис. 6, Б), после чего производят его инвагинацию в просвет культи желудка (рис. 6, В). Формирование пищеводно-желудочного клапана производится путем инвагинации пищевода и анастомоза между передней и задней стенками культи желудка с помощью предварительно наложенных швов-связок (рис. 6, Г, Д, Е).
 А | 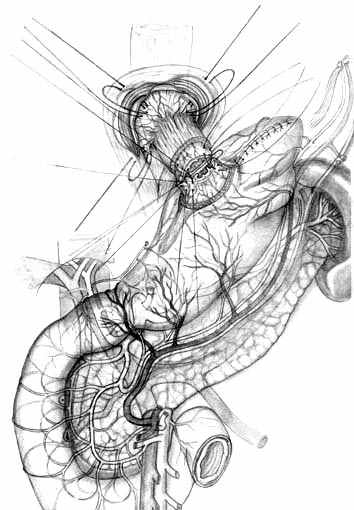 Б В | 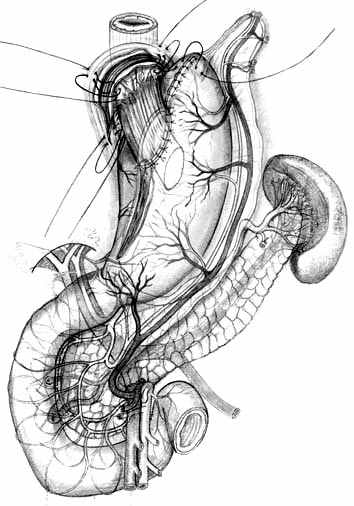 |
 Г | 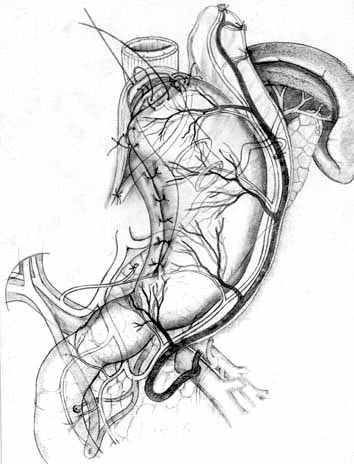 Д | 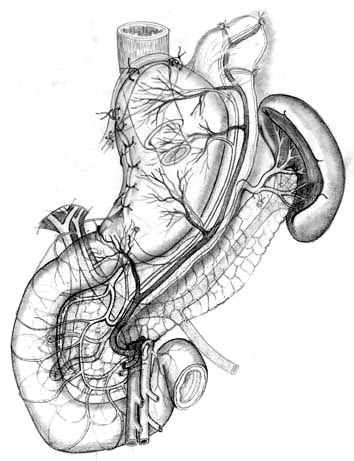 Е |
| Рис. 6. Этапы создания функционально адекватного пищеводно-желудочного анастомоза после экономной проксимальной резекции желудка и окончательный вид операции. | ||
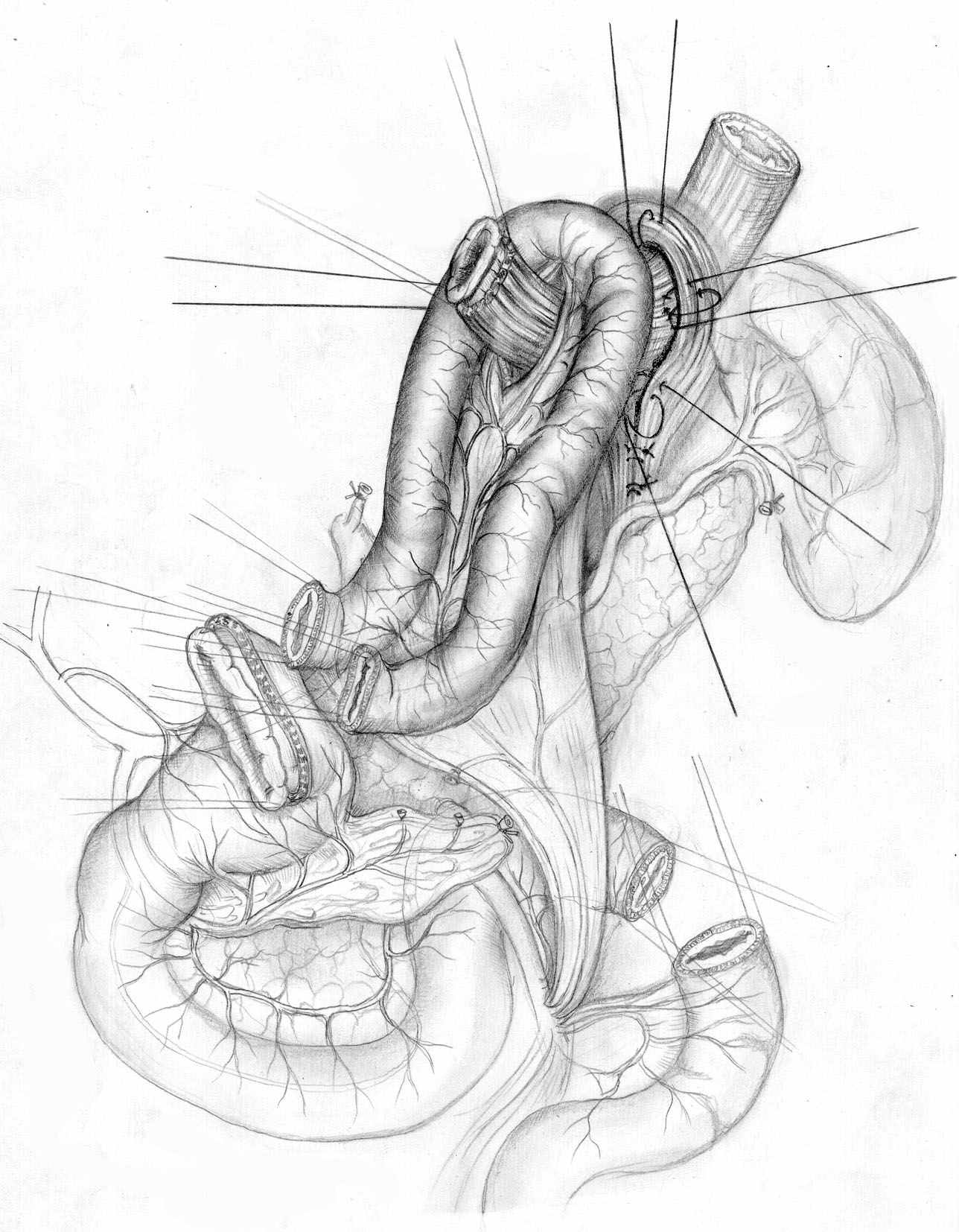 А | 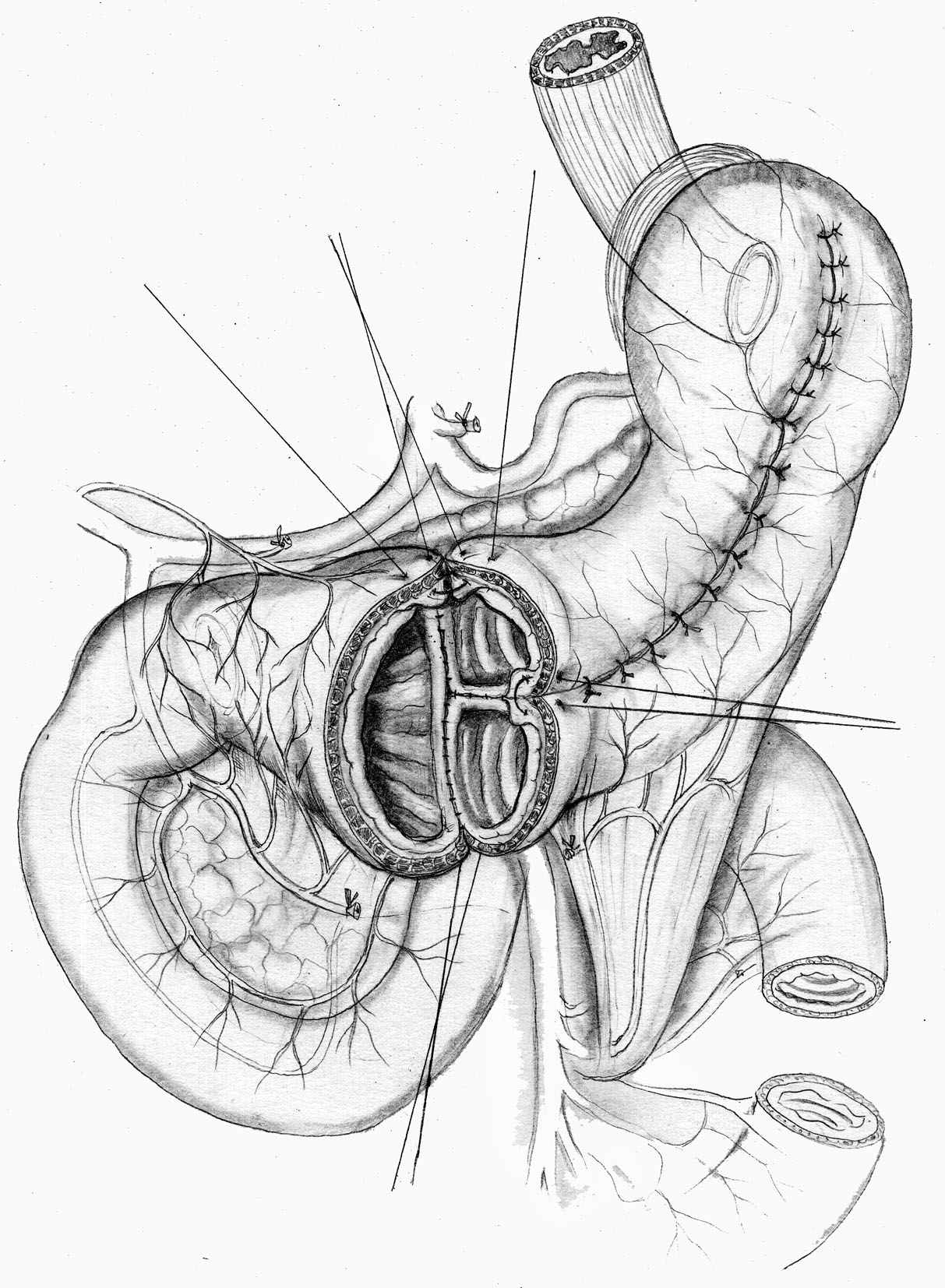 Б В | 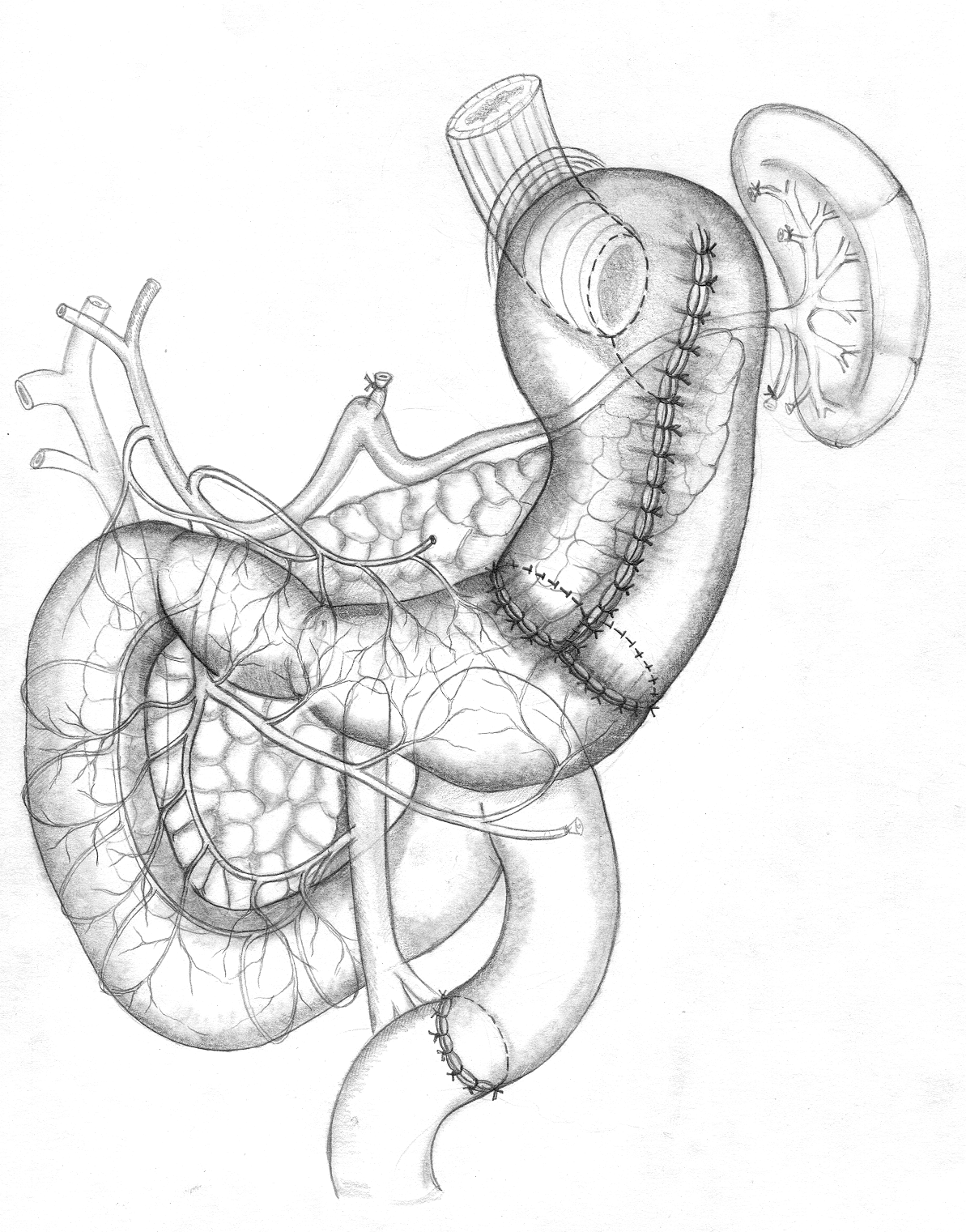 |
| Рис. 7. Проксимальная субтотальная резекция желудка с еюногастропластикой изолированным тонкокишечным трансплантатом при раке желудка. А, Б – этапы операции; В – окончательный вид. | ||
Наиболее предпочтительным с позиций функциональной хирургии являтся замещение проксимальных отделов желудка и пищеводно-желудочного перехода изолированной петлей тощей кишки с созданием концево-петлевого пищеводно-кишечного анастомоза и концево-концевого биэнтеро-антрального анастомоза (рис. 7). При синдроме Золлингера-Эллисона производили полное удаление кислотопродуцирующей зоны желудка с сохранением иннервации антрального отдела и также замещали проксимальные отделы желудка изолированной петлей кишки с концево-петлевым пищеводно-кишечным анастомозом.
