Функционально адекватные анастомозы при гастрэктомии и резекции желудка (клинико-экспериментальное исследование) 14. 00. 27 хирургия
| Вид материала | Исследование |
- Обоснование способов хирургической коррекции нарушений углеводного обмена (клинико-экспериментальное, 502.51kb.
- Система комплексной интраоперационной профилактики спаечной болезни брюшины (клинико-экспериментальное, 626.28kb.
- Способ формирования арефлюксного пищеводно-желудочного соустья при рефлюкс-эзофагитах, 209.78kb.
- Программа научно-практической конференции, 105.1kb.
- Обоснование применения пармелии в комплексной терапии экземы (клинико-экспериментальное, 349.46kb.
- Методы оценки и клиническое значение биомеханических свойств роговицы (клинико-экспериментальное, 429.56kb.
- Реферат: Вглавном военном клиническом госпитале проведено 43 операции трансуретральной, 62.24kb.
- На правах рукописи, 458.44kb.
- Автореферат диссертации на соискание ученой степени, 634.76kb.
- Бандин Артем Александрович Владимир Васильевич Макарчук Содержание курсовой работы:, 28.4kb.
 А | 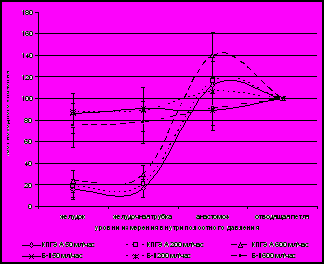 Б | |
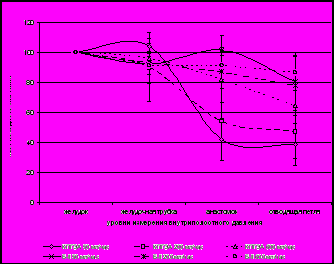
| Рис. 8. Изменения внутриполостного давления (в % от исходного) в системе «желудок – ГЭА – отводящая кишка» при постоянных скоростях потока: А - в антеградном направлении; Б – в ретроградном направлении. | | |
При ретроградном направлении движения жидкости с постоянными скоростями КПГЭА демонстрировал выраженные арефлюксные свойства (рис. 8, Б). В группе после ДРЖ по Б-II как при антеградном, так и при ретроградном направлении движения жидкости статистически значимых различий в уровнях внутриполостного давления не выявлено.
Изучение гидродинамики системы с кратковременными высокоамплитудными подъемами давления в отводящей петле кишки, аналогичными возникающим при перистальтике кишки, выявило способность КПГЭА редуцировать эти подъемы в среднем на 90% (рис. 9, А, Б).
 А Б | 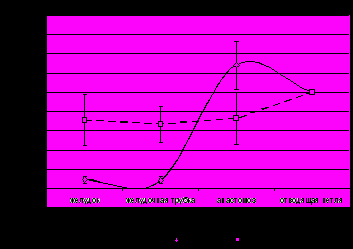 |
| Рис. 9. Изменения внутриполостного давления (в % от исходного) в системе «желудок – ГЭА – отводящая кишка» при создании кратковременных подъемов давления в культе желудка: А - в антеградном направлении; Б – в ретроградном направлении. | |
При изучении гидродинамических характеристик пищеводно-кишечных анастомозов при антеградном движении жидкости с разными скоростями не выявлено статистически значимых различий давления на разных уровнях системы «пищевод – анастомоз – отводящая петля кишки» в обеих группах.
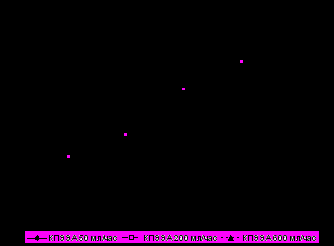 А Б |  |
| Рис. 10. Изменения внутриполостного давления (в % от исходного) в системе «пищевод – эзофагоэнтероанастомоз – отводящая кишка» с постоянными скоростями потока жидкости: А – с концево-петлевым ЭЭА; Б – с анастомозом конец в конец. | |
При ретроградном направлении пассажа жидкости с постоянными скоростями КПЭЭА демонстрировал выраженные арефлюксные свойства (рис. 10).
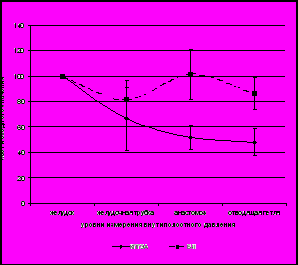
Еще более выраженные при моделировании кратковременных подъемов давления с ретроградным направлением пассажа. Падение уровня амплитуды давления в группе с КПЭЭА на участке «анастомоз – пищевод» составило 91,2%. В группе с простыми соустьями снижение амплитуды давления составило, в среднем, 20 - 25% (рис. 11).
 |
| Рис. 11. Изменения внутриполостного давления (в % от исходного) в системе «пищевод – эзофагоэнтероанастомоз – отводящая кишка» при моделировании кратковременных подъемов давления в отводящей петле тонкой кишки (ретроградное направление) |
При изучении моторики верхних отделов ЖКТ в хроническом эксперименте животных перенесших ДРЖ увеличено отношение времени активности к продолжительности покоя (р<0,05), а также наблюдалось укорочение III фазы по сравнению со здоровыми животными. Отмечено увеличение доли ретроградных волн в составе ММК которые после ДРЖ по Бильрот - II составили 42% от всех волн, против 14% после ДРЖ с КПГЭА и 7% в группе контроля. После приема животными тестового завтрака наблюдали угнетение моторной активности культи желудка в обеих группах, которое проявлялось снижением амплитуды сокращений от 54,0±12,3 до 12,0±3,4 см.вод.ст. Продолжительность торможения моторики составляла от 5 до 23 мин. Затем амплитуда сокращений восстанавливалась и была представлена волнами 5-7/10 мин. В группе с КПГЭА в области желудочной трубки отмечался рост амплитуды сокращений от 49,0±19,8 до 112,0±13,6 см.вод.ст. Данный феномен мы расцениваем как факт сохранения формы желудочной трубки после приема животным тестового завтрака. Желудочная трубка, или псевдопилорический канал, являясь элементом КПГЭА, участвует в разобщении полости желудка и тонкой кишки, с одной стороны создавая арефлюксные свойства складчатостью своей слизистой оболочки, с другой обеспечивая дозированную, порционную эвакуацию за счет сокращений своего мышечного аппарата в новых анатомических отношениях
При внедрении новых методик хирургических операций одной из основных характеристик является оценка непосредственных результатов, прежде всего, по уровню летальности и частоте осложнений. Общая летальность во всей группе оперированных больных составила 4,8±0,8%. (табл. 4).
Таблица 4.
Показатели госпитальной летальности в зависимости от характера операции и типа основного анастомоза
| Группы больных | Подгруппы больных | Количество летальных исходов | |
| Абс. | %%±sp | ||
| I (ГЭ) (n=315) | А (n=211) | 8 | 3,8±1,3 p IБ<0,001 |
| Б (n=94) | 9 | 9,6±3,0 | |
| II (ДСРЖ) (n=240) | А (n=151) | 3 | 2,0±1,1 p IIБ<0,05 |
| Б (n=89) | 4 | 4,5±2,2 | |
| III (ПРЖ) (n=90) | 7 | 7,9±2,8 | |
| Всего (n=645) … | 31 | 4,8±0,8 | |
Примечание: IА – ГЭ с созданием концепетлевого ЭЭА; IБ – ГЭ с «простым» анастомозом; IIА – ДСРЖ с концепетлевым ГЭА; IIБ – ДСРЖ с анастомозом по Бильрот-I и Бильрот-II ; III – проксимальная резекция желудка. p IБ, IIБ – статистическая значимость различий между группами.
Этот показатель зависел от типа операции – наибольшим он был в группе пациентов, перенесших проксимальную резекцию желудка (7,9±2,8%), наименьшим – после дистальной субтотальной резекции желудка.
Таблица 5
Частота послеоперационных осложнений в зависимости от характера операции
| Характер осложнения | Количество пациентов с осложнениями, абс. (%%) по подгруппам | Всего (n=645) | ||||||
| IA (n=211) | IБ (n=94) | IIA (n=151) | IIБ (n=89) | IIIа (n=74) | IIIб (n=16) | |||
| Несостоятельность ЭЭА | 1(0,47) | 2(2,13) | - | - | - | - | 3 (0,47) | |
| Несостоятельность ЭГА | - | - | - | - | 4 (5,41) | - | 4 (0,62) | |
| Несостоятельность других анастомозов или культи ДПК | - | 1(1,06) | - | 2(2,25) | - | - | 3 (0,47) | |
| ОПП | Легкий | 2(0,95) | 2(2,13) | 2(1,32) | 1(1,12) | - | 1 (6,25) | 4 (0,62) |
| Среднетяжелый | 2(0,95) | 1(1,06) | 1(0,66) | 1(1,12) | 2 (2,70) | - | 7 (1,09) | |
| Тяжелый | 4(1,42) | - | - | 3(2,25) | 2 (1,35) | - | 9 (0,93) | |
| Пневмония | 2(0,95) | 1(1,06) | 1(0,66) | - | 2 (2,70) | 1 (6,25) | 7 (1,09) | |
| Гидроторакс | 1(0,47) | 1(1,06) | 1(0,66) | - | - | | 4 (0,62) | |
| Плеврит, эмпиема плевры | - | - | - | - | 1 (1,35) | - | 1 (0,16) | |
| ТЭЛА | - | 1(1,06) | - | - | 1 (1,35) | - | 2 (0,31) | |
| Внутрибрюшное кровотечение, гематома | 3(1,42) | 2(2,13) | 1(0,66) | 1(1,12) | - | - | 7 (1,09) | |
| Нагноение п/о раны | 2(0,95) | 1(1,06) | - | 1(1,12) | | - | 4 (0,62) | |
| Абсцесс брюшной полости | 4(1,90) | 6(6,38) | 3(1,99) | 4(4,49) | 2 (2,70) | - | 19 (2,95) | |
| Эвентрация | - | - | 1(0,66) | - | - | - | 1 (0,16) | |
| Ранняя спаечная непроходимость | 1(0,47) | - | - | 1(1,12) | - | - | 2 (0,31) | |
| Кровотечение в просвет ЖКТ | - | 1(1,06) | - | 1(1,12) | - | - | 2 (0,31) | |
| Итого … | 21 (9,95) | 19 (20,21) | 10 (6,62) | 14 (15,73) | 13 (17,57) | 2 (12,5) | 76 (11,78) | |
Примечание: IА – ГЭ с созданием концепетлевого ЭЭА; IБ – ГЭ с «простым» анастомозом; IIА – ДСРЖ с концепетлевым ГЭА; IIБ – ДСРЖ с анастомозом по Бильрот-I и Бильрот-II ; IIIА – ПРЖ с пищеводно-желудочным анастомозом; IIIБ – ПРЖ с концево-петлевой еюногастропластикой; ОПП – острый послеоперационный панкреатит; p IБ, IIБ – статистическая значимость различий между группами.
Уровень летальности существенно различался в зависимости от метода формирования «основного» анастомоза. Среди больных, у которых использовались разработанные методы анастомозов, госпитальная летальность была статистически значимо ниже, чем при применении традиционных способов.
Анализ течения раннего послеоперационного периода показал, что в группах пациентов, у которых выполнялись пластические функционально адекватные анастомозы частота и тяжесть осложнений были достоверно ниже, чем в группах с традиционными соустьями (табл. 5).
Разработанные нами новые хирургические технологии пищеводных анастомозов показали свою исключительную надежность, характеризуясь практически полным отсутствием осложнений со стороны анастомозов. Наибольшей частотой несостоятельности пищеводных анастомозов характеризовалась группа пациентов после проксимальной резекции желудка (4 больных, 5,41%). Анализ этих случаев показал, что данное осложнение развилось у больных, которым выполнялась резекция нижней трети пищевода с формированием анастомоза над диафрагмой в заднем средостении.
При обследовании пациентов в отдаленном периоде клиническая симптоматика ДС чаще отмечена после РЖ по Бильрот-I и Бильрот-II, составляя 42,1% и 84,6%, соответственно. В группе больных после РЖ с КПГЭА этот показатель составил 21,1%. При этом отмечено, что включение в пассаж пищи ДПК при концево-петлевой еюногастропластике способствует уменьшению частоты и степени выраженности ДС (рис. 12).
Эндоскопическая картина после ДРЖ с КПГЭА определялась особенностями хирургической технологии. У большинства пациентов I группы (91,2%) слизистая оболочка пищевода визуально имела обычную окраску, только у 5 (8,8%) пациентов имели место явления катарального дистального эзофагита. Кардия у 47 (82,5%) больных была сомкнута, при этом с некоторым эластическим усилием пропускала тубус эндоскопа.
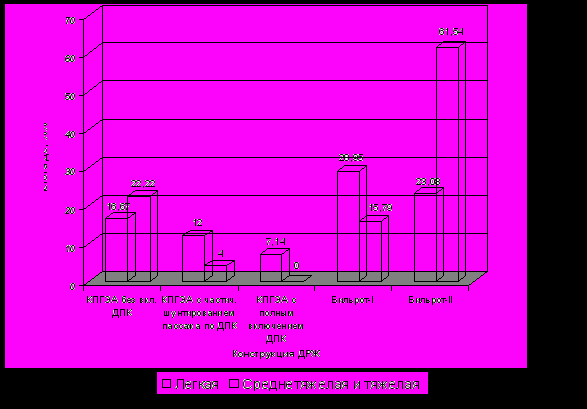
*
**
**
*



р<0,05
Рис. 12. Частота и степень выраженности ДС у пациентов в отдаленные сроки после ДРЖ в зависимости от метода формирования ГЭА. Статистически значимые отличия от показателей группы с анастомозом по Б-II: *- р<0,05; **-р<0,001.
Только у 10 (17,5%) пациентов отмечено неполное смыкание кардии, сопровождающееся дистальным рефлюкс-эзофагитом. Культя желудка у этих больных переходит в цилиндрическую трубку протяженностью 5,0–7,0 см, просвет которой представлялся сомкнутым у 55 (96,5%) пациентов, при этом свободно проходим эндоскопом. Только у 2 обследованных пациентов (3,5%) просвет трубки зиял. При раздувании воздухом диаметр псевдопилорического канала составлял в среднем 2,0 см. Наличие желчи в просвете культи желудка выявлено только у 1 больного. Слизистая оболочка (СО) культи желудка у пациентов после ДРЖ с КПГЭА имела нормальный вид у 43,9% обследованных, очаговая атрофия отмечена у 5,3%, картина поверхностного гастрита – у 47,4%. СО в области непосредственно ГЭА выглядела неизмененной или в части случаев гиперемированной, иногда с лигатурами без паралигатурных зрозий вокруг. Анастомоз всегда был в сомкнутом состоянии, при инсуффляции воздуха и проведении аппарата свободно раскрывался, и затем плотно смыкался на выходе. У пациентов, перенесших резекцию по Б-I и по Б-II статистически значимо чаще выявлялся эзофагит (катаральный у 31,0 и 62,5%, эрозивный - у 16,0 и 37,5 % соответственно), недостаточность кардии. Желчь в просвете культи желудка обнаруживалась в 29,0% и 100% случаев, соответственно. СО культи желудка у этих пациентов с признаками атрофии различной степени выраженности отмечена у 16,0 и 30,8% обследованных после ДРЖ по Б-I и ДРЖ по Б-II соответственно (различия группой с КПГЭА статистически значимы, p<0,05).
При рентгенологическом обследовании пациентов с КПГЭА функциональная недостаточность кардии отмечена только у 7% обследованных, грыжа пищеводного отверстия диафрагмы – у 1,7%, гастроэзофагеальный и энтерогастральный рефлюкс (ГЭР и ЭГР) соответственно у 3,5 и 1,8%. Наиболее часто наблюдался порционно-ритмичный характер эвакуации контрастированной пищи из культи желудка. У большинства пациентов псевдопилорическая трубка сохраняла свою форму и размеры. Отмечена трансформация эвакуаторной деятельности в динамике. В ранние сроки после операции (до 4 недель) наблюдалась преимущественная эвакуация по отводящей петле, однако в более поздние сроки у подавляющего числа пациентов (88%) отмечалась эвакуация как через ДПК, так и через отводящую петлю тощей кишки.
В группах пациентов после ДРЖ по Б-I и Б-II функциональная недостаточность кардии выявлена у 47,4% и 61,5% пациентов, грыжа пищеводного отверстия диафрагмы – у 10,5% и 38,5%, ГЭР– у 28,9% и 61,5% обследованных соответственно. Дуодено(энтеро)гастральный рефлюкс определялся у 39,5% и 76,9% обследованных после ДРЖ по Б-I и по Б-II (различия группой с КПГЭА статистически значимы, р<0,001).
Результаты сравнительного анализа морфологических изменений СО пищевода, культи желудка и зоны анастомоза согласуются с данными эндоскопических и рентгенологических исследований. Частота и степень выраженности морфологических изменений у пациентов после ДРЖ с КПГЭА была значительно меньше, чем у больных после ДРЖ по Б-I и Б-II. По нашему мнению, патогенетической основой реализации данных различий явилось надежное предотвращение дуодено/энтерогастрального и гастроэзофагеального рефлюксов путем создания соответствующих антирефлюксных конструкций на границе между функционально различными отделами пищеварительного тракта. Атрофические изменения СО культи у пациентов после ДРЖ по Б-I и Б-II отмечены у 34,6% и 62,5% случаев соответственно, в группе с формированием КПГЭА этот показатель составил 9,5%. Подобное же соотношение отмечено и для кишечной метаплазии - неполная кишечная метаплазия диагностирована у 30,8% пациентов после ДРЖ по Б-I, у 62,5% пациентов после ДРЖ по Б-II, что статистически значимо превышает показатели в группе больных с КПГЭА – 4,8%.
Изучение синтеза гликопротеидов СО культи желудка в зависимости от типа ГЭА показало, что СО культи после ДРЖ с КПГЭА сохраняют свою функциональную активность в части продукции гликопротеинов, как одного из важнейших защитных факторов, при этом спектр слизеобразования изменяется в сторону более активной продукции нейтральных гликопротеинов, тогда как синтез кислых гликопротеинов не имеет такой тенденции. После ДРЖ по Бильрот−II отмечается более глубокие дистрофические и атрофические процессы в слизистой оболочке культи желудка, снижение синтеза нейтральных гликопротеидов и компенсаторное увеличение продукции кислых гликопротеинов, что обусловлено постоянным воздействием агрессивного доуденального/энтерального содержимого.
Манометрическая оценка пищеводно-желудочного перехода показала, что в группе пациентов после ДРЖ с КПГЭА, технология которой предусматривает низведения нижнего пищеводного сфинктера (НПС) в брюшную полость и формирование фундопликационной манжеты, показатели протяженности и тонуса пищеводно-желудочного клапана приближаются к показателям здоровых лиц. Восстановление абдоминальной позиции НПС и устранение ГПОД, которые входят как компонент хирургической технологии, приводят к полному отсутствию плато давления и двойной реверсии дыхания эзофагокардиоманометрических кривых.
При изучении моторной функции верхних отделов ЖКТ у пациентов после ДРЖ отмечено увеличение отношения времени активности к продолжительности покоя, а также укорочение III фазы мигрирующего моторного комплекса (ММК). Такая перестройка связана с децентрализацией иннервации желудка и тонкой кишки после ДРЖ и активацией автономных механизмов интрамуральной нервной системы, осуществляющих процессы сокращения. Вследствие пересечения нервных путей после резекции нарушается рефлекторное взаимодействие частей пищеварительной трубки, одним из проявлений этого является увеличение доли ретроградных волн в составе ММК. Ретроградные волны у пациентов после ДРЖ по Б-I составили 46,0%, у пациентов после Б-II - 59,0% от всех волн, против 14,0% в группе после ДРЖ с КПГЭА (р<0,05). У 36,4% больных после ДРЖ по Б-I и у 62,5% после Б-II регистрировались моменты прохождения ММК по отводящей петле, во время которого повышение базального давления в ней распространялось и в полость культи желудка, что указывает на отсутствие анатомического и физиологического разобщения культи желудка и нижележащих отделов ЖКТ. Эти факты косвенно подтверждают наличие систематического заброса дуоденального содержимого в полость культи желудка с нарушением гастроэнтерального эвакуаторного процесса.
У 82% пациентов после ДРЖ с КПГЭА отмечалась трансформация моторной активности псевдопилорического канала культи желудка в виде увеличения амплитуды и частоты сокращений. Возникновение этого феномена, как компенсаторно-приспособительной реакции оперированного желудка, мы связываем с увеличением пропульсивной активности фундального отдела, необходимой для постепенного порционного продвижения пищевых масс в тонкую кишку через искусственно созданный привратник – желудочную трубку с КПГЭА, моделирующим функцию пилорического сфинктера. Изучение миграции ритмической активности из желудка через анастомоз в ДПК и тонкую кишку показало, что в сроки более 1 года после операции III фаза или активность, подобная III фазе, возникала в тощей кишке согласованно с ритмичной активностью культи желудка у 72% обследованных после ДРЖ с КПГЭА, тогда как после ДРЖ по Б-I – у 29% (р<0,05). У остальных пациентов культя желудка, ДПК и тонкая кишка функционировали изолированно друг от друга. Восстановление координации желудка, ДПК и тонкой кишки возможно в результате достаточной регенерации интрамуральных нервных сетей в области гастроэнтероанастомоза и отсутствия грубых повреждений в стенках органов.
Оценка качества жизни (КЖ) с помощью опросника SF-36 показала, что у пациентов после ДРЖ по Б-I показатели «болевой симптом», «общее здоровье», «суммарные измерения физического здоровья», «социальное функционирование», «ролевое эмоциональное функционирование», «суммарные измерения психологического здоровья» статистически значимо отличались от здоровых лиц, а такие показатели, как «физическое функционирование» и «ролевое физическое функционирование» отличались как от здоровых лиц, так и от пациентов после ДРЖ с КПГЭА. У пациентов после ДРЖ с КПГЭА показатели «социальное функционирование», «ролевое эмоциональное функционирование» отличались в сторону снижения от здоровых лиц (р<0,05), по остальным шкалам наблюдается снижение показателей, не достигающее при этом статистической значимости. У больных после ДРЖ по Б-II отмечено статистически значимое снижение показателей КЖ по шкалам: «физическое функционирование», «ролевое физическое функционирование», «болевой симптом», «общее здоровье», «суммарные измерения физического здоровья», по сравнению с пациентами после ДРЖ с КПГЭА, что связано, по нашему мнению, с более выраженными морфо-функциональными нарушениями гастродуоденального комплекса. Остальные параметры КЖ не имели различий в обеих группах.
При клинической оценке отдаленных результатов ГЭ проявления рефлюкс-эзофагита обнаружены у 6,0% обследованных с КПЭЭА, при этом у большинства из них в легкой степени. В группе больных с традиционными анастомозами данное осложнение отмечено у 80,7% обследованных, у значительной части в тяжелой и средне-тяжелой формах. ДС наблюдался у 30,1% обследованных с КПЭЭА и у 52,2% – с простыми анастомозами. Включение в пассаж пищи ДПК при концево-петлевой еюногастропластике, так же как и при ДРЖ, способствовало уменьшению частоты развития среднетяжелых и тяжелых форм ДС (рис. 13).
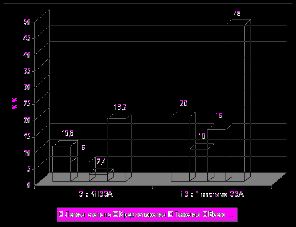 | 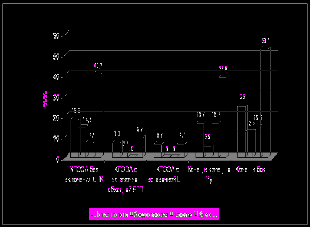 |
| Рис. 13. Частота и тяжесть ДС после ГЭ в зависимости от типа пищеводно-кишечного анастомоза и варианта восстановления непрерывности ЖКТ | |
Клинические данные согласуются также с результатами эндоскопического, морфологического и рентгенологического исследований. СО нижней трети пищевода у больных с КПЭЭА у 91,6% была визуально без патологических изменений, явления эзофагита выявлены в у 7 пациентов (8,2%), причем у 5 из них (6,0%) носили характер катарального. В большинстве случаев (92,6%) КПЭЭА был сомкнут, при инсуффляции воздуха приоткрывался и свободно пропускал тубус эндоскопа. В группе пациентов с традицинонными ЭЭА неизмененная СО пищевода наблюдалась только у 52,0% обследованных, преобладали эрозивные изменения (28,0%), у 4,0% обследованных отмечено язвенное поражение. Наиболее выраженные изменения СО выявлены в группе больных с анастомозом конец в бок: эрозивный эзофагит имел место в 37,5% случаев, катаральный – в 18,8%, язвенный – в 6,3% исследований. У 50% больных просвет анастомоза зиял, неполное смыкание отмечено еще в 26,0% случаев. Через просвет анастомоза в группе больных с боковым соустьем отмечалось поступление окрашенного желчью кишечного сока. Только у 20,0% пациентов слизистая анастомоза выглядела неизмененной, у остальных имели место воспалительные явления различной степени – гиперемия, отек, гиперпластические разрастания слизистой, эрозии, паралигатурные изъязвления.
Жалобы на дисфагию предъявляли 22% обследованных больных с традиционными соустьями , что было обусловлено снижением проходимости анастомоза, в основном связанным с рубцовыми процессами на фоне длительно существующего рефлюкса. У 6 больных отмечалась регургитация (срыгивание). Рубцовый стеноз ЭЭА подтверждался при эндоскопическом и рентгенологическом исследованиях.
Морфологическое исследование биоптатов СО нижней трети пищевода позволило констатировать значительно большую частоту и выраженность морфологических маркеров хронического эзофагита у больных с простыми ЭЭА. Морфологические критерии острого воспалительного процесса в целом по группе присутствовали в трети исследованных препаратов, в 5 случаях (26,3%) обнаружена морфологическая картина эрозии, в 2 биоптатах (10,5%) – хронической язвы пищевода. В 21,1% бипотатов выявлены атрофические процессы в слизистой оболочке пищевода. В 2 (10,5%) препаратов имелись фиброзные изменения. Паракератоз и папилломатоз обнаружены в 5,3% биоптатов, в 3 (15,8%) имела место метаплазия.
При рентгенологическом изучении частоты рефлюкса контрастной взвеси в пищевод в положении Тренделенбурга рефлюкс умеренной степени выявлен только у 2 обследованных больных (2,41%) с КПЭЭА. Среди пациентов контрольной группы рефлюкс выявлен у 32 (63,0%) (р<0,001), при этом у двух третей обследованных степень выраженности заброса была значительной.
Таким образом, полученные нами данные убедительно свидетельствуют о том, что применение функционально адекватных пищеводных анастомозов при ГЭ сопровождается значительно более низкой частотой и степенью развития рефлюксных осложнений со стороны анастомоза, чем традиционных методов.
Основной функциональной особенностью КПЭЭА, отличающей его от других конструкций, является свободная проходимость для пищевого комка только в одном направлении и клапанное закрытие анастомоза, предупреждающее обратный транзит пищи. Изучение рентгенологических данных показало наличие следующих механизмов функционирования анастомоза: 1) диафрагмальный компонент, обусловленный сокращением диафрагмального мышечного жома, восстановленного швами-вязками; 2) пищеводный компонент – сокращение мышечных слоев пищевода в зоне нижнего пищеводного сфинктера; 3) кишечный компонент, обусловленный перистальтикой охватывающей пищевод петли тонкой кишки; 4) клапанный компонент, обусловленный газовым пузырем созданного кишечного резервуара.
При манометрическом исследовании в области КПЭЭА регистрируется подъем давления, достигающий 12,8±3,1 мм. рт. ст. и указывающий на наличие тонуса искусственной кардии, протяженность зоны повышенного давления составляет 25 – 50 мм (в среднем 41,7±6,1 мм). Изучение манометрических показателей позволило нам уточнить некоторые механизмы антирефлюксной активности концево-петлевого ЭЭА. Эти механизмы включают: спонтанное волнообразное действие мускулатуры тонкой кишки на стенку пищевода, действие ее при рефлекторном усилении мышечной активности кишки после раздражения кишечной слизистой водой или пищей, действие мускулатуры диафрагмы, а также действие собственной мускулатуры терминальных отделов пищевода.
У всех пациентов после ГЭ констатировано снижение всех показателей КЖ в сравнении с контрольной группой, наиболее выраженное в группе больных с простыми конструкциями анастомозов.
При оценке клинико-функциональных результатов ПРЖ худшие показатели имели место среди пациентов с I вариантом соустья. В этой группе клинически отмечались наибольшая частота и степень выраженности симптома изжоги (21,4% против 8,3 и 0% в группах II и III, p<0,05), дисфагии (10,6%), регургитации (6,4%). Клинические данные четко корелировали и данными инструментальных методов исследования. У больных I группы эндоскопические признаки эзофагита зарегистрированы у 15 обследованных пациентов (31,9%): у 3 (6,4%) катаральный, у 12 (25,5%) – эрозивный, у трети больных этой группы отмечено наличие слизи, жидкости и примеси пищи в просвете пищевода, что свидетельствовало о нарушении проходимости анастомоза, а также о наличии гастро-эзофагеального рефлюкса. В группах II и III частота и выраженность рефлюкс-эзофагита было статистически значимо меньше (p<0,05), в частности, эрозивных поражений СО пищевода не отмечено ни в одном случае. Помимо большей частоты и степени выраженности эзофагита у 6 больных I группы (12,8%) была нарушена проходимость анастомоза, у 2 из них отмечался выраженный стеноз соустья, что проявлялось дисфагией умеренной и выраженной степеней. У 12 (25,5%) I группы отмечено неполное смыкание соустья, у 1 больного (2,1%) анастомоз зиял. У 34,0% обследованных пациентов I группы отмечались те или иные изменения со стороны непосредственно анастомоза - гиперемия, отечность, паралигатурные эрозии. Морфологические критерии эзофагита выявлены приблизительно у 25% пациентов I группы, у 20,8% из них морфологически подтверждено эрозивное поражение слизистой, в то время как в биоптатах пациентов III группы эрозии не обнаружены ни в одном случае, во II группе – только в одном биоптате. При рентгенологическом исследовании гастроэзофагеальный рефлюкс зафиксирован у 10 (14,7%) пациентов после ПРЖ: у 6 больных с I вариантом концевого пищеводно-желудочного анастомоза он был выраженный, у 3 умеренной степени. Во II группе рефлюкс умеренной степени отмечен только у 1 пациента.
Сопоставляя полученные морфофункциональные результаты с особенностями выполненной операции следует констатировать, что у пациентов II и III групп ПЖА формировался при наличии достаточной длины культи абдоминального отдела пищевода – не менее 4,0 см, что позволяло сформировать полноценный инвагинационный клапан или концево-петлевой ЭЭА при еюногастропластике. У 15 обследованных пациентов I группы была выполнена резекция абдоминальной части пищевода и ПЖА формировался на уровне или выше уровня диафрагмы в условиях сагиттальной диафрагмокруротомии. При резекции абдоминального отдела пищевода создать полноценную клапанную конструкцию без фиксации клапана к диафрагме практически не представляется возможным. Отсутствие фиксации пищевода к диафрагме в условиях полного разрушения естественного связочного аппарата создает условия для миграции соустья в средостение вследствие развивающегося укорочения пищевода. Этим фактом объясняются сравнительно худшие морфофункциональные результаты у пациентов I группы.
При изучении манометрических характеристик пищевода в сроки 1 год и более обнаружились различия между группами больных в зависимости от типа анастомоза. В группе пациентов с 1 типом анастомоза изменения моторики пищевода выражались в снижении амплитуды и увеличении продолжительности перистальтических волн. Подобная картина сократительной активности пищевода свидетельствуют о развитии воспалительных изменений в пищеводе и ухудшении его опорожнения, что характерно для эзофагита. У пациентов II и III групп подобные изменения были выражены в меньшей степени. Протяженность и тонус сформированного инвагинационного клапана была наибольшей у пациентов с II типом анастомоза, у больных с концевым инвагинационным анастомозом протяженность клапана была существенно меньше. У больных III группы показатели протяженности и тонуса пищеводно-кишечного соустья были сопоставимы с аналогичными показателями у пациентов после ГЭ.
Пациенты, перенесшие экономную проксимальную резекцию желудка с инвагинационным ПЖА и проксимальную резекцию желудка с еюногастропластикой с концево-петлевым эзофагоэнтероанастомозом характеризовались более высокими показателями КЖ по шкалам физического и психического здоровья.
Анализ механизмов реализации арефлюксной функции концевых инвагинационных пищеводно-желудочных анастомозов показал наличие нескольких компонентов. Как и в концево-петлевом пищеводном соустье, одна из основных ролей принадлежит диафрагмальному компоненту, включающему мышечный диафрагмальный жом и искусственный связочный аппарат. Активный мышечный компонент в инвагинационных конструкцииях играет меньшую роль, чем в концево-петлевых анастомозах, тем не менее, мышечная «петля» из стенки желудка при прохождении перистальтических и антиперистальтических волн способствует полному перекрытию просвета анастомоза. Относительно большее значение в инвагинационных конструкциях имеет клапанный компонент: подвижный клапан, сформированный из слизисто-подслизистого слоя с избыточной складчатостью смыкается за счет газового пузыря культи желудка при повышении внутрипросветного давления в культе в процессе заполнения ее пищей.
ВЫВОДЫ
- Хирургическая технология формирования кишечной раны однорядным серозно-мышечно-подслизистым швом с расширенным сопоставлением подслизистых слоев при формировании концевых анастомозов на тонкой и толстой кишке позволяет осуществлять адекватный визуальный контроль за сохранностью сосудистой сети подслизистой основы, обеспечивает точное сопоставление одноименных слоев кишечной стенки и создает оптимальные условия регенерации кишечной раны, что в сравнении с другими прецизионными однорядными швами в эксперименте обеспечивает более быструю эпителизацию соустья и значительно меньший объем рубцовой ткани на уровне мышечного и подслизистого слоев.
- Желудочно-кишечный анастомоз концево-петлевой конструкции (в условиях эксперимента) при пропускании через него жидкости с постоянными скоростями, а также при моделировании кратковременных ритмичных подъемов давления в условиях эксперимента, функционирует как единый механизм с псевдопилорическим каналом культи желудка и выполняет функции дозированного постепенного опорожнения культи желудка и препятствия рефлюксу из отводящей петли в культю желудка. Пищеводно-кишечный анастомоз концево-петлевой конструкции в аналогичных условиях обеспечивает беспрепятственный антеградный пассаж через пищевод и соустье и проявляет выраженные антирефлюксные свойства при ретроградном направлении движения жидкости.
- Концево-петлевой ГЭА в условиях хронического эксперимента функционирует согласованно с культей желудка и обеспечивает разобщение полостей желудка и тонкой кишки. Это способствует более полной компенсации моторной функции верхних отделов ЖКТ, сохранению функциональной активности СО культи желудка в части продукции гликопротеидов, незначительной степени выраженности атрофических процессов в СО культи желудка.
- В группах пациентов с пластическими функционально адекватными анастомозами при ГЭ, дистальной и проксимальной резекции желудка госпитальная летальность, частота и тяжесть осложнений раннего послеоперационного периода ниже, чем в группах с традиционными соустьями.
- Дистальная резекция желудка с концево-петлевым гастроэнтероанастомозом в отдаленном периоде имеет преимущества перед резекцией желудка по способам Бильрот I и II, выражающиеся более низкой частотой и степенью диспепсического синдрома, демпинг-синдрома, рефлюкс-эзофагита и гастрита, меньшей частотой и активностью атрофических и диспластических процессов в слизистой оболочке культи желудка, более высокими параметрами качества жизни пациентов. Концево-петлевой анастомоз, проявляя себя как функционирующая структура, обеспечивает восстановление периодичности и координации моторной деятельности культи желудка, порционность эвакуации пищи, препятствует рефлюксу дуоденального/энтерального содержимого в культю желудка, предупреждает развитие постгастрорезекционных синдромов.
- Концево-петлевой эзофагоэнтероанастомоз у большинства больных в отдаленном послеоперационном периоде после ГЭ сохраняет все свои структурные элементы и функциональные возможности, обеспечивает свободную и порционную эвакуацию и адекватно замещает разобщающую функцию утраченной кардии, что предупреждает развитие рефлюкс-эзофагита и других поздних послеоперационных осложнений. Отсутствие клапанных устройств в простых концевых и концево-боковых анастомозах лишает их арефлюксной функции и приводит к развитию у большинства пациентов регургитационных синдромов. Варианты реконструкции после ГЭ, предусматривающие включение в пассаж пищи ДПК имеют преимущества перед выключающими ДПК схемами в плане частоты и тяжести течения демпинг-синдрома.
- Пластические арефлюксные пищеводно-желудочные анастомозы при ПРЖ обеспечивают хорошие отдаленные клинические и функциональные результаты у большинства пациентов в отдаленном периоде. Частота и степень выраженности рефлюкс-эзофагита после ПРЖ зависит от объема резекции желудка и абдоминального отдела пищевода и от конструкции пищеводно-желудочного анастомоза: наибольшая она после ПРЖ с концевым инвагинационным анастомозом, наименьшая – после ПРЖ с еюногастропластикой с концево-петлевым эзофаго-энтероанастомозом.
- В реализации антирефлюксной функции пищеводно-кишечного анастомоза концево-петлевой конструкции принимают участие активные функциональные механизмы, включающие двигательную активность самого пищевода, движения диафрагмы, спонтанное волнообразное действие мускулатуры тонкой кишки на стенку пищевода, а также действие кишечной петли при рефлекторном усилении мышечной активности в результате раздражении ее слизистой оболочки поступающей через анастомоз пищей.
- В функционировании концевых инвагинационных пищеводно-желудочных анастомозов при ПРЖ одна из основных ролей принадлежит диафрагмальному компоненту, включающему мышечный диафрагмальный жом и искусственный связочный аппарат. Активный мышечный компонент при прохождении перистальтических и антиперистальтических волн создает зону повышенного давления на границе пищевода и культи желудка, в которой кроме постоянного тонического компонента присутствуют и фазовые колебания.
