Отчет о научно-исследовательской работе
| Вид материала | Отчет |
- Реферат отчет о научно-исследовательской работе состоит, 61.67kb.
- Отчёт о научно-исследовательской работе за 2011 год, 1208.93kb.
- Отчёт о научно-исследовательской работе за 2009 год, 851.3kb.
- Отчёт онаучно-исследовательской работе гу нии но ур за 2010 год, 997.69kb.
- Отчет о научно-исследовательской работе профессорско-преподавательского состава, 617.56kb.
- Отчет о научно-исследовательской работе; пояснительная записка к опытно-конструкторской, 14.47kb.
- Отчет о научно-исследовательской работе (итоговый), 2484.06kb.
- Отчет о научно-исследовательской работе, 2473.27kb.
- Отчет о научно-исследовательской работе, 392.92kb.
- Задачи секции: широкое привлечение учеников к участию в научно исследовательской работе;, 67.94kb.
Федеральное государственное образовательное учреждение
высшего профессионального образования
«Московская государственная академия
ветеринарной медицины и биотехнологии имени К. И. Скрябина»
| УДК 544.7 № госрегистрации 01200961265 Инв.№ | УТВЕРЖДАЮ Ректор ФГОУ ВПО МГАВМиБ, академик РАСХН ______________Ф.И. Василевич «___» ___________ 2009 г. |
ОТЧЕТ О НАУЧНО-ИССЛЕДОВАТЕЛЬСКОЙ РАБОТЕ
Проведение научных исследований коллективами научно-образовательных центров в области коллоидной химии и поверхностных явлений.
по теме:
РАЗРАБОТКА МЕТОДИК И СОЗДАНИЕ БИОХИМИЧЕСКИХ КОЛЛОИДНЫХ СИСТЕМ ДЛЯ ВЕТЕРИНАРНО-БИОЛОГИЧЕСКИХ И ЗООТЕХНИЧЕСКИХ НАПРАВЛЕНИЙ
(промежуточный)
Этап первый:
«Выбор направлений исследований и этап предварительных исследований по ферментным коллоидным системам»
Государственный контракт от «07» июля 2009 г. № 02.740.11.0270 в рамках ФЦП «Научные и научно-педагогические кадры инновационной России» на 2009-2013 годы
Мероприятие 1.1 Проведение научных исследований коллективами научно-образовательных центров.
| Руководитель темы | _____________________ (подпись) « __»___________2009г. (дата) | /Балакирев Н.А./ |
Москва 2009
Список основных исполнителей
| Проректор ФГОУ ВПО МГАВМиБ, академик РАСХН | ___________________ подпись, дата | Н.А. Балакирев |
| Зав. кафедрой, д.х.н., д.б.н., проф | ___________________ подпись, дата | С. Ю. Зайцев |
| Проф., д.х.н | ___________________ подпись, дата | М. С. Царькова |
| Доцент, к.б.н. | ___________________ подпись, дата | Т.В. Каштиго |
| Доцент, к.х.н. | ___________________ подпись, дата | О.С. Белоновская |
| Доцент, к.б.н. | ___________________ подпись, дата | А.А. Лисицына |
| Докторант, к.х.н. | ___________________ подпись, дата | И.Н. Староверова |
| Ст. преподаватель, к.б.н. | ___________________ подпись, дата | Т.О. Азарнова |
| Зав. уч. лабораторией, к.б.н. | ___________________ подпись, дата | И.В. Милаёва |
| Аспирант | ___________________ подпись, дата | Е. Н. Зарудная |
| Аспирант | ___________________ подпись, дата | В. В. Бондаренко |
| Аспирант | ___________________ подпись, дата | А. Н. Тимонин |
| Студент | ___________________ подпись, дата | Д.О. Соловьева |
| Лаборант | ___________________ подпись, дата | М.Н. Шапошников |
Реферат
Отчет 150 с., 6 ч., 31 рис., 10 табл., 121 источник.
Ключевые слова: биохимические коллоидные системы, иммобилизованные ферменты, супрамолекулярные ферментные комплексы, ферментные коллоидные системы, коллоидно-химические свойства, белки, полиэлектролиты.
Объекты исследования и разработки. Анализ научно-технической литературы и других материалов, относящихся к биохимическим коллоидным системам, ферментным комплексам и иммобилизованным ферментам, патентные исследования. Получение комплексов липаз с пептидами, изучение каталитической активности таких комплексов в зависимости от условий. Синтез полимерного антистатического средства для текстильных материалов и меха, исследование его термостабильности, антистатических свойств и адгезионных характеристик.
Цели работы по первому этапу
- Анализ научно-технической литературы и других материалов, относящихся к ферментным коллоидным системам (ФКС). Информационно-аналитическое обеспечение исследований ФКС.
- Патентные исследования по ФКС.
- Описание постановки и научно-техническая реализация проведения исследований ФКС.
- Изучение каталитических свойств липаз в комплексе с белками и пептидами.
- Разработка способа получения полимерного антистатического средства и изучение его коллоидно-химических свойств.
- Анализ и обобщение полученных на 1 этапе результатов НИР.
Метод и методология проведения работы включали: анализ научно-технической литературы и других материалов путём изучения печатных и электронных, отечественных и зарубежных изданий, относящихся к ФКС, патентный поиск по международной базе данных, описание постановки и технической реализации проведения исследований, разработка сетевого графика, проведение экспериментальных работ по получению комплексов ферментов (на примере липаз из разных источников) с белками и пептидами, изучение каталитической активности таких комплексов при разном соотношении полимер : липаза. Синтез полимерного антистатического средства на основе сополимеров N,N’-диметил-N,N’-диаллиламионий хлорида и метилметакрилата (ММА), отличающегося большой адгезивной способностью к текстильным материалам и образующего пленкообразные покрытия с высокими антистатическими и термическими свойствами.
В работе использованы следующие физико-химические методы исследования:
потенциометрическое титрование, тензиометрия, ЯМР-спектроскопия, термогравиметрический анализ.
Результаты работы
1. Проведён анализ научно-технической литературы и других материалов, относящихся к ФКС. Изучены методы получения ФКС, их свойства, применение в биологии, медицине, технологии живых систем.
2. Проведенные патентные исследования выявили патентную чистоту разрабатываемых в рамках данного проекта ФКС.
3. Разработана и описана постановка и техническая реализация проведения исследований по ФКС.
- Изучены каталитические свойства липаз из разных источников (из поджелудочной железы свиньи, бактерий Pseudomonas fluorescence, гриба Mucor javanicus) в комплексе с белками и пептидами.
- Разработан способ получения полимерного антистатического средства и изучены его коллоидно-химические свойства.
- Проведен анализ и обобщены полученные на 1 этапе результаты НИР.
Рекомендации по внедрению результатов НИР
Разработка методик и создание биохимических коллоидных систем с использованием современных методических и инструментальных достижений позволит решить ряд актуальных фундаментальных проблем в области коллоидной химии и поверхностных явлений, а также прикладных задач биомедицины и экологии, нано- и биотехнологии, ветеринарии и зоотехнии. Биохимические коллоидные системы на основе ферментов позволят выявить молекулярные механизмы каталитической активности и расширить ассортимент и области применения ферментных препаратов в производстве моющих средств, поверхностно- и биологически-активных соединений, вкусовых и ароматических компонентов, для аналитических и лекарственных целей в медицине и ветеринарии. Особенное значение приобретает разработка и внедрение более эффективных средств диагностики и мониторинга состояния организма животных, что является неотъемлемой частью научно-технического прогресса в развитии животноводства на современном этапе и будет реализовано в данной НИР на базе достижений коллоидной химии.
Выполнение НИР обеспечит достижение научных результатов мирового уровня в решении многих актуальных фундаментальных и прикладных проблем химии и биологии, медицины и экологии, нано- и биотехнологии, ветеринарии и зоотехнии; завершить создание комплексной системы подготовки высококвалифицированных специалистов (от бакалавров и магистров до кандидатов и докторов наук), обладающих особыми компетенциями по профилю данной НИР, что приведет к формированию эффективного и жизнеспособного научного коллектива.
Область применения полученных результатов
Результаты проекта должны быть включены в образовательную программу ФГОУ ВПО МГАВМиБ и использоваться в образовательном процессе на базе научного кадрового потенциала, лабораторного и испытательного оборудования научно-образовательного центра ФГОУ ВПО МГАВМиБ, в том числе в процессе проведения настоящих научно-технических работ.
Новые ФКС, разработанные на основе липазы, могут найти применение в биотехнологии, пищевой промышленности, производстве кормов и т.д. Разработанные способы получения антистатических средств будут использованы в текстильной промышленности. Проведенные исследования новых ФКС на основе липаз из поджелудочной железы свиньи, бактерий Pseudomonas fluorescence, гриба Mucor javanicus исключительно важны для дальнейшей работы по оптимизации каталитической активности этих ферментов с учётом физико-химических параметров и выбора полиэлектролита. Полученные на данном этапе результаты являются ключевыми для успешного выполнения всего проекта.
Прогнозные предположения о развитии объекта исследования
В процессе проведения НИР должны быть разработаны технологические параметры ФКС и методические рекомендации по их использованию для различных областей применения, в том числе: экспериментальные образцы; методики испытаний экспериментальных образцов; технологии получения биохимических коллоидных систем.
В ходе выполнения этапа НИР будут получены результаты интеллектуальной деятельности (статьи, патенты и т.д.); учебно-методические комплексы, включающие учебно-методические пособия, указания и рекомендации; примерные и рабочие учебные программы, практикумы по дисциплинам «Биохимия мембран», «Физическая и коллоидная химия», «Кинетика и термодинамика ферментативных реакций», «Энзимология», «Биоэнергетика», «Бионанотехнология» и другие.
СОДЕРЖАНИЕ
| Реферат ……………………………………………………………………………………….…… | 3 |
| Введение ……………………………..………………………………………………………….… | 10 |
| 1.1 Анализ научно-технической литературы и других материалов, относящихся к ферментным коллоидным системам (ФКС). Информационно-аналитическое обеспечение исследований ФКС | 12 |
| 1.1.1 Ферменты – коллоидные частицы ………………………………………………………..… | 12 |
| 1.1.2 Типы наночастиц ……………………………………….…………………………………... | 13 |
| 1.1.3 Супрамолекулярные комплексы ферментов …………………………………………….... | 16 |
| 1.1.4 Общие принципы иммобилизации ферментов и свойства супрамолекулярных ферментативных систем ………………………………………………………………..….……… 1.1.5 Иммобилизированные ферменты – устойчивые системы………………………………… 1.1.6 Применение иммобилизированных ферментов……………………………………………. 1.1.7 ФКС – диагностические тест-системы……………………………………………………… 1.1.8 Инкапсулирование ферментов……………………………………………………………… 1.1.9 Использование иммобилизованных ферментов в терапии………………………………... 1.1.10 Другие области применения ФКС…………………………………………………………. 1.1.11 Нанокапсулированные ферментные системы…………………………………... 1.1.12 Информационно-аналитическое обеспечение исследований ФКС……………………… | 39 51 53 61 63 66 72 75 85 |
| 1.2 Проведение патентных исследований по ФКС | 97 |
| 1.3 Описание постановки и научно-техническая реализация проведения исследований ФКС ………………………………………………………………………………………………… | 109 |
| 1.3.1 Определение активности липазы методом потенциометрического титрования………… 1.3.2 Определение динамического поверхностного натяжения (ДПН) ферментных систем…. 1.3.3 Исследование термических и термоокислительных свойств новых сополимеров и антистатических свойств обработанных ими материалов………………………………………. 1.3.4 Статистическая обработка результатов…………………………………………………….. 1.3.5 Планирование разработки с использованием сетевого графика………………………….. 1.4 Изучение каталитических свойств липаз в комплексе с белками и пептидами…...… 1.4.1 Определение каталитической активности липаз из различных источников в присутствии природного полимера – бычьего сывороточного альбумина (БСА)…………….. 1.4.2 Измерение ДПН растворов липазы из поджелудочной железы свиньи в смеси с бычьим сывороточным альбумином……………………………………………………………… 1.4.3 Измерение ДПН растворов липазы из поджелудочной железы свиньи в смеси с поли-L-глутаминовой кислотой………………………………………………………………………… 1.4.4 Измерение ДПН растворов липазы из поджелудочной железы свиньи в смеси с поли-L-лизином………………………………………………………………………………………….. 1.4.5 Измерение ДПН растворов липазы из поджелудочной железы свиньи в трехкомпонентном комплексе с поли-L-лизином и поли-L-глутаминовой кислотой…..…… | 111 112 115 119 120 126 126 127 129 130 131 |
| 1.5 Разработка способа получения полимерного антистатического средства и изучение его коллоидно-химических свойств…………………………………………………………… | 132 |
| 1.6 Анализ и обобщение полученных на 1 этапе результатов НИР …………….………... | 139 |
| Список использованных источников…………………………………………………………. | 141 |
ОБОЗНАЧЕНИЯ И СОКРАЩЕНИЯ
АЛТ Аланинаминотрансфераза
АМ Антимикробные полимеры
6-АПК 6-аминопенициллановая кислота
АСТ Аспартатаминотрансфераза
БАС Биологически активное соединение
ГГТ Гамма-глутамилтрансфераза
ГОД Глюкозооксидаза
ИЖ Ионы железа
ИМ Иммозим
ИН Инулиназа
ИП Иммобилизованная пектиназа
ИПЕ Иммобилизованная пектиназа
КФ Классификация ферментов
КК Креатинкиназа
ОПА Общая протеолитическая активность
ЛДГ Лактатдегидрогеназа
ПАА Поли(аллиламин)
ПААГ Полиакриламидный гель
ПАВ Поверхностно-активные вещества
ПАМАМ Полиамидоамин
ПВС Поливиниловый спирт
ПДДА Поли(диметилдиаллиламмоний хлорид)
ПЕ Пектиназа
ПНМК Полиэлектролитные нано- и микрокапсулы
ПР Пектиновый раствор
ПСС Поли(стиролсульфонат)
ПЭ Полиэлектролит
ПЭГ Полиэтиленгликоль
ПЭИ Поли(этиленимин)
ПЭНП Полиэтилен низкой плотности
ПФ Пиридоксальфосфат
СБ Селективные барьерные свойства
СБС Супрамолекулярная биологическая система
СМС Синтетические моющие средства
СНС Супрамолекулярные наноразмерные системы
ФКС Ферментные коллоидные системы
ЭДТА Этилендиаминтетрауксусная кислота
Введение
Создание супрамолекулярных биохимических систем (СБС) на основе таких биоорганических соединений, как белки, пептиды, липиды и их синтетических производных, является одной из наиболее интересных и активно развивающихся в настоящее время областей исследований, находящаяся «на стыке» органической и биологической химии, полимерной и коллоидной химии, физической и аналитической химии, ряда современных направлений биологических и медицинских наук. По определению одного из основоположников супрамолекулярной химии и лауреата Нобелевской премии по химии Жан-Мари Лена «супрамолекулярная химия – это химия межмолекулярных связей, изучающая ассоциацию двух и более химических частиц, а также строение и свойства подобных ассоциаций». Наиболее наглядными примерами такого рода СБС могут служить мембранные системы, широко используемые для моделирования структуры и функции биомембран, а именно: мономолекулярные слои (монослои) и пленки Ленгмюра-Блоджетт, плоские бислойные липидные мембраны (БЛМ), сферические би- и полислойные мембраны (везикулы, липосомы и аналоги). Главным недостатком указанных систем является их невысокая стабильность в отличие от природных мембран, стабилизированных электростатическими и гидрофобными взаимодействиями интегральных и периферических белков, пептидов, липидов и гликолипидов. Одним из наиболее успешных подходов к решению этой важной проблемы, развиваемых и автором с сотрудниками, является создание полимерных монослоев, БЛМ и липосом на основе липидоподобных и поверхностно-активных мономеров.
Последние достижения в области СБС связаны с зарождением и бурным развитием нанотехнологии, в том числе – биомедицинской нанотехнологии (биомеднанотехнологии), бионанотехнологии или нанобиотехнологии, которые многими авторами рассматриваются как синонимы. Одно из возможных определений бионанотехнологии (биомеднанотехнологии) может быть представлено как особая область биохимических и биомедицинских наук, занимающаяся изучением принципов создания и функционирования биологических наноразмерных систем; применением полученных знаний для усовершенствования существующих и создания принципиально новых бионаноматериалов, биотехнологических процессов и бионаноразмерных устройств; новых нанотехнологий для локальной селективной диагностики, терапии, хирургии, генной инженерии и биотехнологии. Активное развитие этой области связано с крупными достижениями в биохимии и молекулярной биологии клетки, в познании механизмов действия клеточных и субклеточных систем, а также – с развитием новых методов исследования наноразмерных биосистем, физиолого-биохимических показателей в организме животных и человека. В простейшем случае, даже отдельные сложные белки (хромопротеины, металопротеины, липопротеины, гликопротеины и т.д.), можно рассматривать как природные наносистемы, структурно и функционально оптимизированные в процессе эволюции. Тем более, это относится к их супрамолекулярным системам (агрегатам белков и т.д.), образующимся путем фундаментальных принципов самоассоциации и молекулярного узнавания.
1.1 Анализ научно-технической литературы и других материалов, относящихся к ферментным коллоидным системам (ФКС). Информационно-аналитическое обеспечение исследований ФКС.
Отв. исполнители: зав. кафедрой ФГОУ ВПО МГАВМиБ, проф. д.х.н, д.б.н. С.Ю. Зайцев; доцент, к.б.н. О.С. Белоновская.
1.1.1 Ферменты – коллоидные системы
Глобальная роль коллоидов в естествознании заключается в том, что они являются основными компонентами таких биологических образований как живые организмы. Все биополимеры организма человека и животных представляют собой коллоидные системы.
Практически любая жидкость или ткань организма человека представляет собой коллоидно-дисперсную среду. Таковыми являются, например, кровь, лимфа, молоко содержимое желудочно-кишечного тракта, желчь, спинномозговая жидкость, моча. Веществами, имеющими размеры и обладающими свойствами коллоидных частиц в живом организме, являются белки (в том числе, ферменты), полисахариды, нуклеиновые кислоты.
Ферменты — это белки, т.е. относительно лабильные полипептидные соединения природного происхождения. Молекулы ферментов содержат уникальные структуры, возникающие в результате упорядоченного свертывания полипептидной цепочки, которое происходит при синтезе фермента. В нем появляется сравнительно ограниченная область, состоящая из реакционноспособных химических групп и исполняющая каталитические функции. Геометрическое строение такой области, называемой активным центром, исключительно точно «настроено» на размеры и химические особенности молекул тех веществ, реакции которых катализирует данный фермент. Благодаря этому ферменты обладают чрезвычайно высокой каталитической активностью и специфичностью. Например, химотрипсин, сравнительно малоактивный фермент, в желудочно -кишечном тракте в реакциях гидролиза пептидов и сложных эфиров в 107 раз активнее, чем ион гидроксила.
Специфичность ферментов весьма высока, нередки случаи, когда она абсолютна. Последнее означает, что данный фермент способен катализировать превращение одного-единственного вещества из многих сотен или тысяч веществ близкой химической природы. Известны, однако, ферменты относительно слабой специфичности. Все эти особенности способствуют использованию ферментов в практике, так как в каждом конкретном случае удается выбрать фермент нужной специфичности.
Широкому применению ферментов в различных областях химии, включая ее прикладные направления, до последнего времени мешали три обстоятельства: относительно высокая стоимость ферментов; их высокая лабильность; трудность отделения от продуктов химических реакций для повторного использования.
Развитие микробиологических методов получения ферментов практически полностью решило первую проблему. Сегодня микроорганизмы стали источником производства большого числа ферментов как для научных, так и для технических целей. Можно высказать твердую уверенность, что с дальнейшим совершенствованием микробиологической технологии цена ферментов будет неуклонно понижаться. [1]
1.1.2 Типы наночастиц
«Нано» (греч. – миллиардная доля) в применении к описываемым объектам подразумевает, что их размеры находятся в пределах 1÷500 нм (от 10−9до 510-7м), что соответствует уровням биологической организации от атомарного до субклеточного. Таким образом, под определение «наночастицы», вообще-то, попадают практически любые супрамолекулярные комплексы. Однако, по уже сложившейся традиции в биологической и медицинской литературе, под наночастицами обычно подразумевают вполне конкретные молекулярные конструкции.
Наночастицы можно условно разделить на несколько классов (рис. 1).
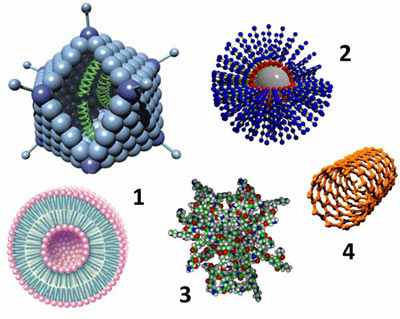
Рисунок 1 – Наночастицы, используемые в доставке терапевтических молекул. 1 – липосома (внизу) и аденовирус (вверху); 2 – полимерная наноструктура; 3 – дендример; 4 – углеродная нанотрубка.
Биологические и биогенные наночастицы. Биологический мир буквально наполнен наночастицами – это ферменты (белки с каталитической активностью), молекулы ДНК и РНК, рибосомы, клеточные везикулы, вирусы и пр. Отличительной особенностью таких объектов является их способность к агрегации и самоорганизации. Это свойство активно используется при создании искусственных конструкций, имитирующих реальные биологические структуры. Яркий пример представляют собой различные однокомпонентные и мультикомпонентные липосомы, которые способны при определенных условиях формироваться из раствора смеси липидов. Часто на практике используют и уже существующие в природе биологические наночастицы. Например, различные вирусы активно применяют для генной модификации (трансфекции) клеток. Показано, что аденовирусы с подавленной системой репликации могут быть эффективно использованы и для местной неинвазивной вакцинации через кожу (доставке антигенов к клеткам Лангерганса, присутствующим в коже) [2]. К искусственным биогенным наночастицам, предназначенным для направленной доставки, помимо липосом обычно также относят липидные нанотрубки [16], липидные наночастицы и наноэмульсии, циклические пептиды [4], хитозаны, наночастицы на основе нуклеиновых кислот [5].
Полимерные наночастицы. Полимерные материалы обладают рядом преимуществ, определяющих эффективность их применения в технологиях доставки, – биосовместимость, способность к биодеградации, функциональная совместимость. Типичными соединениями, которые представляют основу для создания полимерных наночастиц, являются полимолочная и полигликолевая кислоты, полиэтиленгликоль (ПЭГ), поликапралактон и др., а также их различные сополимеры. ПЭГ часто используют для повышения стабильности различных молекулярных переносчиков. Например, липосомы, покрытые ПЭГ («стелс-липосомы»), по сравнению с обычными, менее подвержены биодеградации, в результате чего обладают заметным пролонгированным действием [6].
Дендримеры. Дендримеры являются уникальным классом полимеров с сильно разветвлённой структурой. При этом их размер и форма могут быть очень точно заданы при химическом синтезе [7]. Дендримеры получают из мономеров, проводя последовательные конвергентную и дивергентную полимеризации (в том числе используя методы пептидного синтеза). Типичными «мономерами», используемыми в синтезе дендримеров, являются полиамидоамин (ПАМАМ) и аминокислота лизин. «Целевые» молекулы связываются с дендримерами либо путём образования комплексов с их поверхностью, либо встраиваясь глубоко между их отдельными цепями. Контролируемые размеры и свойства поверхности, а также стабильность дендримеров делают их весьма перспективными для использования в качестве переносчиков. На животных моделях показана эффективность их применения для трансдермальной доставки ряда препаратов [8].
Углеродные наночастицы. Нанотрубки и фуллерены являются одними из самых «узнаваемых» наноструктур – практически ни один популярный текст про нанотехнологии не обходится без их изображений. За открытие этой новой формы существования углерода Р. Керл, Р. Смолли и Г. Крото в 1996 г. были удостоены Нобелевской премии по химии. Эти структуры, образованные только атомами углерода, могут быть получены при помощи вольтовой дуги, лазерной абляцией (выжиганием), химическим осаждением из газовой фазы, а также в процессе горения. Сегодня в промышленных масштабах фуллерены получают термическим распылением углеродсодержащей сажи в атмосфере инертного газа при пониженном давлении в присутствии катализатора. Нанотрубки обладают повышенным сродством к липидным структурам; при этом они способны образовывать стабильные комплексы с пептидами и ДНК-олигонуклеотидами [9, 10], и даже инкапсулировать эти молекулы [11, 12]. Это определяет их применение в области создания эффективных систем доставки вакцин и генетического материала [13].
Неорганические наночастицы. К этому классу обычно относят наноструктуры, полученные на основании оксида кремния, а также различных металлов (золото, серебро, платина). При этом часто такая наночастица имеет кремниевое ядро и внешнюю оболочку, сформированную атомами металла. Использование металлов позволяет создавать переносчики, обладающие рядом уникальных свойств. Так, их активность (и в частности, высвобождение терапевтического агента) может быть модулирована термическим воздействием (инфракрасное излучение), а также изменением магнитного поля [13]. При этом показано, что металлические наночастицы могут эффективно проникать вглубь эпидермиса [14].
Использование описанных выше наночастиц в медицине позволит не только эффективно доставлять биологически активные молекулы сквозь различные барьеры организма, которые они не способны преодолевать самостоятельно (кожный, гематоэнцефалический), но и существенно изменять характер действия препарата. Например, трансдермальная доставка, по сравнению с доставкой через кровяное русло, позволяет избежать нежелательных побочных эффектов, снизить эффективную дозу препарата за счет существенного повышения его локальной концентрации. Кроме того, было показано, что у терапевтических молекул, доставляемых в организм с помощью наночастиц, меняется фармакокинетика. Если для препаратов, попадающих в организм перорально или в результате инъекции, увеличение концентрации во времени описывается характерной кинетической кривой первого порядка (концентрация экспоненциально увеличивается во времени), то в случае использования наночастиц наблюдается идеальная временная зависимость нулевого порядка (равномерное увеличение концентрации препарата во времени) [13]. Это позволяет более точно планировать дозировки препарата и пролонгировать его действие.
1.1.3 Супрамолекулярные комплексы ферментов
Хорошо известно, что существование организма животного неразрывно связано с множеством биохимических реакций клеточного метаболизма. Эти реакции протекают в присутствии специфических белков – ферментов, наделенных каталитическими свойствами [14–16]. Имеющаяся обширная и доступная литература по ферментам позволяет не останавливаться на определении классов и всех характеристик этих специфических белков [14–16] (в списке литературы к данной диссертации цитируются только некоторые издания, необходимые для этой работы). В данном разделе литературного обзора основное внимание будет уделено структурно-функциональной характеристике только некоторых ферментов (наиболее важных для нашего исследования) из их огромного множества, существующего в природе. На сегодня выделено более 3500 ферментов, для нескольких сотен из которых уже определена трехмерная пространственная структура [14–16].
Наиболее полной и широко известной является классификация ферментов (КФ) по типу катализируемой биохимической реакции [16]. Эта «функциональная» классификация, принятая в Москве на Международном биохимическом съезде в 1961 году, выделяет 6 классов ферментов: оксидоредуктазы; трансферазы; гидролазы; лиазы; изомеразы; лигазы (синтетазы) [14–16]. В последнее время активно развивается классификация ферментов по уровням структурной организации. На взгляд автора, наиболее рациональным и удачным для «структурной» классификации ферментов является использование принципов и подходов, развитых недавно в супрамолекулярной и биоорганической химии [15, 17].
В современной биохимической литературе это иллюстрируется таблицей 1, переведенной из монографии П. Фриедриха (P. Friedrich) [18].

Начиная с работ С.И. Афонского [20], представления о полисубъединичных ферментах и ферментных комплексах как супрамолекулярных системах начинают использоваться и в нашей биохимической литературе. Многие ферменты, определяемые в плазме крови и широко применяемые для диагностики физиолого-биохимического статуса человека и животных, можно отнести к супрамолекулярным ферментным системам, поскольку in vivo: 1) они образуют достаточно сложные комплексы с субстратами и модификаторами различных типов; 2) они состоят из нескольких полипептидных цепей (субъединиц), которые, комбинируясь различными способами, образуют четвертичную структуру фермента; 3) они имеют четко определенный набор изоферментных форм. Последняя характеристика имеет уникальное значение для клинической диагностики патологических состояний определенных органов и тканей как человека, так и животных.
Принято считать, что изоферменты – это группа ферментов, которая катализирует один и тот же тип реакции, но имеет различные физико-химические характеристики [16]. Например, изоферменты различается по величине и распределению электрического заряда (что позволяет выполнить их электрофоретическое разделение), термостабильности, оптимальной величине рН, отношению к ингибиторам, действию на «вторичные» субстраты [16]. Очень важно, что каждый изофермент (точнее – каждая изоферментная форма данного фермента) или их заданный набор локализован в определенных органах и тканях животных, причем все изоферменты имеют единое каталитическое действие на основной субстрат. Установлены изоферментные формы большого числа дегидрогеназ, трансаминаз, оксидаз, фосфатаз, фосфорилаз [14–16]. Ниже будут описаны только сравнительно хорошо изученные изоферментые формы лактатдегидрогеназы и креатинкиназы, а также ряд других ферментов, важных для биохимических исследований и клинической диагностики.
Лактатдегидрогеназа
Лактатдегидрогеназа (ЛДГ) – КФ. 1.1.1.27. - различных органов и тканей человека или животных (рис. 2-4) всегда состоит из 4 полипептидных субъединиц одного или двух типов: М («мышечный» тип субъдиниц) или Н («сердечный» тип субъединиц) [16]. Поэтому лактатдегидрогеназу с полным основанием можно называть супрамолекулярной ферментной системой, которая имеет 4 активных центра, включающих обязательно (в случае ЛДГ человека и животных) по молекуле кофермента – никотинамидадениндинуклеотида (НАД+ или НАДН). ЛДГ, выделенная в кристаллическом виде из мышечной ткани позвоночных, имеет молекулярную массу тетрамера порядка 140000.
Показано, что полипептидная цепь Н-субъединицы ЛДГ1, выделенной из сердечной мышцы человека, состоит из 332 аминокислот с каталитическим центром Asp166 - His193 - Arg169 [16], тогда как полипептидная цепь М-субъединицы ЛДГ5, выделенной из скелетных мышц человека, состоит из 331 аминокислоты, но с каталитическим центром Asp165 - His192 - Arg168.
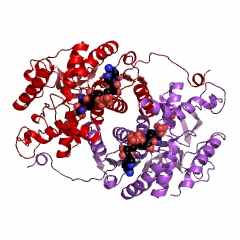 | 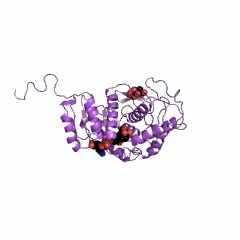 |
| Рисунок 2 – Схематическое изображение М-субъединиц ЛДГ, выделенной из скелетных мышц свиньи (справа) и Н-субъединицы ЛДГ, выделенной из сердечной мышцы свиньи (слева), в комплексе с 2 молекулами НАДН: коды 9ldb (PDB-EBI) и 5ldh (PDB-EBI), соответственно. | |
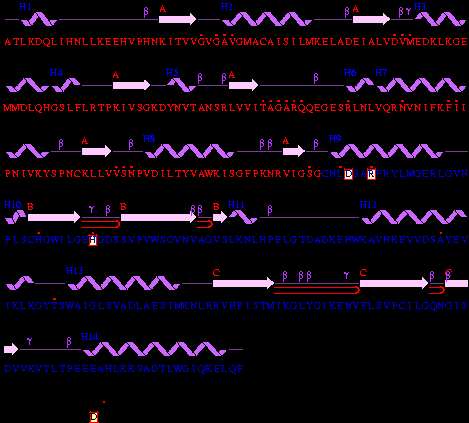 |
| Рисунок 3 – Аминокислотная последовательность М-субъединицы ЛДГ5, выделенной из мышц свиньи (sus scrofa domestica): код 9ldb (PDB-EBI). |
| |
| |
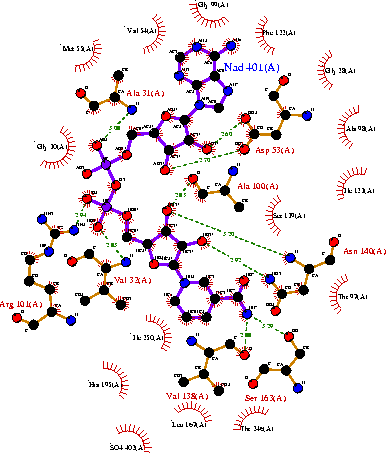 |
| Рисунок 4 – Строение активного центра М-субъединицы ЛДГ, выделенной из мышц свиньи (sus scrofa domestica) в комплексе с коферментом НАДН: код 9ldb (PDB-EBI). |
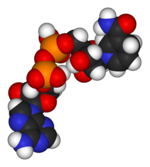 |  |
| Рисунок 5 – Структура кофермента НАДН (слева) и его локализация (справа) в М-субъединицах ЛДГ5, выделенная из мышц свиньи код 9ldb (PDB-EBI). | |
Лактатдегидрогеназа – фермент класса оксидоредуктаз (L-лактат:NAD-оксидоредуктаза) обратимо катализирующий окисление молочной кислоты (L–лактата) в пировиноградную кислоту (пируват), где в качестве промежуточного акцептора водорода требуется кофермент – никотинамидадениндинуклеотид: окисленная форма (НАД+) и восстановленная форма (НАДН+Н+).
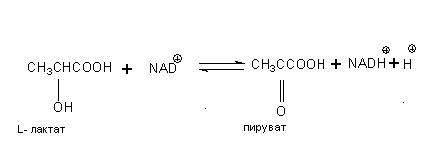
В большинстве животных тканей равновесие катализируемой ЛДГ реакции сильно сдвинуто в сторону образования молочной кислоты; требует присутствия НАДН+Н+ и протекает в анаэробных условиях. Исключение составляют раковые клетки: в них образуется большое количество молочной кислоты в аэробных условиях. Фермент встречается во всех органах и тканях, но наибольшая активность ЛДГ обнаружена в почках, сердце, скелетной мускулатуре и печени. ЛДГ содержится также и в эритроцитах, поэтому сыворотка, используемая для анализа, должна быть лишена даже следов гемолиза. Повышение общей активности в сыворотке отмечается при инфаркте миокарда, лейкозах, тромбоцитопении, повреждениях печени вирусной, токсической и травматической природы, опухолях различной локализации, заболеваниях почек, гемолизе эритроцитов [16].
В тканях животных выявлено 5 изоферментных форм ЛДГ, которые являются тетрамерами, причем каждый орган имеет свой «изоферментный спектр» ЛДГ. Так, тетрамер Н4 или ЛДГ1 – преимущественно локализован в сердечной мышце; тетрамер М4 или ЛДГ5 - локализован как в печени, так и в поперечно-полосатой мышечной ткани; другие три изофермента – гибриды: Н3M1 или ЛДГ2 ; Н2M2 или ЛДГ3 ; Н1M3 или ЛДГ4 – преимущественно локализованы в ретикулоэндотелиальной системе, легких и почках, соответственно. Интересно, что изофермент Н4 помимо реакции «пировиноградная кислота-молочная кислота» может катализировать реакцию «кетоглутаровая кислота-гидроксимасляная кислота», но легко ингибируется пируватом и поэтому особенно полезен для такого «высокоаэробного органа» как сердце. Хотя изофермент М4 эффективен лишь в реакции «пировиноградная кислота-молочная кислота», но он не ингибируется пируватом и поэтому особенно полезен для скелетных мышц, где может создаваться большая нагрузка, требующая мощных процессов анаэробного гликолиза. Обычно активность изофермента Н3М1 в крови человека и животных незначительно выше, чем других изоферментов. Поэтому увеличение активности М4 свидетельствует о патологии печени, а в случае инфаркта миокарда активность изоферментов Н4 и M1Н3 становится значительно выше активности других изоферментов. Указанные различия в активности изоферментов в крови имеют важное значение для клинической диагностики патологических состояний определенных органов и тканей как человека, так и животных.
Креатинкиназа
Креатинкиназа (КК) – КФ. 2.7.3.2. - гетерогенный фермент с молекулярной массой порядка 86000-89000 (рис. 6-11). Комплекс КК состоит из двух субъединиц 2 разных типов (В и М), обладающих молекулярной массой 44500 и 43000 соответственно [16]. В приложение 2 приведено строение полипептидных цепей креатинкиназы (типа ММ) из мышц человека, состоящих из 365 аминокислотных остатков. Каталитический центр состоит из 5 аминокислотных остатков Arg132 - Arg320 - Glu232 - Arg292 - Arg236.
Креатинкиназа катализирует как прямую реакцию переноса фосфорильного остатка с АТФ на креатин, так и обратную реакцию переноса фосфорильного остатка с креатинфосфата на АДФ:
