Отчет о научно-исследовательской работе
| Вид материала | Отчет |
- Реферат отчет о научно-исследовательской работе состоит, 61.67kb.
- Отчёт о научно-исследовательской работе за 2011 год, 1208.93kb.
- Отчёт о научно-исследовательской работе за 2009 год, 851.3kb.
- Отчёт онаучно-исследовательской работе гу нии но ур за 2010 год, 997.69kb.
- Отчет о научно-исследовательской работе профессорско-преподавательского состава, 617.56kb.
- Отчет о научно-исследовательской работе; пояснительная записка к опытно-конструкторской, 14.47kb.
- Отчет о научно-исследовательской работе (итоговый), 2484.06kb.
- Отчет о научно-исследовательской работе, 2473.27kb.
- Отчет о научно-исследовательской работе, 392.92kb.
- Задачи секции: широкое привлечение учеников к участию в научно исследовательской работе;, 67.94kb.
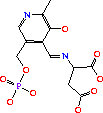
АТФ + Креатин АДФ + Креатинфосфат.
Скорость прямой реакции максимальна при рН 9,0; обратной – при рН 6-8. В организме равновесие сдвинуто в сторону обратной реакции. Активность фермента повышается под влиянием ионов магния, марганца, кальция, глутатиона и цистеина, а ионы цинка, меди и ртути, напротив, оказывают ингибирующее воздействие [16].
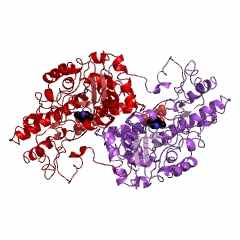
Креатинкиназа (типа КК-ВВ) из мозга цыпленка (Gallus gallus) состоит из двух В-субъединиц (рис. 6): код 1qh4 (PDB-EBI). Полипептидная цепь В-субъединицы креатинкиназы (типа КК-ВВ) из мозга цыпленка состоти из 380 аминокислотных остатков. Хотя эта последовательность отличается, но порядок аминокислотных остатков в калитическом центре этой В-субъединицы Arg132 - Arg320 - Glu232 - Arg292 - Arg236 полностью совпадает с таковой для М-субъединицы креатинкиназы (типа ММ) из мышц человека код 1i0e (PDB-EBI).
Безусловно «супрамолекулярным» является строение ассиметрического комплекса и биологически активного октамера (рис. 7) митохондриальной креатинкиназы (КК-мит.) из сердечной мышцы цыпленка (Gallus gallus): код 1crk (PDB-EBI). Полипептидная цепь субъединицы КК-мит. из сердечной мышцы цыпленка состоит из 380 аминокислотных остатков, как и для приведенной выше В-субъединицы типа КК-ВВ из мозга цыпленка. Однако порядок аминокислотных остатков в калитическом центре этой митохондриальной субъединицы Arg231(A) - Arg287(A) - Arg127(A) - Arg315(A) - Glu227(A) существенно отличается от приведенной выше В-субъединицы креатинкиназы (типа КК-ВВ) из мозга цыпленка.
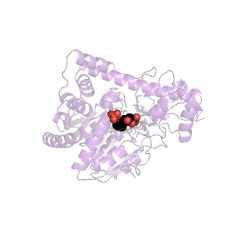
Необычным является строение ассиметрического комплекса и биологически активного димера креатинкиназы из сердечной мышцы кролика (Oryctolagus cuniculus) (рис. 8). Полипептидная цепь субъединицы креатинкиназы из сердечной мышцы кролика состоит из 365 аминокислотных остатков. Как эта последовательность, так и порядок аминокислотных остатков в калитическом центре этой субъединицы Arg132 - Arg320 - Glu232 - Arg292 - Arg236 полностью совпадает с таковой для М-субъединицы креатинкиназы (типа ММ) из мышц человека.
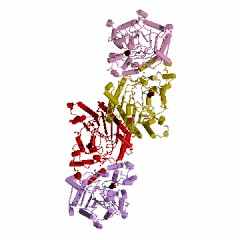 |  |
| Рисунок 6 – Схематическое изображение ассиметрического комплекса (слева) и биологически активного димера (справа) креатинкиназы (типа КК-ВВ) из мозга цыпленка (Gallus gallus): код 1qh4 (PDB-EBI). | |
 | 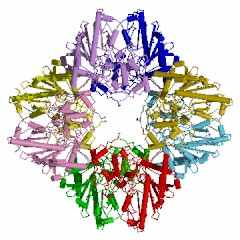 |
| Рисунок 7 – Схематическое изображение ассиметрического комплекса (слева) и биологически активного октамера (справа) митохондриальной креатин-киназы (типа КК-мит) из сердечной мышцы цыпленка: код 1crk (PDB-EBI). | |
 |  |
| Рисунок 8 – Схематическое изображение ассиметрического комплекса (слева) и биологически активного димера (справа) креатинкиназы из сердечной мышцы кролика (Oryctolagus cuniculus. Rabbit): код 2crk (PDB-EBI). | |
Одним из объяснений этого феномена может служить наличие внутри каждой группы изоферментов нескольких изоформ, отличающихся по своим физико-химическим свойствам. Эти факты усложняют и делают поистине «супрамолекулярной» ставшую уже классической теорию о том, что «комбинация двух субъединиц в димерную структуру приводит к образованию трех изоферментов, называемых по входящим в их состав субъединицам КК-ММ, КК-ВВ и КК-МВ изоэнзимами, и локализованных в скелетных мышцах, клетках мозга и сердечной мышце, соответственно» [16]. Кроме того, в тканях миокарда содержится и ММ-изофермент КК. В сыворотке крови здорового человека имеет место следующее соотношение изоферментов КК: активность КК-ММ составляет 94-96 %, КК-МВ - 4-6 %, изофермент КК-ВВ присутствует в следовых количествах.
Согласно современным представлениям, в энергетическом обеспечении функции миофибрилл и саркоплазматического ретикулума сердечной мышцы ведущее место занимает креатинкиназный механизм, который в значительной мере определяет скорость и характер внутриклеточного перераспределения энергии и утилизацию ее субклеточными структурами. Поэтому активность креатинкиназы в сыворотке крови повышается при остром инфаркте миокарда. При этом активность креатинкиназы увеличивается раньше, чем изменяется активность других ферментов. Однако значительное повышение активности креатинкиназы в сыворотке крови может наблюдаться также при повреждении скелетной мускулатуры и при самых различных нарушениях центральной нервной системы. Считается, что повышение общей активности КК при ряде заболеваний центральной нервной системы связано с увеличением проницаемости клеточных мембран скелетных мышц и сердца, а также понижением скорости инактивации и выделения фермента из кровотока. На основании всех известных данных можно сделать вывод, что наибольшее распространение в клинической лабораторной практике приобрело определение общей КК и ее МВ-составляющей, причем определение активности МВ-изофермента КК имеет особо важное значение при диагностике инфаркта миокарда и мониторинге постинфарктного состояния.
Аспартатаминотрансфераза и аланинаминотрансфераза
Считается оптимальным рассматривать совместно ферменты КФ 2.6.1.1. или аспартатаминотрансферазу (АСТ) и КФ 2.6.1.2. или аланинамино-трансферазу (АЛТ), которые имеют много общего в строении и свойствах, а также учитывая недостаток детальных структурных данных по АЛТ в отличие от АСТ. Как АЛТ, так и АСТ состоят из двух полипептидных субъединиц одинакового типа с ММ порядка 45000, т.е. ММ каждого фермента составляет порядка 90000 [16]. Субъединицы имеют «богатую» вторичную структуру с двумя выраженными доменами, один из которых необходим для связывания кофермента (пиридоксальфосфата). По последним данным, полученным методом рентгеновской дифракции кристаллов митохондриального фермента с разрешением 0,28 нм, считается, что оба активных центра димера находятся на границе между субъединицами и состоят из аминокислотных остатков обеих субъединиц. Для АСТ показано, что остаток Arg292 в обычном ферменте в основном «отвечает» за специфичность к субстрату. Мутантный по данному остатку фермент (замена на Asp-292 приводит к инверсии зарядового баланса) становится активным в реакции трансаминирования аргинина, а не аспартата [16].
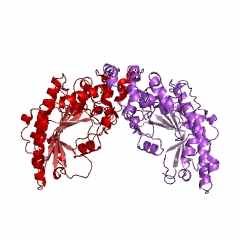
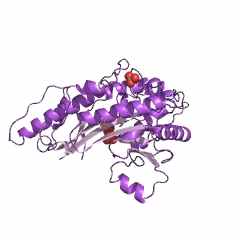
АСТ из митохондрий сердечной мышцы цыпленка (gallus gallus): код 1map (PDB-EBI) состоит из двух одинаковых субъединиц (рис. 9). Поли-пептидная цепь субъединицы АСТ из митохондрий сердечной мышцы цыпленка состоит из 401 аминокислотного остатка. Считается, что кофермент ПФ всегда связывается с Lys258 (рис. 10) и порядок амино-кислотных остатков в каталитическом центре этой субъединицы Trp140 - Asp222 - Lys258 достаточно консервативен для всех АСТ. Всего в активном центре субъединицы АСТ насчитывается 19 аминокислотных остатков.
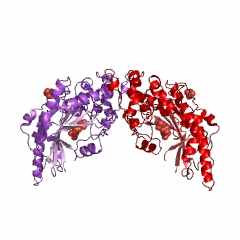
Надо обязательно учитывать, что в этом активном центре находятся также еще 4 аминокислотных остатка из другой субъединицы АСТ. Интересно, что АСТ из цитоплазмы клеток сердечной мышцы цыпленка (gallus gallus): код 2cst (рис. 11) состоит из двух одинаковых субъединиц, но состоящих из 411 аминокислотных остатков каждая. Всего в активном центре субъединицы (обозначенной А) этой АСТ насчитывается 19 аминокислотных остатков (с рядом отличий) и еще 4 аминокислотных остатка из другой субъединицы (В) этой же АСТ. Важно, что порядок и положение аминокислотных остатков в каталитическом центре субъединицы этой АСТ неизменен Trp140(A) - Asp222(A) - Lys258(A), несмотря на увеличение (на 10 единиц) общего числа аминокислотных остатков для АСТ из цитоплазмы клеток сердечной мышцы цыпленка, по сравнению с АСТ из митохондрий этой же мышцы.
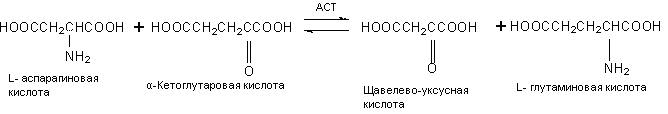
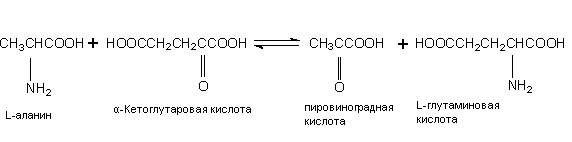
АСТ катализирует обратимый перенос аминогруппы с аспарагиновой кислоты на α-кетоглутаровую кислоту с образованием оксалоацетата:
 |
Наибольшее содержание АСТ обнаружено в сердечной мышце, в печени, скелетной мускулатуре, головном мозге, почках, семенниках. Так, активность АСТ в сердечной мышце почти в 10000 раз выше, чем в сыворотке крови. Поскольку даже в эритроцитах активность АСТ в 10 раз выше, чем в сыворотке, то исследуемая сыворотка крови не должна иметь следов гемолиза. Увеличение активности АСТ в сыворотке крови происходит при инфаркте миокарда (в 4-5 раз) и сохраняется 3-5 дней. Умеренное увеличение активности АСТ обнаруживается также у больных с метастазами в печень, циррозом печени, при прогрессивной мышечной дистрофии, а также при некрозе или повреждении печеночных клеток любой этиологии, включая холестатическую и обтурационную желтуху, острый и хронический гепатит, причем в большинстве этих случаев уровень активности АЛТ выше уровня активности АСТ [16].
 | 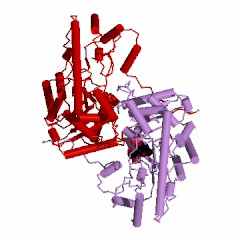 |
| Рисунок 11 – Изображение димеров АСТ, полученных из цитоплазмы клеток сердечной мышцы цыпленка (gallus gallus): код 2cst (слева) и свиньи (Sus scrofa): код 1ajs (справа) | |
 |
Наиболее высокая активность АЛТ обнаруживается в печени, поджелудочной железе, сердце, и скелетной мускулатуре. Повышение активности АЛТ является наиболее специфичным признаком заболеваний печени, особенно острых, что имеет большое диагностическое значение. Как правило, оно возникает за 1-4 недели до развития клинических симптомов и за 7-10 дней до обнаружения максимального уровня билирубина в крови, более чем в 5-10 раз превышая норму. Длительное увеличение активности АЛТ или повышение активности в поздние сроки заболевания может означать начало массивного печеночного некроза. Повышение активности АЛТ в сыворотке крови отмечается при гепатитах различной этиологии, механической желтухе, циррозе печени, введении гепатотоксических препаратов, инфаркте миокарда. В норме соотношение активностей АСТ/АЛТ (коэффициент де Ритиса) для человека равно 1,33±0,42. У больных инфекционным гепатитом происходит снижение коэффициента, а при остром инфаркте миокарда резко возрастает [16].
Гамма-глутамилтрансфераза
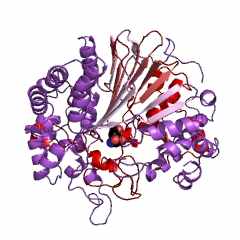
Фермент КФ. 2.3.2.2. или γ-глутамилтрансфераза (ГГТ) – мембрано-связанный белок сложного строения: димер ГГТ состоит из субъединиц А и В, содержащих разное число аминокислот (рис. 12). Таких димеров может быть несколько в «мембранно-трасферазном комплексе», который с полным основание можно считать «ферментной» СБС (рис. 12). К сожалению, детали структур ГГТ животных в доступной литературе отсутствуют, поэтому здесь приведены данные для бактерий. Димер ГГТ, выделенный из бактерий (Escherichia coli. Strain: k-12.), состоит из субъединиц, содержащих 359 (А) и 109 (В) аминокислотных остатков. Несмотря на то, что В-субъединица этой ГГТ почти в 3,5 раза короче А-субъединицы, но в ней взаимодействует с лигандом или субстратом в 3 раза больше амино-кислотных остатков (15), чем в А-субъединице (6), что следует из строения активного центра ГГТ (рис. 13).
ГГТ является ключевым из 6 ферментов γ-глутамильного цикла, служащего для переноса ряда аминокислот через плазматические мембраны. Данный фермент присутствует в высоких концентрациях в печени, почках и поджелудочной железе. Его активность в плазме является чувствительным индикатором заболеваний гепатобилиарной системы, хотя он и не дает возможности разграничить холестатический и гепатоцеллюлярный типы патологии. При обструкции желчных путей увеличение активности ГГТ в плазме может предшествовать подъему активности щелочной фосфатазы. Активность ГГТ в плазме возрастает при отсутствии заболеваний печени у пациентов, принимающих антиконвульсанты (аналогичное действие может оказывать рифампицин при лечении туберкулеза). В указанных выше случаях повышение активности ГГТ в плазме происходит не вследствие повреждения клеток, а в результате усиления внутриклеточного синтеза фермента и освобождения его повышенного количества в циркуляцию в процессе нормального метаболизма клеток. Повышение активности ГГТ плазмы связано также с холестазом (превышение верхнего предела нормы более чем в 10 раз); гепатитом (острый и хронический); циррозом (без холестаза); панкреатитом (превышение верхнего предела нормы в 5-10 раз); многими состояниями, отражающими «вторичные воздействия» на печень: с лекарствами, вызывающими индукцию фермента; с сердечной недостаточ-ностью (превышение верхнего предела нормы менее чем в 5 раз) [16].
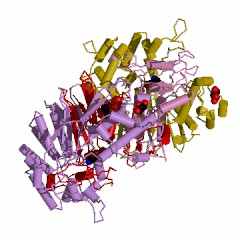 |  |
| Рисунок 12 – Изображение асимметрического комплекса – тетрамера (слева) и димера (справа) ГГТ, выделенной из бактерий ( Escherichia coli. Strain: k-12.): код 2dbw (PDB-EBI) | |
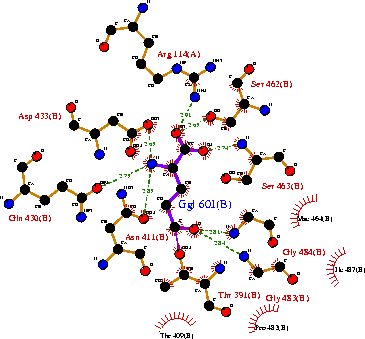 |
| Рисунок 13 – Строение активного центра для субъединицы ГГТ из бактерий ( Escherichia coli. Strain: k-12.): код 2dbw (PDB-EBI) |
Все эти ферменты и их изоформы в крови животных составляют характерный набор – «ферментный профиль», который изменяется при патологических изменениях тканей, что активно используют в клинической биохимической диагностике.
Липолитические ферменты (липазы из поджелудочной железы животных, бактерий и грибов)
Различные типы липаз традиционно относятся к липолитическим ферментам (это прежде всего гидролазы эфиров карбоновых кислот) и играют важную роль в обмене липидов у животных [20–25]. Наиболее важной для данной работы являлась панкреатическая липаза или триацилглицероллипаза (КФ 3.1.1.3) как гидролаза сложных эфиров глицерина и жирных кислот или, по-другому, ацилгидролаза различных триацилглицеридов. Панкреатическая липаза преимущественно вырабатывается поджелудочной железой животных и принимает участие в расщеплении нейтральных жиров, поступающих в кишечник с пищей. Панкреатическая липаза – один из активно исследуемых липолитических ферментов, поэтому ее часто используют в качестве модели для других липаз (как животного, так и растительного или микробного происхождения).
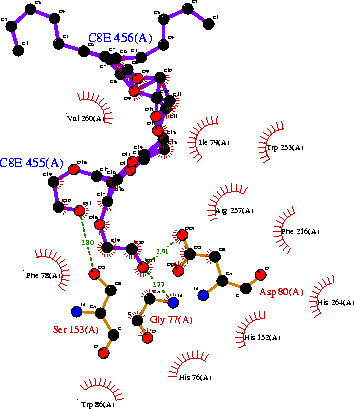
Использование идеологии супрамолекулярных систем особенно полезно при структурно-функциональном исследовании комплексов молекул субстрата и димеров или октамеров панкреатической липазы в комплексе с колипазой (рис. 14), выделенных из поджелудочной железы свиньи (Sus scrofa): код 1eth (PDB-EBI). На рис. 15 и 16 приведены полипептидные последовательности для субъединиц липазы и колипазы свиньи (Sus scrofa), состоящих из 448 и 87 аминокислотных остатков, соответственно. Для правильного структурного представления этой достаточно сложной супрамолекулярной системы необходимо добавить 1071 молекулу воды, хотя бы по одному катиону Са2+ и одной молекуле субстрата (рис. 17) на каждый комплекс липазы с колипазой в димере или октамере (рис. 14 и 18). Строение каталитического центра липазы: Ser153, Asp80 и Gly77, отличается от «субстрат-связывающего» центра. Предполагается, что комплекс липазы с колипазой образуется 16 и 12 аминокислотными остатками соответствующих белков с использованием 8 водородных связей и от 96 до 100 «других контактов», хотя «критическими» для такой супрамолекулярной организации организация этих комплексов являются только 4 аминокислотных остатка с каждой стороны и 15 «других типов» контактов.
Гидролиз триглицеридов в желудочно-кишечном тракте животных осуществляется панкреатическими липазами, которые продуцируются у млекопитающих в ацинарных клетках поджелудочной железы и накапливаются в зимогенных гранулах, содержащих набор пищеварительных ферментов или их проферментов. Из этих гранул липаза высвобождается в специальный проток, по которому панкреатический сок поступает к месту своего назначения — в тонкий кишечник. Данных, свидетельствующих о наличии профермента (зимогена) липазы, не имеется и нет никаких причин думать, что таковой существует. В отличие от протеиназ или фосфолипаз, панкреатическая липаза обладает особой специфичностью, которая заключается в том, что липаза действует на свой субстрат — триглицерид только в том случае, если он находится в эмульгированном состоянии. Такое эмульгирование липидов эффективно осуществляется желчью при участии солей желчных кислот (в печени синтезируются холевая, дезоксихолевая, гликохолевая и таурохолевая кислоты), что увеличивает скорость расщепления триглицеридов панкреатической липазой. Адсорбируясь и уменьшая поверхностное натяжение жировых капелек, желчные кислоты раздробляют их и превращают жиры и масла в тонкую эмульсию, диаметр частиц которой не превышает 0,5 мкм. Эмульгирование жира приводит к увеличению поверхности соприкосновения триглицерида с водным раствором липазы, т. е. облегчает ферментативный гидролиз [16, 24].
 |  |
| Рисунок 14 – Схематическое изображение супрамолекулярных систем молекул субстрата и димера (слева) и октамера (справа) комплексов липазы из поджелудочной железы свиньи (Sus scrofa) и колипазы : код 1eth (PDB-EBI) | |
 |
| Рисунок 15 – Полипептидная последовательность для липазы из поджелудочной железы свиньи (Sus scrofa): код 1eth (PDB-EBI). |
 |
| Рисунок 16 – Полипептидная последовательность для колипазы из поджелудочной железы свиньи (Sus scrofa): код 1eth (PDB-EBI). |
Панкреатическая липаза свиньи является гликопротеидом, имеющим молекулярную массу порядка 50 000 и оптимум рН 8-9 [24]. Данный фермент расщепляет триглицериды, находящиеся в эмульгированном состоянии, но может гидролизовать также ди- и моноглицериды [24].
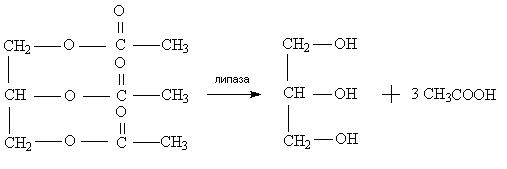 |
Широко известны и активно используются бактериальные липазы из различных источников, например, Pseudomonas aeruginosa, Pseudomonas cepacia, Pseudomonas fluorescens [23–26]. В ходе исследования бактериальных липаз было обнаружено, что у них имеется два связывающих места: широкий карман для спирта и узкий – для карбоновых кислот. Так как липаза катализирует гидролиз триглицеридов, то два углеводородных остатка направляются в широкий карман, а другая ацильная группа – в узкий и длинный карман. Липаза из Pseudomonas может узнавать энантиомер вторичных спиртов благодаря специфической структуре широкого кармана и показывать при этом высокую энантиоселективность для вторичных спиртов, а липаза из Candida показывает низкую энантиоспецифичность для спиртов из-за плоской структуры широкого связывающего кармана. После того как липаза подвергалась импринтингу субстратами, происходило изменение структуры этого связывающего кармана, вследствие чего изменялась энантиоселективность [26].
Плесневый гриб Мucor javanicus продуцирует ферменты с протеиназной и липазной активностью. Запатентованы по крайней мере два ферментных препарата из этого плесневого гриба, предназначенных для использования в производстве сыров [24]. В этих неочищенных препаратах протеиназ обнаружена липолитическая активность, поэтому в сырах, созревающих при участии неочищенных протеиназ, накапливаются свободные жирные кислоты, которые придают сыру специфический вкус и которые при избыточном содержании могут вызвать нежелательные изменения вкуса у сыра. Микроорганизм выращивают на среде, содержащей 4 % пшеничных отрубей, при рН 6,7 и 35ºС. Из химических свойств фермента приводятся только данные об ингибировании липолитической активности диизопропил-фторфосфатом. Цистеин, ЭДТА не влияли на активность. На этом основании фермент можно отнести к группе сериновых ферментов, однако он отличается от большинства других липаз рН оптимумом (около 5,5). В качестве субстратов этой липазы были испытаны несколько природных триглицеридов и моноглицеридов. Хотя липаза гидролизовала все эти соединения, максимальная активность наблюдалась только в отношении тридеканоина и триоктаноина. Метиловые эфиры жирных кислот с короткой цепью (4:0, 6:0 и 8:0) гидролизовались плохо, в то время как эфиры кислот с длинной цепью – хорошо. О строении этой липазы и кинетике гидролиза ею субстратов доступная информация отсутствует.