Отчет о научно-исследовательской работе
| Вид материала | Отчет |
- Реферат отчет о научно-исследовательской работе состоит, 61.67kb.
- Отчёт о научно-исследовательской работе за 2011 год, 1208.93kb.
- Отчёт о научно-исследовательской работе за 2009 год, 851.3kb.
- Отчёт онаучно-исследовательской работе гу нии но ур за 2010 год, 997.69kb.
- Отчет о научно-исследовательской работе профессорско-преподавательского состава, 617.56kb.
- Отчет о научно-исследовательской работе; пояснительная записка к опытно-конструкторской, 14.47kb.
- Отчет о научно-исследовательской работе (итоговый), 2484.06kb.
- Отчет о научно-исследовательской работе, 2473.27kb.
- Отчет о научно-исследовательской работе, 392.92kb.
- Задачи секции: широкое привлечение учеников к участию в научно исследовательской работе;, 67.94kb.
Регламент поиска № 1
Объектом исследований являются композитные материалы на основе ферментов и полимеров для создания биокаталитических систем. Назначением объектов исследования является создание биокаталитических систем с заданными рабочими характеристиками (регулируемой ферментативной активностью, высокой стабильностью при хранении и к действию различных денатурирующих агентов и т.д.) и использование их в различных биотехнологических процессах.
Цель информационного поиска: определение научно-технического уровня мировых разработок в области создания биокаталитических композитных систем на основе ферментов и полимеров.
Обоснование регламента поиска. Поиск патентных материалов проводится в информационном массиве развитых стран, прежде всего США, Японии и Европы, России, так как именно в этих странах публикуется большая часть работ по полимерным нанокомпозитным материалам для создания хемосенсоров. По этим материалам имеются полные базы данных, доступные в сети Интернет.
Глубина и источники: по заданию заказчика основное внимание уделяется информации, начиная с 1995 г. по 2005 г. включительно, по бесплатным электронным патентным базам Интернета: по автоматизированным информационным патентным базам России, США, Европейского патентного ведомства (включает заявки Японии, Китая). Фактически: по автоматизированным электронным патентным базам – со дня их создания (глубиной 20-30 лет).
Ключевые слова, предложенные заказчиком: иммобилизованные ферменты, ферменты и полимеры, ферменты и коллоидные наночастицы.
В процессе поиска ключевые слова в зависимости от объемов обнаружения информации были уточнены.
Начало поиска __августа 2009 г.____________
Окончание поиска ___ сентября 2009 г.________
Таблица 4 – Патентный поиск
| Предмет поиска (объект исследования, его составные части, товар) | | Источники информации, по которым будет проводиться поиск | | | |||
| | Патентные | НТИ | | | |||
| Страна поиска | Наименование | Классифика ционные рубрики: МПК и другие | Наименова-ние | Рубрики УДК и другие | Ретро-спектив-ность | Наименование информационной базы (фонда) | |
| Иммобилизация ферментов на полимерных носителях | США Япония Китай Европа Россия | Патенты | МПК C12N11 C12N9 A61K9 A61K4 Ключевые слова | Immobilized enzymes, enzymes and polymers, enzymes and nanoparticles | Ключе-вые слова | 1990-2009 | US Patent & Trademark Office; European Patent Office; Базы данных ФИПС; Научная электронная библиотека |
Форма отчета о поиске
В.4 Сведения о выполнении регламента поиска (указывают степень выполнения регламента поиска, отступления от требований регламента, причины этих отступлений)
Работа выполнена в соответствии с регламентом поиска.
1. Патенты США. Автоматизированная патентная база US Patent Full Text Databases Manual Search – https:/www.uspo.gov/patft/index.phpl, за период с 1976 г. (дата создания базы) по настоящее время, по следующим полям: заголовок (Тitle), реферат(Abstract), предмет патентования (Claims), по всему документу.
В патентной базе США поиск проводился с использованием ряда ключевых словосочетаний, а именно:
(immobilization AND enzyme), найдено 13 документов
(enzyme AND nanoparticles), найдено 6 документов
В результате проведенного поиска в патентной базе США по выше приведенным ключевым словам получено более 10 релевантных документов.
2. Европейские (EP) и мировые (PCT) патенты, патенты европейских стран, заявки Японии. Автоматизированная европейская патентная база ESPACENET Europes Network of patent databases - net.com, за период 20 лет по настоящее время, по следующим полям: заголовок (Тitle), реферат(Abstract).
Для поиска информации в европейской базе Wordwide database использовались следующие сочетания ключевых слов:
(immobilization AND enzyme), найдено 837 документов
(immobilization AND enzyme AND polymer), найдено 133 документa
(enzyme AND nanoparticles), найдено 44 документа
Поиск информации в европейской базе EP database проводился по следующим сочетаниям ключевых слов:
(immobilization AND enzyme), найдено 3 документа
(immobilization AND enzyme AND polymer), найден 1 документ
(enzyme AND nanoparticles), найден 1 документ
3. Патенты РФ. Патентная база Роспатента (Рефераты российских патентных документов за период с 1994-2009 гг., по адресу: ru).
В патентной базе Роспатента информация выявлена по следующему словосочетанию
(иммобилизованные ферменты)- найдено 94 документа
(ферментные наночастицы)- найдено 3 документа.
В результате систематизации найденного массива документов выявлены следующие фирмы и научные центры:
Московский государственный университет им.М.В.Ломоносова
Государственное образовательное учреждение высшего профессионального образования Воронежская государственная технологическая академия (RU)
Институт химической физики им. Н.Н. Семенова РАН (ИХФ РАН) (RU),
Институт биохимии им. А.Н. Баха РАН (RU)
КАУНСИЛ ОФ САЙЕНТИФИК ЭНД ИНДАСТРИАЛ РИСЕРЧ (IN)
Воронежский государственный университет
Эллайд Коллоидс Лимитед (GB)
ООО "Научно-производственный центр "Амфион" (RU)
BIORIGHT WORLDWIDE COMPANY LTD [VG]
University of Pittsburgh (Pittsburgh, PA)
UNIV EAST CHINA SCIENCE & TECH [CN]
BIORIGHT WORLDWIDE COMPANY LTD [VG]
UNILEVER NV [NL]
DALIAN CHEMICAL PHYSICS INST [CN]
UNIV PITTSBURGH
UNIV ZHEJIANG TECHNOLOGY [CN]
ADVANCED RES & TECH INST [US]
DAINIPPON PRINTING CO LTD
RENSSELAER POLYTECHNIC INST A
UNIV PENNSYLVANIA [US]
UNIV DONGHUA [CN]
FUJIFILM CORP
NANOSPHERE LTD [GB]
UNIV DEBRECEN DEPT OF COLLOID
NANODELIVERY INC [US]
ЯДЕРНЫЕ ПАТЕНТЫ:
Иммобилизация/фермент
Ru
2327738
2005133446
EP
1970443 (A1)
EP1970443 (A1)
WO
WO2009010561 (A1)
US
7,521,504
Иммобилизация/фермент/полимер
US
US2008108745
US2002068339
US2007292687
US5922531
CN
CN101113433
JP
JP6009713 (A)
Ферменты/наночастицы
Ru
2006123043
US
US2009143487
US2009110741
US2005226938
JP
JP2007224012
В.5 Предложения по дальнейшему проведению поиска и патентных исследований
Результаты настоящего патентного поиска являются основной базой для дальнейшего мониторинга информационной ситуации, касающейся осуществляемого проекта, и первым этапом проведения патентно-информационного исследования по оценке научно-технического уровня и патентной чистоты разработки по проекту.
В.6 Материалы, отобранные для последующего анализа (см. таблицу)
Таблица 5 – Патентная документация
-
Предмет поиска (объект исследования, его основные части)
Страна выдачи, вид и номер охранного документа, классификационный индекс
Заявитель (патентообладатель), страна. Номер заявки, дата приоритета, конвенционный приоритет, дата публикации
Название изобретения (полной модели, образца)
Сведения о действии охран- ного докумен-та
иммобилизованные ферменты
RU Patent
888544
C12N11/08
C12N9/50
Московский государственный университет им.М.В.Ломоносова
2897046/04
21.03.1980
10.01.1998
Способ иммобилизации сериновых протеаз
прекратил действие
RU Patent
2327738
C12N11/00
C12N11/04
C12N11/12
C12N11/14
Государственное образовательное учреждение высшего профессионального образования Воронежская государственная технологическая академия (RU)
2006141092/13
20.11.2006
27.06.2008
Способ получения иммобилизован-ной β-фруктофуранозидазы
действует
RU Patent
2326818
C01G23/047
C12N11/14
Институт химической физики им. Н.Н. Семенова РАН (ИХФ РАН) (RU),
Институт биохимии им. А.Н. Баха РАН (RU)
2006134485/15
29.09.2006
20.06.2008
Способ получения мезопористых наноструктурированных пленок диоксида титана и способ иммобилизации на них ферментов
действует
RU Patent
2005133446
C08F275/00
КАУНСИЛ ОФ САЙЕНТИФИК ЭНД ИНДАСТРИАЛ РИСЕРЧ (IN)
2005133446/04
31.03.2003
10.05.2006
Способ получения фотореактивных полимеров для иммобилизации на них биомолекул
Нет данных
RU Patent
C12N11/08
C12N9/34
Воронежский государственный университет
2001110288/13
16.04.2001
20.05.2003
Способ получения иммобилизованной глюкоамилазы
Прекратил действие
RU Patent
98113063
C12N9/78
C12N1/20
C12P13/02
Эллайд Коллоидс Лимитед (GB)
98113063/13
13.07.1998
20.05.2000
Ферменты, их получение и их использование для получения аммонийакрилата
Нет данных
ферментные наночастицы
RU Patent
2006123043
A61K31/00
ООО "Научно-производственный центр "Амфион" (RU)
2006123043/15
29.06.2006
20.01.2008
Способ получения системы доставки водонерастворимых и плохорастворимых биологически активных веществ и лекарственная форма на ее основе
Нет данных
immobilization AND enzyme
Европатент
EP1970443 (A1)
C12N11/06; C12N11/08; C12N9/92; C12R1/19; C12N11/00; C12N9/90
BIORIGHT WORLDWIDE COMPANY LTD [VG]
Appl. No: EP20060791101 20060925
Carrier for making immobilized enzyme or immobilized cells and method of using the same
действует
США патент
7,521,504
C08G 18/00; B05D 3/00
University of Pittsburgh (Pittsburgh, PA)
Appl. No: 12/002,841 20071219
Irreversible immobilization of enzymes into polyurethane coatings
действует
Патент
WO2009010561 (A1)
C12N11/14; C12N11/00
C12N9/20; C12N11/14
NOVOZYMES AS [DK]; MAZEAUD ISABELLE [FR]; JOERGENSEN KAARE [DK]; PEDERSEN LARS SAABY [DK]
Appl. No: WO2008EP59390 20080717
Immobilization of enzymes
действует
Патент
CN101250247 (A)
C08F220/56; C08F2/32; C08F2/44; C08F216/14; C08F220/32; C08F222/38; C08K3/22; C12N11/08; H01F1/42; C08F220/00; C08F2/32; C08F2/44; C08F216/00; C08F222/00; C08K3/00; C12N11/00; H01F1/00
UNIV EAST CHINA SCIENCE & TECH [CN]
Appl. No: CN20081034516 20080313
Magnetic polymer microsphere for enzyme immobilization and preparation method thereof
действует
Европатент
EP1970443 (A1)
C12N11/06; C12N9/92; C12N11/08; C12R1/19; C12N11/00; C12N9/90
BIORIGHT WORLDWIDE COMPANY LTD [VG]
Appl. No: EP20060791101 20060925
Carrier for making immobilized enzyme or immobilized cells and method of using the same
действует
Патент
MX9800035 (A)
C12N9/16; C12N11/02; C12N11/08; C12N11/10; C12P7/64; C12N9/16; C12N11/00; C12P7/64; (IPC1-7): C12N11/02; C12N11/10; C12P7/64
UNILEVER NV [NL]
Appl. No: MX19980000035 19980107
Immobilized enzyme and its use for the processing of triglyceride oils.
действует
Патент
CN101177678 (A)
C12N11/14; C12P41/00; C12N11/00; C12P41/00
DALIAN CHEMICAL PHYSICS INST [CN]
Appl. No: CN20061114398 20061109
Magnetic nano particle enzyme immobilization as well as preparation method and uses thereof
действует
immobilization AND enzyme AND polymer
США патент
US2008108745 (A1)
C08G18/00; C12N11/04; C12N11/08; C08G18/00; C12N11/00
UNIV PITTSBURGH
Appl. No: US20070002841 20071219
Irreversible immobilization of enzymes into polyurethane coatings
действует
Патент
CN101113433 (A)
C12N11/06; C12N9/20; C12N11/00; C12N9/18
UNIV ZHEJIANG TECHNOLOGY [CN]
Appl. No: CN20071069820 20070629
Process for preparing chitosan microsphere immobilized lipolytic enzyme
действует
США патент
US2007292687 (A1)
A61K9/16; A61K9/50; A61K9/16; A61K9/50
POMMERSHEIM RAINER [DE]
Appl. No: US20050587494 20050131
Microcapsule with Controllable or Delayed Release for the Immobilization of Chemical and/or Biological Materials, and Method for the Production Thereof
действует
Патент
WO2008118108 (A2)
C12N11/08; C08F8/00; C08F8/28; C12P7/62; C12P19/22
KESKINLER BULENT [TR]; TANRISEVEN AZIZ [TR]; DIZGE NADIR [TR]; UNSAL MEHMET [TR]
Appl. No: WO2008TR00027 20080326
Synthesis of strene-divinylbenzene copolymers by using polyglutaraldehide and the applications
действует
США патент
US2002068339 (A1)
C12N11/02; C12N11/10; C12P13/04; C12P17/10; C12N11/00; C12P13/00; C12P17/10; (IPC1-7): C12N11/10; C12N11/00
PFEFFER HENRY A, ; CUKRAS CATHERINE-ANN, ; PRUD'HOMME ROBERT K
Appl. No: US20010909003 20010719
Microbead immobilization of enzymes
действует
США патент
US6284375 (B1)
A61K9/127; A61K9/133; A61K9/50; A61K49/00; A61K9/16; A61K9/127; A61K9/133; A61K9/50; A61K49/00; A61K9/16; (IPC1-7): B32B5/16; A61K9/133; A61K51/12
JIN TUO, ; PENNEFATHER PETER, ; LEE PING I
Appl. No: US19970953552 19971017
Lipid vesicle system
действует
США патент
US5922531 (A)
C12N9/00; C12N9/04; C12N11/02; C12P1/00; C12P7/24; C12Q1/00; C12Q1/37; C12N9/00; C12N9/04; C12N11/00; C12P1/00; C12P7/24; C12Q1/00; C12Q1/37; (IPC1-7): C12Q1/00; C12N9/00; C12N11/00; C12Q1/37
ADVANCED RES & TECH INST [US]
Appl. No: US19970916491 19970822
Polyelectrolyte treated glass for enzyme immobilization and protein purification
действует
Япония патент
JP7255478 (A)
C12N11/04; C12N11/08; C12N11/00; (IPC1-7): C12N11/08; C12N11/04
MITSUI SAITETSUKU KK
Appl. No:JP19940077746 19940325
Immobilization of enzyme and immobilized enzyme
действует
Япония патент
JP6009713 (A)
C08F2/44; C08F12/00; C08F12/08; C08G63/06; C08G69/26; C08G69/28; C08G85/00; C08J5/18; C08F2/44; C08F12/00; C08G63/00; C08G69/00; C08G85/00; C08J5/18; (IPC1-7): C08F2/44; C08F12/08; C08G63/06; C08G69/26; C08G85/00; C08J5/18
DAINIPPON PRINTING CO LTD
Appl. No: JP19930036353 19930225
Fine polymer particle and production of composite film containing the fine particle
действует
enzyme AND nanoparticles
США патент
7,452,565
B05D 3/00
Banerjee; Sukanta (North Brunswick, NJ), Huang; Hui (Piscataway, NJ)
Appl. No: 10/868,451 20040613
Immobilization of bead-displayed ligands on substrate surfaces
действует
США патент
US2009143487 (A1)
A61K47/42; A61P43/00; C12Q1/00; C12Q1/58; A61K47/42; A61P43/00; C12Q1/00; C12Q1/58
RENSSELAER POLYTECHNIC INST A
Appl. No:US20050663040 20050907
Enhanced stability of proteins immobilized on nanoparticles
действует
США патент
US2009110741 (A1)
A61K9/16; A61K9/50; A61K38/00; A61K38/54; A61K9/16; A61K9/50; A61K38/00; A61K38/43
UNIV PENNSYLVANIA [US]
Appl. No: US20070925834 20071027
Method and compositions for polymer nanocarriers containing therapeutic molecules
действует
Патент
CN101270352 (A)
C12N11/04; C12N11/00
UNIV DONGHUA [CN]
Appl. No: CN20081035950 20080411
Method for preparing beta-glucosidase fixed with magnetic nano-particle
действует
Патент
WO2007112679 (A1)
C12N11/02; C12N11/00
ZHANG YUQING [CN]
Appl. No: WO2007CN01032 20070329
Silk fibroin nanoparticles fixed with enzyme and their production
действует
Япония патент
JP2007224012 (A)
C07K14/78; A23L1/30; A61K8/55; A61K8/64; A61K8/96; A61K45/00; A61K47/24; A61K47/42; A61Q7/00; A61Q19/00; A61Q19/02; A61Q19/08; C12P21/02; A61K31/4045; C07K14/435; A23L1/30; A61K8/30; A61K8/96; A61K45/00; A61K47/24; A61K47/42; A61Q7/00; A61Q19/00; A61Q19/02; A61Q19/08; C12P21/02; A61K31/403
FUJIFILM CORP
Appl. No: JP20060326640 20061204
Enzymatically crosslinked protein nanoparticle
действует
США патент
US2007224277 (A1)
A61K31/728; A61K9/14; C08B37/00; A61K31/726; A61K9/14; C08B37/00
BORBELY JANOS [HU]; RENTE TUNDE [HU]; BOONAP MAGNOLNA [US]
Appl. No: US20060645094 20061222
Hyaluronic acid-based cross-linked nanoparticles
действует
Патент
GB2427157 (A)
A61K9/16; A61K41/00; A61K49/18; B01J13/02; B01J13/04; C08J7/04; C09C3/00; C12N11/14; G01N33/543; A61K9/16; A61K41/00; A61K49/06; B01J13/02; B01J13/04; C08J7/00; C09C3/00; C12N11/00; G01N33/543
NANOSPHERE LTD [GB]
Appl. No: GB20060012104 20060619
Coated microspheres
действует
США патент
US2005226938 (A1)
A61K9/16; A61K9/51; A61K47/36; C08B37/08; A61K9/16; A61K9/51; A61K47/36; C08B37/00; (IPC1-7): C08B37/08; A61K9/16
UNIV DEBRECEN DEPT OF COLLOID
Appl. No: US20050091940 20050328
Nanoparticles from chitosan
действует
США патент
US2003035838 (A1)
A61K9/00; A61K9/26; A61K9/51; A61K9/70; A61K47/48; A61K9/00; A61K9/26; A61K9/51; A61K9/70; A61K47/48; (IPC1-7): A61K9/26
NANODELIVERY INC [US]
Appl. No: US20020256508 20020927
Drug delivery system exhibiting permeability control
действует
1.3 Описание постановки и научно-техническая реализация проведения исследований ФКС
Отв. исполнители: зав. кафедрой ФГОУ ВПО МГАВМиБ, проф. д.х.н, д.б.н. С.Ю. Зайцев; зав. лабораторией, к.б.н. И.В. Милаева.
Познание молекулярных механизмов формирования биохимических коллоидных систем (БКС) с использованием современных методических и инструментальных достижений «нанотехнологической революции» в рамках выполнения данной НИР позволит найти пути решения многих актуальных фундаментальных и прикладных проблем химии и биологии, медицины и экологии, нано- и биотехнологии, ветеринарии и зоотехнии. В частности, новые БКС на основе ферментов позволят расширить ассортимент и области применения ферментных препаратов в пищевой, фармакологической, агрохимической и кожевенной промышленности, в производстве моющих средств, поверхностно- и оптически-активных соединений, вкусовых и ароматических компонентов, для аналитических и лекарственных целей в медицине и ветеринарии. Особенное значение приобретает разработка и внедрение новых и более эффективных средств диагностики и мониторинга состояния организма сельскохозяйственных животных, что является неотъемлемой частью научно-технического прогресса в развитии животноводства и будет реализовано в данной НИР на базе достижений коллоидной химии. Проведение исследований по вышеуказанным направлениям позволит не только решить важные и актуальные научно-технические задачи, но завершить создание комплексной системы подготовки высококвалифицированных специалистов (от бакалавров и магистров до кандидатов и докторов наук), обладающих особыми компетенциями по профилю данной НИР.
Иммобилизованные ферменты представляют собой важную и быстро развивающуюся междисциплинарную область ФКС на «стыке» коллоидной и физической химии, энзимологии и биотехнологии. Создание биокатализаторов нового поколения в виде иммобилизованных ферментов открыло перед прикладной энзимологией новые перспективы. В настоящее время выделяют 4 подхода к иммобилизации ферментов: адсорбция, ковалентное связывание, встраивание и микрокапсулирование. Возможно также комбинирование двух и более подходов. Иммобилизация путем адсорбции – это самый простой и дешевый метод приготовления биокатализатора на твердом носителе. Он основан на физической адсорбции и/или ионном связывании липазы на поверхности твердого носителя. Большое число синтетических и природных носителей с различной формой и размерами, пористой и непористой структурой, различной связывающей способностью было использовано для иммобилизации липаз. Ковалентное связывание липаз с различными носителями является многообещающим методом, т.к. значительно снижаются диффузионные ограничения для субстрата и продуктов. К тому же ковалентная иммобилизация предоставляет огромные возможности для увеличения стабильности фермента и предотвращает его от перехода в раствор. Однако, условия ковалентной иммобилизации таковы, что нельзя избежать некоторой потери ферментативной активности.
Изучение полимер-ферментных комплексов важно для моделирования биополимерных взаимодействий и регуляции активности ферментов в биологических жидкостях.
По этапу 1 НИР планируется изучение каталитических свойств трех липаз: из поджелудочной железы свиньи, бактерий Pseudomonas fluorescence, гриба Mucor javanicus в системах с БСА, положительно заряженным поли-L-лизин и отрицательно заряженной поли-L-глутаминовой кислотой при различных соотношениях фермент:полимер с помощью метода потенциометрического титрования; по физико-химическим свойствам липазы с указанными БКС (полиэлектролитами-липазные комплексы) с помощью метода межфазной тензиометрии, что даст представление о свойствах этих комплексов на поверхности раздела фаз; по корреляции между данными по активности этих систем и параметрами поверхностного натяжения, что в дальнейшем позволит построить модели указанных биокаталитических БКС.
Кроме того, представляет большой научно-практический интерес получение новых полимерных материалов, с помощью которых текстильные материалы, а также материалы из кожи и меха, могли бы долго сохранять антистатические и антибактериальные свойства. Известным полимером, используемым для этих целей, является N,N’-диметил-N,N’-диаллиламмоний хлорид, который обладает антибактериальными и антисептическими свойствами. Антибактериальную и антистатическую обработку, как правило, проводят на заключительных отделочных этапах. Однако длительная эксплуатация, стирка, температурная обработка текстильных материалов приводят к потере этих свойств, имеющих важное гигиеническое значение. Вышеуказанный полимер обладает низкой термической стабильностью и не влагостоек. Поэтому получение новых полимерных материалов, с помощью которых текстильные материалы могли бы длительно сохранять антистатические и антибактериальные свойства, представляет большой интерес.
На 1 этапе НИР предполагалось получить сополимеры N,N’-диметил-N,N’-диаллиламионий хлорида и метилметакрилата, которые отличались бы большой адгезивной способностью к текстильным материалам и образовывали пленкообразные покрытия с более высокими антистатическими и термическими свойствами, исследовать термические и термоокислительные свойства новых сополимеров и антистатические свойства обработанных ими материалов.
1.3.1 Определение активности липазы методом потенциометрического титрования
Основные достоинства этого метода – высокая точность, высокая чувствительность и возможность проводить титрование в более разбавленных растворах, чем это позволяют визуальные индикаторные методы.
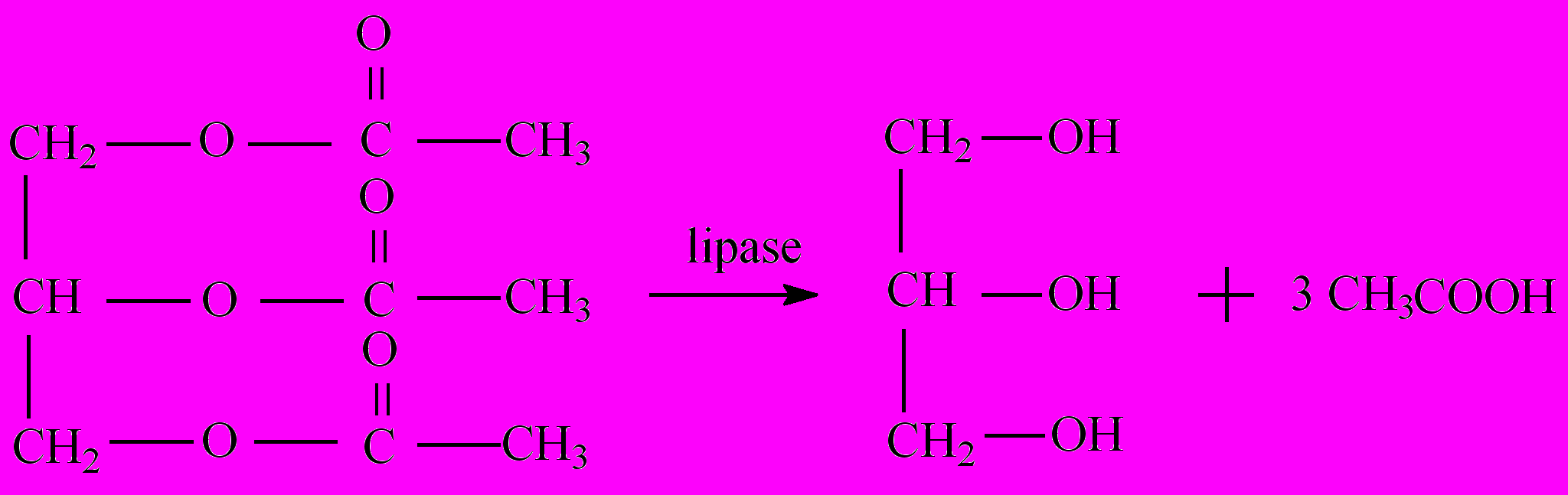
Принцип метода. Липаза обладает свойством стереоспецифичности и расщепляет 1 и 3 связи в молекуле триацилглицерола.
Липаза
В результате выделяется моноацилглицерол и уксусная кислота, которая титруется щелочью. Активность фермента определяется по графику зависимости объема добавленной щелочи от времени [26].
Прибор. Титрование проводят с помощью автоматического титратора фирмы «Radiometer» (Копенгаген).
Титратор состоит из 4 частей:
- Анализирующая часть pH-stat Controller.
- Титрующая часть (Autoburette ABU 901), состоящая из бюретки со щелочью, системы шлангов и поршня для подачи щелочи в кювету с рабочим раствором.
- Воспринимающая часть (комплексный электрод).
- Персональный компьютер.
В кювету помещают 10 мл рабочего раствора субстрата и ставят на магнитную мешалку. Запускают программу титрования и после звукового сигнала добавляют 100 мкл раствора липазы или комплекса липазы с полиэлектролитами. Время титрования 10 минут, в течение которых программа Stat Talk (версия 1.2) строит график зависимости объема добавленной щелочи от времени. Активность рассчитывают по тангенсу угла наклона касательной к графику. Одна единица активности липазы соответствует 1 мкмоль уксусной кислоты, выделяющейся при ферментативном гидролизе субстрата в одну минуту. Каждую пробу измеряют по 5 раз и рассчитывают среднее значение абсолютной активности липазы. Относительную активность (в %) рассчитывают как отношение активности опытной пробы к активности контрольной пробы. Результаты представляют в виде таблиц и графиков.
1.3.2 Определение динамического поверхностного натяжения (ДПН) ферментных систем
Метод максимального давления в пузырьке
Принцип метода. Принцип работы тензиометра ВРА-1Р основан на методе максимального давления в пузырьке, который является в настоящее время наиболее удобным для исследования биологических систем. В ВРА воздух от компрессора поступает в капилляр, который опущен в исследуемую жидкость. С помощью электрического преобразователя определяется избыточное давление в системе, которое используется для расчёта поверхностного натяжения. Давление, необходимое для отрыва пузырька воздуха от капиллярного кончика, опущенного на границу жидкость-воздух, прямо пропорционально поверхностному натяжению () на этой границе. Электрические сигналы от всех измерительных систем поступают в электронный блок, который посредством аналого-цифрового преобразователя соединён с персональным компьютером. Полученные данные заносятся в таблицу, которая затем обрабатывается в компьютерной программе [118].
Прибор. Тензиометр BPA-1P (Maximal Bubble Pressure Tensiometer) измеряет динамическое поверхностное натяжение (ДПН) при коротких временах существования поверхности – от 0,001 до 100 с.
Для проведения эксперимента наливают исследуемый раствор в лабораторный стакан (объём жидкости 10-15 мл) и помещают его под капилляр, затем с помощью компьютера, через который осуществляется управление прибором, дают команду для начала нового эксперимента. Капилляр автоматически опускается в жидкость, начинается измерение поверхностного натяжения в промежуток времени от 0,001 до 100 с.
Метод висящей капли
Принцип метода. Измерение поверхностного натяжения на приборе РАТ-2P (Topfen-Blasen-Profiltensiometer) осуществляется с использованием метода висящей капли. Его преимуществами являются малый объём анализируемой жидкости, широкий диапазон измерений времени жизни капли (от 10 до 10000 с и более). Форма капли, висящей на кончике капилляра, при прочих равных условиях определяется ее размерами. Чем больше объем капли, тем в большей степени ее форма отличается от сферической. Уравнение Лапласа описывает механическое равновесие капли, как баланс действующих на каплю сил. Если известно поверхностное натяжение, то форма капли может быть определена по уравнению Лапласа. В приборе PAT-2P поверхностное натяжение определяется по форме капли методом анализа формы осесимметричных капель (ADSA), в котором форма капли автоматически анализируется, оптимизируется и сравнивается с теоретическим лапласовским профилем [118].
Прибор. Тензиометр PAT-2P измеряет поверхностное натяжение при длинных временах существования поверхности (рис. 26). Он состоит из макродозирующего устройства, включающего шприц для жидкостной хроматографии на 0,5 мл и микрометрического регулятора (1), микродозирующей системы (7), которая через процессор управляется компьютером (6), источника света (3), объектива и специальной видеокамеры (4), обеспечивающей неискажённое изображение капли, термостатируемой ячейки (8) с каплей исследуемой жидкости (2), формируемой на кончике стального или тефлонового капилляра.
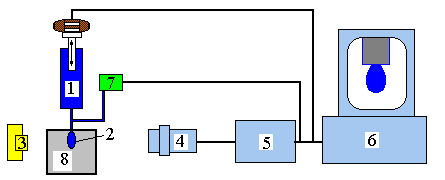
Рисунок 26 - Схема прибора PAT-2P: 1 - макродозирующая система, 2 - капля биологической жидкости, 3 - источник света, 4 - объектив и видеокамера, 5 - аналогово-цифровой преобразователь, 6 - компьютер, 7 - микродозирующая система, 8 - термостатируемая ячейка.
От видеокамеры (4) сигнал поступает в видеопроцессор (5), где происходит его преобразование из аналогового в цифровой. Затем он передаётся на компьютер (6). Для определения геометрической границы капли используется метод локального порога яркости. Граница капли определяется по максимальному градиенту яркости, как функции от координаты строки изображения, а также используется полиномиальное сглаживание каждой группы из 5 последовательных точек на границе капли. Для калибровки видеоустановки используется эталонная оптическая сетка. Экспериментальная погрешность измерений поверхностного натяжения по методу висящей капли составляет около 0,1 мН/м.
Для проведения анализа в стаканчик наливают исследуемую жидкость (достаточно 5 мл), опускают в него шланг от дозирующего устройства прибора и промывают систему шлангов и капилляр. Затем капилляр опускают в термостатируемую ячейку, включают камеру и начинают измерение. Программа строит график зависимости поверхностного натяжения и площади поверхности от времени.
Исходя из данных, полученных на приборах BPA-1P и PAT-2P, строят графики (тензиограммы) в координатах - ln T.
Анализ полученных тензиограмм. Значение ДПН в начальный момент времени (0, мН/м) определяют в координатах - T1/2 с помощью автоматической программы анализа тензиограмм Reading ADSA. В этих же координатах определяют угол наклона начального участка тензиограммы (λ0, мН/м-1 с1/2). Зависимость ДПН от времени жизни поверхности обусловлена неравновесным характером процессов адсорбции-десорбции поверхностно-активных веществ на жидкой границе раздела фаз. В начальный момент времени (t0) поверхностный слой не содержит избытка поверхностно-активных компонентов, т.е. адсорбция равна нулю, а ДПН раствора и растворителя 0 однозначны.
Скорости адсорбции и понижения ДПН определяются в общем случае диффузией сурфактантов к поверхности, скоростью преодоления так называемого адсорбционного барьера (электростатической, энтропийной или иной природы) и процессами перестройки адсорбированных молекул в поверхностном слое [118].
В координатах - lgT определяют значения ДПН при 0,1 и 1 с (1 и 2, соответственно). Значения 1, как и 0 и 0, характеризует свойства растворителя и адсорбцию в области коротких времен, а 2 - в области средних времен жизни поверхности. Величины 1 и 2 обусловлены в основном наличием низко и средне молекулярных поверхностно-активных веществ. Для высокомолекулярных фракций белков и других соединений определяющими являются значения 3 и 4, рассчитанные после обработки тензиограмм, полученных на приборах BPA 1P и PAT-2P, соответственно, путем экстраполяции к нулю в координатах - T-1/2 . При этом угол наклона тензиограммы λ1 (в области 100 с) характеризует величину адсорбции и концентрацию основного компонента раствора.
1.3.3 Исследование термических и термоокислительных свойств новых сополимеров и антистатических свойств обработанных ими материалов
