Отчет о научно-исследовательской работе
| Вид материала | Отчет |
| Получение организованных мультислоев путем чередующейся адсорбции полиионов, наночастиц и белков 1.1.5 Иммобилизированные ферменты – устойчивые системы 1.1.6 Применение иммобилизированных ферментов |
- Реферат отчет о научно-исследовательской работе состоит, 61.67kb.
- Отчёт о научно-исследовательской работе за 2011 год, 1208.93kb.
- Отчёт о научно-исследовательской работе за 2009 год, 851.3kb.
- Отчёт онаучно-исследовательской работе гу нии но ур за 2010 год, 997.69kb.
- Отчет о научно-исследовательской работе профессорско-преподавательского состава, 617.56kb.
- Отчет о научно-исследовательской работе; пояснительная записка к опытно-конструкторской, 14.47kb.
- Отчет о научно-исследовательской работе (итоговый), 2484.06kb.
- Отчет о научно-исследовательской работе, 2473.27kb.
- Отчет о научно-исследовательской работе, 392.92kb.
- Задачи секции: широкое привлечение учеников к участию в научно исследовательской работе;, 67.94kb.
Получение организованных мультислоев путем чередующейся адсорбции полиионов, наночастиц и белков
Послойная сборка чередующихся слоев противоположно заряженных полиэлектролитов и/или наночастиц позволяют формировать тонкие пленки (5-500 нм) с монослоями из различных веществ, растущими в заранее установленной последовательности на заряженном субстрате. Эта техника была названа “molecular beaker epitaxy” (молекулярная эпитаксия в пробирке) [30-37]. Это означает, что с помощью простых методов можно получить молекулярно организованные системы или СБС, аналогичные пленкам, полученным дорогим и сложным методом молекулярной лучевой эпитаксии.
Процедура послойной самосборки представлена на рисунке 19 Основная идея этого метода состоит в адсорбции полиионов, приводящей к чередованию концевых зарядов после нанесения каждого слоя. Эта главная идея подразумевает, что теоретически не существует запрета в выборе полиэлектролитов, при этом получены композитные полимерные пленки в пределах от 5 до 1000 нм с точностью более чем 1 нм и с заранее определенным составом. Для успешной сборки пленки из наночастиц или белков важен порядок чередования их с полиионами. Гибкие линейные полиионы проникают между наночастицами и выступают в роли «электростатического клея» (рис. 1.18). Концепция «электростатического полиионного клея», который соединяет вместе соседние наночастицы, является основной в данном методе, особенно плодотворна для иммобилизации ферментов [30-37].
Этот метод уже применяется для производства ультратонких пленок из заряженных полимеров (полиионов) и наночастиц (металлов, полупроводников, магнитов, ферроэлектриков и изоляторов), белков, красителей и других супрамолекулярных веществ [30-37]. Чаще всего используются следующие полиионы: поликатионы – поли(этиленимин) (ПЭИ), поли(диметилдиаллиламмоний хлорид) (ПДДА), поли(аллиламин) (ПАА), полилизин, хитозан; полианионы – поли(стиролсульфонат) (ПСС), поли(винилсульфат), поли(акриловая кислота), гепарин, ДНК. Одна полимерная нанокомпозитная пленка может содержать до сотни коммерчески доступных полиионов.
Мультислойные пленки, содержащие организованные слои белковых частиц были собраны путем чередующейся электростатической адсорбции главным образом с положительно заряженными ПЭИ, ПАА, ПДДА, хитозаном и отрицательно заряженными ПСС, ДНК и гепарином [30-37]. Величина рН белковых растворов выбиралась вдали от изоэлектирческой точки и таким образом белки были заряжены, что являлось необходимым условием эксперимента. Удачно была выполнена сборка пленок с 20 разными белками (в их числе, цитохром, карбоновая ангидраза, миоглобин, гемоглобин, родопсин, пероксидаза, алкогольдегидрогеназа, глюкоамилаза, глюкозооксидаза, иммуноглобулин, каталаза). Все белки подвергались чередующейся адсорбции с органическими полиэлектролитами неограниченное количество циклов. Белки, иммобилизованные в мультислои даже с сильными полиэлектролитами, как правило, не денатурировали [37].
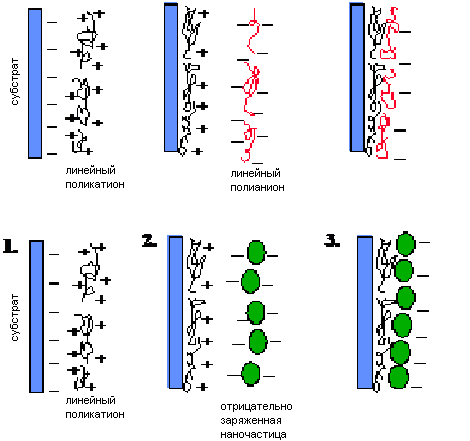 |
| Рисунок 19 – Схема поликатион/полианионной чередующейся сборки: линейный полианион с поликатионом и поликатион с наночастицами [37] |
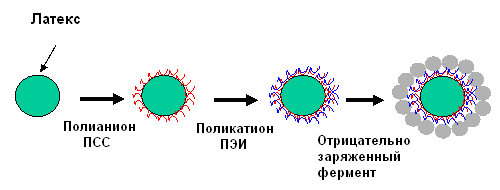
Рисунок 20 – Схема сборки полиион/наночастица на сферических микроядрах
 |
| Рисунок 21 – Уреаза, инкапсулированная в микрокапсулы диаметром 5 мкм, толщина стенок 30 нм [37] |
Кроме того, в некоторых случаях послойная иммобилизация в линейные и разветвленные полиэлектролиты увеличивала стабильность ферментов. Ферментативная активность в мультислоях возрастала линейно с увеличением числа белковых слоев до 10-15, и в этой точке активность пленки становилась «насыщенной». Это «насыщение» возможно обуславливается ограничением диффузии субстрата в пленку, т.е. наступлением предела доступности субстрата для фермента при постоянной скорости транспорта субстрата через мультислой [30-37].
Развитие техники сборки «полиэлектролитных пленок» для различных белков позволило конструировать мультикомпонентные белковые пленки. Эти пленки чрезвычайно интересны в качестве новых биологически активных наноматериалов. Последовательные ферментативные реакции и перенос электронов и энергии становятся возможными путем приготовления анизотропных белковых слоев с точным контролем за расстоянием между активными слоями [30-37]. Процесс сборки, разработанный для твердых носителей, может быть перенесен на пористые носители (хроматографические пластины, мембраны, пористые волокна) или на поверхность микро- и наноядер. Сборка оболочек наночастица-фермент-полиэлектролит на микроядрах является многообещающим инструментом в создании комплексов ферментных коллоидов [30-37].
Недавно был описан [37] новый подход в построении трехмерных субмикронных структур с использованием заряженного латекса и липидных трубок. При этом поликатионный раствор добавлялся к отрицательно заряженному латексу или другим ядерным частицам. После того как прошла адсорбция, латекс отделяли от раствора поликатиона (обычно 10-мин. центрифугированием при 10000 g), и затем выдерживали латекс в полианионном растворе, и так далее. Например, на рисунке 20 представлена сборка кремниевых сфер диаметром 75-нм на латексе диаметром 100 нм. Сборка оболочки проводилась в 2 этапа: сначала путем адсорбции катионного поли(этиленимина) изменялся заряд поверхности отрицательного 200-нм латекса на положительный; а затем адсорбировались организованные частицы кремния. Смешивание видоизмененных и невидоизмененных наночастиц приводит к их флоккуляции и образованию суперкристаллов: большие частицы разделяются слоем более мелких частиц [37].
Метод послойной самосборки был применен для создания тонких организованных оболочек на латексных ядрах. Организованные мультислои наночастиц (9-, 20-, 45-нм в диаметре частицы кремния или 12-нм магнетит) и глюкозооксидазы (ГОД) были собраны чередованием с противоположно заряженными полиэлектролитами на 420-нм латексных частицах. Поэтапный рост мультислойной пленки был подтвержден методом микроэлектрофореза и электронной микроскопии. Введение слоя наночастиц на латексе дает увеличение площади поверхности, что приводит к большей адсорбции ГОД и, таким образом, к увеличению каталитической активности биореактора. Биоактивность была пропорциональна площади поверхности ядра и количеству монослоев ГОД в оболочке. Кроме того, присутствие магнитных наночастиц позволяет нанореакторам самостоятельно перемешиваться с изменением магнитного поля и увеличивает их продуктивность [35-37].
Существует также несколько другой подход в создании «биореакторов»: после того как будет сформирована «поликатион-полианионная» оболочка, растворяют меланоформальдегидные латексные ядра при рН=1 и получают полые полимерные капсулы с толщиной стенок 40 нм. Эти капсулы могут включать в себя различные ферменты. Продемонстрировано увеличение каталитической активности ферментов, инкапсулированных таким способом. Ферменты в этих «биореакторах» защищены от действия высокомолекулярных денатурирующих агентов и ингибиторов, в то время как маленькие молекулы субстрата могут свободно достигать фермента.
Полые полиэлектролитные оболочки, собранные методом послойной самосборки, позволяют точно контролировать размер таких оболочек, толщину оболочки, состав оболочки и ее проницаемость. В оболочки из линейных полиионов могут быть включены липидные бислои, ферменты и наночастицы. Конструкция полых полиэлектролитных оболочек включает послойную адсорбцию противоположно заряженных полиэлектролитов на каком-либо ядре с последующим разрушением этого ядра. Процедура покрытия коллоидных частиц противоположно заряженными полиэлектроли-тами является модификацией метода «самосборки» (рис. 19). После того как все заданные полиэлектролитные слои были нанесены, покрытые частицы подвергали воздействию раствора HCl для разрушения ядра. После промывания системы были получены полые оболочки (рис. 21). Используют 2 способа нагрузки оболочек: а) нагрузка при низких значениях рН; б) нагрузка в смеси воды и спирта. Оболочки, выдерживаемые при рН 4,5, образуют дыры диаметром до 10 нм. По-видимому, изменение заряда полиэлектролитов под действием изменения рН вызывает образование пор или разрыхление полиэлектролитной структуры, делая полимерные слои проницаемыми. Оболочки, выдерживаемые в смеси вода:этанол 1:1 достаточно проницаемы для проникновения глобул уреазы 5-нм в диаметре через мембрану оболочки (рис. 21). Когда эти же оболочки помещали обратно в воду, то они снова становились непроницаемыми (рис. 21). Объяснение этого процесса заключается в том, что полиэлектролитная структура становится «доменной» в водно-спиртовой среде, позволяя проникновение уреазы внутрь оболочки, в то время как при возвращении капсул в водную среду полиэлектролитные стенки переходят в закрытую структуру. Алогичным методом были инкапсулированы глюкозооксидаза, каталаза, миоглобин, гемоглобин, и химотрипсин. Ферменты в оболочках сохраняли биоактивность и увеличивали свою стабильность [37].
Таким образом, реализация принципов создания супрамолекулярных ферментных систем или СБСф – это достаточно простые и эффективные методы иммобилизации или послойной «самосборки» полимер-ферментных комплексов. Эти методы не требуют высокой чистоты компонентов, могут быть автоматизированы и применены для массового производства организованных нанокомпозитных биоматериалов.
1.1.5 Иммобилизированные ферменты – устойчивые системы
В процессе иммобилизации зачастую происходит частичная потеря активности фермента. Глубина этой «денатурации» зависит от свойств сшивающего агента и подложки, а также от условий проведения реакции. Экспериментальные данные свидетельствуют, что во многих случаях молекула белка при иммобилизации практически не меняет своей нативной конформации и потеря активности связана с экранировкой активного центра поверхностью носителя. При благоприятных обстоятельствах иммобилизованный фермент сохраняет исходную активность и даже превышает ее, возможно, за счет полезных конформационных изменений или влияния локальных свойств поверхности носителя. [1, 39]
Чаще всего иммобилизация приводит к существенному возрастанию стабильности фермента но отношению к нагреванию и действию денатурирующих агентов. По данным П. Каплана (США), такой лабильный фермент, как лактатдегидрогеназа, пришитая к стеклу, сохраняет свою активность в кислой среде без малейшего изменения в течение месяца. Нативный фермент в тех же условиях полностью теряет активность в течение трех часов. [1, 39]
При нагревании многие иммобилизованные на поверхностях ферменты частично теряют активность в начальный период, затем активность достигает некоторого постоянного значения, которое остается далее неизменным. Например, активность трипсина, пришитого к поверхности сефадекса с помощью бромциана, при 50 °С падает до 55 % от исходной, после чего инактивация практически прекращается. Гомогенно растворенный трипсин полностью инактивируется в этих условиях в течение 6 часов. [1]
Можно думать, что скорость и глубина инактивации иммобилизованных ферментов в известной степени зависит от числа связей молекулы белка с поверхностью носителя. Так, Д. Габил (Швеция) показал, что молекулы трипсина, пришитые одним или двумя мостиками к поверхности сефадекса, полностью теряют свою активность в 8 М мочевине. Фермент, прикрепленный в трех точках, сохраняет в этой среде 30 % активности. Если трипсин связан с носителем в четырех точках, его активность полностью сохраняется [1].
Физико-химические закономерности иммобилизации ферментов изучены пока еще недостаточно, однако данные о стабильности ферментов свидетельствуют, что метод иммобилизации при правильном выборе носителя, сшивающего агента и условий позволяет получить препараты ферментов, близкие по свойствам к химическим гетерогенным катализаторам [1, 39, 40].
На рисунке 22 схематически представлены основные принципиально важные способы иммобилизации ферментов. В первом случае (а) фермент пришит одной связью к поверхности носителя. Даже такая простейшая иммобилизация позволяет стабилизировать фермент. Известно, что некоторые протеолитические ферменты подвержены реакции автопротеолиза, в результате чего быстро теряется их активность. Если же такой фермент (например, трипсин или химотрипсин) привязать к поверхности, то межмолекулярное взаимодействие будет исключено и автопротеолиз прекращается. Фермент можно привязать к поверхности и рядом связей, сочетая эти связи со связыванием ферментов между собой, например, глутаровым альдегидом, диметиловым эфиром диимида адипиновой кислоты (б), его можно включить в гель или в полимер (в). Можно сочетать включение фермента в гель с пришивкой его к полимерным молекулам геля (г). Кроме того, иммобилизацию фермента можно осуществить инкапсулированием – созданием около молекул фермента полупроницаемой капсулы, например, включением фермента в липосомы.
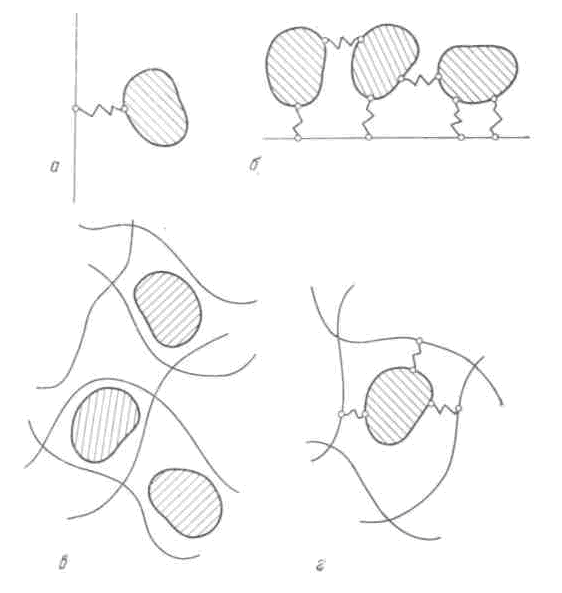
Рисунок 22 – Некоторые виды иммобилизации.
Связывание фермента с носителем осуществляется путем образования ковалентных связей между ферментом и матрицей; полимеризацией мономера; благодаря электростатическому взаимодействию противоположно заряженных групп фермента и матрицы; сополимеризацией фермента и мономера, образующего матрицу; связыванием фермента и матрицы в результате невалентных взаимодействий – гидрофобных, с образованием водородных связей и др.
1.1.6 Применение иммобилизированных ферментов
Уникальные качества иммобилизованных ферментов создают реальную базу для развития новых технологических процессов. Интересные возможности открылись в пищевой, химической и других отраслях промышленности.
Сегодня в промышленности реализовано всего четыре крупномасштабные технологии на основе иммобилизованных ферментов (глюкозоизомеразы, аминоацилазы, пенициллинацилазы и лактазы).
В качестве примера укажем на технологически реализованный процесс получения 6-аминопенициллановой кислоты (6-АПК) из природного бензилпенициллина. Раствор бензилпенициллина обрабатывают иммобилизованной пенициллинамидазой, в результате чего расщепляется амидная связь с остатком фенилуксусной кислоты и образуется 6-АПК.
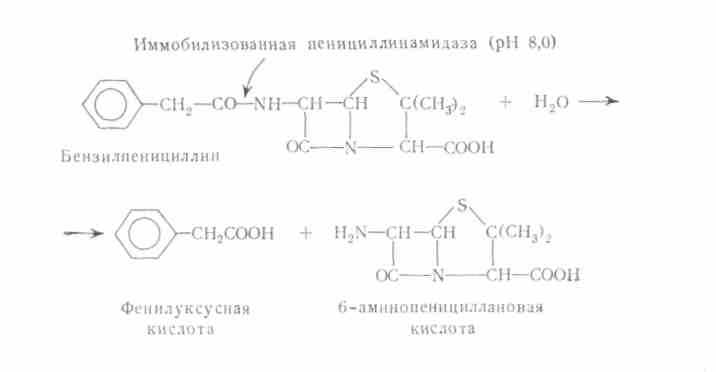
Химически провести такое расщепление чрезвычайно трудно, так как в молекуле пенициллина существует другая, значительно более лабильная амидная связь в четырехчленном лактамном кольце. 6-АПК служит исходным продуктом для синтеза пенициллинов широкого антибактериального спектра действия. В настоящее время особый интерес приобретает использование ампициллина, аналога природного пенициллина, в молекуле которого остаток фенилуксусной кислоты замещен остатком D-фенилглицина. Ампициллин получают химическим путем из 6-АПК и D-фенилглицина, но в принципе этот процесс может быть также осуществлен с использованием иммобилизованной пенициллинамидазы. Как выяснилось, этот фермент в кислой среде катализирует реакцию синтеза пенициллинов из 6-АПК и подходящих кислот. [41].
В обозримом будущем иммобилизованные ферменты могут быть использованы для следующих целей [41].
Лактазу иммобилизовали на частицах кремнезема и применяли для конверсии лактозы сыворотки в глюкозу и галактозу. Холинэстераза может применяться для определения пестицидов. Степень ингибирования этого фермента в присутствии пестицидов оценивают электрохимическими или колориметрическими методами. Аналогичным образом другие ферменты могут использоваться для определения токсических веществ. Так, карбоангидраза очень чувствительна даже к малым концентрациям хлорпроизводных углеводородов, гексокиназа — к хлордану, линдану и токсафену. Иммобилизованная диизопропилфторфосфатаза нервных клеток кальмара может найти применение для обезвреживания фосфоорганических нервных газов (зомана, зарина). Иммобилизованная гепариназа может применяться для предотвращения тромбообразования в аппаратах искусственного кровообращения. Иммобилизованная билирубиноксидаза может использоваться для удаления билирубина из крови новорожденных, страдающих желтухой.
Наиболее хорошо изучены и широко применяются иммобилизированные ферменты для производства продуктов, в том числе диетических.
Изучались условия иммобилизации в полиакриламидном геле фермента глюкозоксидазы из Aspergillus niger штамма ATCC 166808, используемой для окисления глюкозы инвертного сахара в глюконовую кислоту. Установлено, что оптимум pH не изменяется при иммобилизации, а температурный оптимум сдвигается с 50 до 55 °C. В результате иммобилизации уменьшилась инактивация фермента под действием температуры и pH среды. Наблюдается увеличение кажущейся Km. Высокая активность иммобилизированного фермента свидетельствует о возможности использования полиакриламидного геля при иммобилизации глюкооксидазы [42].
В другой работе для повышения качества инвертного сиропа и его биологической ценности кислотную инверсию сахарозы заменили ферментативной. Для этой цели использовали иммобилизованную -фруктофуранозидазу. Рекомендованы следующие условия получения инвертного сиропа из сахарного р-pa концентрацией 80%: дозировка ферментного препарата 10 ед. активности на 1 г сахара, pH 4,0, t 70±2 °C, продолжительность гидролиза 3,0-4,0 ч. Предлагаемый способ получения инвертного сиропа позволяет уменьшить расход ферментного препарата в 1,5 раза и сократить продолжительность инверсии на 1-1,5 ч [43].
β-Фруктофуранозидазы (КФ 3.2.1.26) Aspergillus niger St-0018 и A. foetidus St-0194 использованы для получения фруктоолигосахаридов в периодических и непрерывных условиях. Наиболее эффективные иммобилизованные биокатализаторы получены включением клеток в гель альгината кальция. Установлена возможность превращения остаточной сахарозы в палатинозу и трегалулозу под действием изомальтулозсинтазы (КФ 5.4.99.11) [44].
Исследовали применение промышленной пектиназы (ПЕ) в производстве плодово-ягодных соков. Определяли кинетические характеристики иммобилизованной на анионообменной St-DVB смоле с макропористой основой с использованием электростатической адсорбции промышленной ПЕ (Pectinex Ultra SP-L). Пектолитическая активность иммобилизованной и свободной ПЕ определялась с помощью вискозиметрического метода с регистрацией данных снижения вязкости при 35 °C и pH 4,5. Для определения кинетических параметров модели Микаэлиса - Ментена использовались различные концентрации пектина (0,5; 1,0; 1,5; 2,0; 2,5; 3,0; 3,5 % масс./об.). Установили, что иммобилизованная ПЕ проявляла относительно низкую активность в сравнении с растворимым ферментом. Препарат иммобилизованной ПЕ снижал вязкость пектинового р-ра (3,5 %) после 20 мин выдержки с 717 до 132,6 Пуаз. Ферментная активность измерялась при 6 рабочих температурах в диапазоне от 20 до 90 °C. Оптимальная ферментная активность была получена при 65 °C для свободной и иммобилизованной ПЕ. Было установлено, что иммобилизация повышает теплоустойчивость ПЕ. Была определена энергия активации биохимической реакции, катализированная свободным и иммобилизованным ферментами, на основании правила Аррениуса - 9,424 и 11,98 ккал/моль соответственно. Кроме того, было установлено, что оптимальная рабочая температура не зависела от иммобилизации [45].
Кроме того, исследовали иммобилизацию пектиназы в процессе фильтрации яблочного сока с использованием полого волокна из полисульфона; определяли способность физически иммобилизованного фермента гидролизовать гелевый слой; определяли влияние ферментного слоя на сопротивление пермеатному потоку; изучали влияние глютаральдегида на процесс иммобилизации. В качестве образцов использовался цитрусовый пектин промышленного производства, из которого приготавливались дисперсии с концентрацией 1,2-10 мг/л. Для ультрафильтрации использовалась пилотная установка Amicon модели DC50P с единичным картриджем с полым волокном (0,45 м2). Проводились 3 вида экспериментов: ультрафильтрация пектинового раствора (ПР) через чистое полое волокно; ультрафильтрация ПР через полое волокно с иммобилизованной пектиназой (ИП); ультрафильтрация ПР через неактивную ИП. Установили, что в процессе ультрафильтрации ПР на ИП эффективно развивался гелевый слой. Величины относительного пермеатного потока (Jr) для мембраны без фермента в основном были ниже, чем после иммобилизации пектиназы методом адсорбции. Подтвердилось также, что величина Jr в основном более стабильна при использовании ИП. Улучшение пермеатного потока было получено только при меньшей концентрации пектина (Ср) и повышенной концентрации фермента (Се). С другой стороны, при увеличении Ср иммобилизация фермента отрицательно влияла на поток пермеата (Jp). При снижении потока ретентата (Q) до ламинарного состояния поток пермеата через мембрану без фермента усиливался более чем на 60%. То же самое наблюдалось при исследовании ИП. При увеличении рН до 7 фермент инактивировался, пектиновый гелевый слой не снижался, а Jr повышался. ИП оставалась адсорбированной на мембране, увеличивая сопротивление пермеатному потоку. Результаты исследования гидролизованного пектина показали, что содержание галактуроновой кислоты (Са) быстро повышалось вместе с Се, достигая максимума при величине Се около 5 г/л. При использовании относительно концентрированного раствора глютаральдегида было получено заметное инактивирование фермента. Хотя физическая иммобилизация промышленной пектиназы практически не увеличивает пермеатный поток, она в некоторой степени контролирует гелевый слой, образованный при ультрафильтрации яблочного сока. Пектиназный слой частично гидролизует пектиновые молекулы, непрерывно осаждаемые в процессе ультрафильтрации, тормозя скорость образования гелевого слоя на мембране и вокруг отверстий мембраны. Такой эффект обеспечивает сохранение скорости пермеатного потока на достаточно высоком уровне, чтобы снизить число ступеней промывания мембраны, увеличивая, т.о., срок работы в пределах достаточного выхода сока [46].
Также, исследовали применение промышленной пектиназы в производстве морковного сока с целью изучения активности и возможности повторного использования иммобилизованной промышленной пектиназы (ИПЕ) Pectinex Ultra SP-L на морковном пюре. Промышленное получение пектолитического фермента представляло собой иммобилизацию с применением электростатической адсорбции на частицах пористых анионообменных смол. Активность ИПЕ определялась измерением снижения вязкости модельной системы пектинового р-ра при t 35 оC. Частицы ИПЕ добавлялись в морковное пюре в количестве 1,5 г/100 г пюре для разрушения растворимого и нерастворимого пектина и вызывающих помутнение полисахаридов. Была установлена нагрузка фермента на анионообменные смолы, которая составила 8,10-81,96 %. В то время как вязкость и pH пюре снижались, содержание сухих веществ и общий выход сока повышались в результате разрушения полисахаридов. В среднем увеличение выхода сока составило 30,23 % по отношению к использованию неферментативного метода производства. При первоначальной концентрации ИПЕ 2 % об./об. выход морковного сока достиг максимальной величины 81,96 %, однако видимая ферментная активность не была связана с выходом сока и составляла 2,52 пектина (% масс./об.)/мл фермента в с. При 2-кратном использовании ИПЕ значительного снижения стабильности не наблюдалось. После 9 циклов использования ИПЕ потеря активности составила всего 20 %. Исследование устойчивости ИПЕ при хранении показало, что первоначальная активность фермента сохранялась в течение не меньше 7 нед при 4 °C и pH 4,5 в нитратном буфере. Потеря активности составила только 7,80 %. Установили, что при обработке морковного пюре кислотность сока повышалась, а содержание сухого в-ва менялось с 9,2 до 10,8 % масс./масс. в основном в результате разрушения пектина, вязкость пюре снижалась с 90 до 6,5 Пуаз после 60 мин воздействия. После повторного использования значительного снижения устойчивости иммобилизованных частиц смолы не наблюдалось в течение 1 нед экспериментов. Общее снижение активности составляло примерно 6,5 %. Результаты показали, что иммобилизация промышленной пектиназы представляет интерес для обработки морковного пюре с целью повышения выхода морковного сока [47].
Качество плодово-ягодных соков в значительной степени зависит от упаковки, при выборе которой важно учитывать ряд факторов: сохранение вкуса/аромата, возможность изменения цвета на свету, скорость потери витаминов, микробиальная активность. В работе [48] рассмотрены различные виды упаковки (стекло, металлы, полимеры), их преимущества и недостатки. Представлена таблица с наиболее важными физическими (оптическими, механическими, термическими и др.) и химическими (газо- и водопроницаемость, абсорбция ароматов и др.) свойствами полимерных У. Для соков рекомендовано использовать комбинации различных полимеров или полимеров с картоном и алюминиевой фольгой с учетом того, что ни один материал не обладает всеми необходимыми свойствами. Подробно рассмотрены пленочные упаковки нового поколения, взаимодействующие с продуктом: антимикробные полимеры (АМ); обогащающие аромат (АО); с селективными барьерными свойствами (СБ). АМ продлевают сохранность соков и других продуктов, их готовят внедрением в съедобные пленки низина, сорбатов или иммобилизованных ферментов, в частности глюкозооксидазы. Используют также антимикробные свойства ионов серебра, покрывая солями серебра цеолиты и затем внедряя их в контактирующий с поверхностью пищевого продукта ПЭНП (полиэтилен низкой плотности). Дана таблица с рядом веществ, которые могут быть добавлены к полимерам, делая их АМ. ОА пленки содержат иммобилизованные ферменты, которые улучшают аромат соков из плодовых цитрусовых культур и гидролизуют вещества, придающие горечь соку. Упаковка в модифицированной газовой среде (3-6 % O2, 2-10 % CO2) в пленки СБ значительно повышает сохранение качества продуктов.
Изучались условия иммобилизации и структурно-функциональные свойства иммобилизованной инулазы, фермента, перспективного для производства диетических продуктов из нетрадиционных видов растительного сырья. В качестве носителей для иммобилизации инулазы были апробированы ионообменные смолы, подготовленные к связыванию с молекулой фермента путем кондиционирования. Данные по исследованию аминокислотного состава фермента показали, что инулаза содержит преимущественно полярные аминокислотные остатки (аспарагиновые и глутаминовые), а также имеет в своем составе имидазольные группы гистадина. Эксперименты по исследованию влияния температуры на каталитическую активность инулазы свидетельствуют о том, что фермент является термостабильным: даже при 70 °С активность сохраняется на 22 % от максимальной. Температурный оптимум функционирования инулазы лежит в пределах 47-51 °С с максимальной активностью при 50 °С. Опыты с ионами железа (ИЖ) показали, что при концентрации 104 М/л ИЖ вызывают увеличение активности фермента на 20 %. Воздействие ИЖ на свободную инулазу также приводит к активации фермента, но повышает каталитическую активность на 25-30 %. Было также установлено, что ИЖ не влияют на кинетику ферментативного катализа реакции гидролиза субстрата, а лишь оказывают воздействие на реакцию воздействия фермента с субстратом, т.е. ИЖ выступают в роли структурного агента. Исследования показали, что иммобилизованную инулазу можно использовать для гидролиза инулина в реакторе колоночного типа в течение нескольких мес [49].
В работе Kochhar A. at al.[50] исследования посвящены идентификации штамма Aspergillus candidus (NCIM 883) (10 ед./см3 среды) с высоким производством инулиназы (ИН) для получения фруктозы из инулина. Межклеточная ИН этого плесневого гриба была очищена в 56 раз фракционированием с сульфатом аммония и методом колоночной хроматографии. Соотношение содержания инвертазы к ИН (1,8 в фильтрате культуры) было снижено до 0,14 в очищенном растворе. Оптимальные значения рН и температуры составили 5,5 и 45 оС, соответственно. Молекулярная масса ИН была определена равной 54±4 кДа, Km ИН с инулином в качестве субстрата был равен 3,8 мМ/дм3. Очищенный препарат позволил получать только фруктозу в качестве продукта гидролиза инулина, что указывает на то, что ИН обладает, главным образом, экзо-инулиназной активностью. ИН была иммобилизована на хитине и казеине с помощью глютаральдегида в качестве связующего агента и на целлюлозе с помощью FeCl3-HCl в качестве хелатообразователя. На целлюлозе был достигнут максимум иммобилизации (45,8 %). Все 3 иммобилизованных препарата имели более высокую оптимальную t 55 °С. ИН, иммобилизованные на целлюлозе и казеине, были стабильны при рН 5-7. Препарат, иммобилизованный на целлюлозе, был более устойчивым, чем другие 2 после нагревания в течение 1 ч при t 55 °С, и сохранял 76 % активности по сравнению с 52 % и 61 % для препаратов, иммобилизованных на хитине и казеине, соответственно. Нагревание выше 55 °С приводило к быстрому спаду активности. Препараты ИН гриба Aspergillus candidus были более устойчивы по сравнению с 50%-ной потерей активности иммобилизованной ИН Fusarium oxysporum при t 50 оС в течение 45 мин. Km ИН, иммобилизованной на целлюлозе, казеине и хитине составили 1,25, 0,3 и 1,66 мМ/дм3, соответственно. Следовательно, иммобилизация не оказала вредного воздействия на сродство инулина с ферментом [50].
Возможно, вскоре удастся создать системы из нескольких иммобилизованных ферментов. Так, если заключить в микрокапсулы три фермента — уреазу, глутаматдегидрогеназу и глюкозодегидрогеназу, то их можно будет использовать для удаления мочевины из крови больных с почечной недостаточностью.
Иммобилизованные ферменты найдут дальнейшее применение в молочной промышленности. При производстве сыра могут использоваться иммобилизованные свертывающие молоко белки — реннин и пепсин. Для гидролиза жира в молоке можно использовать иммобилизованные липазы и эстеразы.
Разнообразные иммобилизованные ферменты со временем найдут применение и в датчиках для быстрого анализа. Сегодня в таком качестве используются лишь несколько ферментов, но когда будет решена проблема стабилизации, их число увеличится. Особенно полезными из-за их высокой стабильности могут оказаться ферменты термофилов.
Хорошие результаты дает применение ферментов иммобилизованных, т.е. фиксированных на твердых носителях, которые не реагируют с пищевым соком и устойчивы к механическим, химическим и микробиологическим воздействиям. К таким носителям относятся синтетические смолы, полистиролы, полимерные карбоновые соединения.
Ферменты связываются с носителем в результате взаимодействия реактивных групп их белковых молекул (амино- и карбоксильные группы) с реактивными группами носителя (кислоты, альдегиды). Активность иммобилизованных ферментов в несколько сот раз выше, чем ферментов, растворенных в соке [51, 52].
В настоящее время ферменты широко используются в биотехнологическом производстве и лабораторных исследованиях. В связи с чем, актуальным является продление и увеличение их активности. Использование наночастиц, обладающих рядом уникальных свойств, открывает перспективу модуляции каталитических свойств ферментов. Показано, что связывание ферментов с наночастицам приводит к сохранению их активности при отклонении параметров реакции (рН, температуры) от оптимальных [53, 54]. Ферменты, иммобилизованные на наночастицах, имеют так же более длительный срок хранения. Однако в некоторых работах сообщается об угнетении активности ферментов при взаимодействии с наночастицами [55].
Глюкоамилаза препарата «Глюкоаваморин» иммобилизована адсорбцией на углеродном носителе марки «Сибунит». Полученный биокатализатор изучен в процессе осахаривания крахмала (гидролиз декстринов). Исследования по влиянию адсорбционной иммобилизации на кинетические характеристики глюкоамилазы, в том числе на константы скорости термоинактивации, показали, что при иммобилизации Глюкоаваморина на углеродном носителе Сибуните наблюдается 103-кратное повышение термостабильности глюкоамилазы по сравнению с ферментом в растворе. Значительный стабилизирующий эффект оказывает присутствие субстрата (декстрины) в реакционной среде, причем увеличение концентрации декстринов приводит к повышению термостабильности иммобилизованного фермента. Суммарный эффект стабилизации глюкоамилазы при ее адсорбции на углеродном носителе Сибуните в присутствии 53%-ных растворов декстринов составляет ~105 раз по сравнению с ферментом в растворе. Биокатализатор для процесса осахаривания крахмала, приготовленный на основе иммобилизованного на Сибуните Глюкоаваморина, отличается высокой операционной стабильностью: при 60 °С время его полуинактивации превышает 30 сут [56].
