Отчет о научно-исследовательской работе
| Вид материала | Отчет |
- Реферат отчет о научно-исследовательской работе состоит, 61.67kb.
- Отчёт о научно-исследовательской работе за 2011 год, 1208.93kb.
- Отчёт о научно-исследовательской работе за 2009 год, 851.3kb.
- Отчёт онаучно-исследовательской работе гу нии но ур за 2010 год, 997.69kb.
- Отчет о научно-исследовательской работе профессорско-преподавательского состава, 617.56kb.
- Отчет о научно-исследовательской работе; пояснительная записка к опытно-конструкторской, 14.47kb.
- Отчет о научно-исследовательской работе (итоговый), 2484.06kb.
- Отчет о научно-исследовательской работе, 2473.27kb.
- Отчет о научно-исследовательской работе, 392.92kb.
- Задачи секции: широкое привлечение учеников к участию в научно исследовательской работе;, 67.94kb.
1.4.1 Определение каталитической активности липаз из различных источников в присутствии природного полимера – бычьего сывороточного альбумина (БСА)
Очень важно, что БСА который является одним из наиболее доступных и простых белков [29], имеет относительно небольшую молекулярную массу (66000), ненамного превышающую молекулярную массу выбранных липаз. БСА выполняет важные физиолого-биохимические функции в плазме крови, в частности, связывая и транспортируя жирные кислоты и катионов металлов. Эта функция очень важна и делает БСА перспективным для данных исследований.
Активность липаз из поджелудочной железы свиньи, Pseudomonas fluorescens и Mucor javanicus была измерена в системе с бычьим сывороточным альбумином в соотношениях фермент : альбумин 10:1, 1:1, 1:10 и 1:100. Активность липазы из поджелудочной железы свиньи (Л-1), измеренная при соотношениях фермент : БСА от 10:1 до 1:100 не показала достоверных отклонений от активности липазы без БСА, принятой за 100 %.
В случае липазы из гриба Mucor javanicus наблюдается незначительное снижение активности фермента в присутствии БСА на 4-16 % при избытке липазы относительно альбумина, и снижение активности на 27-28 % при избытке альбумина относительно фермента.
Активность липазы из Pseudomonas fluorescens в присутствии БСА всегда была выше контроля (за контроль была принята активность липазы без альбумина) и максимальна при соотношении липаза : БСА, равном 10:1 (выше контроля в 1,5 раза).
Подобное увеличение ферментативной активности липазы может быть объяснено структурными особенностями альбумина. Структура альбумина описывается как одна длинная полипептидная цепочка, уложенная в 4 связанных глобулярных сегмента неравных размеров, конформация которых фиксирована 17 дисульфидными связями [29].
Такое сегментированное устройство придает молекуле значительную подвижность. На ее поверхности имеется 2–5 участков, с наличием которых связывают высокое сродство к органическим анионам, нерастворимым в водной среде. Особенно важно это свойство проявляется при связывании анионов жирных кислот, благодаря чему менее чем 1/5000 от их общего количества находятся в крови в свободном виде [29]. Связывание анионов жирных кислот альбумином и удаление их из реакционной смеси сдвигает равновесие гидролитической реакции расщепления субстрата триацетина в сторону образования продуктов реакции.
Таким образом, БСА по-разному взаимодействует с указанными липазами и является оптимальным «активатором» только для липазы из Pseudomonas fluorescens. В случае липаз из поджелудочной железы свиньи и Mucor javanicus требовались другие полимеры, которые были выбраны из имеющихся синтетических полиэлектролитов.
1.4.2 Измерение ДПН растворов липазы из поджелудочной железы свиньи в смеси с бычьим сывороточным альбумином
ДПН раствора липазы из поджелудочной железы свиньи было измерено в присутствии бычьего сывороточного альбумина при молярных соотношениях липаза : альбумин 1:100, 1:50, 1:10, 1:1, 10:1, 50:1, 100:1, а также измерено ДПН индивидуальных растворов липазы из поджелудочной железы свиньи (концентрация 10-5 М) и бычьего сывороточного альбумина (концентрация 10-5М).
Из полученных тензиограмм было рассчитано ДПН в динамике. При коротких временах существования поверхности 0,01 и 0,1 с ДПН растворов липазы, БСА и их смесей в различных соотношениях близко к ДПН воды и незначительно изменяется от 74,5±0,2 до 77,2±0,4 мН/м (эти значения соответствуют ДПН воды при данных временах существования поверхности, полученному на приборе BPA-1P). Угол наклона начального участка тензиограмм отличался незначительно.
При времени жизни 1 с становятся заметны различия в σ2 смесей липаза : БСА. Видно, что БСА быстрее понижает ДПН (σ2 = 69,4±0,1 мН/м), чем липаза (σ2 = 71,7±0,1 мН/м), поверхностное натяжение которой лишь незначительно ниже ДПН воды при этом времени. Как и следовало ожидать, при увеличении концентрации липазы в смеси липаза : БСА от 1:1 до 100:1 σ2 практически не изменяется и близко к ДПН воды. При увеличении концентрации БСА в смеси липаза : БСА от 1:10 до 1:100 σ2 близко к ДПН чистого БСА.
ДПН липазы и смесей липаза : БСА с высокой относительной концентрацией липазы (10:1, 50:1, 100:1) заметно понижалось лишь при 100 с (σ3 лежит в пределах от 69,9 ±0,6 до 71,1 ±0,1 мН/м). Продолжает понижаться ДПН БСА (62,0±0,3 мН/м) и смесей липаза : БСА с высокой относительной концентрацией БСА (1:10 - 61,9±0,2 мН/м, 1:50 - 62,7±0,1 мН/м, 1:100 - 61,9±0,4 мН/м).
В случае эквимолярного соотношения липаза : БСА σ3 было равно 67,7±0,2 мН/м, что на 5,7 мН/м больше, чем при увеличении концентрации БСА в 10 раз (1:10), и на 3,4 мН/м меньше, чем при увеличении в 10 раз концентрации липазы (10:1). Угол наклона тензиограммы в области 100 с - λ1 изменяется от 11,2±0,9 до 13,2±0,3 мН∙м-1с1/2 для БСА и смеси липаза : БСА 1:10-1:100, уменьшается при соотношении 1:1 до 7,4±0,9 мН∙м-1с1/2, и значительно уменьшается с увеличением концентрации липазы относительно БСА до 1,2±0,6 – 4,8±0,7 мН∙м-1с1/2.
При длинных временах существования поверхности ДПН (σ4) липазы (42,9±1,2 мН/м) снижается больше, чем ДПН БСА (51,7±0,1 мН/м) на 9 мН/м.
Следует отметить, что добавление БСА в малых концентрациях к раствору липазы (соотношения от 100:1 до 10:1) увеличивает ДПН комплексов липаза : БСА при длинных временах на 3-5 мН/м. Это говорит о том, что БСА либо вступает в конкурентную адсорбцию с липазой за поверхность раздела фаз, либо образует комплекс с липазой, который понижает адсорбцию чистой липазы на границе раздела фаз. При эквимолярном соотношении параметр σ4 увеличивается на 7 мН/м. В случае преобладания в смеси БСА (соотношения 1:10, 1:50 и 1:100) σ4 близко к ДПН чистого БСА, так как большой молекулярной массы альбумин занимает все больше поверхности. Кроме того, известно, что белки на границе раздела фаз подвергаются конформационным изменениям, в частности возможно разворачивание белковой глобулы и «вытягивание» белка на поверхности раздела фаз.
Таким образом, добавление БСА к раствору липазы в соотношении 1:10 проводит к максимальному снижению ДПН при больших временах существования поверхности (σ4).
1.4.3 Измерение ДПН растворов липазы из поджелудочной железы свиньи в смеси с поли-L-глутаминовой кислотой
Для изучения взаимодействия липазы с отрицательно заряженными полиэлектролитами и возможности образования их комплексов был выбран модельный полипептид – поли-L-глутаминовая кислота. ДПН раствора липазы из поджелудочной железы свиньи было измерено в присутствии поли-L-глутаминовой кислоты (ПГ) при молярных соотношениях липаза : ПГ 1:100, 1:10, 1:1, 10:1, 100:1.
В программе Reading ADSA были рассчитаны показатели динамического поверхностного натяжения. При коротких временах существования поверхности 0,01 и 0,1 с ДПН растворов ПГ и смесей липаза : ПГ в различных соотношениях близко к ДПН воды и незначительно изменяется от 75,1±0,2 до 77,1±0,1 мН/м (эти значения соответствуют ДПН воды при данных временах существования поверхности, полученному на приборе BPA-1P). Угол наклона начального участка тензиограмм отличается незначительно.
Полиглутаминовая кислота, как известно для полиэлектролитов, является поверхностно неактивным соединением. Это видно на тензиограмме, которая соответствует динамическому поверхностному натяжению воды. При длинных временах существования поверхности σ4 раствора липазы меньше, чем ДПН раствора ПГ на 27 мН/м.
При временах жизни 1 и 100 с различия в σ2 и σ3 смесей липаза : ПГ еще не видны. ДПН изменяется от 70,5±0,2 до 73,1±0,5 мН/м, а углы наклона тензиограмм в области 100 с - от 0,5±0,1 до 1,6±0,3 мН∙м-1с1/2.
В случае смесей липаза : ПГ показательным является лишь значение поверхностного натяжения при длинных временах существования поверхности - σ4.
При избытке ПГ в смеси (соотношения липаза : ПГ 1:100 и 1:10) σ4 близко к поверхностному натяжению поверхностно неактивной полиглутаминовой кислоты. При молярном соотношении липаза : ПГ 1:1 наблюдается резкое падение ДПН на 13 мН/м, свидетельствующее об образовании поверхностно активных комплексов липазы и ПГ. При дальнейшем увеличении относительной концентрации липазы в 10 и 100 раз (соотношения 10:1 и 100:1) ДПН изменяется в пределах ошибки измерения. Однако добавление даже незначительного количества ПГ (соотношение 100:1) увеличивает ДПН раствора чистой липазы на 13 мН/м.
Таким образом, установлено, что одноименно заряженные при нейтральном значении рН липаза и полиглутаминовая кислота образуют комплексы (возможно, за счет водородных связей и гидрофобных взаимодействий), стремящиеся на границу раздела фаз, что подтверждается снижением σ4 на 13,4 мН/м при увеличении содержания липазы в системах от 1:100 до 100:1.
1.4.4 Измерение ДПН растворов липазы из поджелудочной железы свиньи в смеси с поли-L-лизином
В качестве положительно заряженного полиэлектролита был выбран модельный полипептид – поли-L-лизин. ДПН раствора липазы из поджелудочной железы свиньи было измерено в присутствии поли-L-лизина (ПЛ) при молярных соотношениях липаза : ПЛ 1:100, 1:10, 1:1, 10:1, 100:1.
Из полученных тензиограмм были рассчитаны показатели динамического поверхностного натяжения.
При коротких временах существования поверхности 0,01 и 0,1 с ПН растворов ПЛ и смесей липаза : ПЛ в различных соотношениях близко к ПН воды и незначительно изменяется от 75,4±0,1 до 77,1±0,2 мН/м (эти значения соответствуют ПН воды при данных временах существования поверхности, полученному на приборе BPA-1P). Угол наклона начального участка тензиограмм отличается незначительно.
Полилизин является поверхностно неактивным соединением, его ПН соответствует динамическому поверхностному натяжению воды, и лишь незначительно ниже при длинных временах существования поверхности. При длинных временах существования поверхности σ4 раствора поверхностно активной липазы меньше, чем ПН раствора ПЛ на 26 мН/м.
При временах жизни 1 и 100 с различия в σ2 и σ3 смесей липаза : ПЛ еще не видны. ПН изменяется от 69,6±0,2 до 72,3±0,5 мН/м.
В случае смесей липаза : ПЛ показательным является лишь значение поверхностного натяжения при длинных временах существования поверхности - σ4. При высоких относительных концентрациях ПЛ (соотношения липаза : ПЛ 1:100 и 1:10) σ4 близко к поверхностному натяжению поверхностно неактивного полилизина.
При молярном соотношении липаза : ПЛ 1:1 наблюдается резкое падение поверхностного натяжения на 18 мН/м, что говорит об образовании комплекса между отрицательно заряженной липазой и положительно заряженным полилизином за счет электростатических взаимодействий. При дальнейшем увеличении относительной концентрации липазы в 100 раз (соотношение 100:1) ПН снижается еще на 4,5 мН/м до 46,1±1,1 мН/м, что однако на 4 мН/м больше ПН индивидуального раствора липазы.
Таким образом, общее снижение σ4 при увеличении содержания фермента от 1:100 до 100:1 для системы липазы с поли-L-лизином составило 22,5 мН/м.
1.4.5 Измерение ДПН растворов липазы из поджелудочной железы свиньи в трехкомпонентном комплексе с поли-L-лизином и поли-L-глутаминовой кислотой
ДПН раствора липазы из поджелудочной железы свиньи было измерено в трехкомпонентном комплексе с двумя разнозаряженными полиэлектролитами полилизином и полиглутаминовой кислотой. Соотношение липаза : полиглутаминовая кислота было равно во всех случаях 1:1, отношение двух полиэлектролитов варьировалось от 0,3 до 1,0. При всех изученных соотношениях эти комплексы понижали поверхностное натяжение растворителя.
Таким образом, при временах существования поверхности от 0,01 до 100 с ДПН снижается незначительно на 4-6 мН/м. При длинных временах поверхностное натяжение падает еще на 16-20 мН/м. Однако, вероятно, вследствие сложных взаимодействий в изученной трехкомпонентной системе концентрационных зависимостей выявлено не было: параметр σ4 при всех соотношениях ПЛ/ПГ лежит в пределах ошибки измерения, но достоверно выше σ4, полученного для чистого раствора липазы (42,9±1,2 мН/м).
Таким образом, можно сделать следующие выводы:
- Получены и исследованы двух- и трёхкомпонентные комплексы липазы с природными полимерами: БСА, полилизином и полиглутаминовой кислотой.
2. Показано, что природный полимер – бычий сывороточный альбумин может как увеличивать (в случае липазы из Pseudomonas fluorescens на 14-47 %), так и уменьшать (в случае липазы из Mucor javanicus на 4-28 %) относительную активность фермента в зависимости от типа липаз. Впервые показано влияние природы полимера при его взаимодействии с липазой на параметры динамической тензиометрии, характеризующие скорость адсорбции данных комплексов на поверхность раздела фаз. Величина изменения динамического поверхностного натяжения σ4 для систем панкреатической липазы с полимерами с увеличением относительного содержания фермента от 1:100 до 100:1 уменьшается в ряду: поли-L-лизин > поли-L-глутаминовая кислота > бычий сывороточный альбумин.
- Полученные результаты могут быть использованы при изучении механизмов основных биохимических процессов в организме животных, преподавании биохимии студентам биологических специальностей.
- Разработанные методики могут применяться в биомедицинской диагностике.
1.5 Разработка способа получения полимерного антистатического средства и изучение его коллоидно-химических свойств
Отв. исполнитель: доцент, к.х.н. И.Н. Староверова.
Получение новых полимерных материалов, с помощью которых текстильные материалы могли бы долго сохранять антистатические и антибактериальные свойства, представляют большой научно-практический интерес. Среди известных полимеров N,N’-диметил-N,N’-диаллиламионий хлорид обладает антибактериальными и антисептическими свойствами. Однако этот полимер обладает низкой термической стабильностью и не- влагостоек.
Цель настоящей работы заключалась в создании сополимеров N,N’-диметил-N,N’-диаллиламионий хлорида (ДМДААХ) и метилметакрилата (ММА), которые отличались бы большой адгезивной способностью к текстильным материалам и образовывали пленкообразные покрытия с более высокими антистатическими и термическими свойствами.
Полимеры N, N-диметил-N,N-диаллиламмоний хлорида получили широкое применение в текстильной промышленности при производстве антибактериального акрилового волокна, в качестве фиксирующего агента при окраске волокна [119]. Антибактериальную и антистатическую обработку, как правило, проводят на заключительных отделочных этапах. Однако длительная эксплуатация, стирка, температурная обработка текстильных материалов приводят к потере этих свойств, имеющих важное гигиеническое значение [121]. Поэтому получение новых полимерных материалов, с помощью которых текстильные материалы могли бы длительно сохранять антистатические и антибактериальные свойства, представляет большой интерес.
В качестве таких новых материалов были выбраны сополимеры N, N-диметил-N,N-диаллиламмоний хлорида (ДМДААХ) и метилметакрилата (ММА) в виде устойчивых в водной среде дисперсий; исследованы термические и термоокислительные свойства новых сополимеров и антистатические свойства обработанных ими материалов.
Сополимеры N,N-диметил-N,N-диаллиламмоний хлорида и метилметакрилата получали радикальной полимеризацией, используя мономеры N,N-диметил-N,N-диаллиламмоний хлорида (ДМДААХ), метиловый эфир метакриловой кислоты (ММА) и инициатор – персульфат аммония (ПСА). Реакцию проводили в запаянной ампуле в среде аргона, в качестве растворителя был взят диметилсульфоксид. Были приготовлены сополимеры с разными соотношениями сомономеров ММА и ДМДААХ (МАА:ДМДААХ от 0,5:1 до 3:1).
Таблица 8 – Условия радикальной сополимеризации ДМДААХ и ММА
| Образец, соотн. ММА: ДМДААХ | ММА, г | ДМДААХ, г | ДМСО, г | (ДМДААХ и ММА):ПСА** | Выход продукта реакции, % |
| СП-6● (0,5:1) | 0,6 | 1,97 | 6,6 | 500 | 20,9 |
| СП-7● (1:1) | 1,2 | 1,97 | 6,6 | 500 | 24,6 |
| СП-3● (1,5:1) | 6,0 | 6,5 | 27,5 | 500 | 25,0 |
| СП-4* (1:1) | 2,8 | 4,6 | 16,5 | 1500 | 42,0 |
| СП-5* (1,5:1) | 4,4 | 4,6 | 16,5 | 1000 | 33,2 |
● – t=60 0C; * - t=45 0C; ** соотношение суммарного количества сомономеров к количеству инициатора.
Состав полученных сополимеров изучали методом ЯМР спектроскопии. Антистатические свойства полученных сополимеров оценивали по результатам кинетики разряда. Величину напряженности электростатического поля определяли прибором ИЭЗ-П [120]. Термические и термоокислительные свойства исследовали термогравиметрическим методом. Все эксперименты проводили на приборе Perkin-Elmer TGA-7, при скорости нагревания 10 °С/мин и скорости потока газа (воздуха или аргона) 30-40 мл/мин.
Состав и строение полученных сополимеров исследовали при помощи спектров 1Н ЯМР (d6 ДМСО, 400 МГц). Установлено, что при радикальной сополимеризации образуются сополимеры ММА и ДМДААХ, в которых присутствуют звенья ДМДААХ циклического (тип I) и ациклического (тип II) строения, а также звенья ММА. Звенья ДМДААХ (тип I) получаются при внутримолекулярной циклизации мономера ДМДААХ, протекающей с раскрытием обеих аллильных групп. Звенья ациклического строения (II) получаются при полимеризации ДМДААХ с раскрытием одной аллильной группы и, следовательно, содержат непрореагировавшую аллильную группу.
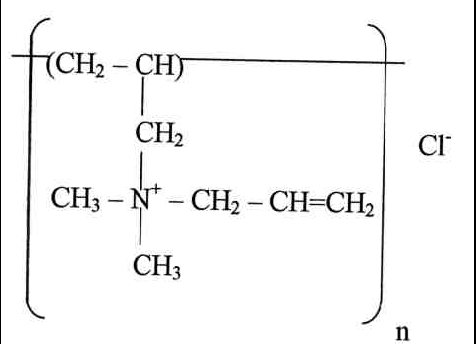 | 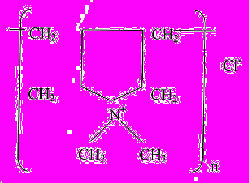 |
| (I) | (II) |
Для изучения антистатических свойств сополимеров были взяты ковровые изделия (100 % полиамид) "Carpetline Deister" фирмы Teppich (Германия). Для пропитки образцов размером 250х250 мм растворами полученных сополимеров их помещали в ванночку с плотной крышкой и держали в течение 30 минут в 1%-ном растворе сополимера ММА и ДМДААХ. Масса сополимера составляла 1 % от массы образца. После того как образец полностью вбирал в себя раствор, его высушивали при комнатной температуре до постоянного веса. Образцы коврового покрытия до и после пропитки растворами сополимеров исследовали на электризуемость. Для этого их заряжали по методике [121] зарядами статического электричества при напряжении 18,2 кВ на металлическом электроде, имеющем одинаковый размер с образцами тканей, и проводили исследование кинетики разряда. Величина напряженности электростатического поля уменьшается со временем согласно уравнению:
E=E0·e-t/τ, или lg(Еt /Еo )=-0,434 t/τ, ( )
где E – напряженность электростатического поля на поверхности ткани или коврового покрытия в данный момент времени; E0 – напряженность электростатического поля при t=0; τ – постоянная утечки заряда.
Из данных, приведенных на рисунках 28 и 29, следует, что продукты сополимеризации обладают разными антистатическими эффектами в зависимости от соотношения взятых сомономеров ММА и ДМДААХ. Наилучшими антистатическими свойствами обладали образцы, полученные с меньшим количеством инициатора (СП-4 и СП-5). В частности, стекание заряда с ковровых покрытий, обработанных этими образцами, происходило быстрее, чем c остальных. Для СП-6 (получен с большим количеством инициатора и с соотношением сомономеров ММА: ДМДААХ, взятом как 0,5:1), антистатические свойства были хуже.
При еще больших количествах изначально взятого ММА (СП-7 и СП-3) утечка заряда с пропитанных ковровых покрытий шла еще медленнее. Следовательно, антистатические свойства полученных сополимеров зависели от их состава и строения макромолекул. Сополимеры ММА и ДМДААХ, в макромолекулах которых преобладали звенья ДМДААХ циклического строения (тип I) обладали большим антистатическим эффектом. Преобладание звеньев ММА или ациклической формы ДМДААХ (тип II) в сополимерах приводило к снижению их антистатических свойств. Таким образом, варьируя соотношениями сомономеров и сомономеров и инициатора можно регулировать антистатические свойства сополимеров ММА и ДМДААХ.
Термическая и термоокислительная устойчивость сильно различались у продуктов сополимеризации ММА и ДМДААХ в зависимости от соотношения изначально взятых сомономеров. В таблице 8 приведены результаты разложения полученных сополимеров в атмосфере воздуха.
Из таблицы 8 следует, что наибольшая термоокислительная устойчивость наблюдается у образцов, полученных из сомономеров ММА:ДМДААХ, взятых в пределах 1:1-1,5:1.
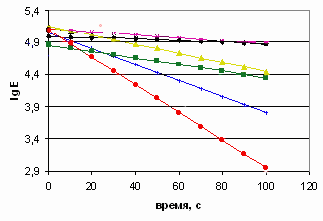 | 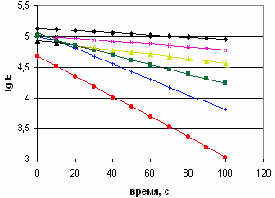 |
| Рисунок 28 – Линейные уравнения кинетики разряда (отрицптельный заряд)  | Рисунок 29 – Линейные уравнения кинетики разряда (положительный заряд)  |
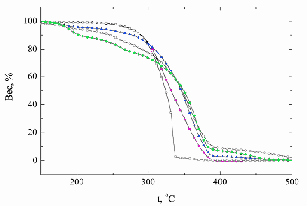 | 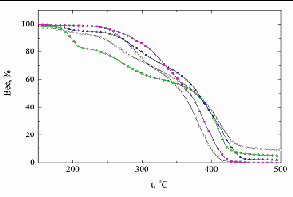 |
| Рисунок. 30 - Термогравиметрические кривые потери массы на воздухе у образцов сополимеров при соотношении ММА : ДМДААХ: | Рисунок 31 - Термогравиметрические кривые потери массы в среде аргона у образцов сополимеров при соотношении ММА : ДМДААХ: |
 | |
Таблица 9 - Термоокислительная деструкция сополимеров
| Температура деструкции (t °С) и потеря массы (Δm, %) сополимеров с разным исходным соотношением ММА:ДМДААХ | |||||||||
| 0,5:1 | 1:1 | 1,5:1 | 2:1 | 3:1 | |||||
| t°С | Δm, % | t°С | Δm, % | t°С | Δm, % | t°С | Δm, % | t°С | Δm, % |
| 191,2* | 5 | 300 | 16 | 300 | 18 | 183,8* | 4 | 185,1* | 5 |
| 257,9* | 21 | 319,5* | 36 | 330,3* | 68 | 355,4* | 63 | 358,0* | 66 |
| 365,4* | 72 | 350 | 74 | 350 | 95 | 380 | 97 | 380 | 94 |
| 450 | 97 | 380 | 98 | 375 | 100 | | | | |
*термоокислительная деструкция, сопровождающаяся значительной потерей массы при указанной температуре, выраженная в виде пика на термограмме.
Из таблицы 9 следует, что те же самые образцы сополимеров (т.е. исходные соотношения сомономеров ММА и ДМДААХ взяты в пределах 1:1 – 1,5:1) также самые термостабильные. При увеличении количества ММА в исходной смеси сомономеров термическая и термоокислительная стабильность сополимеров понижались, и образцы начинали терять массу в аргоне и на воздухе уже при температуре 150 °С. Потеря массы при 250 °С составляла от 7 % до 12 % - на воздухе и от 6 % до 11 % - в аргоне, соответственно для образцов с соотношениями ММА:ДМДААХ 2:1 и 3:1.
Причем самая большая потеря массы наблюдалась у образца с большим количеством ММА. Деструкция этих образцов на воздухе и в аргоне протекала похожим образом. В результате термической деструкции этих образцов количество кокса получалось больше, чем в остальных случаях.
Таблица 10 - Термическая деструкция сополимеров
| Температура деструкции (t°С) и потеря массы (Δm, %) сополимеров с разным исходным соотношением ММА:ДМДААХ | ||||||||||
| 0,5:1 | 1:1 | 1,5:1 | 2:1 | 3:1 | ||||||
| t °С | Δm, % | t °С | Δm, % | t °С | Δm, % | t °С | Δm, % | t °С | Δm, % | |
| 199,0* | 14 | 291,7* | 14 | 330,0* | 32 | 188,8* | 4 | 188,8* | 5 | |
| 271,4* | 27 | 381,9* | 64 | 386,4* | 74 | 290,2* | 19 | 264,4* | 17 | |
| 410,5* | 76 | 420 | 100 | 420 | 99 | 414,1* | 82 | 414,2* | 67 | |
| 450 | 95 | | | | | 440 | 91 | 450 | 91 | |
*термическая деструкция, сопровождающая значительной потерей массы при указанной температуре, выраженная в виде пика на термограмме.
При наименьшем количестве введенного сомономера ММА (ММА:ДМДААХ = 0,5:1) характер деструкции образца отличался. Термическая деструкция начиналась уже при температуре 150 °С. При нагревании образца до 250 °С потеря массы составляла 22 % в аргоне, и 17 % - на воздухе.
Из данных таблицы 8 и 9 следует, что продукты сополимеризации ММА и ДМДААХ деструктировали многостадийно.
На рисунках 30 и 31 приведены термогравиметрические кривые деструкции образцов в среде воздуха и аргона.
Особенностью термоокислительной деструкции для всех исследованных образцов в интервале температур 250-350 °С являлось образование продуктов окисления перекисного типа. Из-за этого наблюдался прирост массы на термогравиметрических кривых (рисунки 30 и 31). Образование перекисей было связано, вероятно, с окислением аллильных групп в макромолекулах сополимера ДМДААХ и ММА [121]. Образование перекисей по двойным связям =СН2 – групп происходило на фоне термической деструкции других участков макромолекул. Таким образом, в температурном диапазоне 250-350 °С наблюдались два параллельных процесса: (1) образование перекисей и (2) термоокислительная деструкция. В ходе процесса (1) наблюдался некоторый прирост массы, тогда как деструкция (2), приводила к потере массы (рис. 30 и 31). При этом потери массы, как в среде воздуха, так и в аргоне происходили приблизительно с одинаковыми скоростями. Образование перекисных или гидроперекисных фрагментов при нагревании образцов на воздухе подтверждалось также тем, что участок термограммы, отражавший несколько возросшую термостабильность образцов, завершался участком термогравиметрической кривой, характерной для стадии их катастрофической деструкции, что свойственно для перекисей или гидроперекисей, которые способны катализировать "лавинообразные" цепные процессы при деструкции.
Таким образом, в зависимости от соотношений сомономеров ММА и ДМДААХ и сомономеров и инициатора получались сополимеры, макромолекулы которых имели разное строение и состав. При количественном соотношении сомономеров и инициатора (ММА и ДМДААХ):ПСА=500:1 и соотношении ММА:ДМДААХ, взятом как 0,5:1, в макромолекуле присутствовали в основном звенья ациклического ДМДААХ и звенья ММА. При большем количестве взятого сомономера ММА (ММА:ДМДААХ=1:1) получался сополимер, состоявший в основном из макромолекул с метилметакрилатными звеньями. При меньшем количестве инициатора (СП-4*) образовывался сополимер, макромолекулы которого в основном состояли из звеньев циклического ДМДААХ и звеньев ММА.
Антистатическими свойствами обладали в большей степени сополимеры ДМДААХ и ММА, в макромолекулах которых присутствовали звенья ДМДААХ циклического строения и ММА, и в меньшей степени – сополимеры, в макромолекулах которых присутствовали в основном, либо звенья ациклического ДМДААХ, либо звенья ММА.
Таким образом, варьируя соотношением исходных сомономеров можно регулировать термическую и термоокислительную стабильность получаемых продуктов сополимеризации. Большей термической стабильностью и термоокислительной устойчивостью обладали продукты сополимеризации сомономеров ММА:ДМДААХ, взятые в соотношении 1:1 – 1,5:1.
1.6. Анализ и обобщение полученных на 1 этапе результатов НИР
Отв. исполнители: зав. кафедрой ФГОУ ВПО МГАВМиБ, проф. д.х.н, д.б.н. С.Ю. Зайцев; проф. д.х.н. М.С. Царькова.
В результате работы на первом этапе выполнения проекта детально проанализирована научная, техническая и патентная информация, относящаяся к ферментным коллоидным системам (ФКС) и другим запланированным исследованиям. Показана актуальность, научная и практическая значимость предлагаемых в работе подходов. Особенностью работ первого этапа была серьезная проработка имеющейся в современной базе данных литературы как в целом по ферментным коллоидным системам, так и по отдельным перспективным направлениям, включающим наноразмерные системы для иммобилизации ферментов и их доставки в органы и ткани; комплексные патентные исследования в указанной области поиска; необходимость применения как научно-аналитических, так и экспериментальных работ по новым направлениям.
В результате экспериментов были оптимизированы методы определения активности липаз из различных источников, в том числе их комплексов с белками и пептидами. Показано, что природный полимер – бычий сывороточный альбумин может как увеличивать (на 14-47 % в случае липазы из бактерий Pseudomonas fluorescens), так и уменьшать (на 4-28 % в случае липазы из гриба Mucor javanicus) относительную активность фермента в зависимости от типа липаз. В случае липазы из поджелудочной железы свиньи (Hog pancreas) наибольшие изменения относительной активности фермента наблюдались в комплексах с синтетическими полипептидами. Разработаны оригинальные подходы к созданию супрамолекулярных комплексов ферментов (типа липаз) с белками и пептидами, изучению их активности и возможности повышения их активности в зависимости от условий существования (температура и pH) и их окружения, а также соотношения между ферментом и другим компонентом супрамолекулярного комплекса.
В результате исследований разработан способ получения полимерного антистатического средства на основе сополимеров N,N-диметил-N,N-диаллиламмонийхлорида и метилметакрилата, исследованы их термические, термоокислительные свойства и антистатические свойства обработанных ими материалов.
Все проведенные исследования и полученные результаты полностью соответствуют уровню, существующему в мировой науке на данном этапе, что подтверждается публикациями в ведущих научных журналах.
Области возможного применения полученных результатов достаточно широкие и включают ряд областей коллоидной химии и биохимии, зоотехнии и ветеринарии. Результаты НИР предполагается использовать для решения актуальных фундаментальных и прикладных проблем химии и биологии, медицины и экологии, нано- и биотехнологии. Они перспективны для использования в современной системе подготовки высококвалифицированных специалистов по ветеринарно-биологическим и зоотехническим направлениям.
Результаты НИР включены в образовательную программу ФГОУ ВПО МГАВМиБ для магистров и аспирантов и используются в образовательном процессе на базе научного кадрового потенциала, лабораторного оборудования ФГОУ ВПО МГАВМиБ и докладывались на научно-практической конференции и учебно-методических совещаниях в ФГОУ ВПО МГАВМиБ и других.
Полученные результаты окажут положительное влияние на подготовку и закрепление в сфере науки и образования научных и научно-педагогических кадров, достижение или превышение заданных индикаторов и показателей.
При выполнении работ по первому этапу в полном объеме достигнуты результаты, предусмотренные ТЗ.
Список использованных источников
- Березин, И.В. Иммобилизованные ферменты. Современное состояние и перспективы. Т. 1-2, / И.В.Березин, В.К. Антонов, К. Мартинек; под ред. И.О. Березина. - М.: Изд-во МГУ, 1976. – 360 с.
- Bramson, J. Enabling topical immunization via microporation: a novel method for pain-free and needle-free delivery of adenovirus-based vaccines. / J. Bramson, K. Dayball, K. Evelegh, Y.H. Wan, D. Page, A. Smith // Gene Ther. 10. - 2003. P. 251–260.
- Cans, A.S. Artificial cells: unique insights into exocytosis using liposomes and lipid nanotubes/ A.S. Cans, N. Wittenberg, R. Karlsson, L. Sombers, M. Karlsson, O. Orwar et al. // Proc. Natl. Acad. Sci. U.S.A. 100. - 2003. P.400–404.
- Djalali, R. Doughnut-shaped peptide nanoassemblies and their applications as nanoreactors/ R. Djalali, J. Samson, H. Matsui // J. Am. Chem. - 2004. - Soc. 126. P.7935–7939.
- Niemeyer, C.M. Semi-synthetic nucleic acid-protein conjugates: applications in life sciences and nanobiotechnology. / C.M. Niemeyer // J. Biotechnol. - 2001. – V. 82. P. 47–66.
- Мoghimi, S.M. Stealth liposomes and long circulation nanoparticles: critical issues in pharmacokinetics, opsonization and protein-binding properties. / S.M. Moghimi, J. Szebeni // Prog. Lipid. -2003. - Res. 42. P.463–478.
- Yang, H. Dendrimers for pharmaceutical and biomedical applications. / H. Yang, W.J. Kao // J. Biomater. – 2006. - Sci. Polymer 17. P. 3–19.
- Gupta, U. A review of in vitro–in vivo investigations on dendrimers: the novel nanoscopic drug carriers / U. Gupta, H.B. Agashe, A. Asthana, N.K. Jain // Nanomedicine. – 2006. – V. 2. P.66–73.
- Shi Kam, N.W. Nanotube molecular transporters: internalization of carbon nanotube-protein conjugates into mammalian cells. / N.W. Shi Kam, T.C. Jessop, P.A. Wender, H. Dai // J. Am. Chem. – 2004. - Soc. 126. P. 6850–6851.
- Choi, J.H. Multimodal biomedical imaging with asymmetric single-walled carbon nanotube/iron oxide nanoparticle complexes. / J.H. Choi, F.T. Nguyen, P.W. Barone, D.A. Heller, A.E. Moll, D. Patel, S.A. Boppart, M.S. Strano // Nano Lett. – 2007. – V. 7. P. 861–867.
- Trzaskowski, В. Molecular dynamics studies of protein-fragment models encapsulated into carbon nanotubes. / В. Trzaskowski, A.F. Jalbout, L. Adamowicz // Chem. Phys. - 2007. - Lett. 430. P. 97–100.
- Cui, D. Encapsulation of pt-labelled DNA molecules inside carbon nanotubes. / D. Cui, C.S. Ozkan, S. Ravindran, Y. Kong, H. Gao // Mech. Chem. Biosyst. – 2004. – V. 1. P. 113–121.
- Hughes, G.A. Nanostructure-mediated drug delivery. / G.A. Hughes // Nanomedicine. – 2005. – V. 1. P. 22–30.
- Мецлер, Д. Биохимия. Химические реакции в живой клетке. Под. ред. акад. А.Е. Браунштейна. / Д. Мецлер // М.: Мир.,1980. - Т. 1. - 395 с.
- Овчинников Ю.А. Биоорганическая химия / Ю.А. Овчинников // М.: Просвещение, 1987. - 815 с.
- Уайт, А. Основы биохимии. / Уайт А., Хендлер Ф., Смит Э., Хилл Р., Леман И. // Под ред. Ю.А. Овчинникова. М.:Мир, 1985.- Т.1. - 534 с.
- Лен, Ж.-М. Супрамолекулярная химия: Концепции и перспективы / Лен Жан-Мари // Новосибирск: Наука, 1998. - 334 с.
- Friedrich, P. Supramolecular enzyme organization. Quaternary structure and beyond / Friedrich P. // Akademiai Kiado, Budapest. – 1984. Р. 3
- Афонский, С. И. Новое в учении о биокомплексах и их роли в жизненном процессе / Афонский С. И. // Биокомплексы и их значение в обмене веществ - М.: Наука, 1966. С. 3-29.
- Алиев, А.А. Обмен веществ у жвачных животных. / А.А. Алиев // М.: НИЦ «Инженер», 1997.- 419 с.
- Алиев, А.А. Оперативные методы исследований с.-х. животных. / А.А. Алиев // Л.: Наука, 1974.- 362 с.
- Алиев, А.А. Липидный обмен и продуктивность жвачных животных. / А.А. Алиев // М.: Колос, 1980.- 382 с.
- Бергельсон, Л.Д. Препаративная биохимия липидов./ Л.Д. Бергельсон, Э.В. Дятловицкая, Ю. Г.Молотковский, С.Г. Батраков, Л.И. Барсуков, Н.В. Проказова // М.: Наука, 1981. - 256 с.
- Брокерхоф, X. Липолитические ферменты./ X. Брокерхоф, Р. Дженсен; Под ред. Акад. А.Е. Браунштейна и Е.В. Горяченковой // М.: Мир, 1978. - 396 с.
- Кейтс, М. Техника липидологии / М. Кейтс // М.: Мир, 1975.- 322 с.
- Hult, K.H. Kinetics, Molecular Modeling and Synthetic Applications with Microbial Lipases / K.H. Hult, M. Holmquist // Methods in Enzymology.- 1997.- Vol. 286. Р. 386-405.
- Honger, T. Phospholipase A2 activity and physical property of lipid-bilayer substrates /T. Honger, K. Jorgensen, D. Stokes // Methods in Enzymology.- 1997.-Vol. 286. Р.168-190.
- Клесов, А.А. Ферментативный катализ / А.А. Клесов, И.В. Березин // М: Издательство МГУ, 1980. - 264 с.
- Тривен, М. Иммобилизованные ферменты. Вводный курс и применение в биотехнологию / М. Тривен // М.: Мир, 1983. - 213 с.
- Lvov, Y. Biocolloids with Ordered Urease Multilayer Shells as Enzymatic Reactors / Y. Lvov, F. Caruso // Analytical Chemistry. - 2001. - Vol. 73. Р.4212-4217.
- Lvov, Y. Urease Encapsulation in Nano/organized Microshells / Y. Lvov, A. Antipov, H. Möhwald, G. Sukhorukov // NanoLetters. - 2001.- Vol. 1. Р.125-128.
- Lvov, Y. Nanoscale Patterning on Biologically Derived Microstructures / Y. Lvov, R. Price, A. Singh, J. Selinger, J. Schnur // Langmuir.- 2000.- Vol. 16. Р. 5932-5935.
- Lvov, Y. Direct Electrochemistry of Myoglobin and Cytochrome P450 in Alternate Layer-by-Layer Films with DNA and other Polyions / Y. Lvov, J. Schenkman, J. Rusling // J. Am Chem. Soc.-1998.- Vol. 120. Р. 4073-4080
- Lvov, Y. Assembly of Multicomponent Protein Films by Means of Electrostatic Layer-by-Layer Adsorption / Y. Lvov, I. Ichinose, T. Kunitake // J. Am Chem. Soc. - 1995.- Vol. 117. Р. 6117-6122.
- Lvov, Y. Polyion/Protein Nanostructures / Y. Lvov // Encyclopedia of Surface and Colloid Science Ed. A. Hubbard. Marcel Dekker, NY, 2002. Р. 4162-4171.
- Lvov, Y. Handbook for Surfaces and Interfaces, Volume 3: Nanostructured. Materials / Y. Lvov // Thin Film Nanofabrication by Alternate Adsorption of Polyions, Proteins and Nanoparticles, Ed: H. Nalwa, Academic Press, NY, 2001. Р. 170-189.
- Lvov, Y. Electrostatic Layer-by-Layer Assembly of Proteins and Polyions. / Y. Lvov // Protein Architecture: Interfacial Molecular Assembly and Immobilization Biotechnology, Ed: Y. Lvov and H. Möhwald, Marcel Dekker Publ., NY, 2000. Р. 125-167.
- Зезин, А. Б. Новый класс комплексных водорастворимых полиэлектролитов / А.Б. Зезин, В.А. Кабанов // Успехи хи мии. – 1982. - Т. 51. - Вып. 9. С. 1447-1483.
- Березин, К. Введение в прикладную энзимологию: Иммобилизированные ферменты, под ред. И.В. Березина, К. Мартинека. - М.: МГУ, 1982. - 383 с.
- Козлов, Л. В. Биоорганическая химия. / Л. В. Козлов. - 1980. - Т. 6. - № 8 С. 1243-1254.
- Неклюдов, А.Д. Экологические проблемы производств: учебное пособие для студентов вузов, / А.Д. Неклюдов, А.Н. Иванкин; Ч. 1. М.: МГУ, 2006. - 358 с.
- Безусов, А.Т. Иммобилизация глюкооксидазы из Aspergillus niger ATCC 166808 / А.Т. Безусов, И.Р. Беленькая, Абдулазиз Абду Яхья Аббас //Хранение и перераб. Сельхозсырья. - 2007. - № 5. С. 58-59.
- Корнеева, О.С. Технология ферментативного гидролиза сахарозы [Получение инвертного сиропа] / О.С. Корнеева, О.М. Омельченко, Т.В. Свиридова // Хранение и перераб. Сельхозсырья. - 2007.- № 4. С. 41-42.
- Маркосян, А.А. Получение фруктоолигосахаридного сиропа из сахарозы совместно с палатинозой и трегалозой / А.А. Маркосян, Л.А. Абелян, М.О. Адамян, 3.Д. Экажев, Ж.И. Акопян, В.А. Абелян // Прикладная биохимия и микробиология. – 2007. – Т. 43. - № 4. - С. 424-431.
- Sarioglu, K. The use of commercial pectinase in the fruit juice industry Pt 2. Determination of the kinetic behaviour of immobilized commercial pectinase / K. Sarioglu, N. Demir, J. Acar, M. Mutlu // J. Food Engg, 2001. - V.47. - № 4. P. 271-274.
- Carrin, M.E. Effects of pectinase immobilization during hollow fiber ultrafiltration of apple juice / M.E. Carrin; L. Ceci; J.E. Lozano // J. Food Process Engg. - 2000. - V.23. - № 4. P. 281-298.
- Demir, N. The use of commercial pectinase in fruit juice industry Pt 3. Immobilized pectinase for mash treatment / N. Demir, J. Acar, K. Sarioglu, M. Mutlu // J.Food Engg. - 2001. - V.47. - № 4. P. 275-280.
- Hotchkiss, J.H. Packaging opportunities for fruit juices / J.H. Hotchkiss // Spec.rep. - New York State agr.experiment station, 1996. - № 70. P. 25-33.
- Ковалева, Т.А. Влияние активаторов на структурно-функциональные свойства иммобилизованной инулазы / Т.А. Ковалева, С.В. Кожедуб, О.А. Кодаева, Ж.В. Шмырева // Второй междунар. симпоз. "Новые и нетрадиционные растения и перспективы их практ. использ.":Материалы докл. - Т.2. - Пущино, 1997. С. 48-50.
- Kochhar, A. Purification and immobilisation of inulinase from Aspergillus candidus for producing fructose / A. Kochhar; A.K. Gupta.; N. Kaur // J. Sc. Food Agr. - 1999. - V. 79. - № 4. P. 549-554.
- Carrin, M.E. Effects of co-immobilization of pectinase and amylase on ultrafiltration of apple juice simulate / M.E. Carrin; L.N. Ceci; J.E. Lozano // J. Food Process Engg. – 2001. - Vol.24. - N 6. P. 423-435.
- Demir, N. The use of commercial pectinase in fruit juice industry. Immobilized pectinase for mash treatment / N. Demir, J. Acar, K. Sarioglu, M. Mutlu // J. Food Engg. – 2001. - Vol. 47. - N 4. P. 275-280.
- Huang, S.-Н. Direct Binding and Characterization of Lipase onto Magnetic Nanoparticles / S.-Н. Huang et al. // Biotechnol. Prog. - 2003. – Vol. 19. P. 1095–1100.
- Kouassi1, G.K. Examination of Cholesterol oxidase attachment to magnetic nanoparticles/ G.K. Kouassi1 et al. // J. of Nanobiotechnology. - 2005. –Vol. 3. P.116.
- Dyal, А. Activity of Candida rugosa Lipase Immobilized on – Fe2O3 Magnetic Nanoparticles / А. Dyal et al. // J. Am. Chem. Soc. - 2003. – Vol.125 (7). P. 1684
- Коваленко, Г.А. Каталитические свойства глюкоамилазы, иммобилизованной на углеродном носителе сибуните / Коваленко Г.А., Перминова Л.В., Терентьева Т.Г., Плаксин Г.В. // Прикладная биохимия и микробиология, 2007, том 43, № 4. - С. 412-418.
- Степина, Н.Д. Белковые молекулярные наноструктуры на твердой подложке / Степина Н.Д., Гайнутдинов Р.В., Толстихина А.Л., Новикова Н.Н., Юрьева Э.А., Хрипунов А.К., Атякшева Л.Ф. // Нанобио- и другие новые и перспективные биотехнологии: Материалы четвертой международной конференции.– Пущино - С. 132-135.
- Сухоруков, Б.И. Полиэлектролитный ферментный нано- и микродиагностикум и его свойства / Б.И. Сухоруков, Е.А. Сабурова, С.А. Тихоненко, А.В. Дубровский, Л.И. Шабарчина // Нанобио- и другие новые и перспективные биотехнологии: Материалы четвертой международной конференции. – Пущино - 2007- С. 136-137.
- Шабарчина, Л.И. Технология получения полиэлектролитных нано- и микрокапсул содержащих ферменты и создание микродиагностикума / Шабарчина Л.И., Дубровский А.В., Тихоненко С.А., Сабурова Е.А., Сухоруков Б.И. // Нанобио- и другие новые и перспективные биотехнологии: Материалы четвертой международной конференции. – Пущино - 2007- С. 156-158.
- Сухоруков, Б.И. Инкапсулирование белков в полиэлектролитные нано- и микрокапсулы и проблемы разработки ферментного микродиагностикума / Б.И. Сухоруков, С.А. Тихоненко, Е.А. Сабурова, А.В. Дубровский, Ю.Н. Дыбовская, Л.И. Шабарчина // Биофизика. – 2007. - Т. 52. - № 6. – С. 1041-1048.
- Келети, Т. Основы ферментативной кинетики: Пер. с англ. / Т. Келети — М.: Мир, 1990. — 350 с.
- Пимоненко, Н.Ю. Целесообразность, особенность и перспективы сочетанного применения цитаминов и энтеросорбентов / Н.Ю. Пимоненко, С.А. Олейник, В.Е. Шевченко и др. // Фітотерапія в Україні. - 2001. — № 3. С. 20—25.
- Тезисы докладов 3-й украинской конференции «Новые средства и сферы применения сорбционной детоксикации организма»— Днепропетровск, 1995.
- Фершт, Э. Структура и механизм действия ферментов: Пер. с англ. / Э. Фершт — М.: Мир, 1980. — 432 с.
- Аванесян, С.С. Изучение направленного синтеза энтеросорбентов / С.С. Аванесян, О.В. Воробьева, С.М. Кунижев, А.А. Филь // Материалы четвертого съезда биотехнологов России им. Овчинникова – М.: МАКС Пресс, 2006.-321 с.
- Анисенко, О.В. Сорбенты для медицинской биотехнологии / О.В. Анисенко, О.В. Воробьева, А.А. Филь // Ж. Наука Москвы и регионов.- №1 - 2004. С. 71.
- Анисенко, О.В. Сорбенты для медицинской биотехнологии / О.В. Анисенко, О.В. Воробьева, С.М. Кунижев, А.А. Филь // Наука Москвы и регионов. – 2004. - №1 С. 72.
- Анисенко О.В. Biosorbents for reception of biocatalysts of medical purpose// Industrial Application Of Biotechnology/ Анисенко О.В., Воробьева О.В., Кунижев С.М., Филь А.А. // Nova Science Publishers Inc., New York. 2006. - P.91-95.
- Филь, А.А. Исследование процессов иммобилизации компонентов - метаболитов кишечного тракта на твердых носителях: Автореф. дисс. … канд. биол. наук: - Ставрополь,СГУ, 2006. 24 с.
- Аванесян, С.С. Разработка биотехнологии получения антидота / С.С. Аванесян, О.В. Воробьева, С.М. Кунижев, А.А. Филь // Российская школа-конференция молодых ученых "Экотоксикология: Современные биоаналитические системы, методы и технологии". – Пущино, 2006.- 154 с.
- Аванесян, С.С. Микрокапсулированный фермент β–галактозидаза. / С.С. Аванесян, О.В. Воробьева, Э.Н. Пшеничная, А.А. Филь // Биотехнология. Вода и пищевые продукты. – М., ЗАО "ПИК "Максима"",2008.- С. 295.
- Аванесян, С.С. Биодеградируемые материалы на основе полисахаридов и белковых компонентов. / С.С. Аванесян, С.Ф. Андрусенко, Е.В. Волосова, О.В. Воробьева, А.А. Каданова, А.А. Филь // Перспективные разработки науки и техники - Przemysl, Nauka I studia, 2008.-V.11.-P.42-46
- Аванесян, С.С. Иммобилизация β-гиалуронидазы методом включения в биоразлагаемые полимерные пленки. / С.С. Аванесян, Е.В. Волосова, О.В. Воробьева, А.А. Каданова, М.С. Ростова, А.А. Филь. // 5 съезд общества биотехнологов России им. Ю.А. Овчинникова – М., ИАЦ, 2008.- С.187-188.
- Андрусенко, С.Ф. Биодеградируемые полимерные материалы / С.Ф. Андрусенко, В.А. Баркова, А.А. Каданова, А.А. Филь // III ежегодная научная конференция студентов и аспирнатов базовых кафедр Южного научного центра РАН - Ростов-на-Дону:Изд-во ЮНЦ РАН,2007. С. 21-22
- Воробьева, О.В. Biotechnology for reception of antidotes / О.В. Воробьева, А.А. Филь // Biotechnology for reception of antidotes. - New York, 2007. Р. 180.
- Аванесян, С.С. Гиалуронидазные биоразлагаемые полимерные материалы. / С.С.Аванесян, Е.В. Волосова, О.В.Воробьева, А.М. Иванова, А.А. Филь // V - ежегодная научная конференция студентов и аспирантов базовых кафедр Южного научного центра РАН. - Ростов-на-Дону.: Изд-во ЮНЦ РАН, 2009. - С. 11-15.
- Dajani, A.S. Prevention of bacterial endocarditis. / A.S. Dajani, K.A. Taubert, W. Wilson, A.F. Bolger et al. //Recommendation by the Amerucan Heart Assotiation , Circulation. – 1997. - № 96. P.358-366.
- Cukingnan, R.A. Early valve replacement in active infective endocarditis. Results and late survival. / R.A. Cukingnan, J.S. Carey, J.H. Witting, J. Thorac // Cardiovasc. - Surg. - 1983. - Vol. 85. N 2. P. 163-173.
- Фадеева, Т.В. Закономерности микробной контаминации при гнойном перитоните и механизмы эффективности регионарного протеолиза иммобилизованными протеиназами: Автореф. дис. … канд. мед. наук./ Т.В.Фадеева // ГУ ВПО Российская государственная медицинская академия Росздрава.: Иркутск, 1998. - 23 с.
- Желтовский, Ю.В. Применение иммобилизованных протеолитических ферментов в хирургическом лечении инфекционного эндокардита. / Ю.В.Желтовский, Е.В.Пешков, В.А. Подкаменный // Научно-медицинский вестник Центрального Черноземья. – Иркутск. – 2007. - № 30. С.101-102.
- Салганик, Р.И. Иммобилизованные протеолитические ферменты и раневой процесс: Учебник / Р.И.Салганик, А.С.Коган, А.М. Гончар– Новосибирск: Наука, 1983. – 266 с.
- Троицкий, А.В. Разработка способа получения лекарственных препаратов на основе иммобилизованных протеаз Bac. Subtilis.: Дис. … канд. мед. наук./ А.В. Троицкий - Новосибирск, 1998. - 109 с.
- Григорьев, Е.Г. Хирургия тяжёлых гнойных процессов: Учебник / Е.Г.Григорьев, А.С. Коган – Новосибирск: Наука, 2000. – 314 с.
- Аброкова, М.Ф. Лечение глубокого кариеса и инициального пульпита с применением иммобилизированных ферментов: Автореф дисс. ….. канд.мед.наук.:14.00.21. / М.Ф. Аброкова; ЦНИИ стоматологии МЗ РФ. - М., 2004. - 22 с.
- Прошкин, В.М. Протеолитическая активность содержимого суставной полости при асептическом артрите у телок с применением иммозима. / В.М.Прошкин, Б.С.Семенов, А.В. Николаев // Актуал. пробл. вет. хирургии. – Воронеж. - 1999. С. 142-143.
- Прошкин В.М. Показатели крови у телок при асептическом артрите / В.М. Прошкин, Б.С. Семенов, А.В. Николаев // Ветеринария. – М., 2000. - N 3. С. 44-45.
- Кондырев, Л.В. Лечение коров с гнойной формой мастита / Л.В. Кондырев // Лечеб.-профилакт. мероприятия при травматизме и бесплодии с.-х. животных. - Кишинев, 1991. С. 16-19.
- Гафуров, Д.С. Заживление ран под влиянием иммобилизованного фермента профезим. / Д.С. Гафуров // Профилактика болезней с.-х. животных в Таджикистане. – Таджикистан, 1987. С. 80-84.
- Абрамян, С.А. Регуляция ферментативной активности в мелиорированных солонцах-солончаках. / С.А. Абрамян, А.Ш. Галстян // Тр. НИИ почвоведения и агрохимии. – АрмССР. – 1987. - Т. 22. С. 56-61.
- Canale-Gutierrez, L. Enzymic determination of ammonia in food by flow injection -Определение аммиака в пищевых продуктах ферментным методом. / L. Canale-Gutierrez, A. Maquieira, R. Puchades // Analyst. – Испания. – 1990. - Vol. 115. - N 9. P.1243-1246.
- Fadiloglu, S. Olive oil hydrolysis by celite-immobilized Candida rugosa lipase. / S. Fadiloglu, Z. Soylemez // J. Аgr. Food Chem. –– 1998. - Vol.46. N 9. P. 3411-3414.
- Moran, E.T. Digestion and absorption of carbohydrates in fowl and events through perinatal development. / E.T Moran // J. Nutrit. – 1985. - Т. 115. N 5. Р. 665-674.
- Brooks, R.I. Steroid hormone pathways in the pig, with special emphasis on boar odor: A review. / R.I. Brooks, A.M. Pearson // J. anim. Sc. – 1986. - Т. 62. - N 3. Р. 632-645.
- Couvreur, P. The potential advantages of nanoparticle drug delivery systems in chemotherapy of tuberculosis / P. Couvreur, G. Parratt, E. Fattal, P. Legrand, C. Vauthier
// Therapeutic Drug Carrier Systems. – 2002. - № 19. – P. 99-134.
- Markvicheva, E. Bioencapsulated peptides, proteins, animal cells: preparation and applications in biomedical fields. / E. Markvicheva, Ch. Grandfils, L. Bezdetnaya, J-L. Goergen, A. Bartkowiak, F. Guillemin, D. Poncelet // Chem. Industry. – 2004. – V.58 (6a). P. 75-78.
- Ferranti, V. Primidone-loaded poly-
 -caprolactone nanocapsules: incorporation efficiency and in vitro release profiles. / V. Ferranti, H. Marchais, C. Chabenat, A.M. Orecchioni, O. Lafont // International Journal of Pharmaceutics. – 1999. – V. 193. P. 107-111.
-caprolactone nanocapsules: incorporation efficiency and in vitro release profiles. / V. Ferranti, H. Marchais, C. Chabenat, A.M. Orecchioni, O. Lafont // International Journal of Pharmaceutics. – 1999. – V. 193. P. 107-111.
- Себякин, Ю.Л. Изучение взаимосвязи структура-свойства в ряду катионных липопептидов. / Ю.Л. Себякин, У.А. Буданова // Вестник МИТХТ. – 2006. – Т. 1. № 1. С. 44-49.
- Markvicheva, E. Bioencapsulated mammalian cells, proteins, peptides: preparation and application for biomedical fields. / E. Markvicheva // European Journal of Cell Biology. – 2004. – V. 83. Suppl.54. P. 96-97.
- Дугина, Т.Н. Эффект синтетического пептида-агониста тромбинового рецептора, инкапсулированного в микрочастицы на основе сополимера молочной и гликолевой кислот, на заживление ран у мышей. / Т.Н. Дугина, E.В. Киселева, M.A. Ланге, T.В. Васильева, К. Грандфис, Е.А. Марквичева, Е.Д. Беспалова, M.E. Палькеева, С.М. Струкова // Бюлл. Экспер. Биол. Мед. – 2004. – Т. 138 (11). C. 523-527.
- Markvicheva, E. Gel-immobilized enzymes as promising biocatalysts for enantioselective hydrolysis in water/organic media. / E. Markvicheva, V. Lozinsky, F. Plieva, K. Kochetkov, L. Rumsh, V. Zubov, R. Kumar, V. Parmar, Yu. Belokon // Pure and Applied Chemistry. – 2005. – V. 77 (1). P. 227-236.
- Сташевская, К.С. Биодеградируемые микрочастицы с иммобилизованным пептидом для заживления ран. / К.С. Сташевская, Е.А. Марквичева, С.М. Струкова, А.В. Русанова, А.М. Макарова, Л.Р. Горбачева, И.А. Прудченко, В.П. Зубов, К. Грандфис // Биомедицинская химия. – 2006. – Т. 52(1). С. 83-94.
- Kuptsova, S. Proteases entrapped in hydrogels based on poly(N-vinyl caprolactam) as promising biocatalysts in water-organic systems. / S. Kuptsova, E. Markvicheva, K. Kochetkov, Yu. Belokon', L. Rumsh, V. Zubov // Biocatalysis and Biotransformations. – 2000. – V. 18. P. 133-149.
- Себякин, Ю.Л. pH-чувствительные катионные липопептиды для создания транспортных систем медицинского назначения. / Ю.Л. Себякин, У.А. Буданова // Биоорган. химия. – 2006. – Т. 32. №5. С. 453 458.
- Себякин, Ю.Л. Изучение взаимосвязи структура-свойства в ряду катионных липопептидов. / Ю.Л. Себякин, У.А. Буданова // Вестник МИТХТ. – 2006. – Т. 1. № 1. С. 44-49.
- Markvicheva, E. Encapsulated multicellular tumor spheroids a novel model to study small size tumors. / E. Markvicheva, L. Bezdetnaya, A. Bartkowiak, A. Marc, J-L. Goergen, F. Guillemin, D. Poncelet // Chem. Industry. – 2003. – V. 57 (12). P. 585-588.
- Markvicheva, E. Biodegradable microparticles loaded with thrombin receptor agonist peptide for gastric ulcer treatment in rats. / E. Markvicheva, K. Stashevskaya, S. Strukova, I. Prudchenko, A. Rusanova, A. Makarova, T. Vasilieva, J. Bespalova, Ch. Grandfils. // J. Drug Del. Sci. Tech. – 2006. – V.16(4). P. 321-325.
- Русанова, А.В. Пептид-агонист рецептора тромбина, иммобилизованный в микросферы, ускоряет репаративные процессы на модели язвы желудка у крыс. / А.В. Русанова, А.М. Макарова, С.М. Струкова, Е.А. Марквичева, Л.Р. Горбачева, К.C. Сташевская, Т.В. Васильева, E.И. Сидорова, Ж.Д. Беспалова, К. Грандфис //Бюлл. Эксп. Биол. Мед. – 2006. – Т. 142(7). С. 42-46.
- Грегориадис, Г. Липосомы в биологических системах. / Г. Грегориадис, Л. Аллисон // М.: Медицина. – 1983. – C. 256.
- Торчилин, В.П. Проблемы и перспективы использования липосом для направленного транспорта лекарств (обзор). / В.П. Торчилин, В.Н. Смирнов, Е.И. Чазов // Вопросы медицинской химии. – 1982. – Т.28. №1. С. 3-12
- Марголис, Л.Б. Липосомы и их взаимодействие с клетками. / Л.Б. Марголис, Л.Д. Бергельсон //М.: Накука. – 1986. – C. 240.
- Torchilin, V. Nanoparticulates as Drug Carriers. / V. Torchilin // World Scientific Publishing Co.: New York. – 2006. – P. 756.
- Claudio, N. Nanobiotechnology and Nanobiosciences. / N. Claudio // World Scientific Publishing Co.: New York. – 2008. – P. 380.
- Ehud, G. Plenty of Room for Biology at the Bottom. An Introduction to Bionanotechnology. / G. Ehud // World Scientific Publishing Co.: New York. - 2007. – P. 200.
- Renugopalakrishnan, V. Bionanotechnology. Proteins to Nanodevices. / V. Renugopalakrishnan, R.V. Lewis // Springer: Berlin, Heidelberg, New York. – 2006. – P. 1916.
- Niemeyer, С.М. Nanobiotechnology: Concepts, Applications and Perspectives. / С.М. Niemeyer, C.A. Mirkin // Wiley-VCH. – 2004. – P. 491.
- Bhushan, B. Springer Handbook of Nanotechnology. / B. Bhushan // Springer, Berlin, Heidelberg, New York. – 1st edition 2004, 2nd edition 2007. - P. 1916.
Lvov, Y. Protein Architecture: Interfacial Molecular Assembly and Immobilization Biotechnology. / Y. Lvov, H. Moehwald //New York: Marcel Dekker Publ. – 2004. – P. 394.
-
Русанов, А.И. Межфазная тензиометрия / А.И. Русанов, В.А. Прохоров.- Санкт-Петербург: Химия, 1994.- 400с.
Бояркина, Н.М. Пластические массы. / Н.М. Бояркина, В.В. Крючков, В.А. Кабанов – 1987. - № 8. – С. 17-19.
Староверова, И.Н. Возникновение статического электричества на различных материалах и методы его оценки: Учебное пособие / И.Н. Староверова, И.В. Кулешов, О.Ю. Оськина // М.: ФГОУ ВПО МВГАВМиБ.- 2007. – 92 с.
Староверова, И.Н. Электризация шерстяных и полушерстяных тканей и натурального меха: Учебное пособие / И.Н. Староверова, С.А. Крылова, Д.С. Лычников // М.: Рос. экон. акад.- 2006. – 104 с.
