Федеральное Государственное Учреждение Здравоохранения цмсч №165 Федерального Медико-Биологического Агентства справочное методическое пособие
| Вид материала | Методическое пособие |
- Работа выполнена в фгу «Государственный научный центр лазерной медицины» Федерального, 275.62kb.
- Утверждено, 220.09kb.
- «Научно-исследовательский институт детских инфекций Федерального медико-биологического, 263.32kb.
- Комплексный подход к диагностике и хирургическому лечению заболеваний щитовидной железы, 1223.26kb.
- «Оценка эффективности и безопасности структурно-резонансной терапии у неврологических, 1777.93kb.
- «Санкт-Петербургский институт усовершенствования врачей-экспертов Федерального медико-биологического, 361.07kb.
- Федеральное медико-биологическое агентство, 6378.43kb.
- На правах рукописи, 423.43kb.
- Государственное образовательное учреждение высшего профессионального образования московский, 1119.17kb.
- Государственное образовательное учреждение высшего профессионального образования московский, 1335.69kb.
В желудочно- кишечном тракте большое количество ферментных систем обрабатывают пищевую массу, превращая белки до олигопептидов и аминокислот, углеводы – до моно- и дисахаридов, жиры (холестерин, триглицериды, фосфолипиды) – .до моноглицеридов, жирных кислот, глицерофосфохолина. Только после расщепления до безантигенных компонентов все эти фрагменты вновь синтезируются в адекватные для организма белки, углеводы и жиры (и в энтероцитах, в печени и др.).
В желудке всасывается вода, медь, алкоголь; в 12-п. кишке и тощей кишке – гидролизат белков, жиры и углеводы, кальций, магний, железо; подвздошной – витамины, соли желчных кислот; толстой – вода, хлориды, основания, жирные кислоты.
При большой нагрузке жирами --- жир может частично всасываться неизмененным и депонироваться в таком виде только в жировой ткани.
Клетки кишечного эпителия за 3 дня успевают из складок переместиться до вершины и отторгнуться в просвет кишечника (до 250 г. энтероцитов в сутки – 25 г. белка). Период полуэлиминации белков печени составляет 10 суток.
Фенестры капилляров под базальной мембраной энтероцитов имеют размеры 45- 67 нм.
Размеры альбумина 3,2- 3.6 нм при молекулярном весе 40 кДа – 70 кДа --- и он не проходит без расщепления через стенку кишечника. Даже такой малый по размеру белок – инсулин (менее 6,0 кДа) также не проходит через кишечную стенку.
Вследствие этого безопасно применение ферментных препаратов перорально у больных различными нарушения пищеварения – независимо от генеза диспепсии:
Панкреатин (креон – кишечно растворимый; мезим форте; пангрол; панкреалипаза;
панкреаль; панкренорм; панкреон; панцитрат; трифермент; фестал N) –
ферменты поджелудочной железы (трипсин и/или химотрипсин; амилаза;
липаза).
Панкреатин + желчь + гемицеллюлаза (гидролиз клетчатки) = дигестал (панстал; энзистал).
Панкреатин + желчь + бромелаин (гликопротеиды из ананаса; 8 протеаз с оптимальной зоной
рН от 3,0 до 8,0) = меркензим.
Панкреатин + желчь + грибковая липаза = сетсол.
Панкреатин + желчь + пепсин с соляной кислотой + аминокислоты = панзинорм.
Панкреатин + гемицеллюлаза = фестал (ликреаза – кишечно растворимый).
Панкреатин + диметикон (газоадсорбирующее) = панкреофлэт.
Панкреатин + куркума (желчегонное) = панкурмен (фестизим –в оболочке).
Панкреатин + папаин (из дынного дерева) = Вобэ-Мугос-Е.
Панкреатин + папаин + бромелаин + рутозид = Вобэнзим.
Панкреатин грибкового происхождения + мальтаза = ораза.
Абомин (из сычужка телят и ягнят;при непереносимости молока).
Липаза грибковая (чернушка дамасская) = нигедаза.
Липаза грибковая ( Penicillium solitum) = солизим.
Солизим + амилаза = сомилаза.
Сомилаза +террилитин (протеолитический фермент из аспергиллия) = триаза.
Амилаза грибковая + папаин + симетикон + уголь активированный + никотинамид =
Юниэнзим.
Не вызывает сомнения факт улучшения пищеварения на фоне приема бромелаина и/или папаина, принятого в индивидуально адекватной дозе во время еды, с вторичным улучшением функционального состояния многих систем и органов.
Если смочить водой кожу (руки) и потереть вобэнзимом, то получим раневую поверхность (аналогично и опыт с химоралом – химотрипсин в таблетках)
Прием натощак вобэнзима в дозе 6-10 таблеток ведет к протеолизу микробной биопленки на внутренней поверхности кишечника и может быть средством борьбы с дисбактериозом.
Сборщики ананаса вынуждены одевать маски и длинные перчатки для профилактики “ожогов”.
При блоке вирсунгианова протока при остром панкреатите “уклонение” протеолитических ферментов кровь вызывает некроз и сепсис.
Учитывая эти факты и общебиологические законы, трудно представить, что протеолитические ферменты (например, в составе вобэнзима) могут без вреда всасываться в кишечнике и в неизмененной форме достигать именно той зоны тела (воспаление, гематома, тромбоз и т.п.), которая нужна больному для санации.
Однако, также как и в проблеме “down” – эффекта, менее 1% поступающих в ЖКТ веществ могут проникать мало измененные по структуре в общую систему гомеостаза – что важно для оптимального развития иммунитета, хотя может приводить и к аллергии.
Чрезвычайно частой и клинически важной патологией является дисбактериоз в любой зоне слизистых оболочек разных полых органов. Для его коррекции делаются попытки (как правило, неэффективные) изменения местного иммунитета: фиксирующиеся в ЖКТ биостим (гликопротеины Klebsiella pneumoniae), бронхо-ваксом (лизат 8 микробов) и бронхо-мунал (лизат несколько других 8 микробов); имудон (лиофилизированная смесь сухих 14 микробов для полости рта); рибомунил (рибосомы 4 микробов при ОРЗ); уро-ваксом (лизат разных штаммов Esherichia Coli при инфекции мочевых путей); ликопид, линекс (стрептококк, лакто- и бифидобациллы) и хилак (молочная кислота с продуктами жизнедеятельности кишечных бактерий) — при кишечном дисбактериозе. Субреум (лизат разных штаммов Esherichia Coli) — при ревматоидном артрите.
Отсутствие эффекта от попыток заселения кишечника резидентной микробной флорой, в первую очередь, зависит от того, что заселившая кишечник условнопатогенная флора взаимно поддерживает друг друга в пределах активной “биопленки”. Следовательно, сначала надо убрать неадекватную флору либо с помощью невсасывающихся антибактериальных средств при пероральном приеме (стрептомицин, гентамицин, специальная форма рифампицина и канамицина; фталазол и сульгин; эрсефурил; интетрикс; энтеросептол, мексаформ, мексаза, хлорхинальдон) или пробиотиком (в смысле пролекарством) сульфасалазином в адекватной дозе (разовой, суточной, курсовой), либо — подвергнуть микробные биопленки банальному протеолизу с помощью больших доз вобэнзима. Но и далее на хорошее приживление можно рассчитывать лишь при введении достоверно живых микробов в виде “организованной” простокваши.
Под иммунокоррекцией, как правило, подразумевают иммуностимуляцию, которая противопоказана при исходно резковыраженном иммунном конфликте — системная красная волчанка, хронический активный гепатит высокой степени активности и т. п., — а также в продроме или начале разгара органотропных вирусных инфекций (острый вирусный гепатит) и обострении латентных инфекций. Основное осложнение обусловлено прямым фармакодинамическим эффектом — активацией иммунной защиты с захватом чужеродных антигенов и их лизосом вместе с собственными клетками, пораженными вирусом (то есть развитие цитолиза). Там, где этот цитолиз индивидуально у конкретных больных реализуется, соответственно этому наблюдаются клинические синдромы. Наиболее типично это осложнение для препаратов вилочковой железы (тималин, Т-активин, тимоптин, тимактид, вилозен; дипептид — тимоген), стимулирующих функции Т-лимфоцитов. При этом цитолиз мало зависит от режима дозирования.
В меньшей степени развивается неадекватный цитолиз на фоне гексапептида иммунофана.
Мощным иммуностимулирующим свойством обладают противопаразитарные средства, из которых с 1971 года самым широким образом (за рубежом) применяется левамизол (= декарис) — на функцию Т-лимфоцитов помощников и супрессоров. Препарат применяется в максимальных дозах (150 мг через 60 часов, то есть через 2 дня на 3-й) для профилактики метастазирования злокачественных опухолей после операции и/или химиотерапии, облучения — под прикрытием метаболитов (под контролем тромбо- и лейкоцитоза) в течение года, затем доза снижается наполовину. При часторецидивирующих латентных вирусных инфекциях и поллинозе применяется в разовой дозе 50 и даже 25 мг. Причем если требуется курс более трех недель, то эта разовая доза используется два и даже один раз в неделю. В случае малых доз очень редко наблюдается цитолитический синдром.
Очень опасно использовать левамизол в острую фазу активных иммунных заболеваний и при неверифицированных клинических синдромах (например, при лихорадке и артропатии, обусловленных ОРЗ, левамизол может купировать ситуацию; но если это окажется вариант продрома острого вирусного гепатита, то высок риск развития острой дистрофии печени).
Другим серьезным осложнением является изменение соотношения фракций лейкоцитов периферической крови в пользу лимфоцитов за счет гранулоцитопении. Для профилактики и лечения (за счет адекватного увеличения суточной дозы и длительности курса) лейкоцитопении начали применяться цитокины — колониестимулирующий фактор, влияющий на уровне костного мозга (граноцит; лейкин; лейкомакс; нейпоген). Однако хороший эффект наблюдается при использовании исходных метаболитов для синтеза нуклеиновых кислот (аспаркам или сочетание метилурацила с оротатом калия; рибоксин; деринат — продукты деградации ДНК; нуклеинат натрия).
Миелопид (из культуры клеток костного мозга телят и поросят) существенно отличается от других средств, применяемых для иммунокоррекции, тем, что может использоваться и при аллергии, и при беременности, и в любую фазу заболевания, а также не только при вирусной, но и при бактериальной инфекции (обычно уровень мононуклеарно-макрофагального и нейтрофильно-гранулоцитарного иммунитета реципрокны между собой), включая туберкулез и остеомиелит. На фоне миелопида можно проводить длительные курсы декариса (левамизола).
Стимуляции Т-лимфоцитов можно добиться применением изопринозина.
Полиоксидоний. Иммуномодулирующий препарат. Повышает резистентность организма в отношении локальных и генерализованных инфекций. Основой механизма иммуномодулирующего действия является прямое воздействие на фагоцитирующие клетки и естественные киллеры, а также стимуляция антителообразования.Восстанавливает иммунные реакции при вторичных иммунодефицитных состояниях, вызванных различными инфекциями, травмами, ожогами, злокачественными новообразованиями, осложнениями после хирургических операций, применением химиотерапевтических средств, в т.ч. цитостатиков, стероидных гормонов.Наряду с иммуномодулирующим действием Полиоксидоний обладает выраженной детоксикационной активностью. Повышает устойчивость мембран клеток к цитотоксическому действию лекарственных препаратов и химических веществ, снижает их токсичность. Эти свойства препарата определяются структурой и высокомолекулярной природой препарата.
Применение Полиоксидония в составе комплексной терапии онкологических пациентов уменьшает интоксикацию на фоне химио- и лучевой терапии, позволяет проводить лечение без изменения схемы стандартной терапии в связи с развитием побочных эффектов (в т.ч. цитопения, рвота, диарея, цистит, колит).Применение Полиоксидония позволяет повысить эффективность и сократить продолжительность лечения, значительно уменьшить необходимость применения антибиотиков, бронхолитиков, ГКС, увеличить период ремиссии.Препарат не обладает митогенной, поликлональной активностью, антигенными свойствами, не оказывает аллергизирующего, мутагенного, эмбриотоксического, тератогенного и канцерогенного действия. Особенно необходим при лечении хламидиоза, уреаплазмоза и других вяло текущих инфекций, плохо корригируемых антибиотиками.
Введение экзогенных иммуноглобулинов помогает справиться с обострением латентной вирусной инфекции, хотя титр собственных антител к вирусу чаще всего достаточно высок. Этот остающийся неизученным феномен может быть объяснен с точки зрения информационно-энергетических взаимоотношений участников “химеры”: появление большой порции новых антител информирует паразитирующего агента об изменении сил в пользу “хозяина”, что и прекращает обострение заболевания.
Следует только добавить, что вводимая доза должна быть массивной (не менее 10—15 мл нормального иммуноглобулина или специального) также и потому, чтобы воспрепятствовать образованию активных комплексов с комплементом и дальнейшему развитию “болезни иммунных комплексов” на путях элиминации или по сосудистому руслу.
Кроме того, экзогенные иммуноглобулины блокируют специфические рецепторы клеток, как мигрирующих, так и различных тканей, к которым присоединяется циркулирующий в организме вирус; не допускают С3-комплемент к рецепторам макрофагов и Т-киллеров; блокируют рецепторы мембран лизосом базофилов и мастоцитов.
В тех случаях, когда титр эндогенных противовирусных антител низкий (например, при НВ-Ag-емии), введение специфического иммуноглобулина временно (приблизительно на три недели) прерывает циркуляцию антигена в системе гомеостаза. Однако имеет это не клиническое или стерилизующее значение, а скорее противоэпидемическое и, в частности, может воспрепятствовать трансплацентарной передаче вируса (при регулярном введении).
Введение цитотекта, содержащего антитела к цитомегаловирусу, также может оказать временный положительный эффект при обострении латентной инфекции.
Нередко собственные (эндогенные) иммуноглобулины имеют аффинитет не ко всем актуальным компонентам вируса и клеточным рецепторам, опосредующим прилипание вируса к мембране, что и определяет положительный эффект от введения экзогенных полноценных иммуноглобулинов (от нескольких сотен доноров — в препарате).
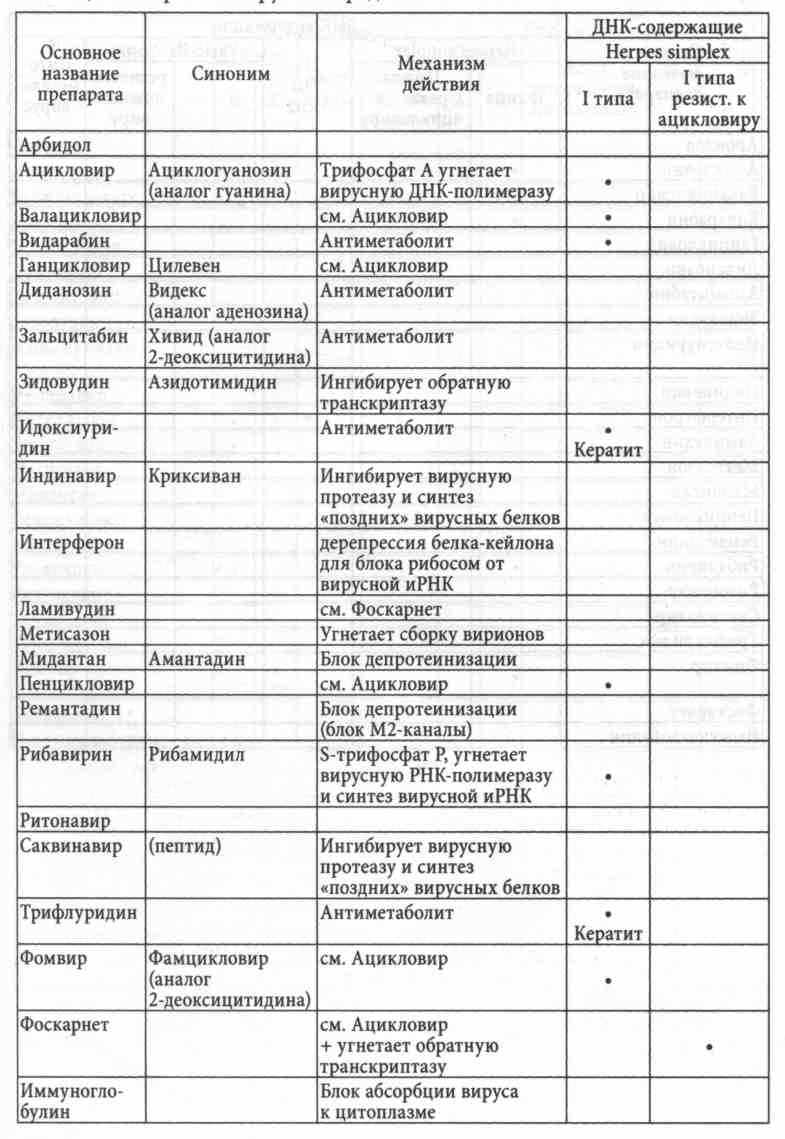
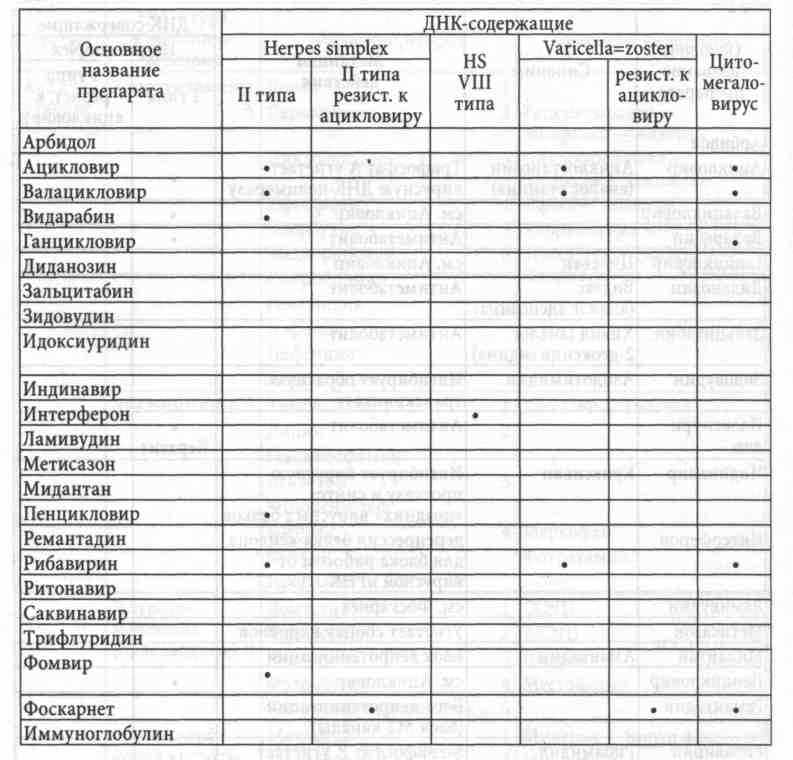
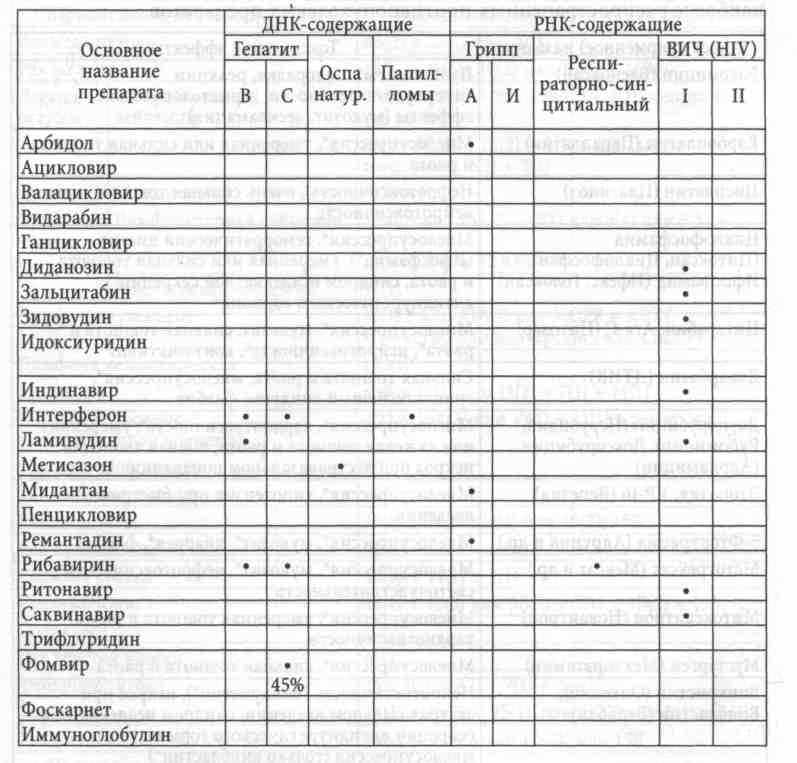
Противовирусные химиопрепараты (см. таблицу) широко известны и позволяют контролировать тяжесть и длительность обострений латентных ДНК-содержащих вирусов, в первую очередь, Herpes simplex и zoster. Эффективность против других вирусов значительно ниже в связи с неспецифичностью антиметаболического эффекта и невозможностью дать такую высокую дозу, которая достаточна для стерилизации от этиологического агента, да еще столь длительное время, чтобы задействовать все пораженные клетки в разных фазах жизнедеятельности вируса. Эффект терапии, как всегда, дозозависим. Ацикловир (и его аналоги) должен в случаях средней тяжести обострения Herpes simplex and zoster назначаться в дозе 1,0 через каждые 6 часов (6-12-18-24) до 1,4 на прием в тяжелых случаях --- курс до полной реабилитации.
Все, что используется для нейропротекции, автоматически оказывает и ноотропный эффект- позитивное влияние на память, обучение, аналитические способности. Поэтому к функциональной группе ноотропов следует отнести только те фармакопрепараты, которые способны оказывать заданное действие даже в условиях отсутствия исходной структурной и психической патологии и только на уровне центральной нервной системы (без непосредственных системных эффектов). В 1972 г. К. Giurgea предложил термин "ноотропы" для обозначения класса препаратов, улучшающих высшие функции головного мозга и не имеющих побочных эффектов, присущих психомоторным стимуляторам.
Ноотропы
Полипептиды, проходящие при клиническом применении ГЭБ (гемато- энцефалический барьер):
церебролизин
церебрамин
дельтаран
семакс
селанк
кортексин
ноопепт
актовегин --- продукт высокотехнологичной переработки кровяного полуфабриката
Меклофеноксат (ацефен) и Деанол (ацетил- холин) и ингибиторы холинэстеразы (нейромидин; такрин; экселон); Холитилин; Цераксон.
Пирацетам и Афобазол (ГАМК)
Проноран (дофамин)
Бета- аланин (глицин)
Бетасерк (гистамин)
Флупиртин (NMDA)
Амантадин (NMDA и дофамин)
Бемитил ( метапрот) -- производное бензимидазола В основе механизма действия лежит активация синтеза белка, а точнее РНК и белков-ферментов (в частности, ферментов глюконеогенеза и митохондриального окисления), в результате чего в клетке повышается энергопродукция, утилизация обменных "шлаков" и антиоксидантная защита (уменьшается образование гидропероксидов липидов, диеновых конъюгатов). Обнаружено благоприятное воздействие препарата на мозговые сосуды. Есть данные о подавлении препаратом некоторых путей свободного нефосфорилирующего окисления, а также о поддержании митохондрий в более сопряженном состоянии, особенно при воздействиях на организм (в частности, тяжелых физических нагрузках), ведущих к разобщению окисления и фосфорилирования.Применяется при хронической гипоксии разного происхождения, является эффективным средством повышения физической работоспособности как в обычных, так и в экстремальных условиях.
Адаптол (тетраметилтетраазабициклооктандион по химической структуре является близким к естественным метаболитам организма — его молекула состоит из двух метилированных фрагментов мочевины, входящих в состав бициклической структуры). Действует на активность структур, входящих в лимбико-ретикулярный комплекс, в частности на эмоциогенные зоны гипоталамуса, а также оказывает действие на все 4 основные нейромедиаторные системы — ГАМК-, холин-, серотонин- и адренергическую, способствуя их сбалансированности и интеграции, но не оказывает периферического адреноблокирующего действия. Устраняет или ослабляет беспокойство, тревогу, страх, внутреннее эмоциональное напряжение и раздражительность. Успокаивающий эффект не сопровождается миорелаксацией и нарушением координации движений. Не снижает умственную и двигательную активность, поэтому Адаптол можно применять в течение рабочего дня или учебы. Не создает приподнятого настроения, ощущения эйфории. Снотворным эффектом не обладает, но усиливает действие снотворных средств и нормализует течение сна при его нарушениях. Адаптол облегчает или снимает никотиновую абстиненцию. Кроме успокаивающего оказывает ноотропное действие. Улучшает когнитивные функции, внимание и умственную работоспособность, не стимулируя симптоматику продуктивных психопатологических расстройств — бред, патологическую эмоциональную активность.
При различных патологических процессах в нервной системе изменяется обмен металлов. При дефиците меди в препаратах синаптосом мозга существенно повышается связывание ГАМК мускариновыми рецепторами и снижается связывание бензодиазепина. Нейрональная память, реализующаяся через потенциалзависимый тип N-метил-D-аспартат-чувствительных рецепторов, регулируется магнием. По последним данным, в устье ионного канала рецепторов к глутамату расположен участок для связывания цинка.
Магний. На молекулярном уровне Mg участвует в формировании каталитических центров и в стабилизации регуляторных сайтов в составе многочисленных ферментов нервной и глиальных тканей, входит в состав глутаминсинтетазы (превращение глутамата в глутамин), γ-глутаминцистеинсинтетазы (контроль первой ступени синтеза глутатиона), холинэстеразы. Магнийсодержащие ферменты и ионы Mg2+ обеспечивают поддержание энергетических (каскад АТФ, транспортирование глюкозы в клетки) и пластических процессов (рибосомальный синтез нейроспецифических белков и липопротеидных комплексов) в нервной ткани. Mg участвует в процессах синтеза нейромедиаторов: норадреналина, тирозина, ацетилхолина, нейропептидов в головном мозге. Уровень Mg играет роль в регулировании баланса фракций липопротеидов высокой и низкой плотности и триглицеридов. В состоянии глубокой ишемии мозга происходит снижение содержания GluR2-субъединиц глутаматных рецепторов в коре (в тяжелых случаях — на 90–100 %). Это вызывает перевозбуждение и смерть нейронов, приводит к повышению проницаемости мембран для Са2+ и Na+, уменьшению митохондриального пула Mg2+, перемещению его сначала в цитозоль, а затем во внеклеточное пространство, что ведет к потере с мочой. В состоянии покоя устье АМРА-рецептора заблокировано ионами магния. При гипоксии АМРА-рецептор из устья теряет Mg2+, в нейрон направлено «шоковое» поступление Ca2+ (формируются «горячие пятна» в мозге), а участок для связывания Zn2+ лишается металла. Формируется свободный пул реактогенных, потенцирующих СРО в мозге ионов Zn2+. В постинсультном периоде сохраняющаяся диспропорция Mg : Ca и дефицит магния (ДМ) потенцируют процессы склерозирования и последующего фиброзирования очага поражения; усиленно продолжается кальцификация АСБ, утолщение интимы сосудов, создаются условия для повторных инсультов, ГТ .
Селен. Физиологическое поступление ультрамикроэлемента селена (Se) признано защитным фактором в борьбе с инсультом. Изучение роли Se в мозге привело к ряду важных открытий. Ионы Se активируют окислительно-восстановительные ферменты митохондрий и микросом, глутатионредуктазу, глутатионпероксидазу, цитохром Р450, участвуют в синтезе гликогена, АТФ, в передаче электронов от гемоглобина к кислороду, поддерживают обмен цистеина, потенцируют работу α-токоферола, являются антидотом против тяжелых металлов в мозге (ртути, серебра, кадмия, в меньшей степени — свинца, никеля). Селен входит в состав глутатионпероксидазы (GPX) — основного мембранного антиокислительного фермента — в виде остатка селеноцистеина (Se-Cys). Изоформа-6 экспрессируется в мозге, особенно в астроглии, и зависит от селена. При дефиците селена (ДС) у больных уровень Se в крови снижается позже, чем активность Se-GPX. Se необходим для регенерации фермента. Поэтому сниженная ферментативная активность Se-GPX — ранний маркер неблагополучия в обеспеченности мозга селеном . Тиоредоксинредуктаза, включая три цитозольные и две митохондриальные формы, максимально представлена в кислород-обогащенных органах (мозг, сердце, почки и др.). Для мозга не менее важна концентрация Se-содержащей йодтирониндейодиназы 2-го типа (мозг), 3-го типа (нейрон), Se-метионин-сульфоксидредуктазы (Se-протеин-R, мозг).
При этом в целом селен играет критическую роль в функционировании ЦНС. Нейропротекторный потенциал Se реализуется через экспрессию Se-протеинов, которые вовлекаются преимущественно в регуляцию редокс-состояния нейронов и клеток глии при физиологических условиях и окислительном стрессе. Недостаточный уровень Se в мозге потенцирует нарушения функции и структуры нейронов, индуцированные эндогенными и патогенными воздействиями, приводящими к апоптозу и гибели нейронов, к нейродегенерации. Выделено более 50 подтипов Se-протеина. Отклонения их обмена оказались разгадкой ключевых моментов биохимического маршрута ряда заболеваний. Уменьшение активности Se-BP1, или SELENBP1 (selenium-binding protein 1), патогмонично для шизофрении, при обострении снижается до критических цифр, при восполнении наблюдается улучшение состояния. Другой Se-протеин — Se-протеин W оказался важным буфером против отравления мозга метилртутью. Снижение Se-протеина 15 (SEP15) сопровождает развитие мезотелиомы, а при его дотации рост опухоли подавляется.
Пищевой ДС приводит к значительному снижению (от 40 до 80 %) активности Se-зависимых ферментов в многочисленных тканях эпителиального, железистого и лимфоидного происхождения. В мозге активность Se-зависимых ферментов сохраняется на относительно стабильном уровне даже в условиях глубокого дефицита селена, в силу существования уникальной Se-транспортной системы ЦНС (белки, депонирующие селеноцистеин, Se-транспортный белок аппарата Гольджи и др.).
Назначение селена вызывает нормализацию метаболизма дофамина и предотвращает эффект токсических веществ, вызывающих паркинсонизм . Полиморфизм генов Se-глутатионпероксидазы (особенно дефекты генов, ответственных за синтез GPX-1, тRNK) для Se при эстрогензависимом раке груди является прямым маркером опухолевых заболеваний (рак груди 1-го типа: полиморфизмы 185 delAG, C61G, T181G T>G, 4153 delA, 5382insC — маркеры при нейродегенеративных и цереброваскулярных заболеваниях. Это значит, что с момента рождения имеет место угнетение метаболизма селена
Апробированы при инсульте эбселен (2-фенил-1,2-бензизоселеназол-3(2Н)-ОН) и его аналоги. Эбселен регулирует уровень восстановленной аскорбиновой кислоты в мозге, оказывает противовоспалительное действие. Эбселен уже используется в комплексной терапии острого ИИ в Японии. Потенцируют усвоение селена в мозге жирорастворимые витамеры каротиноидов (ликопин, бета-каротин).
Оптимальная доза селена для профилактики ИИ и снижения смертности от церебро- и кардиоваскулярных заболеваний не должна превышать 200 мкг/сут. Дозы селена, превышающие максимально допустимый порог потребления (более 400 мкг/сут.), при длительном приеме могут стимулировать меланозависимый рак кожи.
Литий. Попытки воздействовать препаратами лития (Li) на воспалительный компонент ишемическом инсульте (ИИ) и уровень простагландина PGA1 (маркер эксайтотоксичности в нервной ткани при ИИ) показали свою перспективность на уровне экспериментальных моделей инсульта .Низкие дозы Li, как в моноварианте, так и в комбинации с каптоприлом были эффективны в профилактике подъема АД и возникновения ИИ у спонтанно гипертензированных крыс. Литий пролонгирует эффект ингибиции ангиотензинпревращающего фермента (иАПФ). При артериальной гипертензии обнаружена гиперфункция Na+-H+- и/или Na+-Li+-обмена, т.е. натрий усиленно накапливается, а литий теряется. Литий стимулирует выработку фактора роста нервов.
Цинк. Физиологические дозы пищевого цинка (5–15 мг/сут.) необходимы растущему мозгу, так как его адекватное поступление с пищей — обязательное условие для становления и функционирования всех звеньев иммунитета, формирования когнитивной функции и нормальной работы ЦНС.
Этот микроэлемент необходим для обеспечения метаболизма клеток и их функций, так как входит в состав простетических групп ферментов, катализирует их действие, участвует в гемопоэзе. 75% всего Zn в организме находится в эритроцитах в составе их фермента карбоангидразы. Также Zn входит в состав транскрипционных факторов, регулирующих активность гемопоэтических клеток - GATA-белки, содержащие так называемый "цинк-связывающий палец" белка, а именно аминокислотную последовательность, характерную для Zn -связывающих белков: цис-х-х-цис-(х)17-цис-х-цис(х-любая аминокислота).Отсутствие Zn нарушает биосинтез витаминов С и В1.
Цинк присутствует в клетках в качестве компонента многих металлозависимых ферментов и транскрипционных факторов. Он также является нейротрансмиттером и нейромодулятором ЦНС. Значительные концентрации ионов Zn обнаружены в пресинаптических везикулах и синаптическом пространстве сразу после стимуляции нейронов. Было установлено, что цинк может воздействовать на ряд рецепторов и потенциал-зависимых ионных каналов, в частности может ингибировать активность NMDA-рецепторов.
Zn, в отличие от Mg, не просто блокатор ионных каналов, а регулятор синаптической передачи. Выделяясь вместе с глутаматом, он оказывает эффект на рецепторы, локализованные как на пресинаптической, так и на постсинаптической мембране. Кроме того, имеет способность выходить из синаптической щели и влиять на состояние других синапсов – это так называемая «объёмная передача».
Среди структур головного мозга наибольшее количество цинка содержат гиппокамп и кора мозжечка, особенно мозжечковые клубочки - синаптические структуры, образованные окончаниями моховидных волокон на дендритах зернистых клеток. Возможно, цинк влияет на передачу нервных импульсов, препятствуя связыванию пептидов и других лигандов с рецепторами (опиатными, холинорецепторами, рецепторами ГАМК, глутаматными NMDA-рецепторами).
Железо И недостаток, и избыток железа в нервной ткани приводит к эскалации прооксидантных процессов. Существенно сниженный уровень железа (соответствующий железодефицитной анемии) и его повышенный уровень — предикторы усиления процессов СРО в мозге. Глубокий дефицит железа вызывает нарушение продукции нейромедиаторов (серотонина, дофамина, норадреналина), миелина, приводит к развитию энергетического кризиса и может сочетаться с повышенным риском инсульта. При алкоголизме нейротоксичность железа возрастает.
Под влиянием нейраминидазы происходит отделение гликановых цепей и трансферрин (ТФ) превращается в тау-белок, уровень которого при инсульте возрастает, а в процессе лечения снижается. Свободные ионы Fe2+ вызывает активацию CРО и окисление нейромеланина в черном веществе мозга
ТФ и ферритин участвуют в выбросе Al3+ и Fe3+, запуске СРО, перекрестного соединения молекул β-амилоидного предшественника, что вызывает формирование постинсультных сенильных бляшек, возрастанию уровня железа и марганца в подкорковых ядрах. Кроме этого, процесс утилизации внутриклеточного железа зависит от активности митохондриальных цитохромов, аконитазы и эритроидной σ-аминолевулинатсинтетазы (σ-АЛС). В целом дисбаланс железа в организме способствует совместному повышенному накоплению токсичных металлов в ЦНС (Mn, Cu, Co, Cd, Al, Sc и др). Неполное насыщение ТФ Fe3+ или его сниженный аффинитет к Fe3+ предрасполагает к связыванию иных металлов и их транспорту через ГЭБ, с чем может быть связан патогенез не только болезни Альцгеймера, но и постинсультной нейродегенерации, алкогольной деменции. Единственное показание для терапии железом — железодефицитная анемия, подтвержденная объективными данными (снижение сывороточного железа, ферритина и трансферрина в крови, и, возможно, гемоглобина
ОПИАТНЫЕ РЕЦЕПТОРЫ
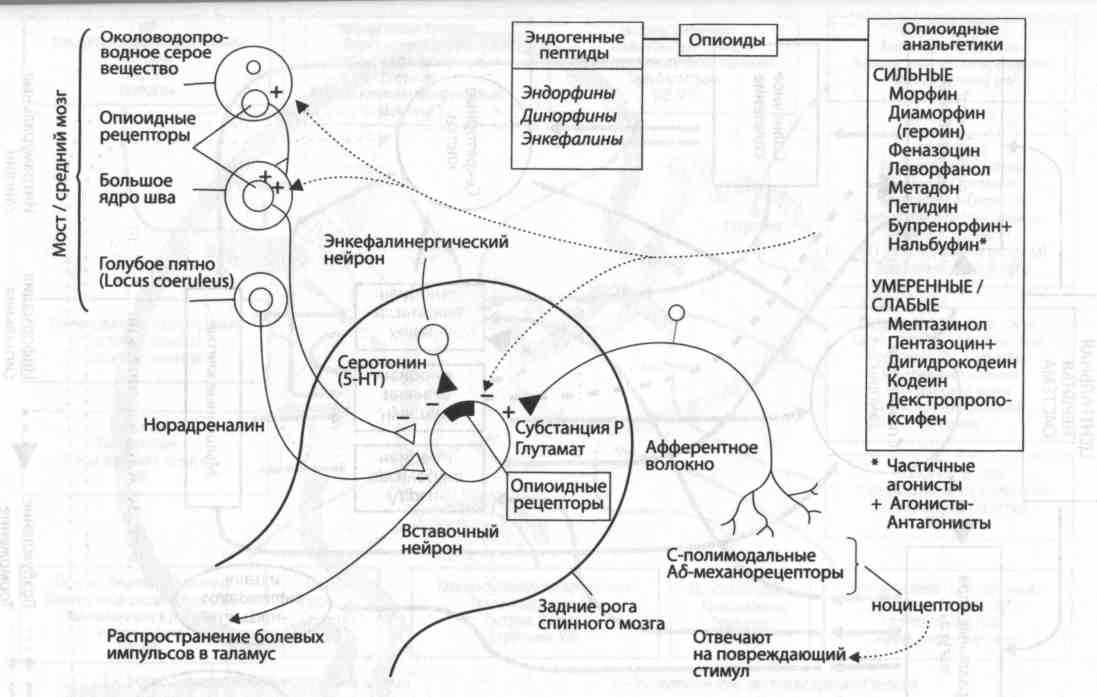
Некоторые экзогенные лиганды и их сродство к опиоидным рецепторам
| Вещество | Сродство к рецепторам | ||
| μ | δ | κ | |
| Морфин | + + | + | + |
| Героин*, Метадон, Фентанил | + + | | |
| Сальвинорин А | | | + |
| Кодеин, Оксикодон, Гидрокодон, Декстропропоксифен | ± | | |
| Буторфанол | ± | | + + |
| Пентазоцин | ± | | + |
| Бупренорфин | ± | − − | − − |
| Налорфин | − | | + |
| Нальбуфин | − − | | + + |
| Налоксон и Налтрексон | − − | − | − |
| Обозначения: ++: сильный агонист, +: агонист, ±: частичный агонист, −: антагонист, − −: сильный антагонист. | |||
*Сам героин обладает довольно слабым сродством к μ-рецепторам, но легко проникает через гемато-энцефалический барьер, где преобразуется в 6-моноацетилморфин — мощный агонист μ-рецепторов.
σ-рецепторы ранее относили к опиоидным, так как считали, что противокашлевой эффект многих опиоидов реализуется через действие на эти рецепторы, а также первые селективные σ-агонисты были производными опиоидов (например, аллилнорметазоцин). Однако было обнаружено, что σ-рецепторы не активируются эндогенными опиоидными пептидами и сильно отличаются от других опиоидных рецепторов как по функции, так и по генетической структуре. Также они показали высокую чувствительность к фенциклидину и кетамину, которые являются специфическими антагонистами комплексу глутамат-N-метил-D-аспартат. Кроме того, они не подвергаются реверсии налоксоном и обладают стереоселективностью к правовращающим изомерам, а опиоидные рецепторы избирательны к левовращающим изомерам.
Дзета (ζ-) опиоидный рецептор, который проявил себя как модулятор фактора роста клеток при действии его эндогенного лиганда — мет-энкефалина. Этот рецептор в настоящее время чаще обозначают как опиоидный рецептор фактора роста (OGFr).
Активация ε-рецептора вызывает выраженное обезболивание и выброс мет-энкефалина и было обнаружено, что ряд широко используемых опиоидных агонистов, таких как μ-агонист эторфин и κ-агонист бремазоцин, действуют как агонисты этих эффектов (даже в присутствии антагонистов к их более известным мишеням), а бупренорфин действует как антагонист этого рецептора.
МИ- брадикардия; миоз; урежение частоты дыхания; гипотермия; ослабление разгибательного рефлекса; анальгезия (гипоталамус, таламус, гиппокамп, лимбическая система); лей- и мет-энкефалины из гипоталамуса оказывают эффект пролактостатина; блок моторики ЖКТ (препятствуя также выходу ацетилхолина).
ДЕЛЬТА- эпилепсия (подавление активности коры – в ряде случаев в зависимости от уровня расположения ГАМК- рецепторов); эйфория; блок моторики ЖКТ.
КАППА – седативный; анальгезия; модуляция Н-холинергического влияния на хромаффинную ткань надпочечников.
СИГМА – мидриаз; учащение дыхания; маниакальные состояния; галлюцинации.
ЭПСИЛОН – регуляция функций надпочечников.
Антагонисты
МИ: налоксон; пентазоцин; налтрексон; дипренорфин.
Болевые импульсы от ноцицепторов (болевых рецепторов) по первичным афферентным волокнам передаются в задние рога спинного мозга (пластинки I и II), где происходит их переключение на первый вставочный нейрон. Отсюда возбуждение распространяется через таламус к сенсорным зонам коры головного мозга. Выявлено, что в окончаниях первичных афферентных волокон высвобождаются некоторые пептиды (например, субстанция Р, кальцитониноподобный пептид).
Активность вставочных нейронов задних рогов спинного мозга регулируется несколькими ингибиторными механизмами. К ним относятся промежуточные нейроны, высвобождающие опиоидные пептиды (например, мет-энкефалины), окончания норадреналинергических и серотонинергических волокон, идущих от различных образований головного мозга, которые активируются опиоидными пептидами. Опиоидные пептиды, высвобождающиеся как в головном, так и спинном мозге, понижают активность вставочных нейронов задних рогов спинного мозга и вызывают анальгезию (обезболивание).
Опиоиды — это вещества, эффекты которых устраняются налоксоном. Известно 3 семейства опиоидных пептидов, являющихся производными крупномолекулярных предшественников, кодирующихся отдельными генами. Пропиомеланокортин (ПОМК) является предшественником -эндорфинов и некоторых неопиоидных пептидов, включая адренокортикотропный гормон (АКТГ). Проэнкефалин дает начало лей-энкефалинам и мет-энкефалинам. Продинорфин является предшественником опиоидных пептидов, содержащих в своей структуре лей-энкефалины (например, динорфин А). Опиоидные пептиды, являющиеся производными различных предшественников, различаются по локализации в ЦНС и сродству к разным подтипам опиоидных рецепторов.
Опиоидные рецепторы. -рецепторы участвуют в процессах формирования боли; взаимодействие опиоидов с этими рецепторами вызывает развитие анальгезии. Концентрация -рецепторов в головном мозге невелика. Агонистами - и -рецепторов являются, соответственно, энкефалины и динорфины. Активация -рецепторов вызывает анальгезию, которая обычно сопровождается чувством дисфории (например, при применении пентазоцина, нальбуфина), тогда как активация -рецепторов (например, морфином) вызывает анальгезию, сопровождающуюся эйфорией. Некоторые опиоидные анальгетики (например, пентазоцин) действуют на -рецепторы, вызывая психостимулирующий и психозомиметический (галлюциногенный) эффекты (известно, что галлюциноген фенциклидин является агонистом этих рецепторов), которые не устраняются введением налоксона. Этот факт свидетельствует о том, что -рецепторы не являются опиоидными. Активация - и -рецепторов при участии G-белков приводит к увеличению проницаемости К+-каналов и вызывает гиперполяризацию мембран нейронов. Активация -рецепторов уменьшает проницаемость Са2+-каналов мембран нейронов. Опиоидные пептиды угнетают синаптическую передачу в ЦНС и кишечнике.
Агонисты
МИ: морфин; дигидроморфин; норморфин; гидроморфин; леворфанол; эторфин; метадон; петидин; фенталин; кетамин.
ДЕЛЬТА: Ala 2 , Leu 5 – энкефалин.
КАППА: бремазоцил; кетоциклазоцин; диморфин; леуморфин; этилкетазоцин.
СИГМА: N- аллилнорциклазоцин.
ЭПСИЛОН: бета-эндорфин.
Ингибирование связи ионов кальция с фосфолипидами, активности аденилатциклазы, орнитиндекарбоксилазы почек, секреции соматостатина и адреналина. Модуляция работы холин- и адренергических нейронов (через гуаниннуклеотиды). Увеличение синтеза глюкокортикостероидов и ганглиозидов и активация липолиза при хронической даче
Морфин и другие наркотические анальгетики оказывают множество центральных эффектов. Кроме выраженной анальгезии наркотические анальгетики вызывают состояние эйфории, угнетение дыхательного и сосудодвигательного центров (что может привести к ортостатической гипотензии), оказывают седативное действие, стимулируют триггерную хеморецепторную зону (вызывая тошноту и рвоту). Опиоиды стимулируют центр глазодвигательного нерва, вызывая сужение зрачка — миоз (исключением является петидин, обладающий слабой м-холиноблокирующей активностью). Препараты угнетают кашлевой центр, однако выраженность этого эффекта не коррелирует с их опиоидной активностью. При применении наркотических анальгетиков возможны запоры, спазм желчных протоков и сфинктера Одди. Морфин может вызвать либерализацию гистамина, что приводит к расширению сосудов и появлению кожного зуда. Морфин метаболизируется в печени путем конъюгации с глюкуроновой кислотой, образуя неактивный морфин-3-глюкуронид и высоко активный морфин-6-глюкуронид.
При продолжительном применении опиоидных анальгетиков к ним развивается толерантность (то есть привыкание — уменьшение чувствительности организма к лекарству).
Для опиоидов характерно длительное удержание ксенобиотика на специфических рецепторах, которые перестают участвовать в процессах адаптивного обезболивания, а также перестают либерализовать норадреналин в отделах ЦНС, ответственных за эйфорию. Для улучшения настроения требуются новые поступления опиоидов, включающие дополнительные рецепторные поля. Однако развитие down –эффекта приводит к уменьшению пула соответствующих рецепторов.
Прочное соединение опиоидов к мембранам различных клеток организма переводит их в аутоантигены с закономерным развитием системного хронического аутоиммунного воспаления и дистрофии всех органов и тканей (с итоговой дистрофией).
Такие побочные эффекты наркотических анальгетиков, как сужение зрачка и запоры, не уменьшаются при длительном их применении.
К опиоидным анальгетикам развивается психическая и физическая лекарственная зависимость, резкая отмена препаратов вызывает абстинентный синдром.
Диаморфин (героин, диацетилморфин) в два раза активнее, чем морфин. В организме быстро превращается в активный метаболит 6-ацетилморфин и более медленно в морфин. При применении героина отмечается выраженная эйфория; тошнота, запор и артериальная гипотензия выражены слабее, чем при использовании морфина.
Метадон хорошо всасывается при приеме внутрь, оказывает продолжительное действие. Его применяют перорально в комплексной терапии опийной наркомании для предупреждения абстинентного синдрома (“ломки”).
Петидин по своим свойствам напоминает морфин, но действует короче. При применении в дозах, вызывающих анальгезию, угнетает дыхательный центр, оказывает слабое противокашлевое действие и практически не вызывает развития запоров. Препарат высоко липофилен, поэтому его эффект развивается быстро. В печени петидин превращается в норпетидин, который может вызывать целый ряд побочных эффектов (например, расширение зрачка, судороги). При комбинированном применении с ингибиторами МАО петидин может вызывать появление делирия, повышение температуры тела, судороги и угнетение дыхания.
Бупренорфин — это частичный агонист -рецепторов, липофильный, эффективный при сублингвальном применении. Препарат действует продолжительнее, чем морфин. При его использовании возможно появление продолжительной рвоты. Бупренорфин прочно связывается с опиоидными рецепторами, поэтому налоксон практически не устраняет угнетение дыхания, вызванное применением препарата.
Нальбуфин (агонист -рецепторов и антагонист -рецепторов) соответствует морфину по анальгезирующей активности и способности угнетать дыхательный центр; тошнота и рвота при его применении отмечаются реже. При использовании в высоких дозах вызывает дистрофию.
Пентазоцин является слабым наркотическим анальгетиком, неприятным на вкус. При парентеральном введении оказывает обезболивающее действие (среднее между обезболивающим эффектом морфина и кодеина). Пентазоцин является агонистом - и -опиоидных рецепторов, но антагонистом -рецепторов. Препарат часто вызывает галлюцинации, кошмарные сновидения, расстройство умственной деятельности из-за активации -рецепторов. Преимуществом препарата является его слабая способность вызывать лекарственную зависимость.
Кодеин (метилморфин) хорошо всасывается при пероральном введении, обладает слабым сродством к опиоидным рецепторам. Около 10% препарата деметилируется в печени в морфин, с которым преимущественно и связан его обезболивающий эффект. Побочные эффекты (запоры, рвота, угнетение ЦНС) не позволяют увеличивать дозу для достижения более сильного болеутоляющего эффекта. Кодеин используют в основном как противокашлевое и противопоносное средство.
Анальгезирующая активность декстропропоксифена выражена в 2 раза слабее, чем у кодеина. Препарат часто используют в комбинации с аспирином или парацетамолом.
Специфическим антагонистом опиоидных рецепторов является налоксон, он устраняет угнетение дыхательного центра, вызванного наркотическими средствами. Налоксон может спровоцировать синдром отмены у пациентов с опийной лекарственной зависимостью. Препарат устраняет также обезболивающий эффект электроакупунктурной анальгезии и анальгезии, связанной с приемом плацебо, что свидетельствует об участии эндогенных опиоидных пептидов в этих видах обезболивания.
Аналог энкефалинов имодиум (лоперамид) стимулирует - и -рецепторы толстого кишечника, вызывая спазм сфинктеров (циркулярных мышц) с антидиарейным эффектом.
Агонист каппа-рецепторов федотозин — адаптатор моторики толстого кишечника при разном исходном состоянии.
Даларгин — гексапептид из группы энкефалинов применяется внутривенно или местно (в том числе при эндоскопии) для лечения тяжелых панкреатита, язвы желудка, облитерирующего эндартериита.
-эндорфин дельтаран (пептид дельта-сна) применяется для купирования алкогольной зависимости (а при его дефиците провоцируется алкогольная зависимость).
Трамадол - синтетический опиоидный анальгетик, агонист опиоидных рецепторов. Активирует опиоидные рецепторы (мю-, дельта-, каппа-) на пре- и постсинаптических мембранах афферентных волокон ноцицептивной системы в головном мозге и ЖКТ. Обладает действием на головной и спинной мозг: способствует открытию К+- и Са2+-каналов, вызывает гиперполяризацию мембран и тормозит проведение болевых импульсов. Усиливает действие седативных средств. Залдиар (парацетамол +трамадол).
Боль — неприятное сенсорное и эмоциональное переживание, связанное с истинным или потенциальным повреждением ткани или описываемое в терминах такого повреждения.То есть боль, как правило, нечто большее, чем чистое ощущение, связанное с существующим или возможным органическим повреждением, поскольку обычно сопровождается эмоциональным переживанием.
Термин боль обозначает субъективное переживание, которое обычно сопровождается ноцицепцией, но может также возникать и безо всяких стимулов.
Ноцицепция — это нейрофизиологическое понятие, обозначающее восприятие, проведение и центральную обработку сигналов о вредоносных процессах или воздействиях. То есть это физиологический механизм передачи боли, и он не затрагивает описание её эмоциональной составляющей. Важное значение имеет тот факт, что само проведение болевых сигналов в ноцицептивной системе не эквивалентно ощущаемой боли.
Повышение чувствительности терминалей ноцицептивных афферентов при активации постганглионарных симпатических волокон опосредуется двумя путями. Во–первых, за счет повышения сосудистой проницаемости в зоне повреждения и увеличения концентрации медиаторов воспаления (непрямой путь) и, во–вторых, за счет прямого воздействия нейротрансмиттеров симпатической нервной системы – норадреналина и адреналина на адренорецепторы, расположенные на мембране ноцицепторов. При воспалении происходит активация так называемых «молчащих» ноцицептивных нейронов, которые в отсутствие воспаления не отвечают на различного рода ноцицептивные раздражения. Наряду с усилением афферентного ноцицептивного потока при воспалении отмечается усиление нисходящего контроля . Это происходит в результате активации антиноцицептивной системы. Она активируется, когда болевой сигнал достигает антиноцицептивных структур ствола мозга, таламуса и коры больших полушарий мозга . Активация околоводопроводного серого вещества и большого ядра шва вызывает высвобождение эндорфинов и энкефалинов, которые связываются с рецепторами, запуская серию физико–химических изменений, уменьшающих боль. Наибольшее число используемых анальгетиков оказывают свое действие благодаря взаимодействию с µ –рецепторами . До недавнего времени было принято считать, что опиоиды действуют исключительно на нервную систему и вызывают анальгетический эффект за счет взаимодействия с опиоидными рецепторами, локализованными в головном и спинном мозге. Однако опиатные рецепторы и их лиганды обнаружены на иммунных клетках , в периферических нервах , в воспаленных тканях . В настоящее время известно, что 70% рецепторов к эндорфину и энкефалинам расположены в пресинаптической мембране ноцицепторов и чаще всего болевой сигнал подавляется (перед тем как достигнуть задних рогов спинного мозга).
Динорфин активирует афферентные рецепторы и ингибирует вставочные нейроны, что приводит к высвобождению ГАМК, которая вызывает гиперполяризацию клеток заднего рога и ингибирует дальнейшую передачу сигнала
Синаптические терминали многих тонких высоко-пороговых афферентов содержат в качестве нейромедиатора глутамат, аспартат и ряд нейропептидов, таких, как субстанция Р, нейрокинин А, кальцитонин ген-родственный пептид и многие другие, которые высвобождаются из пресинаптических терминалей под действием ноцицептивных импульсов.
Выделение глутамата из пресинаптических терминалей происходит при любом ноцицептивном воздействии — коротком (уколе) или длительном. Считается, что реализация физиологических болевых реакций (например, защитный рефлекс отдёргивания) при выделении глутамата опосредуется через АМРА-рецепторы (alpha-amino-3-hydroxy-5-methyl-4-isoxazole-propionic acid), в то время как NMDA-рецепторы (N-methyl-D-aspartate) обеспечивают длительную, в том числе и патологическую гиперактивность ноцицептивных нейронов.
Активирующее действие глутамата на ноцицептивные нейроны потенцируется субстанцией Р, которая как медиатор сосуществует в более 90 процентах терминалей высокопороговых сенсорных волокон, содержащих глутамат. Субстанция Р, как и другие нейрокинины, взаимодействуя с NK-1 рецепторами (neurokinin-1), не только повышает концентрацию внутриклеточного Са2+ посредством его мобилизации из внутриклеточных депо, но и усиливает активность NMDA-рецепторов.
Необходимо подчеркнуть, что возникшая вследствие повреждения тканей сенситизация ноцицептивных нейронов может несколько часов или дней сохраняться и после прекращения поступления ноцицептивных импульсов с периферии, иными словами, если уже произошла гиперактивация ноцицептивных нейронов, то она не нуждается в дополнительной подпитке импульсами из места повреждения.
Ограничение входа ноцицептивной импульсации в ЦНС достигается при помощи различного рода блокад местными анестетиками, которые не только могут предотвратить сенситизацию ноцицептивных нейронов, но и способствовать нормализации микроциркуляции в зоне повреждения, улучшая восстановление повреждённых тканей. Использование нестероидных и/или стероидных противовоспалительных препаратов обеспечивает подавление синтеза алгогенов, снижение воспалительных реакций и тем самым уменьшает сенситизацию ноцицепторов.
Для активации структур антиноцицептивной системы, осуществляющих контроль за проведением ноцицептивной импульсации в ЦНС, может быть использован целый спектр (в зависимости от клинических показаний) медикаментозных (наркотические и ненаркотические аналгетики, бензодиазепины, агонисты альфа-2-адрено-рецепторов и другие) и немедикаментозных (чрезкожная электронейростимуляция, рефлексотерапия, физиотерапия) средств, снижающих болевую чувствительность и негативное эмоциональное переживание.
Для нейрогенного (невропатического) болевого синдрома характерно наличие следующих симптомов: постоянная, спонтанная или пароксизмальная боль, сенсорный дефицит в зоне болезненности, аллодиния (появление болезненного ощущения при лёгком неповреждающем воздействии), гипералгезия и гиперпатия. Полиморфизм болевых ощущений у разных пациентов обусловлен характером, степенью и местом повреждения. При неполном, частичном повреждении ноцицептивных афферентов чаще возникает острая периодическая пароксизмальная боль, подобная удару электрического тока и длящаяся всего несколько секунд. В случае полной денервации боли чаще всего имеют постоянный характер.
Одной из типичных черт нейрогенных болевых синдромов является аллодиния — болевое ощущение, возникающее при слабом механическом раздражении кисточкой определённых кожных участков. В механизме возникновения аллодинии большое значение придаётся сенситизации нейронов широкого динамического диапазона (ШДД-нейроны), которые одновременно получают афферентные сигналы от низкопороговых "тактильных" А-бета волокон и высокопороговых "болевых" С-волокон.
Приоритетными при нейропатических болях считаются следующие лекарственные средства: антиконвульсанты и препараты, усиливающие тормозные реакции в ЦНС — бензодиазепины, агонисты рецепторов ГАМК, блокаторы кальциевых каналов, антагонисты возбуждающих аминокислот, периферические и центральные блокаторы Na-каналов. Специальное направление – этиотропная терапия повреждений нервной системы, особенно при обострении латентных вирусных инфекций.
