Совершенствование методов диагностики и лечения рака тела матки 14. 00. 14 онкология
| Вид материала | Документы |
| Результаты исследования и их обсуждение |
- Запорожан В. Н., Голант М. Б., Хаит, 62.84kb.
- Последняя надежда или чудо своими руками, 3060.3kb.
- Некоторые медико-социальные аспекты диагностики и лечения запущенных форм рака молочной, 417.81kb.
- Особенности рака и гиперпластических процессов эндометрия в сочетании с миомой матки, 408.19kb.
- Стратегия и тактика лучевой терапии в многокомпонентном лечении местно-распространенного, 1026.52kb.
- Эпидемиология рака молочной железы в приморском крае. Пути профилактики и ранней диагностики, 441.79kb.
- Пути улучшения диагностики и лечения меланомы кожи 14. 00. 14 Онкология, 659.38kb.
- Риск развития миомы матки снижается при увеличении числа родов и увеличивается у женщин,, 33.08kb.
- Учебно-методическая карта дисциплины, 62.2kb.
- План практического занятия: обсуждение методов диагностики, дифференциальной диагностики, 118.68kb.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Изучение общесоматического статуса у больных РТМ показало увеличение числа женщин с гиперстенической и пикнической конституцией по сравнению с контролем (P<0,05). Обращает на себя внимание увеличение числа больных РТМ с андроидным типом ожирением I-IV по сравнению с контролем (P<0,05), что полностью согласуется с данными литературы (Окулов В.Б., Войтенков Б.О., 1990; M. Marinaccio et al., 1995; Kamelle S.A. et al., 2001; Blythe J.G., 1997; Brinton L.A. et al, 2002). Возможно, что гиперстеническая и пикническая конституции больше предрасполагают к ожирению, чем нормостеническая, можно предположить, что и пониженная физическая активность, отмечаемая в анамнезе у практически половины больных (48,2%, в контроле - у 38,3%, P<0,05), является одной из причин ожирения и также является фактором риска в отношении РТМ (Karttunen R. et al., 1991; Pfleiderer, A., 2001). Вероятно, гиподинамия связана с профессиональными особенностями больных РТМ, половина которых (50,1%) имеют высшее образование (в контроле – 27,5%, P<0,05), что подтверждает данные Littman AJ et al. (1999) о том, что большинство их относится к хорошо обеспеченным в социально-экономическом отношении слоям населения. Немаловажным аспектом в этом плане является и то, что большинство обследуемых больных РТМ предпочитали употребление жирной и углеводистой пищи.
Известно, что эстрогены в организме вырабатываются в жировых депо, особенно в периоде постменопаузы, обусловливая хроническую эстрогенную стимуляцию эндометрия (Calleri L.F., 2000; Linn H.H. et al., 1995; Kalandidi A. et al., 1996; Brinton L.A. et al., 2002). У больных РТМ гиперэстрогения выявлялась статистически достоверно чаще, чем в контроле (P<0,05), и вполне вероятно по вышеперечисленным причинам.
РТМ нередко сопровождаются изменениями показателей свертывающей систем крови (Безрукова, О.Д. и др. 1986, Моисеенко В.М. и соавт., 1999; Weiss E. et al., 1999), причем в значительной степени они обусловлены пожилым возрастом этих больных (Бохман Я.В., 1972; Бохман Я.В., 2002; Бохман Я.В. и др., 1979). Анализ гемокоагуляционного потенциала, а также тромбоэмболических осложнений у больных РТМ показал превышение показателей коагулограммы, а также частоты варикозного расширения вен и флеботромбоза нижних конечностей по сравнению с контролем (P<0,05), что также может рассматриваться одним из возможных факторов риска развития РТМ.
Выявленный значительный процент кардиопатий: климактерической, диабетической, гипертензивной, ишемической у больных РТМ (31,3%). По данным литературы они отмечаются у 23,56% больных (Trimble E.L. et al., 1998; Giacalone P.L. et al., 2001), определяемых от 2 до 6 и более лет до первых симптомов РТМ, можно объяснить не только пожилым возрастом больных, но и тем, что сочетание ожирения, сахарного диабета, гипертонической болезни и кардиопатии также возможно является одним из аспектов в патогенезе РТМ.
Важным в плане возможных факторов онкологического риска является поиск генетических маркеров, в первую очередь антигенов различных изосерологических систем крови. В настоящее время известная связь некоторых групповых факторов крови и ее резус-принадлежности с рядом злокачественных новообразований женских половых органов. Отмечено повышение частоты заболеваемости РШМ у женщин с группой крови В (III), раком яичников - у женщин с группой 0 (I) и АВ (IV) (Бохман Я.В., 1976; Бохман Я.В., 1972). Женщины с группой крови А(II) более склонны к развитию опухолей трофобласта, чем женщины с группой 0 (I), а с группой АВ (IV) наиболее подвержены заболеванию хориокарциномой (Брауде И.Л., 1959). Выявленное нами снижение процента больных РТМ с 0αβ(I) группой крови (P<0,002), увеличение с Аβ (II), Вα (III) и особенно с АВ0(IV) группой (P<0,05) по сравнению с контрольной группой позволяет предположить, что наличие гемагглютининов α и β в сыворотке крови, и особенно их сочетание, оказывают онкопротекторное воздействие в отношении PТМ. В то же время повышение среди них процента больных с резус-отрицательной кровью (P<0,05) может служить основанием для предположения о возможном онкопротекторном воздействии и резус-положительной крови в отношении РТМ. На основании полученных данных можно предположить, что как групповая (АВ0(IV)), так и резус-отрицательная принадлежность крови, наряду с другими факторами, также могут в какой-то мере обусловить предрасположенность к заболеванию РТМ. В доступной литературе мы не встретили работ, посвященных изучению иммуногенетических маркеров эритроцитарных систем (АВ0 и Rh-Hr) у больных РТМ.
Роль дооперационной диагностики в постановке диагноза рака эндометрия и его стадий имеет большое значение, поскольку определяет объем оперативного лечения. До настоящего времени морфологический метод диагностики является основным для верификации патологии эндометрия и цервикального канала (Адамян Р.Т., 1998; Безрукова, О.Д. и др., 1986; Бохман, Я.В., 1976), при этом используется как цитологическое исследование аспиратов из полости матки, так и гистологическое –соскобов эндометрия и слизистой оболочки цервикального канала и биоптатов, полученных при гистероскопии. Последняя широко используется в онкогинекологии (Безрукова, О.Д. и др., 1986; Бохман Я.В., 2002; Брауде, И.Л., 1959), но имеет ряд недостатков (Бохман Я.В., 1972; Вишневская Е.Е.,. Бохман Я.В., 1994; Бессемельцев С.С. и др., 2001). Нами был предложен и апробирован метод цервикогистерскопии гибким эндоскопом – фиброскопом, который благодаря многим конструктивным особенностям создает более благоприятные условия для обзора слизистой полости матки и цервикального канала и проведено сопоставлении результативности используемых методов в диагностике РТМ, малигнизированных полипов эндометрия (МПЭ) и атипической железистой гиперплазии эндометрия (АЖГЭ) ( рис.5).
Анализ эффективности различных методов диагностики патологии эндометрия выявил, что цитологическое исследование аспиратов из полости матки позволяет поставить правильный диагноз МПЭ только в 25,9% случаев. При гистологическом исследовании соскобов из полости матки МПЭ распознаются уже в 51,8% случаев (P<0,05). Сочетанное использование обоих методов улучшает результативность диагностики только до 63% и только одновременное использование цитологического и гистологического исследования гистеробиоптатов позволяет статистически значимо увеличить эффективность диагностики до 92,3 % (P<0,05).
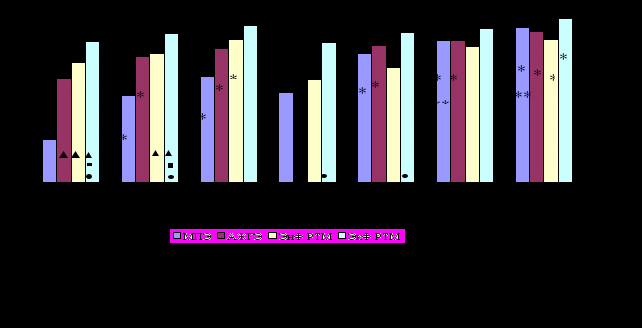
Рис. 5. Эффективность различных методов диагностики патологии эндометрия
Примечание:
* P<0,05 по сравнению с цитологическим исследованием аспиратов из полости матки
** P<0,05 по сравнению с гистологическим исследованием аспиратов из полости матки
▲ P<0,05 по сравнению с МПЭ
■ P<0,05 по сравнению с АЖГЭ
● P<0,05 по сравнению с ЭнФ РТМ
Оценка эффективности различных методов диагностики АЖГЭ выявила, что цитологическое исследование аспиратов из полости матки является наименее результативным- 61,6%. При гистологическом исследовании соскобов эффективность диагностики повышается до 75% ( P<0,05), а наиболее эффективным методом является сочетанное морфологическое исследовании гистеробиоптатов (89,5%).
Анализ эффективности различных методов диагностики эндофитной формы РТМ показал, что сочетанное исследование аспиратов из полости матки с гистологическим исследованием соскобов статистически значимо превышает эффективность только цитологического исследования аспиратов (84,8% и 71,3% соответственно) и не отличается от результативности сочетанного цитологического и гистологического исследования гистеробиоптатов- 85,1%.
Анализ эффективности рассматриваемых методов диагностики экзофитной формы РТМ выявил, что для этой формы РТМ все рассматриваемые методы диагностики, проводимые на дооперационном этапе, отличаются высокой эффективностью и только сочетанное морфологическое исследование гистеробиоптатов статистически значимо превышает результативность цитологического исследования аспиратов из полости матки (97,2% и 82,9% соответственно, P<0,05).
Таким образом, сочетанное морфологическое исследование гистеробиоптатов, полученных при ФЦГС, является наиболее эффективным методом дооперационной диагностики рассматриваемой патологии эндометрия по сравнению с цитологическим исследованием аспиратов и гистологическим – соскобов из полости матки.
Особую важность представляет распознавание перехода опухолевого процесса на слизистую оболочку цервикального канала (СОЦК), так как в этом случае определяется уже II (T2) стадия заболевания, при которой необходимо расширение объема оперативного вмешательства.
Оценка эффективности диагностики Т2 при различных формах РТМ представлена на рис. 6. Эффективность диагностики Т2 при эндофитной форме РТМ наиболее низкой была при цитологическом исследовании аспиратов из полости матки (диагностическая точность - 56,7%, чувствительность – 39,4%, специфичность – 61,1%), а максимальных значений все три показателя достигали при сочетанном морфологическом исследовании гистеробиоптатов, полученных при ФЦГС (95,5%, 92,8% и 96,2% соответственно).
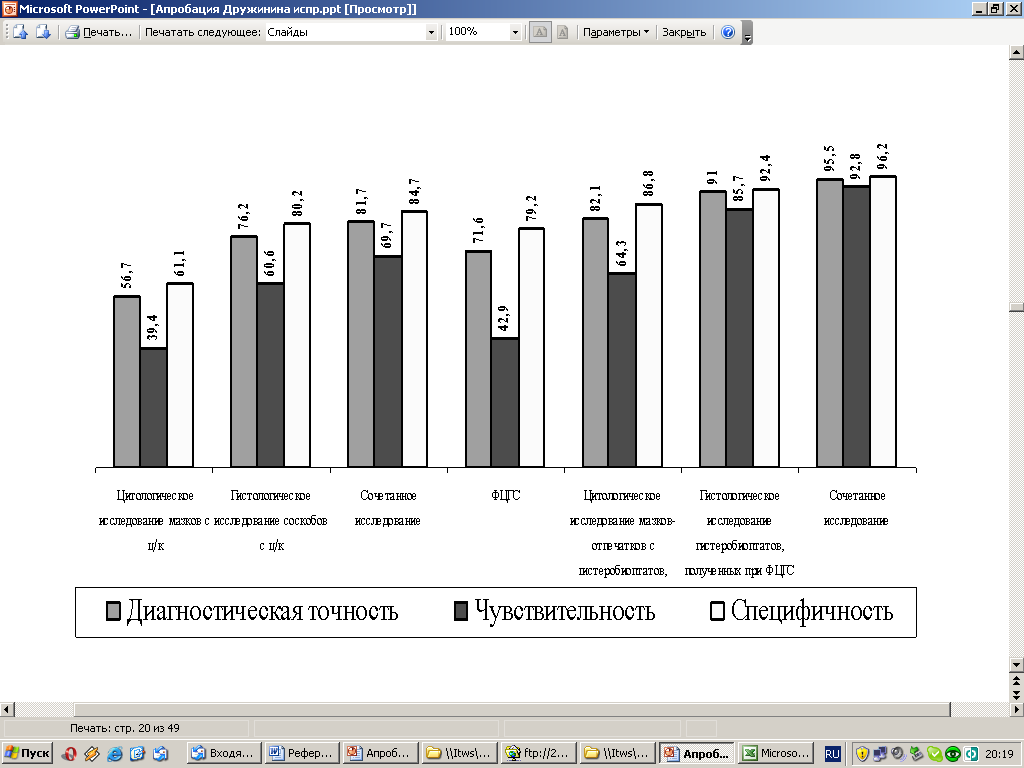
Рис. 6. Сравнительная эффективность различных методов диагностики перехода Т2 эндофитной формы РТМ (%).
При оценке эффективности диагностики перехода экзофитной формы РТМ на СОЦК видно, что результативность используемых методов диагностики выше по сравнению с эндофитной формой РТМ. При этом диагностическая точность – 74,7%, чувствительность – 66,7% и специфичность – 75,6% наблюдаются уже при гистологическом исследовании соскобов из цервикального канала и достигают 100% результативности при использовании сочетанного морфологического исследования гистеробиоптатов, полученных при ФЦГС (рис. 7).
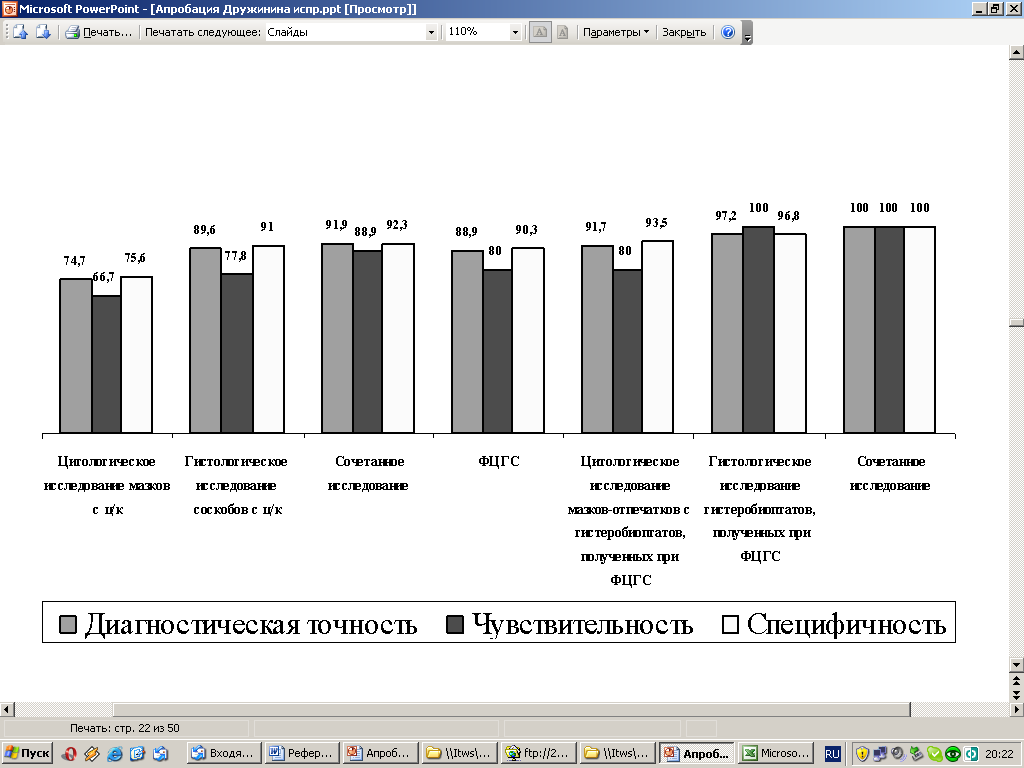
Рис. 7. Сравнительная эффективность различных методов диагностики Т2 экзофитной формы РТМ (%).
В настоящее время не подлежит сомнению, что организм человека обладает противоопухолевой иммунной и естественной резистентностью, а опухолевый рост сопровождается нарушением этих систем (Безрукова О.Д., 1986; Бохман Я.В., 2002; Вишневская Е.Е., 1994). Снижение или нарушение функции последних отражается на дальнейшем течении заболевания, поэтому при лечении злокачественных опухолей, наряду с основными методами (хирургический, химио- и лучевая терапии), применяется иммунностимуляция (Адамян Р.Т., 1998; Бохман Я.В. с соавт., 1979; Вишневская Е.Е., 1994).
Изучение иммунологического статуса у больных РТМ до начала лечения, в процессе комбинированной терапии и в отдаленные сроки после нее, включая феномен контрасупрессии с выявлением его прогностического значения показал, что у больных РТМ до начала лечения уже при I-II стадии наблюдается дисбаланс иммунной системы- параметров как естественного, так и приобретенного иммунного ответа, усугубляемых на этапах комбинированного лечения, особенно после ЛТ. Восстановление сниженных показателей неспецифической противоопухолевой и естественной иммунной реактивности до контрольного уровня у больных с I-II стадией происходит через 5 лет после лечения, а при III-IV стадии большинство показателей его так и не достигает. (Рис. 8.).
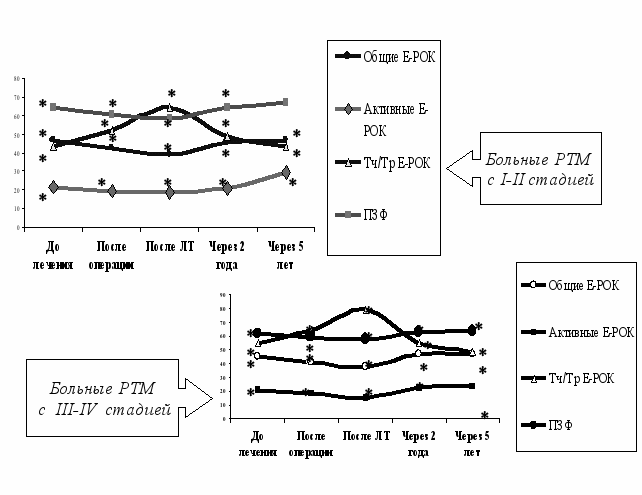 Рис. 8. Динамика показателей иммунологической реактивности у больных РТМ на этапах комбинированного лечения и в отдалённые сроки.
Рис. 8. Динамика показателей иммунологической реактивности у больных РТМ на этапах комбинированного лечения и в отдалённые сроки.Примечание: * - достоверность по сравнению с контролем (Р<0,05).
Проведен анализ различных методов иммунностимуляции. По данным литературы МТ обладает иммуномоделирующим действием, которое может вносить вклад в реализацию клинических эффектов посредством воздействия на регуляторные системы организма (Г.Н. Перфильева и соавт., 1983). Анализ эффективности МТ в качестве иммуностимулятора показал, что она нормализует показатели неспецифической противоопухолевой (Т-лимфоциты) и естественной иммунной резистентности (ФАНК, ГЗТ и титра лизоцима сыворотки крови), оказывая иммуннопротекторное воздействие только у больных РТМ с I-II стадией и только в отношении оперативного этапа комбинированного лечения (рис.9).
Возможно в основе получения эффекта стимуляции функциональной активности Т-лимфоцитов лежит усиление продукции цитокинов под воздействием магнитотерапи, которые способны вызывать стимуляцию пролиферации и дифференцировки лимфоцитов, а также их миграцию из лимфоидных органов в периферическую кровь (Златник Е.Ю. и соавт., 2004).
Одним из методов активной неспецифической стимуляции противоопухолевого иммунитета у онкологических больных является применение бактериальных антигенов - Corynebacterium parvum (C-parvum) (Бохман Я.В., 2002; Вишневский А.С. с соавт., 1990; Morice P., 2001) и вакцины БЦЖ (Вишневский А.С. и др., 1990; Friedenreich C.M., 2001), которая в настоящее время используется лишь для лечения опухолей мочевого пузыря (Chen S.S., 1999). На основании проведенных экспериментальных исследований впервые была обоснована возможность использования иммуномодулятора бактериальной природы – туляремийной живой вакцины у больных РТМ.
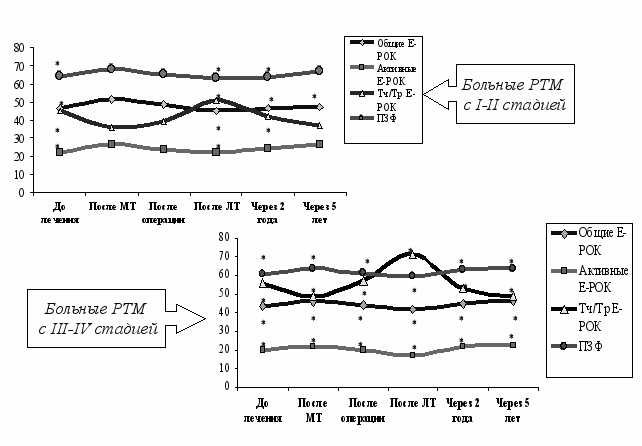
Рис. 9. Влияние МТ на динамику иммунологических показателей у больных РТМ в процессе комбинированного лечения и в отдалённые сроки
Примечание: * - достоверность по сравнению с контролем (Р<0,05).
Полученными результатами экспериментальных исследований в лаборатории канцеро- и мутагенеза НЦО им. В.А. МЗ РА было установлено, что предварительная (за 15 дней до введения цитостатиков) иммунизация животных-опухоленосителей ТЖВ снижает у них токсическое действие этих препаратов (Данилова А.Б. и др., 1998; Нерсесян А.К., 1997), повышает резистентность животных к патогенной флоре (Li Z. et al., 1998; Atzinger A., 2001; Fanning J., 2001; Eltabbakh G.H. et al., 2000) и радиорезистентность (Munkarah A., 2000), усиливает противоопухолевое действие ЛТ и удлиняет среднюю продолжительность жизни (Данилова А.Б. и др., 1998). Кроме того, было выявлено антиканцерогенное, противоопухолевое и антимутагенное действие ТЖВ, причем более выраженное, чем у вакцины БЦЖ (Данилова А.Б. и др., 1998; Myers E.R., 1999).
Иммунизация экспериментальных животных ТЖВ способствовала: синтезу специфических антител, интерферона-гамма (IFN-gamma), фактора некроза опухолей (TNF), интерлейкинов (IL) -2, -4, -6, -10 (Dilman V.M., 1994; Atzinger A., 2001; Cunha T.M. et al., 2001; Landoni F. et al., 1997 ). При этом было выявлено, что иммунитет начинает формироваться через 5-10 суток после вакцинации, и в эти же сроки начинает возрастать противоопухолевая резистентность организма (Данилова А.Б. и др., 1998). В отличие от других микробных штаммов, ТЖВ ни в одном случае не стимулировала рост опухолей.
Изучение механизма повышения неспецифической резистентности при иммунизации ТЖВ показало, что не протеины, а очищенные липополисахариды, выделенные из нее, играют важную роль в этом процессе (Kitchener H.C., 2001). В организме людей, иммунизированных ТЖВ, также обнаружены активация Т-клеток, синтез специфических антител, IFN-gamma, IL-2, -4 и TNF-alpha (Fanning J., 2001). При этом показано, что стимулятором Т-клеток является специфический липопротеин, находящийся в антигенной структуре микробов ТЖВ (Mariani A. et al., 2001). Кроме того, ТЖВ обладает эффективностью иммунизации, близкой к 100%, ее специфическая антигенная активность сохраняется до 5 лет. Длительное использование ТЖВ не выявило осложнений, связанных с вакцинацией (Данилова А.Б. и др., 1998).
На основании полученных данных было изучено влияние ТЖВ на динамику иммунологических показателей у больных РТМ в процессе комбинированного лечения и в отдалённые сроки (рис.10).
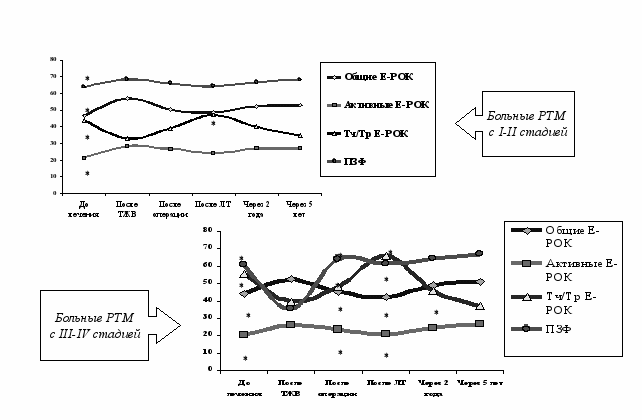
Рис. 10. Влияние ТЖВ на динамику иммунологических показателей у больных РТМ в процессе комбинированного лечения и в отдалённые сроки.
Примечание: * - достоверность по сравнению с контролем (Р<0,05).
Было выявлено что вакцинация ТЖВ статистически достоверно способствовала повышению показателей как естественного, так и приобретенного иммунного ответа, по сравнению с исходными данными, при всех стадиях опухолевого процесса, оказывает иммунопротекторное воздействие в отношении хирургического и лучевого этапов комбинированного лечения при I-II стадии, способствуя восстановлению всех иммунологических показателей через 2 года после лечения при I-II и через 5 лет - при III-IV стадии заболевания, возможно, что последнее может быть обусловлено наличием иммунносупрессирующих сывороточных факторов, которые выявляются на поздних стадиях опухолевого процесса (Бохман Я.В. с соавт., 1992).
Дополнительное применение иммуностимуляции ТВЖ у больных РТМ улучшает отдаленные результаты лечения этих больных, однако и их нельзя признать удовлетворительными (Бохман Я.В., 1976). Одна из вероятных причин резистентности к терапии может быть обусловлена тем, что опухолевые клетки как бы «окутываются» нитями фибрина наподобие «пленки», которая маскирует антигенные детерминанты их мембранных структур, вследствие чего они не распознаются иммунной системой организма как «чужеродные» (Бохман Я.В., 2002; Брауде И.Л., 1959). Кроме того, обволакивающий опухолевые клетки фибрин играет и барьерную роль — защищает их от атаки естественных и Т-киллеров и макрофагов (Джирш, Д.У., Флак Р.Е., 1982), тем более в свете данных, которые свидетельствуют о повышении содержания фибриногена крови у больных со злокачественными новообразованиями, и в частности у больных РТМ (Безрукова, О.Д. с соавт. 1986; Вишневская Е.Е.,. Бохман Я.В., 1994; Гуменюк Е.Г. с соавт., 1999). В связи с этим нами разработан метод иммунностимуляции больных РТМ, при котором иммунизация ТЖВ проводится на фоне антикоагулянтов.
Было изучено влияние иммунизации ТЖВ на фоне АК на динамику иммунологических показателей у больных РТМ в процессе комбинированного лечения и в отдалённые сроки (рис.11)
Анализ полученных данных свидетельствует, что иммунностимуляция ТВЖ на фоне АК нормализует изучаемые показатели и оказывает иммунопротекторное воздействие в отношении оперативного вмешательства при всех стадиях РТМ, а ЛТ – при I-II стадии. Нормализация параметров иммунной системы наблюдается через 2 года после окончания лечения при всех стадиях РТМ.
Достигнутый положительный эффект возможно является результатом того, что антикоагулянты, разрушая «окутывающую» опухолевые клетки фибриновую «пленку», создают беспрепятственные условия для воздействия на них Т- лимфоцитов, естественных киллеров и макрофагов организма на фоне иммунностимуляции. Соответственно, получены результаты, имеющие, прежде всего клиническое значение, косвенно свидетельствуют в пользу предположения об интимных механизмах данного эффекта.
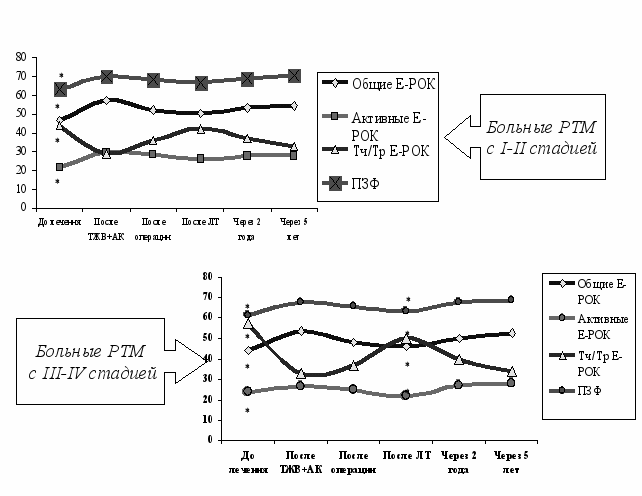
Рис. 11. Влияние ТЖВ на фоне АК на динамику иммунологических показателей у больных РТМ в процессе комбинированного лечения и в отдалённые сроки.
Примечание: * - достоверность по сравнению с контролем ( Р<0,05).
Кроме того, был впервые изучен эффект контрасупрессии лимфоцитов крови больных РТМ на ближайшие и отдаленные результаты комбинированного лечения. Данные об изучении контрасупрессии - как нового уровня иммунорегуляции представлены лишь в единичных работах (Бессемельцев С.С. с соавт., 2001; Бохман Я.В. с соавт., 1992; Гостищев В.К., Шалчкова Л.П., 2000). Было показано, что в популяции мононуклеаров человека присутствуют клетки, играющие большую роль в иммунологическом гомеостазе и выявлено нарушение взаимодействия в системе «супрессор - контрасупрессор» у этих больных. Не изученность индукции указанного эффекта при различных патологических состояниях и, в частности, при опухолевом росте возможно связано с отсутствием простого и удобного метода для его выявления и оценки.
Выявлено, что ЭКС также статистически значимо снижен уже при I-II стадии заболевания, а на этапах комбинированного лечения наблюдается его дальнейшее снижение. При этом возрастет процент больных с неопределявшимся у них ЭКС и статистически значимо – процент больных с инверсным эффектом, при котором имеется усиление супрессии, при III-IV стадии процесса (Рис. 12, 13).
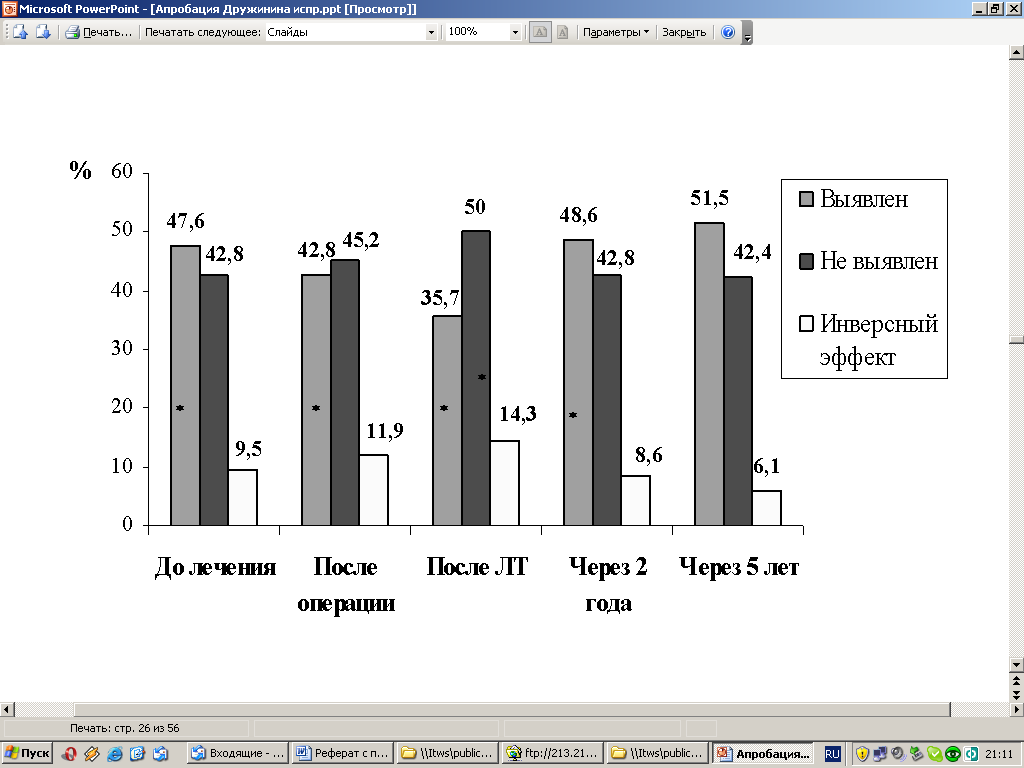
Рис. 12. Динамика ЭКС у больных РТМ с I-II стадией в процессе комбинированного лечения и в отдаленные сроки.
Примечание: * - достоверность по сравнению с контролем ( Р<0,05).
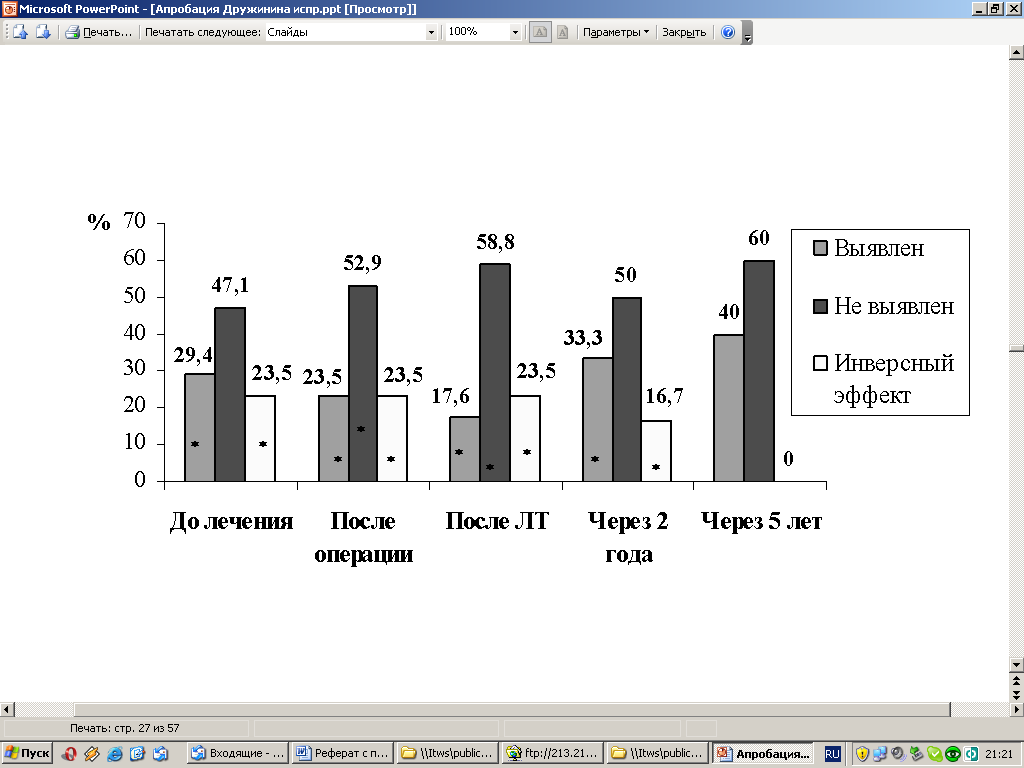
Рис. 13. Динамика ЭКС у больных РТМ с III-IV стадией в процессе комбинированного лечения и в отдаленные сроки (%).
Примечание: * - достоверность по сравнению с контролем (Р<0,05).
В то же время у больных с определявшимся ЭКС до лечения 5-летняя общая выживаемость была выше, чем у больных с неопределявшимся эффектом и статистически значимо, чем у больных с инверсным эффектом (Рис. 14).
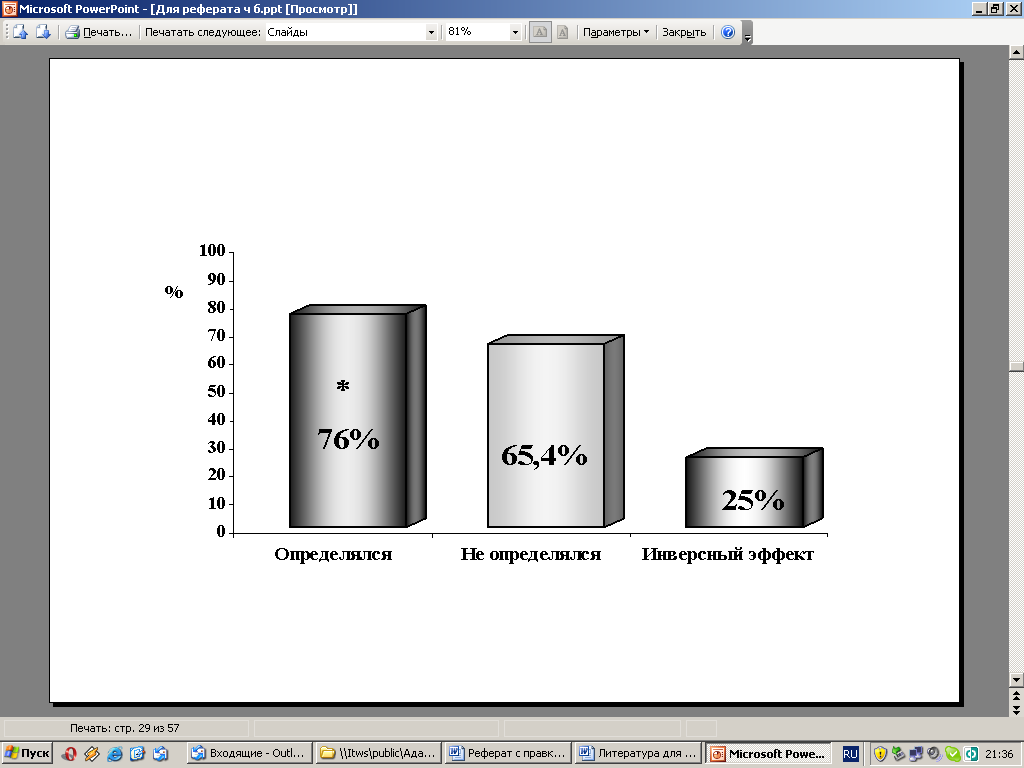
Рис. 14. Влияние ЭКС на 5-летнюю общую выживаемость больных РТМ
Примечание: * - Р<0,05 по сравнению инверсным эффектом.
Изучение влияния ТЖВ на ЭКС показало, что у больных РТМ во всех стадиях, иммунизированных ТЖВ на фоне АК до начала лечения процент больных с выявленным ЭКС повышается до нормы, оставаясь таким на обоих этапах комбинированного лечения при I-II стадии, а статистически значимого повышения инверсного эффекта (усиление супрессии), не наблюдается даже при III-IV стадии процесса (Рис. 15). Выявлено, что отдаленные результаты лечения оказались статистически значимо лучше у больных с выявленным эффектом контрасупрессии по сравнению с больными у которых указанный эффект не выявлялся и особенно с теми больными, у которых наблюдалась инверсия эффекта.
 Рис. 15. Влияние ТЖВ на фоне АК на ЭКС у больных РТМ в процессе комбинированного лечения и в отдалённые сроки.
Рис. 15. Влияние ТЖВ на фоне АК на ЭКС у больных РТМ в процессе комбинированного лечения и в отдалённые сроки.Примечание: * - достоверность по сравнению с контролем ( Р<0,05).
Следовательно, наличие эффекта контрасупрессии до начала комбинированного лечения является благоприятным прогностических фактором у больных РТМ.
Анализ отдалённых результатов лечения больных РТМ, получивших комплексную терапию с предварительной иммунизацией ТЖВ и ТВЖ на фоне АК и больными РТМ, получивших традиционное лечение выявил, что иммунизация ТЖВ на фоне АК по сравнению с больными, получившими иммунизацию только ТВЖ повышает 2-х, 3-х и 5-летную общую выживаемость и статистически значимо увеличивает ДБП при I-II стадии - 23,0±1,9 мес., в контроле – 18,2±1,4 мес. (Р<0,05) и СПЖПЛ при III-IV стадии – 2,8±0,4 года, в контроле – 1,7±0,3 года (P<0,05). А при сравнении с группой больных, получивших традиционное комбинированное лечение , различия в 2-х, 3-х и 5-летней общей выживаемости оказались ещё более выраженными, при этом ДБП статистически значимо увеличилась как при I-II стадии – 23,9±1,9 мес., в контроле – 16,2±2,5 мес. (P<0,05), так и при III-IV стадии – 14,2±1,9 мес., в контроле – 7,0±1,1 мес. (P<0,05) ( рис.16). СПЖПЛ также статистически значимо увеличилась как при I-II стадии – 3,9±0,6 года, в контроле – 2,1±0,5 года (Р<0,05), так и при III-IV стадии - 2,8±0,4 года, в контроле – 1,6±0,3 года (Р<0,05) (Рис. 17).
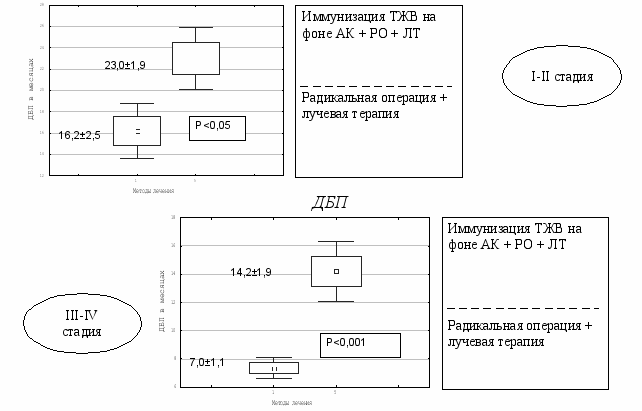
Рис.16. Длительность безрецидивного периода у больных РТМ, получивших комплексное лечение с иммунизацией ТВЖ на фоне АК.
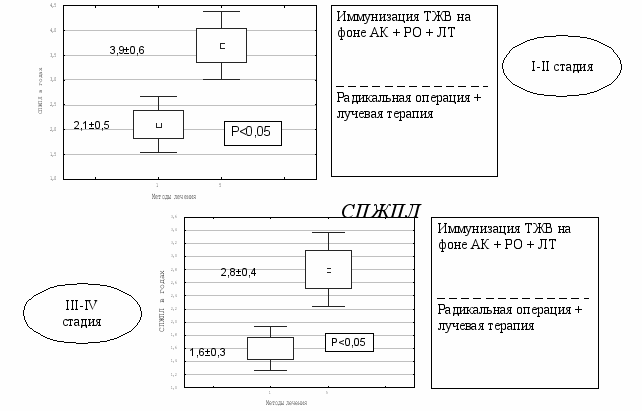
Рис. 17. Средняя продолжительность жизни после лечения у больных РТМ, получивших комплексное лечение с иммунизацией ТВЖ на фоне АК.
Таким образом, предварительная иммунизация ТЖВ больных РТМ на фоне АК существенно улучшает показатели отдаленных результатов лечения по сравнению с больными, у которых иммунизация ТЖВ проводилась без АК, и с больными без иммунизации.
При изучении влияния ТЖВ на ближайшие результаты комбинированного лечения больных РТМ было выявлено, что после предварительной иммунизации ТВЖ больных I-IV стадий показатель безосложнённого заживления операционной раны, в отличие от МТ, и контроля был статистически значимо выше, а после предварительной иммунизации ТЖВ, проведенной на фоне АК, уже все показатели заживления операционной раны передней брюшной стенки и культи влагалища были лучше чем в группе контроля (P<0,05) (Рис. 18).
Гормонотерапия атипической гиперплазии эндометрия и РТМ синтетическими прогестинами давно применяется не только как компонент комбинированного и комплексного лечения больных с указанной патологией, но и как самостоятельный метод терапии (Бохман Я.В. с соавт., 1979). Однако проводимая гормонотерапия далеко не всегда бывает эффективной (Бохман Я.В., 1976; Урманчеева, 2004) и возможно одной из причин может быть наличие нитей фибрина в виде пленки вокруг опухолевых клеток, которая защищает их от различных воздействий (Адамян Р.Т., 1998; Вишневская Е.Е., Бохман Я.В., 1994). Об этом косвенно можно судить по повышенным параметрам гемокоагуляционного потенциала крови у больных с атипической гиперплазией и раком эндометрия (Безрукова О.Д. с соавт., 1986; Брауде И.Л., 1959).
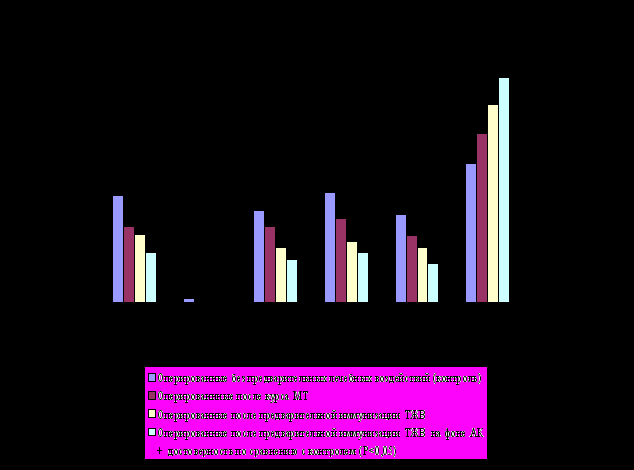
Рис. 18 Заживление операционной раны у больных РТМ при различных условиях проведения оперативного вмешательства
В связи с этим был разработан способ гормонотерапии на фоне антикоагулянтов. Апробация его показала, что в неоадъювантном режиме он статистически достоверно ускоряет редукцию клинических симптомов и улучшает показатели гормонального патоморфоза в опухоли, особенно при высокодифференцированной АКЭ по сравнению с гормонотерапией без АК, особенно при высокодифференцированной АКЭ. В адъювантном режиме повышает 2-х, 3-х и 5-летнюю общую выживаемость и статистически значимо удлиняет ДБП до 14,1±1,7 месяца, без АК 9,7±1,4 мес. (P<0,01) и СПЖПЛ до 2,6±0,4 года, без АК 1,6±0,1 года (Р<0,02) при III - IV стадии заболевания. А при сравнении с группой больных, получивших традиционную комбинированную терапию различия в 2-х, 3-х и 5-летней выживаемости оказались ещё большими, а ДБП и СПЖПЛ были статистически значимо выше уже как при I-II, так и при III-IV стадиях процесса. ДБП при I-II стадии составила – 23,6±2,8 мес., в контроле 16,2±2,3 мес. (Р<0,01) , 14,1±1,7 мес. при III-IV стадии, в контроле – 7,0±1,1 мес. (Р<0,001) ( рис.19). Средняя продолжительность жизни после лечения у больных I-II стадии составила 3,4±0,4 года, в контроле – 2,1±0,5 года (Р<0,008) и 2,6±0,4 года при III-IV стадии, в контроле – 1,6±0,3 года (Р<0,02) (Рис. 20).
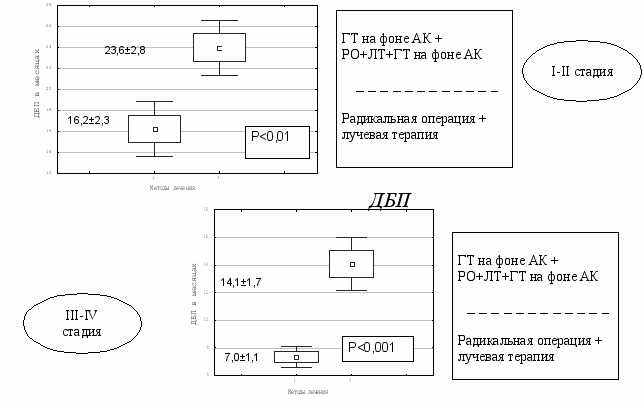 Рис.19. Длительность безрецидивного периода у больных РТМ, получивших комплексное лечение с гормонотерапией на фоне АК.
Рис.19. Длительность безрецидивного периода у больных РТМ, получивших комплексное лечение с гормонотерапией на фоне АК.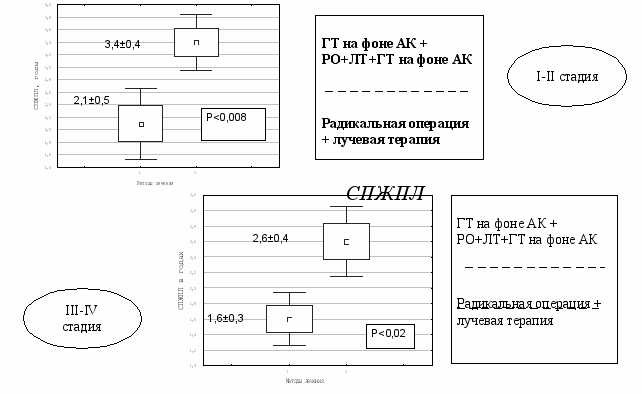
Рис. 20 Средняя продолжительность жизни у больных РТМ, получивших комплексное лечение с гормонотерапией на фоне АК.
Применение этого метода позволило также сократить частоту тромбоэмболических осложнений у больных РТМ – до 9,3%, тогда как при проведении гормонотерапии без АК она составила 18,8% (P<0,05).
С целью профилактики интра- и послеоперационных осложнений у больных РТМ были разработаны и апробированы новые способы выполнения основных этапов хирургических операций, применяемых при этой патологии: пересечения и лигирования связочного аппарата матки и придатков, идентификации мочеточников, лигирования сосудов в глубине малого таза, ушивания культи влагалища с дренированием параметриев, перитонизации и ушивания операционной раны передней брюшной стенки. Оптимизация основных этапов оперативных вмешательств позволило исключить повреждение мочеточников, уменьшить общую кровопотерю до 415±48 мл, в контроле – 562±56 мл (Р<0,05), укоротить на 20-30% время выполнения основных оперативных вмешательств у этих больных (Р<0,05) и статистически значимо увеличить безосложненное течение послеоперационного периода – 79,2%, в контроле – 47,3% (Р<0,05) (рис.21). Разработанный способ лечения послеоперационной атонии мочевого пузыря позволяет восстановить мочеиспускание у всех оперированных больных по поводу ТРМ.
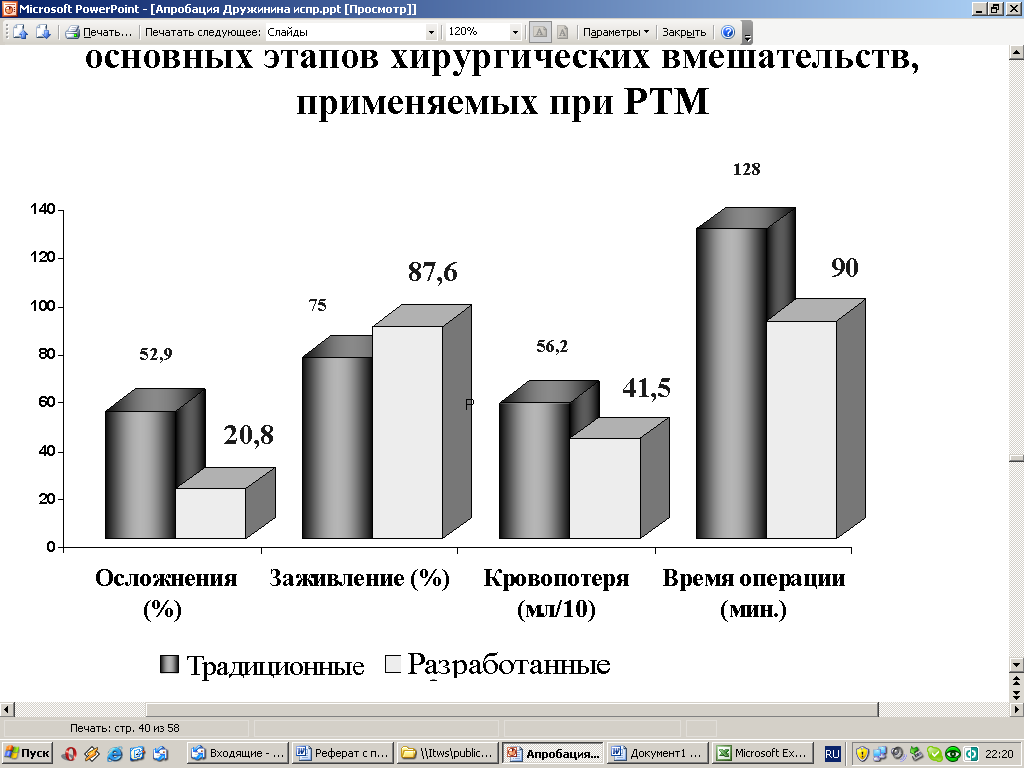
Рис. 21. Эффективность разработанных способов выполнения основных этапов хирургических вмешательств, применяемых при РТМ
Проведен сравнительный анализ разработанных способов лечения больных РТМ. Было показано, что наиболее оптимальной схемой комплексного лечения больных РТМ является иммунизацию ТЖВ на фоне АК + радикальная операция + лучевая терапия + гормонотерапию 17-ОПК на фоне АК. Оценка его эффективности показала, что он статистически значимо повышает 2-х, 3-х и 5-летнюю общую выживаемость (рис.22), удлиняет ДБП (рис.23) и СПЖПЛ (рис.24) по сравнению с традиционным способом лечения больных РТМ.
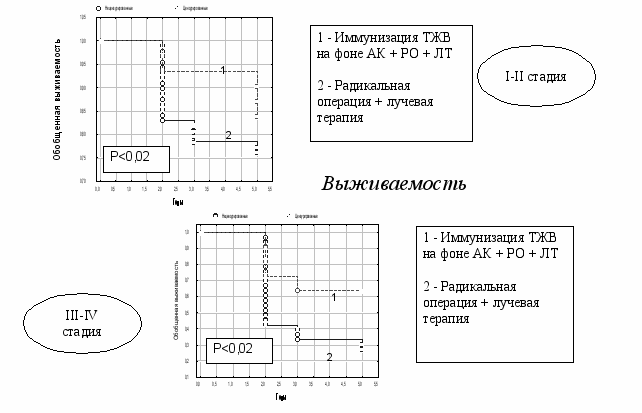
Рис. 22. Общая 2-х, 3-х и 5-летняя выживаемость у больных РТМ, получивших комплексное лечение по схеме: ТВЖ на фоне АК + радикальная операция + лучевая терапия + гормонотерапия на фоне АК.
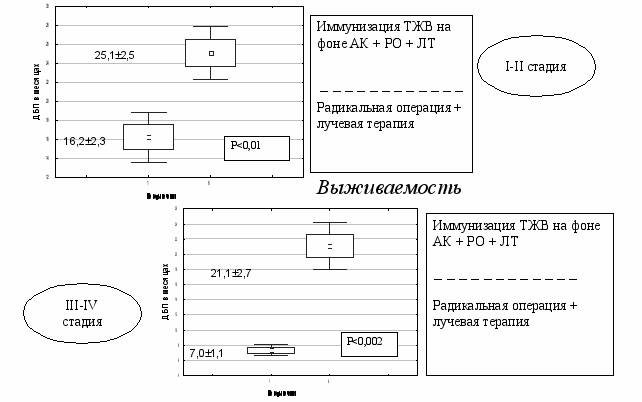
Рис.23. Длительность безрецидивного периода у больных РТМ, получивших комплексное лечение по схеме: ТВЖ на фоне АК + радикальная операция + лучевая терапия + гормонотерапия на фоне АК.
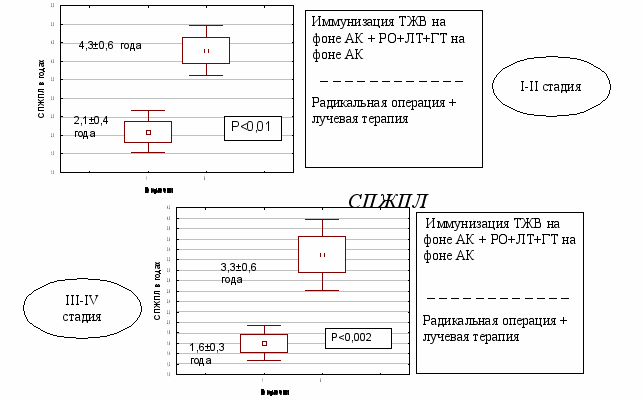
Рис. 24. Средняя продолжительность жизни после лечения у больных РТМ, получивших комплексное лечение схеме ТВЖ на фоне АК + радикальная операция + лучевая терапия + гормонотерапия на фоне АК.
Таким образом, выявление дополнительных факторов онкологического риска РТМ, усовершенствование методов его диагностики, разработка новых способов выполнения основных этапов оперативных вмешательств, применяемых при этой патологии, а также новых методов иммуностимуляции и гормонотерапии с оптимизацией схем лечения, позволяют улучшить как диагностику, так и эффективность лечения больных РТМ.
