Стратегия и тактика лучевой терапии в многокомпонентном лечении местно-распространенного рака шейки матки (14. 01. 13 лучевая диагностика, лучевая терапия 14. 01. 12 онкология)
| Вид материала | Автореферат |
- Адъювантная лучевая терапия рака желудка. 14. 00. 14 онкология 14. 00. 19 лучевая диагностика,, 304.24kb.
- Лучевая терапия различными видами ионизирующего излучения в комплексном лечении больных, 785.18kb.
- Ультразвуковое исследование в комплексной лучевой диагностике злокачественных опухолей, 485.88kb.
- Современная тактика системной радиотерапии хлоридом стронция-89 в комплексном лечении, 651.21kb.
- Учебно-методическая карта дисциплины, 62.2kb.
- Комплексная лучевая диагностика в оценке репаративного процесса при лечении больных, 429.1kb.
- Нейтронная и нейтронно-фотонная терапия злокачественных новообразований слюнных и щитовидной, 340.88kb.
- Селиверстов Павел Владимирович лучевая диагностика диспластически-дистрофического синдрома, 488.65kb.
- Селиверстов Павел Владимирович лучевая диагностика диспластически-дистрофического синдрома, 488.95kb.
- Мр-маммография в планировании объема хирургического лечения рака молочной железы 14., 324.55kb.
На правах рукописи
КРЕЙНИНА Юлия Михайловна
СТРАТЕГИЯ И ТАКТИКА ЛУЧЕВОЙ ТЕРАПИИ
В МНОГОКОМПОНЕНТНОМ ЛЕЧЕНИИ
МЕСТНО-РАСПРОСТРАНЕННОГО РАКА ШЕЙКИ МАТКИ
(14.01.13 – лучевая диагностика , лучевая терапия
14.01.12 – онкология)
rncrr.ru
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
Москва - 2011
Работа выполнена в ФГБУ «Российский научный центр рентгенорадиологии» Минздравсоцразвития России (директор – член-корреспондент РАМН, д.м.н., профессор В.А.Солодкий)
Научные консультанты:
академик РАМН, профессор Харченко Владимир Петрович
доктор медицинских наук, профессор Титова Вера Алексеевна
Официальные оппоненты:
Доктор медицинских наук Демидова Л.В.
Доктор медицинских наук, профессор Кузнецов В.В.
Доктор медицинских наук, профессор Возный Э.К.
Ведущее учреждение:
ФГБУ «Научно-исследовательский институт онкологии им. Н.Н.Петрова» Минздравсоцразвития России
Защита диссертации состоится « 26 » декабря 2011 года в _____ часов на заседании Диссертационного совета Д.208.081.01 при ФГБУ «Российский научный центр рентгенорадиологии» Минздравсоцразвития России по адресу: 117997, г. Москва, ул. Профсоюзная, д. 86.
С диссертацией можно ознакомиться в библиотеке ФГБУ «РНЦРР» Минздравсоцразвития России (117997, г. Москва, ул. Профсоюзная, д. 86)
Автореферат разослан « » ноября 2011 г.
Ученый секретарь диссертационного совета,
доктор медицинских наук, профессор Цаллагова З.С.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ.
Актуальность проблемы.
Эффективное лечение местно-распространенных форм рака шейки матки (РШМ) остается одной из важнейших медико–социальных задач современной онкогинекологии. По данным ВОЗ (2006), ежегодно в мире выявляется около 370 000 новых случаев заболевания, приводящего к смерти 250 000 женщин в год, из которых 190 000 (51,4%) умирают от РШМ в течение первого года с момента установления диагноза (WHO,2006; Jemal A., 2010). В РФ за последние 7 лет число женщин с впервые установленным РШМ выросло на 8%, составляя в среднем 12 215 случаев в год, до 40% которых представлены запущенными формами заболевания (41,2% – в 2002 г., 40,6% – в 2007 г.). Анализ динамики показателей смертности от РШМ в РФ также не демонстрирует за указанный период отчетливой тенденции к снижению, составляя 5,2-5,3 на 100 000 женского населения в год, причем в некоторых регионах отмечено превышение этих показателей (Мерабишвили В.М., Урманчеева А.Ф., 1999; Давыдов М.И., Аксель Е.М., 2007; Важенин А.В. с соавт., 2010; Чиссов В.И., Старинский В.В., 2010).
Особую опасность представляет распространенность данного заболевания среди молодых женщин до 40 лет. За период с 1990 года по 2007 год в возрастной группе 15 – 24 года заболеваемость РШМ в РФ увеличилась в 4 раза, в группе 25–34 года – в 2,5 раза,; при этом смертность от РШМ в возрастных категориях 20–29 и 30–39 лет увеличилась за 15 лет в различных регионах страны в 1,5 – 2,2 раза, являясь основной причиной смерти от онкологического заболевания в указанной возрастной категории (Новикова Е.Г. с соавт., 2000, 2008; Урманчеева А.Ф., 2002; Ашрафян Л.А. с соавт., 2003, 2004, 2008; Демидова Л.В. с соавт., 2005, 2008; Кузнецов В.В., 2005; Чиссов В.И. с соавт., 2010).
В целом, в настоящее время в РФ до 70% больных РШМ подвергаются лечению по поводу опухоли, выходящей за пределы органа и имеющей признаки местного распространения на прилежащую клетчатку, влагалище, лимфатические узлы таза и брюшной полости (Костромина К.Н., 1999; Титова В.А. с соавт., 2003, 2006; Ашрафян Л.А. с соавт., 2004, 2008; Демидова Л.В., Бойко А.В., 2006, 2008; Кузнецов В.В., Морхов К.Ю., 2007; Крикунова Л.И. с соавт., 2010). Единственным стандартизованным методом лечения местно-распространенного рака шейки матки (МРРШМ) в течение многих десятилетий является сочетанная лучевая терапия, отдаленные результаты которой в целом невысоки и не превышают по данным отчетов Cochrane Database 65% для II-й и 47% – для III cтадии заболевания (Green J., 2005).
Расширение границ курабельности, улучшение показателей выживаемости и качества жизни больных МРРШМ связываются большинством исследователей с расширением показаний к многокомпонентному лечению, с включением в программы химиотерапии и хирургических вмешательств радикального и сверхрадикального объема (Вишневская Е.Е., Косенко И.А., 1999; Максимов С.Я., Гусейнов К.Д., 2003; Кузнецов В.В. с соавт., 2005; Ашрафян Л.А. с соавт., 2007; Крикунова Л.И. с соавт., 2010; Benedetti–Panici P., 2002, 2007; Bartelink H., 2002; Fowler J.,2004, Eifel P.,2004; Park D.C.,2009). Активное использование, начиная с 90х годов, в программах терапии МРРШМ цитостатиков в различных сочетаниях позволило констатировать в последнее десятилетие рост абсолютного числа больных РШМ, подвергающихся комбинированному и комплексному лечению. Вместе с тем в этот же период отмечено снижение на 15 - 20% числа больных, закончивших лечение первоначально запланированного объема при объективно регистрируемом росте первичной неизлеченности (Аксель Е.М., 2004; Кандакова Е.Ю., 2002; Максимов С.Я., 2004; Чиссов В.И., Старинский В.В., 2009; Bloss J.D.., 1995; Lopes–Graniel C., 2001; Grigsby P., 2001; Narayan K., 2008). Недостаточный учет преимущественных видов токсичности применяемых цитостатиков, отсутствие объективных критериев выбора варианта многокомпонентного лечения, формальные принципы планирования и реализации лучевой терапии в режимах, разработанных для принципиально иных клинических ситуаций, признаны ведущими причинами, снижающими эффективность проводимого многокомпонентного лечения, особенно на этапе внедрения предлагаемых программ в практическое здравоохранение.
В тоже время радиологические возможности в эффективной терапии этого заболевания отнюдь не исчерпаны и используются далеко не полностью. Бурное развитие медицинской техники, создание и внедрение в практику принципиально нового оборудования для дистанционного и контактного облучения, появление целого спектра аппаратов для высокоточной визуализации органов и тканей и современных компьютерных технологий для обработки данных обуславливают техническую возможность достижения стойкого излечения и полноценной реабилитации женщин с запущенными формами РШМ. Однако, различия в техническом оснащении и технологическом обеспечении самого радиологического воздействия, предлучевых этапов, проблемы унификации лечебного процесса и воспроизводимости методик, существенно влияют на результаты (Костромина К.Н., 2001; Бойко А.В., Демидова Л.В., 2002; Марьина Л.А. с соавт., 2008; Кравец О.А., 2010; Ling C., 2006; Narayn K., 2008).
Таким образом, в настоящее время назрела необходимость в формировании рационального, медицински и экономически обоснованного подхода к лечению МРРШМ, ключевым моментом которого является разработка эффективной стратегии и тактики лучевого компонента терапии.
Цель исследования.
Улучшение результатов лечения больных МРРШМ путем разработки эффективной
стратегии лучевого этапа и принципов ее индивидуальной реализации в программах многокомпонентного лечения МРРШМ.
Задачи исследования.
- Определить принципы формирования программ облучения при различных вариантах многокомпонентного лечения МРРШМ.
- Оптимизировать комплекс топометрической подготовки и мониторинга лучевой терапии в многокомпонентном лечении МРРШМ на основе синтеза данных ультразвуковой, рентгеновской компьютерной и магнитно–резонансной томографии.
- Разработать стратегию и тактику внутриполостного и дистанционного этапов послеоперационной лучевой терапии в многокомпонентном лечении оперированных больных МРРШМ.
- Обосновать стратегию и тактику проведения внутриполостного и дистанционного этапов сочетанной лучевой терапии в программах химио-лучевого лечения МРРШМ – после неоадъювантной химиотерапии и в едином курсе с химиотерапией.
- Разработать методики проведения радикальной сочетанной лучевой терапии МРРШМ в условиях локальной радиомодификации – пролонгированной химиорадиомодификации, лазериндуцированной гипертермии, криогипотермии.
- Оценить непосредственные, ближайшие и отдаленные результаты исследуемых программ многокомпонентного лечения МРРШМ и дать их сравнительную характеристику.
- Оценить характер, частоту, степень тяжести и сроки развития осложнений исследуемых программ многокомпонентного лечения МРРШМ и дать их сравнительную характеристику.
Научная новизна.
Впервые при МРРШМ научно обоснованы и адаптированы применительно к отечественной клинической практике методики визуально–контролируемой лучевой терапии, разработаны оригинальные комплексы предлучевой подготовки и мониторинга лучевой терапии в рамках многокомпонентного лечения МРРШМ на основе оптимизации сочетания ультразвуковой, рентгеновской компьютерной и магнитно-резонансной томографии. Определены современные принципы формирования программ лучевой терапии в многокомпонентном лечении МРРШМ на основании индивидуальных карт учета клинико-морфологических факторов прогноза, дана статистическая оценка влияния выделенных факторов на отдаленные результаты лечения. Разработаны стратегия, тактика и сформированы алгоритмы проведения лучевой терапии в многокомпонентном лечении оперированных и неоперированных больных МРРШМ на основе индивидуального выбора и коррекции параметров облучения с учетом профиля токсичности используемых цитостатиков, результатов предлучевых этапов лечения, динамики опухоли в ходе реализации терапевтической программы. На репрезентативном клиническом материале – 828 больных МРРШМ – в рамках одноцентрового исследования проведена сравнительная оценка эффективности вариантов многокомпонентного лечения МРРШМ, статистически обоснованы принципы предпочтительного их применения. Разработана методика и научно обоснована целесообразность расширения объема дистанционной лучевой терапии с симультантным облучением параааортальных лимфатических узлов без пролонгации лучевого этапа у оперированных и неоперированных больных МРРШМ при высоком риске лимфогенного метастазирования. Разработаны принципиально новые для лечения МРРШМ методики локальной радиомодификации – пролонгированной химиорадиомодификации с применением текстильных депо-систем, криогипотермии, лазериндуцированной гипертермии (ЛИГТ), проведена комплексная сравнительная оценка результатов применения, статистически определена целесообразность приоритетного использования ЛИГТ в качестве радиомодификатора при МРРШМ. Дана сравнительная оценка характера, частоты, степени тяжести, сроков развития токсических реакций, ранних и поздних осложнений при различных вариантах многокомпонентного лечения МРРШМ в соответствии с международными классификациями, статистически обоснованы противопоказания и ограничения к применению различных программ многокомпонентного лечения МРРШМ.
Практическая значимость.
Комплексный анализ клинико–морфологических факторов прогноза на каждом из этапов лечения МРРШМ с формированием индивидуальных карт учета позволяет объективизировать параметры выбора и коррекции программ терапии и рационализировать расходы на многокомпонентное лечение МРРШМ. Реализация лучевой терапии в программах многокомпонентного лечения МРРШМ в рамках предлагаемых научно обоснованных алгоритмов – с дифференцированным выбором разовых и суммарных очаговых доз, объемов и ритма облучения, сроков начала, длительности курса и последовательности его этапов, оптимизацией терапии сопровождения, в том числе с применением оригинального озоно–лазерного комплекса для немедикаментозной профилактики и коррекции осложнений – стойко улучшает на 20–30% общие результаты лечения больных МРРШМ с повышением на 35–40% уровня локального контроля. Предлагаемые программы не требуют при внедрении в клиническую практику принципиально нового аппаратурного оснащения, воспроизводимы на радиотерапевтических установках различных поколений, позволяют оптимизировать трудовые затраты персонала радиологических и смежных диагностических служб и формировать экономичные режимы продуктивного использования высокотехнологичного оборудования. Внедрение новой методики локальной радимодификации – ЛИГТ – расширяет терапевтический интервал и общие границы курабельности больных МРРШМ, на 15% повышая общую эффективность самостоятельного лучевого лечения без системного применения цитостатиков.
Основные положения, выносимые на защиту.
- Современная стратегия эффективного лечения МРРШМ требует перехода от конвенциальной лучевой терапии к многокомпонентным программам на основе сочетания модифицированных вариантов облучения с неоадъювантной химиотерапией и при наличии условий – с радикальным хирургическим вмешательством. Для выбора и коррекции варианта многокомпонентного лечения при МРРШМ необходим комплексный анализ клинико-морфологических факторов прогноза у каждой больной с формированием индивидуальных карт их учета до начала лечения и на каждом из его этапов.
- Современным стратегическим принципом, определяющим тактику проведения лучевых этапов в рамках многокомпонентного лечения оперированных и неоперированных больных МРРШМ, является дифференцированный в соответствии с результатами анализа клинико-морфологических факторов выбор объемов облучения, разовой и суммарной очаговых доз, способов их подведения, вариантов профилактики и коррекции осложнений. Технологическую основу данной стратегии составляют адаптированные методики визуально-контролируемой лучевой терапии с интеграцией современных ультразвуковых технологий в стандарт топометрии и мониторинга.
Внедрение результатов исследования.
Основные результаты исследования одобрены и внедрены в практику Российского научного центра рентгенорадиологии Минздравсоцразвития РФ в виде внутреннего протокола лечения РШМ (С53/10), используются при подготовке специалистов в рамках первичной специализации по специальностям «Акушерство и гинекология», «Онкология», «Радиология» и на циклах повышения квалификации, проводимых на базе РНЦРР, оформлены в виде новых медицинских технологий – «Послеоперационная сочетанная лучевая терапия у больных местно-распространенным раком шейки матки с учетом клинико-морфологических факторов прогноза» (ФС №2009/151 от 15.06.2009), «Многокомпонентные программы лечения рака шейки матки, вульвы, влагалища и прямой кишки в условиях радиосенсибилизирующего действия локальной лазерной гипертермии» (ФС №2009/389 от 25.11.2009),«Комплексная коррекция осложнений многокомпонентного лечения злокачественных опухолей различных локализаций с использованием озонотерапии и низкоинтенсивного лазерного излучения» (ФС №2009/391 от 25.11.2009), разрешенных с 2009 года к применению в лечебных учреждениях практической сети, внедрены в клиническую практику Челябинского областного клинического онкологического диспансера, Калужского областного онкологического диспансера, отделения онкогинекологии ГКБ №57 г. Москвы.
Апробация работы.
Основные положения диссертационной работы были представлены и обсуждены на международном конгрессе Невский радиологический форум «Наука - клинике» (г. С.-Петербург, 2005), Всероссийском Научном форуме «Радиология – 2005» (г. Москва, 2005), научной конференции «Физико-технические проблемы и гарантии качества лучевой терапии» (г. Обнинск, 2006г.), Всероссийской научно-практической конференции «Высокие медицинские технологии» (Москва, 2007г.), ХII онкологическом конгрессе (г. Москва, 2008г.), на заседании Московского Общества Онкологов (г. Москва, 2008), научно–практической конференции РНЦРР (г. Москва, 2008г.), Международном конгрессе по онкохирургии (г. Краснодар, 2008), на Европейской школе онкологов (г. Москва, 2009), Всероссийской конференции онкологов (г. Челябинск, 2010г.), на конгрессах Европейского Общества по Гинекологической Онкологии (ESGO 14th–16th Biennial Meetings) в 2005-2009гг, Международного Общества по Гинекологическому Раку (IGCS 10th – 14th Biennial Meetings) в 2006 – 2010гг, Европейского Общества Терапевтических и Радиационных Онкологов (ESTRO–25, Leipzig, 2006), Американского Общества по Брахитерапии (ABS) (Chicago, 2007, San Diego, 2011), Первом Всемирном Конгрессе по Брахитерапии (1st World Brachytherapy Congress, г. Бостон, 2008), 13м Международном Конгрессе Европейской Медицинской Лазерной Ассоциации (13th International Congress of the European Medical Laser Association, г. Хельсинки, 2008). Апробация диссертационной работы состоялась на научно–практической конференции ФГБУ «РНЦРР» Минздравсоцразвития РФ 30 мая 2011 года.
Публикации.
По теме диссертации опубликовано 59 печатных работ, в том числе одна монография, 15 статей в российских рецензируемых научных журналах, рекомендованных ВАК, в том числе в 5 журналах с международным цитированием, 43 тезиса докладов в материалах российских (25) и зарубежных (18) конференций и конгрессов 2001–2011годов. Доклад ‘Optimal integration of 3D-sonography and MRI in gynecological brachytherapy (GYN-BT) image-guided individual planning’ (Оптимальная интеграция трехмерной эхографии и МРТ в индивидуальном визуально–контролируемом планировании брахитерапии гинекологического рака) был отмечен как лучшая презентация на 12м Биеннале Международного Общества по Гинекологическому Раку (IGCS–12), г.Бангкок, 2008. На методики лучевого лечения в условиях локальной химиорадиомодификации с использованием текстильных депо-систем «Колетекс» в 2004 году получены патенты на изобретения РФ (№2268763 «Способ лечения рака шейки матки с экзофитной формой опухоли» от 27 июня 2004 года; №2268724 «Способ лечения онкологических больных с опухолевым поражением влагалища» от 25 июня 2004 года).
Объем и структура диссертационной работы.
Диссертация написана на русском языке, изложена на 300 страницах машинописного текста, иллюстрирована 67 рисунками, 45 таблицами. Работа состоит из введения, обзора литературы, семи глав собственных исследований, заключения, выводов, практических рекомендаций и указателя литературы, включающего 145 отечественных и 220 зарубежных источников.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ.
Материалы и методы исследования.
Общая характеристика клинического материала.
Настоящее исследование носило характер одноцентрового нерандомизированного проспективно-ретроспективного с историческим контролем; основным критерием включения служило проведение лучевой терапии в рамках первичного противоопухолевого лечения МРРШМ без признаков отдаленного органного метастазирования. Под определение МРШРМ подпадали больные Ib2–IVb стадий, в окончательный анализ включено 828 больных.
В основе качественной и количественной характеристики клинического материала лежали данные клинико-инструментального и лабораторного обследований, выполнявшихся в соответствии с федеральными стандартами РФ и внутренними протоколами РНЦРР. Ультразвуковые исследования выполнялись на ультразвуковом сканере «Voluson 730 Pro» (General Electric Medical Systems, Австрия), компьютерная томография (КТ) – на компьютерном томографе Asteion (Toshiba), магнитно–резонансная томография (МРТ) – на томографах «Open Pro View» (Marconi) с напряженностью магнитного поля 0,23Тл и «Signa» (GЕ) 1,5Тл. Рентгентопометрия и КТ–топометрия в режиме cone beam проводилась на аппарате «Simulix HQ» (Nucletron). Анализ данных проводился с помощью стандартных методов медико–биологической статистической обработки с использованием программного обеспечения для ПК (SPSS 19, SAS 8.0 для Windows, Biostatistics Version 4.3).
Основную группу (500 чел.) составили две подгруппы: послеоперационной лучевой терапии (ПОЛТ) − 246(49,2%) пациенток, консервативного лечения –254(50,8%) пациенток. В подгруппу ПОЛТ вошли больные МРРШМ после хирургического этапа, проведенного в рамках комбинированного лечения (M–КОМБ) у 152(61,8%)чел., комплексного лечения (КОМПЛ) с этапом неоадъювантной полихимиотерапии (НАХТ) – у 94(38,2%) чел.. В подгруппу консервативного лечения были включены 112(44,1%) пациенток с химио-лучевым вариантом терапии (ХЛЛ), у которых в едином (C–ХЛЛ) или последовательном (П–ХЛЛ) с сочетанной лучевой терапией курсе применялась системная полихимиотерапия, а также 142(55,9%) больные, получившие курс радикальной сочетанной лучевой терапии в условиях локальной радиомодификации (ЛРМ), в том числе в виде локальной химиорадиомодификации (ЛХРМ) – 52(36,6%) пациентки, локальной лазериндуцированной гипертермии (ЛИГТ) – 65(45,8%) пациенток, локальной криогипотермии (КГТ) – 25(17,6%) пациенток. Контрольную группу составили 328 больных МРРШМ после конвенциального лечения, проводившегося в РНЦРР в 1986-2000 гг., из них 232 чел. после радикальной сочетанной лучевой терапии (РСЛТ), 96 чел. – после комбинированного лечения (КОМБ).
Возраст больных варьировал от 16 до 86 лет в основной и от 18 до 84 лет – в контрольной группах. Группы были сопоставимы по возрасту, значимых различий между группами по повозрастному распределению не выявлено (Р>0,05). Средний возраст больных в основной группе составил 51 + 11,3 лет, медиана 49 лет, в контрольной − 54 + 14,2 лет, медиана 52 года. В обеих группах преобладали пациентки репродуктивного и перименопаузального возраста (74% − в основной, 72,9% − в контрольной группах), более трети заболевших в каждой группе составляли женщины моложе 40 лет (32,8% в основной, 32,4% - в контрольной группах). Значимой зависимости выбора метода лечения от возраста в основной группе не выявлено (Р>0,05), хотя прослеживается тенденция к сокращению доли больных, подвергнутых хирургическому вмешательству и ПХТ по мере нарастания возраста. В контрольной группе у больных моложе 40 лет прослеживается отчетливая тенденция к преобладанию комбинированного лечения с хирургическим компонентом; во всех возрастных группах старше 50 лет в этот период превалировала радикальная сочетанная лучевая терапия.
Распределение больных по стадиям в основной и контрольной группах достоверно не отличалось (Рис.1). Пациентки с Ib2 и IIa стадией заболевания включались в настоящее исследование только при первичном выявлении опухоли более 4см в наибольшем измерении; пациентки с IVb стадией включались только в случаях выявления верифицированных метастазов в парааортальные, шейные или паховые лимфатические узлы, поэтому в исследование вошли преимущественно пациентки с IIa–b – 288 (34,8%) и IIIa–b – 375 (45,3%) стадиями. Также в соответствии с критериями включения в исследование входили 129(15,6%) больных Ib2 и 36(4,3%) больных IVa–b стадии.
Анализ зависимости выбора метода лечения от стадии заболевания (Рис.2), отмечено достоверно большее число больных Ib2 стадии в подгруппах комбинированного лечения основной и контрольной групп по сравнению с другими подгруппами (Р<0,01), хотя более 60% больных и в этих подгруппах имели по формальным признакам первично неоперабельные опухолевые процессы; по постадийной структуре подгруппы комбинированного лечения основной и контрольной групп достоверно не отличались.
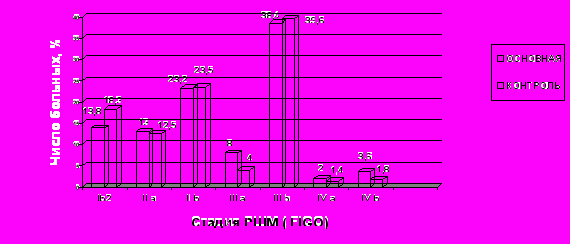
Рис. 1. Распределение больных МРРШМ по стадиям в соответствии с классификацией FIGO, 2009, в основной и контрольной группах.
Наиболее тяжелый по распространенности опухоли контингент больных в основной группе концентрировался в подгруппах комплексного (КОПМЛ) и химио–лучевого лечения (ХЛЛ). В целом по тяжести контингента леченых основная и контрольная группы были сопоставимы (Р>0,05 при всех сравнениях).
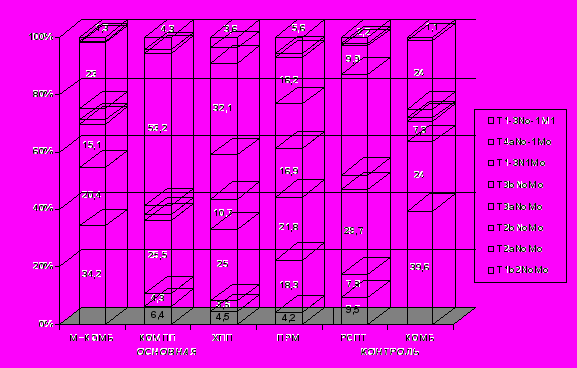
Рис. 2. Распределение больных по стадиям TNM в соответствии с вариантом лечения в основной и контрольной группах.
Преобладающее число пациенток, входивших в исследование, характеризовалось неблагоприятными формами роста первичной опухоли: у 555(67%) из них выявлялись опухоли с эндофитной и смешанной формой роста, затрудняющей адекватную клиническую оценку распространенности; у 116(14%) больных определялись инфильтративно–язвенные формы, отличающиеся неблагоприятным клиническим течением и техническими трудностями в реализации всех видов локального противоопухолевого воздействия. Достоверных различий между основной и контрольной группами в распределении больных по форме роста первичной опухоли не выявлено, преобладал смешанный вариант (44,6% в основной, 47,6% – в контрольной группах соответственно). Группы также достоверно не различались в распределении больных по форме роста первичной опухоли в соответствии с вариантом лечения.
По морфологическому строению преобладающее большинство опухолей – 656 (79,3%) – имели строение плоскоклеточного рака различной степени дифференцировки без достоверных различий в частоте между основной и контрольной группой; во всех подгруппах преобладали умеренно- и высокодифференцированные его формы, низкодифференцированный плоскоклеточный рак достоверно чаще встречался в основной группе – 22,8% против 9,5% в контрольной (P<0,01). Опухоль была представлена аденокарциномой различной степени дифференцировки у 127(15,3%) больных, у 64(12,8%) – в основной и у 63(16,5%) – в контрольной группах, при этом до 5% больных во всех подгруппах обеих групп имели низкодифференцированные формы цервикальной аденокарциномы. Железисто-плоскоклеточный рак с различными вариантами гистологического строения обоих компонентов был выявлен у 45(5,4%) пациенток, у 35(2%) в основной и 10(3,1%) - в контрольной группах.
Из сопутствующей соматической патологии пациентки, входившие в исследование, наиболее часто страдали заболеваниями сердечно-сосудистой системы, эндокринной патологией, ожирением, патологией мочевых путей и заболеваниями ЖКТ. По спектру и частоте выявления соматической патологии основная и контрольная группы и составляющие их подгруппы были сопоставимы. При этом у 225(45%) больных в основной и 170(51,8%) – в контрольной выявлялось два и более вида экстрагенитальной патологии одновременно, степень выраженности которых влияла на выбор параметров специального лечения; более, чем половине больных требовалась обязательная коррекция соматической патологии до начала противоопухолевой терапии.
Общая характеристика методов лечения
Дистанционное облучение проводилось на отечественных гамма-терапевтических установках «РОКУС», линейных ускорителях электронов SL-75-5 (Phillips), Clinac 2100-CD(Varian) с энергией фотонов 5, 6 , 18 МэВ. Внутриполостное облучение реализовывали на автоматизированных брахитерапевтических комплексах, оснащенных изотопами 60Со («АГАТ-ВУ») и 192Ir высокой мощности («Микроселектрон HDR»), с применением планирующих системам PLATO и Oncentra TCS (Nucletron).
Облучению по модифицированным программам в основной группе были подвергнуты 500 человек,из них 246(49,2%) больных были предварительно оперированы по поводу МРРШМ в различных учреждениях страны, в т.ч. 135(55%) – на первом этапе лечения, 111(45,1%) – после неоадъювантной терапии. 254(51,8%) больных основной группы лечились консервативно, в т. ч. 112(44,1%)чел. получили химио–лучевое лечение, у 142(55,9%) применялась только радикальная сочетанная лучевая терапия с локальными вариантами радиомодификации.
Характеристика хирургического этапа лечения оперированных больных МРРШМ в основной и контрольной группах представлена на рис. 3. В рамках модифицированного комбинированного лечения в основной группе лечились 152 пациентки (вариант М–КОМБ), из них 56 (36,8%) были оперированы в отделении онкогинекологии РНЦРР, 96(63,2%) – в других учреждениях РФ и стран СНГ. 123(80,9%) больным была выполнена расширенная экстирпация матки с придатками II–III типа по Piver, 21(13,8%) больной – простая экстирпация матки с/без придатков, у 8(5,2%) пациенток объем операции был ограничен надвлагалищной ампутацией матки с оставлением массива опухоли.

Рис. 3. Характеристика хирургического этапа лечения оперированных больных МРРШМ в основной и контрольной группах
(М–КОМБ- – модифицированное комбинированное лечение, основная группа; КОМПЛ– комплксное лечение, основная группа; КОМБ–комбинированное лечение, контрольная группа; РЭМП – расширенная экстирпация матки с придатками II–IV типа по Piver; ЭМП–экстирпация матки с придатками; НАМ– надвлагалищная ампутация матки; НИУ–научно–исследовательские учреждения; ОД–онкодиспансеры; НОУ–неонкологические учреждения).
17(11,2%) больным проводилось неоадъювантное лучевое лечение до СОД на опухоль 30–40Гр; III–IV степень терапевтического патоморфоза зафиксирована в результате неоадъювантного лечения только у половины из них – 9(5,9%) больных.
94 пациентки основной группы подвергались облучению в рамках комплексного лечения (вариант КОМПЛ) – после хирургического вмешательства с предшествовавшей неоадъювантной химиотерапией в платиносодержащих режимах – НАХТ (Табл.1).
Таблица 1.
Распределение оперированных больных основной группы в соответствии со схемами НАХТ.
| Характеристика СХЕМА | PtFu (Xe) CDDP100mg/m2 (Carboplatin AUC 5) 1d 5FU 500mg/m2 1–5d (Xe 2000mg/m2 1–14d) | TPt Тх 135 mg/m2 ( Тdx 75 mg/m2) 1d CDDP 75mg/m2 (Carboplatin AUC 5) 2d | Другие Pt | Всего | |
| Число больных, чел (%±sp) | 36 38,3±5,0 | 46 47,9±5,2 | 12 12,8±3,4 | 94 100 | |
| Число больных и кол–во циклов, чел (%) | 1 | 6 16,7 | 8 17,4 | – | 14 14,9 |
| 2 | 22 61 | 38 82,6 | 2 16,7 | 62 66 | |
| 3 | 8 22,2 | – | 6 50 | 14 14,9 | |
| 4 | – | – | 4 33,4 | 4 4,2 | |
| Среднее число циклов | 2,1±0,6 | 1,83±0,4 | 2,5±0,9 | 2,1±1,3 | |
| Средний период до хирургического вмешательства, дней | 45±25,0 | 69,3±12,5 | 106,6±20,5 | 64,8±19,7 | |
