Стратегия и тактика лучевой терапии в многокомпонентном лечении местно-распространенного рака шейки матки (14. 01. 13 лучевая диагностика, лучевая терапия 14. 01. 12 онкология)
| Вид материала | Автореферат |
- Адъювантная лучевая терапия рака желудка. 14. 00. 14 онкология 14. 00. 19 лучевая диагностика,, 304.24kb.
- Лучевая терапия различными видами ионизирующего излучения в комплексном лечении больных, 785.18kb.
- Ультразвуковое исследование в комплексной лучевой диагностике злокачественных опухолей, 485.88kb.
- Современная тактика системной радиотерапии хлоридом стронция-89 в комплексном лечении, 651.21kb.
- Учебно-методическая карта дисциплины, 62.2kb.
- Комплексная лучевая диагностика в оценке репаративного процесса при лечении больных, 429.1kb.
- Нейтронная и нейтронно-фотонная терапия злокачественных новообразований слюнных и щитовидной, 340.88kb.
- Селиверстов Павел Владимирович лучевая диагностика диспластически-дистрофического синдрома, 488.65kb.
- Селиверстов Павел Владимирович лучевая диагностика диспластически-дистрофического синдрома, 488.95kb.
- Мр-маммография в планировании объема хирургического лечения рака молочной железы 14., 324.55kb.
90(95,7%) пациенток в этой подгруппе были оперированы в объеме расширенной экстирпации матки с придатками III-IV типа, только у 4(4,2%) больных тазовые лимфоузлы не были удалены из–за технических сложностей. Достоверно реже при варианте КОМПЛ имелись указания на визуально определяемую остаточную опухоль – в 7(7,4%) случаях против 38(25,7%) в подгруппах комбинированного лечения, Р<0,05.
В послеоперационном периоде всем больным подгруппы ПОЛТ проводилась модифицированная сочетанная лучевая терапия на область таза, дополненная профилактическим облучением зоны парааортальных лимфоузлов у 100(40,7%) оперированных больных МРРШМ с высоким риском лимфогенного метастазирования, по 50 больных при вариантах М–КОМБ (32,9%) и КОМПЛ (53,2%).
254 больных МРРШМ в основной группе были подвергнуты консервативному лечению; из них у 112(22,4%) пациенток реализованы химио-лучевые варианты терапии (подгруппа ХЛЛ), 142(55,9%) больные были лечены радикально сочетанной лучевой терапией в условиях разработанных нами методов локальной радиомодификации (ЛРМ). Курс ХЛЛ включал сочетанную лучевую терапию в режиме двухэтапного облучения и цикловую полихимиотерапию, проводившуюся на предлучевом этапе у 78(69,6%) больных или симультантно с облучением, начиная с 1- 3 дня– у 34(30,4%) больных. Использовались комбинированные схемы с включением препаратов платины (цисплатин, карбоплатин), таксанов (паклитаксел, доцетаксел), гемцитабина, 5-фторурацила, циклофосфана, блеомицина, доксорубицина в стандартных терапевтических дозах, с числом циклов от 1 до 4, по 2–3 цикла у 89(79,5%) леченых (Табл.2.). Достоверных различий в частоте применения тех или иных схем ПХТ в рамках последовательного или симультантного курсов ХЛЛ не отмечено, в обоих случаях преобладали платиносодержащие схемы ПХТ.
Таблица 2.
Распределение неоперированных больных основной группы в соответствии со схемой ПХТ
| Подгруппа ХЛЛ СХЕМА | PtFu (Xe) CDDP100mg/m2 (Carboplatin AUC 5) 1d 5FU 500mg/m2 1–5d (Xe 2000mg/m2 1–14d) | TPt Тх 135 mg/m2 ( Тdx 75 mg/m2) 1d CDDP 75mg/m2 (Carboplatin AUC 5) 2d | HemPt H 800mg/m2 1, 8d CDDP75mg/m2 2d | Другие Pt | Другие Non-Pt | Всего | |
| Число больных, чел (%±sp) | П–ХЛЛ | 18 23,0± 4,8 | 28 35,9± 3,6 | 10 12,8± 3.8 | 10 12,8± 3.8 | 12 15,4± 4,1 | 78 69,6± 4,3 |
| С-ХЛЛ | 8 23,5± 7,3 | 11 32,4± 8,0 | 6 17,7± 6,5 | 4 11,8± 5,5 | 5 14,7± 6,1 | 34 30,4± 4,3 | |
| Всего | 26 23,2± 4,0 | 39 34,8± 4,5 | 16 14,3± 3.3 | 14 12,5± 4,1 | 17 15,2± 3.4 | 112 100 | |
| Число больных и кол–во циклов, чел (%) | 1 | – | – | 7 43,7 | 4 28,6 | 3 17,6 | 14 12,5± 4,1 |
| 2 | 15 57,7 | 25 64,1 | 9 56,3 | 5 35,7 | 6 35,3 | 60 53,6± 4,7 | |
| 3 | 5 19,3 | 14 35,9 | – | 5 35,7 | 5 29,5 | 29 25,9± 4,1 | |
| 4 | 6 23 | – | – | – | 3 17,6 | 9 8,0± 2,5 | |
| Среднее число циклов | 2,7±0,8 | 2,4±0,5 | 1,6±0,5 | 2,1±0,8 | 2,5±1,0 | 2,3±0,8 | |
* П–ХЛЛ– последовательное химио–лучевое лечение; С–ХЛЛ– симультантное химио–лучевое лечение; 5FU –5– фторурацил , CDDP – цисплатин , Carboplatin – карбоплатин, Xe – капецитабин (кселода), Тx – паклитаксел, Тdx – доцетаксел, Hem – гемцитабин. Pt–платиновые режимы ПХТ, Non–Pt– бесплатиновые режимы ПХТ. %±sp – выборочная доля и стандартная ошибка доли в процентах
Локальная химиорадиомодификация (ЛХРМ) в виде пролонгированных 24-часовых аппликаций текстильных депо-систем, содержащих цитостатики 5-фторурацил (салфетки «Колетекс–5ФТУР», рег. удостоверение ФС 01035263/1810-05 от 16.06.2005г)
и проксифеин (патенты на изобретение РФ №2268763 «Способ лечения рака шейки матки с экзофитной формой опухоли» от 27 января 2006 года и №2268724 «Способ лечения онкологических больных с опухолевым поражением влагалища» от 27 января 2006 года) применялась на первом – дистанционном – этапе облучения у 52(36,6%) пациенток. У 90 (63,4%) пациенток ЛРМ проводилась на втором этапе совместно с внутриполостным облучением, в том числе в виде локальной лазериндуцированной гипертермии (ЛИГТ) на отечественной лазерной установке «Лазон-ФТ» (сертификат соответствия РОСС RU.ИМ 02В16418 от 23.09.2009г., рег. удост. ФСР №2009/04660 от 02 апреля 2009г.) – у 65(45,8%) пациенток; локальной криогипотермии (КГТ) на установке «КРИО-ИНЕЙ» (регистрационное удостоверение Минздрава России №29/15040698/1893-01, сертификат Госстандарта № РОСС RU.ИМО4. ВО2761) – у 25(17,6%) пациенток.
Сочетанная лучевая терапия у неоперированных больных МРРШМ в основной группе проводилась в соответствии с отечественной традицией лучевой терапии гинекологического рака – в два этапа, с включением на первом – дистанционном – этапе в клинический терапевтический объем (CTV) всей области таза, РОД 1,8 – 2Гр, на втором – сочетанном – ДЛТ РОД 2 –2,4Гр проводилась только на область тазовых (обтураторных, пресакральных, наружных, внутренних, общих подвздошных) лимфатических узлов в соответствии с первичной распространенностью опухоли, СОД 44-48Гр, а первичный очаг облучался преимущественно контактно, с применением брахитерапевтических комплексов «АГАТ-ВУ» и «Микроселектрон HDR», с режимами фракционирования 5 – 6Гр 2 раза в неделю до СОДэкв 40 – 50Гр в точке А или по терапевтическому изодозному контуру, соответствовавшему лечебному объему с высоким риском рецидива (HR–CTV). У 14(5,5%) больных с визуализирующимися метастазами в тазовых лимфатических узлах РОД на зоны метастазов эскалировалась до 2,3–2,4Гр в ходе единого сеанса ДЛТ по принципу «field–in field». У 73(15%) неоперированных больных, вошедших в исследование, с визуализированными по УЗИ и КТ/МРТ метастазами в лимфоузлы, включая 17(3,5%) больных с визуализированными перед началом лучевого этапа лечения метастазами в парааортальные лимфоузлы, объем облучения расширялся за счет облучения средне-нижней группы парааортальных лимфоузлов до уровня Th12.
В контрольной группе из 328 больных МРРШМ после конвенциального лечения, проводившегося в РНЦРР в 1986-2000 гг., 232 больным (подгруппа РСЛТ) была проведена радикальная сочетанная лучевая терапия, соответствовавшая отечественному стандарту терапии РШМ. Суммарные дозы на опухоль варьировались в зависимости от стадии от 64–66Гр до 70–72Гр в абсолютных величинах, не превышая 130–140 ед. ВДФ. Парааортальная область в контрольной группе облучалась только у 5 (2,2±1,0%) больных IV стадии с визуализированными до начала лечения метастазами в парааортальные лимфоузлы, после полного курса радикальной сочетанной лучевой терапии на таз. Дополнительного облучения шейных или паховых лимфоузлов в ходе нашего исследования не проводилось. Послеоперационное облучение в рамках комбинированного лечения в контрольной группе (подгруппа КОМБ) проводилось 96 больным МРРШМ, из них после неоадъювантной лучевой терапии – у 19(19,8%). В РНЦРР были оперированы 65(67,7%) больных, 31(32,3%) – в других профильных учреждениях Советского Союза, РФ и СНГ. Среднегодовое число больных МРРШМ, пролеченных в рамках комбинированного лечения в указанный период – 6,86±2,1 чел. – было достоверно (Р<0,02) ниже аналогичного показателя (21,7±4,8 больных в год) в основной группе.
Таким образом, несмотря на изначально нерандомизированный характер исследования, основная и контрольная группа достоверно не различались по стандартным прогностическим параметрам: возрастному составу исследуемых, набору стадий основного заболевания, морфологическому строению, форме роста опухоли, спектру и степени выраженности соматической патологии. Достоверные различия оцениваемых групп были связаны с различиями в примененных методах лечения, обуславливавших необходимость разработки новых подходов к планированию и реализации лучевого этапа лечения МРРШМ, что и составляло предмет нашего исследования.
Результаты исследования.
В рамках решения первой задачи настоящего исследования, для определения принципов формирования программ облучения при различных вариантах терапии больных МРРШМ, на основании комплексного анализа первичной документации нами были выделены 20 основных клинико-морфологических факторов, чье влияние на отдаленные результаты могло быть подвергнуто сравнительному анализу в основной и контрольной группах. Для этого первоначально было оценено влияние выделенных факторов на общую и безрецидивную выживаемость у оперированных и неоперированных больных МРРШМ в контрольной группе.
На основании данных многофакторного регрессионного анализа и оценки силы корреляционных зависимостей было установлено, что у оперированных больных МРРШМ, подвергнутых конвенциальному комбинированному лечению, значимыми факторами, неблагоприятно влияющими на отдаленные результаты, являются: объем первичной опухоли до начала лечения более 30см3 (r=0,967); инвазия стромы шейки матки более 1/3 (r=0,91); распространение на тело матки с инвазией в миометрий более 5мм (r=0,87); внеорганное распространение (параметрии, влагалище) (r=0,998); низкая (0-I) степень терапевтического патоморфоза в первичной опухоли после неоадъювантного лечения (r=0,778); элементы опухоли в границе резекции (r=0,96); опухолевые эмболы в лимфатических щелях и кровеносных сосудах (r=0,996); метастазы в лимфатические узлы таза (r=0,998); наличие остаточных опухолей в тазу после хирургического этапа (r=0,998); интраоперационная кровопотеря с последующей стойкой анемией 2-3 степени(r=0,768).
Для неоперированных больных МРРШМ, лечившихся по стандартным методикам радикальной сочетанной лучевой терапии, значимыми факторами неблагоприятного прогноза (ФНП) явились: объем опухолевого поражения на момент начала лучевого этапа более 50см3 (r=0,837); низкодифференцированные и инфильтративно−язвенные формы опухоли (r=0,993); эндофитная форма роста первичной опухоли (r=0,76); аденогенные гистологические формы (r=0,78); распространение опухоли на матку с поражением средней и верхней трети (r=0,8); опухолевое поражение влагалища (r=0,94); поражение параметральной клетчатки протяженностью более 1/3 параметрия (r=0,946); признаки метастатического поражения тазовых (r=0,993) и парааортальных лимфатических узлов (r=0,998); анемия более III степени до начала и стойкая анемия II и более степени во время консервативного лечения (r=0,87); общая продолжительность лучевого этапа более 60 дней (r=0,69); хронические заболевания кишечника, мочевого пузыря (r=0,7).
На основании полученных данных нами были сформированы индивидуальные «Карта учета факторов прогноза», заполнявшиеся в основной группе на каждую больную до начала лучевой терапии на основании доступной первичной документации.У оперированных больных дополнительно фиксировались особенности хирургического лечения (вскрытие просвета полых органов, технические трудности при вхождении в забрюшинное пространство, выделении мочеточников, выполнение резекции и пластики мочеточников, мочевого пузыря, кишки, наличие и локализация анастомозов), существенное нарушение топографии органов малого таза после хирургического этапа, продолжительность послеоперационного периода в сутках до начала лучевого лечения. На основании текущего клинико-ультразвукового обследования в «Карту» вносились данные о состоянии рубца в куполе влагалища, наличии и размере объемных образований в полости таза. Оценивалось общее состояние больной при поступлении на облучение по шкале ECOG, фиксировались анамнестические данные об осложнениях ≥ II cтепени со стороны кишечника, мочевого пузыря, кожи, слизистых, гематологические нарушения.
У неоперированных больных МРРШМ в «Карту» дополнительно вносились сведения об объеме и распространенности опухоли на момент начала лучевого лечения, дополняемые схемой и конкретизированными по результатам УЗИ,КТ, МРТ данными о степени вовлечения в опухолевый процесс тела матки, влагалища, клетчаточных пространств, указывали анатомо–топографические формы опухоли, возможность адекватного размещения внутриполостных излучающих систем. Впоследствии в эту же карту вносились данные о динамике опухолевого процесса на СОДэкв 20,30,40,60Гр на опухоль и общий непосредственный эффект лечения на момент его окончания, дополняемые графическим анализом, фиксировалась информация об осложнениях. После НАХТ в карту дополнительно включались данные об общем эффекте химиотерапии, степени терапевтического патоморфоза в первичной опухоли, фиксировались осложнения ≥II степени в ходе НАХТ со стороны периферической крови, кишечника, мочевого пузыря.
Анализ частоты указанных ФНП в подгруппе ПОЛТ основной группы (Приложение 1, табл. 1) позволил заключить, что у всех оперированных больных МРРШМ в основной группе имелись основания для проведения послеоперационной лучевой терапии на ложе опухоли и зоны регионарного метастазирования. Эффекты проведенного неоадъюватного лечения во всех случаях не были достаточными для отказа от послеоперационного облучения в связи с выявлением значимых ФНП, причем сочетание трех и более ФНП было установлено у 89(80,1%) леченых предоперационно. В совокупности результаты предлучевых этапов позволяли планировать стандартный профилактический курс ПОЛТ только у 10% больных исследуемой группы; у 90,2% оперированных больных МРРШМ в основной группе программы облучения на послеоперационном этапе требовали модификации с целью преодоления негативного влияния выделенных ФНП.
Для неоперированных больных МРРШМ, учитывая тяжесть контингента и бесперспективность проведения стандартной сочетанной лучевой терапии, исходя из выявляемости и силы влияния установленных ФНП (Приложение 1, табл. 2), успех лечения связывался нами не с прямым увеличением дозы в опухоли в рамках монотерапии, а с синергичным сочетанием нескольких методов противоопухолевого воздействия при минимальной суммации побочных эффектов. Основным направлением методических разработок у этой категории пациенток явилось формирование эффективных и безопасных программ облучения на основе адаптации для МРРШМ технологий визуально−контролируемой лучевой терапии при различных вариантах сочетания с цитостатиками и локальными радиомодификаторами нескольких механизмов действия.
В рамках решения второй задачи настоящего исследования были оптимизированы комплексы топометрической подготовки и мониторинга лучевой терапии в рамках исследуемых вариантов многокомпонентного лечения больных МРРШМ на основе использования эхографии как базового метода визуализации, наравне с КТ-МРТ-топометрией. У оперированных больных МРРШМ алгоритм предлучевой УЗ-топометрии предполагал получение изображения культи влагалища в поперечной и саггитальной плоскостях и в трехмерном изображении, измерение линейных размеров и площади вагинального рубца, визуализацию границы с мочевым пузырем, прямой кишкой с измерением толщины стенки полых органов для выбора объема 100% изодозного контура при внутриполостном облучении. Эхографический мониторинг с выполнением УЗ–топометрии перед каждой фракцией внутриполостного облучения позволил избежать необоснованных процедур репланирования у 70% оперированных больных МРРШМ, а в 30% осложненных случаев – своевременно определить показания и сроки проведения повторной КТ-МРТ–топометрии. Проведение рентгентопометрии в двух режимах – рентгеновской симуляции и КТ – топометрии, в т.ч. с использованием технологии cone beam, требовало предварительного перорального контрастирования для дифференцировки внутренних структур таза – мочевого пузыря, прямой кишки, петель тонкого и толстого кишечника. В неосложненных случаях лечебный объем для дистанционного и контактного облучения формировался в ходе единой процедуры. Безопасное проведение адъювантного облучения зоны парааортальных лимфоузлов потребовало предварительного выполнения ЭГДС, а также - дополнительного контрастирования желудка и 12-перстной кишки специальной смесью при проведении рентгеновской и КТ- топометрии с целью минимизации объема этих органов, входящих в терапевтический объем.
Одной из узких задач настоящего исследования являлось формирование адекватного алгоритма предлучевой подготовки и выбор оптимальной программы лучевой терапии в лечения больных МРРШМ с транспозицией яичников. При этом в ходе комплексного УЗ-КТ-планирования определялось точное месторасположение яичников, оценивалась их эхоструктура и особенности васкуляризации, после чего на уровне центра яичника на кожу больной выносилась метка. При плоскостном планировании облучения на гамма–терапевтических установках и ЛУЭ 5–6МэВ выбор предполагаемой программы ПОЛТ, характера формирующих устройств осуществляли в соответствии с анализом дозных распределений от каждого вида облучения не только на уровне планирования, но и на уровне проекции транспонированных яичников или верхних границ полей, максимально приближенных к ним, с предварительным расчетом суммарной дозы, приходящейся на яичники, вводимых в планирующую систему как «зоны интереса». При 3D-планировании после этапа УЗ–топометрии яичники визуализировались на серии КТ или МРТ и оконтуривались как дополнительные органы риска, дозы в оценивались по гистограммам «доза–объем». Средняя суммарная доза на транспонированных яичниках при облучении на гамма–установках составила 3,8±1,1Гр; при лечении на ЛУЭ Clinac 2100 с энергиями фотонов 6-18МэВ – 1,95±0,9Гр, что дополнительно свидетельствует о преимуществах визуально-контролируемой лучевой терапии перед конвенциальными вариантами облучения.
У неоперированных больных МРРШМ основной группы динамическое измерение объемов первичной опухоли и определяемых метастатических очагов (т.н. волюметрия) проводилось согласно современным требованиям RECIST 1.1, 2000, и рекомендациям GEC–ESTRO, с помощью КТ−МРТ−томографии, выполнявшихся по стандартизированным методикам, и параллельно – на основании данных ультразвукового исследования в 2D–3D режимах «серой шкалы». УЗ-волюметрии первичного очага предшествовала оценка в режиме 2D формы шейки и тела матки, эхоструктуры всех внутренних половых органов, при этом особое внимание уделялось области перешейка, стенок влагалища, ретровезикальной клетчатки, других клетчаточных пространств таза, оценивалась ровность и четкость контуров визуализируемых анатомических структур, после чего приступали непосредственно к волюметрии. При использовании только 2D- эхографии в В–режиме в первые два года набора больных в исследование, на этом этапе проводились измерения трех наибольших размеров опухолевого очага в сагиттальной (длина, а, толщина, c,) и поперечной (ширина,b) плоскостях, после чего объем вычислялся по формуле расчета объема эллипса (0,5236хaхbхс). При сложной конфигурации опухоли изображения виртуально делились на части, близкие по форме к эллипсоидной; объем ее рассчитывался как сумма объемов виртуальных частей. В последующем при накоплении опыта трехмерной эхографии в В–режиме при РШМ, объемная информация собиралась в автоматическом режиме. Дальнейшая компьютерная обработка изображения и оконтуривание мишени повышало точность волюметрии на 5–10%.
Динамическая волюметрия выполнялась всем 254 больным подгруппы консервативного лечения в основной группе до начала лучевого лечения, после ДГТ СОД20Гр или перед первым сеансом ВПГТ и в дальнейшем перед каждой фракцией внутриполостного облучения. За курс лечения у одной больной выполнялось в среднем 11,2±1,6 исследований [9 – 14], по результатам измерений оценивали динамику размеров опухоли путем расчета процента регрессии объемов измеряемых очагов и кратность регрессии ρn, определяемую как отношение первичного объема опухоли-мишени V1 к измеренному в момент n ее объему Vn. По окончании лечения данные фиксировались в истории болезни в виде графика, косвенно отражающего полноту и темп регрессии.
Во всех случаях в шейке матки, измененной по форме и структуре у всех больных, определялся опухолевый очаг, отличавшийся по эхогенности от окружающих тканей, измеряемый в подавляющем большинстве случаев. Контуры опухоли во всех случаях были неровными, структура – неоднородной, с гипоэхогенными и анэхогенными зонами и линейными гиперэхогенными включениями. При переходе опухоли на матку нарушалась или отсутствовала дифференциация слоев тела матки в этой зоне, структура тела матки в области поражения соответствовала структуре опухоли шейки матки, граница перехода опухоли с шейки на тело матки отсутствовала. Технические сложности в оценке объема опухоли на этом этапе возникали преимущественно при некоторых вариантах распространения опухоли на влагалище и параметральную клетчатку. Cравнительный анализ УЗ– и МРТ–изображений на этом этапе продемонстрировал значимое, но сравнимое снижение чувствительности обоих методов в отношении оценки состояния параметриев – до 67% и 74% соответственно, однако, дальнейший анализ позволил дифференцировать варианты поражения параметральной клетчатки, исходя из возможных механизмов их развития, и выявить соответствующие различия в их УЗ- и МР-визуализации. Так, при прямом распространении опухоли на клетчатку со стороны шейки матки инфильтраты в параметриях не имели границ с опухолью шейки матки, однако, отличались по эхогенности и тканевой плотности от окружающих тканей и подлежали измерению как единый опухолевый конгломерат с шейкой матки. Рост опухоли в параметриях из метастатически измененных лимфатических узлов характеризовался визуализацией в области параметриев измеряемого опухолевого очага с измененной эхогенностью, накапливающего контрастное вещество при МРТ, который по мере роста мог сливаться с опухолью шейки матки и, соответственно, измеряться в общем объеме опухоли. В тоже время поражение параметриев по типу ракового лимфангоита за счет эмболизации элементами опухоли лимфо–васкулярных пространств может быть отнесено к неизмеряемым; при УЗИ в В–режиме в этих случаях определялась неровность, нечеткость, «изъеденность» боковых контуров шейки матки; на МР–томограммах этот вид инфильтрации определялся как выраженная тяжистость прилежащей клетчатки с неравномерным накоплением контрастного вещества. В этих случаях требовалось дополнительно в ходе планирования маркировать и контролировать эти зоны как отдельные «зоны интереса», наравне с визуализируемой опухолью–мишенью, и включать в максимально доступном объеме в терапевтический изодозный контур. При динамических исследованиях после подведения на первичный очаг СОДэкв 30–40Гр необходимо использовать аппаратурные возможности подстройки УЗ−изображений, с преимущественной визуализацией трансвагинальным и транректальным доступом.
Выполнение динамической УЗ-топометрии в рамках мониторинга внутриполостного облучения при консервативном лечении МРРШМ позволяло индивидуально подобрать конструкцию эндостатов, контролировать положение аппликатора относительно опухоли, выбирать объем терапевтического изодозного контура (CTV), определять зоны эскалации и щажения, что в среднем вдвое − с 4,2±0,7 до 1,8±0,4 раз − сократило число процедур КТ/МРТ-планирования.
Сформированные алгоритмы визуального контроля и коррекции параметров облучения явились технической платформой для модификации лучевого воздействия при многокомпонентном лечении больных МРРШМ. На этапе послеоперационного облучения, стратегия и тактика которого разрабатывались в рамках решения третьей задачи нашего исследования, основным направлением стал дифференцированный выбор согласно установленных ФНП сроков начала лечения, длительности курса ЛТ и последовательности его этапов, лечебного объема, разовых и суммарных очаговых доз дистанционного и внутриполостного облучения, способов их подведения к «мишени» и областям со сниженной тканевой толерантностью. Сформированный алгоритм модифицированной ПОЛТ у оперированных больных МРРШМ (Приложение 2 а–г) предусматривал начало облучения уже на 14 - 18 сутки. При облучении зажившего вагинального рубца с использованием источников Со60HDR к куполу влагалища подводили трехканальный метракольпостат с размещением излучателей в одной горизонтальной плоскости. В зависимости от состояния купола культи влагалища и терапевтических задач овоиды могут быть как плотно прижаты к центральному эндостату, так и разведены в углы культи с соответствующей геометрией, разведение не должно превышать 4см во избежание «провалов» дозы в центральных отделах культи влагалища, РОД на слизистую 5Гр ежедневно до СОД 25–30Гр. При повышенном риске локального рецидива − наличии элементов опухоли в краю резекции, близости опухоли (расстояние ≤ 5мм) c минимальными признаками терапевтического патоморфоза к границам резекции влагалища, длине влагалищной трубки ≥ 10см, СОД на купол влагалища эскалируется до 35–40Гр, дополняется облучением влагалищной трубки, РОД 3 - 5Гр контактно на слизистую (РОДэкв 2,5–4Гр на глубине 0,5см), до СОД 21-30Гр. При наличии признаков воспалительной инфильтрации паравезикальной/параректальной клетчатки, катального мукозита в куполе, влагалище облучается в щадящем режиме, со снижением на 20–30% разовых и суммарных доз. При использовании одноканального аппликатора требуется оптимизация стандартного плана в форме «булавы для обеспечения равномерного охвата культи терапевтической изодозой без переоблучения начальных отделов влагалищной трубки, что может быть достигнуто варьированием шага источника Ir192 HDR и времени стояния его в определенной позиции. При выявлении в эти сроки фибринозного и некротического мукозита в куполе влагалища, в связи с риском развития мочеполового свища облучение вагинального рубца откладывается до полного его заживления, облучение начинается с дистанционного этапа.
Реализация алгоритмов ДЛТ в рамках ПОЛТ (Приложение 2в) также предусматривает дифференцированный выбор параметров облучения в соответствии с типом доступного излучателя и терапевтическими задачами, обусловленными результатами предлучевых этапов. Выбор оптимального способа и режима ДЛТ основывается на сравнительном анализе гистограмм «доза-объем» (DVH) в отношении структур–мишеней, органов риска, зон дополнительной эскалации и щажения. При осуществлении объемного планирования (Oncentra Masterplan) культя влагалища и области тазовых и парааортальных лимфатических узлов оконтуриваются и заводятся в систему как отдельные мишени для формирования фигурных полей облучения в соответствии с индивидуальной послеоперационной анатомией. Это позволяет избегать необоснованного пере– или недооблучения определенных структур таза и брюшной полости (культи влагалища, мочеточников, почечных «ножек», мочевого пузыря, ректо–сигмоидного отдела кишки) при их фиксированных смещениях и деформациях.
ДЛТ на первом этапе проводится на весь объем таза до суммарных доз 24–36Гр, далее реализуется контактное облучение культи влагалища симультанно с дистанционным облучением регионарных лимфоузлов. Временной интервал между дневными фракциями ДЛТ и ВПГТ – 3,5–4ч. При выборе такого варианта интенсификации сочетанной лучевой терапии, позволяющего на 6–10 дней сократить общие сроки послеоперационного лучевого лечения, следует уделять особое внимание оценке суммарных доз в периферических отделах культи влагалища, где происходит наложение полей дистанционного и внутриполостного облучения, не превышая запланированные РОД и СОД в этих областях. При нарушениях общего состояния больной (ECOG II и выше), развитии осложнений ≥II степени в ходе реализации I этапа, ВПГТ и ДЛТ на тазовые лимфоузлы проводятся последовательно, при этом общая продолжительность курса ПОЛТ не должна превышать 56 дней.
У больных нормостенической конституции, в отсутствие сопутствующей патологии и осложнений ≥ II cтепени на предлучевых этапах со стороны органов риска, отдавали предпочтение облучению в статическом режиме с четырех взаимно перпендикулярных полей (box–метод) на всех видах излучателей (телекобальтовых гамма–терапевтических установках, линейных ускорителях электронов энергией 5–18 МэВ), РОД 2 – 2,2Гр до СОД 24 – 26Гр на центр таза. У больных с ожирением, сопутствующей патологией или осложнениями ≥ II степени со стороны мочевого пузыря, прямой кишки, тонкого, толстого кишечника на предлучевых этапах при реализации облучения на гамма–установках и ЛУЭ с энергией фотонов 5–6мэВ нами использовались оптимизированные многопольные статические и подвижные варианты облучения с планируемым вовлечением не более 50% органов риска в терапевтический изодозный контур. При «фартучном» типе ожирения облучение на гамма-установке предпочтительнее проводить в положении пациентки на животе, с использованием ткань–эквивалентных болюсов, однако, вариантом выбора в этой ситуации является облучение на ЛУЭ 18–20МэВ с высокой проникающей способностью и смещенным максимумом дозы.
При глубокой инвазии опухоли в толщу шейки матки, распространении на тело матки с инвазией миометрия на глубину более 5мм, тотальном поражении полости матки, низкой (0-II) степени патоморфоза после неоадъювантного лечения в первичной опухоли и лимфатических узлах, наличии эмболов в лимфатических щелях и кровеносных сосудах, метастазов в лимфатических узлах, суммарная доза облучения, подводимая на весь объем таза, эскалируется до 30 – 34Гр, затем центральные структуры облучаются контактно, а зоны параметриев и тазовых лимфатических узлов подвергаются ДЛТ до СОДэкв 48 – 50Гр. Для адекватного облучения лимфатических «цепочек» на всех уровнях, в особенности при наличии эмболов в лимфатических щелях и кровеносных сосудах, метастазов в лимфатических узлах, предпочтительнее использовать оптимизированные многопольные статические режимы облучения, например, шестипольную методику («полубокс»); общие размеры и ориентация полей соответствуют топографической анатомии лимфатических путей данной области (Приложение 2г) При значительных поперечных размерах, протяженности конгломерата метастатически удаленных лимфоузлов, низкой степени ТП в них, РОД увеличивается до 2,4–2,6Гр, СОДэкв − до 56–60Гр в зоне пораженных лимфатических узлов за счет дополнительного локального облучения области удаленных метастазов РОД 0,2 – 0,4Гр по принципу «field−in−field», что требует дополнительной маркировки этих областей рентгеноконтрастными скобками. Обнаружение в зоне облучения лимфокисты или гематомы любого размера служит причиной отказа от эскалации локальных доз в зонах регионарного метастазирования. ввиду высокого риска обструкции мочевыводящих путей
При наличии метастазов в лимфатических узлах, в том числе – с низкой 0–II степенью ТП после НАХТ, а также при повышенном риске лимфогенного метастазирования – раковых эмболах в лимфатических щелях и кровеносных сосудах, объеме первичной опухоли более 30см3, невыполнении радикальной тазовой лимфодиссекции, облучение таза дополняется профилактическим облучением зоны парааортальных лимфоузлов. В обязательную терапию сопровождения включаются гастропротекторы (H2-блокаторы); антиэметики центрального действия (антагонисты 5-НТ3- и NKi-рецепторов серотонина) – гранисетрон (китрил), ондасетрон (латран, зофран, эмесет), трописентрон (навобан, тропиндол), по меньшей мере однократно за час до сеанса; жидкие антациды (альмагель, фосфалюгель, маалокс) по 20–40 мл за 30мин. до сеанса. При реализации облучения на установках, оснащенных только системами двухмерного планирования, целесообразно использование оптимизированных статических и подвижных режимов с минимизацией поглощенных доз в спинном мозге, почках и их ножках, тонком кишечнике, коже, при средней ширине поля 6−7см, высоте -8−10см. При оснащении установки системой 3D–планирования клинический терапевтический объем (СТV) определяется индивидуально, c максимально точным соответствием (+0,5–0,7см) объему условной мишени, соответствующей зоне визуально неизмененных парааортальных лимфатических узлов до уровня Th12, с преимущественным щажением почек с ножками и спинного мозга, РОД 1,8 – 2,0 Гр, СОДэкв 40Гр.
В рамках решения четвертой задачи настоящего исследования химио–лучевое лечение (ХЛЛ) осуществлялось нами в двух вариантах, при которых лучевая терапия – дистанционная на первом этапе и сочетанная на втором – проводилась последовательно или симультанно с ПХТ. Выбор оптимального способа и режима ДЛТ на первом этапе основывался на сравнительном анализе гистограмм «доза-объем» с дифференцированным вводом в планирующую систему контуров матки и регионарных лимфатических узлов как таргетных (GTV1, GTV2, GTV3), а мочевого пузыря, прямой кишки, сигмовидной кишки, кожи с подкожно-жировой клетчаткой, костей таза как органов риска. При дополнительном облучении парааортальной зоны клинический терапевтический объем определялся индивидуально, на основании трехмерной реконструкции опухоли или неизмененных лимфатических узлов в этой зоне по КТ-сериям, с преимущественным щажением почек с ножками и спинного мозга, РОД составили 1,8-2,2Гр, СОД 46-50Гр. На втором этапе дистанционно облучали только зоны тазовых лимфоколлекторов, при этом медиальные границы пахово–подвздошных и крестцовых полей формировались в соответствии с предполагаемым объемом ВПГТ во избежание наложения 90–100% изодоз в области перекреста мочеточника и маточной артерии (соответствующего типично расположенной точке А). При визуализации метастазов в тазовых лимфоузлах эти зоны облучались по принципу «field–in field», РОД в них составляла 2,2–2,4Гр при РОД 2,0–2,2Гр на остальном протяжении. СОД на зоны метастазов составили в среднем 54,7±2,9Гр [CI 95% 48,4 – 61Гр] при СОД на оставшуюся часть лимфоколлекторов 44–48Гр.
Терапевтические объемы внутриполостного облучения в программах ХЛЛ формировались в максимально точном соответствии геометрии 100-90% контура реальной анатомии опухолевого очага, определяемого в динамике при комплексной УЗ- и КТ/МРТ-топометрии. В рамках настоящего исследования нами была сопоставлена количественная информация о динамике площадей и объемов опухолей-мишеней в ходе ВПГТ, оцененных у 16 больных МРРШМ с помощью 2D−3D−эхографии в режиме «серой» шкалы и МРТ в Т2–взвешенных изображениях, всего 156 исследований, по 78 исследований для каждого типа визуализации. Значимых различий между методами в точности измерений не выявлено (P>0,05), что позволило и при консервативном лечении МРРШМ, наряду с ПОЛТ, считать комплексное УЗИ базовым методом визуализации для мониторинга и коррекции планов ВПГТ. При этом 10% изменение площади или 15% - объема опухоли-мишени от фракции к фракции по данным эхографии служило показанием для повторного КТ/МРТ-планирования с целью коррекции объемов ВПГТ.
Многопараметровый сравнительный анализ продемонстрировал, что последовательное проведение ПХТ и лучевой терапии у неоперированных больных МРРШМ, в отличие от симультанного варианта лечения, достоверно улучшало условия реализации облучения в рамках ХЛЛ. Так, при сопоставимом для двух подгрупп прогностическом индексе и отсутствии значимых различий в объемах облучения на первом − дистанционном − этапе, на сочетанном этапе объемы дистанционного облучения при последовательном ХЛЛ (П-ХЛЛ) были значимо меньше таковых при симультанном ХЛЛ (С-ХЛЛ) − 6291,7±1719,3cм3 против 7781,0±1715,0 см3 соответственно, Р<0,05. Объем мишени (GTV) на момент начала ВПГТ в подгруппе П–ХЛЛ колебался от 22,7см3 до 216cм3 , средний объем GTV составлял 49,6±8,3см3 [СI 95% 33,0–66,2см3], что было достоверно меньше аналогичного показателя в подгруппе С–ХЛЛ, в которой значения объема GTV до начала лечения колебались от 38,4см3 до 317cм3, а средний объем GTV составлял 68,6±11,7см3 [СI 95% 45,2–92,0см3] (Р<0,001). Адекватность охвата мишени терапевтическим изодозным контуром в подгруппе П–ХЛЛ также достоверно превышала таковую в подгруппе С–ХЛЛ, что отражает значимое позитивное влияние НАХТ на динамику опухолевого процесса, способствующее сокращению курсовых объемов ДЛТ и ВПГТ. Так, D90 и V100 в подгруппе П–ХЛЛ составили в среднем 98,7±2,4% [78–114%] и 92,1±1,4% [85,3–99,6%], в подгруппе С–ХЛЛ – 88,4±4,2% [74–118%] и 89,1±3,4% [82,3–97,6%] соответственно, (Р>0,001). При этом в подгруппе П–ХЛЛ достижение клинического излечения достигалось меньшими СОД на опухоль (Рис.4), отмечалась лучшая переносимость лечения при отсутствии достоверных различий между подгруппами в его продолжительности.
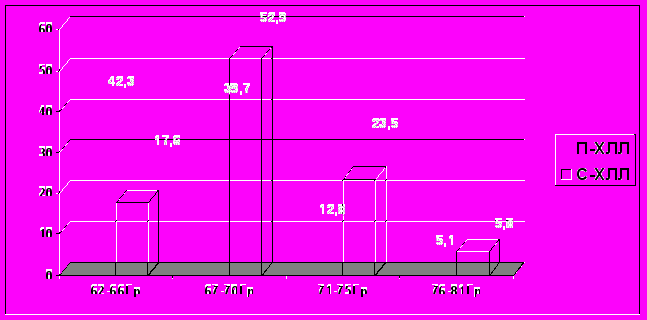
Рис. 4. Сравнительный анализ числа больных (в долях, %) с различными уровнями СОД в опухоли на момент достижения клинического излечения в подгруппах симультанного и последовательного химио-лучевого лечения МРРШМ.
В рамках решения пятой задачи настоящего исследования были разработаны и оценены три новых методики локальной радиомодификации (ЛРМ) при проведении радикальной сочетанной лучевой терапии МРРШМ. Локальная химиорадиомодификация (ЛХРМ) в ходе проведения первого–дистанционного– этапа радикального лучевого лечения осуществлялась в виде протрагированных 24–часовых аппликаций текстильных депо–систем «Колетекс», содержавших цитостатики 5–ФУ («Колетекс–5ФТУР», рег. удостоверение №ФС 01035263/1810-05 от 16.06.2005г.) или проксифеин (рег. № 97/292/1 РЛС РФ) в концентрации 9 масс % на биосовместимом полимер–полисахариде альгинате натрия, что при аппликации увлажненной перед введением 20% раствором димексида основы 6х10см соответствовало постепенному высвобождению препарата за 24ч в средней допустимой суточной дозе 1,5г. Наибольшую эффективность в виде значимого ускорения регрессии первичной опухоли при таком виде ЛРМ мы отметили при опухолях с преимущественно экзофитной формой роста, а также при распространении опухоли на слизистую влагалища. При опухолях с преимущественно эндофитной формой роста, а также при подслизистом распространении опухоли на влагалище значимого эффекта этот вид ЛРМ не имел. Также в ходе отработки методики мы отказались от проведения такого вида ЛРМ у больных МРРШМ с инфильтративно–язвенной формой роста, выраженном самопроизвольном распаде опухоли, обильном кровотечении из половых путей, гнойном параканкрозном воспалении.
На этапе ВПГТ, после количественной оценки параметров опухолевого очага (2D-3D УЗИ, РКТ/МРТ), у 65 (45,8%) больных МРРШМ с целью радиомодификации применили локальную лазериндуцированную гипертермию (ЛИГТ) с нагревом опухоли до 41-43ºС, у 25 (17,6%) − криогипотермию жидким азотом с охлаждением опухоли до – 90-100С. ЛИГТ проводили с помощью полупроводникового лазера с диодной накачкой на длине волны 1,06мкм, в режиме постоянного тока с мощностью в диапазоне от 1 до 10Вт. Выбор световода производился в соответствии с преимущественной формой роста опухоли: торцевой световод использовался чаще при экзофитных и смешанных формах опухоли, диффузный цилиндрический – при эндофитной, боковой (side fiber) – при распространении опухоли на влагалище. Криовоздействие проводили перед 1-2, 4-5, 7-8 сеансами ВПГТ; у больных с экзофитными формами опухоли на первых двух сеансах для поверхностной криодеструкции применяли пуговичные наконечники различного диаметра, при эндофитных и смешанных опухолях чередовали использование интрацервикальных и пуговичных аппликаторов. Наиболее клинически значимый модифицирующий эффект был достигнут при применении ЛИГТ с обеспечением высокого - 76% - уровня локального контроля, сопоставимых с последовательным химио–лучевым лечением показателей пятилетней безрецидивной выживаемости – 66,2±5,9% против 69,2±5,2% (Р=0,832) при снижении по сравнению с конвенциальной лучевой терапией частоты и степени тяжести поздних осложнений со стороны мочевого пузыря и прямой кишки.
В рамках решения шестой задачи нами были оценены непосредственные, ближайшие и отдаленные результаты исследованных вариантов многокомпонентного лечения МРРШМ, а также проведена сравнительная многопараметровая оценка влияния на отдаленные результаты выделенных ранее ФНП у больных МРРШМ с различными вариантами терапии в основной группе. В подгруппах оперированных больных оценка непосредственных результатов по шкале RECIST 1.1, 2000, проведена у 53(15,5%) больных с измеряемыми очагами – визуализируемыми на момент начала облучения остаточными опухолями в малом тазу, при этом частота полных (ПР) и частичных (ЧР) регрессий в основной группе значимо превышала таковую в контрольной (77,8±6,3 против 37,5±18,3 и 11,1±4,7 против 25,0±15,3 соответственно, Р=0,035). Прогрессирования опухолевого процесса в ходе ПОЛТ у 289 (84,5%) больных, подвергнутых адъювантному облучению без визуально определяемого опухолевого очага, не зафиксировано, у этой части пациенток оценивались показатели выживаемости.
Непосредственные результаты консервативного лечения МРРШМ в основной группе были значимо лучше таковых при аналогичном варианте лечения в контрольной группе (подгруппа РСЛТ): ПР была достигнута у 196 (77,2±2,6%) больных в основной против 134 (57,8±3,2%) – в контрольной группах (Р<0,001), в последней практически вдвое чаще по сравнению с основной регистрировалась ЧР. При детальном анализе результатов между подгруппами основной группы, частота ПР и ЧР в подгруппах ХЛЛ и ЛРМ значимо не различались (Р=0,068 и Р= 0,126 соответственно), однако, при попарном сравнении не было выявлено значимых различий в частоте полных и частичных регрессий только между подгруппами П–ХЛЛ, С–ХЛЛ и ЛИГТ. Непосредственные результаты лечения больных в подгруппах ЛХРМ и КГТ основной группы были значимо ниже и не имели достоверных различий с контрольной группой.
М–КОМБ
При совокупной оценке ближайшие и отдаленные результаты многокомпонентного лечения в основной группе значимо превосходили таковые в контрольной. Так, показатели общей выживаемости (ОВ) в основной группе значимо превышали таковые в контрольной на всех этапах наблюдения с высокой степенью достоверности (Р<0,001), превысив на 18,3±4,3% (68,6±2,1% против 50,3±2,8%, Р<0,001) показатели в контрольной группе к концу срока наблюдения. Показатели безрецидивной выживаемости (БРВ) больных МРРШМ в основной группе также значимо превосходили таковые в контрольной с высокой степенью достоверности (Р<0,005 на всех этапах наблюдения), составив 61,6±2,2% против 36,3±2,7% к концу срока наблюдения ( Рис. 5).
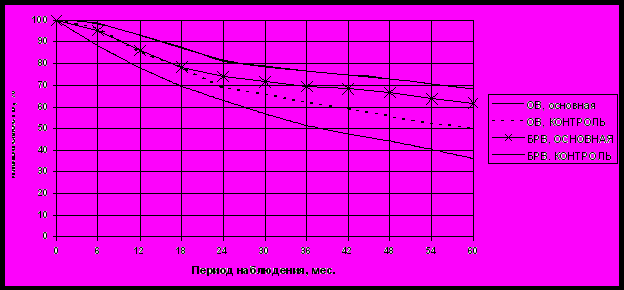
Рис. 5. Общая и безрецидивная выживаемость больных МРРШМ после лечения в основной и контрольной группах (ОВ, ОСНОВНАЯ–общая выживаемость в основной группе; ОВ, КОНТРОЛЬ– общая выживаемость в контрольной группе; БРВ, ОСНОВНАЯ – безрецидивная выживаемость в основной группе; БРВ, КОНТРОЛЬ– безрецидивная выживаемость в контрольной группе).
Показатели ОВ и БРВ у оперированных больных МРРШМ в основной группе были существенно выше таковых в контрольной на всех этапах наблюдения и составляли к концу 5−летнего периода наблюдения 74,0±2,9 против 41,6±5,3 и 71,9±4,6% против 57,9±4,0% соответственно (Р<0,001). Кроме того, показатель БРВ в подгруппе КОМПЛ к концу 5го года наблюдения значимо превышал таковой в подгруппе М−КОМБ − 71,9±4,6 против 57,9±4,0, P=0,04.
Пофакторный анализ зависимости характера прогрессирования от выявленных ранее ФНП продемонстрировал наибольшие уровни корреляции частоты развития отдаленных органных метастазов с метастатическим поражением лимфатических узлов (r=0,997) и выявлением эмболов в сосудистых и лимфатических щелях до начала спецлечения (r=0,83) и после хирургического этапа (r=0,912) во всех подгруппах оперированных больных МРРШМ. Однако, при анализе влияния этого фактора на ОВ и БРВ значимые различия между пациентами No и N1 выявлены только в подгруппах комбинированного лечения основной и контрольной групп, что составило к концу периода наблюдения 78,4±3,8% против 52,8±8,3% (Р=0,005) в основной и 50,0±5,9% против 16,7±7,6% (Р=0,009) в контрольной группах соответственно. Значимых различий показателей ОВ между пациентами No и N1 в подгруппе КОМПЛ не выявлено (70,0±7,2% против 68,5±6,3%, P=0,944). В тоже время при межгрупповом сравнении результатов лечения больных N1 в подгруппах КОМПЛ и М–КОМБ основной группы значимых различий не получено: показатели ОВ составляли 92,6±3,6% против 88,9±5,2% (Р=0,82), 79,6±5,5% против 61,1±8,1% (Р=0,09), 68,5±6,3% и 52,8±8,3% (Р=0,2) на первом, третьем и пятом годах наблюдения соответственно. Дифференцированная оценка влияния различных факторов, способных нивелировать влияние НАХТ на результаты лечения, продемонстрировала сильную корреляционную зависимость показателей ОВ и БРВ у данной категории пациенток от объемов облучения на послеоперационном этапе (r=0,976) и продемонстрировала положительное значение адъювантного облучения вышележащих лимфоколлекторов парааортальной области (Рис.6).
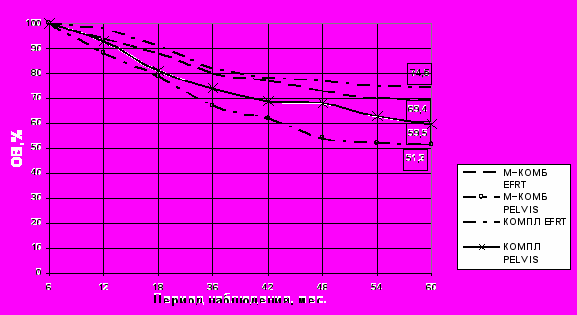
Рис. 6. Общая выживаемость оперированных больных МРРШМ в основной группе с метастазами в тазовые лимфоузлы в зависимости от объемов послеоперационного дистанционного облучения (EFRT– пациентки с адъювантным облучением лимфоузлов парааортальной группы;PELVIS – пациентки с ПОЛТ, ограниченной тазом).
Показатели ОВ и БПВ у неоперированных больных в основной группе значимо превышали соответствующие значения в контрольной группе (P<0,05 при всех погодовых сравнениях), составив к концу периода наблюдения 66,1±3,0% против 53,9±3,3% (P=0,008). При ХЛЛ показатели ОВ значимо превышали таковые в контрольной группе с конца третьего года наблюдения, составив в этот период 75,0±4,1% против 67,2±3,1% (Р=0,025), а к концу 5 года − 69,6±4,3% против 53,9±3,3% (P=0,008) соответственно, однако, при погрупповом анализе значимые различия с контрольной группой выявлены только в подгруппе П−ХЛЛ, где уже к концу второго года наблюдения ОВ составляла 84,6±4,1% против 72,0±2,9% (P=0,038), а к концу периода наблюдения − 74,4±4,9% против 53,9±3,3% (Р=0,002) соответственно. В подгруппе С−ХЛЛ значимых различий с контрольной группой в показателях ОВ не выявлено.
Значимые различия показателей ОВ в подгруппе ЛРМ по сравнению с контрольной группой выявлялись только до конца трехлетнего периода наблюдения (76,8±3,5% против 67,2±3,1%, Р=0,042); при последующем наблюдении значимость различий нивелировалась. Погрупповой анализ показателей ОВ выявил значимые различия показателей при сравнении с контрольной группой только в подгруппах ЛХРМ и ЛИГТ; показатели ОВ в подгруппе КГТ и контрольной группе значимо не отличались (Р≥ 0,528). При этом в подгруппе ЛХРМ значимые различия показателей ОВ по сравнению с контрольной группой прослеживались на втором−четвертом году наблюдения (Р=0,05); на пятом году ОВ падала на 11,5%, на шестом − на 15,4%. В подгруппе ЛИГТ значимые различия показателя ОВ с контрольной группой определялись только в конце второго (86,2±4,3% против 72,0±2,9%, Р=0,029) и пятого года наблюдения (69,2±5,7% против 53,9±3,3%, Р=0,033).
Показатели БРВ у неоперированных больных основной группы значимо превышали аналогичные показатели в контрольной группе, начиная с 3го года наблюдения (Р≤0,043), составив к концу периода наблюдения 60,2±3,1% против 43,1±3,3% соответственно (Р<0,001). При межгрупповом анализе динамика показателей БРВ в целом соответствовала динамике показателей ОВ, при этом в подгруппе ХЛЛ значимые различия с контрольной группой были отмечены только в подгруппе П−ХЛЛ, начиная с 30 месяца наблюдения (79,5±4,4% против 64,7±3,2%, Р=0,022), среди подвариантов ЛРМ значимые различия к концу периода наблюдения зафиксированы только в подгруппе ЛИГТ (66,2±5,9% против 43,1±3,3%, Р= 0,034).
Влияние комплекса выделенных ранее прогностических признаков на ОВ и БРВ и характер прогрессирования у больных МРРШМ в основной группе было анализировано с помощью многофакторного регрессионного анализа Кокса. Констатировано, что вследствие применения модифицированных программ лучевого лечения у оперированных больных МРРШМ утрачивают негативное влияние на БРВ такие факторы, как распространение опухоли на тело матки, влагалище до средней трети, наличие элементов опухоли ближе 5мм к краю резекции, лимфо–васкулярная инвазия стромы шейки матки, метастатическое поражение обтураторных лимфатических узлов. В тоже время модификация ПОЛТ у оперированных больных МРРШМ не снижает значимость неблагоприятного влияния на отдаленные результаты таких факторов, как распространение первичной опухоли на параметральную клетчатку более 1/3 параметрия, наличие после хирургического этапа лечения остаточной опухоли любого размера в тазу, низкая (0−II) степень терапевтического патоморфоза в первичной опухоли и метастатически пораженных подвздошных лимфатических узлах, что требует принципиально иных подходов к адъювантной терапии в таких случаях.
Применение в соответствии с изложенными ранее принципами П-ХЛЛ и ЛИГТ у больных МРРШМ, не подлежащих хирургическому лечению, нивелирует негативное влияние таких факторов, как: распространение опухоли на матку, поражение параметральной клетчатки до 1/3 параметрия, эндофитная форма роста первичной опухоли. При эффективной НАХТ П-ХЛЛ значимо снижает негативное влияние на БРВ таких факторов, как аденогенная гистологическая форма опухоли, лимфо-васкулярная инвазия, эмболы в лимфатических и сосудистых щелях, метастазы в обтураторных, внутренних, наружных подвздошных лимфатических узлах. Негативное влияние таких ФНП, как низкодифференцированная гистологическая форма, инфильтративно−язвенная форма роста первичной опухоли, метастатическое поражение общих подвздошных, парааортальных лимфатических узлов не было преодолено ни в одной из подгрупп консервативного лечения МРРШМ.
В рамках решения седьмой задачи исследования был проведен многопараметровый анализ спектра, частоты и степени тяжести осложнений различных вариантов лечения МРРШМ в основной и контрольной группах в соответствии с международными классификациями NCIC CTCAE v3.0–4.0, RTOG, EORTC, LENT SOMA v.1.3. При этом мы придерживались отечественной традиции дифференцированной оценки реакций, возникающих в процессе лучевого лечения, ранних осложнений, диагностируемых у пролеченных больных на сроке 90-100 дней после окончания лечения и поздних осложнений, возникающих в процессе наблюдения спустя 3 мес. после окончания лечения. Нами не отмечено изменения спектра токсических реакций в основной группе по сравнению с контрольной: все наблюдавшиеся осложнения имели прогнозируемый характер, несмотря на различия, зарегистрированные на этапе НАХТ, связанные с токсическим профилем использованных цитостатиков – таксанов, препаратов платины, гемцитабина, топотекана, кселоды. Наиболее часто в ходе лучевого лечения у больных МРРШМ в обеих группах регистрировались гематологические, гастро–интестинальные токсические реакции и реакции со стороны мочевых путей.
При совокупном анализе нами констатировано значимое снижение токсичности модифицированных программ лечения по сравнению с конвенциальной терапией (Рис.7).
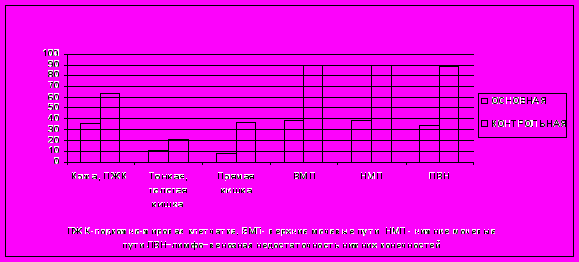 Рис. 7. Сравнительный анализ частоты поздних осложнений в основной и контрольной группах, скоррегированных на показатель безрецидивной выживаемости, к концу 5го года наблюдения.
Рис. 7. Сравнительный анализ частоты поздних осложнений в основной и контрольной группах, скоррегированных на показатель безрецидивной выживаемости, к концу 5го года наблюдения. Так, при сравнении скоррегированных показателей частоты поздних осложнений обращало на себя внимание значимое снижение общей частоты осложнений со стороны кожи и подкожной клетчатки, мочевого пузыря и уретры в основной группе против контрольной, составившие к концу 5го года наблюдения 36,1±3,9% против 63,2±7,5% (Р=0,042) и 38,7±3,9% против 89,5±7,0% (Р<0,001) соответственно. При сравнении скоррегированных показателей частоты поздних осложнений со стороны мочеточников нами отмечено значимое снижение частоты осложнений III cтепени в основной группе по сравнению с контрольной к концу 3го года наблюдения – 9,5±2,3% против 28,6±8,5% (Р=0,011) и осложнений II cтепени к концу 5го года наблюдения – 19,4±3,2% против 42,1±11,3% (Р=0,049) cоответственно. Аналогичные результаты зарегистрированы при сравнительном анализе частоты нарушений лимфо–венозного оттока в основной и контрольной группах – 34,2±3,8% против 89,5±7,0% (Р<0,001) соответственно, со значимым снижением частоты осложнений I cтепени в основной группе– 16,1±3,0% против 52,6±11,5% (Р<0,001) соответственно. Различия между основной и контрольной группами в частоте формирования лимфо–венозной недостаточности II–III cтепени, требовавшей интенсивной сосудистой терапии, статистически не значимы. При анализе скоррегированных показателей гастро−интестинальных осложнений значимые различия между основной и контрольной группой зафиксированы только в частоте осложнений со стороны прямой кишки – 7,7±2,1% против 36,8±11,1% соответственно (Р<0,001).
Выводы.
- Многокомпонентные программы значимо улучшают результаты лечения больных МРРШМ по сравнению с конвенциальной сочетанной лучевой терапией с увеличением пятилетних показателей общей и безрецидивной выживаемости с 50,3±2,8% до 68,6±2,1% и с 36,3±2,7% до 61,6±2,2% соответственно (Р<0,001). Планирование многокомпонентного лечения МРРШМ требует индивидуального анализа клинико-морфологических факторов с формированием карт прогноза на каждом из этапов терапии.
- Стратегическим принципом проведения современной лучевой терапии в рамках многокомпонентного лечения МРРШМ является формирование индивидуальных программ путем дифференцированного выбора объемов облучения, разовой и суммарной очаговых доз и способов ее подведения. Технологическую основу данной стратегии составляют методики визуально−контролируемой лучевой терапии с интеграцией комплексного ультразвукового исследования как базового метода в стандарт топометрии и мониторинга.
- У оперированных больных МРРШМ послеоперационное облучение должно соответствовать радикальному терапевтическому по объему облучения и суммарным дозам; при этом нивелируется негативное влияние таких факторов как распространение опухоли на тело матки, влагалище до средней трети, наличие элементов опухоли ближе 5мм к краю резекции, лимфо–васкулярная инвазия стромы шейки матки, метастатическое поражение обтураторных лимфатических узлов. Позитивное влияние модифицированной программы послеоперационного облучения значимо снижается при продолжительности лучевого этапа более 50 дней, стойкой анемии III степени в ходе облучения.
- Применение модифицированных программ послеоперационной лучевой терапии не изменяет значимо неблагоприятное влияние таких факторов, как распространение первичной опухоли на параметральную клетчатку протяженностью более 1/3 параметрия, наличие после хирургического этапа лечения остаточной опухоли любого размера в тазу, низкая (0−II) степень терапевтического патоморфоза в первичной опухоли и метастатически пораженных подвздошных лимфатических узлах всех групп, что требует принципиально иных подходов к адъювантной терапии в таких случаях.
- Расширение объема ДЛТ с симультантным облучением параааортальных лимфатических узлов на 15–18% улучшает пятилетние результаты излечения больных МРРШМ при высоком риске лимфогенного метастазирования с увеличением показателя общей выживаемости с 59,5±10,9% до 74,5±8,5% в рамках комплексного и с 51,3±7,6% до 69,4±8,5% – в рамках комбинированного лечения.
- Последовательное химио–лучевое лечение МРРШМ с соблюдением принципов индивидуализированной визуально–контролируемой лучевой терапии улучшает отдаленные результаты лечения больных МРРШМ с достижением 5−летней безрецидивной выживаемости 69,2±5,2% против 43,1±3,3% (Р<0,001) по сравнению с традиционной СЛТ без значимого прироста частоты токсических реакций, ранних и поздних осложнений III–IV степени; при этом утрачивается значимость таких ФНП, как распространение опухоли на матку, поражение параметральной клетчатки протяженностью до 2/3 параметрия, эндофитная форма роста первичной опухоли, аденогенная гистологическая форма опухоли при терапевтическом патоморфозе после НАХТ выше II cтепени, метастатическое поражение обтураторных, внутренних и наружных подвздошных лимфатических узлов.
- Проведение последовательного химио–лучевого лечения МРРШМ не улучшает значимо отдаленные результаты при низкодифференцированных, инфильтративно−язвенных формах первичной опухоли, метастатическом поражении общих подвздошных и парааортальных лимфатических узлов, что определяет необходимость применения альтернативных вариантов терапии.
- Симультантное химио–лучевое лечение МРРШМ с одномоментным проведением стандартных курсов ПХТ в платиносодержащих режимах и радикальной СЛТ не улучшает значимо отдаленные результаты по сравнению с конвенциальной СЛТ.
- Локальная лазериндуцированная гипертермия − предпочтительный метод локальной радиомодификации в программах радикального консервативного лечения МРРШМ, обеспечивающий высокий уровень локального контроля и сопоставимые с последовательным химио–лучевым лечением показатели пятилетней безрецидивной выживаемости – 66,2±5,9% против 69,2±5,2% (Р=0,832) при снижении по сравнению с конвенциальной лучевой терапией частоты и степени тяжести поздних осложнений со стороны мочевого пузыря и прямой кишки.
- Проведение многокомпонентного лечения МРРШМ с модификацией в соответствии с разработанными принципами программ лучевой терапии не увеличивает частоту ранних и поздних осложнений в основной группе по сравнению с контрольной со значимым снижением общей частоты поздних осложнений со стороны кожи и подкожной клетчатки до 36,1±3,9% против 63,2±7,5% (Р=0,042), мочевого пузыря и уретры – до 38,7±3,9% против 89,5±7,0% (Р<0,001), мочеточников – до 19,4±3,2% против 42,1±11,3% (Р=0,049), прямой кишки – до 7,7±2,1% против 36,8±11,1% (Р<0,001) к концу 5го года наблюдения.
Практические рекомендации.
- Больным с установленным МРРШМ необходимо проведение многокомпонентной терапии с предпочтительным использованием в программах лечения платиносодержащих схем НАХТ и индивидуализированных вариантов облучения. Проведение симультантного химио–лучевого лечения в платиносодержащих режимах с совмещением стандартных курсов нормодозной ПХТ и радикальной СЛТ нецелесообразно.
- Для выбора и коррекции варианта многокомпонентного лечения при МРРШМ необходимо у каждой больной проводить комплексный анализ клинико-морфологических факторов прогноза с формированием индивидуальных карт их учета до начала лечения и на каждом из его этапов.
- В рамках комплексной предлучевой подготовки и мониторинга лучевого лечения больных МРРШМ необходим регулярный синтез данных рентгеновской компьютерной и/или магнитно-резонансной томографии и комплексного ультразвукового исследования для дифференцированного выбора объемов облучения, разовой и суммарной очаговых доз, способов их подведения к «мишени» и коррекции параметров облучения в ходе лучевого лечения с минимизацией воздействия на критические органы.
- Для контроля положения аппликатора относительно мишени и критических структур, определения клинического терапевтического объема, зон эскалации и щажения при планировании и мониторинге внутриполостного и дистанционного этапов лучевой терапии для всех вариантов лечения МРРШМ целесообразно выполнение комплексной УЗ-топометрии трансабдоминальным, трансвагинальным и трансректальным доступом. Изменение по данным комплексной УЗ–топометрии площади и/или объема «мишени» на 10-15% в процессе лучевого лечения требует коррекции плана облучения на базе повторного КТ/МРТ-планирования.
- Проведение химио-лучевого лечения МРРШМ требует до начала спецлечения учета профиля токсичности выбираемых цитостатиков. Препаратами выбора являются цитостатики с минимальным негативным влиянием на органы ЖКТ и мочевой системы.
- При повышенном риске локального рецидива у оперированных больных МРРШМ, а именно при распространении опухоли на тело матки с его тотальным поражением, инвазией в миометрий более 5мм, наличии элементов опухоли ближе 5мм к краю резекции, вовлечении влагалищной трубки, инфильтрации ретро-везикальной и ректо-вагинальной клетчатки целесообразна эскалация суммарных доз от сочетанной ПОЛТ до СОДэкв 60Гр в культе влагалища и прилежащих структурах за счет интенсификации внутриполостного компонента.
- У больных МРРШМ с высоким риском лимфогенного метастазирования целесообразно расширение объема дистанционной лучевой терапии с симультантным облучением параааортальных лимфатических узлов. Проведение НАХТ не является ни противопоказанием, ни альтернативой расширению объема ДЛТ у данной категории пациенток.
- При развитии в ходе предлучевых этапов осложнений II и более степени со стороны критических органов, а также при выполнении в ходе хирургического этапа транспозиции яичников, необходимо при планировании лучевого лечения дополнительное щажение областей со сниженной тканевой толерантностью. Выявление в зоне послеоперационного облучения лимфокисты, гематомы, выполнение реконструктивно–пластических вмешательств на мочевых путях в ходе хирургического этапа требуют отказа от эскалации или снижения локальных СОД на 15% (8−10 изоГр) в связи с высоким риском обструкции мочевыводящих путей.
- С целью обеспечения высокого уровня локального контроля в ходе лучевого лечения МРРШМ целесообразно применение в качестве радиомодификатора локальной лазериндуцированной гипертермии.
