Лучевая терапия различными видами ионизирующего излучения в комплексном лечении больных раком молочной железы 14. 00. 14 онкология 14. 00. 19 лучевая диагностика, лучевая терапия
| Вид материала | Автореферат |
- Адъювантная лучевая терапия рака желудка. 14. 00. 14 онкология 14. 00. 19 лучевая диагностика,, 304.24kb.
- Современная тактика системной радиотерапии хлоридом стронция-89 в комплексном лечении, 651.21kb.
- Комплексная лучевая диагностика в оценке репаративного процесса при лечении больных, 429.1kb.
- Мр-маммография в планировании объема хирургического лечения рака молочной железы 14., 324.55kb.
- Нейтронная и нейтронно-фотонная терапия злокачественных новообразований слюнных и щитовидной, 340.88kb.
- Рефлексотерапия в реабилитации больных поздними лучевыми повреждениями и паллиативной, 426.37kb.
- Стратегия и тактика лучевой терапии в многокомпонентном лечении местно-распространенного, 1026.52kb.
- Селиверстов Павел Владимирович лучевая диагностика диспластически-дистрофического синдрома, 488.65kb.
- Селиверстов Павел Владимирович лучевая диагностика диспластически-дистрофического синдрома, 488.95kb.
- Ультразвуковое исследование в комплексной лучевой диагностике злокачественных опухолей, 485.88kb.
На правах рукописи
ЖОГИНА ЖАННА АЛЕКСАНДРОВНА
ЛУЧЕВАЯ ТЕРАПИЯ РАЗЛИЧНЫМИ ВИДАМИ ИОНИЗИРУЮЩЕГО ИЗЛУЧЕНИЯ В КОМПЛЕКСНОМ ЛЕЧЕНИИ БОЛЬНЫХ
РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ
14.00.14 – онкология
14.00.19 – лучевая диагностика, лучевая терапия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
Томск – 2008
Работа выполнена в ГУ НИИ онкологии Томского научного центра СО РАМН
Научные консультанты:
доктор медицинских наук,
профессор Мусабаева Людмила Ивановна
доктор медицинских наук,
профессор Слонимская Елена Михайловна
Официальные оппоненты:
доктор медицинских наук, профессор,
заслуженный врач РФ
ГОУ ВПО КрасГМА Росздрава ……………………Дыхно Юрий Александрович
член-корр. РАМН, доктор медицинских наук,
профессор, заслуженный врач РФ
ГОУ ДПО УГМАДО Росздрава Важенин Андрей Владимирович
доктор медицинских наук, профессор
ГОУ ВПО СибГМУ Росздрава Завадовская Вера Дмитриевна
Ведущая организация: ФГУ Московский научно-исследовательский онкологический институт им. П.А. Герцена Росмедтехнологий.
Защита состоится ______________ 2008 г. в ____ часов на заседании диссертационного совета Д.001.032.01 при ГУ НИИ онкологии Томского научного центра СО РАМН (634009, Россия, г. Томск, пер. Кооперативный, 5).
С диссертацией можно ознакомиться в библиотеке ГУ НИИ онкологии Томского научного центра СО РАМН.
Автореферат разослан ______________________2008 г.
У
 ченый секретарь диссертационного совета,
ченый секретарь диссертационного совета,доктор медицинских наук Фролова И.Г.
Актуальность проблемы
Рак молочной железы (РМЖ) занимает лидирующие позиции в структуре онкологической заболеваемости и смертности от злокачественных новообразований среди женщин. По данным Давыдова М.И., Аксель Е.М. (2005) за период с 1996 по 2004 гг. увеличилась доля больных с I-II стадиями опухолевого процесса (61,6 %) и снизилась одногодичная летальность до 11,5 %. При этом, несмотря на достигнутые успехи по выявлению ранних стадий рака молочной железы, больные местно-распространенными формами заболевания составляют от 25,4 до 40 % всех впервые выявленных пациенток.
В настоящее время для лечения рака молочной железы применяется весь комплекс лечебных мероприятий, включающий использование хирургического, лекарственного (химио-, гормонотерапия) и лучевого методов. Лучевая терапия занимает одно из ведущих мест в комплексном лечении ранних и местно-распространенных форм первичного рака молочной железы, а также рецидивов и метастазов опухоли. Как показывает накопленный опыт, возможности лучевой терапии далеко не исчерпаны, идет непрерывный поиск новых, высокоэффективных методов облучения.
Целесообразность проведения адъювантной лучевой терапии в комплексном лечении больных РМЖ T1-2N0-1M0 после органосохраняющих операций не вызывает сомнений, что подтверждается результатами ряда рандомизированных исследований – наблюдается снижение частоты локального рецидивирования с 27,2 % до 8,8 % при 10-летнем сроке наблюдения (Канаев С.В. с соавт., 2006; Летягин В.П., 2006; Fisher B. et al., 2002, 2007). По мнению А. Fortin et al. (1999), сроки возникновения рецидивов РМЖ после «консервативного» лечения составляют от 1 года до 20 и более лет (средний безрецидивный период – 32 месяца) и имеют два пика – через 2 года и 5 лет.
При существующих методиках лучевой терапии не исключена вероятность ухудшения косметического эффекта, а у ряда больных деформация органа за счет фиброзных изменений ткани и уменьшение объема молочной железы (Семиглазов В.Ф., 2002; Магали Я., 2003). Поэтому продолжаются дискуссии по объему тканей, подлежащих облучению, величине дозы на оставшуюся молочную железу, необходимости облучения зон регионарного лимфооттока (Кудрявцев Д.В., 2001; Recht A., 2001; Marinova L., 2001; Horiguchi J. et al., 2002; Shi S.K. et al., 2003).
Весьма важным остается вопрос о необходимости дополнительной лучевой нагрузки на ложе опухоли. По мнению Perez C.A., Taylor M.E. (1997), Lombardi C.P., Rossi S. (1998), Vrieling C. (2002) подведение добавочной дозы 10-16 Гр на ложе опухоли обеспечивает локальный контроль и улучшает показатели пятилетней безрецидивной выживаемости.
На выбор объема необходимых лечебных мероприятий большое влияние оказывают прогностические факторы, коррелирующие с выживаемостью и позволяющие определить группу пациентов с высокой степенью риска развития местного рецидива. Известно прогностическое значение таких параметров, как размер опухоли, ее гистологический вариант, степень злокачественности, наличие метастазов опухоли в регионарных лимфоузлах и их количество, возраст больных (Волченко Н.Н., 2000; Fisher B. et al., 2002; Cbollet P. et al., 2002; Eirmann W. et al., 2003).
Традиционно вышеуказанные порогностические факторы учитываются при назначении нео- и адъювантной химиотерапии и антиэстрогенной терапии (Семиглазов В.Ф., 2005; Early Breast Cancer Trialists, Collaborative Group, 2005; Baselga J. et al., 2006; Rodenhuis S. et al., 2006). В отношении же определения показаний к выбору объема лучевой терапии научные исследования практически отсутствуют.
С 2000 года в ГУ НИИ онкологии ТНЦ СО РАМН в органосохраняющем лечении больных РМЖ T1-2N0-1M0 адъювантная гамма-электронная терапия назначается с учетом прогностических факторов риска развития местного рецидива опухоли. На сегодняшний день накоплен большой клинический материал, который позволяет объективно оценить обоснованность применяемого дифференцированного подхода к планированию послеоперационной лучевой терапии, а также его влияние на отдаленные результаты комплексного лечения больных раком молочной железы T1-2N0-1M0.
Если в органосохраняющем лечении больных раком молочной железы лучевая терапия назначается, преимущественно, в адъювантном режиме, то у больных с местно-распространенными формами РМЖ различные виды ионизирующего излучения применяются как в послеоперационном, так и в предоперационном периоде (Паньшин Г.А., Хмелевский Е.В., 2000; Ryu J.K., 2002; Morgan D. A. et al. 2002; Voordeckers M. et al., 2003).
При использовании редкоионизирущего излучения в предоперационном режиме крупными фракциями частота местных рецидивов рака молочной железы составляет 9-10 %. Это связано с относительной резистентностью РМЖ к фотонному излучению вследствие больших размеров опухоли, гетерогенности опухолевых клеток, наличия гипоксических и аноксических зон в опухоли, где клетки пребывают в состоянии покоя (Курпешев О.К. с соавт., 2003; Bourhis-Martin E. et al., 2003; Kry S.F. et al., 2005; Jiang H. et al., 2005; Halperin E.C., 2006; Mesoloras G. et al., 2006).
Одним из путей повышения эффективности лучевого воздействия считается использование излучений с высокой линейной передачей энергии, в частности быстрых нейтронов. Не имея преимущества в отношении глубинного дозового распределения, быстрые нейтроны более эффективны при лечении радиорезистентных опухолей, благодаря радиобиологическим особенностям своего действия (Мусабаева Л.И., 1991; Мардынский Ю.С. с соавт., 2000; Гулидов И.А. с соавт., 2001; Важенин А.В. с соавт. 2003; Wambersie A. et al., 1994; Sigurdson A. J. et al., 2002; Noеl G. et al., 2003).
В ГУ НИИ онкологии ТНЦ СО РАМН лучевая терапия быстрыми нейтронами 6,3 МэВ на циклотроне У-120 при местно-распространенных формах рака молочной железы применяется с 1984 года. Разработан способ предоперационной нейтронной терапии в комплексе с системными методами воздействия и операцией для лечения больных МР РМЖ (патент РФ № 2186591).
В настоящее время целесообразным представляется изучение отдаленных результатов комплексного лечения больных МР РМЖ с использованием нейтронно-фотонной терапии, оценка выраженности и степени лучевых повреждений нормальных тканей, сравнительный анализ эффективности плотноионизирующего излучения с традиционными видами предоперационной фотонной терапии, а также определение показаний к проведению нейтронной терапии с учетом прогностических факторов.
Другой не менее значимой и важной проблемой является лечение местных рецидивов рака молочной железы, возникающих после радикальных операций, поскольку они развиваются на фоне измененных тканей после проведенного хирургического и/ или лучевого лечения первичного опухолевого процесса и отличаются большой вариабельностью по чувствительности к проводимой химиолучевой терапии (Хмелевский Е.В., 1999; Летягин В.П., 2005).
Лучевая терапия является методом выбора в лечении местно-распространенных рецидивов РМЖ. Применение редкоионизирующих видов лучевой терапии может привести к полной регрессии опухолевых очагов, но не исключает появления повторных рецидивов опухоли. Так, по мнению Тырсиной Е.Г. (2002), рецидивы, появляющиеся после полного курса лучевой терапии, обладают радиорезистентностью и характеризуются меньшей чувствительностью опухоли к повторному воздействию ионизирующего излучения. С этих позиций использование нейтронной терапии у больных с местно-распространенными рецидивами рака молочной железы является весьма перспективным и ранее не применялось.
На сегодняшний день неизученными остаются отдаленные результаты лечения с нейтронной и нейтронно-фотонной терапией больных с местными рецидивами РМЖ. Не проводился сравнительный анализ полученных данных с результатами традиционных видов лучевой терапии. Кроме того, не определена частота и выраженность лучевых реакций и лучевых повреждений нормальных тканей в отдаленный период наблюдения после нейтронной и нейтронно-фотонной терапии у больных первичными МР РМЖ и местными рецидивами рака молочной железы.
Одним из главных критериев, определяющих состояние пациентов, эффективность лечения, является качество жизни. В литературе имеется достаточно большое количество работ, посвященных изучению качества жизни больных раком молочной железы, перенесших комплексное лечение с использованием различных схем и режимов системной химиотерапии, оперативного вмешательства и лучевой терапии (Васютков В.Л. с соавт., 1997; Shimozuma K. et al., 2000; Janni W. et al., 2001; Sharipo K. et al., 2001). В отношении лучевой терапии подобные исследования малочисленны, особенно после применения плотноионизирующего излучения – быстрых нейтронов. С этих позиций оценка качества жизни больных раком молочной железы на этапах лечения, получавших комплексное лечение с применением нейтронной терапии и других видов лучевой терапии, для создания объективной картины о состоянии здоровья данного контингента больных является весьма актуальной.
Все вышеизложенное свидетельствует о том, что роль лучевой терапии в комплексном лечении больных ранними и местно-распространенными формами рака молочной железы, а также рецидивов опухоли весьма существенна. Однако, ряд вопросов, касающихся выбора объема и вида ионизирующего излучения до настоящего времени не нашли своего решения. Все они стояли в центре внимания настоящего исследования и определили его актуальность.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Улучшение результатов комплексного лечения больных первичным раком молочной железы и рецидивами опухоли путем оптимизации подходов к выбору лучевой терапии различными видами ионизирующего излучения.
ЗАДАЧИ ИССЛЕДОВАНИЯ
- Изучить отдаленные результаты органосохраняющего лечения с использованием дифференцированного подхода к планированию смешанной гамма-электронной терапии у больных раком молочной железы T1-2N0-1M0;
- Оценить частоту и степень выраженности лучевых реакций и повреждений нормальных тканей после органосохраняющего лечения с различными видами адъювантной лучевой терапии у больных РМЖ T1-2N0-1M0;
- Изучить эффективность комплексного лечения больных местно-распространенными формами рака молочной железы T2-4N0-2M0 с предоперационным курсом нейтронной терапии;
- Провести сравнительный анализ результатов комплексного лечения больных МР РМЖ T2-4N0-2M0 с применением быстрых нейтронов 6,3 МэВ и различных режимов фракционирования дозы дистанционной гамма-терапии;
- Оценить пятилетние результаты комплексного лечения больных местными рецидивами РМЖ с использованием нейтронной и нейтронно-фотонной терапии по разработанному способу в сравнении с фотонной терапией;
- Изучить частоту и характер отдаленных лучевых повреждений нормальных тканей при местно-распространенных формах РМЖ после комплексного лечения с предоперационным курсом нейтронной терапии и местных рецидивах опухоли после нейтронной и нейтронно-фотонной терапии;
- Оценить качество жизни больных раком молочной железы после комплексного лечения с использованием различных видов ионизирующего излучения;
- Разработать показания к выбору объема и вида лучевой терапии в комплексном лечении больных раком молочной железы различных стадий и местных рецидивов опухоли.
НАУЧНАЯ НОВИЗНА
Впервые на большом клиническом материале изучены отдаленные результаты органосохраняющего лечения больных раком молочной железы T1-2N0-1M0, у которых применялась адъювантная гамма - электронная терапия с учетом факторов, определяющих риск развития местного рецидива опухоли. Показано, что снижение дозы дистанционной гамма-терапии на область оставшейся молочной железы не ухудшает пятилетних результатов органосохраняющего лечения больных ранними формами рака молочной железы и при этом позволяет снизить лучевую нагрузку на организм больной.
Впервые установлено, что использование предоперационного курса нейтронной терапии в СОД-7,2 Гр (ФЭД-38-40 Гр) на область молочной железы в комплексном лечении больных местно-распространенными формами рака молочной железы T2-4N0-2M0 в 7-12 раз снижает частоту местных рецидивов опухоли и достоверно увеличивает продолжительность безрецидивного периода в сравнении с фотонной терапией различными режимами фракционирования дозы. Применение предоперационной нейтронной терапии не сопровождается развитием выраженных общих и местных лучевых реакций кожи и подкожной клетчатки, не вызывает отдаленных лучевых повреждений нормальных тканей за восьмилетний период наблюдения, а также не ухудшает качество жизни больных в сравнении с традиционными режимами фотонной терапии.
Разработан новый способ нейтронно-фотонной терапии в лечении местных рецидивов рака молочной железы (Патент на изобретения РФ № 2286818 от 10.11.06), при реализации которого показана высокая его эффективность. Нейтронная и нейтронно-фотонная терапия в сочетании с системной полихимиотерапией является методом выбора для больных местными рецидивами РМЖ, поскольку позволяет увеличить число полных и частичных регрессий рецидивной опухоли, достоверно увеличить продолжительность безрецидивного периода и улучшить общую выживаемость данного контингента больных. При этом впервые установлено, что частота и степень лучевых повреждений нормальных тканей (кожи, подкожной клетчатки, легочной ткани) в основном соответствуют I-II степени выраженности по шкале RTOG/EORTS (1995 г.).
ПРАКТИЧЕСКАЯ ЗНАЧИМОСТЬ
В результате проведенного исследования определены показания к выбору объема и вида лучевой терапии в комплексном лечении больных первичным раком молочной железы и местными рецидивами опухоли с учетом прогностических факторов, определяющих риск развития местного рецидива опухоли. Дифференцированный подход с учетом факторов низкого и высокого риска развития рецидива опухоли к назначению адъювантной лучевой терапии в органосохраняющем лечении больных ранними формами РМЖ позволяет сохранить адекватный местно-регионарный контроль и снизить лучевую нагрузку на организм больной, не ухудшая косметического эффекта.
Применение предоперационного курса нейтронной терапии в комплексном лечении больных местно-распространенным раком молочной железы T2-4N0-2M0 увеличивает продолжительность выживаемости без признаков рецидива опухоли и опосредованно улучшает показатели безметастатической и общей выживаемости, не увеличивая количество общих и местных лучевых реакций и повреждений нормальных тканей в отдаленный период наблюдения.
Разработки по использованию дифференцированного подхода к планированию смешанной гамма-электронной терапии в комплексном лечении больных РМЖ T1-2N0-1M0 и предоперационного курса нейтронной терапии в комплексном лечении больных МР РМЖ T2-4N0-2M0 включены в сборник «Научные разработки НИИ РАМН – практическому здравоохранению» (выпуск 2, Москва, 2004, с. 64-65, 67) Академии Медицинских Наук России и рекомендованы к применению в учреждениях онкологического профиля. Для врачей онкологических диспансеров создано практическое пособие «Адъювантная лучевая терапия в комплексном лечении больных раком молочной железы T1-2N0-1M0» (2002 г.).
Разработанные способы лечения больных первичным раком молочной железы и местными рецидивами опухоли внедрены в практику клинических отделений: общей онкологии, химиотерапии, радиологии ГУ НИИ онкологии Томского научного центра СО РАМН, а также Томского областного онкологического диспансера.
Результаты проведенных научных исследований могут быть использованы в качестве учебных пособий для студентов кафедры онкологии ГУ НИИ онкологии и кафедры лучевой диагностики, лучевой терапии СГМУ.
ОСНОВНЫЕ ПОЛОЖЕНИЯ, ВЫНОСИМЫЕ НА ЗАЩИТУ:
- Дифференцированный подход к назначению адъювантной электронной и смешанной гамма-электронной терапии с учетом основных прогностических критериев, определяющих степень риска развития местного рецидива у больных ранними формами рака молочной железы после выполнения органосохраняющих операций, способствует уменьшению числа местных рецидивов опухоли и улучшению показателей общей, безрецидивной и безметастатической выживаемости, а также снижает лучевую нагрузку на организм больной при сохранении высокого качества жизни пациенток.
- Применение предоперационного курса нейтронной терапии в комплексном лечении местно-распространенных форм рака молочной железы T2-4N0-2M0 достоверно снижает частоту местных рецидивов опухоли и увеличивает показатели восьмилетней выживаемости без признаков рецидива опухоли, при умеренном количестве лучевых повреждений нормальных тканей в сравнении с фотонной терапией различными режимами фракционирования дозы.
- Использование нейтронной и нейтронно-фотонной терапии в лечении первичных местно-распространенных рецидивов рака молочной железы и рецидивов после ранее проведенной фотонной терапии способствует достоверному увеличению частоты местного излечения и повышает продолжительность безрецидивного периода.
- Планирование объема лучевой терапии различными видами ионизирующего излучения на основании клинико-морфологических факторов прогноза повышает ее эффективность в комплексном лечении больных первичным раком молочной железы и рецидивами опухоли, не ухудшая качества жизни пациенток.
АПРОБАЦИЯ ДИССЕРТАЦИИ
Основные положения проведенных исследований, доложены и обсуждены на заседаниях областного научно-практического общества онкологов, Томск, (2001-2007); III Всероссийской конференции «Актуальные вопросы клинической и экспериментальной онкологии», Москва (2001); I Всесоюзной научно-практической конференции с международным участием «Актуальные вопросы маммологии», Москва (2001); научно - практической конференции «Актуальные проблемы рака молочной железы», Междуреченск (2003); Российском научном форуме с международным участием «Радиология – 2003», Москва (2003); научно-технической конференции «Лазеры на парах металлов и их применение», посвященной 15-летию лаборатории лазерной физики и кристаллофизики Томского государственного университета, Томск, (2003); V Международном конгрессе молодых ученых и специалистов «Науки о человеке», Томск, (2004); V научной конференции СО РАМН «Фундаментальные и прикладные проблемы современной медицины», Новосибирск, (2004); научно-практическом семинаре «Исследование качества жизни в онкологии», Томск, (2005); II Евразийском конгрессе по медицинской физике и инженерии «Медицинская физика – 2005», Москва, (2005); VI Всероссийском съезде онкологов. Ростов-на-Дону, (2005); I конгрессе онкологов республики Узбекистан «Актуальные проблемы онкологии», Ташкент. (2005); II научно-практической конференции онкологов Уральского федерального округа «Лечение рака в ХХI веке», Челябинск, (2006); научно-практической конференции «Физико-технические проблемы гарантии качества лучевой терапии», Обнинск, (2006); III Международной ежегодной конференции «Проблемы диагностики и лечения рака молочной железы» Санкт-Петербург, (2006); научно-практической конференции с международным участием «Лучевое и химиолучевое лечение в клинической онкологии», Египет, (2007); IV Международной ежегодной конференции «Проблемы диагностики и лечения рака молочной железы», Санкт-Петербург, (2007); Всероссийской научно-практической конференции с международным участием «Профилактика и лечение злокачественных новообразований на современном этапе», Барнаул, (2007).
ПУБЛИКАЦИИ
По теме диссертации опубликовано 67 печатных работ, отражающих основные положения диссертации, из них 11 журнальных статей, 9 из которых в рекомендованных ВАК изданиях, 56 тезисных работ в материалах региональных, Всероссийских и зарубежных съездов и конференций. Материалы исследования использованы при написании монографии – «Современные методы лучевой терапии рака молочной железы» (2003). Имеется 1 патент РФ на изобретение.
ВНЕДРЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯ
Разработанные способы лечения больных первичным раком молочной железы и местными рецидивами опухоли внедрены в клиническую практику: отделений общей онкологии, химиотерапии, радиологии ГУ НИИ онкологии ТНЦ СО РАМН (Томск); отделения радиологии и общей онкологии Томского областного онкологического диспансера.
ОБЪЕМ И СТРУКТУРА ДИССЕРТАЦИИ
Диссертация изложена на 292 страницах машинописного текста, включает введение, 5 глав, заключение, выводы и практические рекомендации. Работа иллюстрирована 76 рисунками и 33 таблицами. Список литературы содержит 386 источников, из них 108 отечественных и 278 зарубежных авторов.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
В настоящее исследование включено 623 больные раком молочной железы, получавшие комплексное лечение в отделениях общей онкологии и радиологии ГУ НИИ онкологии ТНЦ СО РАМН с 1985 по 2006 годы.
В зависимости от распространенности, характера опухолевого процесса все пациентки были разделены на три группы. В I группу вошло 277 больных с ранними формами рака молочной железы T1-2N0-1M0, во II группу - 258 пациенток с местно-распространенными формами РМЖ T2-4N0-2M0 и в III группу – 88 больных с местными рецидивами рака молочной железы (рис. 1)
I группа – больные РМЖ T1-2N0-1M0, получавшие органосохраняющее лечение с адъювантной лучевой терапией (n=277).
Срок наблюдения за пациентками составил от 1 года до 7 лет, средний период наблюдения - 5±1,3 лет. Возраст больных варьировал от 25 до 76 лет, средний возраст - 47,5±2,8 лет.
Комплексное лечение 277 больных операбельными формами РМЖ включало проведение: 2-4 курсов неоадъювантной химиотерапии по схемам CMF/CAF (стандартными дозами), органосохраняющей операции, адъювантной химиотерапии по вышеуказанным схемам. Антиэстрогенная терапия (тамоксифен, фемара) назначалась по показаниям.
Больные раком молочной железы (n=623)


I группа
РМЖ T1-2N0-1M0
(n=277)
II группа
МР РМЖ T2-4N0-2M0
(n=258)
III группа
местные рецидивы РМЖ
(n=88)
Ia группа (исследуемая)
(n=159)
Электронная терапия на п/о рубец
(СОД – 15-18 изоГр)
Дистанционная гамма-терапия на область оставшейся молочной железы (СОД- 40 Гр). Курсовая доза –
55-58 изоГр в области ложа удаленной опухоли
(n=66) и в сочетании
с ДГТ на зоны л/оттока
(СОД- 40-44 Гр) (n=86)
Электронная терапия на ложе удаленной опухоли
(СОД-40-45 изоГр) (n=7)
Ib группа (контрольная)
(n=118)
Дистанционная гамма-терапия на область оставшейся молочной железы (СОД- 50-55 Гр) и зоны регионарного л/оттока
(СОД- 40-44 Гр)
IIа группа (исследуемая)
(n=97)
Предоперационная
нейтронная терапия на обл. молочной железы
(СОД-38-40 изоГр)
IId группа (контрольная )
(n=83)
Без предоперационной лучевой терапии
Послеоперац. ДГТ
на зоны л/оттока
(СОД-40-44 изоГр)
IIIb группа
(контрольная)
(n=41)
Электронная
терапия
(СОД – 60-65 изоГр)
IIIa группа (исследуемая)
(n=40)
Нейтронно-
фотонная
терапия
(СОД–60-65 изоГр)
Нейтронная терапия (n=7)
Группы сравнения
IIb (n=40) Предоперационная гамма-терапия на обл. молочной железы крупные фракции (СОД-30-35 Гр)
IIc (n=38) Предоперационная гамма-терапия на обл. молочной железы в стандартном режиме (СОД-40-44 Гр)
Рис.1 Дизайн лечения больных первичным раком молочной железы и местными рецидивами опухоли в зависимости от вида и методики лучевой терапии
В зависимости от применяемой методики адъювантной лучевой терапии (АЛТ) больные распределялись на две группы:
Iа Исследуемая группа (n=159). Адъювантная лучевая терапия включала проведение электронной терапии на послеоперационный рубец (СОД - 15-18 изоГр) и дистанционной гамма-терапии в стандартном режиме на область оставшейся молочной железы (СОД- 40 Гр). Курсовая доза в области ложа удаленной опухоли составила 55-58 изоГр. Дистанционная гамма-терапия на зоны регионарного лимфооттока проводилась только по показаниям у 86 из 159 пациенток в стандартном режиме до СОД- 40-44 Гр.
Ib Контрольная группа (n=118). Адъювантная лучевая терапия включала проведение дистанционной гамма-терапии в стандартном режиме на область оставшейся молочной железы (СОД- 50-55 Гр) и на зоны регионарного лимфооттока (СОД- 40-44 Гр).
Изучаемые группы были репрезентативны по основным клинико-морфологическим параметрам.
Методики лучевой терапии.
Методика электронной и смешанной гамма-электронной терапии.
Лучевая терапия быстрыми электронами проводилась только на область послеоперационного рубца на малогабаритных бетатронах с энергией 7-10 МэВ, 80 % изодоза располагалась на глубине 1,8-2,0 см от поверхности поля облучения. Размеры полей облучения: 6х6 см, 6х8 см, 6х10 см. Режим фракционирования: РОД – 3-4 Гр, 3 фракции в неделю.
Адъювантная лучевая терапия в исследуемой группе проводилось с учетом клинико-морфологических факторов, определяющих степень риска местных рецидивов РМЖ. Факторы высокого риска развития рецидива: размер опухолевого очага более 2 см, локализация новообразования во внутренних квадрантах молочной железы, мультицентричный рост опухоли, наличие метастазов в регионарных лимфоузлах (рN1), инфильтрирующие формы рака (инвазивный протоковый, инвазивный дольковый и их комбинации), степень злокачественности II-III, отрицательный рецепторный статус и т.д. Наличие хотя бы двух из перечисленных критериев являлось основанием для проведения адъювантной лучевой терапии в полном объеме на область оставшейся молочной железы и зоны регионарного лимфооттока.
У семи больных РМЖ T1N0M0 в связи с наличием опухолевого очага ≤ 1 см в диаметре и отсутствием факторов высокого риска местного рецидива был проведен самостоятельный курс электронной терапии на область послеоперационного рубца СОД - 40-45 Гр по изоэффекту.
При смешанной гамма-электронной терапии у 152 больных исследуемой группы СОД быстрых электронов на область послеоперационного рубца составляла 15-18 Гр по изоэффекту. Дополнительно на аппарате «Рокус-М» проводили дистанционную гамма-терапию на оставшуюся молочную железу в стандартном режиме фракционирования дозы до СОД - 40 Гр. Курсовая доза смешанной гамма-электронной терапии в области ложа удаленной опухоли - 55-58 Гр по изоэффекту.
У 86 больных с наличием факторов высокого риска местного рецидива дополнительно проводилась ДГТ на зоны регионарного лимфооттока в стандартном режиме СОД-40-44 Гр.
Продолжительность курса адъювантной смешанной гамма-электронной терапии составила 25 - 35 дней.
В контрольной группе все пациентки получали ДГТ на область оставшейся молочной железы и зоны регионарного лимфооттока в стандартном режиме фракционирования дозы, СОД - 50-55 Гр и 40-44 Гр, соответственно. Продолжительность курса дистанционной гамма-терапии - 35 - 45 дней.
II группа – больные с местно-распространенными формами рака молочной железы T2-4N0-2M0, получавшие комплексное лечение с выполнением радикальной мастэктомии, проведением системной химиотерапии и лучевой терапии (n=258).
Срок наблюдения за пациентками составил от 1 года до 10 лет, средний период наблюдения - 8±1,6 лет. Возраст больных варьировал от 28 до 74 лет, средний возраст составил 50,1±6,4 лет.
Программа комплексного лечения 258 больных МР РМЖ включала: 2-4 курса неоадъювантной химиотерапии по различным схемам (CMF; CAF, FAC), радикальную мастэктомию, лучевую терапию различными видами ионизирующего излучения в пред- и послеоперационных режимах, адъювантную химиотерапию по вышеуказанным схемам и антиэстрогенную терапию (по показаниям).
В зависимости от вида и режима лучевой терапии были сформированы четыре группы больных местно-распространенным раком молочной железы:
IIa Исследуемая группа представлена 97 пациентками, которые получали комплексное лечение с использованием предоперационного курса быстрыми нейтронами 6,3 МэВ: РОД-2,4 Гр, 3 сеанса (интервал 48-72 часа), СОД- 7,2 Гр (ФЭД- 38-40 Гр).
Методика нейтронной терапии.
Нейтронная терапия на циклотроне У-120 проводилась на область пораженной молочной железы. Размеры полей облучения в зависимости от величины молочной железы варьировали от 6x8 см до 10x12 см. Применяли два встречных или тангенциальных поля облучения. Расстояние источник - поверхность (РИП) составляло 110 см.
Дозиметрическое планирование нейтронной терапии РМЖ проводилось с помощью компьютерной программы, созданной на основе данных, полученных при изучении закономерностей распределения дозы нейтронов в тканеэквивалентной среде, зависимости ОБЭ нейтронов от дозы и усовершенствовании модели ВДФ (Лисин В.А., 1986, 1988).
Через 5-10 дней после окончания нейтронной терапии выполнялось оперативное вмешательство в объеме радикальной мастэктомии с сохранением большой или обеих грудных мышц.
Курс послеоперационной ДГТ в стандартном режиме СОД-40-44 Гр на зоны регионарного лимфооттока получили 77 из 97 пациенток.
В группы сравнения вошли 78 больных МР РМЖ, которым проводилась предоперационная дистанционная гамма-терапия на область молочной железы.
IIb Группа сравнения (n=40) предоперационный курс дистанционной гамма-терапии в режиме крупного фракционирования дозы: РОД - 4-5 Гр, 5-6 фракций, СОД - 20-25 Гр (ФЭД- 35-40 Гр по изоэффекту). На 5-7-й день после окончания облучения выполнялась операция в объеме радикальной мастэктомии. В послеоперационном периоде всем больным назначалась дистанционная гамма-терапия на зоны регионарного лимфооттока в стандартном режиме СОД-40-44 Гр.
IIс Группа сравнения состояла из 38 больных МР РМЖ, которым назначался курс предоперационной дистанционной гамма-терапии на молочную железу и зоны регионарного лимфооттока по стандартной методике: РОД-2,0 Гр, 5 раз в неделю, СОД-40-44 Гр. Далее через 20-25 дней после окончания лучевого воздействия выполнялась операция в объеме радикальной мастэктомии.
IId Контрольная группа (исторический контроль) – 83 больных, которым не проводили предоперационного курса лучевой терапии. В послеоперационном периоде проводилась ДГТ в стандартном режиме фракционирования дозы на зоны регионарного лимфооттока СОД-40-44 Гр. Область послеоперационного рубца не облучалась.
Изучаемые группы были репрезентативны по основным клинико-морфологическим параметрам.
III группа - больные с местными рецидивами РМЖ, получавшие различные виды химиолучевой терапии (n=88.)
Срок наблюдения за больными с местными рецидивами РМЖ составил от 1 года до 10 лет, в среднем - 5±2,6 лет. Возраст пациенток варьировал от 34 до 70 лет, средний возраст составил 52,5 ± 1,0 года.
По поводу первичной опухоли всем 88 больным РМЖ T2-4N0-2M0 было проведено комплексное лечение, включавшее нео- и адъювантную полихимиотерапию по схемам CMF, CAF, FAC, радикальную мастэктомию, гормонотерапию (по показаниям). В восьми случаях (9,1 %) из 88 больных проведена предоперационная гамма-терапия на область молочной железы в режиме крупного фракционирования дозы: РОД – 4-5 Гр, 4-6 сеансов, СОД – 32-40 Гр по изоэффекту и в одном случае (1 %) из 88 больных - предоперационная ДГТ на область молочной железы в режиме стандартного фракционирования: РОД – 2 Гр, 22 сеанса, СОД – 44 Гр.
Средний срок появления местных рецидивов составил – 2,53,0 года, у большинства пациенток отмечался местно-распространенный характер процесса.
Всем 88 пациенткам после верификации диагноза местного рецидива РМЖ проводилось комплексное лечение с использованием полихимиотерапии по схемам CMF или CAF и различных видов лучевой терапии, по показаниям назначалась гормонотерапия (тамоксифен, фемара)
В зависимости от применяемой методики лучевой терапии все пациентки были разделены на две группы.
В IIIa исследуемую группу вошло 47 (53,4 %) больных с местно-распространенным рецидивом рака молочной железы.
Лучевую терапию проводили по разработанному способу (Патент РФ № 2286818 от 10.11.06 г.).
На I этапе назначали 3-4 сеанса лучевой терапии быстрыми нейтронами 6,3 МэВ, с интервалом 48-72 часа (2 раза в неделю), на область рецидива опухоли и окружающую нормальную ткань на расстоянии не менее 3-5 см от опухолевых очагов, РОД на очаг – 1,6-2,0 Гр (ОБЭ-2,91-2,79), на кожу - 2,0-2,2 Гр, до СОД на очаг - 6,6±1,5 Гр, на кожу – 8,3±1,3 Гр.
На II этапе в зависимости от распространенности местного рецидива проводили гамма - или электронную терапию в стандартном режиме непосредственно на область рецидивной опухоли. При опухолевой инфильтрации глубоких слоев подлежащих тканей или поражении костных структур (ребер) ДГТ назначали в режиме: РОД – 2,0 Гр, 5 раз в неделю, до суммарной курсовой дозы нейтронно-фотонной терапии 60 Гр по изоэффекту. При наличии поражения только кожи и подкожной клетчатки и при отсутствии опухолевой инфильтрации подлежащих тканей проводили электронную терапию в режиме: РОД – 3,0 Гр, 5 раз в неделю, до суммарной курсовой дозы нейтронно-фотонной терапии 60 Гр по изоэффекту (100 усл. ед. ВДФ).
Длительность всего курса нейтронно-фотонной терапии не превышала 20-25 дней.
Большее число больных с местными рецидивами РМЖ (n=40) получили смешанную нейтронно-фотонную терапию. У 7 пациенток на область рецидива опухоли была проведена только нейтронная терапия, ввиду полной регрессии опухолевых очагов. При этом у двух больных в режиме: РОД-1,4; СОД- 48-62 Гр по изоэффекту и у пяти пациенток – в режиме: РОД - 1,6-2,0 Гр, СОД-27,5-32 Гр по изоэффекту
В IIIb контрольной группе наблюдалась 41 (46,6 %) больная с местными рецидивами РМЖ, которым в плане комплексного лечения проводился радикальный курс электронной терапии на зону опухолевого поражения. Электронная терапия осуществлялась на малогабаритном бетатроне ПМБ – 7-10 МэВ в режиме: РОД – 3 Гр, 5 фракций в неделю. Суммарная очаговая доза электронной терапии составила 48 Гр, что соответствовало 60-65 Гр по изоэффекту.
Изучаемые группы больных были репрезентативны по основным клинико-морфологическим параметрам.
Из 47 пациенток IIIa группы у 39 (83 %) наблюдались первичные местные рецидивы РМЖ, а в 8 (17 %) случаях диагностировались повторные рецидивы опухоли после ранее проведенного комбинированного лечения. В шести из восьми наблюдений повторный рецидив опухоли был отмечен после ранее проведенной электронной терапии по радикальному курсу (СОД - 60-65 изоГр) и в двух - после иссечения первичного рецидива и послеоперационной электронной терапии.
В контрольной группе у 25 (61 %) из 41 больной имелся первичный местный рецидив в области послеоперационного рубца и мягких тканей передней грудной стенки, а в 16 (39 %) случаях отмечались повторные рецидивы, как вне зоны облучения, так и на месте ранее существующих очагов.
Лечение местных лучевых реакций кожи и повреждений нормальных тканей у больных первичным РМЖ и с рецидивами опухоли, осуществляли с помощью лазера на парах меди с одновременным воздействием двух длин волн 510,6 нм и 578,2 нм, длительностью импульса 20 нс с частотой следования 10-15 кГц (Патент РФ № 2086273). Доза излучения лазера на окружающие ткани составляла 3-4 Дж/см2, терапию проводили ежедневно, общий курс лечения - 8-10 сеансов. Так же использовалась отечественная мазь «Тизоль».
Критерии оценки эффективности комплексного лечения больных изучаемых групп.
Основными критериями оценки эффективности комплексного лечения с использованием различных видов и режимов лучевой терапии у больных первичным РМЖ и с местными рецидивами опухоли являлись:
- переносимость больными предлагаемых программ комплексного лечения;
- степень регрессии опухолевых очагов (по данным инструментального обследования и морфологического исследования операционного материала);
- частота и сроки появления первичных и повторных рецидивов, метастазов и летальных исходов;
- показатели общей, безрецидивной и безметастатической выживаемости в различные периоды наблюдения (моментный метод Kaplan-Meier с применением Log-Rank-теста, статистически значимыми считались различия при p0,05);
- частота, характер и сроки появления местных лучевых реакций и поздних лучевых повреждений окружающих нормальных тканей (кожа, легкие) (шкала RTOG/EORTS, 1995 г.).
Изучение качества жизни больных РМЖ проводилось в рамках Международного сотрудничества с Европейской организацией исследования и лечения рака. Для выполнения цели исследования были использованы наиболее чувствительный при онкологических заболеваниях опросник EORTC QLQ-C30 (version 3.0) и специфический опросник для молочной железы EORTC QLQ-BR23.
Статистическая обработка полученных результатов исследования проводилась с помощью пакета программ «STATISTICA for Windows» фирмы Stat Sofort версия 6.0, путем вычисления критерия t Съюдента и показателя соответствия Пирсона.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
Органосохраняющее лечение больных РМЖ T1-2N0-1M0 с применением адъювантной лучевой терапии и системной полихимиотерапии
Рецидивы опухоли были диагностированы в исследуемой группе у 11 (6,9±2,0 %) из 159 больных РМЖ T1-2N0-1M0 за пятилетний период наблюдения. В группе контроля этот показатель был несколько выше и составил 11±2,9 % (13 случаев из 118 наблюдений) (p>0,05). Анализ сроков появления рецидивов РМЖ, показал, что их наибольшее количество было выявлено в первые два года наблюдения и через пять лет после органосохраняющего лечения (табл. 1).
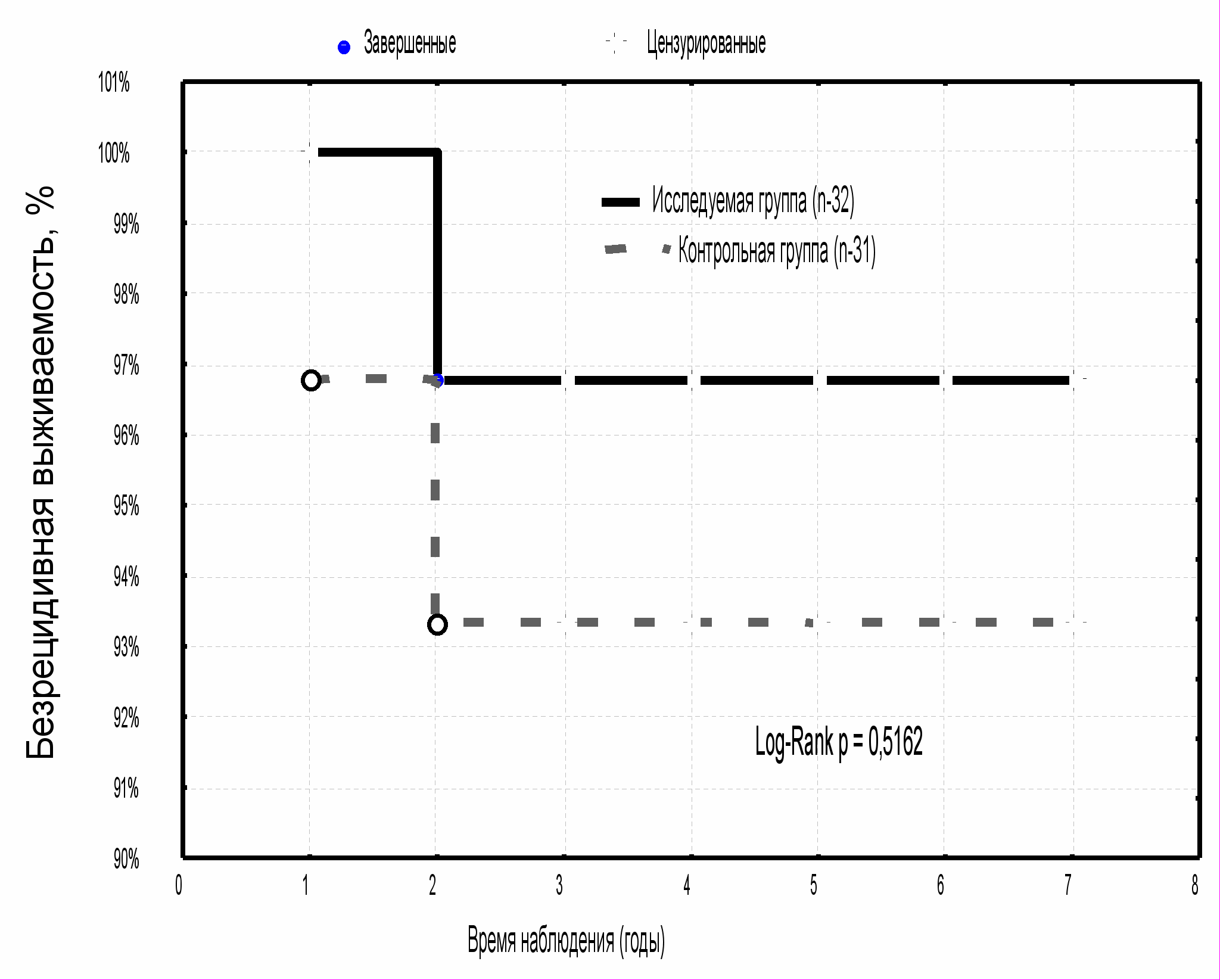
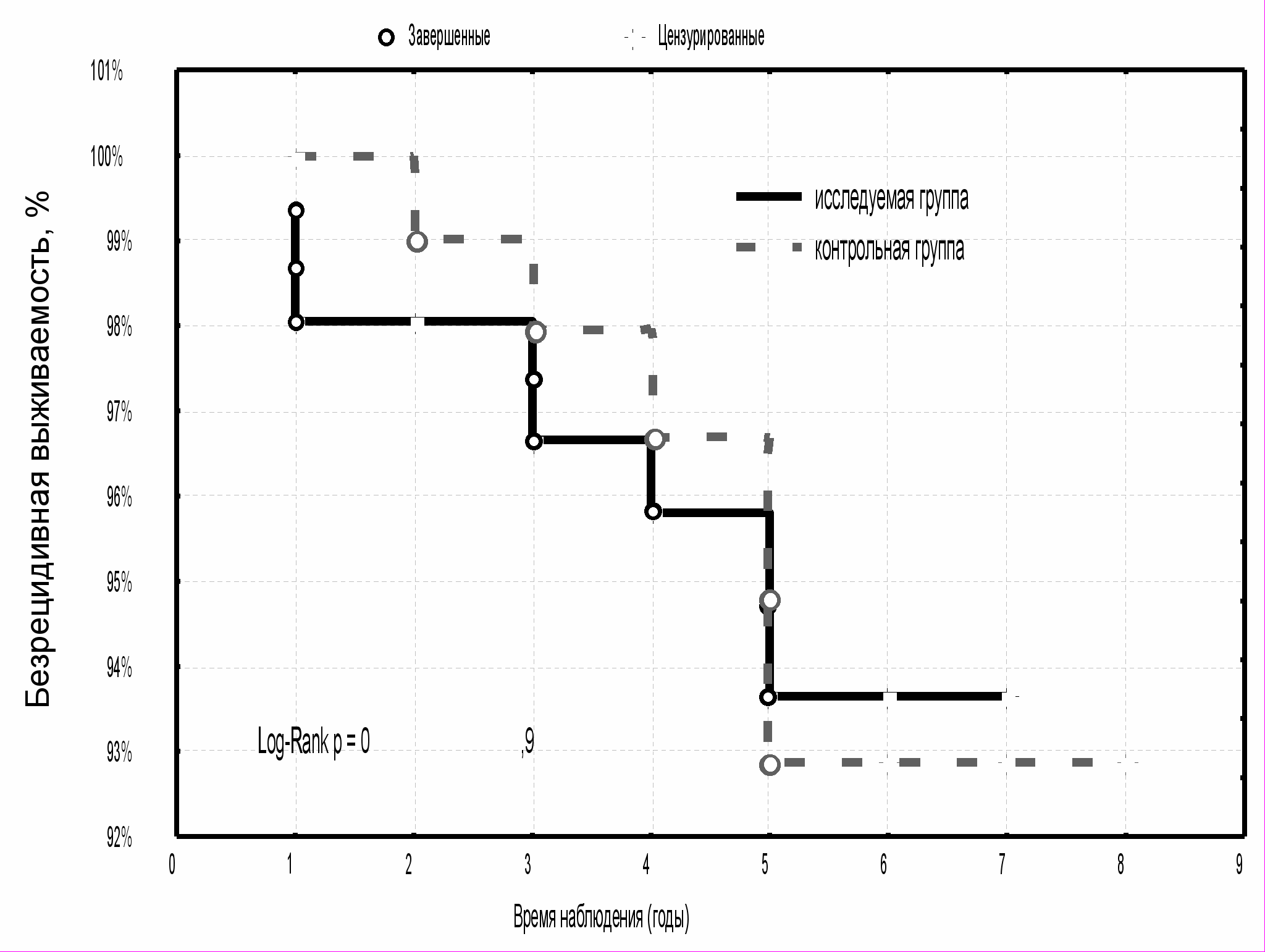
Показатели безрецидивной выживаемости за пятилетний период наблюдения у больных РМЖ T1N0M0 в исследуемой группе были наиболее высокими и составили 96,8±3,2 % против 93,3±4,6 % в контрольной группе (p>0,05) (рис. 2). Пятилетняя безрецидивная выживаемость у больных РМЖ T2N0M0 исследуемой группы также имела положительную тенденцию увеличения (92,7±3,6 %) в сравнении с контролем (84,5±6,6 %) (p>0,05) (рис. 3). Наиболее низкие показатели пятилетней безрецидивной выживаемости в изучаемых группах были отмечены у больных РМЖ с наличием метастазов в регионарных лимфатических узлах (N1): в исследуемой группе - 88,7±4,5 %, в контрольной группе - 82,0±7,1 % (р>0,05) (рис. 4).
В процессе динамического наблюдения у 13 (8,2±4,7 %) из 159 больных РМЖ T1-2N0-1M0 исследуемой группы и у 15 (12,7±9,4 %) из 118 пациенток контрольной группы были диагностированы отдаленные метастазы опухоли (p=0,08). Признаков генерализации опухолевого процесса не было выявлено лишь у 32 больных РМЖ T1N0M0 исследуемой группы, при этом пятилетняя безметастатическая выживаемость составила 100 % против 96,8±3,2 % в группе контроля (р>0,05). Частота появления метастазов у больных РМЖ T2N0M0 составила 7,7 % в исследуемой и 14,3 % в контрольной группе (р>0,05). Поэтому пятилетние показатели были несколько выше в исследуемой группе - 90,7±4,1 % против 82,4±6,6 % в контроле (р>0,05).
Количество метастазов у больных РМЖ T1-2N1M0 в сравниваемых группах было практически одинаковым по восемь случаев в каждой группе, что составило 12,9 % в исследуемой и 20 % - в группе контроля (р>0,05). За период пятилетнего динамического наблюдения показатели безметастатической выживаемости составили 83,5±5,5 % и 76,3±7,2 %, соответственно (р>0,05).
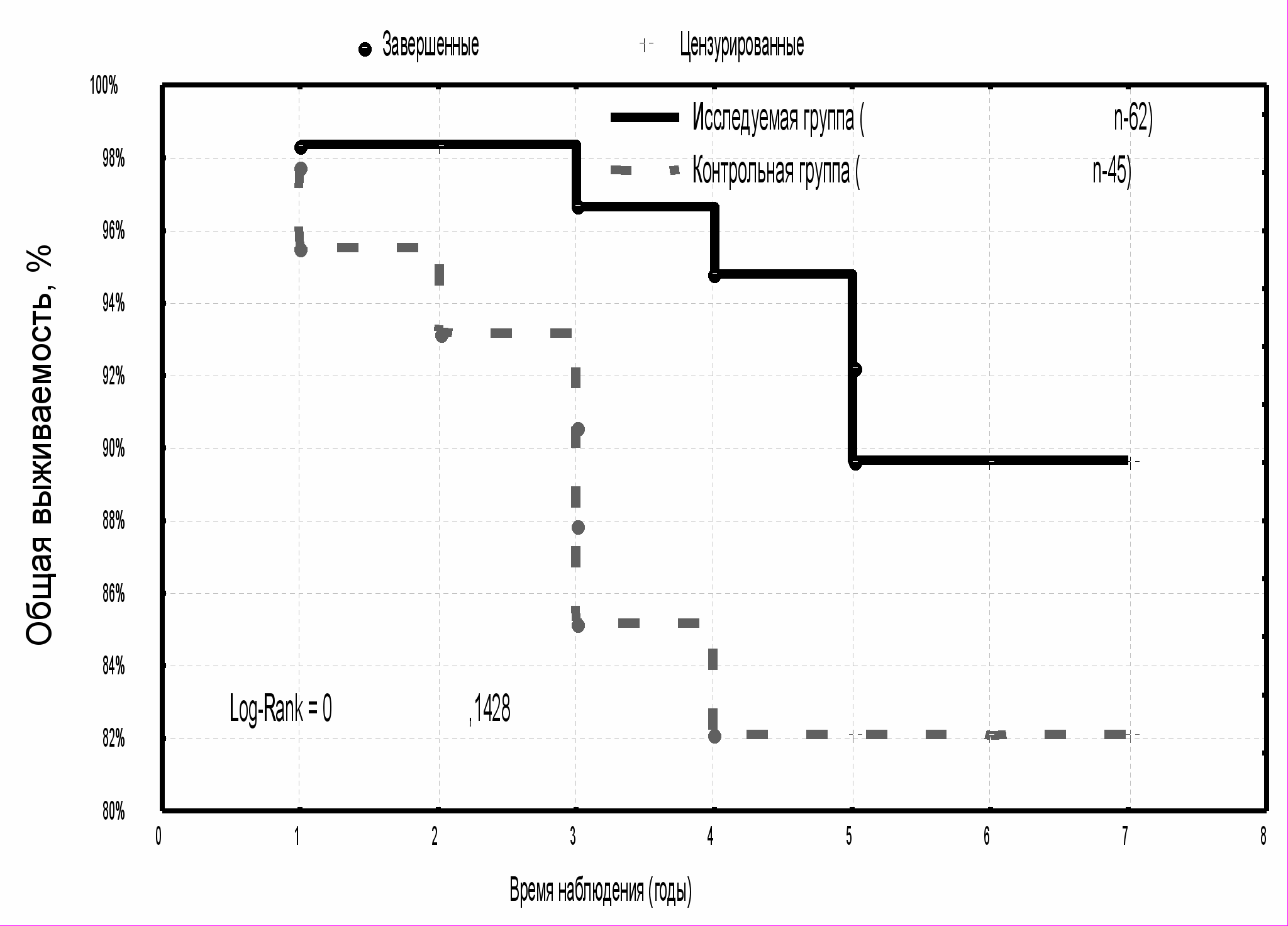
Аналогичная картина наблюдалась по частоте появления летальных исходов и показателям пятилетней общей выживаемости (табл. 2). Больные РМЖ T1N0M0 исследуемой группы не имели случаев летального исхода, общая пятилетняя выживаемость составила 100 % против 96,8±3,2 % - в группе контроля (р>0,05). Из 65 больных РМЖ T2N0M0 было выявлено два случая (3,1 %) смерти, в группе контроля - 4 (9,5 %) наблюдения из 42 пациенток. Показатели пятилетней общей выживаемости в исследуемой группе составили 96,2±2,7 %, а в группе контроля - 87,4±5,9 % (рис. 5) (p>0,05).
Таблица 1
Частота и сроки появления местных рецидивов опухоли у больных РМЖ
в зависимости от стадии заболевания и методики адъювантной лучевой терапии
| Сроки наблюдения, годы | Количество местных рецидивов, абс. число (%) | |||||
| РМЖ T1N0M0 | РМЖ T2N0M0 | РМЖ T1-2N1M0 | ||||
| Исследуемая группа (n=32) | Контрольная группа (n=31) | Исследуемая группа (n=65) | Контрольная группа (n=42) | Исследуемая группа (n=62) | Контрольная группа (n=45) | |
| 1 | - | 1 (3,2 %) | - | 1 (2,4 %) | 2 (3,2 %) | 1 (2,2 %) |
| 2 | 1 (3,1 %) | 1 (3,2 %) | 1 (1,6 %) | 1 (2,4 %) | 1 (1,6 %) | 2 (4,4 %) |
| 3 | - | - | 2 (3,1 %) | 1 (2,4 %) | 1 (1,6 %) | 1 (2,2 %) |
| 4 | - | - | - | - | 1 (1,6 %) | 1 (2,2 %) |
| 5 | - | - | 1 (1,6 %) | 2 (4,8 %) | 1 (1,6 %) | 1 (2,2 %) |
| Всего | 1 (3,1 %) | 2 (6,4 %) | 4 (6,2 %) | 5 (12 %) | 6 (9,7 %) | 6 (13,3 %) |
 |  |
| Рис. 2 Безрецидивная выживаемость больных РМЖ T1N0M0 в зависимости от методики адъювантной лучевой терапии | Рис. 3 Безрецидивная выживаемость больных РМЖ T2N0M0 в зависимости от методики адъювантной лучевой терапии |
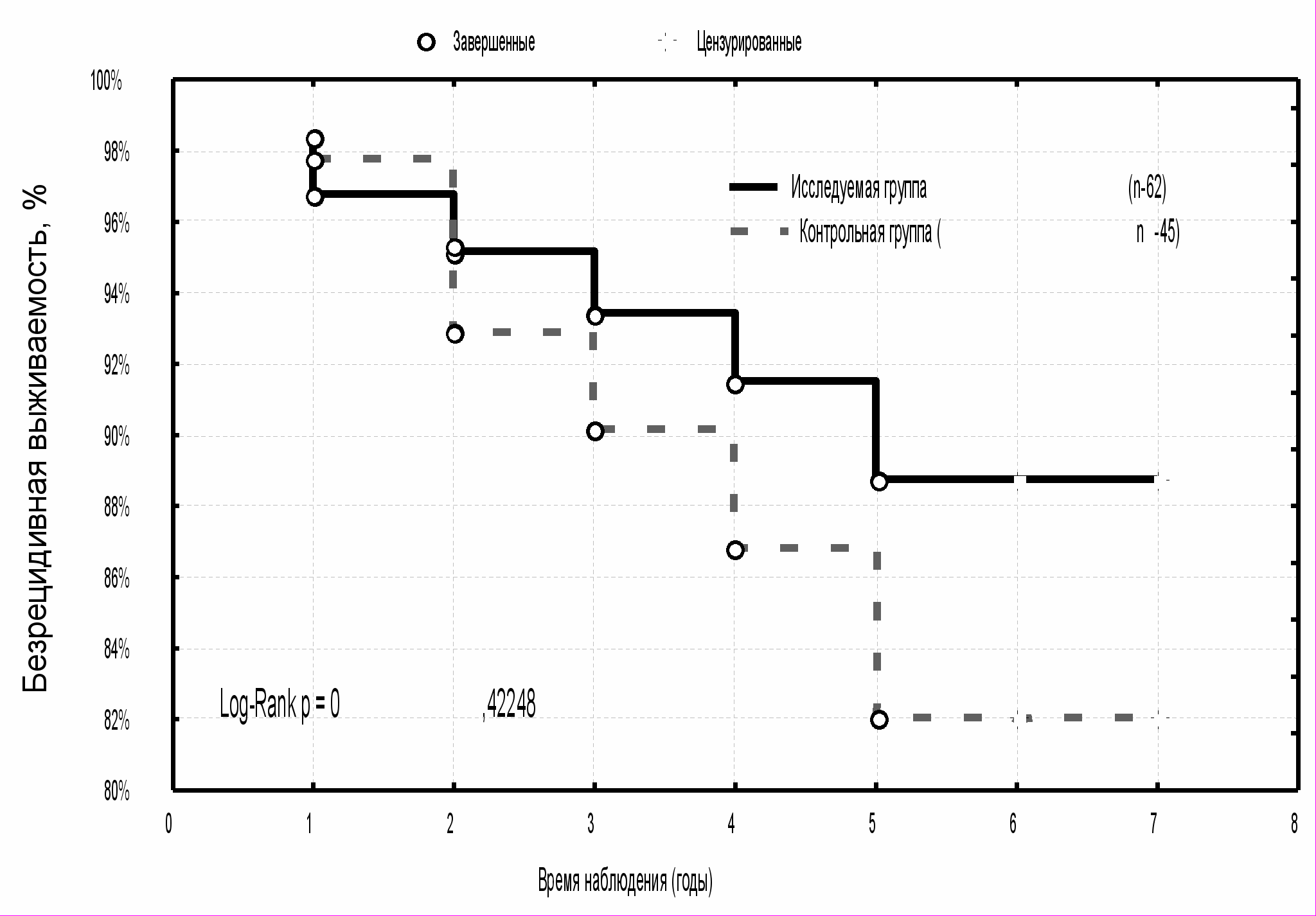
Рис. 4 Безрецидивная выживаемость больных РМЖ T1-2N1M0 в зависимости от методики адъювантной лучевой терапии
Наибольшее число летальных исходов отмечалось у пациенток с поражением регионарных лимфатических узлов: 5 (8 %) из 62 больных в группе исследования, 7 (15,5 %) из 45 пациенток - в группе контроля (p>0,05). Общая выживаемость больных РМЖ T1-2N1M0 за пять лет динамического наблюдения имела тенденцию к снижению в обеих группах и составила 89,7±4,5 % и 82,1±6,2 %, соответственно (p>0,05) (рис. 6).
С целью более объективного представления полученных результатов исследования мы оценили частоту встречаемости местных рецидивов и показатели пятилетней безрецидивной выживаемости в зависимости от их локализации (табл. 3).
Таблица 2
Частота и сроки появления летальных исходов у больных РМЖ
в зависимости от стадии заболевания и методики адъювантной лучевой терапии
| Сроки наблюдения, годы | Количество летальных исходов, абс. число (%) | |||||
| РМЖ T1N0M0 | РМЖ T2N0M0 | РМЖ T1-2N1M0 | ||||
| Исследуемая группа (n=32) | Контрольная группа (n=31) | Исследуемая группа (n=65) | Контрольная группа (n=42) | Исследуемая группа (n=62) | Контрольная группа (n=45) | |
| 1 | - | - | - | - | 1 (1,6 %) | 2 (4,4 %) |
| 2 | - | - | 1 (1,5 %) | - | - | 1 (2,2 %) |
| 3 | - | - | - | 1 (2,4 %) | 1 (1,6 %) | 3 (6,7 %) |
| 4 | - | - | - | 1 (2,4 %) | 1 (1,6 %) | 1 (2,2 %) |
| 5 | - | 1 (3,2 %) | 1 (1,5 %) | 2 (4,8 %) | 2 (3,2 %) | - |
| Всего | - | 1 (3,2 %) | 2 (3 %) | 4 (9,5 %) | 5 (8 %) | 7 (15,5 %) |
 |  |
| Рис. 5 Общая выживаемость больных РМЖ T2N0M0 в зависимости от методики адъювантной лучевой терапии | Рис. 6 Общая выживаемость больных РМЖ T1-2N1M0 в зависимости от методики адъювантной лучевой терапии |
Таблица 3
Частота местных рецидивов у больных РМЖ T1-2N0-1M0
в зависимости от их локализации
| Локализация местного рецидива | Исследуемая группа (n=159) | Контрольная группа (n=118) | Достоверность (p) |
| Общее число рецидивов | 11/159 (6,9 %) | 13 (11 %) | p>0,05 |
| Рецидив в после-операционном рубце | 3/11 (27,3 %) | 6/13 (46,1 %) | p>0,05 |
| Рецидив в другом квадранте молочной железы | 5/11 (54,5 %) | 5/13 (38,5 %) | p>0,05 |
| Рецидив в регионарных лимфоузлах | 1/11 (9,1 %) | 1/13 (7,7 %) | p>0,05 |
| Местно-регионарный рецидив | 1/11 (9,1 %) | 1/13 (7,7 %) | p>0,05 |
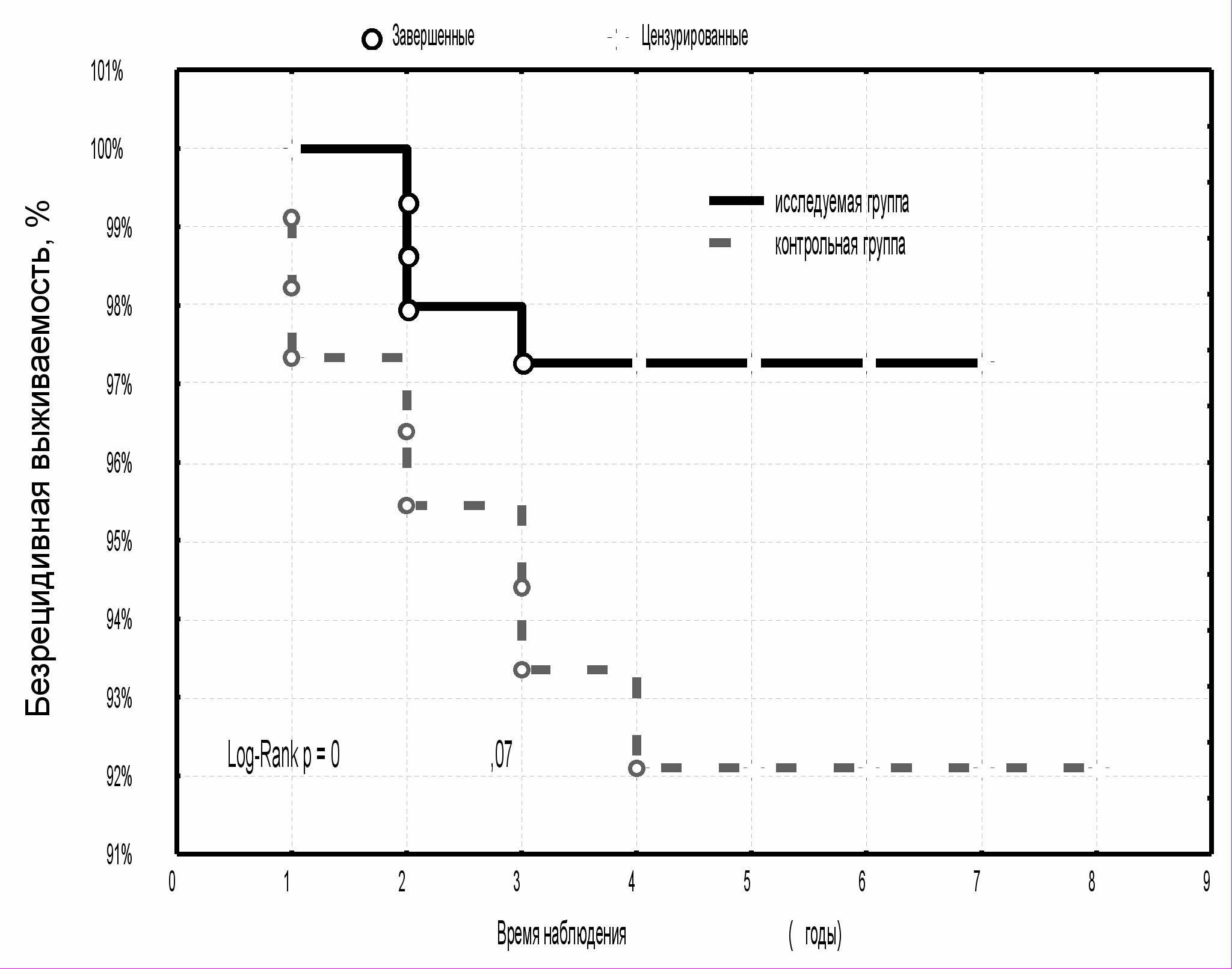
С одинаковой частотой в изучаемых группах диагностировались местно-регионарные рецидивы и рецидивы в регионарных лимфатических узлах (9,1 % и 7,7 %, соответственно). Поскольку в группе исследования все больные РМЖ T1-2N0-1M0 получали на область послеоперационного рубца электронную терапию, то рецидивы в облученной зоне встречались реже и составили 27,3 %, по сравнению с группой контроля - 46,1 %. Показатели пятилетней безрецидивной выживаемости в исследуемой группе были несколько выше (97,3±1,3 %), по сравнению с контрольной группой (92,1±2,7 %) (р>0,05, рис. 7). Несмотря на отсутствие статистической значимости различий, этот факт свидетельствует о том, что дополнительное использование курса электронной терапии на область послеоперационного рубца, куда входит ложе удаленной опухоли, снижает риск рецидива в этой зоне.
Большинство рецидивных опухолевых очагов (54,5 %) у больных в группе исследования локализовались в других квадрантах молочной железы, вне зоны хирургического вмешательства и, соответственно, не входивших в область воздействия электронной терапии. В данном случае было бы более правильно говорить о скрытом мультицетричном типе роста РМЖ, поскольку после выполнения мастэктомии данный факт имел морфологическое подтверждение. В контрольной группе количество рецидивов в другом квадранте молочной железы составило 38,5 %, значимых различий между этими значениями получено не было (p>0,05).
Показатели пятилетней безрецидивной выживаемости в группе исследования и контроля с локализацией рецидива в другом квадранте молочной железы были практически равными и составили 93,6±2,2 % и 92,9±3,1 %, соответственно (р>0,05) (рис. 8).
 |  |
| Рис. 7 Безрецидивная выживаемость больных РМЖ T1-2N0-1M0 при локализации местного рецидива в области послеоперационного рубца | Рис. 8 Безрецидивная выживаемость больных РМЖ T1-2N0-1M0 при локализации местного рецидива опухоли в других квадрантах молочной железы |
Лучевые реакции и повреждения нормальных тканей после органосохраняющего лечения с адъювантной лучевой терапией у больных РМЖ T1-2N0-1M0
Проявление общих реакций, таких как слабость, тошнота, лейкопения I-II степени по критерию RTOG/EORTC (1995) были выявлены у 67 (56,8 %) из 118 больных контрольной группы и у 78 (49,1 %) из 159 больных исследуемой группы, получавших курс послеоперационной гамма-электронной терапии (р=0,1870). Высокая частота общих реакций во многом была обусловлена предшествующей адъювантной химиотерапией.
Эритема кожи была наиболее частым видом местной лучевой реакции и проявлялась у 71 (44,6±3,9 %) из 159 больных исследуемой группы и у 68 (57,6±4,3 %) из 118 пациенток контрольной группы (p<0,05) (табл. 4). При использовании смешанной гамма-электронной терапии частота местных лучевых реакций II и III степени выраженности была значимо ниже (27±3,5 % и 5,7±1,8 %), по сравнению с контрольной группой, где проводился стандартный курс ДГТ (39±4,5 % и 16,1±3,4 %) (р<0,05).
