Лучевая терапия различными видами ионизирующего излучения в комплексном лечении больных раком молочной железы 14. 00. 14 онкология 14. 00. 19 лучевая диагностика, лучевая терапия
| Вид материала | Автореферат |
- Адъювантная лучевая терапия рака желудка. 14. 00. 14 онкология 14. 00. 19 лучевая диагностика,, 304.24kb.
- Современная тактика системной радиотерапии хлоридом стронция-89 в комплексном лечении, 651.21kb.
- Комплексная лучевая диагностика в оценке репаративного процесса при лечении больных, 429.1kb.
- Мр-маммография в планировании объема хирургического лечения рака молочной железы 14., 324.55kb.
- Нейтронная и нейтронно-фотонная терапия злокачественных новообразований слюнных и щитовидной, 340.88kb.
- Рефлексотерапия в реабилитации больных поздними лучевыми повреждениями и паллиативной, 426.37kb.
- Стратегия и тактика лучевой терапии в многокомпонентном лечении местно-распространенного, 1026.52kb.
- Селиверстов Павел Владимирович лучевая диагностика диспластически-дистрофического синдрома, 488.65kb.
- Селиверстов Павел Владимирович лучевая диагностика диспластически-дистрофического синдрома, 488.95kb.
- Ультразвуковое исследование в комплексной лучевой диагностике злокачественных опухолей, 485.88kb.
Таблица 4
Частота ранних и поздних местных лучевых осложнений по шкале RTOG/EORTC у больных РМЖ T1-2N0-1M0 в зависимости от объема адъювантной лучевой терапии
| Вид лучевых осложнений | Исследуемая группа (n=159) | Контрольная группа (n=118) | Достоверность Р |
| Ранние Эритема (I) Сухой дерматит (II) Влажный дерматит (III) Эзофагит (I) Трахеит (I) | 71 (44,6±3,9 %) 43 (27±3,5 %) 9 (5,7±1,8 %) 12 (7,5±2,1 %) 4 (2,5±1,2 %) | 68 (57,6±4,3 %) 46 (39±4,5 %) 19 (16,1±3,4 %) 14 (11,9±3,0 %) 5 (4,2±3,4 %) | *Р=0,0219 *Р=0,0244 *Р=0,0041 Р=0,1563 Р=0,3206 |
| Поздние Атрофия и пигментация кожи; фиброз, уменьшение количества подкожной жировой клетчатки (I ) | 23 (14,5±2,8 %) | 31 (26,3±4,1 %) | *Р=0,011 |
*Р - статистическая значимость
Поздние лучевые изменения тканей в виде атрофии, пигментации кожи, фиброза преимущественно в зоне послеоперационного рубца, уменьшение количества подкожной жировой клетчатки наблюдались в 23 (14,5±2,8 %) случаях в исследуемой группе и в 31 (26,3±4,1 %) - в контроле (р<0,05).
Косметический эффект считался «хорошим», а в некоторых случаях даже «отличным», когда отсутствовала выраженная деформация, не было существенных различий по форме контуров молочной железы, по расположению соска, а также в тех случаях, когда не было выявлено телеангиоэктазии или постлучевого фиброза в молочной железе (рис. 8).
Таким образом, применяемый дифференцированный подход при планировании адъювантной лучевой терапии с учетом факторов риска развития местного рецидива опухоли в органосохраняющем лечении больных ранними формами РМЖ позволяет снизить лучевую нагрузку на организм пациентки, обеспечить положительную тенденцию увеличения показателей безрецидивной, безметастатической и общей выживаемости, а также способствует сохранению высокого качества жизни, вследствие «хорошего» косметического эффекта.
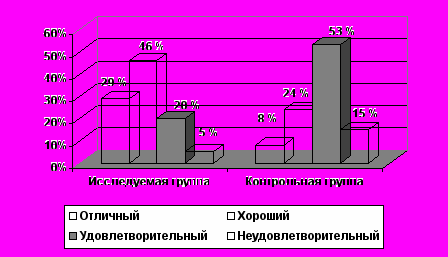
Рис. 8 Оценка косметического эффекта у больных РМЖ T1-2N0-1M0 после органосохраняющего лечения
Нейтронная и нейтронно-фотонная терапия в комплексном лечении больных местно-распространенными формами рака молочной железы
В настоящем исследовании изучались восьмилетние результаты наблюдения за больными МР РМЖ T2-4N0-2M0. Наименьшее количество случаев местного прогрессирования заболевания отмечено в группе пациенток, которым в предоперационном периоде, наряду с системной химиотерапией проводилось облучение быстрыми нейтронами. Из 97 больных МР РМЖ только у двух (2±1,4 %) через два и шесть лет после окончания комплексного лечения были диагностированы рецидивы РМЖ. В группах сравнения количество местных рецидивов было в 7-12 раз выше и составило у больных, получавших фотонное облучение крупными фракциями, 15±5,6 %, а после ДГТ в стандартном режиме - 23,7±6,9 %. Различия статистически значимы (р=0,008 и р=0,0002, соответственно) (табл. 5). В группе контроля, у больных без проведения предоперационной лучевой терапии, количество рецидивов опухоли было максимальным - 26 (31,3±5,1 %) из 83 пациенток (р<0,01).
Таким образом, полученные нами данные наглядно свидетельствуют о том, что проведение нейтронной терапии в предоперационном периоде у больных МР РМЖ позволило существенно уменьшить количество местных рецидивов, по сравнению с использованием фотонной терапии крупными и стандартными фракциями и теми наблюдениями, когда предоперационный курс облучения не проводился.
Наиболее высокая выживаемость без признаков рецидива опухоли на уровне восьми лет наблюдения была отмечена у больных, получавших лучевую терапию быстрыми нейтронами 6,3 МэВ – ее показатели составили 96,0±3,0 %. В группах сравнения эти значения были существенно ниже и составили 74,4±10,7 % и 69,8±8,9 %, соответственно (рис. 9) (p<0,05). Выживаемость без признаков рецидива опухоли в группе контроля была значимо меньше, по сравнению с исследуемой группой, где проводилась предоперационная нейтронная терапия - 57,9±7,4 % (p<0,05) (рис. 10).
Таблица 5
Частота и сроки появления рецидивов опухоли у больных МР РМЖ
в зависимости от методики лучевой терапии
| Сроки наблюдения, годы | Количество местных рецидивов, абс. число (%) | |||
| Исследуемая группа (n=97) | Группы сравнения | Контрольная группа (n=83) | ||
| II b - крупные фракции (n=40) | II c - стандартный режим фракционирования (n=38) | |||
| 1 | - | 1 (2,5 %) | 2 (5,3 %) | 6 (7,2 %) |
| 2 | 1 (1 %) | 3 (7,5 %) | 2 (5,3 %) | 7 (8,4 %) |
| 3 | - | 1 (2,5 %) | 2 (5,3 %) | 4 (4,8 %) |
| 4 | - | - | 2 (5,3 %) | 2 (2,4 %) |
| 5 | - | 1 (2,5 %) | - | 5 (6,0 %) |
| 6 | 1 (1 %) | - | 1 (2,6 %) | 1 (1,2 %) |
| 7 | - | - | - | 1 (1,2 %) |
| 8 | - | - | - | - |
| Всего | 2 (2±1,4 %)* | 6 (15±5,6 %)* | 9 (23,7±6,9 %)* | 26(31,3±5,1 %)* |
* - статистическая значимость (p<0,05)
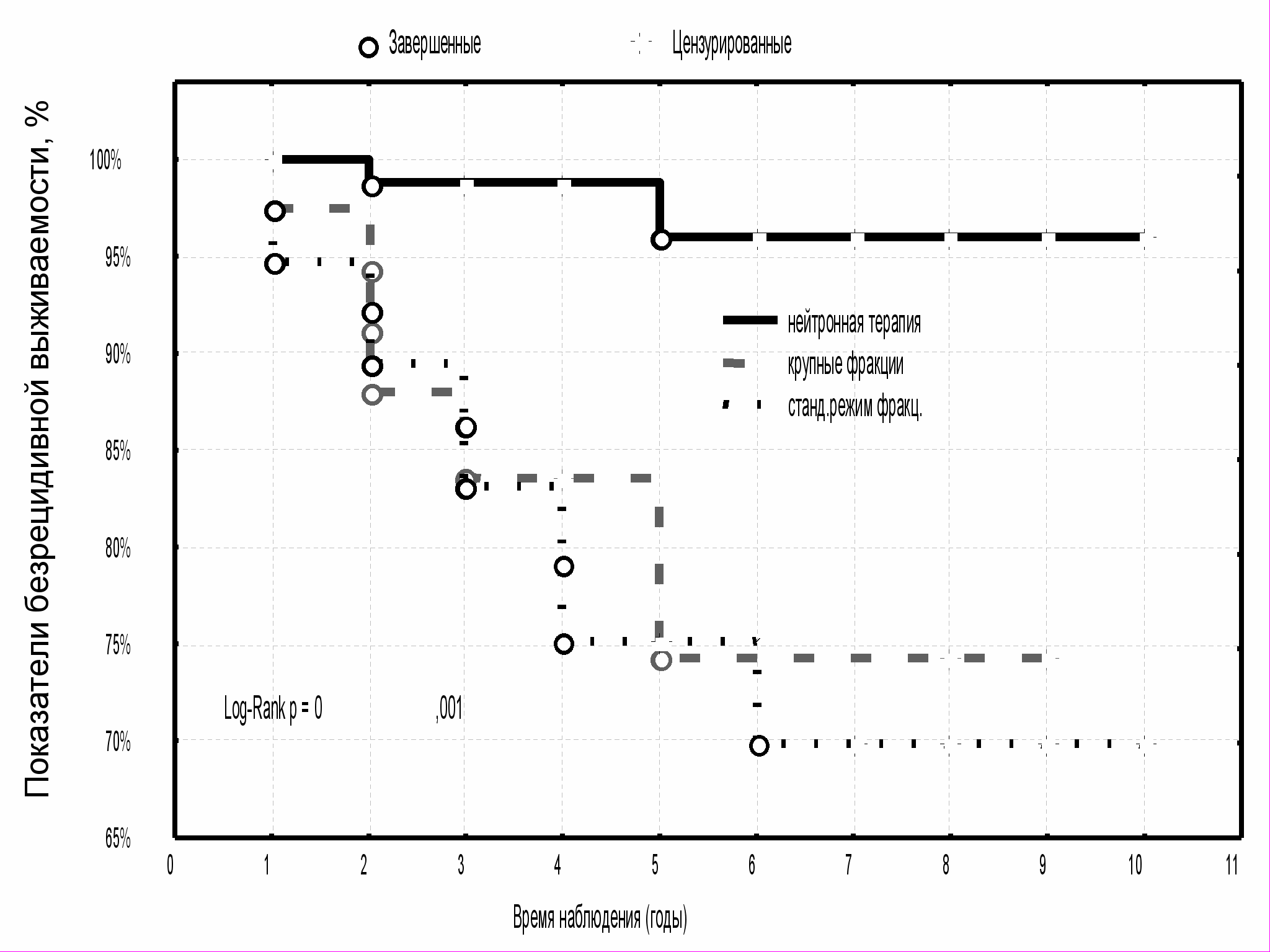 | 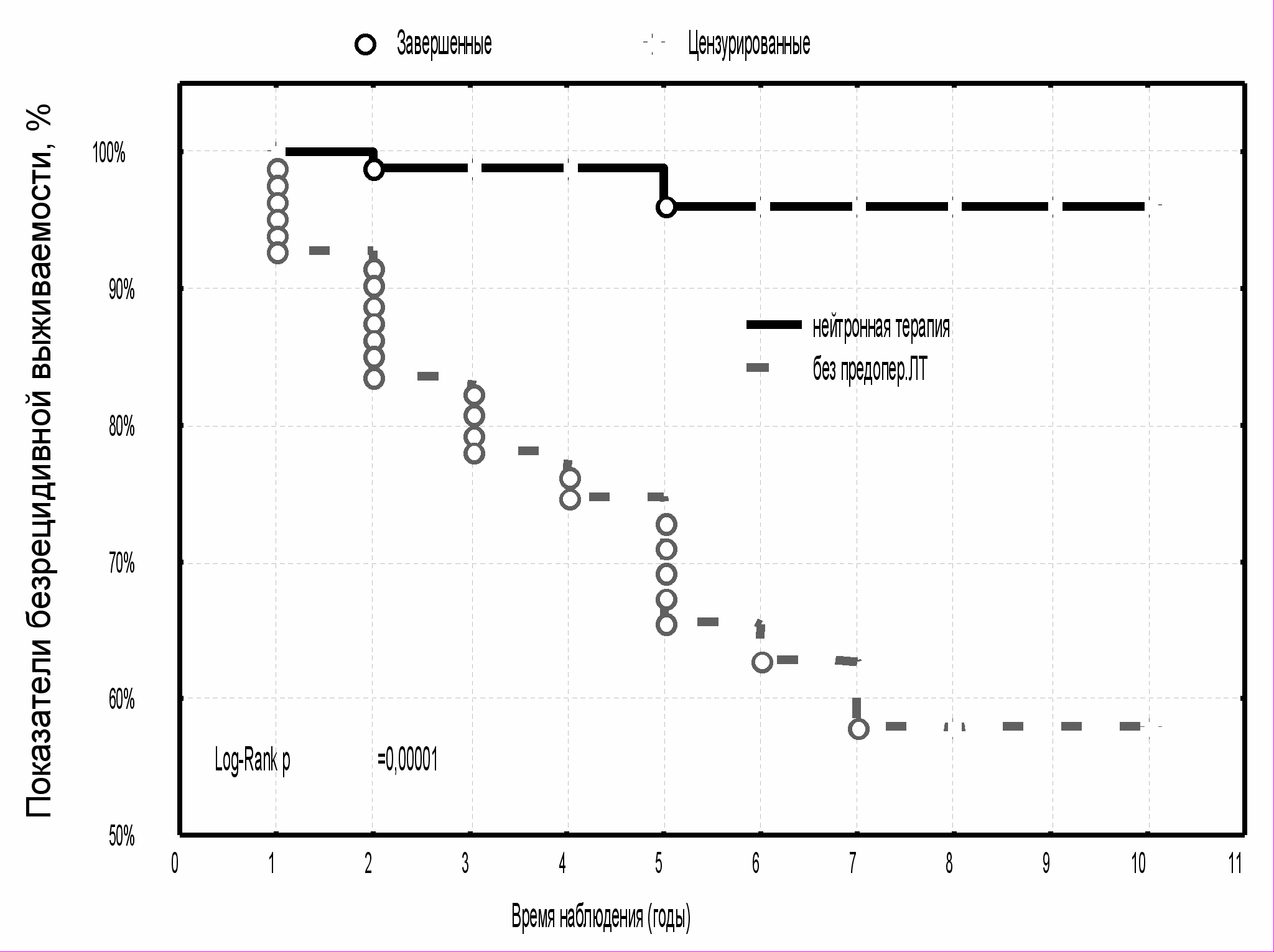 |
| Рис. 9 Выживаемость без признаков рецидива опухоли больных МР РМЖ в зависимости от вида предоперационной лучевой терапии | Рис. 10 Выживаемость без признаков рецидива опухоли больных МР РМЖ с предоперационной нейтронной терапией и в группе контроля |
При анализе частоты и сроков возникновения отдаленных метастазов было выявлено, что наиболее часто они наблюдались среди пациенток группы контроля (50,6±5,5 %) по сравнению с исследуемой группой (27,8±4,5 %) (p=0,001) (табл. 6). У больных МР РМЖ с предоперационной фотонной терапией крупными фракциями или в стандартном режиме эти показатели составили 45±7,9 % и 42,1±8,0 %. При сравнении с исследуемой группой выявленные различия имели статистическую значимость (р=0,04).
Таблица 6
Частота и сроки появления метастазов опухоли у больных МР РМЖ
в зависимости от методики лучевой терапии
| Сроки наблюдения, годы | Количество метастазов, абс. число (%) | |||
| Исследуемая группа (n=97) | Группы сравнения | Контрольная группа (n=83) | ||
| II b - крупные фракции (n=40) | II c - стандартный режим фракционирования (n=38) | |||
| 1 | 5 (5,2 %) | 3 (7,5 %) | - | 11 (13,3 %) |
| 2 | 12 (12,4 %) | 6 (15 %) | 6 (15,8 %) | 10 (12 %) |
| 3 | 7 (7,2 %) | 6 (15 %) | 4 (10,5 %) | 5 (6,0 %) |
| 4 | 1 (1,0 %) | 2 (5 %) | 3 (7,9 %) | 3 (3,6 %) |
| 5 | 1 (1,0 %) | - | 1 (2,6 %) | 5 (6,0 %) |
| 6 | 1 (1,0 %) | 1 (2,5 %) | 1 (2,6 %) | 5 (6,0 %) |
| 7 | - | - | 1 (2,6 %) | 3 (3,6 %) |
| 8 | - | - | - | - |
| Всего | 27 (27,8±4,5 %)* | 18 (45±7,9 %)* | 16 (42,1±8,0 %)* | 42 (50,6±5,5 %)* |
* - статистическая значимость (p<0,05)
У больных МР РМЖ, которым проводилось плотноионизирующее излучение, продолжительность жизни без признаков прогрессирования на уровне восьми лет наблюдения была максимально высокой - 63,6±6,1 % по сравнению с пациентками, получавшими предоперационную ДГТ крупными фракциями (40,1±9,6 %) и в режиме стандартного фракционирования (49,6±9,4 %) (р<0,05) (рис. 11). Наиболее низкие показатели восьмилетней безметастатической выживаемости отмечались у больных контрольной группы - 37,0±7,1 % (р<0,05) (рис. 12).
Анализ частоты и сроков летальных исходов заболевания показал, что результаты лечения больных МР РМЖ, получавших нейтронную терапию, были значимо выше по сравнению с пациентками, получавшими фотонную терапию крупными фракциями и в стандартном режиме фракционирования дозы, а также с больными контрольной группы (p=0,025; р=0,05; р=0,0009, соответственно) (табл. 7). Среди пациенток, которым проводилось комплексное лечение с использованием быстрых нейтронов 6,3 МэВ, восемь лет пережили 70,8±5,8 %, тогда как в группе больных с ДГТ крупными фракциями этот показатель составил 42,4±10,7 %, при стандартном курсе фотонной терапии - 54,2±9,6 % и в контрольной группе - 40,6±7,5 %. Различия по показателям общей выживаемости статистически значимы (р<0,05) (рис. 13, 14).
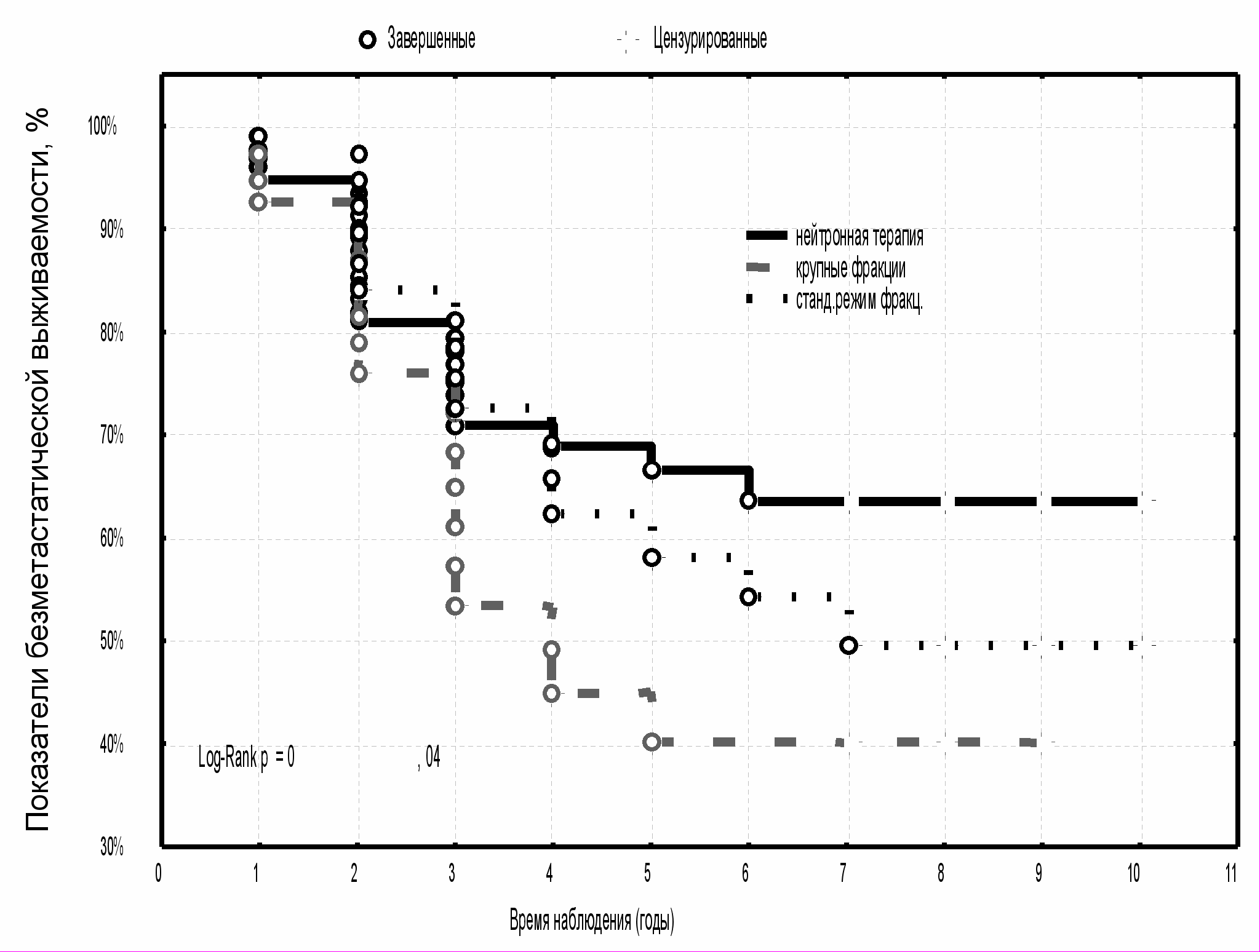 | 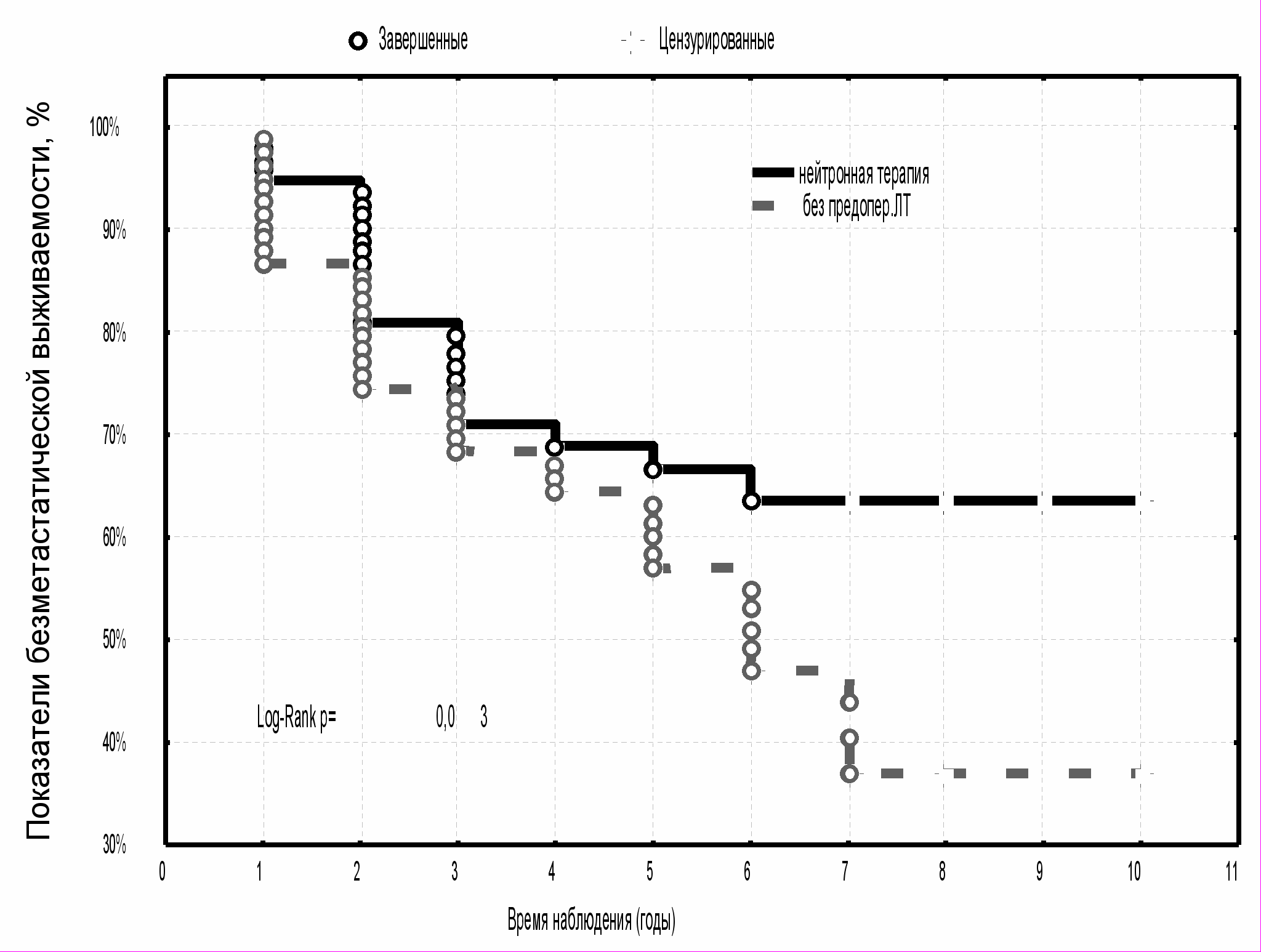 |
| Рис. 11 Выживаемость без признаков метастазов опухоли больных МР РМЖ в зависимости от вида предоперационной лучевой терапии | Рис. 12 Выживаемость без признаков метастазов опухоли больных МР РМЖ с предоперационной нейтронной терапией и в группе контроля |
Таблица 7
Частота и сроки летальных исходов у больных МР РМЖ
в зависимости от методики лучевой терапии
| Сроки наблюдения, годы | Летальные исходы, абс. число (%) | |||
| Исследуемая группа (n=97) | Группы сравнения | Контрольная группа (n=83) | ||
| II b - крупные фракции (n=40) | II c - стандартный режим фракционирования (n=38) | |||
| 1 | 3 (3,1 %) | 3 (7,5 %) | - | 5 (6,0 %) |
| 2 | 7 (7,2 %) | 3 (7,5 %) | 4 (10,5 %) | 9 (10, 8 %) |
| 3 | 8 (8,2 %) | 6 (10 %) | 4 (10,5 %) | 5 (6,0 %) |
| 4 | 1 (1,0 %) | 2 (5 %) | 3 (7,9 %) | 5 (6,0 %) |
| 5 | 1 (1,0 %) | 1 (2,5 %) | 1 (2,6 %) | 6 (7,2 %) |
| 6 | 1 (1,0 %) | - | 1 (2,6 %) | 3 (3,6 %) |
| 7 | - | 1 (2,5 %) | 1 (2,6 %) | 4 (4,8 %) |
| 8 | - | - | - | - |
| Всего | 21 (21,6±4,2 %)* | 16 (40±7,7 %)* | 14 (36,8±7,8 %)* | 37 (44,6±5,5 %)* |
* - статистическая значимость (p<0,05)
Таким образом, анализ отдаленных результатов лечения больных первичным МР РМЖ показал, что проведение предоперационной нейтронной терапии в комплексе с системной химиотерапией является наиболее эффективным в отношении снижения частоты местных рецидивов опухоли, как по сравнению с другими видами предоперационной лучевой терапии, так и при ее отсутствии, поскольку способствует достоверному увеличению безрецидивного периода. Значимое уменьшение количества рецидивов опухоли после проведения нейтронной терапии привело к тому, что в исследуемой группе отмечена устойчивая тенденция к увеличению общей продолжительности жизни пациенток и выживаемости без признаков метастазов опухоли в течение всего восьмилетнего периода наблюдения по сравнению с пациентками, получавшими предоперационную фотонную терапию и с контрольной группой.
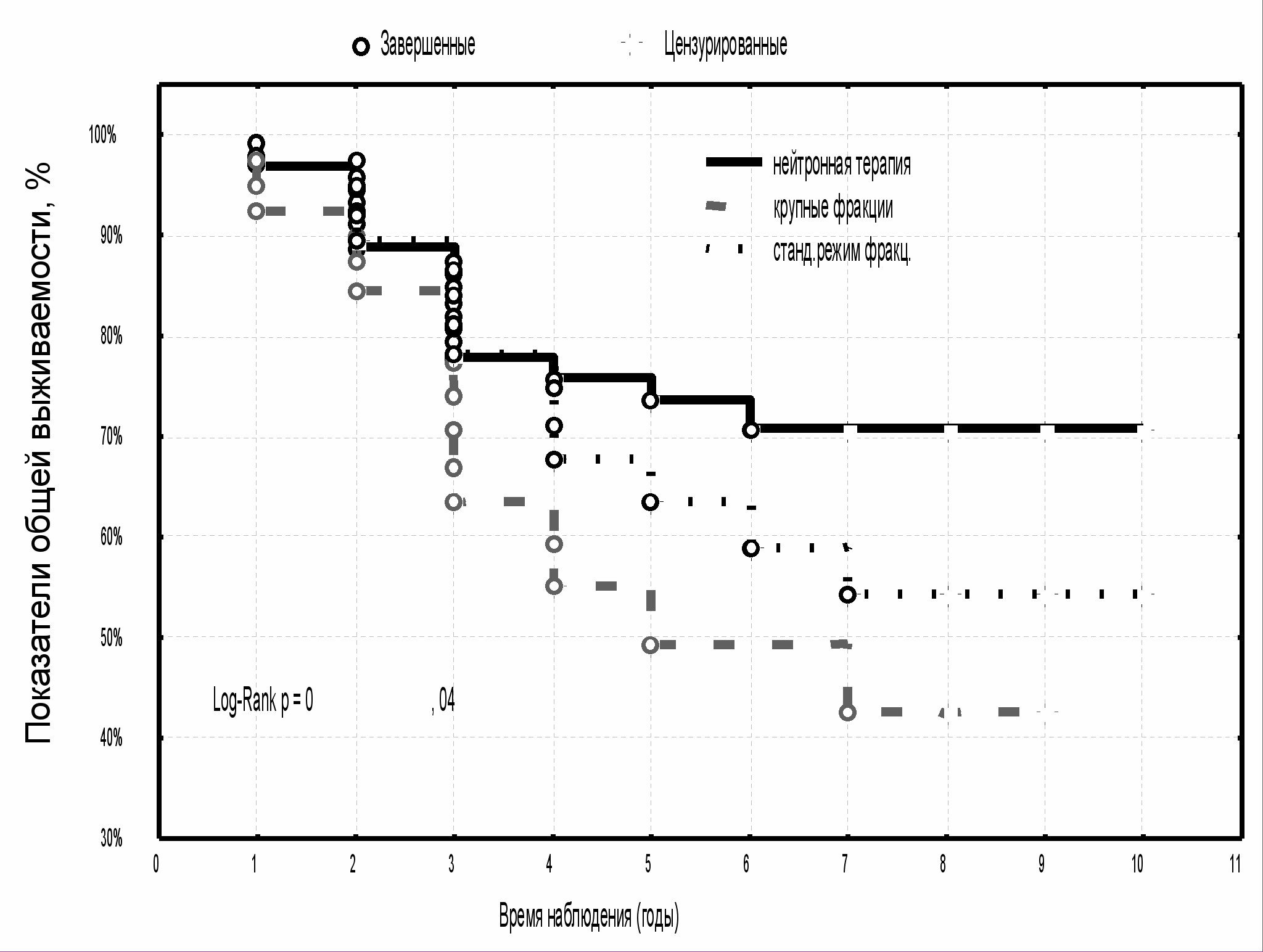 | 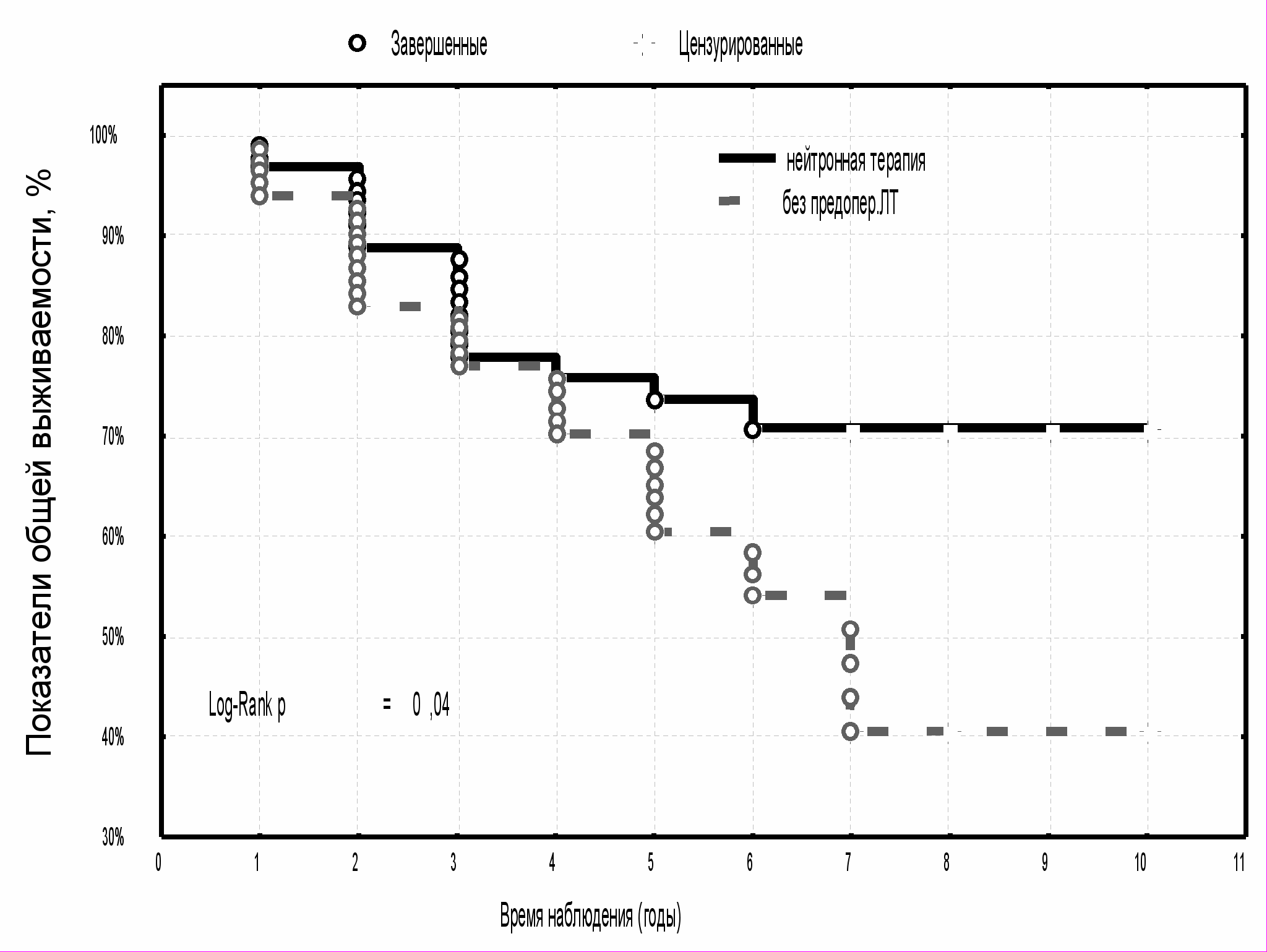 |
| Рис. 13 Общая выживаемость больных МР РМЖ в зависимости от вида предоперационной лучевой терапии | Рис. 14 Общая выживаемость больных МР РМЖ с предоперационной нейтронной терапией и в группе контроля |
Для определения показаний к проведению предоперационной лучевой терапии был проведен анализ прогностической значимости различных клинических и морфологических факторов, оказывающих влияние на частоту рецидивов рака молочной железы. Были изучены более десяти клинико-морфологических критериев, но наиболее значимыми оказались следующие: размер первичной опухоли, наличие метастатического поражения лимфатических узлов, локализация опухолевого очага, характер роста опухоли, степень дифференцировки опухолевых клеток, гистологический вариант опухоли, эффективность неоадъювантной химиотерапии. Максимальное число рецидивов опухоли наблюдалось при сочетании трех и более прогностически неблагоприятных факторов (табл. 8).
Основываясь на полученных нами данных, а также с учетом данных литературы, были разработаны показания к проведению предоперационного курса нейтронной терапии:
- обширная местная распространенность опухоли (T3-4);
- мультицентричный характер роста опухоли;
- расположение опухолевого очага во внутреннем квадранте и/или центральном отделе молочной железы;
- инфильтративный характер роста опухоли (по данным биопсии опухоли молочной железы);
- отсутствие эффекта при проведении неоадъювантной полихимиотерапии (по данным УЗИ, маммографии, маммосцинтиграфии с 99mTc-МИБИ).
Сочетание двух и более перечисленных факторов является основанием для назначения нейтронной терапии на область молочной железы в предоперационном режиме.
Таблица 8
Частота рецидивов рака молочной железы в зависимости от количества прогностически неблагоприятных факторов
| Количество | Частота местных рецидивов, абс. ч. (%) |
| 1 фактор | 3 (11,5 %) |
| 2 фактора | 8 (30,8 %) |
| 3 и более факторов | 15 (57,7 %) |
| Всего: | 26 (100 %) |
Оценка переносимости лучевой терапии быстрыми нейтронами 6,3 МэВ в комплексном лечении МР РМЖ T2-4N0-2M0
Все 97 больных МР РМЖ перенесли предоперационный курс нейтронной терапии вполне удовлетворительно. У 32 пациенток (32,9±4,8 %) после выполнения первого сеанса нейтронной терапии отмечалось легкое недомогание, тошнота. Показатели периферической крови за период облучения оставались стабильными.
Непосредственная эффективность предоперационного комплексного химиолучевого воздействия проводилась через 3-7 дней с момента проведения последнего сеанса нейтронной терапии перед началом оперативного вмешательства и оценивалась по объективным данным клинического осмотра и инструментальных методов обследования (маммографии, маммосцинтиграфии, ультразвукового исследования тканей молочной железы) (табл. 9). Учитывая, что большинство составили пациентки с опухолевым процессом T3-4, то преимущественно были зарегистрированы частичные регрессии (65±4,8 %). Полная регрессия опухолей была отмечена в 8,2±2,8 % случаях, стабилизация процесса – в 26,8±4,5 %. Признаков прогрессирования основного заболевания на фоне проводимого лечения ни в одном случае выявлено не было.
В ближайшем послеоперационном периоде количество и степень выраженности изменений нормальных тканей при проведении предоперационного курса нейтронной терапии не превышало число осложнений, наблюдавшихся при использовании фотонной терапии в режимах крупного и стандартного фракционирования дозы, а также при отсутствии облучения молочной железы на предоперационном этапе (табл. 9).
Продолжительность общего курса комплексного лечения пациенток в исследуемой группе в среднем составила 93 дня, в группах сравнения с предоперационной фотонной терапии в режиме крупного и стандартного фракционирования дозы – 97 и 105 дней, соответственно, в контрольной группе – 82 дня.
Таблица 9
Частота и характер послеоперационных осложнений у больных местно-распространенным раком молочной железы, получавших различные виды предоперационной лучевой терапии
-
Виды осложнений
Количество осложнений, абс. число (%)
Нейтронная
терапия
Фотонная терапия
Исследуемая группа
(n=97)
IIb
крупные фракции
(n=40)
IIc -стандартный
режим фракционирования
(n=38)
Группа
контроля без предопер.ЛТ
(n=83)
Повышенная
кровоточивость
17
(17,5±3,8 %)
9
(22,5±6,6 %)
11
(28,9±7,4 %)
-
Нагноение раны
3
(3,1±1,7 %)
4
(10±4,7 %)
2
(5,3±3,6 %)
2
(2,4±1,7 %)
Вторичное заживление раны
7
(7,2±2,6 %)
6
(15±5,6 %)
4
(10,5±4,9 %)
3
(3,6±2,0 %)
Продолжительность лимфореи >21 дня
10
(10,3±3,0 %)
7
(17,5±6,0 %)
5
(13,2±5,5 %)
5
(6,0±2,6 %)
