Патогенетические обоснования стратегии и тактики лечения миастении 14. 00. 16 патологическая физиология 14. 00. 13 нервные болезни
| Вид материала | Автореферат диссертации |
- Ов курса «Патологическая физиология» для самостоятельного изучения, 13.37kb.
- Клинико-патогенетическое обоснование комбинированного лазерно-медикаментозного лечения, 270.48kb.
- Пояснительная записка к учебной дисциплине Эпизоотология и инфекционные болезни животных, 166.41kb.
- Пояснительная записка Учебно-методический комплекс по курсу «Патологическая физиология», 140.7kb.
- «Патогенетические механизмы развития хронической обструктивной болезни лёгких», 323.59kb.
- Клинико-патогенетические механизмы развития внешне и внутрисекреторной недостаточности, 559.83kb.
- Методические рекомендации для практического занятия №17, №18 Тема: Методика обследования, 25.33kb.
- Задачи по оказанию доврачебной помощи при неотложных состояниях 43 акушерство, 1884.21kb.
- Патогенетические механизмы развития микроциркуляторных нарушений в нефроне и периферических, 264.59kb.
- Патогенетическое обоснование восстановительного лечения нефропатий, сочетанных с нарушениями, 773.4kb.
II тип патологии синапса (больная Г., 47 лет)
Фон ПАО
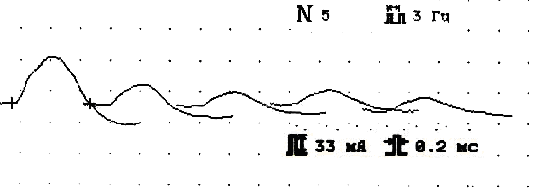
Амплитуда 2,5 мВ, декремент -72% Амплитуда 7,5 мВ, декремент -38%
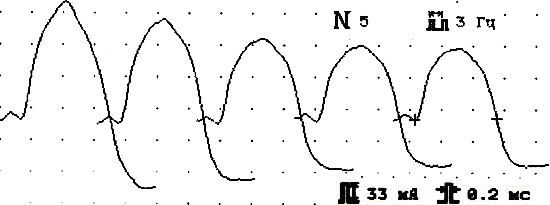
III тип патологии синапса (больная П.,28 лет)
Фон ПАО
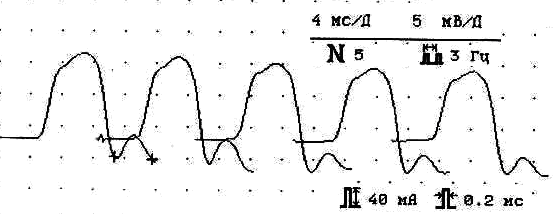
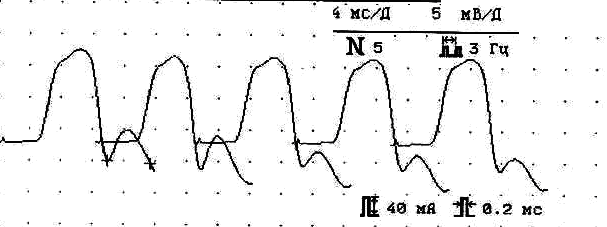
Амплитуда 6,5 мВ, декремент -22% Амплитуда 6,6 мВ, декремент -17%
Рис.7. Основные электромиографические модели разных типов поражения синапса на примере дельтовидной мышцы у трех больных миастенией.
Особенности поражения синапса при III типе патологии предполагают отличия клинической картины заболевания серонегативных больных от серопозитивных (I и II типы).
По сравнению с I и II типами, III тип отличался отсутствием генерализации процесса (кранио-бульбарный паттерн), избирательностью патологического процесса c наличием тяжело пораженных мышц: мимических, бульбарных, диафрагмы, разгибателей шеи и сохранных: глазодвигательных, мускулатуры конечностей и туловища.
Обращала внимание тяжесть поражения лицевой мускулатуры с частым выявлением феномена лагофтальма, гипомимией, «поперечной улыбкой», истончением мышц век, гипотрофиями височных мышц. Наиболее пораженные мышцы (m.orbicularis oculi, m.orbicularis oris, m. nasalis, m.frontalis) были склонны к развитию амиотрофий; в 45% случаев этих мышц отмечалось значительное снижение амплитуды (площади) М-ответа на одиночный супрамаксимальный стимул (0,34 ± 0,27 мВ, в среднем). При этом амплитуда М-ответа, как правило, не восстанавливалась ни на фоне пробы с максимальным мышечным усилием (ПАО), ни на фоне прозерина.
На столь необычное для миастении грубое поражение мимической мускулатуры, вплоть до «diplegii facei» и атрофиями мышц лица и языка у серонегативных больных, указывают А. Evoli с коллегами (2003), D. Sanders с коллегами (2003), J. Newsom-Davis (2005). Одни авторы связывают это с миопатией, обнаруживая появление цитохром с-оксидазных негативных волокон - гистохимического маркера митохондриальных миопатий (Benveniste O. et al., 2005, Rostedt Punga A., et al., 2006). Другие (Shigemoto К. et al., 2006) предполагают о роли денервации, исходя из механизма действия АТ к MuSK, вызывающих денервационную модель поражения синаптического аппарата, подтверждая это выявлением «ангулярных атрофий» мышечных волокон, типичных для денервационных заболеваний (Engel W.K., et al., 1974).
Мы изучали характер атрофий мышц лица с помощью игольчатой ЭМГ у 6 серонегативных пациентов и 6 серопозитивных больных, специально отобранных, на основании грубого поражения лицевой мускулатуры (все имели симптом «лагофтальма»). Организация ПДЕ мышечных волокон исследовалась m.frontalis и m. deltoideus в обеих группах. Характер изменений двигательных единиц был схожим и не имел достоверных отличий. Причем при одинаковой степени клинического поражения мимической мускулатуры (0-1 балл) в обеих подгруппах, более выраженное снижение средней длительности ПДЕ в m.frontalis (на 23,0 ± 7,0 %, в среднем) отмечалось в серопозитивной подгруппе, тогда как в серонегативной группе средняя длительность ПДЕ была снижена менее значительно (на 13,3 ± 7,5%, в среднем). Амплитуды ПДЕ в m.frontalis (средняя и максимальная) также были снижены именно у серопозитивных больных (средняя амплитуда 202,7±42,1; средняя максимальная амплитуда 485,0±50,1); у серонегативных больных амплитуды соответствовали границам нормы. При этом увеличение числа полифазных потенциалов, наоборот прослеживалось в m.frontalis серонегативных больных, по сравнению с серопозитивной группой. Тем не менее, в m. deltoideus серонегативных больных отмечалось более значимое снижение средней длительности на 21,0 ± 7,8 %, в среднем. Отличием MuSK «+» серонегативной миастении было наличие единичной спонтанной активности в виде потенциалов фибрилляций и фасцикуляций, а также положительных острых волн, что в некоторой степени может быть объяснимо холинергической активностью мышц, связанной с повышением чувствительности к АХ при десенситизационном типе блока нервно-мышечной передачи.
Таким образом, характер изменений двигательных единиц у серонегативных больных в нашем исследовании был наиболее близок к миопатическому типу. Электрофизиологических признаков денервации при серонегативной миастении нами не получено. M.E. Farrugia с коллегами (2007) провели похожее исследование в m. orbicularis oculi и m. orbicularis oris, выявив наряду со снижением средней длительности ПДЕ у всех серонегативных больных, у 50% MuSK-позитивных пациентов «миопатический паттерн».
Наряду со слабостью и атрофиями мимической мускулатуры (80% пациентов), бульбарные нарушения были постоянными симптомами заболевания при III типе патологии синапса у 75,8% пациентов, дыхательные - в 34% случаев. По данным ряда авторов поражение мимической, бульбарной и дыхательной мускулатуры составляет основу клинического паттерна СН MuSK «+» миастении (Farrugia M.E., Swingler R.J., 2002; Nemoto Y. et al., 2005; Spreadbury I. et al., 2005; Stickler D.E. et al., 2005; Lee J.Y. et al., 2006).
Кроме этого, слабость передней группы мышц шеи в нашем исследовании при III типе патологии синапса выявлялась в 80% случаев. В ряде других исследований указывается на частое поражение мышц, разгибателей шеи, и даже приводят случаи начала заболевания MuSK «+» СН миастении с так называемой «свисающей головы» - «dropped head» (Stickler D.E. et al., 2005; Okano T. et al., 2006; Casasnovas C. et al., 2007).
Одной из наиболее важных клинических находок мы считаем отсутствие симптомов двоения в дебюте СН миастении. Большинство исследователей не упоминают экстраокулярные мышцы среди типично поражаемых при СН миастении мышечных групп, тем не менее, ряд авторов описывают несколько клинических случаев MuSK «+» СН миастении, начинающихся с двоения (Caress J.B. et al., 2005; Bau V. et al., 2006). В нашем исследовании начало заболевания без двоения встречалось не только при СН, но и при серопозитивной миастении: в 71,8% случаях II типа и даже в 41,7% при классическом I типе патологии синапса, что не позволяет считать отсутствие двоения абсолютным дифференциально-диагностическим критерием дебюта СН миастении.
Обращало внимание, что больные СН миастенией (III тип) имели наиболее молодой средний возраст начала заболевания (26,33 ±13,42 лет); отличались более существенным преобладанием женщин над мужчинами (7:1) и повышением частоты детского и юношеского начала миастении (33,3%). Кроме того, больные с III типом выделялись отсутствием случаев сочетания с тимомами и экстратимическими неоплазиями, наиболее высокой (83,3%) частотой развития миастенических кризов (P<0,001). Аналогичные особенности СН миастении выявляют и другие исследователи (Sanders D. et al., 2003; Anlar B., Vincent A., 2003; Selcen D. et al., 2004; Newsom-Davis J., 2005; Evoli A., 2003; 2006; Murai H., 2006).
Таким образом, трем типам патологии синапса соответствовал свой собственный клинический паттерн заболевания.
Совокупность электрофизиологических, иммунологических и клинических характеристик I,II и III типов патологии синапса представлены в таблице 1.
Таблица 1.
Клинический, лабораторный и электрофизиологический профиль больных миастенией с различным типом патологии синапса.
| Основные характеристики | 1 тип n=275 | 2 тип n=91 | 3 тип n=60 |
| Клинические характеристики | |||
| Средний возраст дебюта (лет) | 36,54 ± 19,02 | 46,47 ± 29,02 | 26,33 ± 13,42 |
| Частота раннего юношеского начала миастении | 11,3± 3,3% | 19,3±8,4% | 33,3±12,5% |
| Соотношение женщин и мужчин | 3,3:1 | 2,0:1 | 7,5:1** |
| Частота сочетания с тимомами (%) | 2,5±3,1% (7 больных) | 55,5±10,6%*** (50 больных) | 0,0%±0,0*** |
| Частота сочетания с нетимическими неоплазиями | 4,3± 3,1% (12 пациентов) | 28,2±5,2%*** (28 пациентов) | 0,0±0,0%*** |
| Частота отдельных симптомов в дебюте заболевания | Птоз (61,3%) Двоение (58,3%) Нарушения речи (32%) | Птоз (33,3%) Двоение (22,2%) Слабость ног (61,7%), рук (41,0%); «вислая голова» (31%)* | Птоз (33,3%) Двоение (0%)* Нарушения речи (83,3%)**, Нарушения глотания (83,3%)**, Диспноэ (22%)* |
| Характер локализации слабости | Генерализованный | Преимущественно туловищный | Преимущественно кранио-бульбарный |
| Частота развития кризов | 8,0%±2,8 | 24,2%±9,1 | 86,6%±9,1*** |
| Иммунологические характеристики | |||
| Повышенный титр АТ к АХР | 100,0±1,1% | 95,0±4,6% | 0,0±0,0%*** |
| Повышен уровень АТ к титину | 37,0±5,1% | 70,0 ±9,7% | 0,0±0,0%*** |
| Повышен титр АТ к MuSK | 0,0±0,0%*** | 0,0±0,0%*** | 45,5%±7,7%*** |
| Электрофизиологические характеристики | |||
| Характер поражения синапса | Постсинаптический (дефицит АХР) | Пост-и-пре- синаптический (дефицит АХР +нарушения секреции АХ) | Постсинаптический (десенситизационный), поражение функции ионных каналов АХР (без дефицита АХР) |
| Тип блока НМП | Недеполяризирующий | Деполяризирующий | |
| Наиболее чувствительные мышцы для проведения декремент - теста | m.triceps brachii, m.deltoideus | m.deltoideus m.abductor digiti min., m.trapezius | m.orbicularis oculi, m.nasalis, m.dyaphragma |
| Основной критерий блока НМП | Декремент М-ответа при стимуляции частотой 3 имп/c | Амплитуда М-ответа и степень ее увеличения в период ПАО (ПТО) | Длительность М-ответа после введения прозерина, феномен повторных М-ответов |
| «+» проба с прозерином | 100±0,0% | 85,0±2,1% | 54,5%±10,6*** |
Примечание: n –число пациентов; НМП - нервно-мышечная передача, «+» проба с прозерином – положительная клиническая и электрофизиологическая реакция на введение прозерина; М ± - среднее значение параметра со стандартным отклонением. - достоверные различия * - P<0,05 – достоверные отличия,*** - Р<0,001 высоко достоверные отличия (t>3,2).
Выявление трех типов патологии синапса раскрывает новые патофизиологические механизмы, через которые может осуществляться целенаправленная коррекция синаптической передачи и регулироваться эффективность иммуносупрессивных методов лечения.
Обратимость блока нервно-мышечной передачи на фоне прозерина в мышцах больных миастении зависела от характера нарушений нервно-мышечной передачи и наблюдалась при первом типе в 100%, при втором - в 85%, при третьем в 55% мышц. Причем, принципиальной разницы в степени восстановления нервно-мышечной передачи при первой прозериновой пробе и при проведении ее у того же больного на фоне длительного лечения антихолинэстеразными препаратами (от 1 года до 9 лет) мы не выявили. Таким образом, характер реагирования на антихолинэстеразные препараты (АХЭП) можно было отнести к свойствам синапсов при различных типах его патологии.
Различная эффективность прозериновой пробы у больных с I, II и III типами патологии синапса определяла вариативность однократной дозы калимина (местинона). Так, у пациентов с I типом однократная доза, как правило, составляла 60 мг (1 табл.), со II - варьировала от 60 до 180 мг(1-3 табл.), с III типом никогда не превышала дозы 1табл. - 60 мг. При этом у больных с III типом патологии синапса отмечался наиболее «узкий интервал» между терапевтической и токсической дозой и повышенная склонность к развитию побочных М - и Н-холинергических реакций. В этой связи 20% (12 пациентов) III типа, у которых негативные эффекты антихолинэстеразных препаратов (АХЭП) «перекрывали» позитивные, не принимали АХЭП на протяжении всего заболевания. Особое внимание обращало, что все серонегативные больные с повышенным титром АТ к MuSK (45,5%) были «прозерин-негативными» и не принимали АХЭП.
У больных с I и II типом отмечалось существенное клиническое восстановление на фоне АХЭП. Примечательно, что так называемый «драматический» эффект АХЭП «от обездвиженности до полного благополучия», описанный Л.Б. Перельманом (1964), Б.М. Гехтом (1974), А.Г. Санадзе c соавт., (2005), G. Briassoulis с коллегами (2000), наиболее часто (32%) встречался среди больных II типа, имеющих сочетанный пре- и постсинаптический характер поражения синапса. Это указывало, что АХЭП имеют не только пост - но и пресинаптический эффект действия на синапс.
Электрофизиологическое изучение показало, что обратимость нарушений нервно-мышечной передачи на фоне АХЭП происходит при I и III типе патологии синапса за счет уменьшения декремента М-ответа (постсинаптический эффект). При этом при II типе восстановление силы мышцы происходит без изменения декремента, за счет существенного прироста амплитуды (площади) М-ответа (пресинаптический эффект). При этом у больных с III типе патологии синапса восстановление силы на фоне уменьшения декремента М-ответа отмечалось только в мышцах, чувствительных к прозерину. В «прозерин-негативных» мышцах больных с III типом отмечалось увеличение длительности М-ответа с появлением дополнительных компонентов М-ответа. Так, в m.orbicularis oculi длительность М-ответа, в среднем составляющая до прозерина 4,5 1,2 мс, после прозерина, увеличивалась до 12,31,2 мс, в m.deltoideus длительность М-ответа увеличивалась с 7,8 1,9 мс до 16,5±2,2 мс, в среднем, на фоне прозерина.
Пресинаптическое действие АХЭП, связанное с облегчением освобождения медиатора, наряду с основным постсинаптическим эффектом, было показано в экспериментах на животных (Gillies J.D., Allen J., 1977; Braga M.F. et al., 1993). По мнению M.F. Braga с коллегами (1993), R.A. Maselli, C. Leung (1993), эффект прозерина на нервно-мышечный синапс (НМС) противоположен эффекту d-тубокурарина. Тем не менее, ряд авторов считает более сложными механизмы опосредованного действия прозерина на выделение медиатора, связывая его с модулирующим эффектом самого АХ и АТФ на механизмы секреции нейромедиатора (Silinsky E.M., Redman R.S., 1996; Giniatullin R.A. et al., 1997; 2001; 2005). Вместе с тем, длительное воздействие АХЭП на НМС грызунов приводит к истощению медиатора во фракции, «готовой к немедленному выделению» (Roberts D.V., Thesleff S., 1968), и поражению ионных каналов АХР с развитием их десенситизации (Maselli R.A., Leung C., 1993).
Именно с этими механизмами связывают наиболее тяжелые для больных миастенией последствия приема АХЭП – холинергические (смешанные) кризы, когда на фоне чрезмерной блокады ацетилхолинэстеразы сам же АХ вызывает десенситизацию (инактивацию) ионного канала АХР (Гиниатуллин Р.А., Швецов А.Б., 1992; Гиниатуллин Р.А., Талантова М.В., 1995; Санадзе А.Г., и др. 2005; Bosch E.P., et al., 1991). В нашем исследовании наиболее высокая частота этих состояний отмечается при III типе патологии синапса у больных с патологией ионных каналов АХР (СН миастения). Большинство авторов указывают на высокую частоту кризов среди СН MuSK-позитивных больных и выделяют, как важную клиническую особенность, слабый или негативный эффект на АХЭП у этих пациентов (Evoli A. et al., 2003; Sanders D. et al. 2003; Newsom-Davis J., 2005, Vincent A., Leite M.I., 2005; Nemoto Y. et al., 2005). Кроме того, ряд исследователей обращает внимание на признаки «холинергической нервно-мышечной гиперактивности» у больных с СН MuSK-позитивной миастенией, обнаруживая фасцикуляции и повторные М-ответы на фоне приема ингибиторов ацетилхолинэстеразы (Nemoto Y. et al., 2005; Hatanaka Y. et al., 2005; Rostedt Punga A. et al., 2006).
Таким образом, при назначении АХЭП необходимо учитывать, что, повышая концентрацию медиатора в синаптическом пространстве, АХЭП модулируют состояние всех звеньев нервно-мышечной передачи у больных миастенией, что требует более дифференцированного подхода в подборе индивидуальной дозы у больных с разным типом патологии синапсов.
Эффективность глюкокортикостероидной терапии (ГКС) при миастении в настоящее время не вызывает сомнений. По данным большинства авторов, клинический эффект лечения отмечается в 70-90% случаях (Кузин М.И., Гехт Б.М., 1996; Genkins G. et al., 1993; Drachman D.B., 1996; Gajdos P., 1999; Juel V.C., Massey J.M., 2005). Вследствие относительно быстрого наступающего терапевтического действия они используются как первоочередное лечение у больных с поражением жизненно-важных функций, в том числе при начале заболевания с бульбарных нарушений (Гехт Б.М. и др., 2000; Genkins G. et al., 1993; Gajdos P., 1999; Juel V.C., Massey J.M., 2005). В нашем исследовании лечение ГКС было наиболее эффективно у больных с I и II типами патологии синапса (92,6% и 87,4% случаев, соответственно). У больных с III типом ремиссия на фоне ГКС-терапии наблюдалась только в 36,0% случаях, в 64,0% лечение ГКС было не достаточно эффективно.
В настоящее время выделяют «стероидо-зависимые» формы заболевания (Antonioni G. et al., 1990; Ponseti J.M. et al., 2005; Sanders D.B. et al., 2006), тяжесть миастении при которых не позволяют больному на протяжении всего заболевания полностью отменить ГКС, заставляя пожизненно принимать поддерживающие дозы препарата (30-40 мг через день). Среди больных с I типом патологии синапса частота таких случаев не превышала 11,8%. Наибольшее число таких больных мы обнаружили среди пациентов со II и III типом патологии синапса, которые составили 74,7 и 92,0% случаев, соответственно. В этой связи максимальная частота побочных эффектов лечения ГКС наблюдалась у пациентов со II и III типом патологии синапса (34,7 и 55,7% случаев соответственно). При этом, по частоте развития отдельных проявлений синдрома Кушинга, группы больных получавших преднизолон и метилпреднизолон, статистически не различались. В то же время другие побочные эффекты ГКС терапии, не связанные с подавлением функции надпочечников, имели статистически достоверные различия у больных изучаемых групп. Так, метилпреднизолон по-сравнению с преднизолоном обладал значительно более слабой стимуляцией аппетита (Р<0,001), и психики (Р< 0,05), отличался хорошей переносимостью ЖКТ (в том числе отсутствием ульцерогенного эффекта) - (Р< 0,05), менее часто способствовал развитию глаукомы и катаракты (Р<0,001). Это указывало на ряд преимуществ лечения метилпреднизолоном у пациентов детского и пожилого возраста, с нестабильной психикой, избыточной массой тела, склонностью к желудочным заболеваниям и атрофиям мышц.
Результаты изучения механизмов действия ГКС-препаратов на нервно-мышечную передачу позволяет обсудить причины неодинаковой эффективности ГКС на больных с разным типом патологии синапса. Уже на ранних сроках лечения происходил значительный прирост амплитуды М-ответа, которая увеличивалась в среднем с 127,8 35,9% через 10 приемов препарата до 185,8 14,7% при более продолжительном курсе терапии (30 приемов). Параллельно увеличению амплитуды М-ответа происходило уменьшение феномена ПТО (ПАО) на 38,2 19,0% в начале лечения и на 61,9 16,7% на фоне курса терапии. Однако, существенно увеличивая амплитуду М-ответа, ГКС вызывали лишь незначительное уменьшение декремента (на 10,3 16,8%) в начале лечения. Тем не менее, в дальнейшем (после 30 приемов), декремент уменьшается более значимо (на 22,2 28,3%, в среднем). Обнаруженное нами облегчающее пресинаптическое действие ГКС на нервно-мышечную передачу у всех больных миастенией, по-разному отражалась на состоянии нервно-мышечной передачи пациентов с I, II, и III типах патологии синапса. Обращало внимание, что наиболее быстрое восстановление наблюдалось у пациентов со II типом (уже в первые 10 дней лечения) в связи непосредственным воздействием ГКС на один из основных механизмов поражения при этом типе – нарушение выделения медиатора. Эти электрофизиологические находки подтверждают ранние клинические наблюдения (Гехт Б.М. и др., 1975; Коломенская Е.А. и др., 1983) о наиболее «быстром» эффекте ГКС на тимомных больных, большинство из которых, как показало наше исследование имеют II тип патологии синапса. Обратимость нарушений нервно-мышечной передачи у пациентов с I типом патологии отмечалась примерно через 2-3 недели от начала лечения. Это объяснятся тем обстоятельством, что иммуносупрессивные механизмы действия ГКС, связанные с уменьшением синтеза антител к АХР и ингибированием специфической CD4+T-клеточной пролиферации (Huang Y. et al., 1999; Рабсон А. и др., 2006), включаются лишь спустя 1-2 недели от начала терапии (Knappe G., Ulrich F.E., 1986). В этой связи, вероятно, уменьшение декремента М-ответа – электрофизиологического эквивалента дефицита АХР, наблюдалось не сразу. При этом, «полезное» пресинаптическое действие ГКС на НМС больных со II типом патологии, вызывало потенциальный риск для пациентов с патологией ионных каналов (III тип), имеющих электрофизиологические признаки повышенной чувствительности к медиатору. Увеличение выделения медиатора на фоне ГКС способствовало переходу ионных каналов в десенситизированное состояние, что, по всей вероятности, являлось причиной ухудшения течения миастении, у 27 пациентов (45%) с III типом в первые 2 недели приема ГКС (с 3 по 17 день от начала терапии); а в 3 случаях (5%), при проведении «пульсотерапии» ГКС по схеме 500мг-1000мг-1500мг ежедневно привело к развитию миастенических кризов.
Наши результаты подтверждают экспериментальные нейрофизиологические исследования, показывающие, что высокие дозы преднизолона оказывают влияние непосредственно на процессы освобождения медиатора из терминали аксона, повышая частоту МПКП; предотвращают развитие пресинаптических нервно-мышечных блоков, вызванных гемихолиниумом, d-тубокурарином и β-бунгакротоксином (Wilson R.W. et al., 1974; Engel W.K., 1976; Wolters M.J., Leeuwin R.S., 1976; Hall E.D. et al., 1983; Hall E.D., Wolf D.L., 1984; Dal Belo C.A. et al., 2002). Тем не менее, эффект ГКС на НМС не ограничивается облегчением выделения медиатора. Bouzat С., Barrantes F.J., (1996) показали, что ГКС относятся к низко-аффинным неконкурентным ингибиторам самих никотиновых АХР и оказывают непосредственный десенситизирующий эффект, вызывая уменьшение количества открытий канала АХР на одни активационный период и более длительное время пребывания канала в закрытом состоянии, типично наблюдаемое при феномене десенситизации.
В этой связи мы указываем на определенный риск лечения пациентов с III типом высокими дозами ГКС при внутривенном введении «пульсотерапии» (10-20 мг на 1 кг массы). Нарастание слабости примерно у трети больных при «пульсотерапии» наблюдали исследователи даже при более осторожном режиме внутривенного введения ГКС 1 раз в 5 дней - 2000г на одно введение (Oosterhuis H.J., 1983; Arsura E. et al., 1985). В то же время, Г.Э. Улумбекова (1989) показала высокую эффективность ежедневного режима введения высоких доз ГКС у 25 больных, находящихся в крайне тяжелом состоянии с бульбарными и дыхательными нарушениями. Тем не менее, наши исследования выявили веские патогенетические обоснования, позволяющих считать, что ежедневная внутривенная «пульсотерапия» высокими дозами ГКС по нарастающей схеме крайне опасна при III типе патологии синапса. И в целом этот метод лечения требует дальнейшего изучения, определения оптимальных режимов и доз введения с учетом типа патологии синапса у различных больных миастенией.
Изучение результатов тим(тимом)эктомии (ТТЭ) также выявило зависимость клинического эффекта от типа патологии синапса. Так, ТТЭ оказывала положительный эффект на течение миастении в 64,8% случаях больных с классическим I типом, в 23,5% со II и лишь в 15,0% при III типе патологии синапса. При этом, немедленный эффект ТТЭ (в первые 10-14 дней после операции) отличался от более отдаленного (через 6-18 месяцев). В первые дни после удаления тимуса (тимомы) отмечалось очень быстрое увеличение мышечной силы в среднем на 2,2 0,8 балла, значительный прирост амплитуды М-ответа (144,4 – 166, 4%), уменьшение феномена ПАО (ПТО) на 49,4 - 59,4% и выраженное уменьшение декремента на 22-27% у больных с I и II типом синапса (серопозитивная миастения). “Драматическое” улучшение уже в первые часы после ТТЭ, которое может продолжаться в течение нескольких дней, отмечали еще основоположники тимэктомии A.Blalock (1941) и G.Keynes (1949), описывают хирурги и в наше время (Ветшев П.С. и др., 2003; Кондратьев А.В., 2006). Однако «немедленный» эффект после операции не сохранялся спустя 6-18 месяцев после ТТЭ. Мы считаем, что объективный результат ТТЭ можно оценивать не ранее, чем через год от проведения операции, при этом, этот отдаленный эффект заметно отличаться от первоначального (немедленного) эффекта.
Частота развития миастенических кризов после тимэктомии в нашем исследовании составляла 6,7% случаев, и не зависела от титра АТ к АХР, а была связана со степенью компенсации бульбарных и дыхательных нарушений миастении перед проведением тимэктомии, указывая на высокий риск развития «драматического ухудшения» заболевания у пациентов с недостаточно компенсированным поражением жизненно-важных мышц.
До сих пор нет единого мнения по многим аспектам ТТЭ. Эффективность операции высока (60-70%) у пациентов с началом миастении до 40 лет и без тимомы, при этом, частота ремиссии заболевания после удаления тимом не превышает 10-30% (Oosterhuis H.J., 1984; Kondo K., Monden Y., 2005; Park I.K. et al., 2006). В нашем исследовании эффективность тимэктомии в значительной степени зависела от наличия тимомы. Так, стабильная ремиссия миастении после ТТЭ у больных с тимомой наблюдалась в 17,1%, в то время как при удалении неопухолевого тимуса - в 46,2% случаях (P<0,05). При этом, недостаточный эффект или отсутствие ремиссии с необходимостью пожизненного приема ГКС и АХЭП после ТТЭ, у пациентов с тимомами встречалось значительно чаще 82,9%, по сравнению с нетимомными больными (28,1%), (P<0,01). В современной литературе достаточно часто встречаются примеры не только ухудшения течения миастении, но даже начала заболевания после хирургического удаления тимомы (Tanimura S. et al., 2002; Shahrizaila N. et al., 2005; Gallego J. et al., 2005; Tseng Y.L. et al., 2006; Gonlugur U. et al., 2006). В нашем исследовании у 3-х пациентов удаление тимомы привело к трансформации миастении из локальной окулярной формы в генерализованную с бульбарными нарушениями (из I-IIa в IIIb-IVb степени тяжести по Barohn R.J. et al., 1998). В 6 случаях удаление тимомы на несколько месяцев/лет (от 8 месяцев до 10 лет, 3,5± 6,2 лет) опережало начало миастении. Обращало внимание развитие у больных после удаления тимомы ряда паранеопластических заболеваний: гнездной плешивости - 3 случая (5,3%), диффузной и тотальной аллопеции - 5 случаев (8,7%); стойкой тромбоцитопении в 5 случаях (8,7%); гипохромной анемии - 3 пациента (5,3%), синдрома Гуда с гипогаммаглобулинемей и бронхоэктатической болезнью в 3 случаях (5,3%); синдрома «cramp-fasciculation» - 2 пациента (3,5%).
Тем не менее, наименьший клинический эффект тимэктомии отмечался при СН миастении (III тип патологии синапса) - 85% случаев, что совпадает с данными литературы. Ряд исследователей докладывают о редком обнаружении патологии тимуса у СН MuSK - позитивных больных, указывая, что в целом морфо-гистологическая картина тимуса этих пациентов не отличается от здоровых людей того же возраста (Gajdos P., 2004; Newsom-Davis J., 2005; Lavrnic D. et al., 2005 Leite M.I. et al., 2005). По данным авторов тимома никогда не обнаруживается при СН миастении. Большинство исследователей указывают, что у СН MuSK ”+” больных нет эффекта на тимэктомию, что позволило даже ввести новый термин - «тимус-независимая миастения» (Evoli A. et al., 2003; Sanders D. et al. 2003; Newsom-Davis J., 2005, Vincent A., Leite M.I., 2005; Nemoto Y. et al., 2005; Lee J.Y. et al., 2006). Одна из причин отсутствия положительного эффекта тимэктомии у СН пациентов, возможно, связана с тем, что MuSK-рецептор является единственной установленной на сегодняшний день антигенной мишенью аутоиммунной миастении, которая не локализована в тимусе. Практически все антигенные белки, участвующие в аутоиммунном процессе при серопозитивной миастении – ацетилхолиновый рецептор, титин-белок и рианодиновые рецепторы скелетных мышц - идентифицированы в культурах тканей тимуса (Berrih-Aknin S. et al., 1987; Kaminski H.J. et al., 1993; Mygland A. et al., 1994; Conti-Fine B.M., Kaminski H.J., 2006). Это является патогенетическим обоснованием для проведения тимэктомии при серопозитивной миастении (I и II типы) как попытки устранения органа «первичной иммуногенности», и не имеет патогенетической основы при СН миастении (III тип).
Применение цитотоксических иммунодепрессантов (ЦТ) в лечении больных миастенией преследовало несколько конкретных целей. 1. Усиление иммуносупрессивного эффекта при неэффективности предшествующей ГКС-терапии, ТТЭ. 2. ЦТ назначались с противоопухолевой целью при паранеопластической миастении (миастения, сочетающаяся с тимомой, и другими неоплазиями). 3. Назначение ЦТ в качестве «страховки» от обострения заболевания на фоне снижения или прекращения приема ГКС 4. Назначение ЦТ в комбинации с ГКС при лечении миастении, сочетающееся с тяжелыми аутоиммунными заболеваниями (системная красная волчанка, ревматоидный артрит, псориаз, аутоиммунный тиреоидит).
Максимальный эффект азатиоприна был связан с его иммуносупрессивным действием и наблюдался у больных с поздним началом миастении (94,4%) и, при сочетании миастении с тяжелыми аутоиммунными заболеваниями (75% случаев). Эффективность лечения азатиоприном миастении, сочетающейся с паранеопластическими заболеваниями, не превышала 15% случаев. Таким образом, противоопухолевый эффект азатиоприна значительно уступал иммуносупрессивному. Более того, у 2-х пациентов (3,5%) отмечалось развитие малигнизации на фоне приема азатиоприна: у одного пациента через 20 месяцев непрерывного приема азатиоприна была обнаружена гемангиома тела Тh6 позвонка; у другой больной через 6 месяцев приема – рецидив тимомы. Эти наблюдения сопоставимы с литературными данными о высоком риске малигнизации у больных, длительно принимающих азатиоприн (Rawoot A. et al., 2006; Wakata N. et al., 2006).
Изучение эффективности лечения азатиоприном в зависимости от типа поражения синапса при миастении показало, что клинический эффект у больных с классическим I типом выявлялся в 84,4%; при II типе (тимомная, туловищная миастения, позднее начало миастении) в 71,4%; при III (серонегативная миастения) в 25% случаев. Тем не менее, назначение азатиоприна было наиболее оправдано у пациентов пожилого возраста с I типом патологии синапса; не показано у больных со II типом, имеющим высокую частоту неоплазий тимической и нетимической этиологии в связи с риском малигнизации; и противопоказано у пациентов с III типом (с преобладанием молодых женщин детородного возраста) из-за риска бесплодия и потенциального тератогенного эффекта (Mantegazza R. et al., 1988; Juel V.C., Massey J.M., 2005), а также вследствие недостаточной эффективности в 75% случаев.
По результатам нашего исследования назначение азатиоприна наиболее целесообразно для поддержания ремиссии в комбинации с ГКС и при снижении дозы ГКС. При этом, в качестве монотерапии в остром периоде заболевания этот препарат не достаточно эффективен. По этой позиции мы встретили общую точку зрения с большинством исследователей (Mantegazza R. et al., 1988; Evoli A. et al., 1996; Juel V.C., Massey J.M., 2005). Авторы указывают, что азатиоприн может использоваться в качестве монотерапии, однако в сравнении с ГКС начинает действовать только через 2-4 месяца, а иногда только к 4-10 месяцу от начала приема (Mertens H.G. et al ., 1981; Witte A.S. et al., 1984; Fonseca V., Havard C.W., 1990). По данным Witte A.S. с коллегами (1984), улучшение на фоне азатиоприна, в конечном счете, достигается в 80% случаев, однако в 44% оно продолжается до тех пор, пока пациент принимает препарат.
Циклофосфан реже используется при лечении миастении, т.к. имеет серьезные побочные эффекты. В частности, у него чаще отмечаются канцерогенные и тератогенные эффекты, чем у азатиоприна. Тем не менее, циклофосфан используется при лечении больных, не реагирующих ни на один вид иммунокоррекции (Drachman D.B., Brodsky R.A., 2005). В литературе описано применение этого препарата, как в виде монотерапии, так и в сочетании с азатиоприном (De Assis J.L. et al., 1986), а также «пульсотерапия» высокими дозами циклофосфана (Drachman D.B., Brodsky R.A., 2005) у тяжелых больных миастенией, резистентных ко всем видам иммуносупрессии. При этом эффективность препарата варьирует по разным данным от 40 % до 83% у больных миастенией (Щербакова Н.И., 2001; Niakan E. et al., 1986; De Assis J.L. et al., 1986).
В нашем исследовании иммуносупрессивный эффект циклофосфана уступал азатиоприну, в то время как противоопухолевый цитостатический эффект циклофосфана был более сильным, чем у азатиоприна (P<0,05). Так, максимальный эффект лечения циклофосфаном наблюдался у больных миастенией, сочетающейся с неоплазиями (77,7%). При этом в группе больных, резистентных к ГКС, иммуносупрессивный эффект циклофосфана вдвое уступал эффективности азатиоприна (20% против 42,8%, соответственно) (P<0,05). У пациентов с поздним началом миастении положительный эффект циклофосфана встречался в три раза реже (P<0,01), чем при лечении азатиоприном (33,3% и 94,4, соответственно).
Сопоставление клинической эффективности лечения циклофосфана в зависимости от типа патологии синапса не выявило какой-либо преимущественности действия у пациентов с разным типом патологии, показав в целом достаточно низкую эффективность препарата: при I типе 28,5%, II - 27,3%, III - 24% случаев. Важно подчеркнуть, что побочное действие циклофосфана отмечалось в тех или иных проявлениях в 92,4% случаев, что достоверно превышало частоту побочных эффектов всех видов лечения миастении (P<0,05). Среди основных побочных эффектов обращает внимание токсическое действие циклофосфана на легочную ткань, способствующее развитию воспалительных изменений (Sulkowski S., 1998). Гистологически при этом выявляется нарушение формирования внутри-альвеолярных перегородок легких, главным образом, эпителиальных клеток II типа. В нашем исследовании, назначение 10 больным с бульбарными и дыхательными нарушениями циклофосфана приводило к развитию тяжелых внутрибольничных пневмоний, наиболее частыми этиологическими факторами которых являлись Streptococcus viridans, Mycoplasma pneumoniae; Pneumococcus, что в 1 случае привело к абсцессу нижней доли правого легкого. Наиболее частым было токсическое действие на систему кроветворения - анемия, лимфопения, лейкопения, панцитопения (71,6% случаев). Начало иммуносупрессивной патогенетической терапии с монотерапии циклофосфаном в 3 случаях (3,6%) вызвало развитие миастенических кризов.
Таким образом, слабый клинический иммуносупрессивный эффект (около 30% случаев), тяжесть и выраженность побочных эффектов (92,4%) не оправдывали назначения циклофосфана больным миастении без тимомы и других неоплазий ни в качестве комбинированной терапии с ГКС, ни в виде монотерапии. Причем, циклофосфан не обладал накопительным эффектом, его действие продолжалось до тех пор, пока препарат давался больному, что согласуется с данными других авторов (Niakan E. et al., 1986).
Следует отметить, что цитостатики, в сравнении с ГКС, начинают действовать менее быстро, клинический эффект появляется только через 2-4 месяца. По данным (Mertens H.G. et al., 1981; Witte A.S. et al., 1984; Fonseca V., Havard C.W., 1990), ответ на эти препараты можно увидеть иногда только к 3-12 месяцу от начала лечения, и максимальный эффект обнаруживается в течении 1-2 года приема. Мы наблюдали клинический эффект цитостатиков не раньше, чем через 1-1,5 месяца от начала приема. В этой связи, назначение цитостатиков в остром периоде, при угрозе развития витальных нарушений является непоказанным. В такой ситуации предпочтение отдается ГКС, обладающим практически немедленным эффектом действия (Evoli A. et al., 1993; 1996; Mantegazza R. et al., 1988; Juel V.C., Massey J.M., 2005).
Проведенное исследование показало, что основные стратегические этапы лечения миастении - 1) АХЭП, 2) ГКС - терапия, 3) тим(тимом)эктомия и 4) цитостатическая терапия – позволяют около 70-80% пациентам достичь ремиссий. Причем полная ремиссия отмечалась в 8,3% случаев, частичная - в 36,3%, медикаментозная - в 38,2%. Таким образом, лечение оказалось эффективным в 82,9% случаях. Тем не менее, 48 больных (15%) не отреагировали на традиционное патогенетическое лечение миастении и составили группу резистентных больных. Клинико-электрофизиологическое изучение резистентных к лечению больных выявило отсутствие среди этих пациентов больных с I типом патологии синапса; в резистентную к лечению группу вошли 23 больных (25,3% от II типа) больных со II типом патологии синапса и 25 с III типом (41,7% от III типа).
Понятие «резистентности» при миастении возникло на основании отсутствия эффективности патогенетической иммуносупрессивной терапии, и наиболее часто этот термин в литературе можно встретить в свете изучения СН миастении (Farrugia M.E., Swingler R.J., 2002; Nemoto Y. et al., 2005; Spreadbury I. et al., 2005; Lee J.Y. et al., 2006). Авторы подчеркивают, что СН больные являются очень трудной в терапевтическом смысле группой, которая не всегда чувствительна к АХЭП, практически не отвечает на тимэктомию и недостаточно компенсируется иммуносупрессивными препаратами. Тем не менее, в нашем исследовании только около половины (52,1%) больных резистентной группы относились к серонегативной форме миастении, 47,3% - больных со II типом патологии синапса были серопозитивными. Кто же из больных, имеющих АТ к АХР, не отвечал на патогенетическое лечение миастении? Мы обнаружили, что тимому имели только 8,3% резистентных больных, т.е. не тимома определяла резистентность II типа. Пациентов с поздним началом миастении из II типа, вовсе не было среди резистентных больных (как правило, в пожилой возрастной группе достаточно быстро удавалось вызвать ремиссию). В резистентную группу вошли больные с юношеской конечностно-поясной (туловищной) миастенией (II тип) и пациенты с III типом патологии синапса, имеющие детское или юношеское начало заболевания. Таким образом, резистентные формы наиболее часто обнаруживались среди девочек-подростков, вступающих или вступивших в период полового созревания, имеющих II и III тип поражения синапса. Это позволяет предположить о роли нарушений функции гипоталамуса, управляющего общей активностью вегетативной нервной и эндокринной систем, как возможного центрального звена патогенеза заболевания.
Стратегия ведения резистентных пациентов была связана с тяжестью их состояния и имела два основных тактических направления: 1)предотвращение развития миастенических кризов и 2) выведение больных из миастенических кризов. В первом случае использовался препарат циклоспорина А (сандиммун неорал), во втором – внутривенное введение препаратов крови человеческий иммуноглобулин G (октагам, вигам, биавен, гамиммун).
Особенностью циклоспорина А (сандиммун неорал) являлось, то, что положительный клинический эффект, который он оказывал на больных резистентной миастенией во всех случаях, не зависел от типа патологии синапса. Отсутствия изменения состояния или негативного клинического эффекта при лечении сандиммуном не отмечалось ни в одном случае. По мере достижения клинического эффекта сандиммуна доза преднизолона (метилпреднизолона) уменьшалась. Снижение дозы ГКС начиналось со 2-6 месяца от начала приема сандиммуна. Полностью отменить прием ГКС-препаратов удалось 8 (25,8%), уменьшить дозу преднизолона (метипреда) более чем вдвое (на 50%) – 16-ти (51,6%) и менее чем на 50% - 7 (22,5%) пациентам. Многим больным, имеющим I группу инвалидности по тяжести миастении, циклоспорин А изменил качество жизни: остановил непрерывно рецидивирующие миастенические кризы больным с III типом патологии синапса, позволил отказаться от инвалидного кресла туловищным больным со II типом.
Разного рода побочные эффекты действия сандиммуна отмечались у 51,6% (16 пациентов), при этом, снижение дозы препарата потребовалось 14 больным (45,1%), временной отмены – 8 (25,8%), необходимость в полной отмене возникла в двух случаях (6,4%). Следует подчеркнуть, что часть из негативных эффектов возникала на ранних этапах лечения (гиперплазия десен (35,4%), диарея (3,2%), гиперкалиемия (29,0%), частые ОРВИ (6,4%), парестезии). Эти эффекты либо самостоятельно проходили, либо легко устранялись уменьшением дозы препарата. Другие побочные эффекты, могли появляться как в начале терапии, так и в дальнейшем (артериальная гипертензия (12,9%), гипертрихоз (22,5%), подкожные гематомы (48,3%)) и являлись «доза-зависимыми». Собственно же нефро- и гепатотоксическое действие препарата (6,4, и 12,9%, случаев, соответственно) развивались уже при длительном, как правило, непрерывном приеме сандиммуна более 3-х лет.
По данным многих авторов, несомненное преимущество циклоспорина А перед другими иммуносупрессивными препаратами заключается в его избирательном действии на отдельные звенья иммунитета, без подавления всей иммунной системы в целом. «Иммунологический скальпель», - так образно называют этот препарат за его направленное действие на активированные Т-клетки, продуцирующие провоспалительные цитокины, что приводит к снижению уровня экспрессии рецепторного интерлейкина 2 и молекул антиген-представления (Гусев Е.И., Бойко А.Н., 2001; McIntosh K.R., Drachman D.B., 1999; Lavrnic D. et al., 2005). Сегодня сандиммун с успехом применяется как при лечении стероидо-зависимых форм миастении (Antonini G. et al., 1990; García-Carrasco M. et al., 2007), так и при тяжелом течении заболевания, в частности, для купирования миастенических кризов (Sato A. et al., 1996; Giraud C. et al., 1997; Juel V.C., Massey J.M., 2005), а также в случаях сочетания миастении с инвазивными тимомами (Aoyama K. et al., 1998). По данным V.C. Juel, J.M. Massey (2005), D. Lavrinic. et al. (2005), этот препарат может быть достаточно перспективным в лечении СН MuSK «+» вариантов миастении.
Однако среди негативных моментов лечения нельзя не отметить, что всякий раз отмена сандиммуна вызывала развитие экзацербации заболевания уже спустя 1-6 месяцев. Вместе с тем, обнадеживает тот факт, что длительность ремиссии была тем дольше, чем более продолжительной была предшествующая терапия сандиммуном. Так, в одном случае ремиссия составила 2 года, чему предшествовал прерывистый прием препарата в течение 6,5 лет. Это обстоятельство определяет необходимость поиска оптимальных режимов приема и сроков терапии этим препаратом, что позволяло бы добиваться максимально продолжительной ремиссии и своевременно избегать развития серьезных осложнений лечения.
В нашем исследовании неотложные состояния развивались у 83 больных миастенией (20,6%). Среди пациентов со склонностью к кризовому течению заболевания, в период вне криза (стационарное состояние), - наиболее типичный для миастении - I тип встречался в 32% случаях. Частота выявления II типа не превышала 13%. Большинство пациентов (55%) имели III тип патологии синапса. Таким образом, соотношение I:II:III типов, которое в общей группе составляло 7:2:1, изменялось в сторону преобладания III типа у больных со склонностью к развитию неотложных состояний вне криза 3:1,5:5,5. В период криза соотношение I, II, III клинико-ЭМГ типов становится 0:0:10. То есть, по мере приближения больного к кризу, независимо от исходного типа патологии синапса, происходит увеличение десенситизированных рецепторов на постсинаптической мембране, и трансформация «недеполяризующего» типа блока в «деполяризующий», когда все больные переходят в III тип патологии синапса. И, если в предкризовом периоде состояние больных еще различалось на преимущественно миастенический или холинергический характер процесса (51,8% и 48,1%, соответственно), то по мере увеличения тяжести во всех случаях отмечался смешанный характер криза, главными критериями которого были отсутствие чувствительности к АХЭП, электрофизиологические признаки патологии ионных каналов – повторные М-ответы.
В этой связи тактика ведения криза была направлена на восстановление функциональной полноценности ионных каналов АХР: 1) отмена АХЭП; 2) внутривенное введение высоких доз иммуноглобулинов (ВВИГ) человека. В настоящее время эти препараты чаще всего используются при неотложных состояниях в миастении (Newsom-Davis J., 2003; Juel V.C., Massey J.M., 2005; Richman D.P., Agius M.A., 2003). Терапевтический эффект ВВИГ-терапии показан в исследованиях M. C. Dalakas с коллегами (1997; 1999; 2004), А. Achiron с коллегами (2000), и обусловлен следующими механизмами действия: 1)нейтрализация циркулирующих аутоантител, цитокинов и молекул адгезии; 2) конкуренция за место связывания с AХР, с целью замедления аутоантитело-зависимого разрушения или блокады рецепторов; 3) увеличение фагоцитоза с целью более быстрого элиминирования иммунных комплексов и аутоантител; 4) подавление воспаления посредством Down-регуляции гиперактивных Т- и В-клеток, а также макрофагов, и подавление выброса провоспалительных медиаторов; 5) модуляция функций Т-супрессоров; 6) уменьшение воспроизводства аутоантител посредством влияния на активность В-клеток по механизму обратной связи; 7) захват активированных факторов комплемента и подавление образования мембранолитических комплексов; 8) поддержка восстановления функций и силы мышц двигательного аппарата и органов дыхания. При этом, основное действие ВВИГ связано не столько с нейтрализацией аутоантител, сколько с конкуренцией за места связывания с АХР (Liblau R. et al.,1991; Ferrero B. et al., 1998). По данным P. Gajdos с коллегами (1997), V.C. Juel, J.M. Massey (2005), на ВВИГ-терапию отвечает 63-100% пациентов. Клиническое улучшение наступает в течение 2-5 дней после инфузии и спустя 10-14 дней достигает своего максимума.
Имеются различные результаты ВВИГ-терапии в отношении уменьшения титра АТ к АХР. Во многих случаях непосредственно после применения ВВИГ наблюдалось снижение уровня аутоантител, которое, однако, по прошествии нескольких дней или недель в большинстве случаев возрастало до предшествующего значения. Как показали P. Gajdos и соавт., (1997), B. Ferrero и соавт., (1998), значительное снижение аутоантител можно достичь только с помощью базисной иммуносупрессивной терапии. Общепринятым режимом терапии считаются короткие (пятидневные курсы) внутривенного введения препарата в дозе 400мг на 1кг массы тела ежедневно. Позже, Gajdos P. с соавторами (2005) показали, что ВВИГ эффективны в дозах не менее 1-2г на кг массы тела. Тем не менее, ряд клиницистов наблюдали улучшение состояния и при использовании менее высоких доз ВВИГ (300 мг/кг массы) в режиме 4 курса по одному дню (Сhu C.C. et. al., 1996). В собственных исследованиях мы показали, что на фоне базисного приема ГКС эффективность ВВИГ можно наблюдать и при дозах в 100 раз меньших (0,4-0,5 мг на 1кг массы тела через 1-2 дня в течение 7-18 дней). Тем не менее, оптимальные дозы иммуноглобулинов в лечении миастении еще не найдены.
Первый клинический эффект в нашем исследовании проявлялся после введения 10г препарата, максимальный достигался к суммарной дозе 20-30г. Введение ВВИГ ускоряло выход больного из криза, восстанавливая чувствительность к АХЭП на 3-4 сутки от начала лечения, в среднем через 3,2 ± 1,1 день. Лечение ВВИГ способствовало повышению общей сопротивляемости организма больных и более быстрому разрешению интеркурентных инфекций, что особенно важно для пациентов с угнетенной иммунной системой. Кроме того, лечение ВВИГ не вызывало побочных эффектов. Все это ставит человеческие ВВИГ на одно из основных мест в ведении неотложных состояний у больных миастенией.
Таким образом, в своем исследовании мы попытались найти критерии патогенетической целесообразности проведения отдельных видов лечения миастении, исходя из особенностей патологии синапса у различных больных на разных стадиях течения патологического процесса. Целью нашей работы было показать, что за диагнозом «генерализованная миастения» скрываются очень неоднородные группы больных, лечение которых не должно быть «стандартным». И если одного пациента следует как можно скорее подготовить к тимэктомии, то другому в первую очередь необходимо проведение онкопоиска, а третьего «ожидают» тяжелые миастенические кризы и многолетние курсы иммуносупрессивной терапии. Каждому из них предстоит пройти свой собственный путь заболевания, и насколько тяжелым будет этот путь, насколько оправданными будут попытки проведения различных видов иммуносупрессивного воздействия, во многом зависит от умения современного невролога искать и находить патогенетические обоснования стратегии и тактики лечения миастении.
