Патогенетические механизмы развития микроциркуляторных нарушений в нефроне и периферических сосудах на фоне интоксикации солями никеля 14. 03. 03. патологическая физиология
| Вид материала | Документы |
- Клинико-патогенетические механизмы развития внешне и внутрисекреторной недостаточности, 559.83kb.
- Синдром эндогенной интоксикации при беременности (патогенетические механизмы и лабораторная, 274.88kb.
- Пояснительная записка Учебно-методический комплекс по курсу «Патологическая физиология», 140.7kb.
- Патогенетические обоснования стратегии и тактики лечения миастении 14. 00. 16 патологическая, 781.52kb.
- Программа вступительных испытаний для специальности магистратуры 1-79 80 29 Патологическая, 348.44kb.
- Молекулярные механизмы апоптоза при окислительном стрессе 14. 00. 16 патологическая, 606.37kb.
- «Патогенетические механизмы развития хронической обструктивной болезни лёгких», 323.59kb.
- Механизмы нарушения цитокинопосредованной кооперации эозинофилов и иммунокомпетентных, 369.32kb.
- Механизмы формирования тромбоопасности при эндоскопических вмешательствах на органах, 460.72kb.
- Пояснительная записка к учебной дисциплине Эпизоотология и инфекционные болезни животных, 166.41kb.
На правах рукописи
ТАКОЕВА ЕЛЕНА АСТАНОВНА
ПАТОГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ РАЗВИТИЯ МИКРОЦИРКУЛЯТОРНЫХ НАРУШЕНИЙ В НЕФРОНЕ И ПЕРИФЕРИЧЕСКИХ СОСУДАХ НА ФОНЕ ИНТОКСИКАЦИИ СОЛЯМИ НИКЕЛЯ
14. 03. 03. - патологическая физиология
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Владикавказ – 2010
Работа выполнена в государственном образовательном учреждении высшего профессионального образования «Северо-Осетинская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию» и Учреждении Российской академии наук Институте биомедицинских исследований Владикавказского научного центра РАН и Правительства Республики Северная Осетия-Алания
| Научные руководители: | заслуженный деятель науки РСО-Алания, доктор медицинских наук, профессор Дзугкоева Фира Соломоновна |
| Официальные оппоненты: | заслуженный работник ВШ РФ, заслуженный деятель науки РСО – Алания, доктор медицинских наук, профессор ХЕТАГУРОВА Лариса Георгиевна |
| | доктор медицинских наук, профессор Павлюченко Иван Иванович |
Ведущая организация: государственное образовательное учреждение высшего профессионального образования «Российская медицинская академия последипломного образования Федерального агентства по здравоохранению и социальному развитию
Защита состоится «___» ____________ 2010 года в____ часов на заседании диссертационного совета Д 208.095.01 в государственном образовательном учреждении высшего профессионального образования «Северо-Осетинская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию» по адресу: 362019, РСО-Алания, г. Владикавказ, ул. Пушкинская, 40
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО СОГМА Росздрава (362019, г. Владикавказ, ул. Пушкинская, 40)
Автореферат разослан «____» ____________ 2010г.
Ученый секретарь диссертационного совета
доктор медицинских наук И.Г. Джиоев
Общая характеристика работы
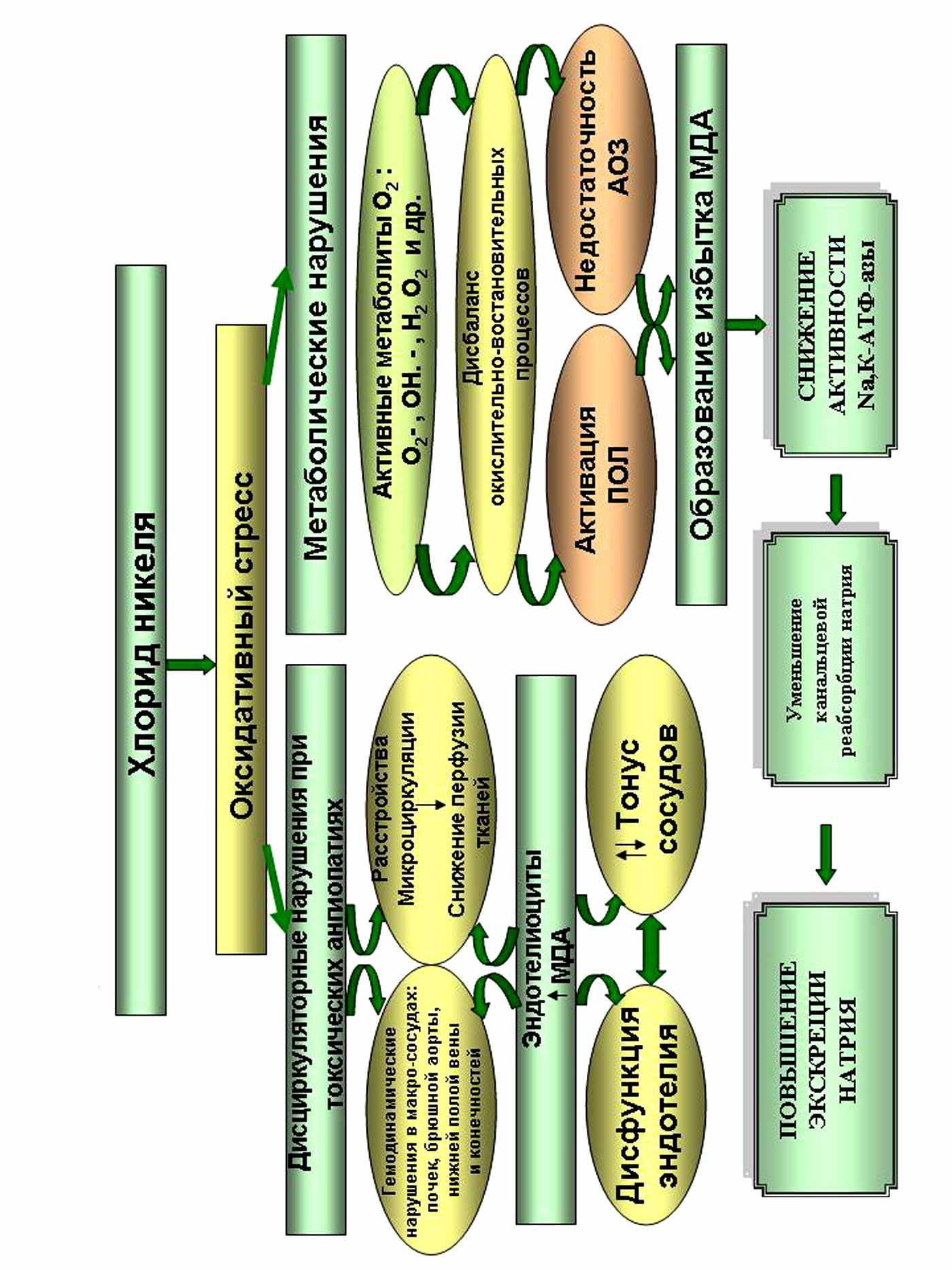
Актуальность исследования. Изучение особенностей влияния на человека ионов тяжелых цветных металлов, поступающих из объектов производственной и окружающей среды, на сегодняшний день в нашем регионе является актуальной проблемой. Город Владикавказ располагает богатой инфраструктурой промышленного производства тяжелых цветных металлов, а также многочисленными видами автотранспорта и др. источниками, загрязняющими экосистему. К таким загрязнителям относится и никель, входящий в VIII группу периодической системы Д.И. Менделеева вместе с железом и кобальтом. Никель является эубиотиком, участвует в метаболических процессах, влияет на активность ряда ферментов: ацил-КоА-синтетазу, карбоксилазу, фосфоглюкомутазу и др. В процессе эмбриогенеза никель концентрируется в органах с интенсивным обменом веществ. Вместе с тем, избыточное поступление никеля в организм вызывает патологические состояния органов дыхания, сердечно-сосудистой, аутоиммунной систем и почек. По данным ВОЗ (2005) и международной классификации канцерогенных веществ никель является одним из опасных загрязнителей окружающей среды. (Шудин В.В., 2008; Aberer W, 1992); обладает канцерогенными, мутагенными и аллергическими свойствами. (Сидоренко Г.И., Ицкова А.И., 1980, Борисенкова Р.В., 2001; Шудин В.В., 2008; Aitio A, 1990; Costa M, 1991; Aberer W, 1992). Соли никеля из атмосферы оказывают воздействие на человека в виде аэрозолей, образующихся при их окислении на воздухе, оседают на волосяном и кожном покровах и всасываются в кровь. Благодаря липофильности легко проникают через клеточные мембраны, обладают стойкостью и способностью к накоплению в клетках органов, взаимодействуют с SH-группами биологических мембран и субклеточных органелл. Поражают практически все органы, особенно почки – основной экскреторный орган. Оказывают прямое воздействие на эндотелиальные и мезангиальные клетки, тубулярный эндотелий, базолатеральные мембраны гломерул и канальцев. На молекулярном уровне никель способен инициировать процессы СРО, повышая уровень активных метаболитов кислорода (АМК), угнетая антиокислительную защиту (АОЗ) клеток (Ушакова В.Н., 1993; Васильева О.В., 1998; Павловская Н.А., 2002; Казимирко В.К. и др., 2004). Легко подвергаются перекисному окислению липидов (ПОЛ) клетки мозга, печени и почек (Ушакова В.Н., 1993, Меньшикова Е.Б. и др., 2006). Процессы пероксидации сопровождаются деформацией мембранного липопротеинового комплекса, повышением проницаемости для протонов и воды, ингибированием мембраносвязанных ферментов, в частности Na,K-АТФ-азы.
Однако, в доступной литературе отсутствуют комплексные исследования, посвященные изучению функциональной способности почек, микроциркуляторных нарушений в нефроне и периферических сосудах, свободно радикального окисления (СРО) и антиоксидантной защите (АОЗ) клетки в динамике на фоне хронической интоксикации солями никеля в эксперименте.
Цель работы: изучение водо- и электролито-выделительной функции почек, гемодинамики, активности перекисного окисления липидов и ферментов антиоксидантной защиты клеток на фоне интоксикации солями никеля в эксперименте.
Для достижения цели исследования решали следующие задачи:
- Воспроизвести модель нефропатии при введении различных дозировок хлорида никеля в течение 2 недель и месяца.
- Изучить изменения показателей водо- и электролито-выделительной функции почек на фоне спонтанного и водного диуреза, вызванные интоксикацией хлоридом никеля в динамике.
- Исследовать активность Na,K-АТФ-азы коркового и мозгового вещества почечной ткани на фоне экспозиции солями никеля в хроническом эксперименте.
- Исследовать состояние микроциркуляции в нефроне и периферических сосудах методом допплерографии на фоне экспозиции хлоридом никеля.
- Изучить показатели интенсивности перекисного окисления липидов по концентрации малонового диальдегида (МДА) в мембранах эритроцитов и клетках коркового и мозгового вещества почечной ткани и активность антиоксидантной системы (АОС) клетки по данным каталазы и супероксиддисмутазы (СОД).
Научная новизна данной работы заключается в выяснении новых звеньев патогенеза никелевой нефропатии, установлении роли перекисного окисления липидов, как фактора, изменяющего физико-химические свойства липидного матрикса клеток, в частности, эритроцитов и клеток почечной ткани. Впервые показано, что в генезе нарушения канальцевого транспорта натрия при хронической никелевой интоксикации, важную роль играет снижение активности Na+,К+-АТФ-азы почечных канальцев вследствие изменения липидного микроокружения фермента. Выявлена впервые взаимосвязь между накоплением малонового диальдегида и активностью Na+,К+-АТФ-азы в клетках почечной ткани. Показано, что в ответ на развитие оксидативного стресса изменяется активность супероксиддисмутазы и каталазы в сыворотке крови.
Научно-практическая значимость. Результаты настоящего исследования имеют научно-практическое значение, так как по состоянию перекисного окисления липидов в мембранах эритроцитов – аналогах тканевых клеток и в почечной ткани можно косвенно судить о состоянии этого процесса в структурах нефрона, что может быть использовано с целью ранней диагностики никелевой нефропатии у лиц, подвергающихся хроническому воздействию. Новизна работы подтверждена получением патента на изобретение: «Способ моделирования хронической токсической нефропатии» получено положительное решение №2009117254/14(023652) от 26.02.2010. На заявку: «Способ диагностики никелевой нефропатии у экспериментальных животных при хроническом отравлении» - приоритетная справка: № 2009117230/13(023616) от 05.05.2009.
Основные положения, выносимые на защиту:
- На фоне хронической никелевой интоксикации угнетается спонтанный диурез, повышается экскреция Na и К, вследствие снижения скорости клубочковой фильтрации (СКФ) и реабсорбции Na в почечных канальцах, тогда как канальцевая реабсорбция воды обнаруживает лишь тенденцию к снижению.
- При формировании хронической никелевой интоксикации нарушается способность почек экскретировать водную нагрузку, что проявляется снижением процента ее выведения за 3 часа и падением суммарного трехчасового диуреза на фоне 5 % водной нагрузки.
- Снижение уровня канальцевой реабсорбции Na обусловлено падением активности Na,K-АТФ-азы почечной ткани – основного компонента Na – насоса, активность которой зависит от липидного микроокружения. На фоне хронической никелевой интоксикации повышается интенсивность ПОЛ в гомогенатах коркового и мозгового слоев почечной ткани, изменяющая состояние липидного матрикса мембран клеток. В ответ на оксидативный стресс снижается активность супероксиддисмутазы и компенсаторно повышается активность каталазы.
- При хронической интоксикации хлоридом никеля формируются токсические ангиопатии, приводящие к нарушению гемодинамики в сосудах микроциркуляторного звена и, соответственно, снижению перфузии - жидкостного обмена, тогда как гемодинамика в артериальных сосудах (БА, ППА, ЛПА) характеризуется компенсаторным повышением средней скорости кровотока.
- На фоне интоксикации хлоридом никеля увеличивается концентрация никеля в плазме крови, моче, почечной ткани. Между вводимой дозой хлоридом никеля и содержанием никеля в плазме крови, моче и почечных тканях существует прямая корреляционная связь.
Апробация диссертации. Материалы диссертации докладывались на: IV региональной конференции «Новые технологии в рекреации здоровья населения», посвященная 10-летнему юбилею ИБМИ (октябрь 2007г.); научных конференциях молодых ученых СОГМА (Владикавказ, 2007, 2008, 2009гг); региональной междисциплинарной конференции молодых ученных посвященной 10-летнему юбилею ВНЦ (Владикавказ, 2010).
Публикации. По материалам диссертации опубликовано 11 работ, из них 2 в журналах, рекомендованных ВАК РФ.
Объем и структура диссертации. Диссертация изложена на 173 страницах, включая библиографию и приложение. Работа состоит из введения, обзора литературы, материалов и методов исследования, четырех глав собственных данных, заключения, общих выводов, списка использованной литературы и приложения. Библиографический указатель включает 215 источников литературы, из них 156 отечественных и 59 иностранных авторов. Работа иллюстрирована 83 рисунками и 21 таблицей.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования. Исследования проводились на 416 крысах самцах линии Wistar одной возрастной группы (10-14 мес.), массой 170-200 грамм интактных и с интоксикацией хлоридом никеля. Во время экспериментов крысы находились на стандартном пищевом рационе со свободным доступом к воде, световой режим – естественный. В качестве объектов исследования использовали плазму крови, эритроциты, гомогенаты коркового и мозгового вещества почечной ткани, мочу. Эксперименты проводили в хронических опытах, в одно и то же время суток, сезоны года, всего провели 3953 исследований. Гемодинамику исследовали в магистральных сосудах – брюшной аорте (БА), нижней полой вене (НПВ), почечных артериях (ПА) и микроциркуляторном звене допплерографически с помощью ультразвукового портативного допплерографа ММ-Д-Ф фирмы «МИНИМАКС» СП(б) у наркотизированных животных; использовали 6 основных точек локации. Для изучения водо-выделительной функции почек, исследовали 6 часовой спонтанный диурез и определяли в моче содержание креатинина, натрия, калия и никеля. По истечении времени эксперимента животных забивали под внутрибрюшинным тиопенталовым наркозом в дозе 20 мг/100г массы тела. Кровь забирали из левого желудочка, в плазме крови определяли концентрацию креатинина, натрия, калия, никеля, активность супероксиддисмутазы и каталазы. Расчетным путем, используя формулы Наточина Ю.В. (1974), вычисляли скорость клубочковой фильтрации, экскрецию воды и электролитов, их фильтрационные заряды и канальцевую реабсорбцию. Интенсивность перекисного окисления липидов в мембранах эритроцитов и в гомогенатах коркового и мозгового веществ почечной ткани исследовали по данным изменения концентрации малонового диальдегида колориметрическим методом с тиобарбитуровой кислотой по методу Аsacawa T., (1980). Состояние антиоксидантной системы оценивали по активности супероксиддисмутазы в сыворотке крови методом аутоокисления адреналина и каталазы в сыворотке крови методом М.А. Королюка и соав., (1988). Активность Na,K,АТФ-азы определяли по методу Scow JС, (1957). Удельную активность фермента рассчитывали на мг белка в час (мкмоль/Рн/мг белка/час). Белок в пробах определяли по методу Lowry OH., (1951). Статистическую обработку результатов производили методом вариационной статистики, принимая во внимание коэффициент вариации динамических рядов, и оценивали корреляцию с использованием компьютерной программы статанализа Microsoft Excel.
Результаты исследования и их обсуждение
Изучение водо-выделительной функции почек на фоне подкожного введения разных дозировок хлорида никеля во всех исследуемых группах экспериментальных животных показало, что происходит достоверное понижение спонтанного диуреза. Анализ данных основных процессов мочеобразования показал, что скорость клубочковой фильтрации достоверно понижалась, тогда как канальцевая реабсорбция воды имела лишь тенденцию к снижению. Следовательно, угнетение диуреза обусловлено достоверным снижением скорости клубочковой фильтрации.
На фоне 5% водной нагрузки данные показали, что суммарный трехчасовой диурез достоверно понижается у животных как при введение хлорида никеля в течение 2-х недель, так и в течение 1 месяца. При анализе суммарного 3-х часового водного диуреза выявлено, что почасовые изменения диуреза характеризуются его повышением на 1 часе в результате рефлекторного увеличения скорости клубочковой фильтрации. На 2 и 3 часах водной нагрузки диурез ниже уровня контроля вследствие угнетения скорости клубочковой фильтрации. Процент выведения водной нагрузки тоже падает по сравнению с данными контрольной группы, что подтверждает нарушение функциональной способности почек.
Таблица №1
Показатели водовыделительной функции почек у крыс с введением
хлорида никеля подкожно в дозах 0,3; 0,5 и 0,8 мг/кг веса в условиях
спонтанного диуреза (М±m)
| Группы животных | Диурез | Клубочковая фильтрация | Канальцевая реабсорбция воды |
| мл/ч/100г | мл/ч/100г | % | |
| Контрольная группа | 0,091 ±0,003 | 14,69 ±0,40 | 99,37 ±0,037 |
| Ni –0,3 мг/кг веса, 2нед | 0,076 ±0,004 111) | 11,21 ±0,24 1111) | 99,319 ±0,016 - |
| Ni –0,3 мг/кг веса, 1 месяц | 0,070 ±0,006 111) | 11,103 ±0,31 1111) | 99,366 ±0,024 - |
| Ni –0,5 мг/кг веса, 2нед | 0,077 ±0,005 11) | 10,929 ±0,535 1111) | 99,298 ±0,029 - |
| Ni –0,5 мг/кг веса, 1 месяц | 0,068 ±0,004 1111) | 9,748 ±0,332 1111) 222) | 99,299 ±0,019 2) |
| Ni –0,8 мг/кг веса, 2нед | 0,071 ±0,005 111) | 10,012 ±0,356 1111) 222) | 99,282 ±0,032 - |
| Ni –0,8 мг/кг веса, 1 месяц | 0,060 ±0,007 1111) | 9,296 ±0,51 1111) 222) | 99,351 ±0,015 3) |
Примечание: 1111) - p<0,001; 111) - p<0,01; 11) - p<0,02; 1) - p<0,05 достоверность относительно контроля
2222) - p<0,001; 222) - p<0,01; 22) - p<0,02; 2) - p<0,05 достоверность относительно дозы 0,3 мг/кг веса.
3333) - p<0,001; 333) - p<0,01; 33) - p<0,02; 3) - p<0,05 достоверность относительно дозы 0,5 мг/кг веса.
4444) - p<0,001; 444) - p<0,01; 44) - p<0,02; 4) - p<0 ,05 достоверность относительно 2 недель.
Таблица №2
Изменение электролитовыделительной функции почек у крыс
с введением хлорида никеля подкожно в дозах 0,3; 0,5 и 0,8 мг/кг веса
в условиях спонтанного диуреза (М±m)
| Группы животных | Экскре- ция Na | Фильтраци онный заряд Na | Реабсорб- ция Na | Экскре- ция К | Фильтрационный заряд К |
| мкмоль/ч/100г | % | мкмоль/ч/100г | |||
| Контрольная группа | 9,38 ±0,26 | 1658,16 ±52,93 | 99,49 ±0,092 | 6,32 ±0,36 | 53,85 ±1,47 |
| Ni –0,3 мг/кг веса, 2нед | 9,935 ±0,08 1) | 1490,61 ±33,65 111) | 99,29 ±0,016 1111) | 6,49 ±0,073 - | 45,02 ±0,89 1111) |
| Ni –0,3 мг/кг веса, 1 месяц | 10,164 ±0,18 11) | 1463,38 ±41,77 111) | 99,301 ±0,023 11) | 7,09 ±0,14 1) | 47,14 ±1,27 111) |
| Ni –0,5 мг/кг веса, 2нед | 10,096 ±0,054 111) | 1443,59 ±17,05 1111) | 99,30 ±0,0085 111) | 6,578 ±0,1 - | 70,786 ±1,676 1111) 2222) |
| Ni –0,5 мг/кг веса, 1 месяц | 10,544 ±0,142 1111) | 1549,32 ±12,78 1) 2) | 99,32 ±0,011 11) | 7,463 ±0,142 111) | 79,382 ±1,368 1111) 2222) |
| Ni –0,8 мг/кг веса, 2нед | 10,202 ±0,18 111) | 1519,82 ±20,43 11) 333) | 99,33 ±0,016 1) | 6,961 ±0,106 2222) 333) | 71,133 ±1,013 1111) 2222) |
| Ni –0,8 мг/кг веса, 1 месяц | 10,742 ±0,18 1111) 2) | 1305,37 ±24,13 1111) | 99,172 ±0,026 1111) | 7,75 ±0,115 222) | 80,306 ±1,824 1111) 2222) |
Примечание: 1111) - p<0,001; 111) - p<0,01; 11) - p<0,02; 1) - p<0,05 достоверность относительно контроля
2222) - p<0,001; 222) - p<0,01; 22) - p<0,02; 2) - p<0,05 достоверность относительно дозы 0,3 мг/кг веса.
3333) - p<0,001; 333) - p<0,01; 33) - p<0,02; 3) - p<0,05 достоверность относительно дозы 0,5 мг/кг веса.
4444) - p<0,001; 444) - p<0,01; 44) - p<0,02; 4) - p<0 ,05 достоверность относительно 2 недель.
Исследование характера кровотока в крупных сосудах и в микроциркуляторном русле показало, что при анализе перфузии тканей при никелевой интоксикации во всех точках локации снижается средняя скорость кровотока (M) за счет снижения систолической (S) и диастолической (D) скоростей кровотока. Реографические показатели характеризуются повышением индекса Гослинга, который отражает повышение упруго-эластических свойств (плотности) сосудистой стенки и снижение градиента давления в сосудах микроциркуляторного русла. Одновременно повышался реографический индекс (RI – индекс Пурсело), свидетельствующий о нарастании регионарного периферического сосудистого сопротивления.
Данные, свидетельствующие о понижении градиента давления (GD) и диастолической скорости кровотока в НПВ, характеризуют венозный застой на фоне повышения средней (М) и систолической (S) скоростей кровотока в магистральных сосудах (БА и почечные артерии). Возможно, это является компенсаторным механизмом для поддержания жидкостного обмена в сосудах микроциркуляторного русла. Все эти изменения микро- и макрогемодинамики направлены на улучшение доставки кислорода и метаболитов в клетки тканей.
Исследование электролито-выделительной функции показало, что происходит повышенная экскреция натрия и калия с мочой. Ответственным за повышенную экскрецию натрия является снижение канальцевой реабсорбции катиона, тогда как величина его фильтрационного заряда у исследуемых животных оказалась сниженной. На фоне 5% водной нагрузки почасовые изменения приводят к достоверному увеличению суммарной экскреции с мочой как натрия, так и калия. При этом отмечается снижение концентрации натрия в крови, а содержание калия достоверно повышается. Как известно, реабсорбция натрия в почечных канальцах является активным процессом и в нем принимает участие Na+,К+-АТФ-аза, являющаяся основным компонентом натриевого насоса. Фермент расщепляет макроэргические фосфатные связи АТФ, обеспечивает энергией активный транспорт Na+ и К+. Однако, в доступной нам литературе отсутствуют данные о состоянии Na+,К+-АТФ-азы в клетках почечной ткани, а особенно в различных ее слоях при хроническом воздействии никеля на организм.
Данные, полученные в нашей лаборатории, свидетельствуют о том, что в норме активность Na+,К+-АТФ-азы зависит от состояния липидного микроокружения (Дзугкоева Ф.С. и соавт., 1996; 2003; 2004; 2008; 2009), ионных регуляторов, нуклеотидов, являющихся субстратами фермента, гормональных ингибиторов и активаторов (Наточин Ю.В., 1982; Слесаренко Е.Г., Корсуновская Г.А., Гарец В.Л., Литвин В.С., Масалыгина Л.С., 1991; Сумакова И.А., 1996). Уменьшение активности данного фермента может быть обусловлено изменением конформации энзима в результате нарушения состояния фосфолипидов мембран клеток канальцев почек, так как каталитическая активность его находится в зависимости от качественного и количественного состава мембранных фосфолипидов. Как известно, важную роль в структурно-функциональной модификации биологических мембран, изменении их физико-химических свойств и проницаемости играет перекисное окисление липидов - универсальный процесс, протекающий в мембранах в физиологических условиях. При ряде патологических состояний, включая никелевую интоксикацию, происходит активация перекисного окисления липидов, которая может привести к целому ряду отклонений, в частности, к структурной перестройке мембран и нарушению клеточного метаболизма, изменению активности мембраносвязанных ферментов (Ушакова В.Н., 1993; Васильева О.В., 1998; Павловская Н.А., Кирьяков В.А., Савельев С.И., 2002; Казимирко В.К., Мальцев В.И., Бутылин В.Ю., Горобец Н.И., 2004).

Рис.1. Показатели активности Na+,К+-АТФ-азы в гомогенатах коркового и мозгового вещества почечной ткани.
При количественной оценке процессов липопероксидации в клетках крови, гомогенатах тканей печени в динамике экспериментальной нефропатии зарегистрированы существенные изменения активности системы свободнорадикального окисления (Осипов А.Н., 1990; Конторщикова К.Н., 2000; Дубинина Е.Е., 2001; Павловская Н.А., 2001; Скулачев В.П., 2001; Шевцов А.А., Заблова Т.А., Бондаренко О.А., Фролова Л.А., 2005). Вместе с тем в доступной нам литературе мы не обнаружили данных об изменении процессов перекисного окисления липидов в почечной ткани и их влиянии на активность Na-насоса, ответственного за реабсорбцию натрия в почечных канальцах.
Интенсивность перекисного окисления липидов при никелевой нефропатии оценивали по концентрации конечного продукта ПОЛ - МДА в мембранах эритроцитов и клетках коркового и мозгового вещества почечной ткани. У экспериментальных крыс на фоне экспозиции хлоридом никеля повышается концентрация МДА в эритроцитах, причем более выраженное повышение МДА отмечено при подкожном введении хлорида никеля в дозе 0,8 мг/кг в течение 1 месяца. Аналогичные изменения выявлены и в клетках почечной ткани: происходит достоверное повышение концентрации МДА как в корковом, так и в мозговом веществе почечной ткани во всех вариантах исследований. Более выраженное повышение активности ПОЛ отмечается при никелевой интоксикации в течение 1 месяца. Усиление процессов липопероксидации при никелевой интоксикации вызывает дезинтеграцию липопротеиновых комплексов, усиливает их гидрофильность и приводит к нарушению проницаемости мембраны и изменению конформации мембраносвязанного фермента Na+,К+-АТФ-азы. Полученные нами данные свидетельствуют о взаимосвязи между повышением концентрации МДА и снижением активности Na+,К+-АТФ-азы в клетках почечной ткани. Отмечается отрицательная корреляционная связь между интенсивностью перекисного окисления липидов и активностью Na+,К+-АТФ-азы в корковом (r = -0,693 в 1 группе животных; r = -0,713 во 2 группе животных; r = -0,688 в 3 группе животных; r = -0,769 в 4 группе животных; r = -0,697 в 5 группе животных; r = -0,788 в 6 группе животных) и мозговом (r = -0,667 в 1 группе животных; r = -0,707 во 2 группе животных; r = -0,673 в 3 группе животных; r = -0,712 в 4 группе животных; r = -0,702 в 5 группе животных; r = -0,725 в 6 группе животных) веществе почечной ткани. Кроме того, нами установлены однонаправленные изменения процессов липопероксидации в эритроцитах и клетках почечной ткани.
Во взаимосвязи с процессами свободнорадикального окисления находится антиоксидантная система организма, основная функция которой заключается в ограничении процессов перекисного окисления липидов практически во всех его звеньях.
Таблица №3
Изменение активности ПОЛ в эритроцитах и почечной ткани
и активности ферментов супероксиддисмутазы и каталазы в сыворотке крови (М±m)
| Группы животных | Концентрация МДА в эритроцитах | Концентрация МДА в клетках корк. в-ва почечной ткани | Концентрация МДА в клетках мозг. в-ва почечной ткани | Активность каталазы в сыворотке крови | Активность СОД в сыворотке крови |
| нмоль/мл | нмоль/мг белка | нмоль/мг белка | мкат/л | ед.активности | |
| Контрольная группа | 4,54 ±0,16 | 1,26 ±0,06 | 2,73 ±0,1 | 225,56 ±29,09 | 2,386 ±0,25 |
| Ni – 0,3 мг/кг веса 2 нед , п/к | 4,98 ±0,09 11) | 2,18 ±0,03 1111) | 3,57 ±0,06 1111) | 329,76 ±12,56 111) | 3,14 ±0,08 111) |
| Ni - 0,3 мг/кгвеса 1 месяц, п/к | 5,11 ±0,11 111) | 2,39 ±0,09 1111) 4) | 4,15 ±0,14 1111) 4444) | 382,92 ±16,65 1111) 44) | 1,56 ±0,04 1111) 4444) |
| Ni -0,5 мг/кг веса, 2 нед , п/к | 5,19 ±0,12 111) | 2,58 ±0,05 1111) 2222) | 4,75 ±0,04 1111) 2222) | 394,08 ±21,69 1111) 22) | 3,27 ±0,061 111) |
| Ni -0,5 мг/кг веса, 1 месяц , п/к | 5,48 ±0,07 111) 222) 4) | 2,68 ±0,12 1111) | 4,90 ±0,26 1111) 22) | 336,68 ±9,77 111) 22) 44) | 1,50 ±0,04 111) 4444) |
| Ni -0,8 мг/кг веса, 2 нед , п/к | 5,26 ±0,05 1111) 2222) 3333) | 2,79 ±0,04 1111) 2222) 333) | 4,86 ±0,04 1111) 2222) | 406,81 ±8,1 1111) | 1,69 ±0,07 111) |
| Ni -0,8 мг/кг веса, 1 месяц , п/к | 5,69 ±0,06 1111) 2222) 3) 4444) | 2,80 ±0,11 1111) 222) | 4,95 ±0,05 1111) 2222) | 401,43 ±28,80 1111) 3) | 1,48 ±0,03 111) 2) 444) |
Примечание: 1111) - p<0,001; 111) - p<0,01; 11) - p<0,02; 1) - p<0,05 достоверность относительно контроля
2222) - p<0,001; 222) - p<0,01; 22) - p<0,02; 2) - p<0,05 достоверность относительно дозы 0,3 мг/кг веса.
3333)- p<0,001; 333) - p<0,01; 33) - p<0,02; 3) - p<0,05 достоверность относительно дозы 0,5 мг/кг веса.
4444)- p<0,001; 444) - p<0,01; 44) - p<0,02; 4) - p<0,05 достоверность относительно 2 недель.
Чтобы оценить реакцию системы антиоксидантной защиты организма в ответ на развитие оксидативного стресса при хронической никелевой интоксикации, мы определяли активность супероксиддисмутазы, превращающей супероксиданион-радикал в перекись водорода и одновременно каталазы, расщепляющей Н2О2 до молекулярного О2 и Н2О. Данные показали достоверное снижение активности супероксиддисмутазы, хотя отмечалось повышение активности каталазы в сыворотке крови. Эти данные свидетельствуют о том, что причиной активации процессов ПОЛ наряду с образованием активных форм кислорода, является угнетение антиокислительной системы клеток, что проявляется угнетением активности супероксиддисмутазы, хотя происходило компенсаторное повышение активности каталазы.
Таким образом, патогенетической основой повреждения нефрона и других клеток тканей при экспериментальной никелевой интоксикации, является перекисное окисление липидов, вследствие образования активных форм кислорода и метаболитов ПОЛ. Развитию этого процесса также способствует дисбаланс между активностью системы свободно-радикального окисления и ферментов антиокислительной защиты.
Для утверждения положения о токсичности никеля, содержащегося в крови и тканях, исследовали содержание никеля в плазме крови, моче и почечной ткани. Данные показали, что во всех биологических средах концентрация никеля повышалась статистически достоверно (р<0,001). Более того, корреляционный анализ показал положительную корреляционную связь между дозой вводимого хлорида никеля и его содержанием в крови (r = +0,62 в 1 группе животных; r = +0,67 во 2 группе животных), в моче (r = + 0,54 в 1 группе животных, r = +0,79 – во 2 группе животных) и в почечной ткани (r = + 0,67 в 1 группе животных, r = + 0,74 – во 2 группе животных). Возрастание содержания металла в биологических средах хлорида никеля в течение 1 месяца было пропорционально вводимой дозе.
Выводы
- При хронической никелевой интоксикации, вызванной подкожным введением хлорида никеля в дозах 0,3; 0,5 и 0,8 мг/кг массы животного, отмечается уменьшение спонтанного диуреза, сопровождающееся снижением скорости клубочковой фильтрации, тогда как канальцевая реабсорбция воды не демонстрирует достоверных изменений. О нарушении функциональной способности почек свидетельствует уменьшение процента выведения водной нагрузки за 3 часа.
- Экскреция натрия в условиях спонтанного и водного диуреза при хронической никелевой интоксикации повышена, что обусловлено падением уровня относительной канальцевой реабсорбции катиона, тогда как экскреция калия повышается на фоне введения хлорида никеля.
- При нефропатии, вызванной введением хлорида никеля, отмечается снижение активности Na+,К+-АТФ-азы коркового и мозгового веществ почечной ткани, что и обусловливает снижение канальцевой реабсорбции натрия и его повышенную экскрецию.
- На фоне введения различных дозировок хлорида никеля выявлено повышение содержания никеля в плазме крови, моче и почечной ткани, причем между вводимой дозой хлорида никеля и его содержанием в плазме крови, моче и почечной ткани существует прямая корреляционная связь.
- Экспозиция никелем в дозах 0,3; 0,5 и 0,8 мг/кг веса животного сопровождается активацией ПОЛ в эритроцитах и в гомогенатах коркового и мозгового слоев почечной ткани, о чем свидетельствует повышение в них концентрации малонового диальдегида. Отмечается прямая корреляционная связь между активностью Na+,К+-АТФ-азы и интенсивностью ПОЛ в почечной ткани.
- В ответ на развитие оксидативного стресса при хронической никелевой интоксикации происходит снижение активности супероксиддисмутазы и компенсаторное повышение активности каталазы в сыворотке крови во всех вариантах опытов.
- Хроническая интоксикация хлоридом никеля вызывает снижение жидкостного обмена (перфузии) в сосудах микроциркуляторного русла из-за увеличения плотности сосудистой стенки, тогда как гемодинамика в артериальных сосудах (БА, ППА, ЛПА) характеризуется компенсаторным повышением средней и систолической скоростей кровотока.
Список работ, опубликованных по теме диссертации
- Дзугкоева Ф.С, Дзугкоев С.Г., Такоева Е.А., Можаева И.В., Дзагуров К.Г. Патогенетические механизмы развития ангиопатий при экспериментальном сахарном диабете и интоксикации солями кадмия и никеля. // Успехи современного естествознания. - 2007. - №12. - С.48-49.
- Такоева Е.А., Дзугкоева Ф.С., Можаева И.В., Хаева Л.Х. Некоторые показатели токсического влияния солей никеля в эксперименте у крыс. // Владикавказский медико-биологический вестник. - 2007. – Т.7. – С.126-129.
- Такоева Е.А. Изменение водо- и электролитовыделительной функции почек на фоне интоксикации хлоридом никеля. // Тезисы докладов 7 конференции молодых ученых СОГМА и ИБМИ ВНЦ РАН. Владикавказ. - 2008. – С.97-99.
- Битарова Ж.Р., Такоева Е.А., Дзугкоева Ф.С. Некоторые механизмы нефротоксичности солей кадмия и никеля в эксперименте // Астраханский медицинский журнал. - 2008. - №3. – С.248-250.
- Такоева Е.А., Дзугкоева Ф.С. Роль ПОЛ в изменении водо- и электролитовыделительной функции почек на фоне экспозиции солями никеля. // Вестник РУДН. - 2008. - С.510-511.
- Дзугкоева Ф.С., Такоева Е.А. Патобиохимические механизмы токсического влияния хлорида никеля в эксперименте у крыс. // Вестник новых медицинских технологий. - 2009. – Т.16, № 3. - С. 36-37.
- Дзугкоева Ф.С., Дзугкоев С.Г., Такоева Е.А., Тедтоева А.И., Битарова Ж.Р., Можаева А.И. Влияние солей тяжелых и цветных металлов на водо-и электролитовыделительную функцию почек. // Фундаментальные исследования. - 2009. - № 9. - С.40-42.
- Такоева Е.А., Можаева И.В. Метаболические и функциональные изменения на фоне экспозиции солями никеля в эксперименте. // «Актуальные проблемы медицины», Материалы 10-й юбилейной научной сессии, посвященной 70-летию СОГМА г. Владикавказ. - 2009. - С. 343-345.
- Лолаева А.Т., Брциева З.С., Такоева Е.А., Можаева И.В. Использование антиоксидантов с мембранотропным действием в комплексной терапии ишемической болезни сердца. // Вестник РУДН. - 2008. - С.613-615.
- Дзугкоева Ф.С., Можаева И.В., Такоева Е.А., Дзугкоев С.Г., Битарова Ж.Р., Тедтоева А.И. Патогенетические механизмы формирования токсических ангио-нефропатий в экспериментах. // Владикавказский медико-биологический вестник. - 2010. – Т.9. – С.87-92.
- Способ моделирования хронической токсической нефропатии/ Дзугкоева Ф.С., Такоева Е.А.; заявитель и патентообладатель ГОУ ВПО «Северо-Осетинская гос. мед. академия» Федеральн. агенства по здравоохр. и соц. разв. №2009117254/14(023652) от 26.02.2010.
СПИСОК СОКРАЩЕНИЙ
- АОС – антиоксидантная система;
- АФК – активные формы кислорода;
- БА - брюшная аорта;
- КФ – клубочковая фильтрация;
- ЛЗ – левая задняя лапка;
- МДА – малоновый диальдегид;
- МЦ – микроциркуляция;
- НПВ – нижняя полая вена;
- ПА – почечная аорта;
- ПЗ – правая задняя лапка;
- ПОЛ – перекисное окисление липидов;
- СОД – супероксиддисмутаза;
- СРО – свободно-радикальное окисление;
- Na+,К+-АТФ-аза – натрий, калиевая аденозинтрифосфатаза;
- M – средняя скорость кровотока
- S – систолическая скорость кровотока
- D – диастолическая скорость кровотока
- PI – пульсаторный индекс (индекс Гослинга)
- GD – градиент давления
- RI – реографический индекс
- RH2O – реабсорбция воды
- RNa – реабсорбция Na
- ENa – экскреция Na
- ФзNa – фильтрационный заряд Na
- EK – экскреция калия
Информационно-технический отдел
ГОУ ВПО СОГМА Росздрава
Подписано в печать 27.05.10 Тираж 100 экз.
Формат издания 60Х90 усл.печ.л.1,0
Заказ № 23
