Томский государственный университет
| Вид материала | Практикум |
- Информатизация в музеях в контексте проблем музейного производства. Кпостановке вопросов,, 38.11kb.
- Образование и наука в третьем, 1269.55kb.
- Личностно-профессиональное становление в условиях вузовского образования: акмеориентированный, 743.02kb.
- Экономическая ситуация требует глубокого изучения теории и практики и необходимость, 39.83kb.
- Оформите, оплатите и вышлите в Томский политехнический университет на дискете или, 86.19kb.
- Томский Государственный Университет Систем Управления и Радиоэлектроники (тусур) Томский, 19.19kb.
- Учебное пособие томск 2003 Томский государственный университет систем управления, 2466.49kb.
- Томский Государственный Университет Систем Управления и Радиоэлектроники (тусур) Томский, 87.68kb.
- Утверждаю, 90.9kb.
- Министерство образования Российской Федерации Томский Государственный Университет Систем, 2141.57kb.
Государственное учреждение высшего профессионального образования
ТОМСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Химический факультет
Кафедра неорганической химии
Лабораторный практикум по неорганической химии
учебно-методическое пособие
для студентов нехимических специальностей
Томск 2010
ОБЩИЕ ПРАВИЛА ВЫПОЛНЕНИЯ и техника ЛАБОРАТОРНЫХ РАБОТ
Лабораторные работы являются одной из важнейших составных частей курса химии. Для их выполнения студенту необходимо ознакомиться с лабораторным оборудованием, измерительными приборами, а также с техникой проведения основных лабораторных операций.
Поскольку в химической лаборатории находятся электроприборы, газ, ядовитые и огнеопасные вещества, студенты должны строго соблюдать правила внутреннего распорядка и техники безопасности.
Перед каждым лабораторным занятием студент должен изучить соответствующий раздел учебника, конспекта лекций и описание лабораторной работы. При выполнении лабораторной работы студент делает записи в лабораторном журнале, а по окончании работы оформляет письменный отчет о проделанной работе.
Общие правила работы в лаборатории
1. Работа в лаборатории должна проводиться согласно требованиям техники безопасности.
2. В лаборатории запрещается находиться в верхней одежде, громко разговаривать, принимать пищу, курить. Запрещается без разрешения преподавателя включать и выключать рубильники, газовые краны, приборы.
3. К проведению эксперимента следует готовиться заранее, используя описание работы, учебник и конспект лекций.
4. Рабочее место не должно быть загромождено лишними предметами. На рабочем столе может находиться только то, что требуется для выполнения текущей работы. Работать следует в халате.
5. Опыт проводят всегда в чистой посуде.
6. Реактивы, предназначенные для общего пользования, должны содержаться в специально отведенных для них местах (в вытяжном шкафу или на специальных столах), нельзя перемещать их оттуда.
7. После извлечения из банки или склянки требуемого количества реактива пробки или пипетки от них немедленно возвращаются на место. Если к склянке с раствором специальная пипетка не прилагается, необходимо использовать чистую пипетку. Твердые реактивы отбирают шпателем или фарфоровой ложкой.
8. Если реактив взят в избытке и не израсходован полностью, нельзя возвращать его обратно в склянку или банку.
9. По окончание работы следует убрать свое рабочее место, закрыть краны и отключить приборы.
10. Во время выполнения лабораторной работы запрещается проводить не относящиеся к ней опыты без разрешения преподавателя.
11. При возникновении в лаборатории нестандартной ситуации немедленно сообщите об этом преподавателю и покиньте помещение.
Техника безопасности и меры предосторожности
1. Опыты, связанные с применением или образованием ядовитых веществ, проводите только в вытяжном шкафу, дверцы которого должны быть опущены на треть.
2. В случае прекращения работы вентиляционных установок все опыты, проводимые в вытяжных шкафах, должны быть прекращены.
3. Запрещается проводить любые опыты с взрывчатыми и огнеопасными веществами и смесями.
4. При нагревании веществ в пробирке используйте держатель. Не направляйте отверстие пробирки в сторону работающих.
5. Не наклоняйтесь над сосудом, в котором происходит нагревание или кипячение жидкости, во избежание попадания брызг на лицо.
6. Если необходимо определить запах выделяющегося газа, то легким движением ладони направьте струю газа от горла сосуда к себе и осторожно понюхайте.
7. При разбавлении концентрированных кислот и щелочей выливайте их небольшими порциями в воду (не наоборот!), непрерывно помешивая образующийся раствор.
8. Если склянка с легковоспламеняющейся жидкостью опрокинулась или разбилась, немедленно выключите все находящиеся вблизи источники открытого огня, засыпьте разлитую жидкость песком, соберите его и перенесите в предназначенный для отходов железный ящик.
9. При попадании концентрированного раствора кислоты на кожу промывайте место ожога струей холодной воды в течение нескольких минут. После этого обожженное место можно либо промыть 2-3 %-ным раствором соды, либо вымыть с мылом.
10. При ожоге концентрированными растворами щелочей промывайте обожженное место струей холодной воды до тех пор, пока кожа не перестанет казаться скользкой, после чего промойте 1 %-ным раствором уксусной кислоты и снова водой.
11. При термическом ожоге охладите пораженное место, для чего поместите его под струю холодной воды. После достаточного охлаждения наложите мазь от ожогов.
12. При сильных ожогах после оказания первой помощи обратитесь к врачу.
13. При попадании раствора любого реактива в глаз немедленно промойте его большим количеством воды (можно водопроводной), после чего сразу же обратитесь к врачу.
14. При отравлении газообразными веществами (сероводородом, хлором, оксидом углерода, парами брома) выйдите (выведите пострадавшего) на свежий воздух, а затем обратитесь к врачу.
15. При ранении стеклом необходимо убедиться в отсутствии в ране стекла, обтереть кожу вокруг ранки ватой, смоченной спиртом, смазать йодом и забинтовать пораненное место.
Техника лабораторных работ и оборудование
Посуда и оборудование
Химические реакции проводят, как правило, в стаканах, пробирках, колбах, на специальных стеклах или пластинах.
Большинство реакций в студенческом практикуме проводят в пробирках (рис. 1). Пробирки могут быть цилиндрическими (1, а) и коническими (1, б), последние применяются также для центрифугирования.
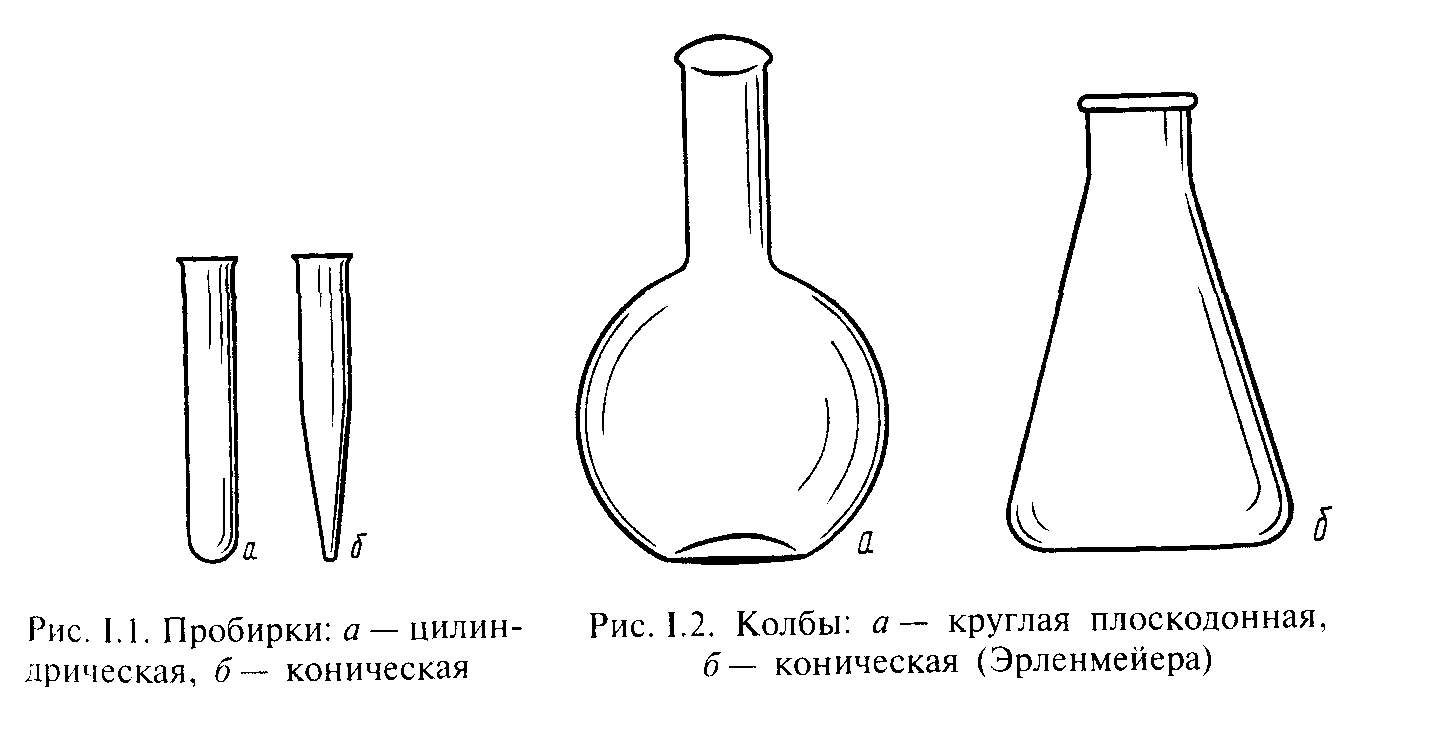

Рис. 1. Пробирки:
а – цилиндрическая, б – коническая
Рис. 2. Колбы: а – круглая плоскодонная,
б – коническая (Эрленмейера)
По объему пробирки разделяют на обычные (10-15 мл) и полумикропробирки (от 2 до 6 мл). Реакции без нагревания можно проводить в плоскодонных колбах (рис. 2).
Реакции с малыми количествами вещества (несколько капель) проводят на часовых (рис. 3, а) или предметных (рис. 3, б) стеклах либо в углублениях специальной пластинки – фарфоровой, стеклянной или пластиковой (рис. 3, в).
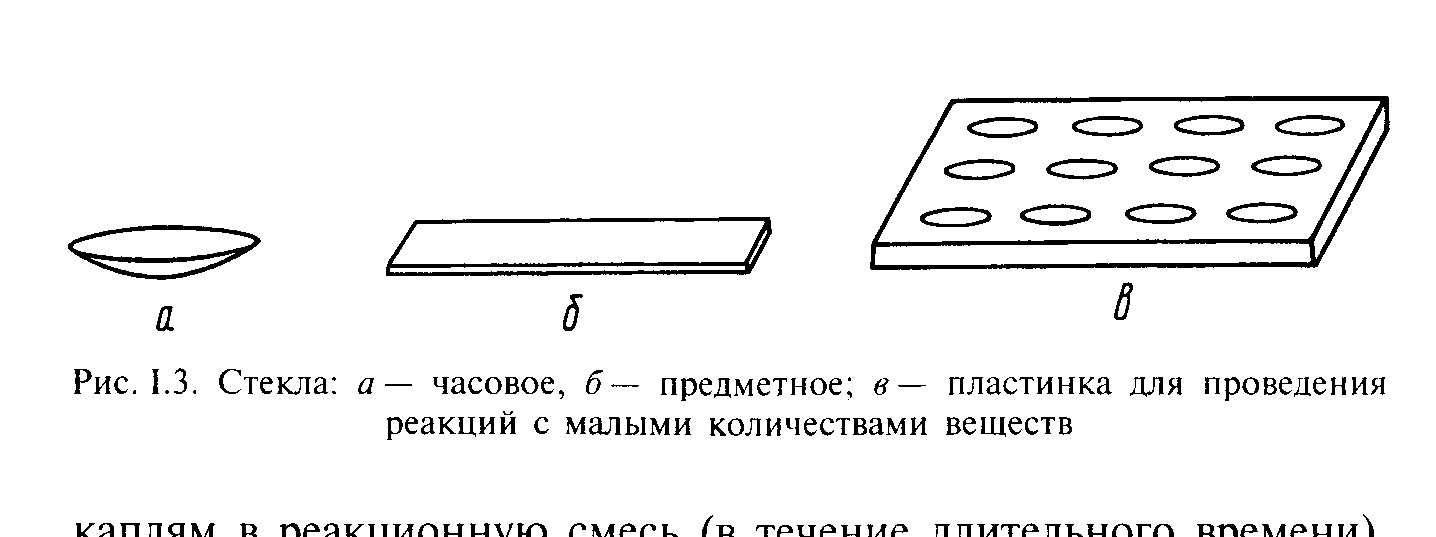
Рис. 3. Стекла: а – часовое, 6 – предметное; в – пластинка для проведения реакций с малыми количествами веществ
Для того, чтобы отобрать или добавить небольшой объем раствора (жидкости), используют пипетки (рис. 4).
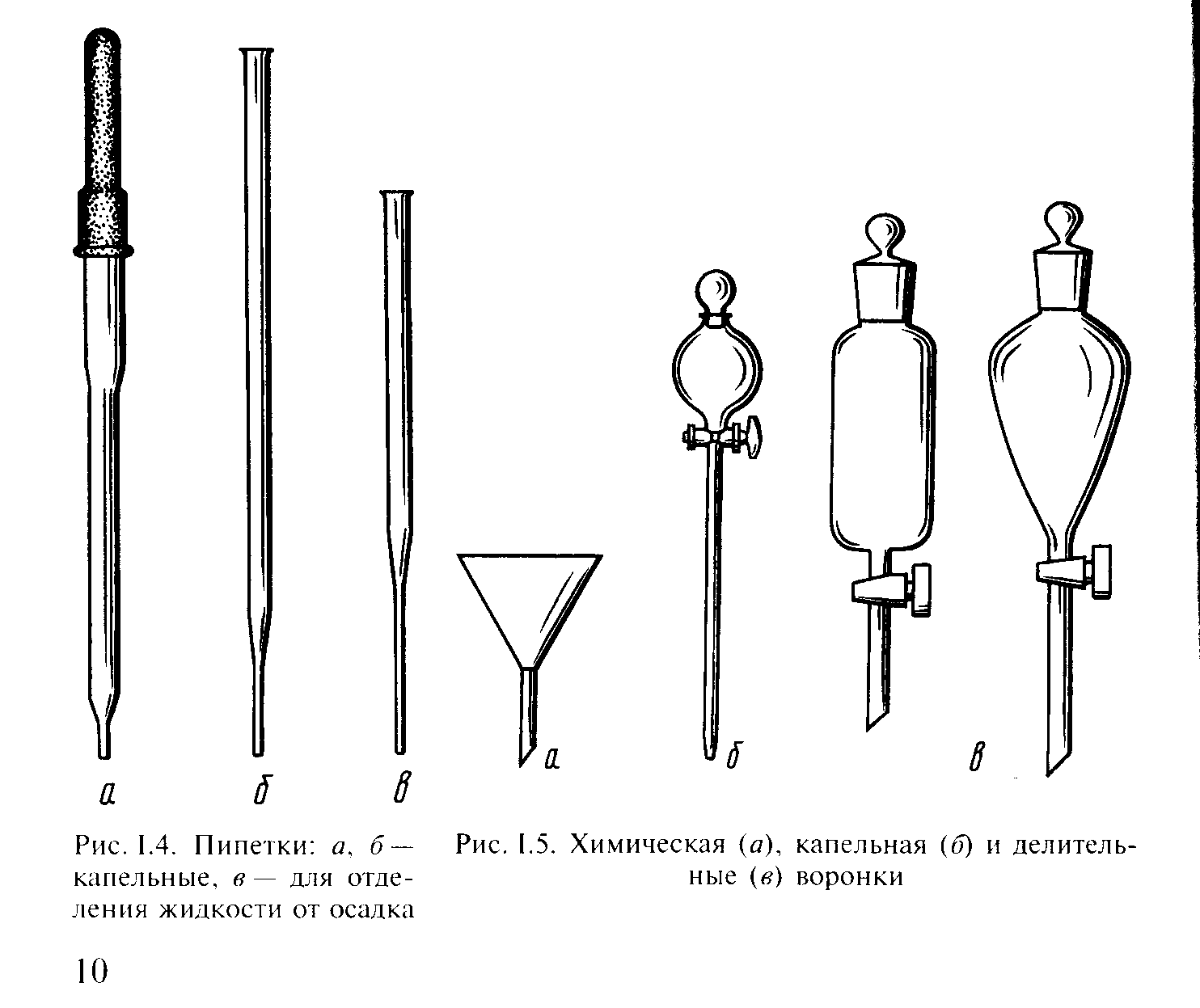
Рис. 4. Пипетки: а, б – капельные, в – для отделения жидкости от осадка
Химическая воронка (рис. 5, а) используется для наливания жидкости в сосуды с узкими горлами. Для насыпания порошков используют воронку с укороченным стеблем. Капельная воронка (рис. 5, б) применяется для прибавления жидкости по каплям в реакционную смесь (в течение длительного времени), делительная – для разделения двух несмешивающихся жидкостей (рис. 5, в).
Рис. 5. Воронки: химическая (а), капельная (б) и делительная (в)

Для получения газов в лаборатории используются различные приборы прерывного действия. В аппарате Киппа газ получают реакцией между жидкостью (например, раствором кислоты) и твердым веществом (мрамор, сульфид железа, цинк). На рисунке 6 показан аппарат Киппа в действии.
Аппарат Киппа состоит из трех резервуаров. Верхний резервуар ( 1) является шарообразной воронкой с длинным сужающимся концом. Резервуар (1) вставлен в средний резервуар (2) на шлифе. Над верхним резервуаром устанавливается предохранительная склянка (7).
Кусочки твердого вещества загружают в средний резервуар через тубус (4). После этого тубус закрывают пробкой, в которую вставлена стеклянная трубка с краном (5) для выхода и регулирования потока получаемого газа. При открытом кране жидкость проходит в нижний резервуар (3), а из него в средний (2). Нижний резервуар также имеет пробку (6), через которую сливают отработанную жидкость. Выделяющийся газ при необходимости пропускают через промывные склянки (8, 9) и собирают в приемник (10).
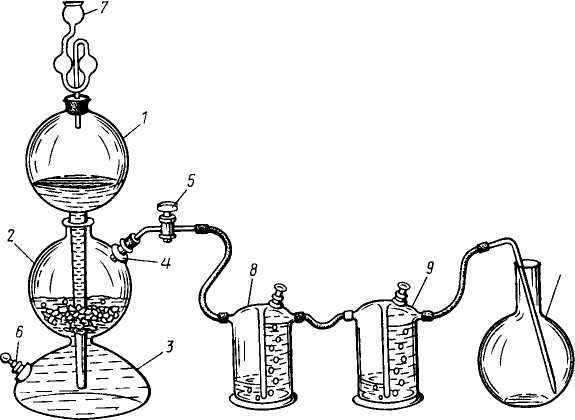
Рис. 6. Прибор (аппарат Киппа).
1, 2, 3 – шарообразные резервуары; 4 – тубус с пробкой и стеклянной трубкой; 5 – кран; 6 – пробка,7 – предохранительная склянка; 8, 9 – промывные склянки; 10 – приемник газа
Для сборки приборов служит металлический универсальный штатив с различными лапками и кольцами (рис. 7).
Рис. 7. Универсальный штатив
Квалификация реактивов
По существующему положению для реактивов установлены квалификации «технический» (т.), «чистый» (ч.), «чистый для анализа» (ч. д. а.), «химически чистый» (х. ч.) и «особо чистый» (ос. ч.), последняя иногда делится на несколько марок. Содержание примесей может различаться для различных реактивов одной квалификации в несколько раз, в зависимости от того, насколько легко поддается очистке и для чего предназначен препарат.
Препараты квалификации «чистый» могут применяться в различных учебных работах, «чистый для анализа» – в аналитических и научно-исследовательских работах, реактивы квалификации «химически чистый» используются для особо ответственных работ. Препараты особой очистки (квалификация ос. ч.) применяются в специальных целях.
Правила работы с химическими реактивами
Сыпучие реактивы из банки (тары) отбирают шпателем (рис. 8, а) или фарфоровой ложкой (рис. 8, б), растворы (жидкости) наливают из склянок либо отбирают прилагаемыми (вставленными в пробку) пипетками.
Рис. 8. Шпатель (а) и фарфоровая ложка (б)
Просыпанный (пролитый) реактив или реактив, по ошибке взятый в избытке, нельзя возвращать обратно в тару. Его следует утилизировать.
Утилизация отходов (остатков) реактивов и нейтрализация полученных в результате экспериментов смесей производится следующим образом: водные растворы неопасных веществ (кислот и оснований малой концентрации) выливают в раковину. Отходы органических растворителей, солей серебра и ртути собирают в вытяжном шкафу в отдельные склянки с соответствующими надписями. Растворы, содержащие аммиак, сероводород, хлор и другие опасные летучие вещества, следует выливать в раковину под тягой. После этого сосуд ополаскивают водой и эту воду тоже выливают в раковину под тягой. Только после этого сосуд можно окончательно вымыть в обычной раковине.
Мытье посуды
Стеклянную посуду считают чистой, если вода не образует отдельных капель на стенках, а стекает равномерной пленкой.
Удалять загрязнения со стенок посуды можно различными методами: механическими, химическими или комбинируя их. К механическим способам можно отнести мытье посуды теплой водой с помощью щеток (ершей) или мытье паром.
Физико-химические методы заключаются в удалении загрязнений с помощью органических растворителей (бензин, ацетон, спирты и др.), поверхностно-активных моющих средств или фосфата натрия.
Химические методы – мытье посуды хромовой смесью, раствором перманганата калия, смесью соляной кислоты и пероксида водорода, концентрированным раствором щелочи или серной кислотой.
Весы и взвешивание.
Взвешиванием называют сравнение массы данного тела с массой гирь.
В зависимости от точности взвешивания весы разделяют на следующие группы:
- технические – для грубого взвешивания (точность до 1 г);
- технические – для точного взвешивания (точность до 0,01 г);
- аналитические – точность 10−4 10−6 г;
- специальные – пробирные, торсионные, электронные.
Технические весы для точного взвешивания, так называемые технохимические весы (рис. 9), состоят из коромысла, на котором укреплены три стальные или агатовые призмы: две на концах, обращенные ребром вверх, и одна посередине, обращенная ребром вниз.
Чашки весов ( 4) посредством серег подвешены на концевые призмы. Для определения состояния равновесия служит длинная стрелка (8) и шкала с делениями (6).
Весы имеют арретир (7), т.е. приспособление, дающее возможность прекращать качания коромысла и связанной с ним стрелки. Арретир приподнимает коромысло и чашки весов, тем самым освобождает призмы от контакта с пластинками. Это предохраняет призмы от преждевременного изнашивания. Неработающие весы всегда должны быть арретированы.
Коромысло (2) своей средней призмой опирается на подушку, укрепленную на центральной колонке весов.
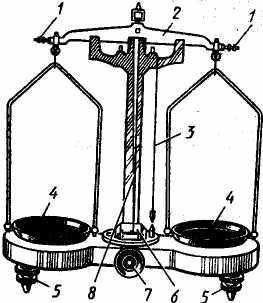
Рис. 9. Технохимические весы:
1 – балансировочные гайки;
2 – коромысла;
3 – отвес;
4 – чашки;
5 – установочные винты;
6 – шкала;
7 – ручка арретира;
8 – стрелка
Для взвешивания на технических весах применяют стограммовый разновес, представляющий собой набор граммовых и миллиграммовых гирь-разновесок, расположенных в определенном порядке в гнездах специального ящика.
Приступая к взвешиванию, нужно убедиться, что весы правильно установлены. Для этого ручку арретира медленно поворачивают вправо и наблюдают за качанием стрелки. Если весы установлены правильно, то стрелка отклоняется от нулевого деления шкалы вправо и влево на одинаковое число делений. Если отклонение от нулевого деления шкалы в одну сторону больше, чем в другую, то весы нужно арретировать и обратиться к лаборанту с просьбой отрегулировать весы. Вещества взвешивают охлажденными до комнатной температуры. Взвешиваемое вещество помещают на левую чашку весов, а на правую – разновески в нисходящем порядке, начиная с самых крупных. Снимать и класть на чашки весов взвешиваемое вещество и разновески следует только при арретированных весах.
При взвешивании рекомендуется использовать специальную посуду: часовые стекла, тигли, бюксы. Когда взвешивание закончено, не снимайте разновески с чашки весов до того, как масса тела будет подсчитана (по пустым гнездам в ящике). Проверьте массу, помещая разновески обратно в ящик.
Если в одной работе нужно сделать несколько взвешиваний, то необходимо пользоваться одними и теми же весами и набором разновесок
Измерение объемов
Для измерения объема жидкости в случаях, не требующих большой точности, используют мензурку и мерный цилиндр (рис. 10).
Для точного измерения объема служат мерные колбы (рис. 11), мерные пипетки (пипетка Мора – рис. 12, а, градуированная пипетка – рис. 12, б) и бюретки (рис. 12, в, г, д). Мерные колбы калиброваны «на вливание», а пипетки на «выливание», т.е. для измерения объема налитой в колбу или вылитой из пипетки жидкости.
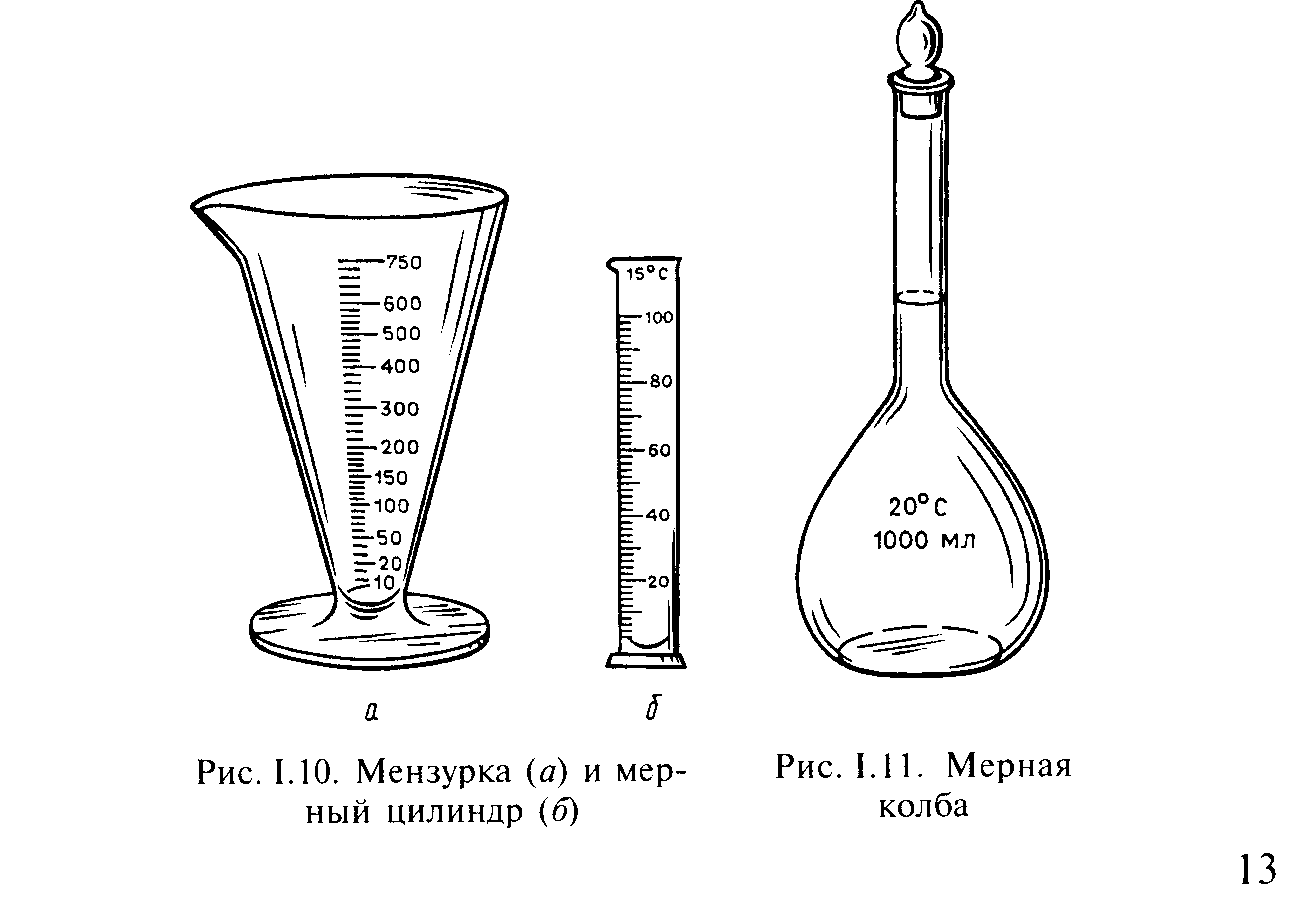

Рис. 10. Мензурка (а) и мерный цилиндр (б) Рис. 11. Мерная колба
Бюретки с краном (рис. 12, г, д) и зажимом (рис. 12, в) служат для точного измерения объема вытекающей жидкости.
На рис. 13 показана бескрановая бюретка. Для сливания жидкости из бюретки со стеклянной бусиной необходимо нажать на бусину так, чтобы она слегка отошла от резиновой трубки. При этом образуется зазор между шлангом и бусиной, в который и протекает жидкость. Если резиновая трубка бюретки перекрыта зажимом, необходимо нажать на концы зажима, ослабляя его (зажим не снимать!). При использовании бюреток для измерения объемов жидкости необходимо следить, чтобы наконечник бюретки был заполнен раствором.
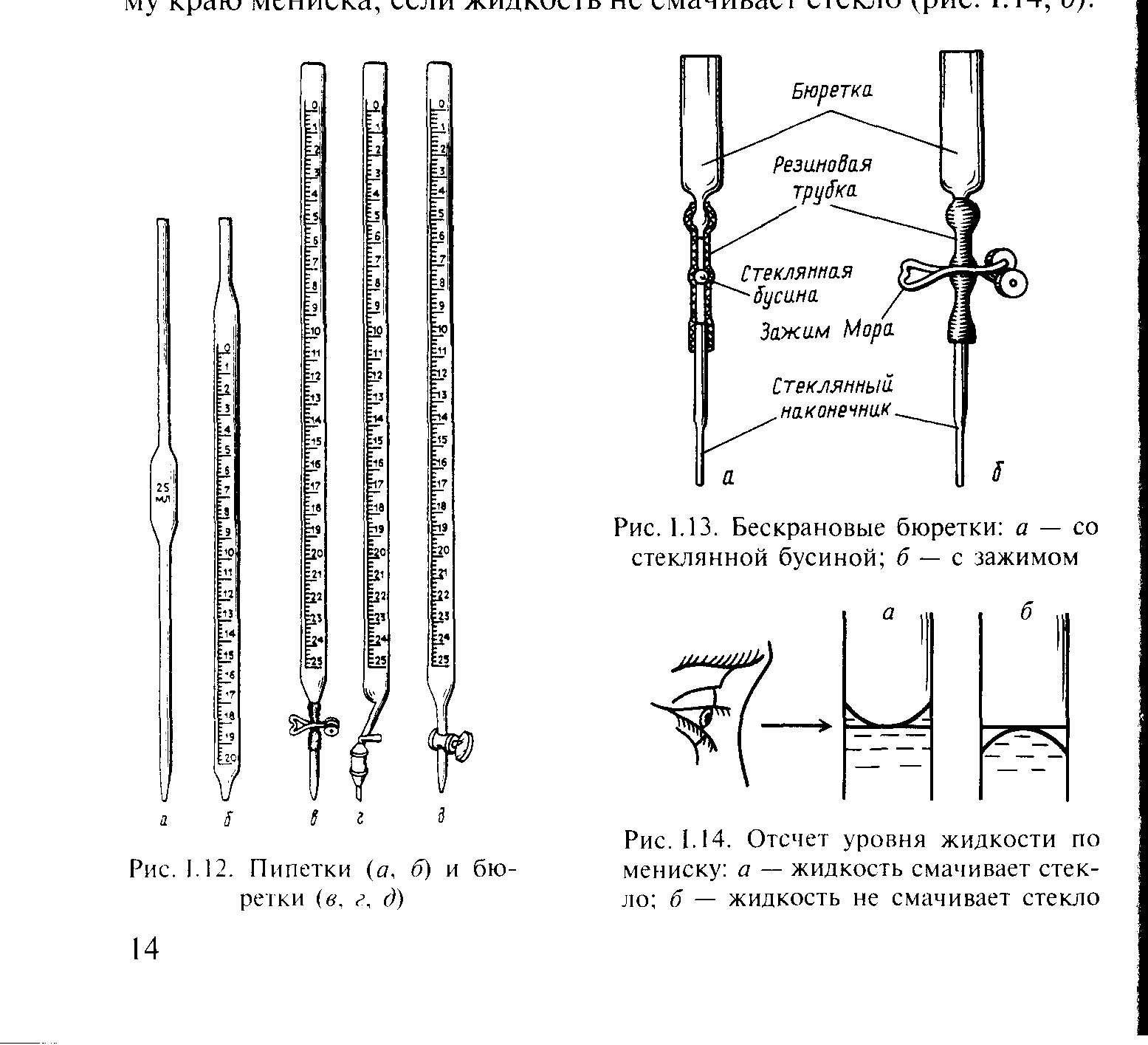

Рис. 12. Пипетки (а, б) и бюретки (в, г, д)
Рис. 13. Бескрановая бюретка
При любых измерениях объемов жидкости отсчет должен производиться таким образом, чтобы глаз находился на одном уровне с краем мениска. Отсчет объема жидкости в сосуде (бюретка, пипетка, мерная колба) производят по нижнему краю мениска, если жидкость смачивает стекло (рис. 14, а) и по верхнему краю мениска, если жидкость не смачивает стекло (рис. 14, б).

Рис. 14. Отсчет уровня жидкости по мениску:
а – жидкость смачивает стекло; б – жидкость не смачивает стекло
Приготовление раствора с точной концентрацией
Для приготовления растворов с точной концентрацией используют только дистиллированную воду. Готовят такие растворы в мерных колбах (рис. 11).
Рассчитанную массу вещества взвешивают на весах в стаканчике или бюксе – стаканчике с притертой пробкой (рис. 15).
Рис. 15. Бюксы: с внутренним (а) и наружным (б) шлифом
В мерную колбу вставляют химическую воронку диаметром 6-10 см (воронка подбирается так, чтобы между ее стеблем и стенками горла колбы оставалось пространство). Вещество переносят в мерную колбу, всыпая его через стеклянную воронку. После перенесения основного количества вещества стаканчик (бюкс) споласкивают небольшим количеством дистиллированной воды и добавляют полученный раствор в колбу. Постепенно добавляя воду и перемешивая жидкость легкими круговыми движениями колбы, добиваются полного растворения вещества.
После полного растворения в колбу добавляют воду, доводя уровень жидкости до метки. Последние порции воды следует прибавлять по каплям из пипетки. Уровень жидкости определяется по нижнему или по верхнему уровню мениска. После этого колбу плотно закрывают пробкой и перемешивают раствор, несколько раз переворачивая колбу вверх дном.
Нагревание
В лаборатории применяют как электрические нагревательные приборы, так и газовые горелки (нагревание открытым пламенем). Для поддержания постоянной температуры в процессе эксперимента используются водяные термостаты (интервал температур от комнатной до 80-90 °С) или песчаные бани (100-300 °С).
Для нагрева используют электрические плитки, печи и сушильные шкафы. Для нагревания жидкостей применяются только плитки с закрытой спиралью. При этом следует использовать термостойкую посуду. Растворы (или другие жидкости) можно также нагревать на электрических водяных банях (сосуд с водой, подогреваемый с помощью электричества). Для более равномерного прогревания жидкости рекомендуется вращать сосуд. Жидкости в сосуде при нагревании должно быть не более половины его объема.
Для прокаливания, плавки и других операций при высоких температурах используют электрические печи (трубчатые или муфельные).
Для упаривания растворов или просушивания твердых веществ применяют специальную фарфоровую посуду: тигель или выпарительную чашу (рис. 16). Фарфоровая посуда для этих операций обязательно должна быть тонкостенной.
При работе с открытым пламенем нагревать посуду желательно через огнезащитную сетку (рис. 17), которую кладут на кольцо штатива или треногу. Пламя горелки при этом не касается сосуда и нагревание получается более равномерным.
Нагревание открытым пламенем – более быстрый, но более опасный способ нагревания. Посуда прогревается неравномерно, потому возможно растрескивание сосуда. Нагревание открытым пламенем газовой или спиртовой горелки возможно только для круглодонных колб и пробирок. Остальные сосуды использовать нежелательно. При нагревании пробирку зажимают пробиркодержателем (рис. 18), колбу – за горло специальной лапкой, или закрепляют в штативе (рис. 7).
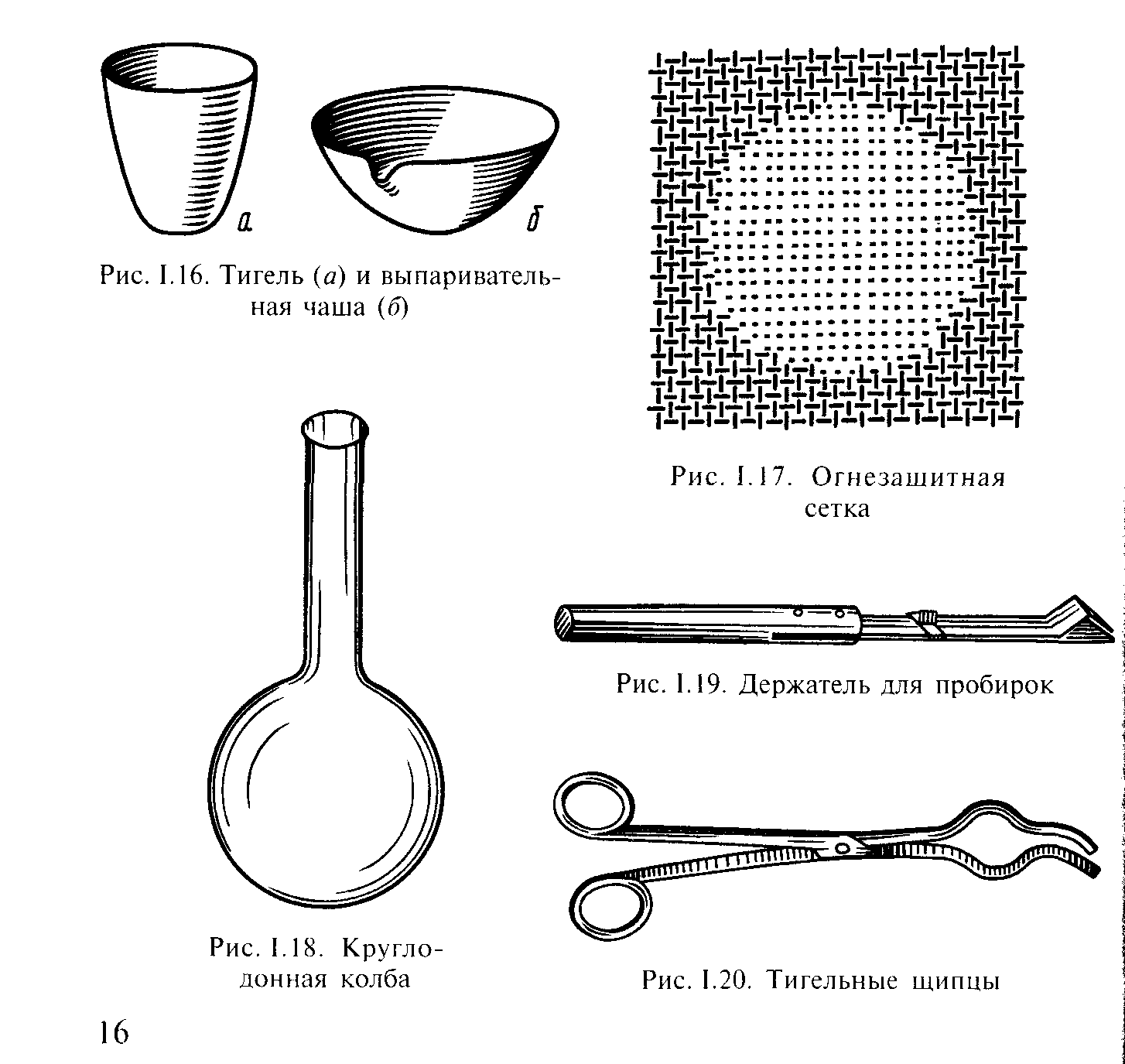
Рис. 16. Тигель (а) и выпарительная чаша (б) Рис. 17. Огнезащитная сетка
Для перемещения горячих выпарительных чаш и тиглей используют тигельные щипцы (рис. 19).


Рис. 18. Держатель для пробирок Рис. 19. Тигельные щипцы
Измельчение вещества
Измельчение твердых материалов можно производить вручную в ступках (рис. 20) или механически в мельницах.
Ступки могут быть изготовлены из различных материалов: латунные, фарфоровые и агатовые. В ступках измельчают небольшие количества веществ, причем объем вещества не должен превышать трети объема ступки. Вначале осторожными ударами пестика измельчают крупные куски вещества, доводя их до размеров горошины, затем медленно растирают круговыми движениями, не очень сильно прижимая пестик к стенкам ступки. По мере измельчения вещества скорость движения пестика можно увеличить. Во время измельчения вещество периодически собирают пестиком или шпателем со стенок к центру ступки.
Рис. 20. Ступка с пестиком
Полученный порошок (измельченный до нужной степени) пересыпают в заранее подготовленную посуду или сразу же используют. При измельчении пылящих веществ работу следует проводить в вытяжном шкафу.
Фильтрование
Суть фильтрования состоит в том, что жидкость с находящимися в ней частицами твердого вещества пропускают через пористую перегородку (фильтр). Поры фильтра столь малы, что жидкость (фильтрат) через них проходит, а частицы твердого вещества задерживаются. Таким образом, осадок собирается на фильтре, а жидкость – в сосуде (рис. 21).
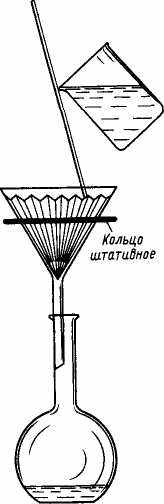
Рис. 21. Фильтрование
При фильтровании воронку с фильтром закрепляют в кольце штатива. Перед началом процесса фильтр смачивают чистым растворителем (водой). Край фильтра не должен доходить до края воронки примерно на 0,5 см. Фильтрование ускоряется, если в стебле воронки находится жидкость.
В зависимости от целей разделения жидкости и осадка применяют различные фильтры. Общее требование: материал фильтра не должен реагировать с жидкостью или осадком.
Фильтры могут быть бумажными (складываются из фильтровальной бумаги), стеклянными или фарфоровыми (пористая стеклянная или фарфоровая пластина), сыпучими (слой хорошо очищенного кварцевого песка), тканевыми или из стекловаты (или обычной ваты) и др.
Один из широко распространенных материалов для фильтров – фильтровальная бумага. Она отличается от обычной бумаги тем, что не проклеена, более чистая и волокнистая. Фильтровальную бумагу заранее можно нарезать кругами различного диаметра. Плотность (пористость) фильтровальной бумаги определяется по цвету бумажной ленты, которой оклеена пачка готовых фильтров.
Черная (розовая) лента – быстрофильтрующие с большими порами фильтры; белая лента – фильтры со средним размером пор; синяя лента – плотные фильтры, предназначенные для фильтрования мелкозернистых осадков.
Собираемая жидкость (фильтрат) может после фильтрования остаться мутной. В этом случае ее следует профильтровать повторно, используя фильтр с более мелкими порами.
Простой фильтр обычно употребляют в случаях, когда отделяют крупнокристаллический осадок. Для приготовления такого фильтра бумагу складывают вчетверо, как показано на рис. 22, затем обрезают и вкладывают в воронку.
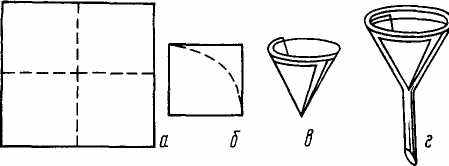
Рис. 22. Изготовление простого фильтра: Рис. 23. Складчатый (плоёный) фильтр
а-в – стадии изготовления; г – фильтр помешен в воронку
Складчатый (плоёный) фильтр (рис. 23) обладает большей площадью поверхности, поэтому фильтрование на нем идет быстрее.
Если фильтрование следует провести быстро, в приемнике создают пониженное давление. В качестве приемника можно использовать колбу Бунзена (рис. 24). Установка для фильтрования при пониженном давлении, изображенная на рис. 24, состоит из фарфоровой воронки Бюхнера (1), колбы Бунзена (2), предохранительной склянки (на рисунке не показана) и вакуумного насоса (3).
В фарфоровую воронку Бюхнера помещают два круглых бумажных фильтра, смачивают их водой и проверяют, хорошо ли они прилегают к стенкам воронки. Если фильтры прилегают хорошо, то при включенном насосе звук ровный, если плохо, то звук неровный, свистящий. Края неплотно прилегающего фильтра прижимают пальцем. После этого, не выключая насоса, в воронку наливают до ½ ее высоты фильтрующуюся жидкость. В приемнике создается разреженное давление, и фильтрат проходит в приемник. Жидкость добавляют по мере ее расходования.
Осадок можно отмыть от жидкости, в которой он находился, непосредственно на фильтре. Для этого, не дожидаясь полного окончания фильтрования, на осадок наливают промывную жидкость, взмучивают его и жидкость отсасывают. При необходимости процедуру промывания повторяют.
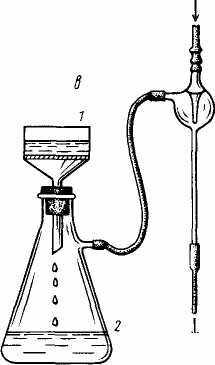
Рис. 24. Установка для фильтрования при пониженном давлении
(пояснение в тексте)
Центрифугирование
Помимо фильтрования разделение жидкости и осадка возможно путем центрифугирования.
При быстром вращении ротора центрифуги (рис. 25) взвешенные в жидкости твердые частицы под действием центробежной силы отбрасываются от центра и таким путем отделяются от жидкости. После этого жидкость можно просто слить (декантировать) с осадка. Центрифугирование целесообразно применять для малых количеств осадков, а также, если они плохо отделяются от жидкости.
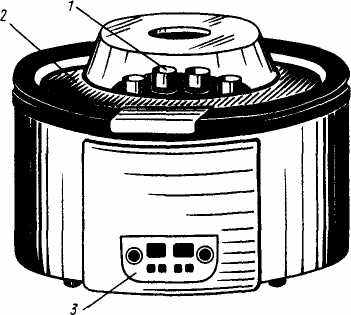
Рис. 25. Общий вид центрифуги:
1 – гнезда для пробирок, 2 – крышка; 3 – панель управления
В гнезда центрифуги жидкость с осадком помещают в специальные конические пробирки. При этом пробирки устанавливают пáрами в диаметрально противоположные гнезда. Если необходимо отцентрифугировать смесь только в одной пробирке, напротив нее устанавливается пробирка с примерно равным объемом воды.
Очистка газов
В тех случаях, когда необходима очистка газа, его пропускают через вещество, помещенное в специальную склянку. Очищающий агент может быть либо жидким, либо твердым веществом. Иногда жидкими агентами смачивают куски твердого носителя (стекло, фарфор, пемза), помещаемые в склянку.
Существуют специальные промывные, т.е. заполняемые жидкостью склянки – Дрекселя, Тищенко, Вульфа; колба Бунзена и обычная склянка с пробкой, в которую вставлены две трубки (рис. 26).
Во всех вышеописанных промывных склянках (кроме склянки Тищенко) есть общий недостаток: если давление в приборе падает, жидкость из склянки может быть переброшена в прибор. Особенно часто это случается при получении газа в процессе нагревания. Для предотвращения попадания промывной жидкости в реакционный сосуд перед промывной склянкой следует поставить пустую склянку.
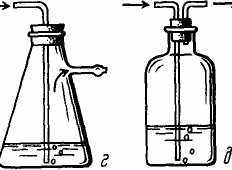
Рис. 26. Промывные склянки: а – Дрекселя; б – Тищенко для жидких (слева) и твердых веществ; в – Вульфа; г – Бунзена; д – обычная склянка
Для хорошей очистки газ должен идти через промывную склянку не слишком быстро, чтобы можно было считать проходящие через жидкость пузырьки.
Часто для осушения (а иногда для очистки) газа используют измельченные твердые вещества. Их помещают в трубки или склянки. При прохождении через твердое вещество газу не приходится преодолевать большое давление, поэтому его ток получается более ровным, а высушивается он, как правило, лучше, чем при пропускании через жидкость. Чтобы увеличить толщину слоя твердого вещества, применяют осушительные склянки значительной длины. Например, можно использовать специальные колонки для осушения газов или U-образные трубки. Можно также использовать модифицированную для твердых веществ склянку Тищенко (рис. 26, б, справа).
Рекомендации по составлению письменного отчета о лабораторной работе
После выполнения каждого опыта все наблюдения и результаты необходимо занести в лабораторный журнал чернилами. Записи должны быть аккуратными, с широкими интервалами между строчками и с полями.
Отчет по лабораторной работе должен содержать следующие сведения:
- дату выполнения работы;
- номер работы и ее название;
- цель работы;
- задание;
- теоретическое введение (основные закономерности, уравнения реакций, предварительные расчеты, выбор метода);
- экспериментальную часть (рисунок или схему прибора, реактивы, посуду, краткое описание хода работы с указанием качественных признаков реакции: изменение цвета раствора; выпадение осадка или его растворение; выделение газа, его цвет и запах; нагревание или охлаждение системы и др.; вопросы техники безопасности; уравнения всех протекающих реакций);
- результаты измерений (таблицы, графики);
- расчеты, если работа носит количественный характер; оценку погрешности результатов;
- обсуждение полученных результатов (сравнение с теоретически ожидаемыми величинами, зависимостями, закономерностями; сравнение с литературными данными);
- выводы (необходимо вспомнить, что было целью эксперимента, осмыслить полученные результаты опытов и использовать их для выводов).
На обложке или на первой странице лабораторного журнала должны быть написаны фамилия студента, инициалы, номер группы.
Лабораторная работа 1. ОПРЕДЕЛЕНИЕ МОЛЕКУЛЯРНОЙ МАССЫ УГЛЕКИСЛОГО ГАЗА
Цель работы – освоение методов определения молекулярной массы газообразного вещества на примере углекислого газа (диоксида углерода).
Массы атомов и молекул очень малы (~ 10‾24 г), непосредственное их измерение в лабораторных условиях провести невозможно. На практике атомную или молекулярную массу выражают в атомных единицах массы. Атомная единица массы (а.е.м.) равна 1/12 массы атома изотопа углерода 12C. В системе СИ ее значение составляет 1,66056∙10‾27 кг. Атомные или молекулярные массы, выраженные в а. е. м., называют соответственно относительными атомными или молекулярными массами и записывают без указания размерности, как, например, в периодической системе элементов.
В химических расчетах в качестве основной единицы количества вещества используют моль. Моль – количество вещества системы, содержащее столько же структурных единиц (атомов, молекул, ионов, электронов, радикалов и т. д.), сколько содержится атомов в углероде-12 (12C) массой 0,012 кг. Число структурных единиц, содержащихся в 1 моль любого вещества, называется числом Авогадро. Его значение (NA) составляет 6,02∙1023 частиц/моль.
Масса 1 моль вещества – молярная масса, выраженная в граммах (г/моль), численно равна его относительной атомной или молекулярной массе. Количество вещества (n) можно найти по формуле: n=m/M, где m – масса вещества (г), М – молярная масса вещества (г/моль).
Если значение молярной массы разделить на число частиц, составляющих 1 моль вещества, то получается масса одной молекулы данного вещества. Моль любого газообразного вещества при нормальных условиях (р0 = 101325 Па, То = 273 К) занимает объем 22,4 л. Этот объем называется молярным объемом (Vm) газа при нормальных условиях.
Определение молекулярной массы вещества основано на нахождении его молярной массы, числовые значения которых, как было отмечено выше, совпадают. Определение молярной массы газа может быть выполнено несколькими способами. Чаще всего ее находят, исходя из абсолютной и относительной плотности газов.
Абсолютной плотностью газа ρ называется масса единицы объема газа при нормальных условиях; за единицу объема газа обычно принимают 1 л. Зная массу 1 л газа при нормальных условиях ρ и его молярный объем 22,4 л, определяют молярную массу газа М:
М = 22,4 ρ
Для приведения объема газа к нормальным условиям используют уравнение состояния идеального газа:
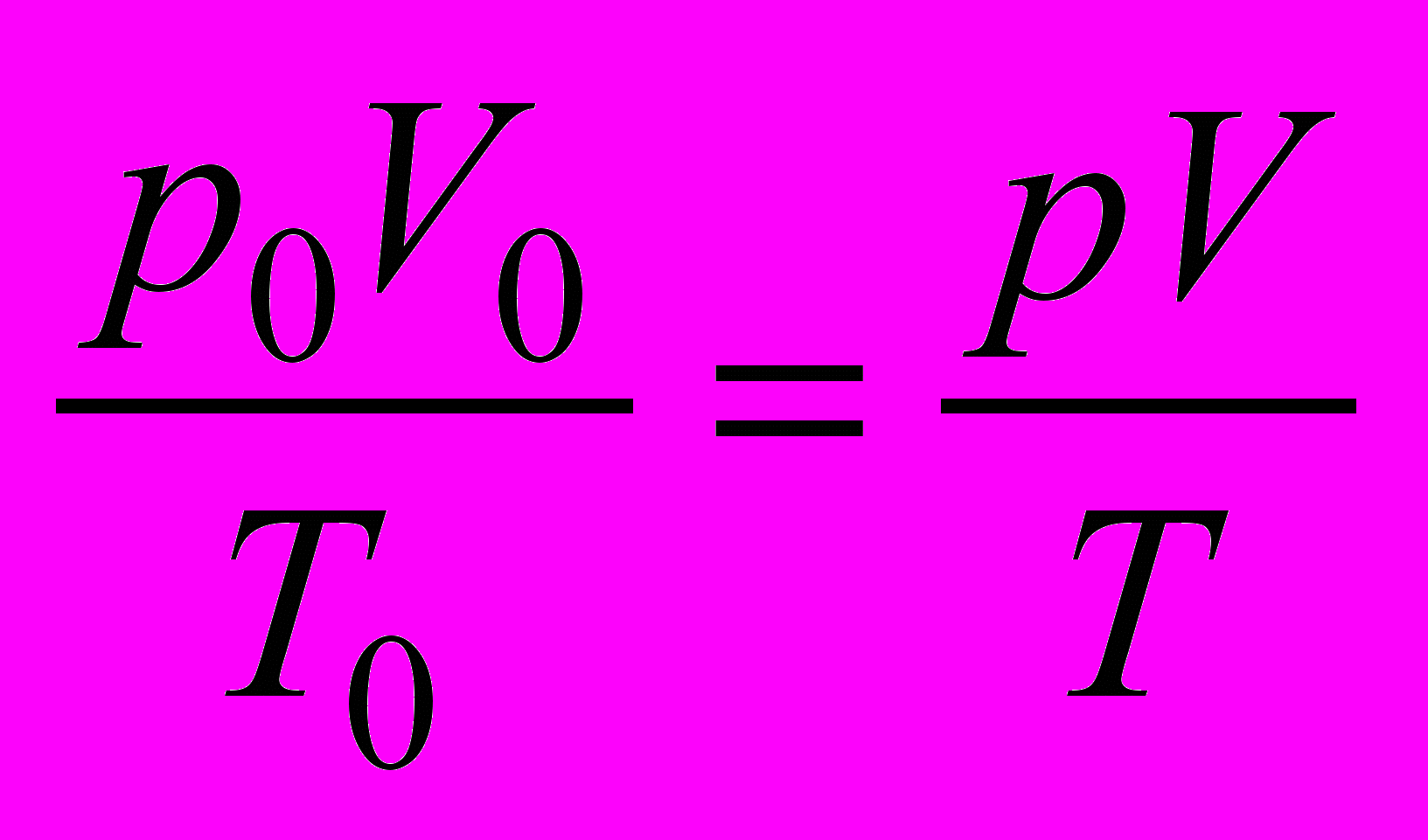 или
или 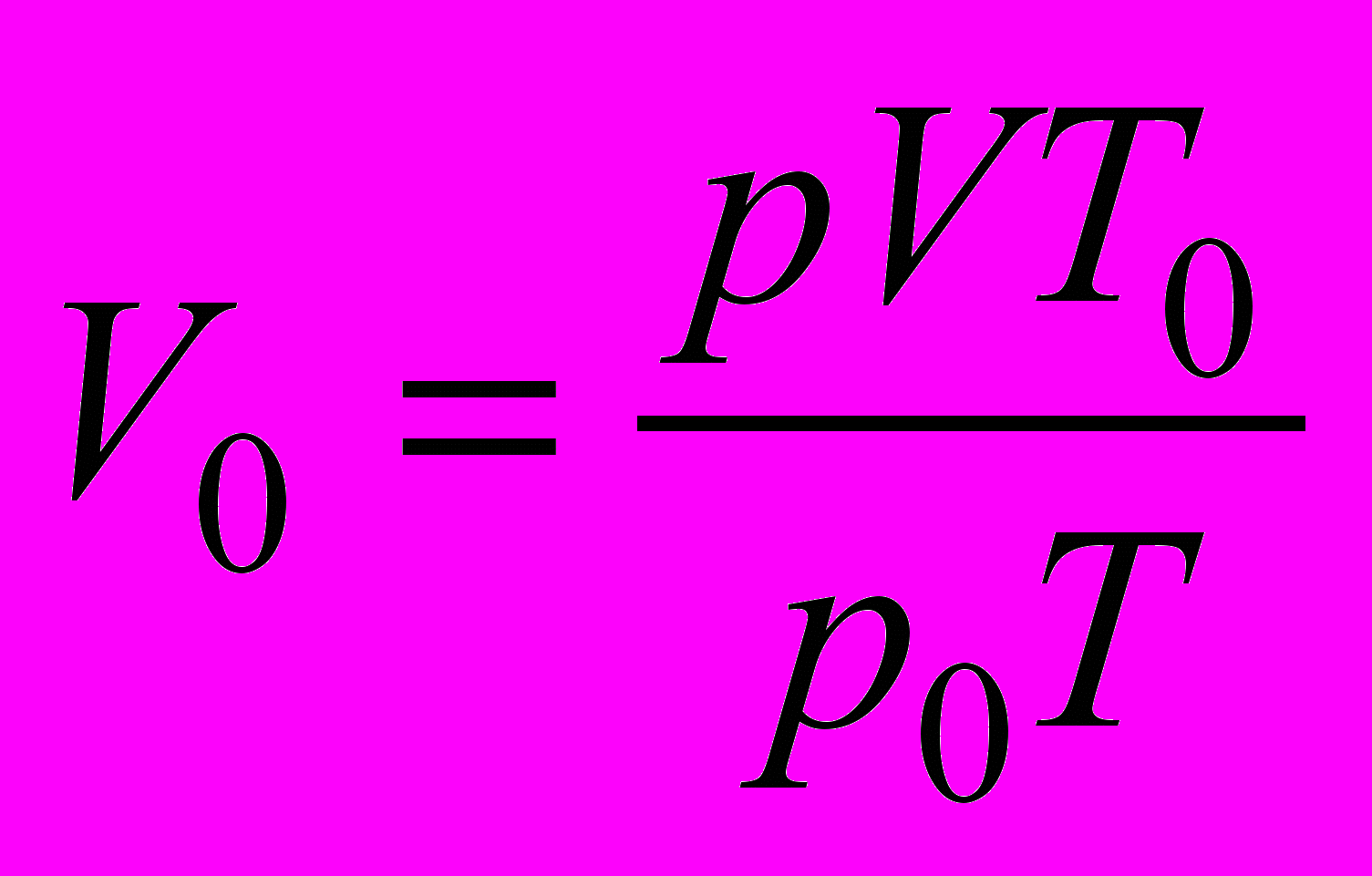 ,
, где V – объем газа, измеренный при реальных условиях, т. е. при атмосферном давлении р и температуре Т; V0 – объем газа при нормальных условиях (ро, То).
Относительной плотностью D первого газа по второму называют отношение плотностей этих газов:
D = ρ1/ρ2,
где ρ1 – абсолютная плотность первого газа, г/л; ρ2 – абсолютная плотность второго газа, г/л.
Отношение плотностей можно заменить отношением масс газов, содержащихся в равных объемах при одинаковой температуре:
D = ρ1/ρ2 = m1/m2,
где m1 – масса первого газа; т2 – масса второго газа.
Известно, что равные объемы двух газов, взятых при одинаковых условиях, содержат одинаковое число молекул (закон Авогадро). Следовательно, их массы относятся друг к другу как их молярные массы:
m1/m2 = M1/М2
Так как m1/m2 – плотность первого газа по второму, то
D = M1/М2, отсюда M1 = М2∙D.
Молярную массу газа можно вычислить также, пользуясь уравнением Клапейрона-Менделеева:
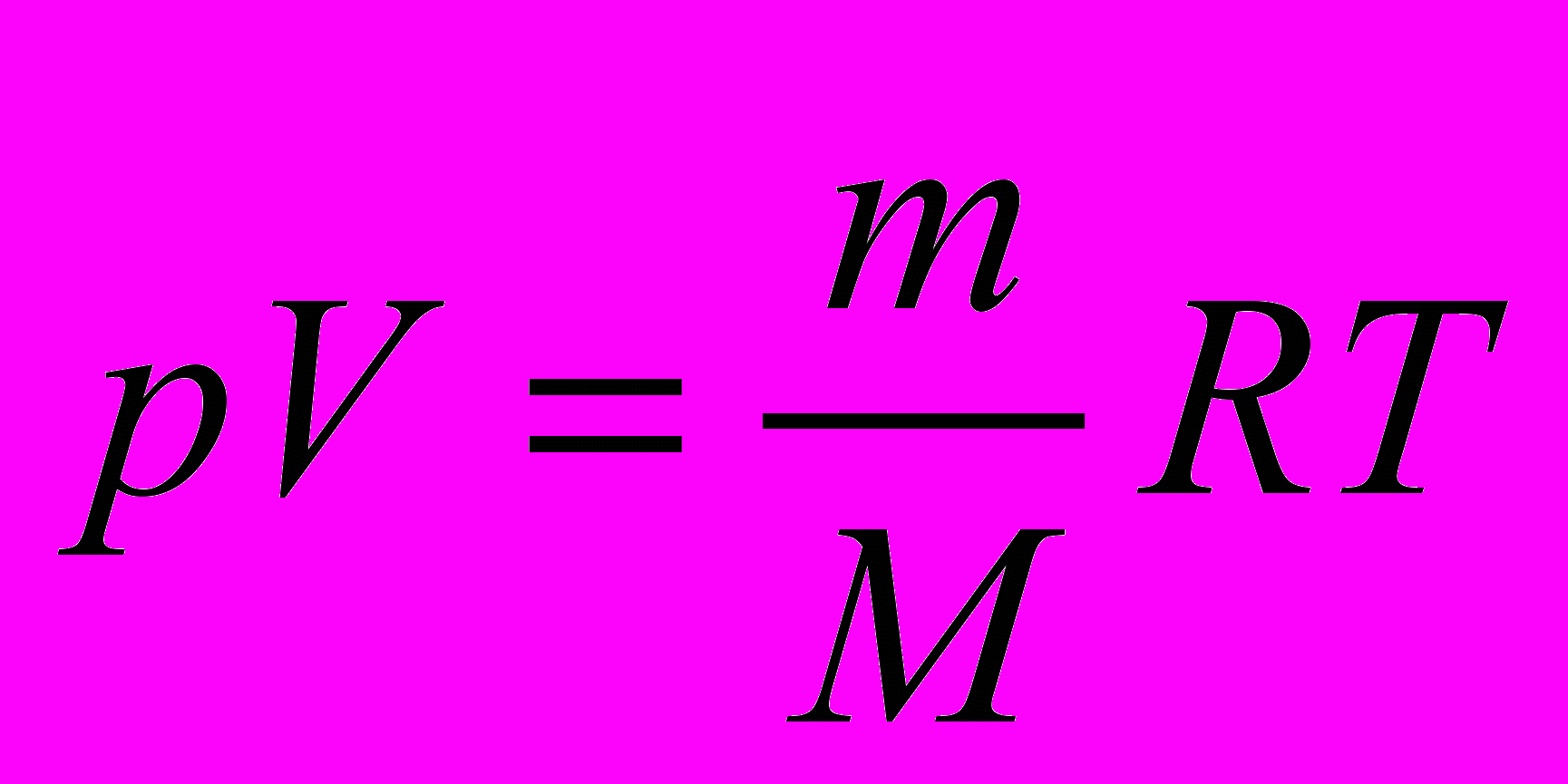 или
или 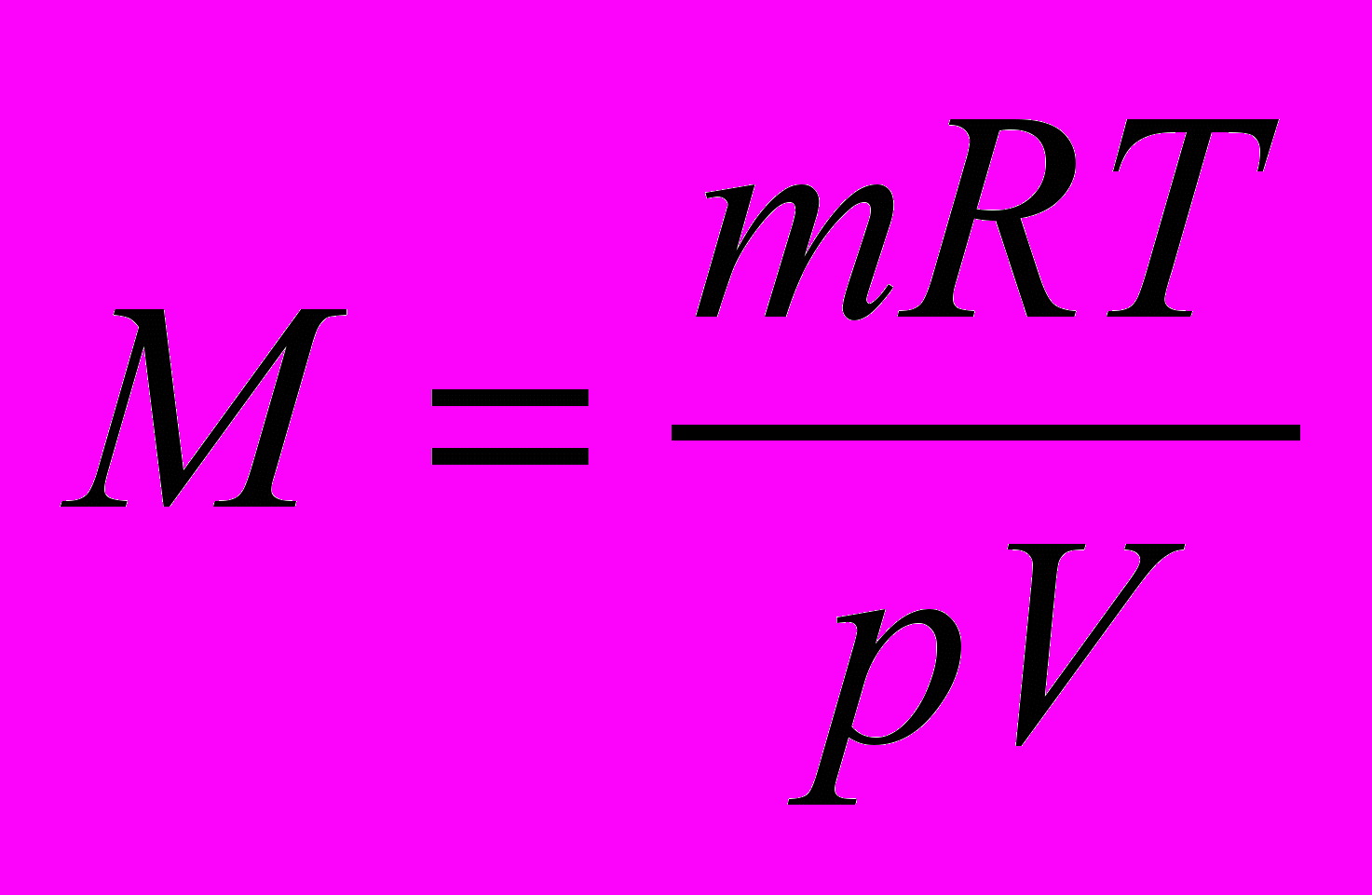 ,
,где р – давление, Па; V – объем, м3; m – масса, кг; М – молярная масса, г/моль; Т – абсолютная температура, К; R – универсальная газовая постоянная, равная 8,314 Дж/(моль∙К) Универсальная газовая постоянная в зависимости от выбора единиц измерения давления и объема может иметь различные числовые значения. Какие?
Приборы и реактивы. Весы технохимические и разновес. Мерный цилиндр на 500 мл. Аппарат Киппа с двумя промывными склянками. Колба вместимостью 250-500 мл с пробкой. Термометр. Барометр. Карандаш восковой. Мрамор. Растворы: хлороводородной кислоты (плотность 1,19 г/см3), серной кислоты (плотность 1,84 г/см3), вода.
Выполнение работы. Сухую колбу плотно закройте пробкой и отметьте восковым карандашом уровень, до которого пробка вошла в горло колбы. Взвесьте колбу с пробкой на технохимических весах с точностью до 0,01 г (m1).
Наполните колбу 10 углекислым газом из аппарата Киппа, которым пользуются для получения непрерывного тока газа в химических лабораториях (рис. 1.).
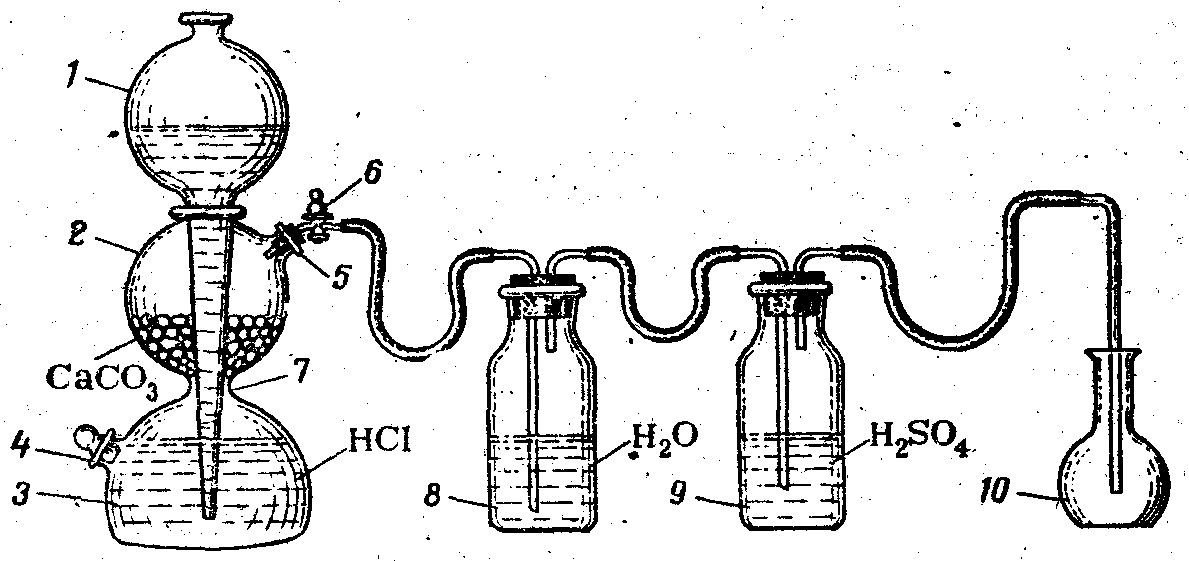
Рис.1. Установка для получения и очистки диоксида углерода, состоящая из аппарата Киппа, промывных склянок и приемника СО2:
1 – шарообразная воронка; 2, 3 – соединенные между собой резервуары; 4, 5 – тубусы; 6 – кран; 7 – перетяжка, 8, 9 –промывные склянки; 10 – приемник СО2.
Аппарат Киппа состоит из двух частей: нижней, представляющей собой два соединенных между собой резервуара 2 и 3, и верхней – шарообразной воронки 1, удлиненный конец которой доходит почти до дна резервуара 3. В верхней части резервуара 2 имеется тубус 5, который закрыт пробкой с газоотводной трубкой, имеющей кран 6. В нижнем резервуаре 3 также имеется тубус 4, служащий для выливания жидкости из прибора. Чтобы зарядить аппарат, в резервуар 2 насыпают через тубус 5 твердое вещество. Размер кусочков твердого вещества должен быть таким, чтобы вещество не попадало в резервуар 3 через щель. Затем тубус 5 закрывают пробкой с газоотводной трубкой. Кран 6 открывают и в прибор через воронку сверху наливают кислоту в таком количестве, чтобы твердое вещество в резервуаре 2 было ею покрыто (слишком много жидкости наливать не следует). Начинается реакция между кислотой и твердым веществом, сопровождающаяся выделением, газа.
Кран 6 закрывают, и, если прибор герметичен, кислота вытесняется из среднего шара 2 под давлением выделяющегося в процессе реакции газа. Как только вся жидкость будет вытеснена из шара 2 в резервуары 3 и 1, реакция прекращается, и газ перестает выделяться.
Для возобновления выделения газа вновь открывают кран 6, жидкость при этом поднимается в средний резервуар 2, приходит в соприкосновение с твердым веществом, и аппарат начинает работать. По окончание работы кран 6 снова закрывают.
Для получения углекислого газа в резервуар 2 помещают мрамор СаСОз, а через воронку 1 наливают хлороводородную кислоту. (Почему в данном случае нельзя пользоваться серной кислотой?) Углекислый газ необходимо пропустить через две промывные склянки (см. рис. 1), одна из которых 8 наполнена водой, чтобы очистить газ от примеси хлористого водорода, а другая 9 – концентрированной серной кислотой для осушки газа. (Запишите уравнения реакций, протекающих в аппарате Киппа и промывных склянках.)
При наполнении колбы газ следует пропускать медленно, чтобы можно было считать пузырьки в промывных склянках. После заполнения колбы углекислым газом (через 3-4 мин. проба горящей лучиной), не закрывая крана у аппарата Киппа, медленно выньте газоотводную трубку из колбы и тотчас закройте колбу пробкой. Не нагревайте колбу руками, для чего при закрывании пробкой держите колбу пальцами за горлышко на весу в вертикальном положении. (Зачем необходима эта предосторожность?)
Взвесьте колбу с диоксидом углерода на тех же весах и с той же точностью, что и колбу с воздухом (m2).
Произведите контрольный опыт. В ту же колбу дополнительно пропускайте газ в течение 3 мин. и снова взвесьте колбу. Если воздух из колбы был полностью вытеснен диоксидом углерода, то результаты первого и второго взвешивания не должны расходиться более чем на 0,01 г. (В противном случае опыт следует полностью повторить.)
Определите рабочий объем колбы (V), для чего наполните колбу дистиллированной водой до черты на горлышке колбы и измерьте объем воды, вылив ее в мерный цилиндр.
Запишите в журнал атмосферное давление р (по показанию барометра) и температуру Т (температуру помещения), при которых производился опыт.
Запись данных опыта и расчеты. Данные опыта запишите в следующем виде:
| Масса колбы с пробкой и воздухом m1, г | | |
| Масса колбы с пробкой и диоксидом углерода т2, г | | |
| Объем газа, равный объёму воды в колбе V, мл | | |
| Температура | Т, °C | |
| абсолютная температура Т, К | | |
| Атмосферное давление | р, мм рт. ст. | |
| р, Па | | |
По полученным данным рассчитайте:
1. Объем газа в колбе при нормальных условиях (V0):
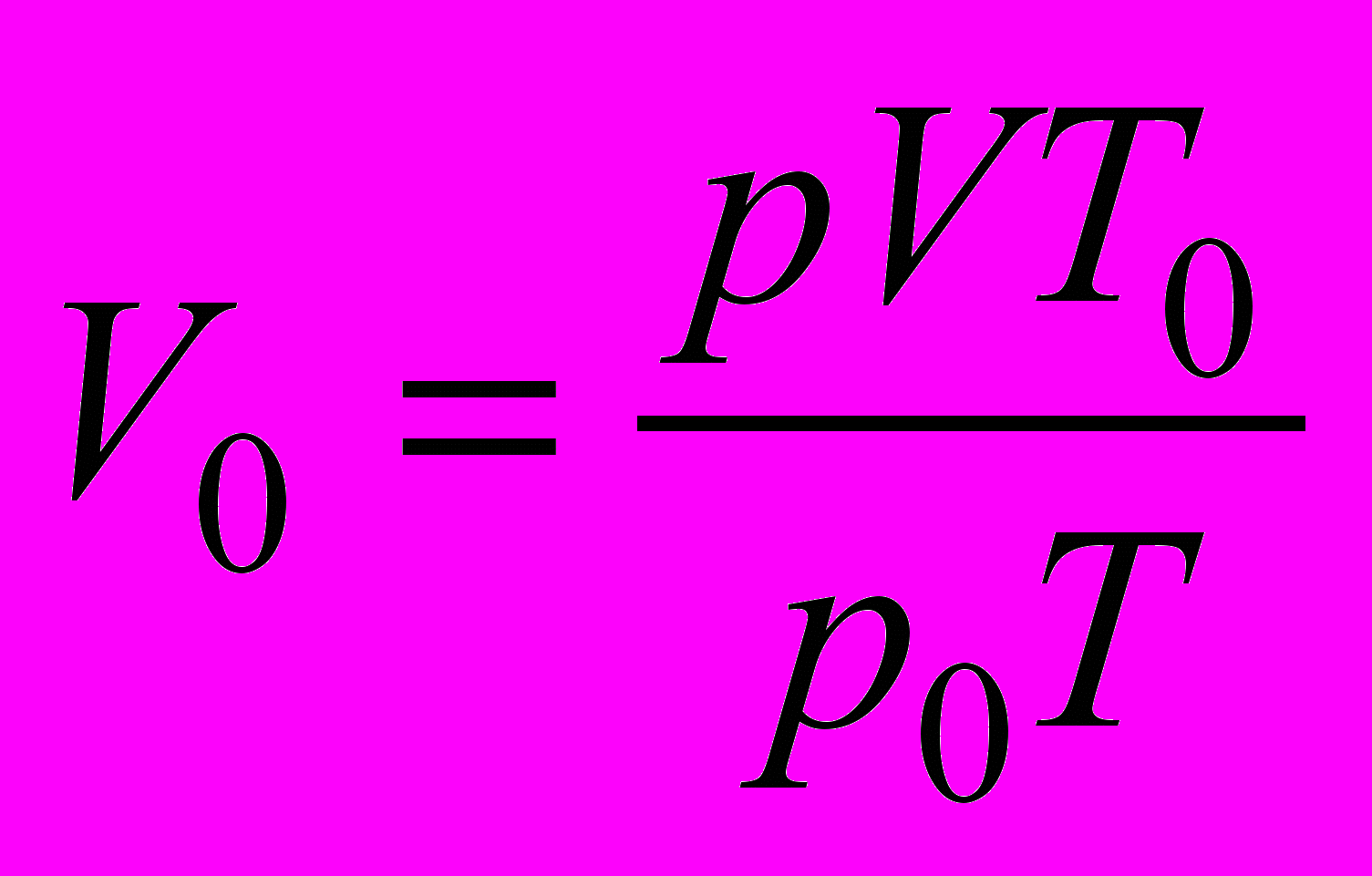
2. Массу воздуха (т3) в объеме сосуда, зная, что масса 1 л воздуха при нормальных условиях (ρв) равна 1,293 г: т3 = ρв∙V0
3. Массу пустой колбы с пробкой (т4): т4 = m1 – m3.
4. Массу диоксида углерода в объеме сосуда (т5): т5 = m2 – m4..
5. Абсолютную плотность СО2 (ρ
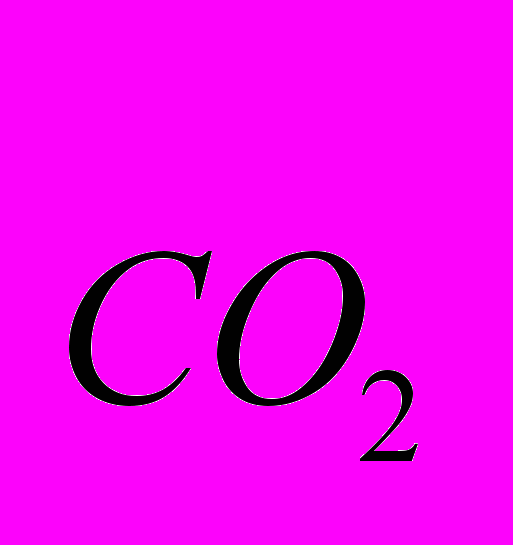 ), т. е. массу 1 л СО2 при н.у.: ρ
), т. е. массу 1 л СО2 при н.у.: ρ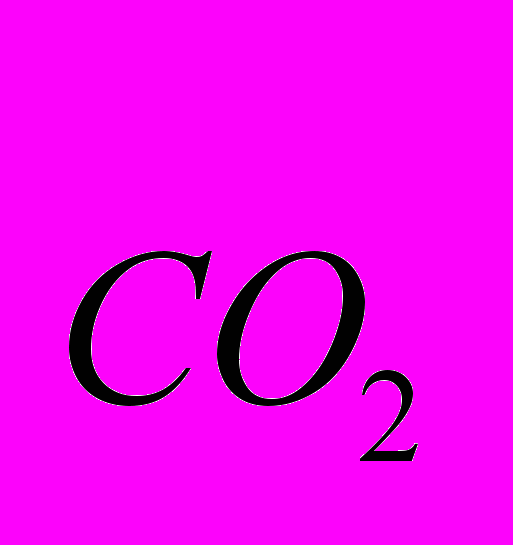 = т5/V0
= т5/V06. Относительную плотность СО2 по воздуху (Dв), зная, что молярная масса воздуха равна 29 г/моль: Dв = т5/m3
7. Молярную массу диоксида углерода:
а) по абсолютной плотности: М1 = 22,4∙ρ
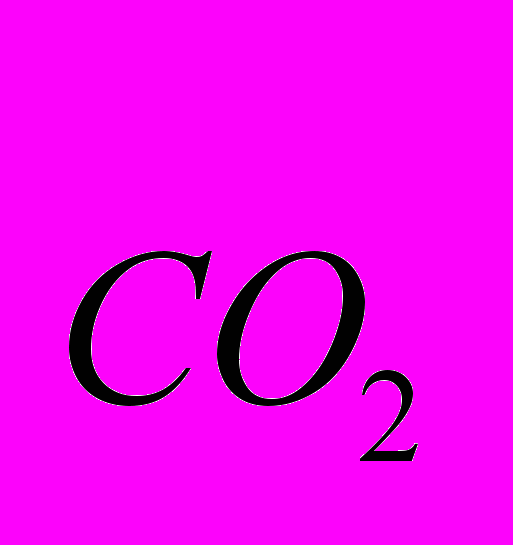 ;
;б) по относительной плотности: М2 = 29∙Dв;
в) по уравнению Клапейpoнa-Менделеева:
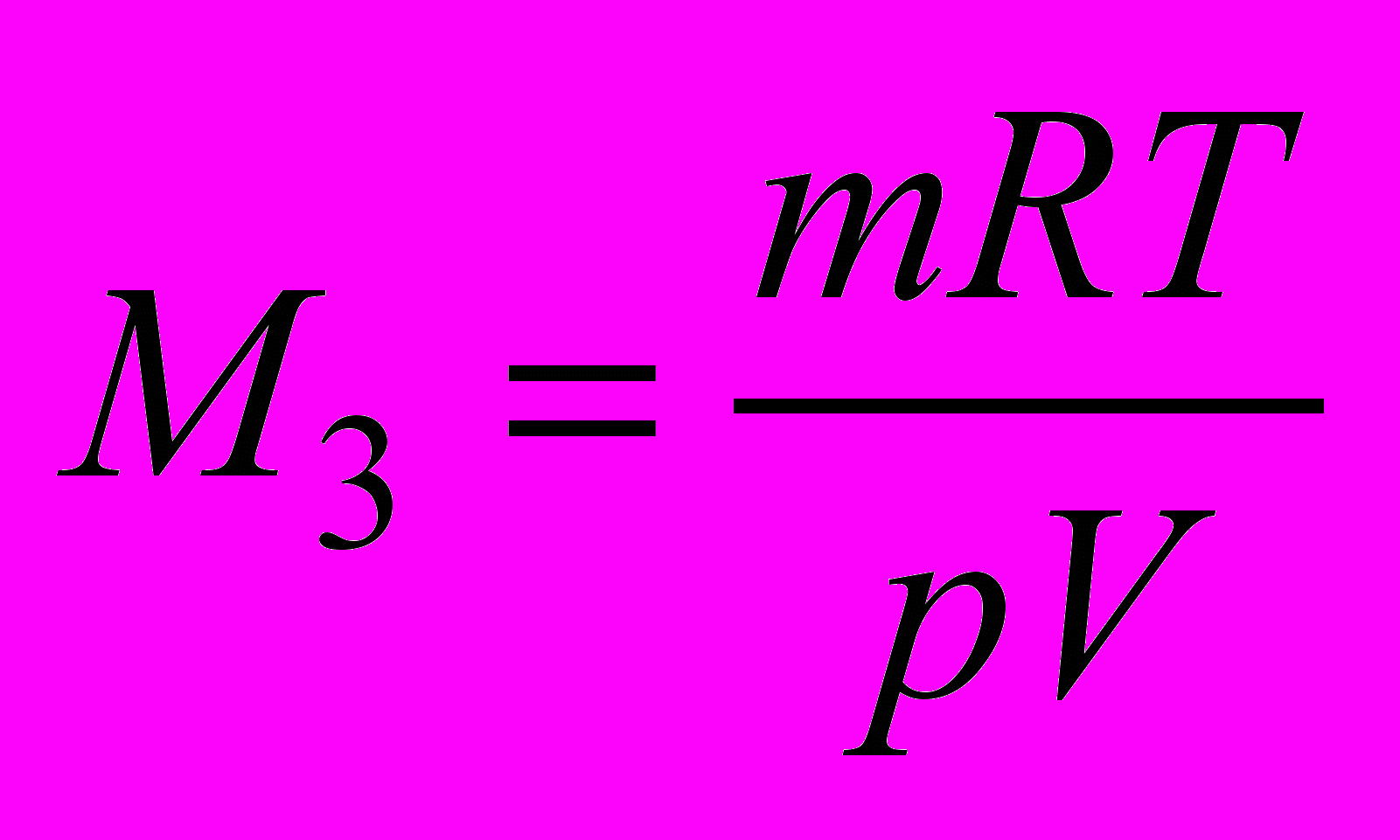 .
.По полученным значениям Мi рассчитайте среднее значение: Моп.(среднее) = ( М1 + М2 + М3)/3.
8. Погрешность опыта – абсолютную и относительную:
а) Абсолютная погрешность опыта (ΔМ) при определении молярной массы вещества представляет собой разность между истинной молярной массой (Мис.т), определяемой по периодической системе элементов, и полученной опытным путем (Моп):
ΔМ = |Мис.т – Моп|.
6) Относительная погрешность равна отношению абсолютной погрешности к истинной молярной массе и выражается в процентах:
ε, % = (ΔМ./Мис.т) ×100%
Вопросы и задания к лабораторной работе 1
1. Для осушки газов применяются следующие вещества: гидроксид натрия, серная кислота, хлорид кальция, оксид кальция. Какие из этих веществ можно использовать для осушки: а) диоксида углерода; б) аммиака; в) азота; г) кислорода; д) сероводорода? Ответ мотивируйте.
2. Что тяжелее: сухой углекислый газ или равный объем этого газа, содержащий водяные пары (при одинаковых условиях)?
3. Что называют абсолютной и относительной плотностью газа?
4. Вычислите значение универсальной газовой постоянной (R) в:
 .
.5. Масса колбы с воздухом равна 63,872 г. После замещения воздуха газом масса колбы оказалась равной 64,182 г. Вместимость колбы 470 мл, температура. 15 °С, давление 102,66 кПа. Рассчитайте относительную плотность газа по воздуху и его молярную массу.
Ответ: 1,53; 44,2 г/моль.
6. Масса 1 л газа при 21 °С и 96,26 кПа равна 2,52 г. Рассчитайте относительную плотность газа по водороду и его молярную массу. Ответ: 32; 64 г/моль.
