Томский государственный университет
| Вид материала | Практикум |
- Информатизация в музеях в контексте проблем музейного производства. Кпостановке вопросов,, 38.11kb.
- Образование и наука в третьем, 1269.55kb.
- Личностно-профессиональное становление в условиях вузовского образования: акмеориентированный, 743.02kb.
- Экономическая ситуация требует глубокого изучения теории и практики и необходимость, 39.83kb.
- Оформите, оплатите и вышлите в Томский политехнический университет на дискете или, 86.19kb.
- Томский Государственный Университет Систем Управления и Радиоэлектроники (тусур) Томский, 19.19kb.
- Учебное пособие томск 2003 Томский государственный университет систем управления, 2466.49kb.
- Томский Государственный Университет Систем Управления и Радиоэлектроники (тусур) Томский, 87.68kb.
- Утверждаю, 90.9kb.
- Министерство образования Российской Федерации Томский Государственный Университет Систем, 2141.57kb.
После выполнения лабораторной работы
Вы должны знать:
– наиболее характерные степени окисления кислорода и серы, их аллотропные модификации и полиморфные превращения серы;
– равновесия, которые устанавливаются в водных растворах сероводородной, сернистой, серной кислот и процессы, определяющие рН растворов солей этих кислот;
– изменение окислительно-восстановительных свойства соединений серы при изменении ее степени окисления от –2 до +6, примеры соединений, которые являются а) только восстановителями, б) только окислителями, в) окислителями и восстановителями;
– сульфиды металлов, растворимые в воде; нерастворимые в воде, но растворимые в соляной или только в азотной кислотах,
– различия в окислительных свойствах концентрированной и разбавленной серной кислоты;
– что представляют собой тиосоли и какие степени окисления имеет сера в тиосульфате натрия.
и уметь:
– кратко охарактеризовать физические свойства кислорода и серы и их соединений, их биологическую роль;
– приводить примеры реакций, илюстрирющих кислотно-основные и окислительно-восстановительные свойства водородных и кислородных соединений серы
Лабораторная работа 6. р- ЭЛЕМЕНТЫ VA ГРУППЫ (АЗОТ, ФОСФОР) И ИХ СОЕДИНЕНИЯ
Цель работы – изучение свойств простых веществ азота и фосфора и их соединений.
Электронная конфигурация внешнего электронного слоя атомов элементов VA группы – ns2np3. Азот в своих соединениях проявляет степени окисления от –3 до +5. Для всех остальных элементов VA группы наиболее характерными степенями окисления являются +3 и +5.
Азот, в качестве простого вещества N2 представляет собой газ (Ткип = – 195,8 °С), без цвета и запаха, плохо растворимый в воде. Водородное соединение азота – аммиак NH3 – бесцветный газ (Ткип = – 33,4 °С) с характерным запахом, очень хорошо растворим в воде. Аммиак обладает восстановительными свойствами.
В лабораторных условиях аммиак получают нагреванием смеси твердых хлорида аммония и гидроксида кальция:
2NH4Cl + Ca(OH)2 → CaCl2 + 2H2O + 2NH3↑
Доказательством выделения аммиака является «белый дым» хлорида аммония, который образуется при его взаимодействии с хлороводородом:
NH3 (газ) + HCl (газ) → NH4Cl (тв.).
Водные растворы аммиака имеют щелочную реакцию в результате установления равновесий:
NH3 + H2O ⇄ NH3×H2O ⇄ NH4OH ⇄ NH4+ + OH‾
Фенолфталеин в растворах аммиака окрашивается в малиновый цвет.
Восстановительные свойства аммиака проявляются при его взаимодействии с галогенами (хлорной, бромной или йодной водой) и перманганатом калия:
2NH3 + 3Br2 = N2 + 6HBr.
2NH3 + 2KMnO4 = N2 + 2MnO2 + 2КOH + 2Н2О.
Азот образует ряд оксидов N2O, NO, N2O3, NO2 (N2O4), два из них – N2O3 и N2O5 являются кислотными.
Оксид азота(I) N2O – бесцветный газ со слабым запахом, плохо растворимый в воде, является сильным окислителем. Оксид азота(I) получают термическим разложением нитрата аммония:
250°С
NH4NO3 → N2O + 2H2O
В атмосфере N2O горят лучина, сера и красный фосфор:
С + N2O → ; S + N2O → ; P + N2O → .
Оксид азота(II) NO – бесцветный газ, плохо растворимый в воде, на воздухе практически мгновенно окисляется до NО2. Оксид азота(II) получают при взаимодействии меди с ~30 %-ным раствором азотной кислоты:
Cu + HNO3 → Cu(NO3)2 + NO + H2O
Оксид азота(III) (азотистый ангидрид) N2O3 – жидкость голубого цвета, устойчивая при температурах ниже –10 °С; при низких температурах взаимодействует с водой с образованием слабой азотистой кислоты HNO2.
Азотистая кислота HNO2 неустойчива, существует при низкой температуре только в растворе. В водном растворе азотистой кислоты при низких температурах устанавливается равновесие:
N2О3 + H2O ⇄ НNО2 ⇄ H+ + NО2‾,
вследствие которого ее раствор окрашивается в голубой цвет, присущий оксиду азота(III). При повышении температуры азотистая кислота и оксид азота(III) диспропорционируют:
2HNO2 → HNO3 + 2NO + Н2О; N2O3 → NO + NO2.
Получают азотистую кислоту вытеснением из растворов солей (нитритов) разбавленной серной кислотой (при Т < 4 °С):
2NaNO2 + H2SO4(paзб.) = Na2SO4 + 2HNO2.
Соли азотистой кислоты – нитриты – более устойчивы термически и могут быть выделены в свободном состоянии.
Азотистая кислота и нитриты проявляют свойства как восстановителей, так и окислителей:
2HNO2 + 2KI + 2H2SO4 = 2KHSO4 + I2 + 2NO + 2H2O;
3NaNO2 + K2Cr2O7 + 5H2SO4 = 3KNO3 + Cr2(SO4)3 + 2KHSO4 + 4H2O.
Оксид азота(IV) NO2 – бурый легкосжижающийся газ (Tкип = 21,2 °С), растворяется в воде с образованием двух кислот:
2NO2 + H2O = HNO3 + HNO2
В степени окисления +5 азот входит в состав азотной кислоты – HNO3. Концентрированная азотная кислота окисляет большинство металлов и некоторые неметаллы. При нагревании красного фосфора с концентрированной азотной кислотой образуется ортофосфорная кислота:
Р + HNO3 (конц.) → H3РO4 + NO2 + H2O
Сера окисляется концентрированной азотной кислотой до Н2SO4::
S + HNO3 (конц.) → H2SO4 + NO2 + H2O.
Доказательством существования фосфат-ионов служит реакция, в результате которой образуется ярко-желтый осадок (NH4)3[PMo12]. Присутствие сульфат-иона обнаруживается по реакции:
H2SO4 + ВаС12 = BaSO4↓ + 2HC1.
Так как в продуктах восстановления азотной кислоты всегда присутствует NO2, его отделяют пропусканием продуктов реакции через раствор щелочи:
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O.
Для сравнения окислительной способности концентрированной и разбавленной азотной кислоты используется стандартная реакция с KI:
HNO3 (конц.) + KI → I2 + NO2 + H2O.
HNO3 (разб.) + KI →
Фосфор образует несколько полиморфных модификаций: белый, красный и черный фосфор. Наиболее термодинамически устойчивой полиморфной модификацией является черный фосфор. За стандартное состояние фосфора принимается модификация – белый фосфор.
Белый фосфор состоит из молекул Р4. Это прозрачное, химически очень активное вещество, которое загорается на воздухе даже при незначительном нагревании. Красный фосфор имеет полимерное строение и вид мелких кристаллов красно-фиолетового цвета. По сравнению с белым красный фосфор химически более инертен. Черный фосфор в лабораторной практике не используется.
Одно из важнейших соединений фосфора – ортофосфорная (чаще называемая просто фосфорной) кислота Н3РО4. Это слабая трехосновная кислота (константы диссоциации Н3РО4 приведены в табл. 3 Приложения). При замещении одного, двух или трех протонов ортофосфорная кислота образует соответственно дигидрофосфаты, гидрофосфаты и фосфаты. Из ортофосфатов и гидрофосфатов растворимы только производные щелочных металлов и аммония. Дигидрофосфаты всех металлов и аммония растворимы в воде.
Растворимые ортофосфаты и в меньшей степени гидрофосфаты подвергаются гидролизу:
РО43‾ + Н2О → НРО42‾ + ОН‾
вследствие чего их растворы имеют щелочную среду.
Растворы дигидрофосфатов щелочных металлов имеют кислую среду, так как их рН определяется не только процессом гидролиза аниона Н2РО4‾, но и процессом диссоциации образующейся ортофосфорной кислоты Н3РО4:
Н3РО4 ⇄ Н2РО4‾ + Н+.
Фосфаты щелочноземельных металлов растворимы в кислотах. При действии на них сильных кислот образуется ортофосфорная кислота:
М3(РО4)2 + 6НС1 = ЗМС12 + ЗН3РО4.
При действии слабых кислот образуются растворимые дигидрофосфаты:
М3(РО4)2 + 2СН3СООН = 2М(СН3СОО)2 + М(Н2РО4)2.
Сурьма и висмут. Из соединений сурьмы(III) и висмута наибольший интерес представляют гидроксиды и растворимые галогениды.
Гидроксиды сурьмы(III) и висмута(III) в лабораторных условиях получают при взаимодействии их растворимых солей с раствором щелочи.
Sb(OH)3 обладает амфотерными свойствами и растворяется в избытке щелочи:
Sb(OH)3 + 3NaOH~ = Na3[Sb(OH)6]
и в кислотах:
Sb(OH)3 + 3HC1 = SbCl3 + ЗН2О.
Гидроксид висмута(III) проявляет основные свойства и растворяется только в кислотах:
Bi(OH)3 + 3HNO3 = Bi(NO3)3 + ЗН2О.
Гидролиз галогенидов сурьмы(III) и висмута(III) протекает с образованием осадков оксогалогенидов – продуктов разложения основных солей:
МС13 + 2Н2О = M(OH)2CI + 2HC1
M(OH)2 CI → MOCI↓ + H2O
(М – Sb3+ или Bi3+). Эти соли плохо растворимы в воде, но растворяются в кислотах.
Под действием сильных окислителей соединения висмута в степени окисления +3 проявляют восстановительные свойства:
Bi(NO3)3 + 6NaOH + Br2 = NaBiO3 + 2NaBr + 3NaNO3 + 3H2O.
Соединения висмута(V) являются очень сильными окислителями:
5NaBiO3 + 2Mn(NO3)2+ 14HNO3 = 5Bi(NO3)3 + 2NaMnO4 + 3NaNO3 + 7H2O.
Экспериментальная часть
Реактивы
Твердые вещества: Сu (стружка); NaCl; NH4C1; Ca(OH)2; NaNO2; KI; S; Р(кр).
Растворы: насыщенные растворы NH4C1, NaNO2; 1 моль/л растворы HC1, H2SO4; NaNO2; 0,01 моль/л растворы KMnO4, K2Cr2О7, HNO3; 25 %-ный раствор NH3; 10 %-ный NaOH; HNO3(1:1).
Оборудование
Штатив с пробирками; фарфоровая чашечка; колба; промывная склянка; воронка; четыре цилиндра; ложечки для сжигания; пробирка с пробкой и газоотводной трубкой; кристаллизатор; штативы; газовая горелка; рН-метр; лакмусовая бумага; лучинка; ступка с пестиком.
Азот
Опыт 1. Получение азота
1.1. Восстановление нитрата калия железом. В сухую пробирку до 1/8 ее объема насыпать порошкообразного железа и внести 2-3 микрошпателя нитрата калия. Смесь перемешать стеклянной палочкой. Пробирку закрыть пробкой с газоотводной трубкой и закрепить в штативе.
Другую пробирку заполнить водой, закрыть отверстие пальцем и, перевернув вверх дном, поместить в кристаллизатор с водой. Открывая под водой пробирку, следить за тем, чтобы вода из нее не выливалась и в нее не проник воздух.
Смесь в первой пробирке слегка нагреть. Когда начнется энергичное выделение газа, газоотводную трубку опустить в кристаллизатор и подвести под пробирку, заполненную водой. Наполнить пробирку газом, убрать газоотводную трубку из воды и прекратить нагревание. Закрыв под водой трубку большим пальцем, вынуть ее из кристаллизатора и перевернуть вверх дном.
В пробирку с азотом внести тонкую горящую лучинку. Что наблюдается при этом? Почему?
1.2. Разложение нитрита аммония. В пробирку внести по ~1 мл насыщенных растворов хлорида аммония и нитрита калия. Закрыть пробирку пробкой с газоотводной трубкой и укрепить вертикально в штативе. Слегка подогреть пламенем горелки. Выделяющийся газ собирать так же, как в опыте 1.1.
Вопросы и задания
 О
О пишите наблюдения.
пишите наблюдения. - Напишите уравнения реакций: а) взаимодействия железа с нитратом калия, учитывая, что продуктами реакции являются оксид железа(III), оксид калия и азот; б) взаимодействия хлорида аммония с нитритом калия в две стадии, учитывая, что получающийся на первой стадии нитрит аммония – непрочное соединение и разлагается на азот и воду.
- Разобрать последнюю реакцию как окислительно-восстановительную, указать в ней окислитель и восстановитель.
Опыт 2. Получение и свойства аммиака
Опыт проводится под тягой!
Поместите в фарфоровый тигелек по 2-3 микрошпателя соли аммония {NH4C1 или (NH4)2SO4} и гашеной извести Са(ОН)2. Стеклянной палочкой тщательно перемешайте смесь и небольшое ее количество поместите в сухую пробирку (на 1/3 ее объема). Отметьте запах аммиака. Пробирку закройте пробкой с газоотводной трубкой и, закрепив пробирку в наклонном положении, как показано на рис. 1.6, слегка нагрейте ее пламенем горелки. Через некоторое время поднесите к концу газоотводной трубки смоченную дистиллированной водой лакмусовую бумажку и по посинению последней убедитесь в том, что аммиак выделяется. У отверстия газоотводной трубки подержите стеклянную палочку, смоченную концентрированной соляной кислотой. Что наблюдается?
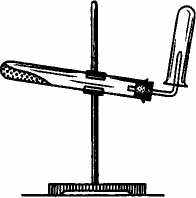
Соберите выделяющийся аммиак в пустую сухую пробирку, удерживая ее над газоотводной трубкой вверх дном. Не переворачивая, закройте пробирку пробкой со стеклянной трубкой, причем длинный конец трубки должен оказаться внутри пробирки.
Возьмите стакан с дистиллированной водой, добавьте в воду несколько капель фенолфталеина. Сохраняя положение пробирки вверх дном, опустите конец стеклянной трубки в стакан с водой. Что наблюдается? Объясните почему. Рис. 1.6. Прибор для получения аммиака
Вопросы и задания
 1
1 . Опишите наблюдения и объясните их.
. Опишите наблюдения и объясните их. 2. Напишите уравнения реакций: а) получения аммиака; б) взаимодействия аммиака с водой; в) взаимодействия аммиака с хлороводородом.
3. Почему вода из стакана заполняет пробирку с аммиаком, которая находится выше?
- В какой цвет окрашивается фенолфталеин в растворе аммиака? О чем это свидетельствует?
Опыт 3. Смещение равновесия в водном растворе аммиака
В пробирку внесите ~1 мл раствора аммиака (обратите внимание на наличие характерного для аммиака запаха), добавьте несколько капель раствора сульфата алюминия (отметьте исчезновение запаха аммиака).
Вопросы и задания
 Н
Н апишите схему равновесия в водном растворе аммиака. Какие частицы (молекулы и ионы) находятся в равновесии?
апишите схему равновесия в водном растворе аммиака. Какие частицы (молекулы и ионы) находятся в равновесии? - Напишите уравнения (в молекулярной, полной и краткой ионно-молекулярной формах) реакций: а) взаимодействия сульфата алюминия с гидроксидом аммония.
- Укажите, в каком направлении смещается равновесие в водном растворе аммиака при добавлении к нему избытка сульфата алюминия. Как при этом изменяется концентрация компонентов равновесной системы: ОН‾, NH4+, NH3?
- В каком направлении сместится равновесие в водном растворе аммиака а) при добавлении соляной кислоты; б) при добавлении хлорида аммония; в) при нагревании раствора? Ответ мотивируйте.
Опыт 4. Восстановительные свойства аммиака
Опыт проводится под тягой!
Возьмите две пробирки. В первую налейте ~1 мл иодной воды, а во вторую ~1 мл 0,01 моль/л раствора КМпО4. В обе пробирки добавьте по ~0,5 мл концентрированного (25 %-ного) раствора аммиака. Полученную смесь в каждой пробирке слегка подогрейте. Отметьте изменение окраски раствора. О чем это свидетельствует?
Вопросы и задания
- Опишите наблюдения и объясните их.
- Напишите соответствующие уравнения реакций, считая, что аммиак в них окисляется до свободного азота, а марганец восстанавливается до четырехвалентного состояния.
- Составьте схемы перехода электронов, укажите окислитель и восстановитель. Рассчитайте ΔЕ° реакций.
Опыт 5. Азотистая кислота и ее соли
5.1. Получение азотистой кислоты взаимодействием нитрита калия с серной кислотой.
Опыт проводится под тягой!
Приготовьте в химическом стакане охлаждающую смесь из льда и поваренной соли. Налейте в пробирку ~2 мл 1 моль/л раствора H2SO4 и поместите ее в стакан с охлаждающей смесью. Добавьте в пробирку около половины микрошпателя нитрита натрия или калия. Отметьте появление в растворе голубой окраски азотистого ангидрида N2O3. Выньте пробирку из охлаждающей смеси, наблюдайте образование над раствором бурого газа.
5.2. Взаимодействие нитрита калия с иодидом калия. В пробирку внесите ~1 мл раствора иодида калия, 3-4 капли 2 моль/л раствора серной кислоты и 1-2 капли раствора нитрита калия. Отметьте изменение окраски раствора и выделение газа. Объясните причину этого.
5.3. Взаимодействие нитрита калия с перманганатом калия. В пробирку с ~1 мл раствора перманганата калия добавьте 3-4 капли 2 моль/л раствора серной кислоты и 2-3 капли раствора нитрита калия. Отметьте изменение окраски раствора (в чем причина этого изменения?). В какое соединение переходит при этом нитрит калия?
Вопросы и задания


- Опишите наблюдения. Объясните, почему раствор азотистой кислоты окрашен в голубой цвет. Какие газы и почему выделяются из раствора, если пробирку с HNO2 вынуть из охлаждающей смеси?
- Напишите уравнения реакций: а) взаимодействия нитрита калия с серной кислотой; б) разложения получившейся азотистой кислоты; в) распада азотистого ангидрида.
- Напишите уравнение реакции взаимодействия нитрита калия с иодидом калия в кислом растворе, учитывая что одним из продуктов реакции является молекулярный азот. Составьте ионные уравнения полуреакций окисления и восстановления, укажите окислитель и восстановитель. Рассчитайте ΔЕ° реакций.
- Напишите уравнение реакции взаимодействия нитрита калия с перманганатом калия в кислом растворе, учитывая что марганец восстанавливается до двухвалентного состояния. Составьте ионные уравнения полуреакций окисления и восстановления, укажите окислитель и восстановитель. Рассчитайте ΔЕ° реакций.
- Сделайте вывод об окислительно-восстановительных свойствах нитритов и азотистой кислоты. Дайте этому объяснение.
Опыт 6. Окислительные свойства азотной кислоты
Опыт проводится под тягой!
6.1. Взаимодействие концентрированной HNO3 с фосфором.
В фарфоровую чашку поместите несколько крупинок красного фосфора. Добавьте 6-8 капель концентрированной HNO3. Установите чашку на электроплитку с асбестовой сеткой и, перемешивая стеклянной палочкой реакционную массу, нагревайте ее до тех пор, пока не получится вязкая сиропообразная жидкость и не исчезнет окраска, присущая фосфору. Отберите от полученной жидкости 2-3 капли в пробирку и добавьте к ним 5-6 капель насыщенного раствора молибдата аммония (NH4)2MoO4 и 1-2 капли HNО3. Нагрейте на водяной бане до появления желтого осадка.
6.2. Взаимодействие концентрированной HNO3 с серой. В пробирку поместите немного (на кончике микрошпателя) порошкообразной серы. Прилейте концентрированную HNO3, прокипятите (осторожно!). Испытайте полученный раствор на присутствие сульфат-иона.
6.3. Взаимодействие концентрированной и разбавленной HNO3 с медью. Возьмите две пробирки. В первую внесите ~ 0,5 мл концентрированной азотной кислоты (плотность 1,4 г/см3), во вторую ~1 мл раствора азотной кислоты (плотность 1,12 г/см3), в обе пробирки поместите по небольшому кусочку медной стружки. Пробирку с разбавленной азотной кислотой слегка подогрейте. Наблюдайте происходящее в обеих пробирках на белом фоне. Отметьте различие течения реакций. Какой газ выделяется в первой пробирке, какой – во второй?
Вопросы и задания

-
 Опишите наблюдения.
Опишите наблюдения.
- Напишите уравнения реакций взаимодействия фосфора и серы с концентрированной азотной кислотой. Подберите коэффициенты, используя метод ионно-электронного баланса (метод полуреакций). Укажите окислитель и восстановитель.
- Рассчитайте ΔЕ° реакций.
- Напишите в молекулярном и ионно-молекулярном виде уравнения реакций, подтверждающие присутствие фосфат- (опыт 6.1) и сульфат- (опыт 6.2) ионов.
- Напишите уравнения реакций взаимодействия с медью а) концентрированной азотной кислоты; б) разбавленной азотной кислоты. Чем объяснить легкое пожелтение выделяющегося газа во второй пробирке в начале реакции?
Фосфор
Опыт 7. Получение солей ортофосфорной кислоты и изучение их растворимости
В 4 пробирки налейте по ~1 мл 0,1 моль/л раствора Na2HPO4. В первую пробирку добавьте ~1 мл 1 моль/л раствора СаС12, во вторую – ~1 мл 1 моль/л раствора ВаС12, в две оставшиеся – по ~1 мл 10 %-го растворa аммиака. Затем в третью пробирку прилейте ~1 мл 1 моль/л раствора СаС12, в четвертую – ~1 мл 1 моль/л раствора ВаС12.
Полученные осадки отцентрифугируйте и слейте с них растворы. Каждый из осадков разделите на 2 части и испытайте их растворимость в 1 моль/л НС1 и в 2 моль/л СН3СООН.
Вопросы и задания


- Опишите наблюдения и объясните их.
- Напишите в молекулярном и ионно-молекулярном виде уравнения реакций, которые протекают в каждой пробирке. Назовите соли, выпавшие в осадок.
- Объясните причины растворения осадков в соляной и уксусной кислотах. Воспользуйтесь для этого величинами констант диссоциации фосфорной и уксусной кислот и ПР соответствующих фосфатов.
Опыт 8. Определение рН растворов фосфатов натрия
Возьмите три пробирки. Налейте в них по ~1 мл 0,1 моль/л растворов Na3PO4, NaH2PO4, Na2HPO4. В каждом растворе определите среду (рН) с помощью бумажной полоски универсального индикатора.
Вопросы и задания

- Опишите наблюдения. Укажите рН растворов.
- Напишите в молекулярном и ионно-молекулярном виде уравнения реакций, которые определяют рН исследуемых растворов фосфатов. Объясните различие рН при гидролизе средних и кислых солей ортофосфорной кислоты.
- Рассчитайте теоретическое значение рН в 0,1 М растворе ортофосфата натрия.
Вопросы и задания к лабораторной работе 6
- Напишите молекулярные и ионно-молекулярные уравнения реакций гидролиза солей: NH4Cl, NaNO2, K3PO4. Укажите рН в растворах этих солей.
- Перечислите полиморфные модификации фосфора. Какая из них наиболее термодинамически стабильная? Какая модификация выбрана за стандартное состояние?
- Приведите примеры реакций, в которых соединения висмута(III) проявляют свойства восстановителей, а соединения висмута(V) свойства окислителей.
- Составьте уравнения окислительно-восстановительных реакций, подобрав коэффициенты методом полуреакций:
HCI + HNO3 → C12 + NO + H2O;
NaNO2 + K2Cr2O7 + H2SO4 → Cr2(SO4)3 + … + … + ….;
HNO3 + FeCI3 → …. ;
KI + HNO3 → …. ;
P + KMnO4 + H2O → ….
Укажите в приведенных реакциях окислитель и восстановитель.
5. Выпадет ли осадок при сливании равных объемов 0,001 моль/л раствора Na3РO4 и 0,0001 моль/л раствора AgNO3?
