Томский государственный университет
| Вид материала | Практикум |
- Информатизация в музеях в контексте проблем музейного производства. Кпостановке вопросов,, 38.11kb.
- Образование и наука в третьем, 1269.55kb.
- Личностно-профессиональное становление в условиях вузовского образования: акмеориентированный, 743.02kb.
- Экономическая ситуация требует глубокого изучения теории и практики и необходимость, 39.83kb.
- Оформите, оплатите и вышлите в Томский политехнический университет на дискете или, 86.19kb.
- Томский Государственный Университет Систем Управления и Радиоэлектроники (тусур) Томский, 19.19kb.
- Учебное пособие томск 2003 Томский государственный университет систем управления, 2466.49kb.
- Томский Государственный Университет Систем Управления и Радиоэлектроники (тусур) Томский, 87.68kb.
- Утверждаю, 90.9kb.
- Министерство образования Российской Федерации Томский Государственный Университет Систем, 2141.57kb.
Ионы водорода (их поставляет в раствор азотная кислота) связывают молекулы аммиака
NH3 + H+ ⇄ NH4+
и выводят их из сферы реакции, в результате чего новые ионы [Аg(NН3)2]+ подвергаются диссоциации (для восстановления равновесия), в растворе увеличивается концентрация Аg+. А поскольку там имеются хлорид-ионы, то произведение концентраций свободных ионов Аg+ и Сl‾ превышает ПРAgCl: [Аg+]×[Сl‾]>ПРAgCl – и АgСl выпадает в осадок. Суммарно весь процесс можно записать так:
[Аg(NН3)2]Сl + НNО3 = АgСl + 2NН4NO3
или в ионно-молекулярном виде:
[Ag(NH3)2]+ + Cl‾ + 2H+ = AgCl↓ + 2NH4+.
Разрушение комплекса может произойти и в результате образования какого-либо более прочного комплекса, т. е. обладающего меньшей Кнест:
[Аg(NН3)2]Сl + 2KCN = K[Аg(CN)2] + KСl + 2NH3
или:
[Аg(NН3)2]+ + 2CN– = [Аg(CN)2]– + 2NH3,
а также в результате окислительно-восстановительных реакций, например:
2K2[Ni(СN)4] + Вг2 + 6КОН = 2Ni(ОН)3↓ + 2КВг + 8KCN.
Сульфиды большинства переходных металлов (за исключением хрома) имеют очень малую растворимость, поэтому многие комплексные ионы разрушаются при добавлении в раствор иона S2‾.
Большое значение комплексным соединениям придавал Д. И. Менделеев. Можно сказать, что наука о комплексных соединениях развилась из химической теории растворов Менделеева, так как уже из этой теории вытекали представления о существовании подобных соединений и их важности.
Большая заслуга в развитии учения о комплексных соединениях принадлежит Л. А. Чугаеву, который выполнил ряд классических исследований по комплексным соединениям Рt, Оs и других металлов. Чугаев получил комплексные соединения, где лигандами являются органические вещества, и применил их в аналитической химии. В 1905 г. им была открыта очень чувствительная качественная реакция на Ni2+ с помощью диметилглиоксима (реакция Чугаева). Соединения Ni2+ с диметилглиоксимом образуют осадок характерного ало-красного цвета.
Для комплексных соединений характерно явление изомерии – существование веществ одинакового состава, но отличающихся по строению и, следовательно, по свойствам.
Номенклатура комплексных соединений. Для составления названия комплексного соединения используются правила систематической (международной) номенклатуры.
Если соединение состоит из комплексного иона и одного или нескольких ионов внешней сферы, т. е. является комплексной солью, то первым в именительном падеже называют анион, а затем в родительном падеже – катион. При названии комплексного иона сначала указываются лиганды, затем комплексообразователь. Для обозначения нейтральных лигандов – молекул аммиака и воды – применяют термины аммин (его называют первым) и аква (называют после аммиака) соответственно. К названию анионных лигандов прибавляют окончание «о», например циано- (СN‾), нитро- (NО2‾), хлоро- (Сl‾), гидроксо- (ОН‾), гидридо- (Н‾), оксо- (О2‾), тио- (S2‾), родано- или тиоцианато- (SСN‾), оксалато- (С2О42‾) и т. д. Число одинаковых лигандов, если их больше одного, указывают греческими числительными: 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса. Наконец, следует название комплексообразователя: в комплексном анионе к корню латинского названия элемента прибавляют суффикс -ат; в комплексном катионе дается русское название элемента. В скобках римской цифрой показывают его валентность, численно равную степени окисления. Например:
[Аg(NН3)2]Сl – хлорид диамминсеребра (I); [Сu(NН3)4]SO4 – сульфат тетраамминмеди (II); [РtС1(NН3)5]Сl3 – хлорид пентаамминхлороплатины (IV); К[Аg(СN)2] – дицианоаргентат (I) калия; K4[Fе(СN)6] – гексацианоферрат (II) калия; NН4[Сr(SCN)4(NН3)2] – диамминтетрароданохромат (Ш) аммония.
Название нейтральных комплексов (неэлектролитов) составляется из названий лигандов (в указанной выше последовательности) и обычных русских названий центральных атомов в именительном падеже. Например:
[РtСl4(NН3)2] – диамминтетрахлороплатина (II); [Со(NO2)3(NН3)3] – триамминтринитрокобальт (Ш).
Многие названия комплексных соединений получаются весьма длинными. Поэтому часто параллельно с ними применяются и другие названия. Например, К2[РtСl6] – хлорплатинат калия; К2[PtСl4] – хлорплатинит калия; К3[Fе(СN)6] – феррицианид калия, [Рt(NН3)5С1]С13 – соль Чугаева и т. д.
Экспериментальная часть
Опыт 1. Образование гидроксокомплексов некоторых металлов
В три пробирки внесите по ~1 мл растворов солей: в первую – А13+, во вторую – Zn2+, в третью – Сг3+, и прибавьте в каждую несколько капель раствора щелочи. Образующиеся осадки растворите в избытке раствора щелочи. Образуются комплексные гидроксосоли, содержащие ионы [А1(ОН)4(Н2О)2]‾, [Zn(ОН)4]2‾, [Сr(ОН)6]3‾.
Вопросы и задания
1

 . Опишите и объясните наблюдаемое.
. Опишите и объясните наблюдаемое.2. Напишите уравнения протекающих реакций в молекулярной и ионно-молекулярной формах.
3. Назовите образующиеся комплексные гидроксосоли по систематической номенклатуре.
Опыт 2. Образование комплексного соединения никеля (II)
К ~1 мл раствора хлорида или сульфата никеля (II) в пробирке добавьте 1-2 капли 2 моль/л раствора щелочи (обратите внимание на образование осадка и его цвет), а затем по каплям – концентрированный раствор аммиака. Отметьте цвет полученного раствора после того, как в нем исчезнут следы мути.
Координационное число никеля (II) в образующемся комплексном соединении равно шести.
Вопросы и задания
1
 . Опишите и объясните наблюдаемое.
. Опишите и объясните наблюдаемое.2. Напишите уравнения протекающих реакций в молекулярной и ионно-молекулярной формах.
3. Назовите образующееся комплексное соединение никеля (II) по систематической номенклатуре.
4. Какое основание – Ni(OH)2 или комплексное [Ni(NH3)6](OH)2 – является более сильным электролитом и почему?
Опыт 3. Образование комплексного соединения ртути (II)
Проделайте предварительный опыт: налейте в две пробирки по ~1 мл раствора нитрата ртути (II) и прибавьте в одну из них 1-2 капли раствора щелочи, а в другую – столько же раствора сероводородной воды. Отметьте цвет образующихся малорастворимых соединений НgО (продукт распада Нg(ОН)2) и НgS.
В пробирку с ~1 мл раствора нитрата ртути (II) добавьте по каплям раствор иодида калия. Отметьте цвет образующегося осадка и его последующее растворение после добавления избытка раствора иодида калия. Координационное число ртути (II) в образующемся комплексе равно 4. Раствор с полученным комплексным соединением ртути (П), содержащий избыток иодида калия, разделите на две части. К одной из них добавьте несколько капель раствора щелочи, а к другой – сероводородной воды. Что наблюдается? Объясните полученные результаты, принимая, что произведение растворимости Нg(ОН)2 – величина порядка 10‾26, а ПР(НgS) = 1,4∙10‾45.
Вопросы и задания
1

 . Опишите и объясните наблюдаемое.
. Опишите и объясните наблюдаемое.2. Напишите уравнения протекающих реакций в молекулярной и ионно-молекулярной формах.
3. Назовите образующееся комплексное соединение ртути (II) по систематической номенклатуре.
Опыт 4. Образование комплексного соединения серебра
В пробирку к ~1 мл раствора нитрата серебра прибавьте 1-2 капли 2 моль/л раствора соляной кислоты или раствора хлорида натрия. Отцентрифугируйте осадок, слейте фильтрат. К осадку прибавьте по каплям раствор тиосульфата натрия Na2S2О3 до полного его растворения. Координационное число иона серебра в образующемся комплексе равно двум.
Вопросы и задания
1
 . Опишите и объясните наблюдаемое.
. Опишите и объясните наблюдаемое.2. Напишите уравнения протекающих реакций в молекулярной и ионно-молекулярной формах.
3. Назовите образующееся комплексное соединение серебра по систематической номенклатуре.
4. Пользуясь правилом произведения растворимости, объясните растворение хлорида серебра в избытке
тиосульфата натрия.
Опыт 5. Образование комплексного соединения меди (II) и сравнительная растворимость его в воде и в этиловом спирте
В пробирку с ~1 мл нагретого почти до кипения концентрированного раствора медного купороса постепенно прибавляйте концентрированный раствор аммиака. Обратите внимание на первоначальное образование осадка оснόвной соли – сульфата гидроксомеди (II) (CuOH)2SO4, отметив его цвет, а также на последующее растворение полученного осадка в избытке аммиака и образование окрашенного (в какой цвет?) раствора. К полученному раствору при перемешивании прибавьте небольшими порциями ~3 мл этилового спирта. Наблюдайте выпадение кристаллов комплексной соли [Cu(NH3)4]SO4∙H2O.
Вопросы и задания
1

 . Опишите и объясните наблюдаемое.
. Опишите и объясните наблюдаемое.2. Напишите уравнения протекающих реакций в молекулярной и ионно-молекулярной формах.
3. Назовите образующееся комплексное соединение меди (II) по систематической номенклатуре.
4. Сделайте вывод о сравнительной растворимости образующегося комплексного соединения меди (II) в воде
и в водно-спиртовой смеси.
Опыт 6. Восстановление железа (III) в составе комплекса иодидом калия
В пробирку внесите ~1 мл 0,1 моль/л раствора иодида калия, 2-3 капли 2 моль/л раствора НС1 (подкисление благоприятствует течению реакции), 5-7 капель органического растворителя (толуола), а затем микрошпателем – небольшую порцию кристаллов гексацианоферрата (Ш) калия К3[Fе(СN)6]. Содержимое пробирки тщательно перемешайте стеклянной палочкой. Изменилась ли окраска органического растворителя?
Вопросы и задания
1

 . Опишите и объясните наблюдаемое. Для чего в опыте используется толуол?
. Опишите и объясните наблюдаемое. Для чего в опыте используется толуол?2. Напишите уравнение протекающей реакции в молекулярной и ионно-молекулярной формах, учитывая, что
комплекс [Fe(CN)6]3‾ переходит в комплекс [Fe(CN)6]4‾. Укажите окислитель и восстановитель.
Опыт 7. Разрушение аммиачного комплекса серебра в сильнокислом растворе
Получите осадок АgС1, прибавив к ~1 мл раствора нитрата серебра 1-2 капли 2 моль/л раствора соляной кислоты или раствора хлорида натрия. Отцентрифугируйте осадок, слейте фильтрат и к осадку добавьте раствор аммиака (лучше концентрированного) до его полного растворения. Почему растворился осадок? Затем в пробирку с растворенным осадком по каплям прибавляйте концентрированную азотную кислоту (3-5 капель). Что наблюдается? Почему?
Вопросы и задания
1
 . Опишите и объясните наблюдаемое.
. Опишите и объясните наблюдаемое.2. Напишите уравнения протекающих реакций в молекулярной и ионно-молекулярной формах.
3. Используя представления об устанавливающихся в растворе равновесиях, объясните растворение осадка
AgCl, а затем вновь его образование при прибавлении азотной кислоты.
Вопросы и задания к лабораторной работе 3
- Для каких элементов периодической системы Д. И. Менделеева характерно образование комплексных соединений? Почему?
- Определите заряд комплекса, степень окисления и координационное число комплексообразователя в соединениях:
а) [Аg(NН3)2]С1; б) К4[ТiС18]; в) К[Аg(СN)2]; г) Fе3[Fе(СN)5]2; д) [Сu(NН3)4]SO4; е) К2[НgI4];
ж) К[Fе(SO4)2]; з) К4[Fе(СN)6]. Дайте систематические названия этим соединениям.
- Какие частицы могут выполнять функцию лигандов? Приведите примеры комплексных соединений (не менее трех) с различными лигандами.
- Как получить комплексные соединения: а) [Сu(NН3)4]SO4; б) Nа3[Аg(S2О3)2]; в) К4[Fе(СN)6]?
Составьте уравнения соответствующих реакций.
5. Напишите выражения констант нестойкости для комплексных ионов:
а) [Fе(СN)6]3‾; б) [Аg(NН3)2]+; в) [Сr(Н2О)6]3+; г) [Сu(NН3)4]2+; д) [Со(NO2)6]3+; е) [Ni(СN)6]4‾.
6. Приведите в ионной форме уравнения реакций, протекающих по схемам:
а) FеС13 + К4[Fе(СN)6] → Fе4[Fе(СN)6]3 + КСl
б) Fе(SСN)3 + NН4F → (NН4)3[FеF6] + NН4SСN
7. Почему действие сероводорода на раствор [Сu(NН3)4]SO4 вызывает образования осадка СuS несмотря на малую концентрацию в растворе ионов меди? Напишите уравнение реакции взаимодействия.
8. Изобразите координационные формулы следующих
а) кристаллогидратов: СгС13∙6Н2О; СгС13∙4Н2О; СuSO4∙5Н2O;
б) двойных солей: А12(SО4)3∙К2SО4; РtСl4∙2КСl; Fе(СN)3∙ЗКСN.
После выполнения лабораторной работы
Вы должны знать:
– основные понятия: комплекс, комплексообразователь, лиганд, координационное число, внутренняя и внешняя сфера комплексного соединения, общие и ступенчатые константы нестойкости и константы устойчивости комплексов;
– способы получения комплексных соединений в растворах,
– свойства комплексных соединений: растворимость в воде и в органических растворителях, устойчивость, окислительно-восстановительные свойства;
– факторы, влияющие на устойчивость комплексных соединений;
– комплексные соединения, использующиеся в практике: в живой и минеральной природе, в промышленности и сельском хозяйстве, в медицине;
и уметь:
– записывать формулы комплексных соединений; давать им названия по систематической номенклатуре;
– составлять уравнения реакций образования комплексных соединений в молекулярной и ионной формах;
– записывать выражения общих и ступенчатых констант нестойкости и констант устойчивости комплексов;
– сравнивать устойчивость однотипных комплексов по значениям их констант устойчивости и нестойкости.
Лабораторная работа 4. ГИДРОЛИЗ СОЛЕЙ
Цель работы – изучение гидролиза различных солей и факторов, влияющих на степень гидролиза.
Под гидролизом понимают обменное взаимодействие ионов соли с водой, приводящее к образованию слабого электролита и (чаще всего, но не всегда) к избыточному содержанию в растворе либо ионов Н+, либо ионов ОН‾, в результате чего происходит изменение рН среды. Так, например, при растворении соли СН3СООNa реакция раствора становится щелочной (рН>7). Изменение рН раствора объясняется следующим образом. Ионы соли СН3СОО‾ и Na+ взаимодействуют с Н+- и ОН‾-ионами воды. При этом ионы Nа+ не могут связывать ионы ОН‾ в NaОН, так как последний является сильным электролитом и существует в растворе в виде ионов Na+ и ОН‾ (или ионных пар). В то же время ацетат-ионы связывают ионы Н+ (с образованием молекул слабого электролита – уксусной кислоты), в результате чего новые молекулы Н2О диссоциируют на Н+- и ОН‾-ионы. Эти процессы протекают до тех пор, пока не установятся равновесия:
СН3СОО‾ + Н+ ⇄ СН3СООН
и Н2О ⇄ Н+ + ОН‾.
Суммируя оба одновременно протекающих процесса, получим уравнение гидролиза соли в ионном виде:
СН3СОО‾ + Н2О ⇄ СН3СООН + ОН‾ (А)
Уравнение (А) показывает, что идет накопление ОН‾-ионов, а потому раствор приобретает щелочную реакцию.
Применив к обратимому процессу (А) закон действующих масс (ЗДМ), получим
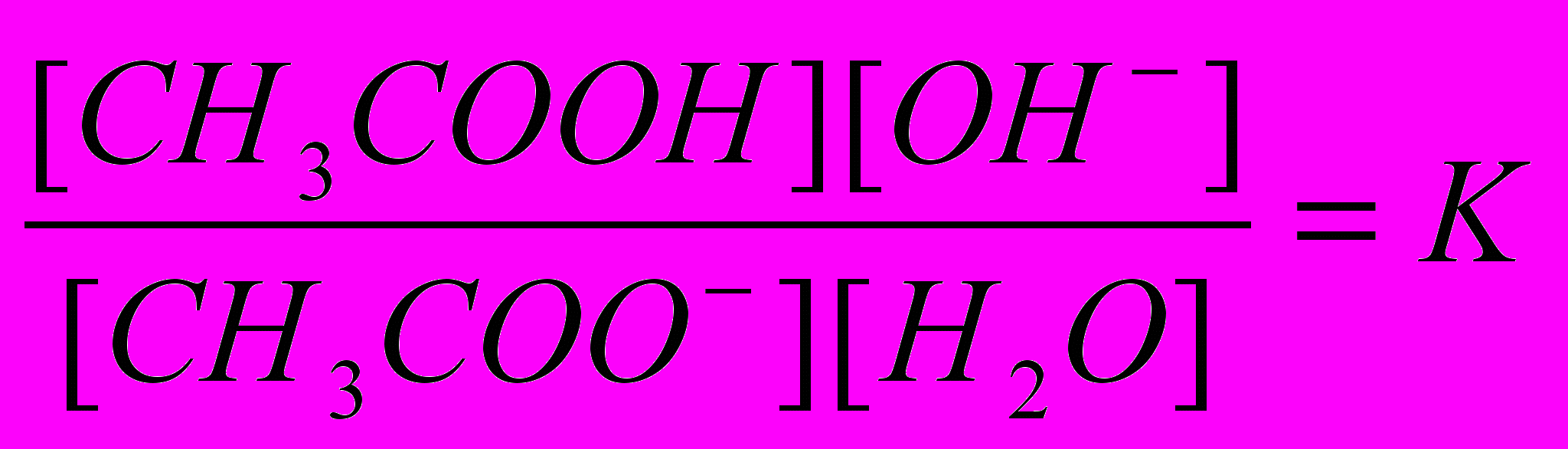 . (1)
. (1)Концентрация воды в растворе соли практически постоянна, поэтому величину [Н2О] объединяем с К:
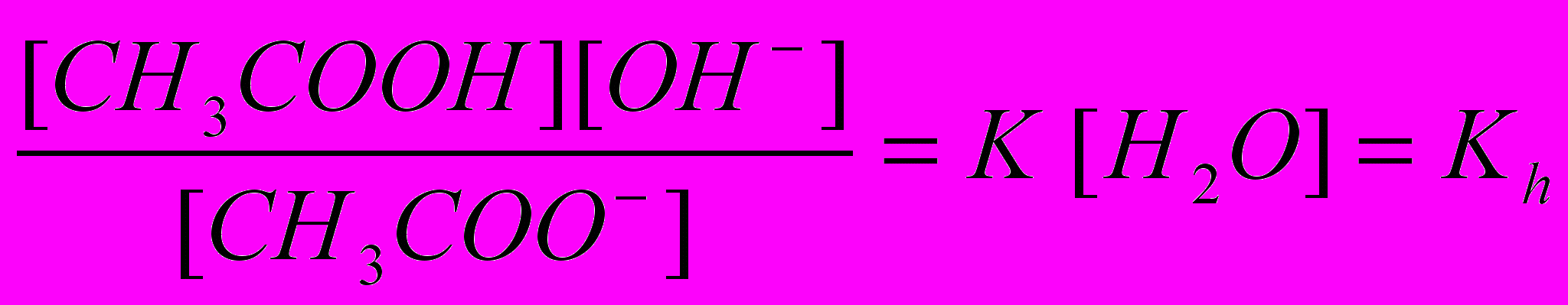 , (2)
, (2)где Кh – константа гидролиза. Из соотношений
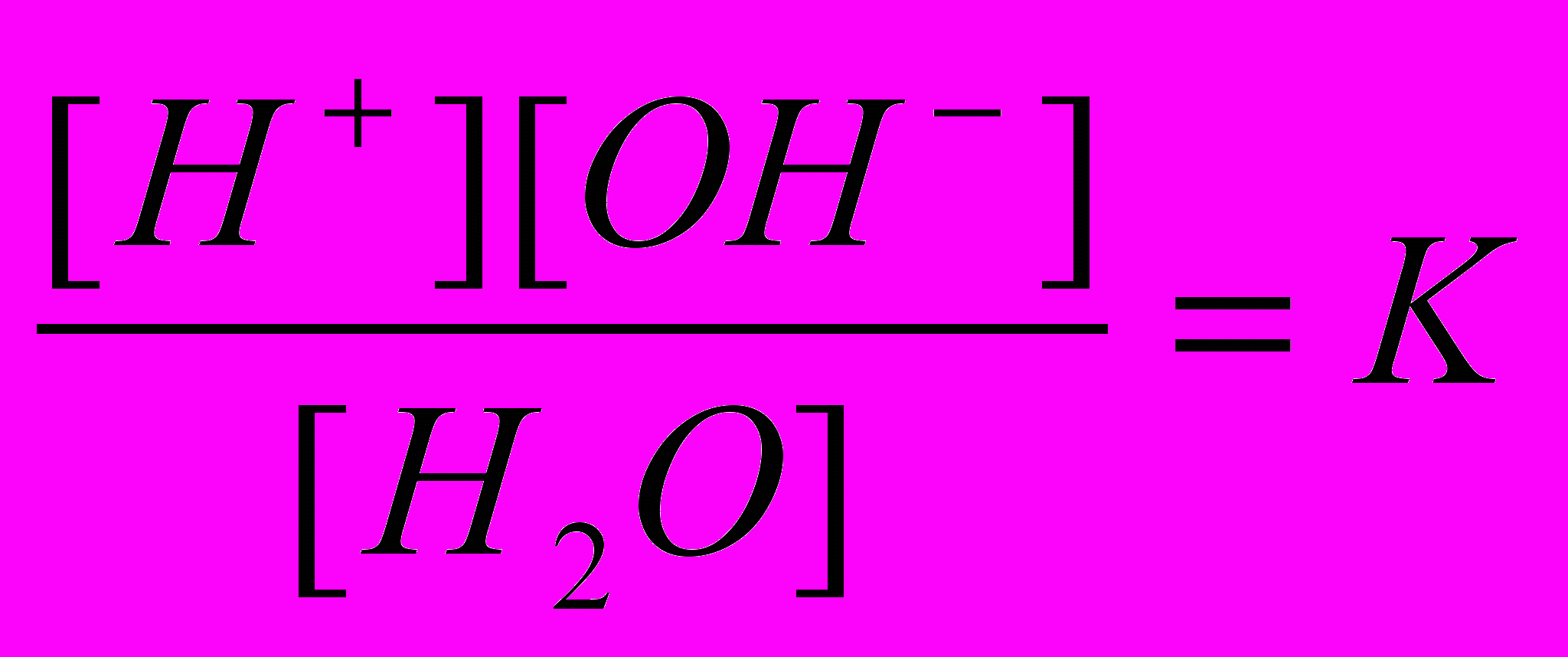 и
и 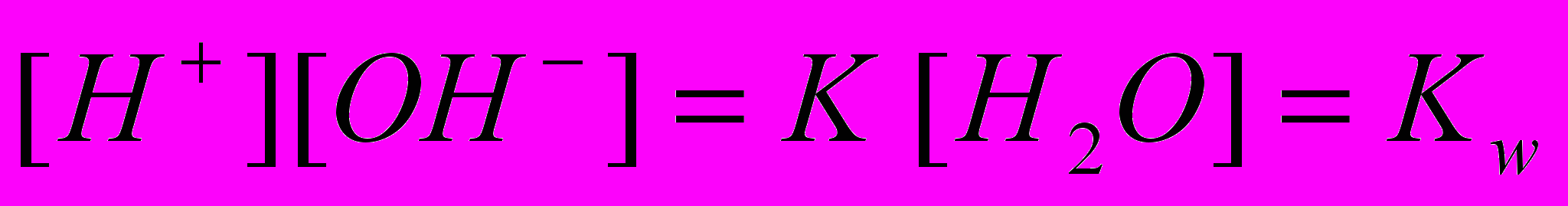 ,
,составленных для равновесия
Н2О ⇄ Н+ + ОН‾,
находим [ОН‾] = Kw/[Н+], и, подставляя его в уравнение (2), получим
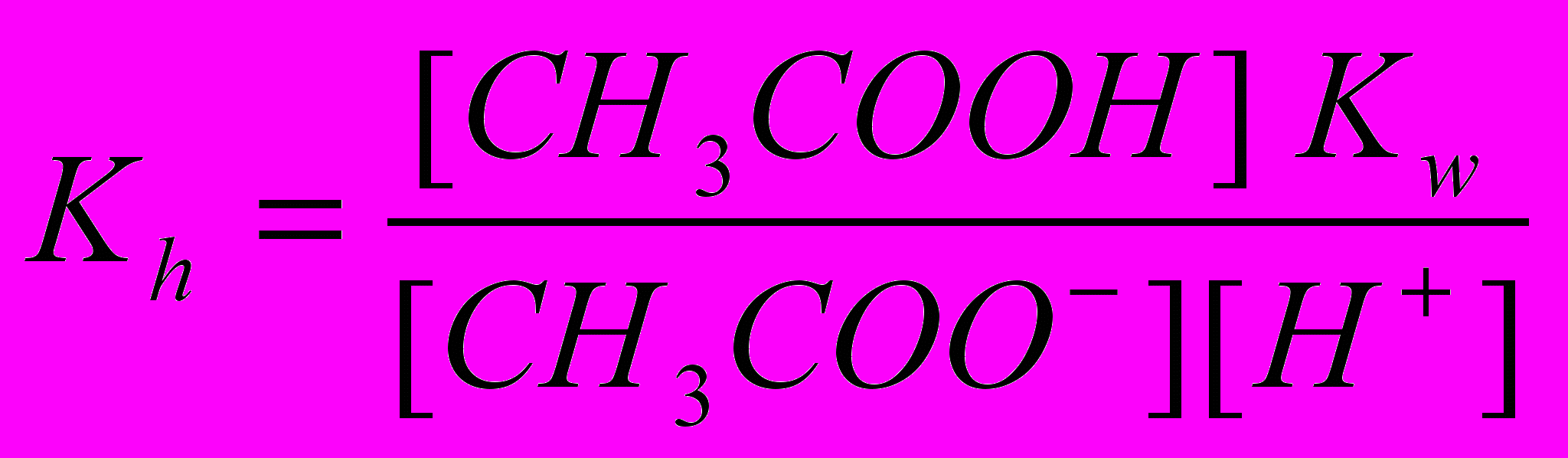 .
.Но так как
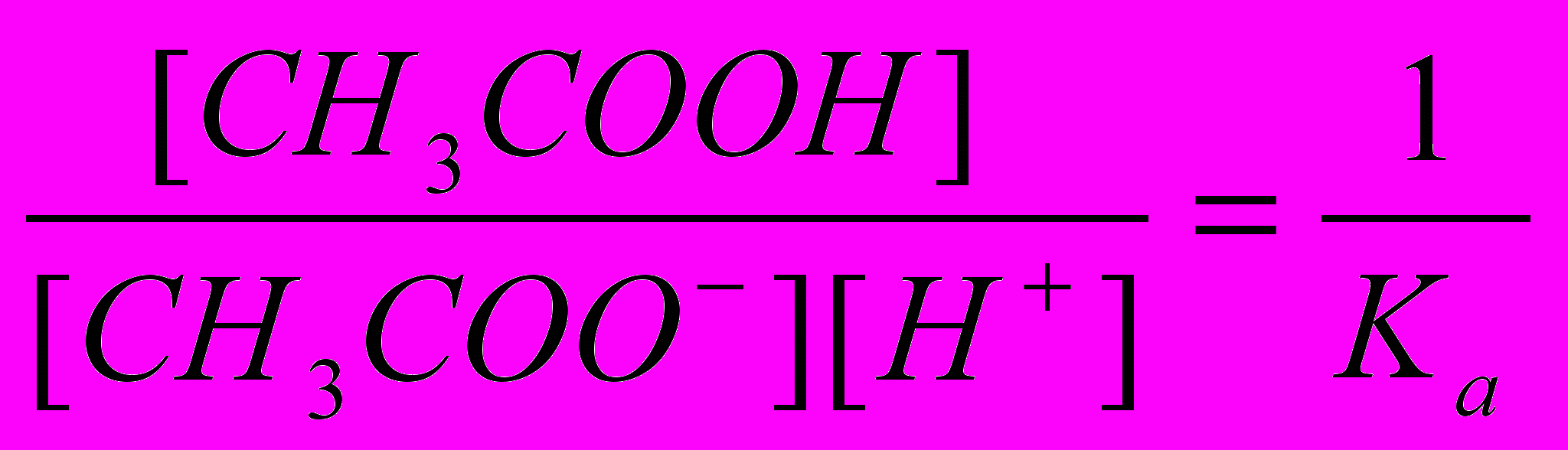 , где Ка – константа диссоциации слабой уксусной кислоты, образованной в результате гидролиза соли, окончательно имеем выражение
, где Ка – константа диссоциации слабой уксусной кислоты, образованной в результате гидролиза соли, окончательно имеем выражениеKh = Kw/Ka. (3)
Чем больше Кh, тем сильнее соль гидролизуется.
Гидролиз солей в количественном отношении обычно характеризуется степенью гидролиза α, под которой понимают отношение числа молекул, подвергшихся гидролизу, к общему числу растворенных молекул. Степень гидролиза легко вычисляется из уравнений (2) и (3). Пусть в реакции гидролиза, изображенной уравнением (А), начальная концентрация соли, а значит и ацетат-ионов (ибо соль – сильный электролит и полностью диссоциирует на ионы) равна с, а степень гидролиза α. Тогда при наступающем равновесии (А) равновесные концентрации примут значения
[СН3СОО‾] = с – сα, [СН3СООН] = сα и [ОН‾] = сα.
Подставляя эти выражения в уравнение (2) и учитывая уравнение (3), получим
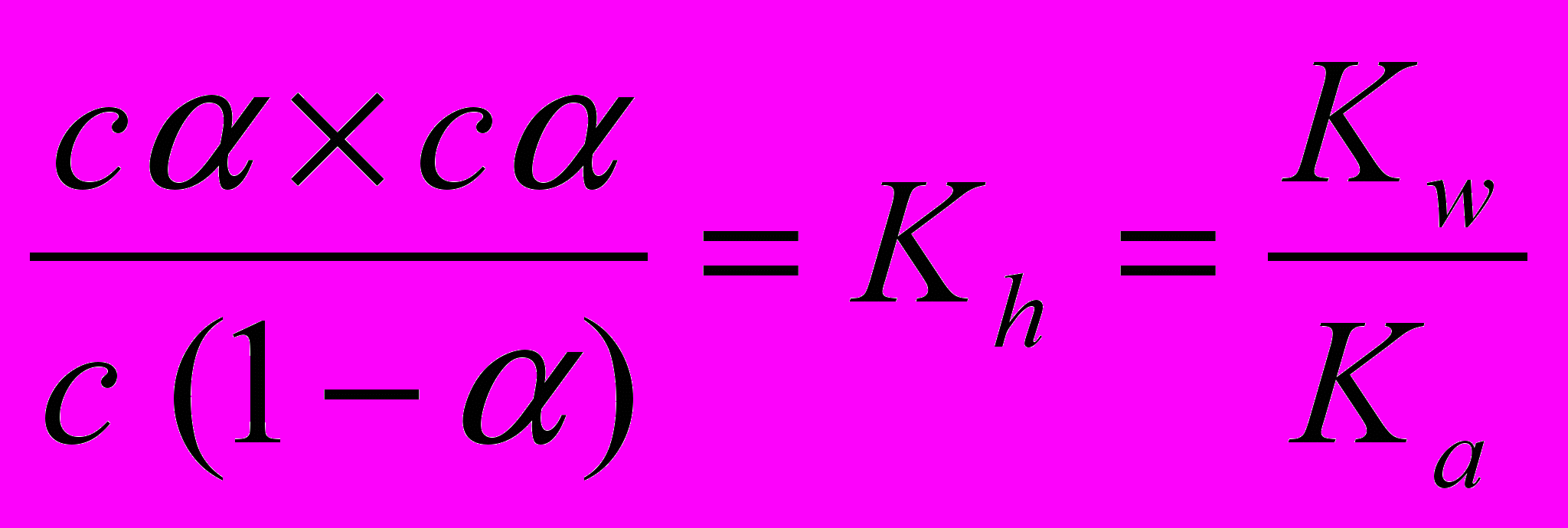
или
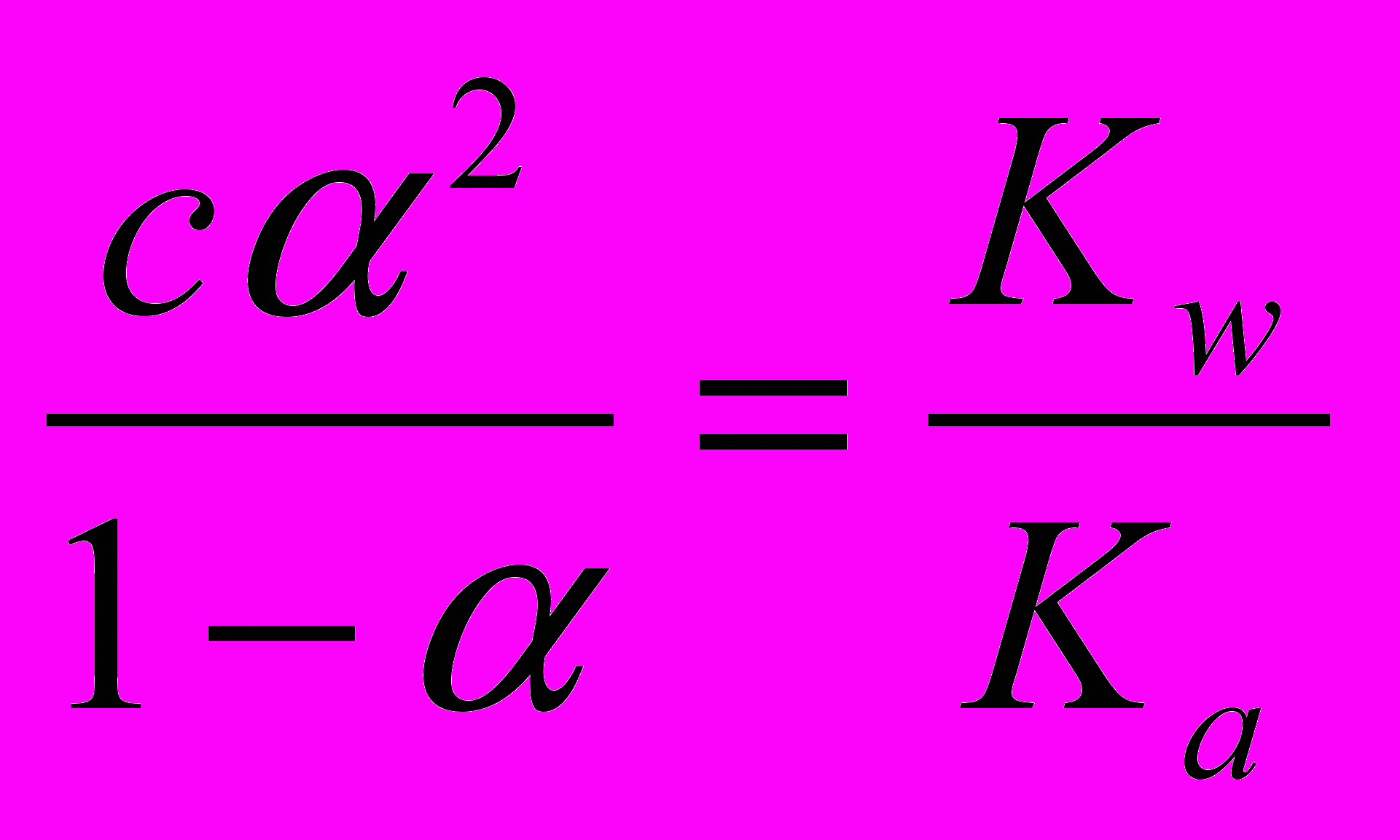 . (4)
. (4)Так как для многих солей α – величина небольшая (обычно α ≤ 0,01), то с известным приближением можно принять 1–α ≈ 1. Тогда уравнение (4) примет вид сα2 ≈ Kw/Ka и
α ≈
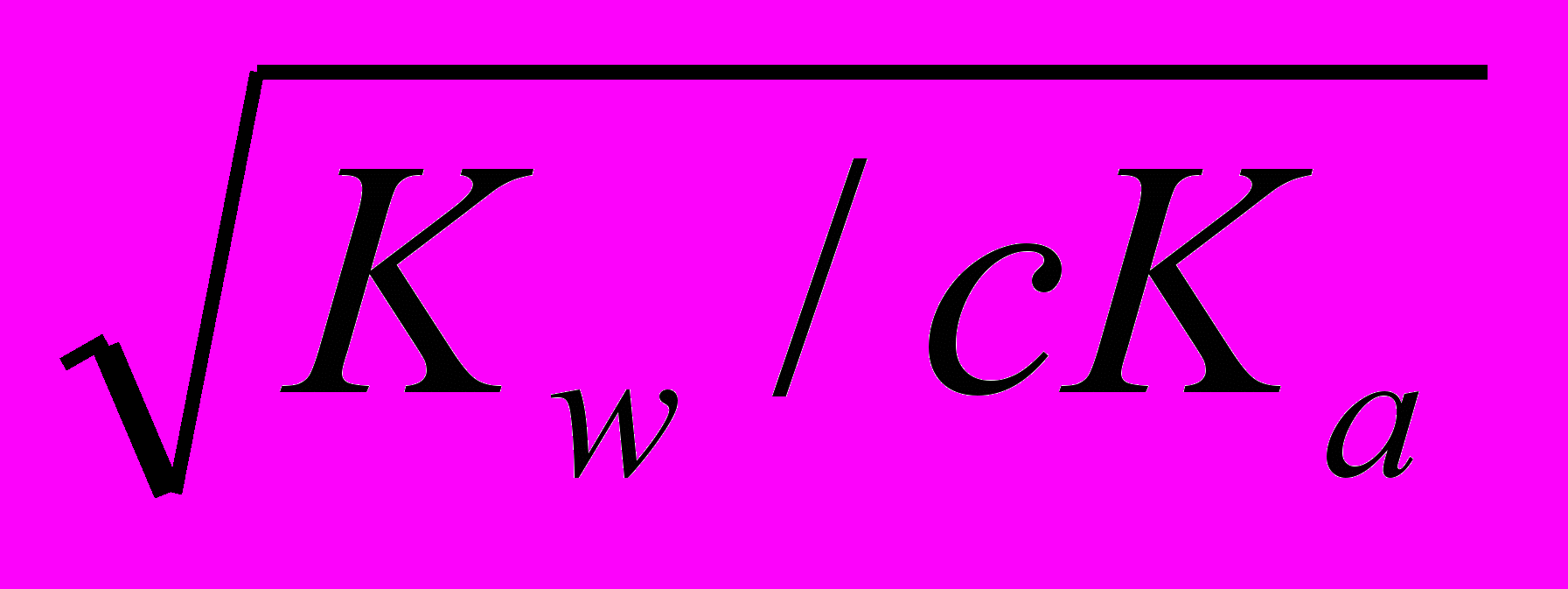 . (5)
. (5)Гидролиз солей чаще всего – обратимый процесс. Равновесие гидролиза может быть смещено в ту или другую сторону при изменении температуры, разбавлении или концентрировании раствора, а также под действием избыточной концентрации ионов, одноименных с теми, которые накапливаются в растворе в результате гидролиза.
Из формулы (5) следует, что степень гидролиза тем больше:
- чем больше Kw, т. е. чем больше температура (так как Kw возрастает с температурой);
- чем меньше Кa, т. е. чем слабее кислота (основание), которая образуется в результате гидролиза соли;
- чем меньше концентрация, т. е. чем больше разбавлен раствор.
Таким образом, чтобы усилить гидролиз соли, надо разбавить раствор соли и нагреть его.
Различают три случая гидролиза солей.
- Соль образована слабой кислотой и сильным основанием. Пример рассмотрен выше – гидролиз соли СН3СООNa. В этом случае Кh = Кw/Кa, т. е. константа гидролиза соли, образованной слабой кислотой и сильным основанием, равна ионному произведению воды, деленному на константу диссоциации слабой кислоты; α ≈
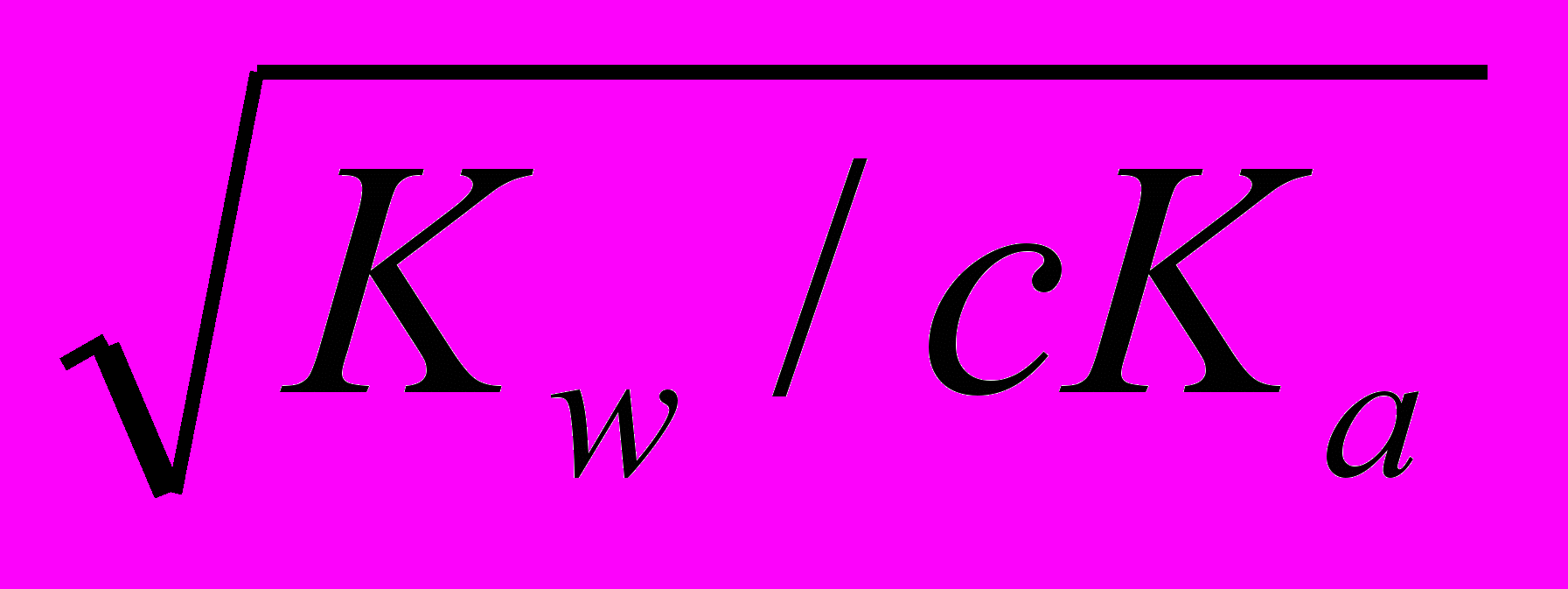 и pH > 7.
и pH > 7.
- Соль образована сильной кислотой и слабым основанием. Пример – хлорид аммония NН4С1. Уравнение гидролиза соли в ионном виде можно написать так:
NH4+ + Н2O ⇄ NН4ОН + Н+ (B)
Реакция раствора должна быть кислой, так как происходит накопление Н+-ионов, что видно из уравнения (B). В этом случае Кh = Кw/Кb (Kb – константа диссоциации слабого основания), т.е. константа гидролиза соли, образованной слабым основанием и сильной кислотой, равна ионному произведению воды, деленному на константу диссоциации слабого основания;
α ≈
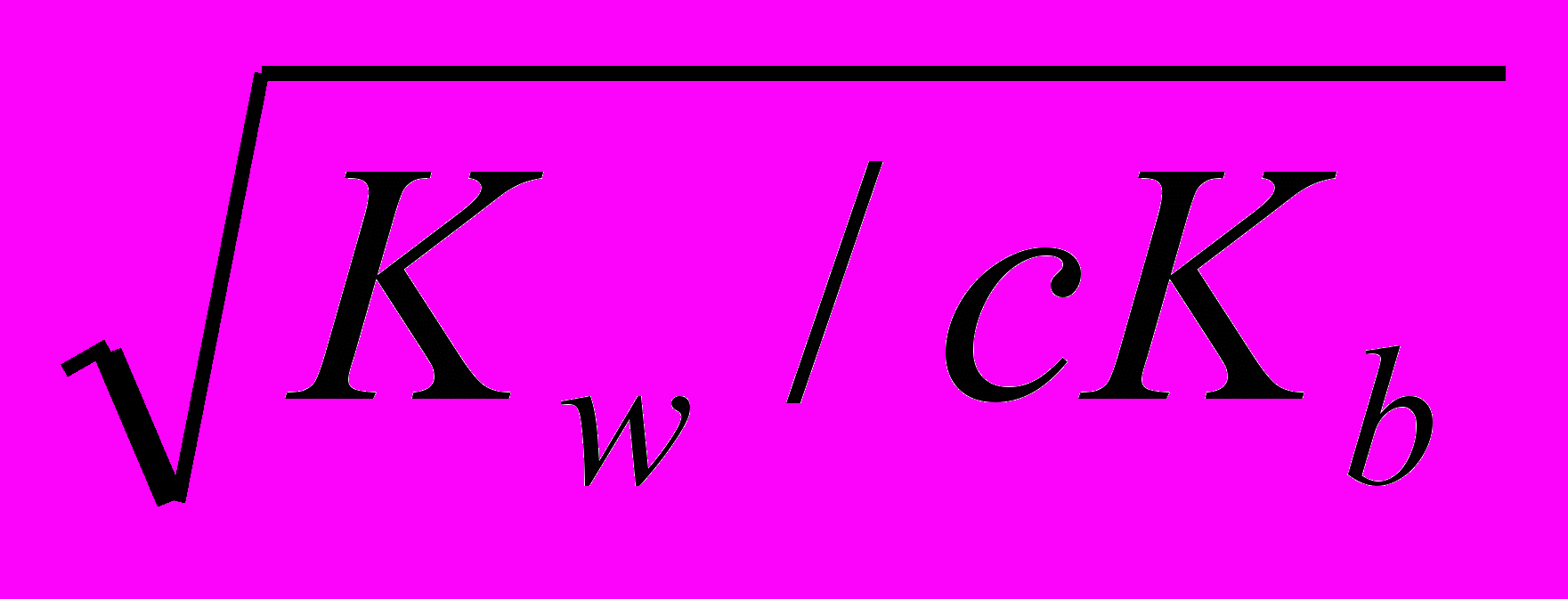 и pH < 7.
и pH < 7.- Соль образована слабой кислотой и слабым основанием. Пример – ацетат аммония СН3СООNН4. Уравнение гидролиза соли в ионном виде запишется так:
СН3СОО‾ + NH4+ + Н2O ⇄ СН3СООН + NН4ОН (Г)
В этом случае одновременно связываются Н+- и ОН‾-ионы воды. Кh = Кw/КaKb, т. е. константа гидролиза соли, образованной слабой кислотой и слабым основанием, равна ионному произведению воды, деленному на произведение констант диссоциации слабой кислоты и слабого основания. Так как знаменатель в выражении константы гидролиза – произведение двух малых величин – есть величина очень малая, то Kh – достаточно большая величина. Действительно, гидролиз солей, образованных слабой кислотой и слабым основанием, протекает в значительной степени и от разбавления не зависит.
В этом случае pH водных растворов солей чуть больше (среда слабощелочная, если константа диссоциации кислоты меньше константы диссоциации основания), равен (среда нейтральная, если сила кислоты и сила основания одинаковы) или чуть меньше (среда слабокислая, если константа диссоциации кислоты больше константы диссоциации основания), 7.
Соли, образованные катионами сильных оснований и анионами слабых кислот, гидролизу не подвергаются.
Изучение гидролиза удобно вести, пользуясь кислотно-основными индикаторами – веществами, меняющими свой цвет в растворе при изменении концентраций ионов Н+ или ОН‾, т.е. значения рН.
В качестве кислотно-основных индикаторов обычно выступают слабые органические кислоты, у которых окраска молекулярной и анионной форм различны. Например, лакмус – слабая кислота HL, которая в растворе диссоциирует:
HL ⇄ H+ + L‾ (В)
красный синий
В кислой среде (при избытке протонов Н+) равновесие (В) смещается в сторону недиссоциированных молекул HL, окраска в растворе красная. В щелочной среде (при избытке гидроксид-ионов ОН‾) равновесие (В) смещается в сторону образования анионов L‾, раствор приобретает синюю окраску. Различные индикаторы меняют окраску при разных значениях рН. В таблице 1 приведены примеры наиболее часто используемых индикаторов и области рН перехода их окраски.
Таблица 1 Кислотно-основные индикаторы
| Индикатор | рН перехода окраски | Окраска | ||
| НL | L‾ | в области перехода | ||
| Лакмус | 5,0 – 8,0 | красная | синяя | |
| Метилоранж | 3,2 – 4,4 | красная | желтая | оранжевая |
| Фенолфталеин | 8,2 – 10,0 | бесцветная | малиновая | розовая |
Составление уравнений гидролиза солей. Следует обратить внимание на правильное написание уравнений гидролиза солей многоосновных кислот и многокислотных оснований. Эти соли гидролизуются по ступеням. Так, гидролиз соли Na2CO3 может быть выражен ионными уравнениями:
первая ступень: СO32‾ + H2O ⇄ HСO3‾ + OH‾
вторая ступень: HСO3‾ + Н2O ⇄ Н2СО3 + OН‾
Т. е. гидролиз карбоната натрия протекает главным образом по первой ступени с образованием кислой соли. И лишь при сильном разбавлении, нагревании или подкислении раствора следует учитывать гидролиз образовавшейся кислой соли (т. е. вторую ступень гидролиза).
При гидролизе солей двух- и многокислотных оснований образуются основные соли. Например, для соли AlCl3 возможны три ступени гидролиза:
первая ступень: Al3+ + H2O ⇄ AlOH2+ + H+
вторая ступень: AlOH2+ + Н2O ⇄ Al(OН)2+ + Н+
третья ступень: Al(OH)2+ + H2O ⇄ Al(OH)3 + H+
Но преимущественно протекает процесс по первой ступени и лишь повышение температуры, разбавление раствора или его подщелачивание усиливают гидролиз.
Уравнения реакций гидролиза составляются а) в молекулярной форме; б) в полной ионно-молекулярной форме и в) в сокращенной ионно-молекулярной форме. При этом должны быть учтены правила написания ионных уравнений обычных реакций обмена.
Экспериментальная часть
Опыт 1. Определение характера гидролиза
На полоски красной и синей лакмусовой или универсальной индикаторной бумаги, помещенные на часовое стекло, нанесите по одной капле растворов солей: сульфида натрия, карбоната натрия (соды), сульфита натрия, сульфата калия, хлорида алюминия, буры. По изменению цвета индикатора определите, какие соли подвергаются гидролизу и объясните, почему.
Вопросы и задания
1

 . Напишите уравнения реакций гидролиза солей в молекулярной, полной и краткой ионно-молекулярной формах.
. Напишите уравнения реакций гидролиза солей в молекулярной, полной и краткой ионно-молекулярной формах.2. Укажите среду (кислая, щелочная или нейтральная) и рН (рН>7; рН<7 или рН≈7) в растворах исследованных солей. Объясните причину различных значений рН в этих растворах.
3. Результаты наблюдений оформите в виде таблицы:
-
Соль
рН
Выводы
Опыт 2. Влияние температуры на гидролиз
В две пробирки внесите по ~1 мл 1 моль/л раствора ацетата натрия, прибавьте в каждую по 2 капли раствора фенолфталеина. Одну пробирку оставьте в качестве контрольной, вторую нагрейте на кипящей водяной микробане. Отметьте изменение цвета раствора при нагревании. Охладите пробирку до комнатной температуры и снова отметьте изменение цвета.
Вопросы и задания
1
 . Опишите наблюдаемое.
. Опишите наблюдаемое. 2. Напишите уравнение реакции гидролиза ацетата натрия в молекулярной, полной и краткой ионно-молекулярной формах.
3. Используя принцип подвижного равновесия (принцип Ле Шателье), объясните, почему при нагревании цвет раствора с индикатором изменяется. Почему цвет раствора изменяется при охлаждении?
4. По результатам опыта сделайте вывод о тепловом эффекте процесса гидролиза (эндо- или экзотермический процесс).
Опыт 3. Влияние разбавления на гидролиз
К 4-6 каплям раствора хлорида сурьмы (III) по каплям прибавляйте воду. Заметьте выпадение осадка оксохлорида сурьмы (III) SbOCl**. Затем прибавьте несколько капель соляной кислоты до растворения осадка. Снова прилейте воды.
** Соли сурьмы (III) в водных растворах сильно гидролизуются с образованием основных солей. Последние, отщепляя воду, переходят в соединения антимонила (или стибила), т. е. одновалентного радикала-катиона SbO+:
Sb3+ + 2Н2О → Sb(ОН)2+ + 2Н+, Sb(ОН)2+ → SbO+ + H2O
Следует иметь в виду, что Sb(III) часто находится в виде радикала SbO*, который входит в состав солей в качестве однозарядного катиона (например, KSbOС4Н4О6 – так называемый рвотный камень, SbOCl – хлорид антимонила и др.).
Вопросы и задания
1
 . Опишите и объясните наблюдаемое.
. Опишите и объясните наблюдаемое.2. Напишите уравнение реакции гидролиза хлорида сурьмы (III) в молекулярной, полной и краткой ионно-молекулярной формах.
3. Объясните смещение ионных равновесий диссоциации и гидролиза хлорида сурьмы (III).
Опыт 4. Растворение веществ в продуктах гидролиза
4.1. В пробирку налейте около ~1 мл раствора хлорида цинка и на микробане хорошо нагрейте раствор. Бросьте в раствор небольшой кусочек цинка, предварительно очистив его поверхность наждачной бумагой. Какой газ выделяется?
4.2. В другую пробирку налейте столько же концентрированного раствора фосфата натрия Na3РО4 и внесите небольшой кусочек алюминия. Сильно нагрейте раствор. Что наблюдается?
Вопросы и задания
1
 . Опишите и объясните наблюдемое.
. Опишите и объясните наблюдемое.2. Напишите уравнения реакций гидролиза в молекулярной, полной и краткой ионно-молекулярной формах а) для хлорида цинка; б) для фосфата натрия.
3. Напишите уравнения реакций растворения металлов в продуктах гидролиза указанных солей.
Опыт 5. Необратимый гидролиз
К ~1 мл раствора сульфата алюминия прибавьте столько же раствора карбоната натрия. Наблюдайте образование осадка и выделение газа (какого?). Почему это происходит?
Вопросы и задания
1
 . Опишите и объясните наблюдаения.
. Опишите и объясните наблюдаения.2. Напишите уравнение реакции гидролиза сульфата алюминия в молекулярной, полной и краткой ионно-молекулярной формах.
3. Как доказать, что выпавший осадок не является солью угольной кислоты?
Опыт 6. Практическая негидролизуемость малорастворимых веществ
В две пробирки налейте по ~1 мл дистиллированной воды, предварительно измерив универсальным индикатором рН этой среды. Затем в первую пробирку внесите 1 микрошпатель кристаллов сульфата свинца PbSO4 и хорошо перемешайте стеклянной палочкой. В другую пробирку внесите столько же кристаллов карбоната кальция и также хорошо перемешайте. С помощью универсального индикатора определите рН воды с осадками в пробирках.
Вопросы и задания
1

 . Опишите и объясните наблюдения. Почему не различаются значения рН для чистой воды и воды с осадками?
. Опишите и объясните наблюдения. Почему не различаются значения рН для чистой воды и воды с осадками?Вопросы и задачи к лабораторной работе 4
- Что называется ионным произведением воды и от чего оно зависит?
- Что такое рН?
- Что называется интервалом перехода индикатора?
- Как влияют температура и разбавление на гидролиз солей?
- Почему не все соли гидролизуются?
6. Вычислить водородный и гидроксильный показатели (рН и рОН) децинормального раствора азотной кислоты.
7. Определить рОН и рН сантимолярного раствора гидроксида натрия.
8. Вычислить рН 3,12 %-ного раствора соляной кислоты, плотность которого равна 1,015 г/см3.
9. Вычислить концентрацию ионов водорода и гидроксид-ионов в растворе, рН которого равен а) 12,05; б) 1,30.
10. Вычислить рН децинормального раствора соляной кислоты, если степень диссоциации ее равна 90 %.
