Методические указания и контрольные задания по физике для слушателей второго курса фзо москва 2004
| Вид материала | Методические указания |
- Методические указания к изучению курса и контрольные задания (для студентов строительных, 1247.25kb.
- Методические указания и контрольные задания по английскому языку для студентов II курса, 375.13kb.
- Программа, методические указания и контрольные задания для студентов 5 курса заочного, 2134.85kb.
- Программа, методические указания и контрольные задания для студентов 5 курса заочного, 439.54kb.
- Методические указания и контрольные задания по английскому языку орёл 2009, 222.99kb.
- Программа, методические указания и контрольные задания по дисциплине концепции современного, 717.75kb.
- Программа, методические указания и контрольные задания по учебной дисциплине «риторика», 1732.52kb.
- Учебные программы, Методические указания и контрольные задания по английскому, немецкому,, 1007.85kb.
- Методические указания и контрольные задания для студентов заочной формы обучения Составитель:, 672.87kb.
- Методические рекомендации и контрольные задания для студентов второго курса заочного, 417.72kb.
Условие нормировки вероятностей:
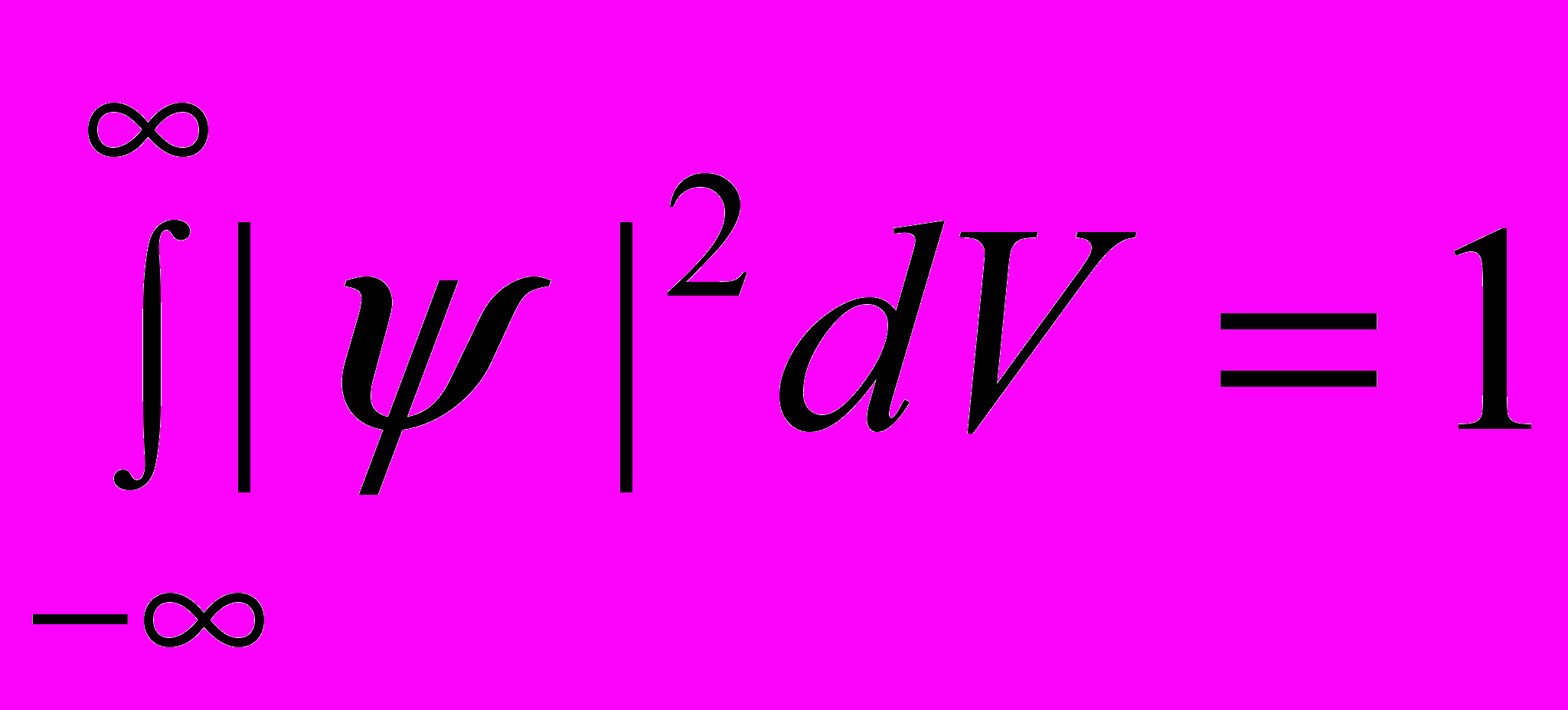
Волновая функция ψ, являясь основной характеристикой состояния микрообъектов, должна быть конечной (вероятность не может быть больше 1), однозначной (вероятность не может быть неоднозначной величиной) и непрерывной (вероятность не может изменяться скачком).
Волновая функция удовлетворяет принципу суперпозиции: если система может находиться в различных состояниях, описываемых волновыми функциями ψ1, ψ2, … ψп, …, то она также может находиться в состоянии ψ, описываемом линейной комбинацией этих функций:
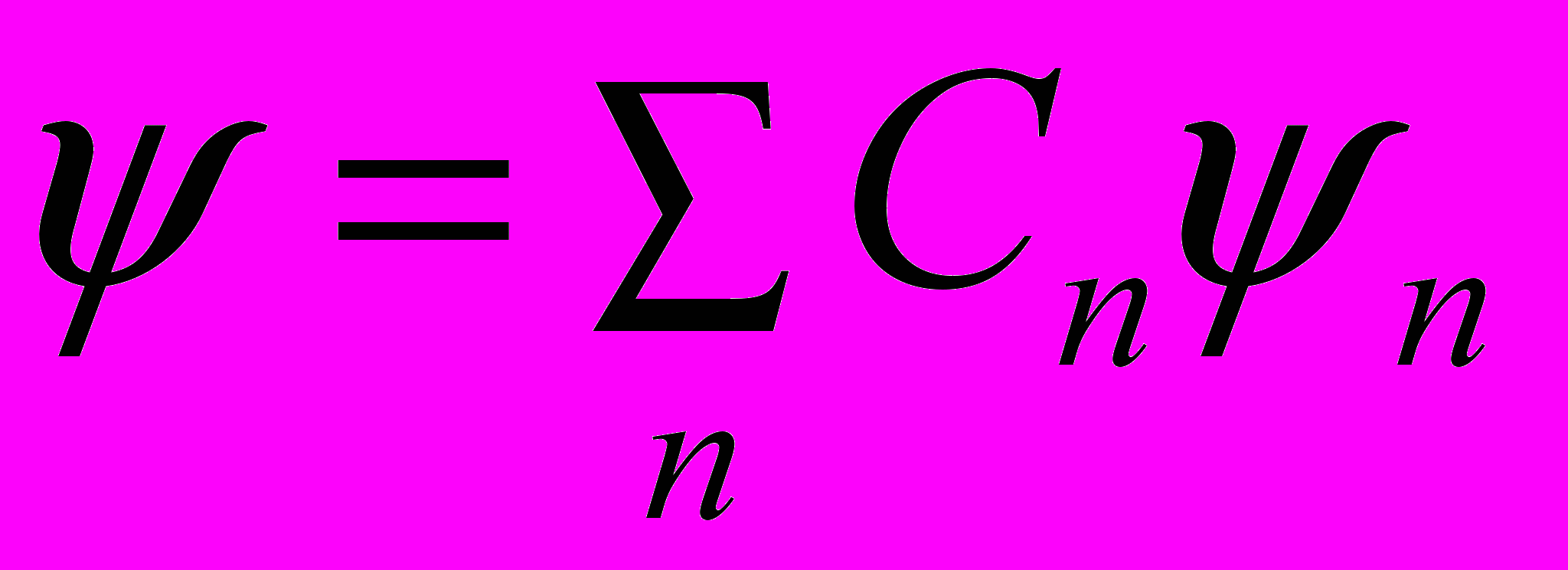
где Cп (п = 1,2, …) – произвольные, вообще говоря, комплексные числа.
Вероятность обнаружения частицы в интервале от х1 до х2:

Среднее значение физической величины L, характеризующей частицу, находящуюся в состоянии, описываемом волновой функцией ψ:
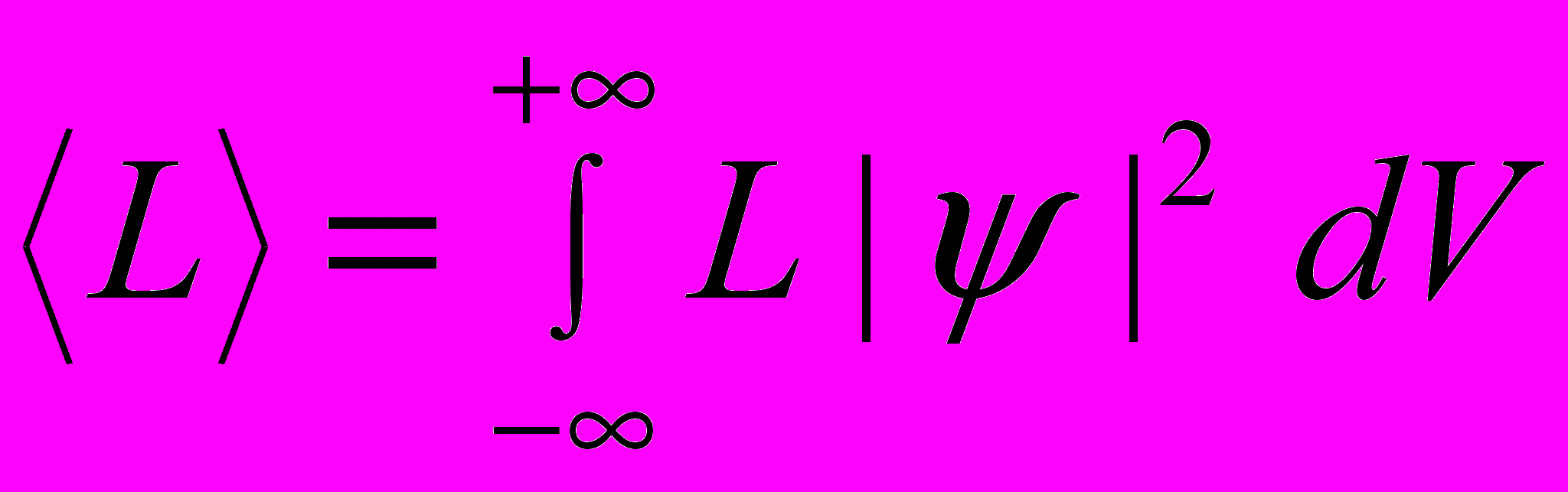
Общее уравнение Шредингера:
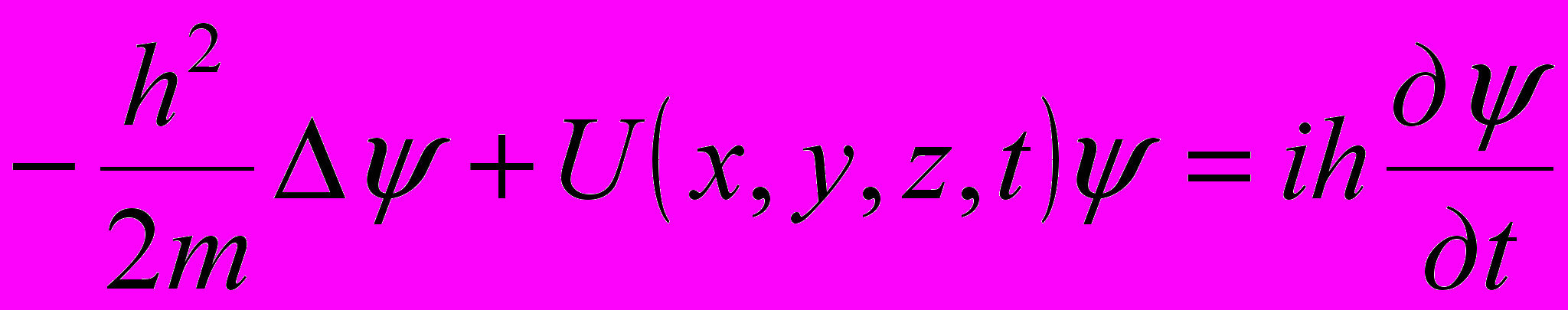
где ψ = ψ (х,у,z,t) – волновая функция, описывающая состояние частицы; h = h /(2π); m – масса частицы; Δ – оператор Лапласа
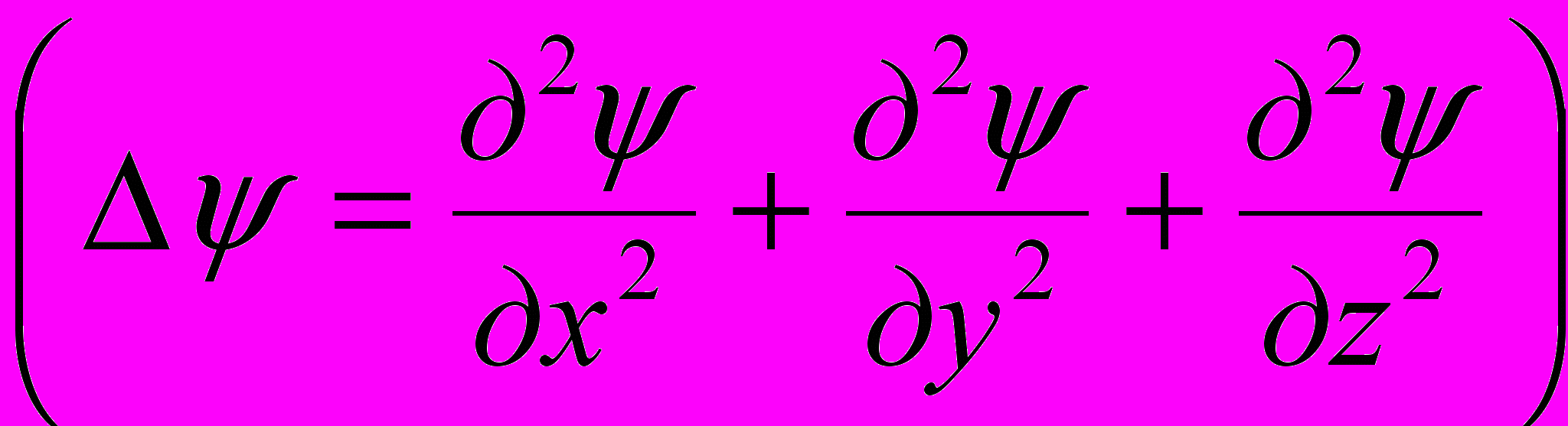 ;
; 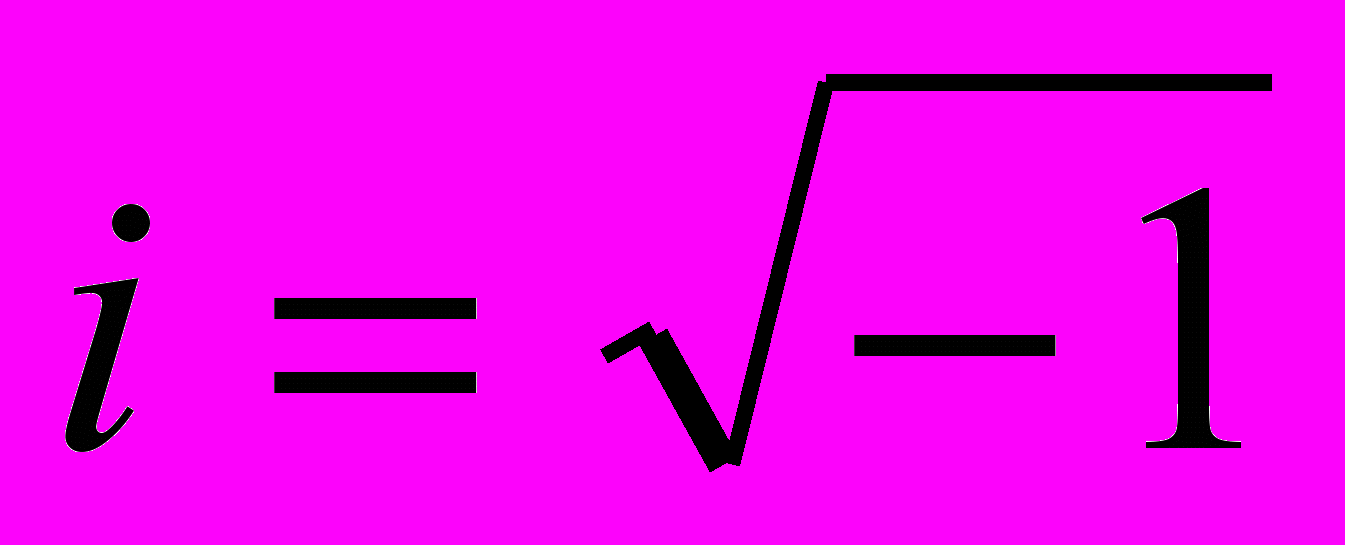 - мнимая единица; U = U (х,у,z,t) – силовая функция частицы в поле, в котором она движется.
- мнимая единица; U = U (х,у,z,t) – силовая функция частицы в поле, в котором она движется.Уравнение Шредингера для стационарных состояний:
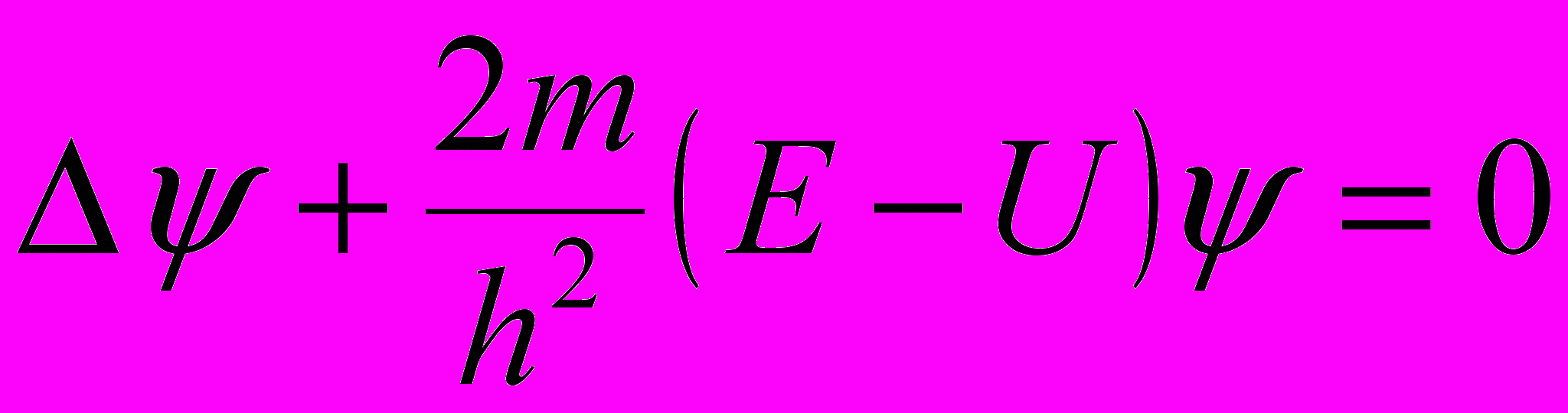
где ψ = ψ (х,у,z) – координатная часть волновой функции (ψ (х,у,z,t) = ψ (х,у,z) е-i(E/h) t); U = U (х,у,z) – потенциальная энергия частицы; Е – полная энергия частицы.
Свободная частица – частица, движущаяся в отсутствие внешних полей.
Волновая функция, описывающая одномерное движение свободной частицы:
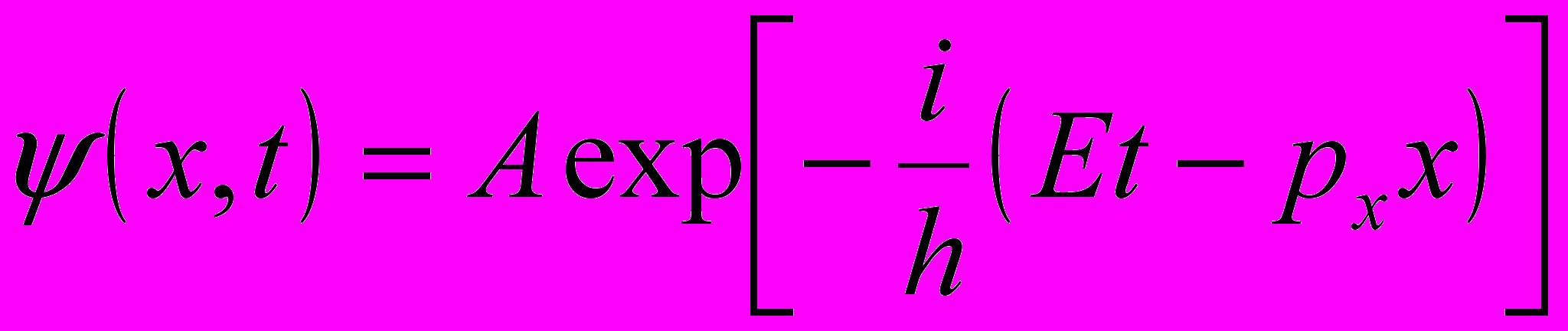
где A – амплитуда колебаний волн де Бройля; px = kh – импульс частицы; E = hω – энергия частицы.
Собственная энергия частицы, находящейся на п-м энергетическом уровне в одномерной прямоугольной “потенциальной яме” с бесконечно высокими “стенками”:
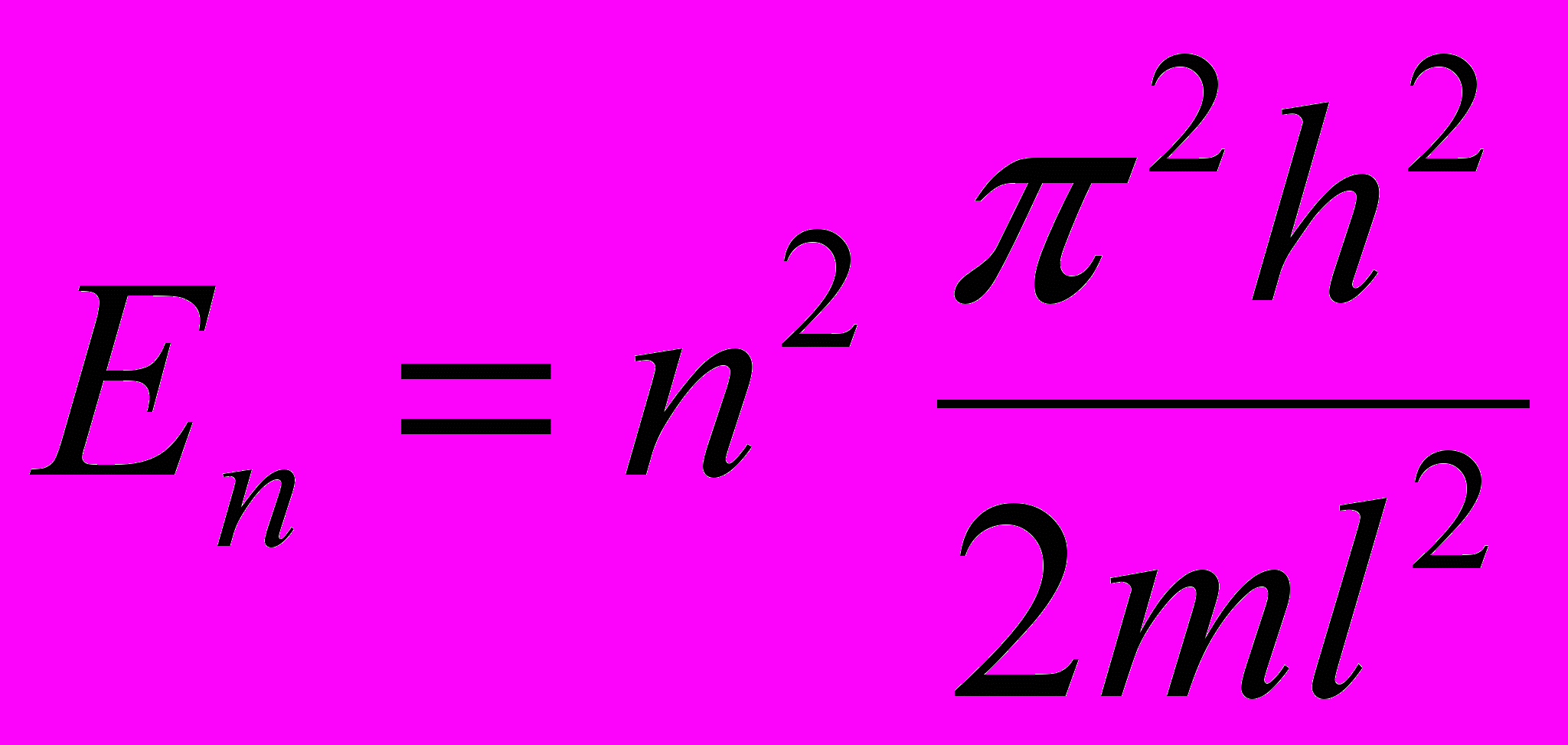
где l – ширина ямы; п = 1,2,3, ….
Энергия Еп принимает лишь определённые дискретные значения, т.е. квантуется.
Уровень энергии – квантованное значение энергии Еп.
Собственная волновая функция, соответствующая собственному значению энергии:
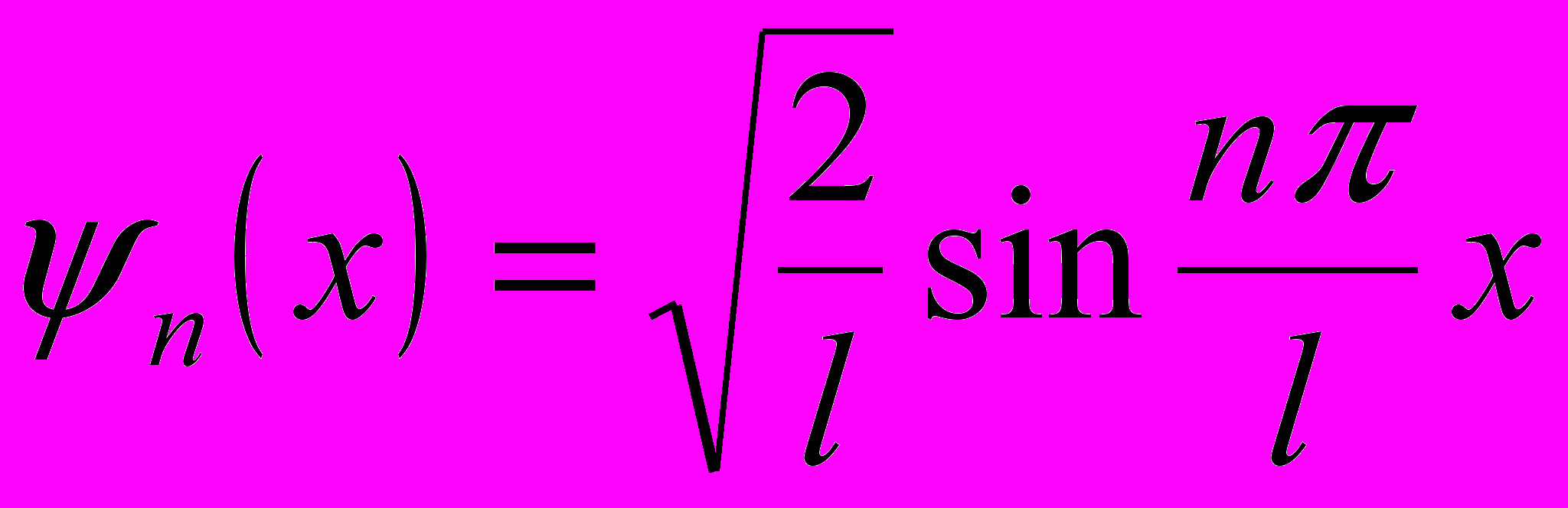
где n = 1,2,3, ….
Потенциальная энергия взаимодействия электрона с ядром в водородоподобном атоме:
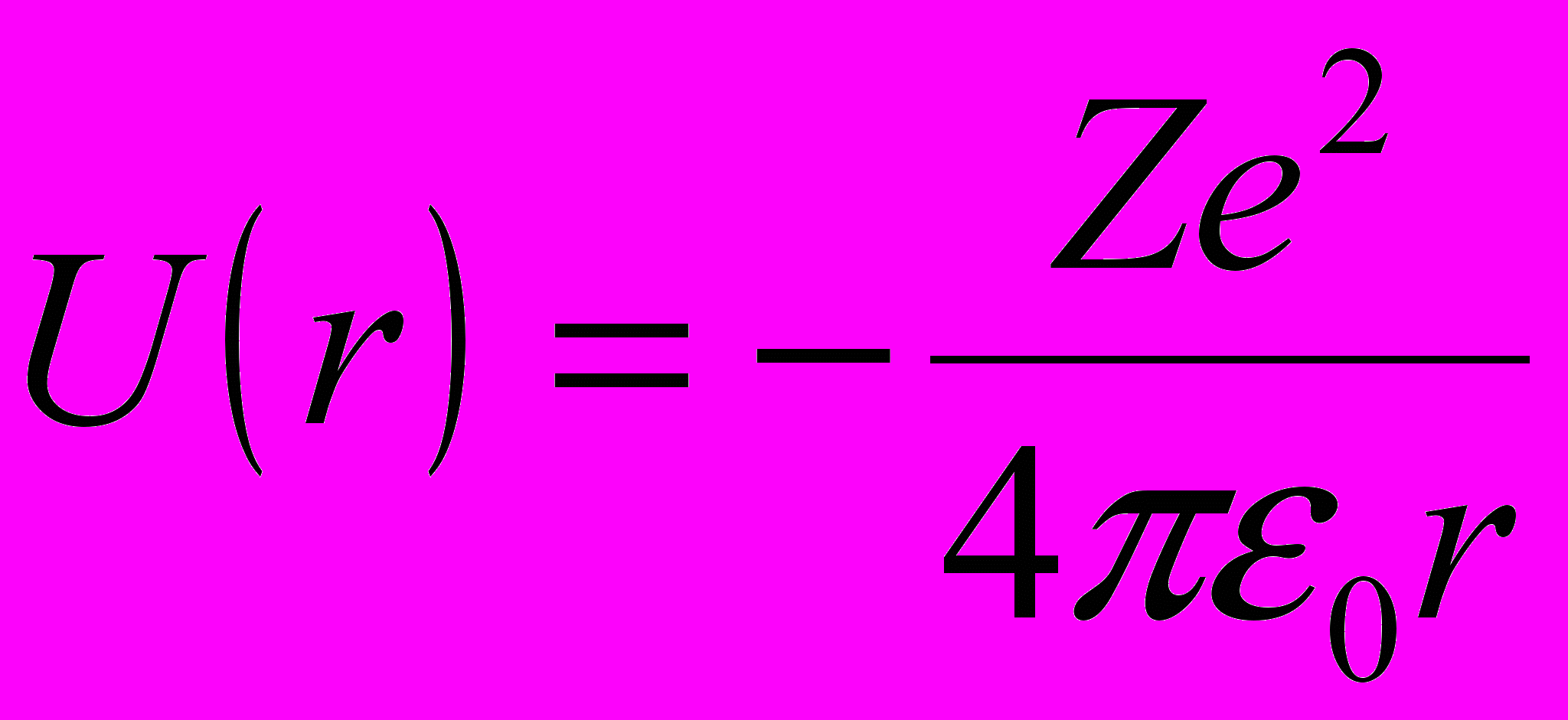
где r – расстояние между электроном и ядром; Z – порядковый номер элемента; ε0 – электрическая постоянная.
Уравнение Шредингера для стационарных состояний электрона водородоподобного атома:
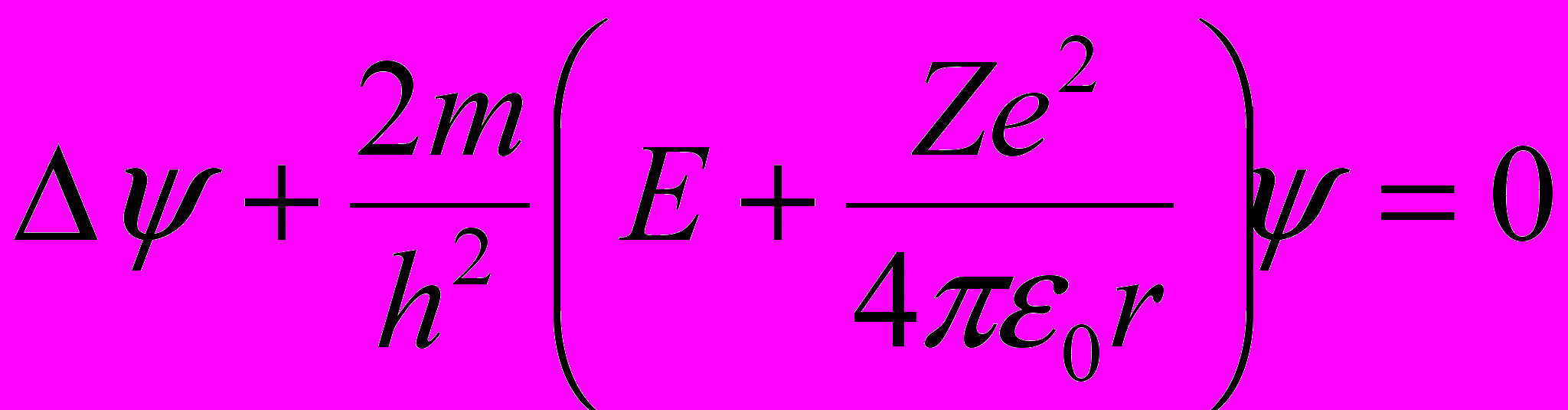
где m – масса электрона; ψ – волновая функция, описывающая состояние электрона; Е – полная энергия электрона в атоме.
Собственная энергия электрона водородоподобного атома:
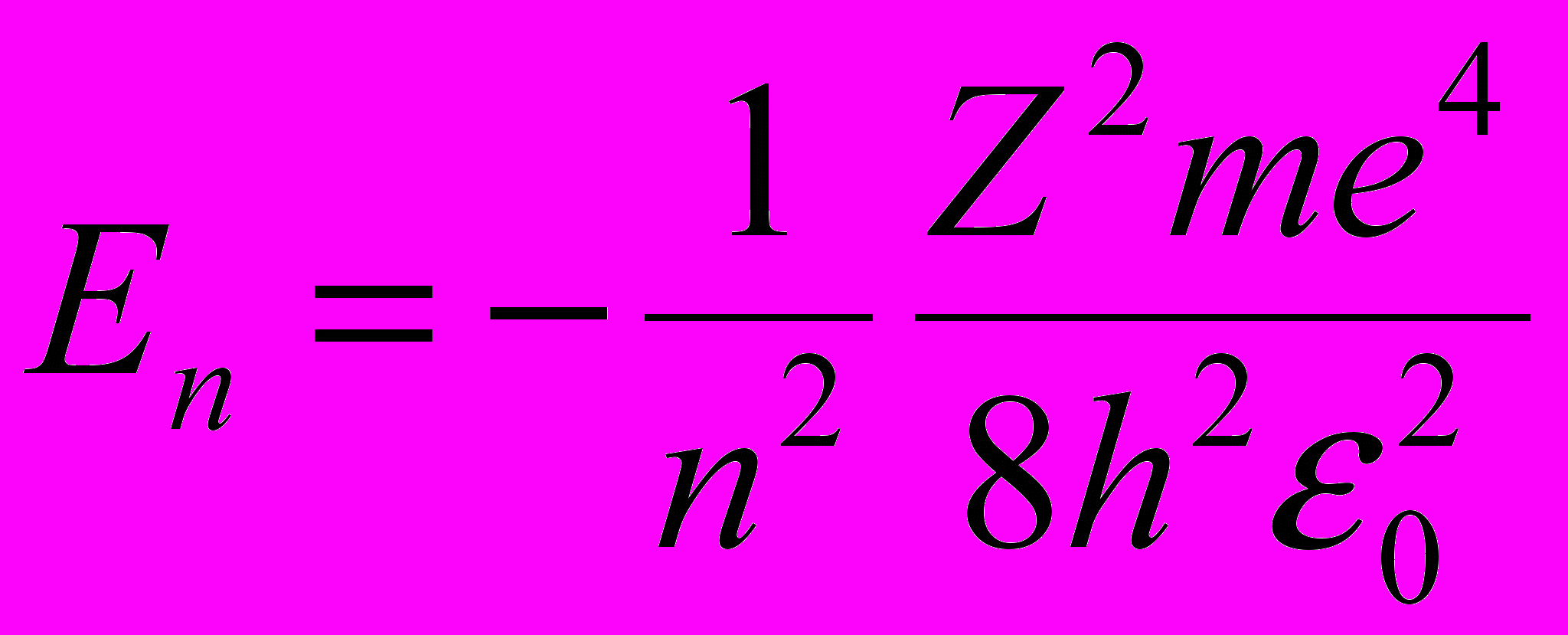
где n = 1,2,3, ….
Главное квантовое число – квантовое число, определяющее энергетические уровни электрона в атоме. Может принимать любые целочисленные значения, начиная с единицы:
п = 1,2,3, …
Энергия ионизации атома водорода:
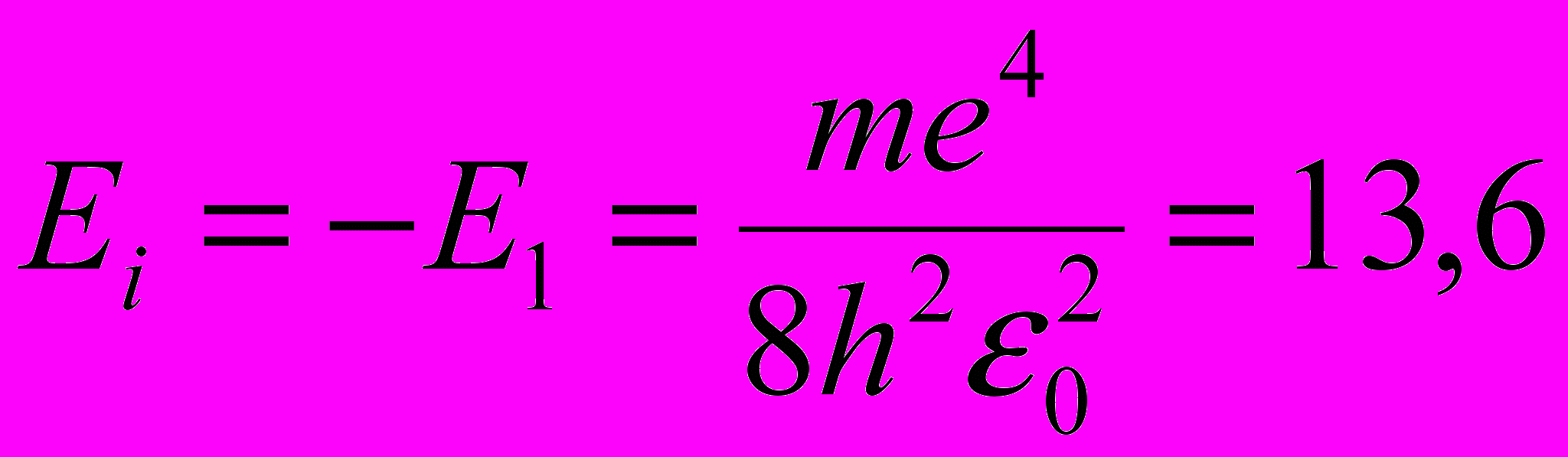 эВ
эВОрбитальное квантовое число – квантовое число, определяющее момент импульса электрона в атоме. При заданном п принимает значения l = 0,1, …, (п – 1), т.е. всего п значений:
l = 0,1, …, п –1
Момент импульса электрона (механический орбитальный момент:
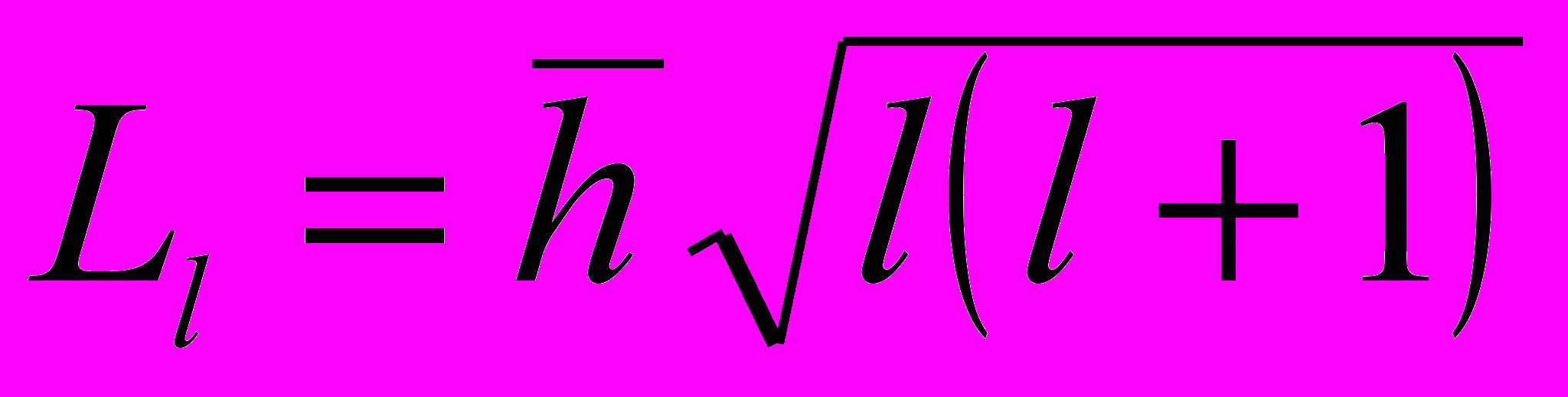
где l – орбитальное квантовое число.
Магнитное квантовое число – квантовое число, определяющее момент импульса электрона на заданное направление. При заданном l принимает значения ml = 0, ±1, ±2, …±l, т.е. всего (2l + 1) значений.
Проекция момента импульса на направление z внешнего магнитного поля:
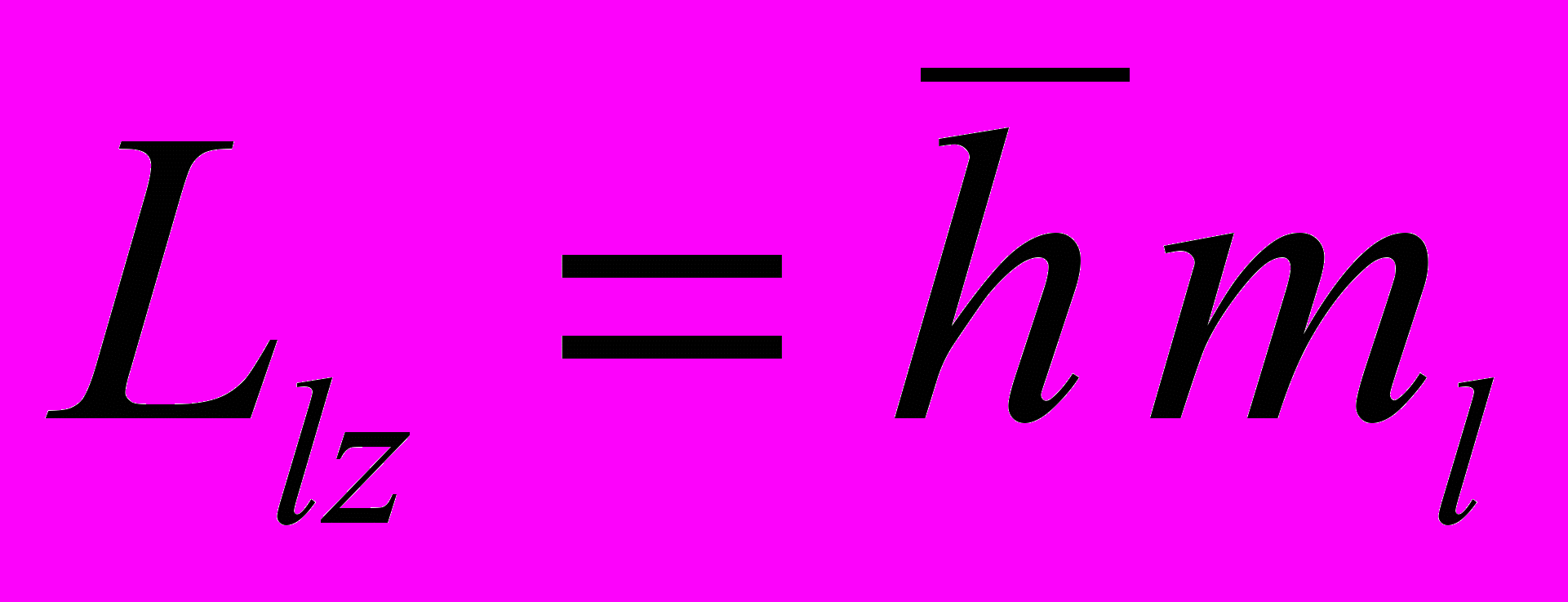
где ml –магнитное квантовое число.
