Методические указания и контрольные задания по физике для слушателей второго курса фзо москва 2004
| Вид материала | Методические указания |
- Методические указания к изучению курса и контрольные задания (для студентов строительных, 1247.25kb.
- Методические указания и контрольные задания по английскому языку для студентов II курса, 375.13kb.
- Программа, методические указания и контрольные задания для студентов 5 курса заочного, 2134.85kb.
- Программа, методические указания и контрольные задания для студентов 5 курса заочного, 439.54kb.
- Методические указания и контрольные задания по английскому языку орёл 2009, 222.99kb.
- Программа, методические указания и контрольные задания по дисциплине концепции современного, 717.75kb.
- Программа, методические указания и контрольные задания по учебной дисциплине «риторика», 1732.52kb.
- Учебные программы, Методические указания и контрольные задания по английскому, немецкому,, 1007.85kb.
- Методические указания и контрольные задания для студентов заочной формы обучения Составитель:, 672.87kb.
- Методические рекомендации и контрольные задания для студентов второго курса заочного, 417.72kb.
Комптоновская длина волны:
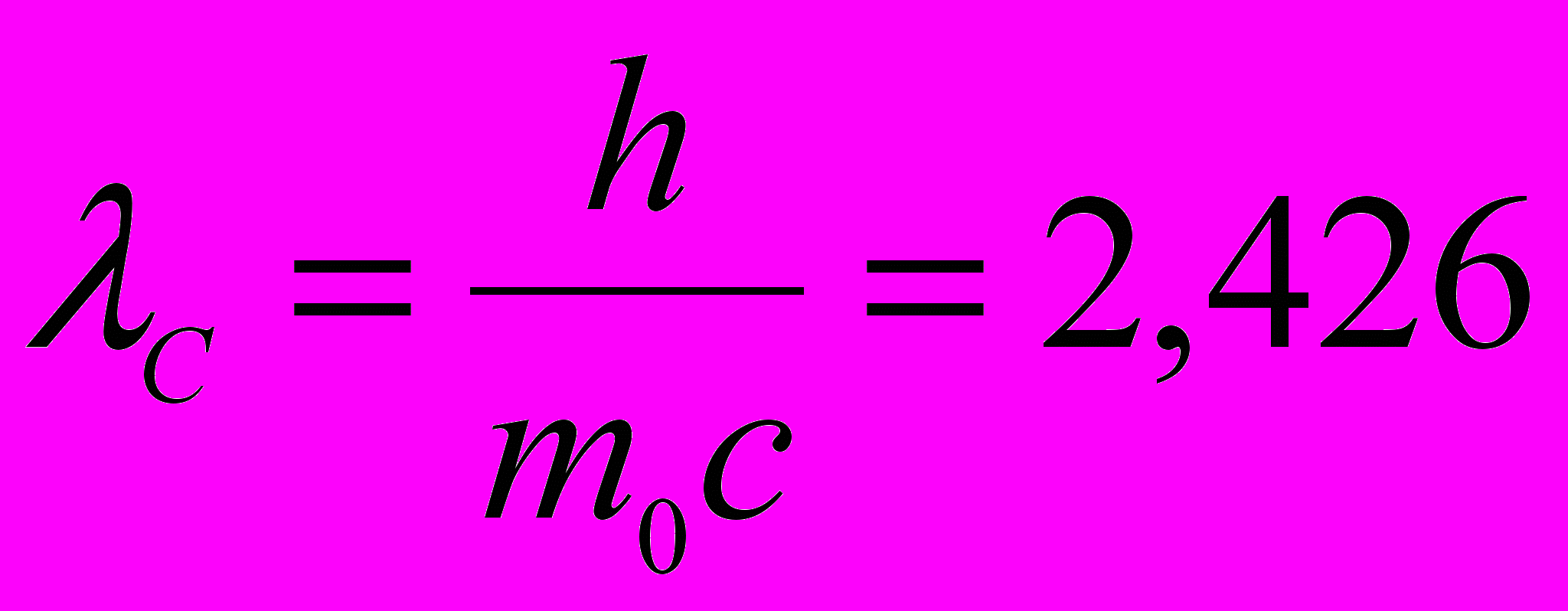 пм
пмОбобщённая формула Бальмера, описывающая серии в спектре атома водорода:
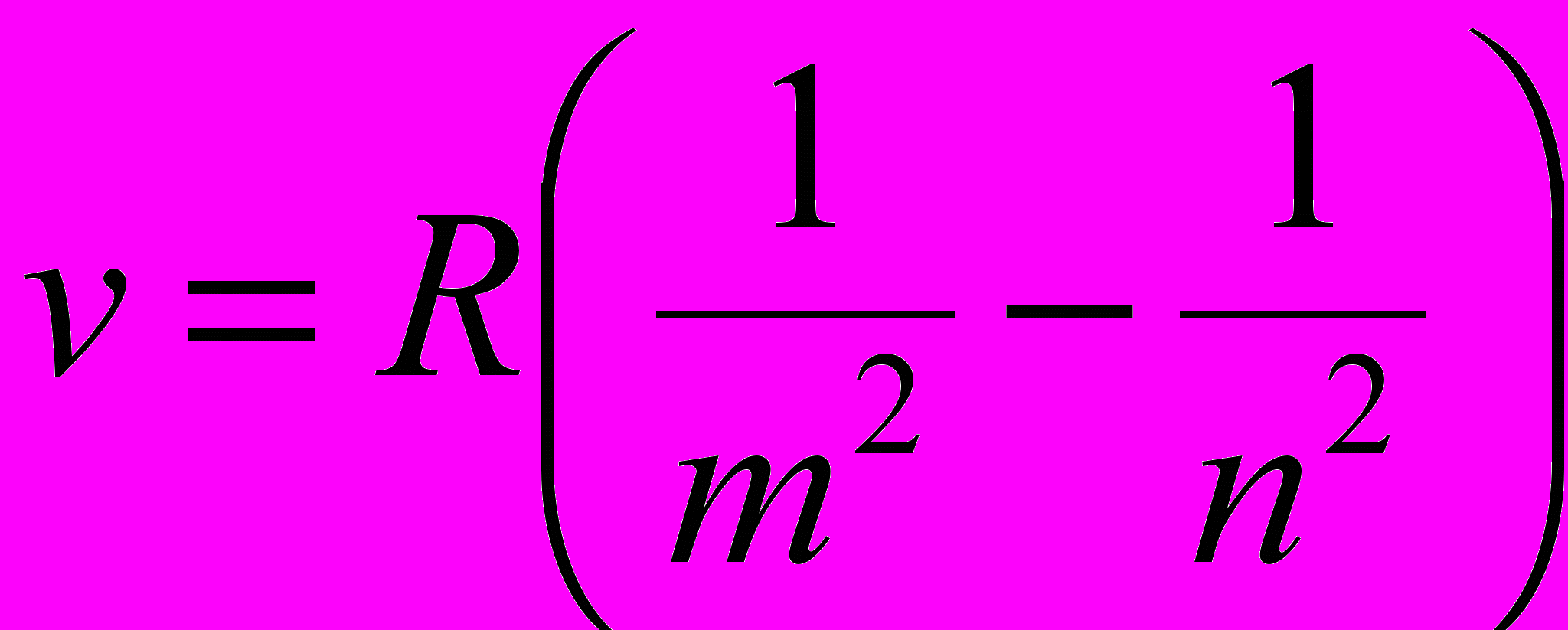
где v – частота спектральных линий в спектре атома водорода; R – постоянная Ридберга; m определяет серию (m = 1,2,3, …); п – определяет отдельные линии соответствующей серии (п = m + 1, m +2, …); m = 1 (серия Лаймана), m = 2 (серия Бальмера), m = 3 (серия Пашена), m = 4 (серия Брэкета), m = 5 (серия Пфунда), m = 6 (серия Хэмфри).
Постоянная Ридберга:
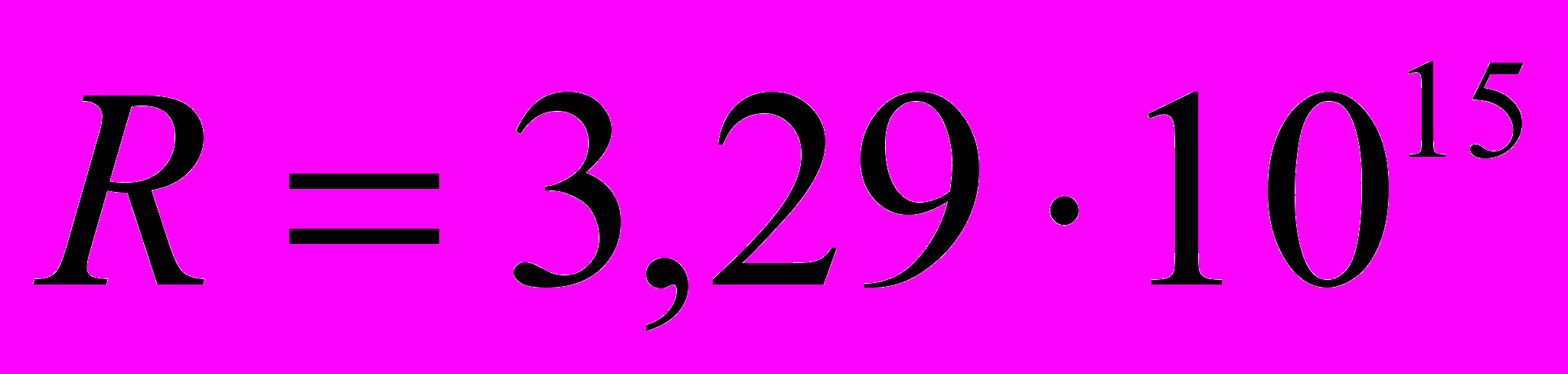 с-1
с-1Первый постулат Бора (постулат стационарных состояний): в атоме существуют стационарные (не изменяющиеся со временем) состояния, в которых он не излучает энергию.
В стационарном состоянии атома электрон, двигаясь по круговой орбите, имеет дискретные квантованные значения момента импульса:
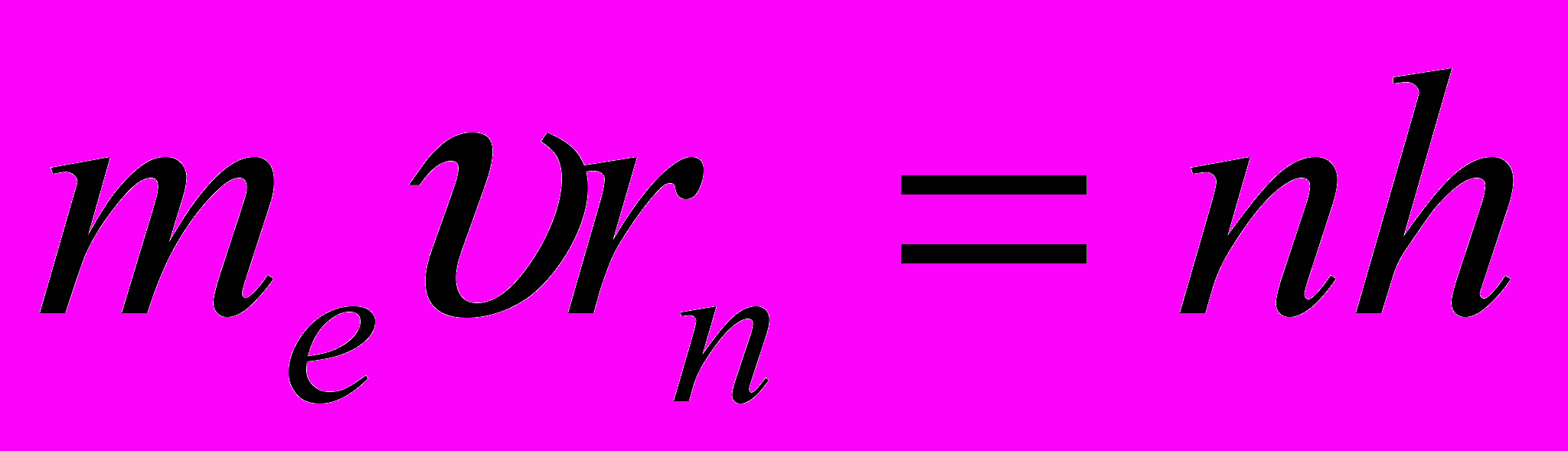
где me – масса электрона, υ – его скорость на п – й орбите радиуса rп, h = h / (2π) (п = 1,2,3, …).
Второй постулат Бора (правило частот): при переходе электрона с одной стационарной орбиты на другую излучается (поглощается) один фотон с энергией, равной разности энергий соответствующих стационарных состояний:
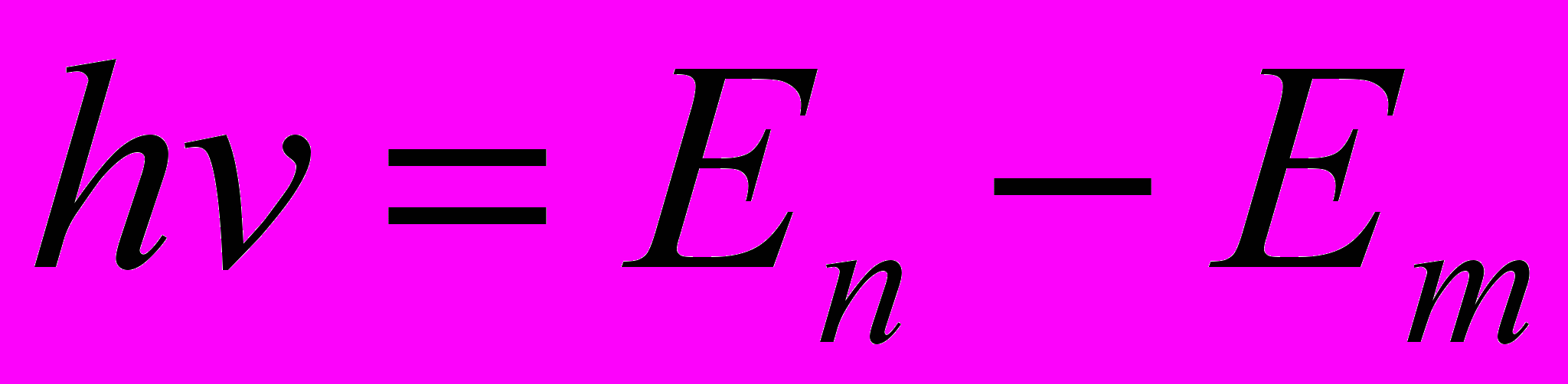
где En и Em – соответственно энергия стационарного состояния атома до и после излучения (поглощения).
Радиус n – й стационарной орбиты:
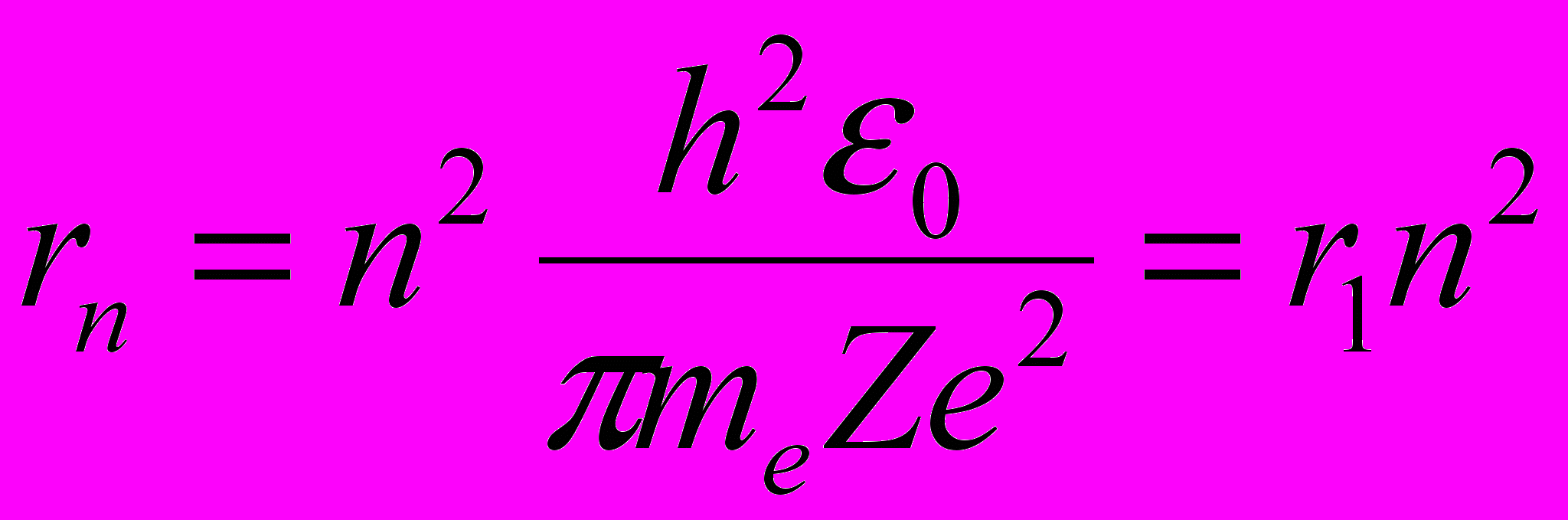
где n = 1,2,3, ….
Первый боровский радиус:
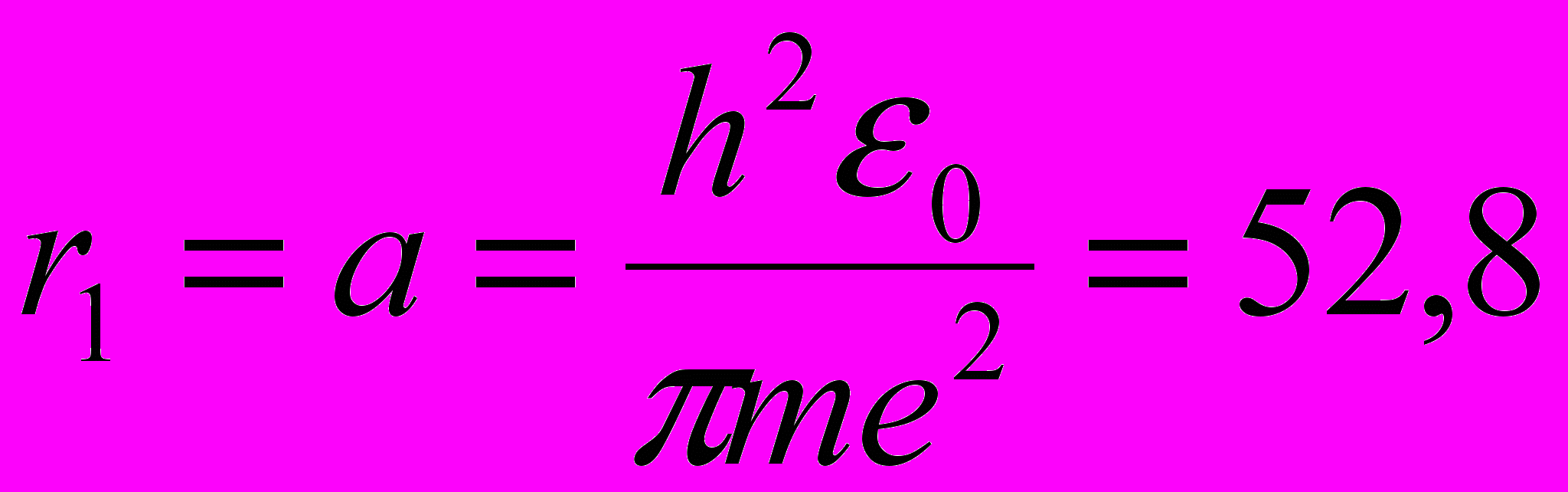 пм
пмЭнергия электрона на n – й стационарной орбите:
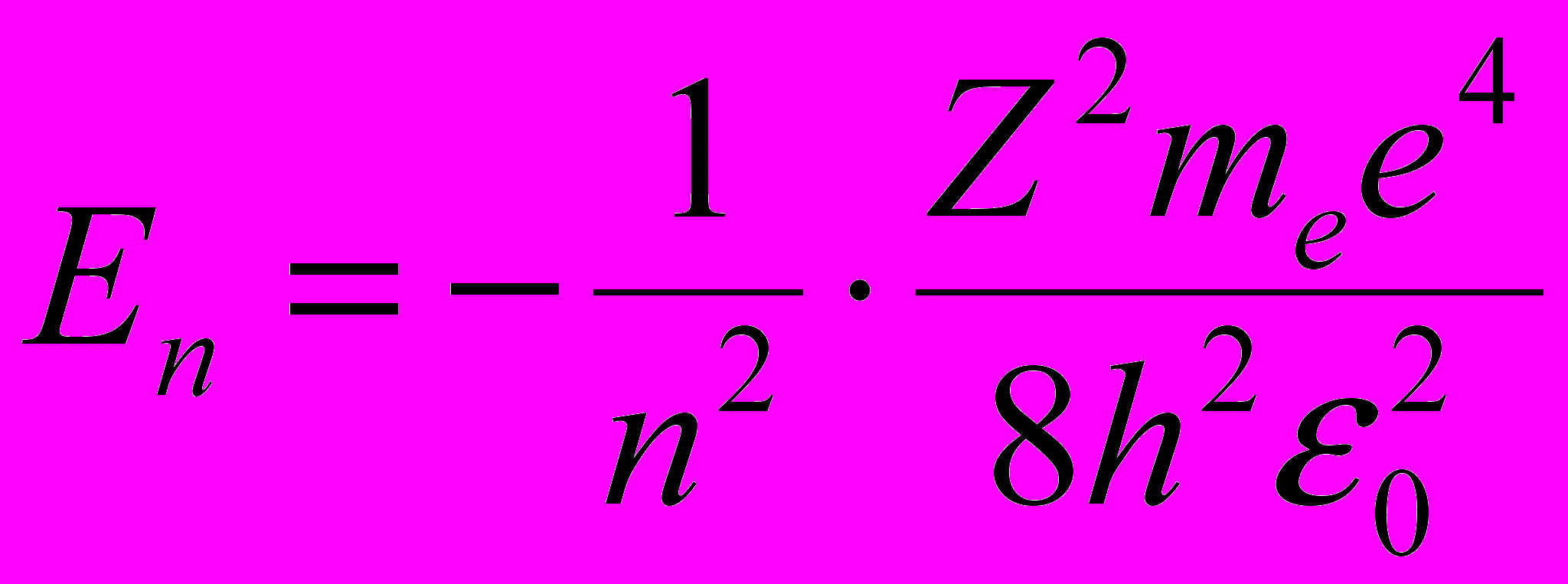
где Z – порядковый номер элемента в системе Менделеева; ε0 – электрическая постоянная; п = 1,2,3, ….
Главное квантовое число п – число, определяющее энергетические уровни атома.
Основное (нормальное) состояние – энергетическое состояние с п=1.
Возбуждённое состояние – энергетическое состояние с n > 1.
Основной (нормальный) уровень – энергетический уровень, соответствующий основному состоянию атома.
Гипотеза де Бройля: с каждым микрообъектом связываются, с одной стороны, корпускулярные характеристики – энергия Е и импульс р, а с другой – волновые характеристики – частота ν и длина волны λ.
Дебройлевская длина волны частицы:

где р – импульс частицы.
Фазовая скорость частицы массой m, свободно движущейся со скоростью υ:
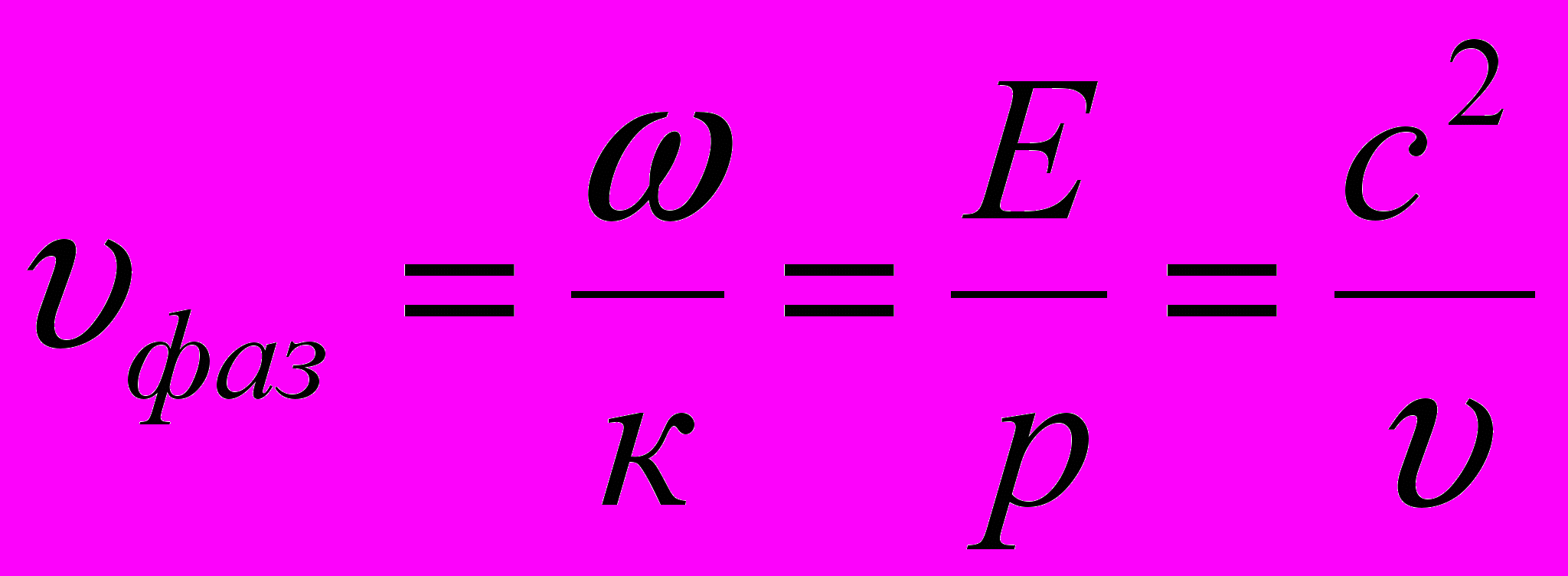
где E = hω – энергия частицы (ω – круговая частота); p = hk – импульс (к = 2π/λ – волновое число).
Групповая скорость свободно движущейся частицы:
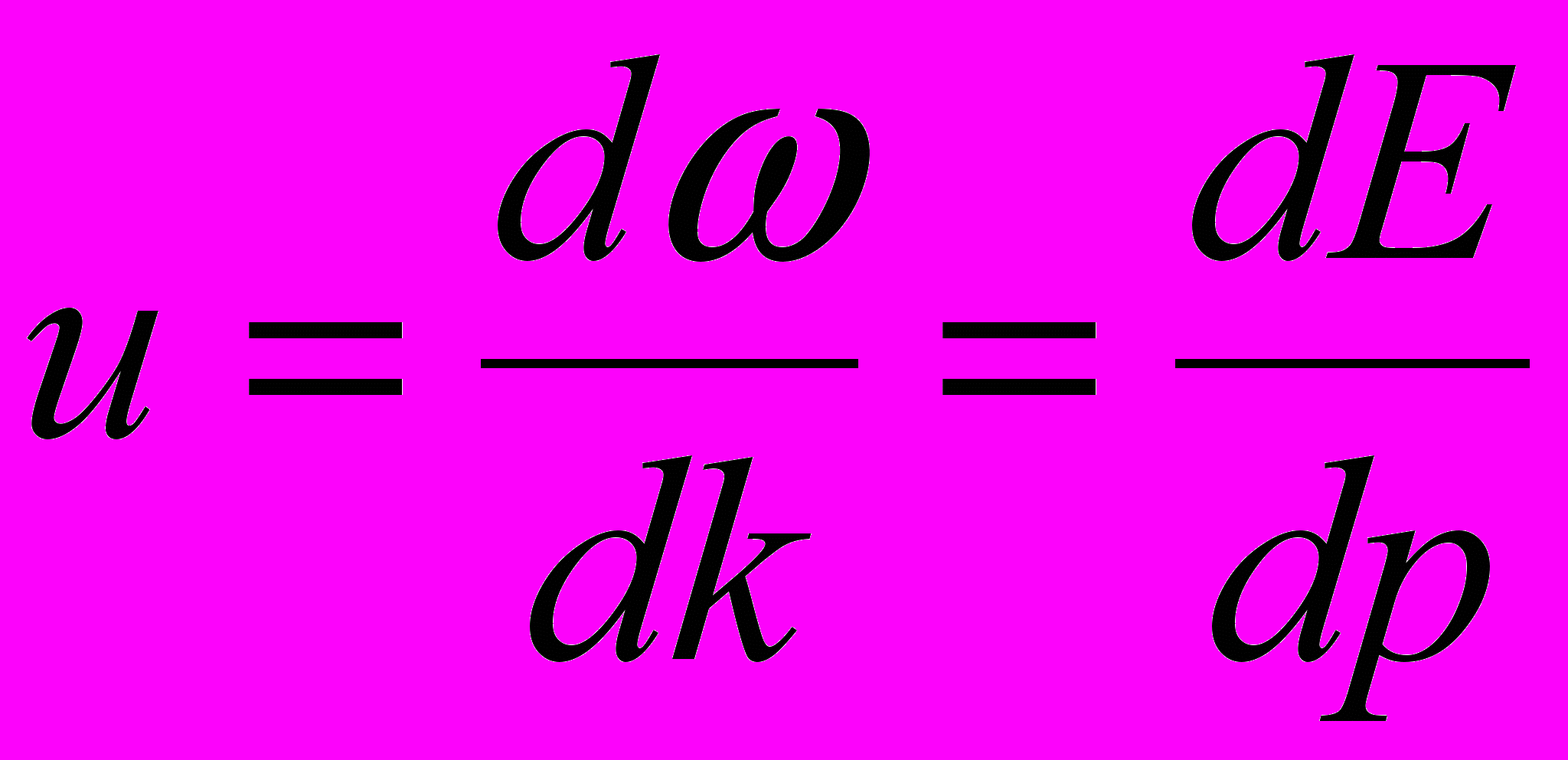
Соотношения неопределённостей: для координаты и импульса частицы:

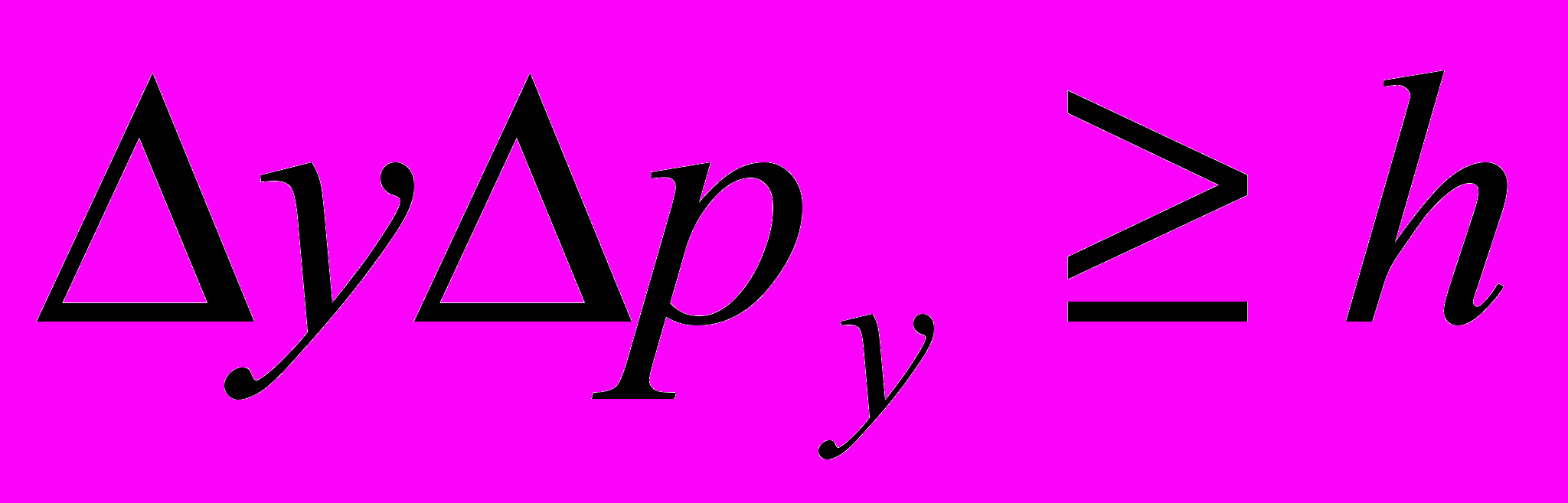
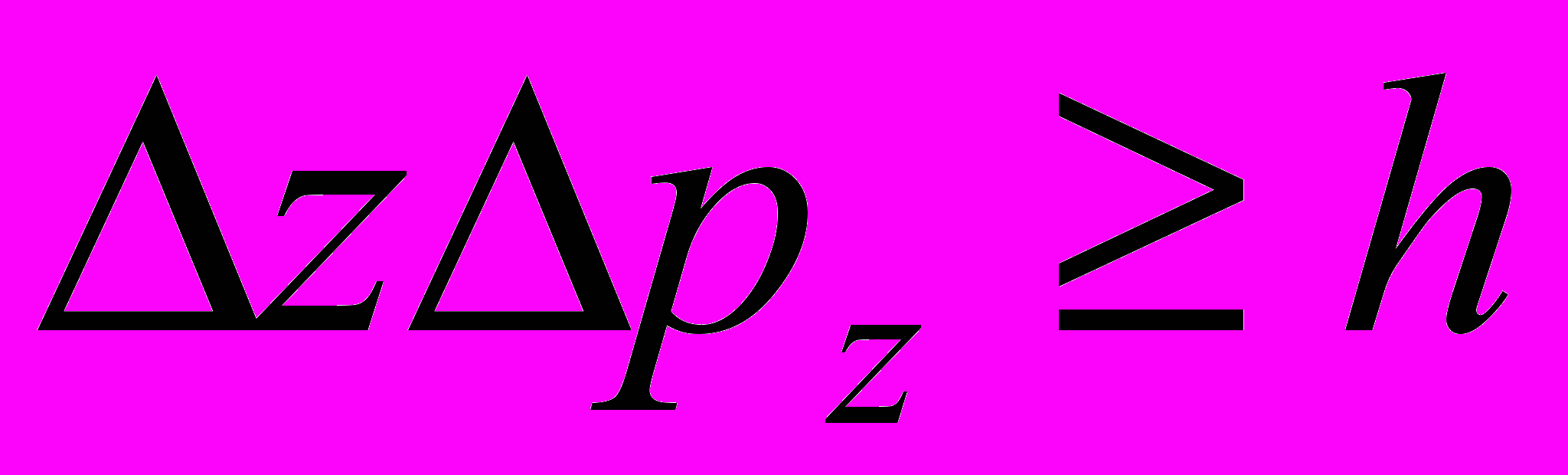
где Δх, Δу, Δz - неопределённости координат; Δрх, Δру, Δрz – неопределённости соответствующих проекций импульса частицы на оси координат;
для энергии и времени:
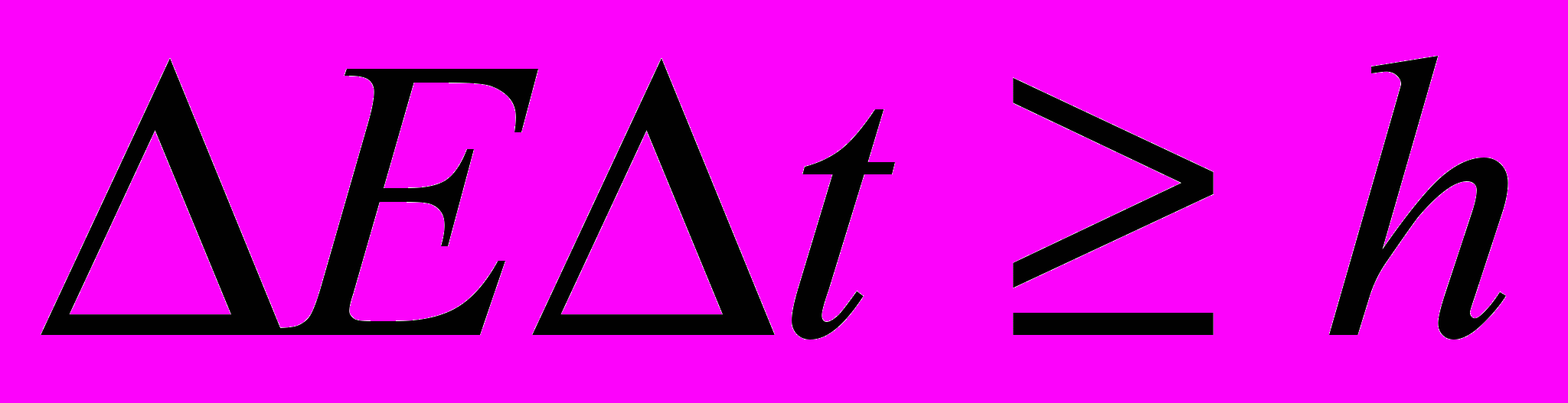
Δ Е – неопределённость энергии данного квантового состояния; Δt – время пребывания системы в данном состоянии.
Вероятность нахождения частицы в объёме dV:
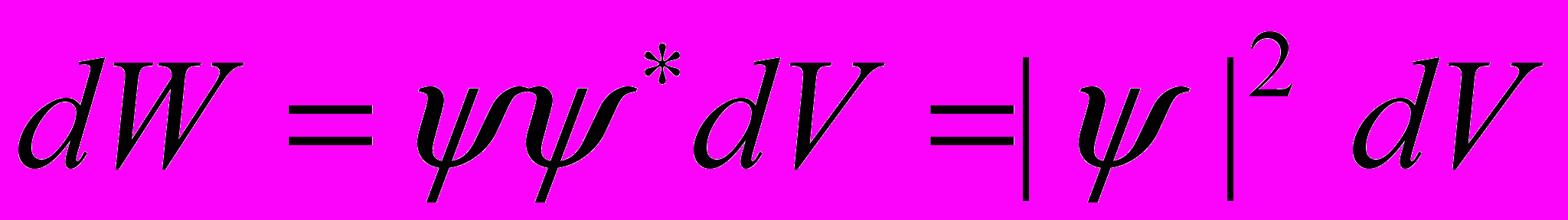
где ψ = ψ (х, у, z, t) – волновая функция, описывающая состояние частицы; ψ* - функция, комплексно сопряжённая с ψ; |ψ|2 = ψ ψ* - квадрат модуля волновой функции.
Плотность вероятности – вероятность нахождения частицы в окрестности точки с координатами х, у, z:

Квадрат модуля волновой функции задаёт интенсивность волн де Бройля.
