Методическая разработка по химии Подгруппа азота
| Вид материала | Методическая разработка |
СодержаниеЭтапы урока Этапы урока Этапы урока Лабораторный опыт. Демонстрационный опыт № 1 Лабораторный опыт. Демонстрационный опыт. |
- Тесты для классов компенсирующего обучения (кко) задание к тесту, 41.19kb.
- Муниципальное Образовательное Учреждение лицей №23 г. Сочи методическая разработка, 233.75kb.
- Дубская Наталья Александровна Челябинск методическая разработка, 101.6kb.
- Учитель Тарачкова Екатерина Владимировна методическая разработка, 107.93kb.
- Разработка программы и определение методики изучения загрязнения почв при использовании, 202.22kb.
- Методическая разработка на тему, 461.38kb.
- Тема урока: Общая характеристика элементов подгруппы азота. Свойства азота, 85.69kb.
- Пояснительная записка. Методическая разработка на тему: «Профессиональная направленность, 187.77kb.
- Пояснительная записка к уроку, 108.58kb.
- Богдановой Татьяны Александровны. Псков, 2010. Уважаемые студенты! Данная методическая, 564.44kb.
Назарова Елена Викторовна МОУ «СОШ № 114 с углубленным изучением
отдельных предметов (математики)» Барнаул
МОУ «Средняя общеобразовательная школа № 114
с углубленным изучением отдельных предметов (математики)»
Методическая разработка по химии
Подгруппа азота
(3 урока)
Выполнила:
учитель химии
Назарова
Елена Викторовна
Барнаул
2011
Пояснительная записка.
Познавательная компетентность является ключевой компетентностью, поэтому ее формирование обеспечивает основу познавательной деятельности. В рамках каждого предмета формирование ключевых компетентностей имеет свои особенности. Химия, как естественнонаучная дисциплина, дает благодатную возможность создания особого пространства учебной деятельности, в котором ученик способен
- совершать переоткрытие (то есть самостоятельное открытие или с помощью учителя) явления, установление закономерности, закона;
- осваивать научный способ познания (через организацию теоретического и экспериментального исследования, проведение лабораторных и демонстрационных опытов, практических работ);
- осознавать механизм приобретения новых знаний о действительности, формируя тем самым понимание научной картины мира.
Поэтому в ходе индивидуальной работы над методической темой «Использование исследовательских методов в обучении учащихся», мною была поставлена цель:
раскрытие возможностей содержания программы по химии, способствующих эффективному формированию у школьников системы научных знаний о химической составляющей естественно-научной картины мира, важнейших химических понятиях, законах и теориях, обеспечивающих овладение умениями применять полученные знания для объяснения разнообразных химических явлений и свойств веществ; развитие познавательных интересов и интеллектуальных способностей в процессе самостоятельного приобретения химических знаний с использованием различных источников информации, то есть формирование познавательной компетентности.
Компетентность проявляется при решении задач жизненной практики, поэтому, содержание учебного материала занятий «прорастает» из реальных ситуаций, проблемами. Например, в предложенных уроках используются отрывки из художественных произведений, где их авторами допущены химические ошибки. Несоответствие текста жизненному опыту учащихся и их теоретическим знаниям по химии, возбуждают интерес к химической составляющей описанной ситуации. Учитель, закручивая учебную интригу, подталкивает учеников к рассуждению, привлекая при этом ранее сформированные знания. Например, в уроке «Аммиак» диалог начинается после прочтения небольшого отрывка из повести Н. Огнева «Дневник Коли Рябцева». Апеллируя к жизненному опыту, удается вывести учащихся на самостоятельную формулировку темы и перспективы ее разворачивания.
Так реализуется этап актуализации знаний, происходит подготовка к восприятию проблемы.
Начало эффективного мышления возможно, если актуализированы знания, которые необходимы для того, чтобы учащиеся могли в дальнейшем решить проблему.
Так, в уроке «Положение элементов подгруппы азота в ПСХЭ. Строение их атомов. Азот. Физические свойства» учащиеся дают характеристику подгруппы азота по плану, исходя из положения в ПСХЭ и строения атомов, обосновывают изменение физических свойств простых веществ, образованных элементами подгруппы азота, сопоставляют различные точки зрения, делают выводы. Через электронное строение атома, механизм образования связи в молекуле простого вещества, тип кристаллической решётки прогнозируются физические свойства простого вещества азота, которые подтверждаются демонстрационным экспериментом и жизненным опытом учащихся. В ходе диалога развивается умение устанавливать причинно-следственные связи, сопоставлять различные точки зрения, делать выводы. Формируется познавательная компетентность через опыт выдвижения и обоснования гипотез, прогнозирования результата.
Развитие этого диалога продолжается в уроке «Химические свойства азота». Химические свойства азота как простого вещества рассматриваются, исходя из двух предпосылок:
- строения атома азота, предопределяющего положение азота в шкале электроотрицательности, от которого зависят особенности реакций соединения азота с более чем он сам, электроотрицательным элементом кислородом и с наиболее электроположительными элементами – металлами и водородом;
- строения молекулы азота, определяющего проявление азотом химической активности лишь при очень высоких температурах.
И опять под руководством учителя учащиеся выдвигают и обосновывают гипотезы, пытаются предвидеть результат, опираясь на ранее изученный материал. Через эксперимент выясняют оптимальные условия для протекания изучаемых реакций, анализируют, учатся аргументировать, выбирать оптимальное решение. Совершенствуется умение составлять уравнения химических реакций в свете представления об окислительно-восстановительных реакциях.
Если проблема возникает на неподготовленной почве, то потребности ее решить не возникает – не устанавливаются ассоциативные связи с изученным, нет необходимости ставить перед собой цель обучения. Цель в этом случае возникает естественным образом, становится конкретной, а процесс целеполагания переходит из внешнего во внутренний. В предлагаемых уроках актуализация знаний позволяет не только мотивировать учащихся, но начать логическую последовательность усвоения материала, так как учащиеся далее строят план достижения цели.
Формулировки пунктов плана задают не только последовательность действий и направление движения, но и результат, поэтому их исполнение легко диагностируется.
Чтобы учащийся приобретал не сумму знаний, а осваивал комплексное умение, в котором кристаллизуется модель процесса познания, создаются условия для проявления этого комплексного умения по открытию знания и процессам его преобразования. Так, при теоретическом исследовании вопроса о влиянии строения атома, молекулы, вида химической связи и типа кристаллической решётки на свойства вещества в уроках «Положение элементов подгруппы азота в периодической системе химических элементов Д.И.Менделеева. Строение их атомов. Азот. Физические свойства азота», «Химические свойства азота» для этого используются специальные компетентностно-ориентированные задания.
Например, учебная ситуация: «процесс растворения аммиака в воде - физический или химический?» в уроке «Аммиак»:
- создает Стимул, который погружает в контекст ситуации и мотивирует на ее разрешение;
- точно указывает на деятельность учащегося, необходимую для разрешения ситуации;
- содержит необходимую информацию и указание на уже присвоенную ранее информацию для успешной деятельности учащегося по разрешению ситуации;
- задает структуру предъявления учащимися результата своей деятельности по разрешению ситуации.
Постановка проблемной ситуации выполняет две задачи: усиливает мотивацию деятельности и запускает механизм простраивания учащимися сложной цепи осмыслений и переосмыслений объяснения изменения окраски фенолфталеина в растворе аммиака и электропроводности раствора аммиака, запаха раствора аммиака, донорно-акцепторный механизм образования ковалентной связи, и, наконец, самого себя, своих возможностей и личностных смыслов в познавательном процессе.
В уроке «Химические свойства азота» проблемная ситуация возникает из поиска причин: «почему такая простая реакция N2 + 3H2 = 2NH3, если судить по уравнению реакции, не давалась в руки химикам на протяжении всего XIX века?». Учащиеся сталкиваются с противоречием и формулируют проблему. Это самый ответственный и сложный этап урока. Учащийся должен осознать причину этого затруднения, поэтому проблема должна быть посильной (у учащихся есть для ее разрешения определённые теоретические знания). Если они не могут подобрать оптимальные слова, то надо услышать от них необходимый смысл, а сформулировать можно и помочь.
Выход из проблемной ситуации проходит в несколько шагов:
- выдвижения гипотез, их обсуждение и выбор одной, наиболее вероятной, гипотезы. Учитель должен так вести диалог, чтобы ученики сами оставили плодотворную гипотезу.
- проверка гипотезы осуществляется (по возможности), практикой, то есть ученики приступают к самому интересному и самому сложному – эксперименту, где подтверждают или опровергают предложенное выше решение.
- далее подводится теоретическое обоснование практических результатов.
Субъект-субъектные отношения формируются благодаря расстановке ролевых акцентов и учебному диалогу (полилогу).
Учебная деятельность строится таким образом, что учитель инициирует условия для самостоятельной деятельности учащихся по освоению учебного материала и далее ученик может оказаться лаборантом, консультантом, ученым-теоретиком, что дает возможность формирования у него ценностно-смысловых компетенций. Благодаря осознанию своей роли на уроке (я – открыватель, я – обоснователь, я – исследователь…) учащиеся приобретают умение выбирать целевые и смысловые установки своих учебных действий, принимать решение, что в свою очередь формирует механизм самоопределения в любой учебной ситуации (не обязательно на уроке химии).
Диалог (полилог) направляет активность ученика на учебный материал – он питает мотивацию в течение всего урока. В диалоге формулируются и решаются учебные проблемы, предъявляется собственное мнение, преподносится позиции в отношении предмета обсуждения.
Поскольку учащимся 9 класса трудно оценивать себя с точки зрения компетентностного подхода, то при оценке и рефлексии учащиеся ориентируются, прежде всего, на оценку сформированности ОУУН, связанных с проявлением познавательной компетенции. Рефлексия учебного занятия позволяет увидеть, как оценивают учащиеся то, чему, каким действиям и обобщённым умениям они научились или учатся. Это могут быть высказывания типа
а) «Я хотел разобраться, попробовать свои силы и у меня получилось… , (наличие у ученика положительного мотива к деятельности),
б) «Я сам сформулировал, открыл, получил результат опыта, ...» (эмоциональное переживание учащимися субъективного опыта – открытия)
в) «Я наконец-то написал уравнение …, так как понял, как надо распределять …» (наличие у учащихся положительных изменений обученности и подкрепление их в эмоционально-волевой сфере – «мне так понравилось …»).
г) «Я никак не понимал, почему у Вани-Пети-Маши все всегда получается, а теперь понял, что надо думать вместе со всеми» - осознание личной и коллективной ценности.
Таким образом, в уроке каждый ученик участвует в
- постановке частных целей учебной работы, в планировании этой работы;
- непосредственном получении (раскрытии, изобретении) нового знания;
- учете и оценке своей учебной работы и работы учащихся, и далее всей совместно выполненной деятельности;
- общем деле (со своими правами и ответственностью), а не играет роль стороннего наблюдателя за деятельностью учителя.
Таким образом, особенностью уроков является формирование познавательной компетентности через деятельность, которая предполагает:
- выражение целей через планируемые результаты;
- освоение предметного содержания обучения через формирование готовности применять и преобразовывать знания в ходе решения специальных ситуаций;
- получение практико-ориентированного и личностно-значимого результата;
- рефлексию и оценку через проявление личной позиции ученика.
Уроки написаны под УМК Кузнецовой Н.Е. Химия, 9 класс.
Для корректного воспроизведения формул и уравнений реакций необходима программа MathType.
Урок № 1.
Тема урока: Положение элементов подгруппы азота в периодической системе химических элементов Д.И.Менделеева. Строение их атомов. Азот. Физические свойства азота.
Тип урока: Урок изучения нового материала.
Цели урока:
Образовательные:
- создание условий для систематизации знаний о строении атомов, видах химической связи, типах кристаллических решёток на примере элементов V группы главной подгруппы.
- создание условий для исследования строения молекулы азота, его физических свойств.
- продолжить формирование умений выявлять существенные признаки при характеристике химических элементов, простых веществ.
Развивающая:
создание условий для развития общеучебных умений и навыков: сравнение, обобщение, выстраивание причинно-следственных связей на основе строения вещества, умение делать выводы
Воспитательная:
- создание условий для формирования исследовательской культуры;
- создание условий для формирования культуры диалога.
Оборудование:
На демонстрационном столе – лабораторный штатив, спиртовка, спички, прибор для получения азота в лаборатории, состоящий из воронки, колбы-реактора, газоотводной трубки, подводящей азот к газометру.
Реактивы: насыщенные растворы нитрита натрия, хлорида аммония; известковая вода.
| Этапы урока | Деятельность учителя | Деятельность учащихся | Результат |
| Проверка готовности класса к уроку, приветствие учащихся. | Подготовка к уроку рабочего места: учебник, тетрадь, дневник, пишущие принадлежности; приветствие учителя. | Подготовка класса к уроку |
Цель: создание условий для формирования цели урока с помощью актуализации необходимых знаний | Освоив периодический закон и строение вещества, мы приступили к изучению химии элементов. Семейства каких элементов Вам знакомы? | Галогены, халькогены. | Сформулирована цель урока. Осознание темы и цели урока учащимися. |
| И ещё ранее получили представление об инертных газах. Что объединяет эти элементы? | Относятся к неметаллам. | | |
| По каким признакам эти элементы относят к неметаллам? | По строению атома, у них на внешнем энергетическом уровне до завершения не хватает 1,2 электронов (у галогенов-1, у халькогенов-2). | | |
| В изучении химии элементов мы «движемся по периодической системе справа налево», и какая группа на нашем пути? | Пятая. Значит, мы приступаем к изучению элементов V группы. | | |
Цель: создать условия для формирования умения планировать собственную учебную деятельность. | Давайте вспомним, по какому плану мы изучали галогены и халькогены, и попробуем определить круг вопросов, которые предстоит рассмотреть. (на доске записываю предложения учащихся) | 1.Общая характеристика подгруппы азота по положению в периодической системе. 2.Химический элемент и простое Вещество азот. 3.Физические свойства азота. 4.Химические свойства азота. 5.Получение азота. 6.Применение азота. 7.Важнейшие соединения азота. | Составили план своей деятельности. |
4.1 Цель: Создать условия для систематизации знаний о строении атомов, видах химической связи, типах кристаллических решёток на примере элементов V группы главной подгруппы. | Молодцы! Вы охватили всё, и нам потребуется несколько уроков, чтобы реализовать этот план. А сегодня давайте рассмотрим первые три пункта. Согласны? Итак, рассматриваем первый вопрос. На какие вопросы нужно ответить, чтобы дать характеристику подгруппы азота? | -Какие элементы образуют подгруппу? -Номер группы, подгруппа? -Число электронов на внешнем энергетическом уровне? -Электронная формула внешнего энергетического уровня? -Возможные валентности и степени окисления? -Формула высшего оксида, его характер? -Каким будет гидроксид? -Существует ли летучее водородное соединение? -Как изменяются сверху вниз Радиусы атомов; Электроотрицательность; Металлические свойства? -Как это отразится на свойствах веществ? | |
| | С соседом по парте обсудите эти вопросы и приготовьтесь дать характеристику подгруппы азота по положению в ПСХЭ. Возможен другой вариант (выбор за детьми): мы слушаем ответ ученика и задаём уточняющие вопросы. | Дети работают в парах. Спустя несколько минут, используя принцип эстафеты (один ученик начинает, следующий подхватывает…), заслушиваем характеристику. | |
| | Давайте обратимся к таблице19 на странице 101 «Электронное строение и свойства элементов подгруппы азота» и сравним: соответствуют ли наши выводы тем закономерностям, которые отражены в этой таблице? (к помощи этой таблицы можно прибегнуть в случае затруднений при ответе) | Убеждаются в правильности ответа. | |
| | Исходя из электронного строения и свойств элементов, предположите, как будут изменяться физические свойства простых веществ, образованных элементами подгруппы азота? Почему? | Так как сверху вниз возрастают радиусы атомов, металлические свойства, то температуры кипения и плавления будут возрастать. Значит, сурьма и висмут будут твёрдыми веществами, возможно, металлами. Азот-газ, находится в атмосфере. Мышьяк твердый, неметалл, возможно, в незначительной степени, проявляет металлические свойства… | |
| | Давайте сравним наши выводы со справочным материалом: страница 102, таблица 20 «Свойства простых веществ элементов подгруппы азота». | Изучают таблицу, убеждаются в правильности теоретических выводов, сделанных на основании электронного строения атомов и закономерностей изменения свойств химических элементов в ПСХЭ. | Дана общая характеристика подгруппы азота по положению в ПСХЭ. На основании электронного строения атомов и закономерностей изменения свойств химических элементов в ПСХЭ сделаны прогнозы свойств химических элементов и простых веществ, которые успешно подтвердили, используя справочные таблицы. |
| 4.2. Цель: создать условия для теоретического исследования строения молекулы азота | Азот-элемент необыкновенный. Порою кажется, что чем больше мы о нём узнаём, тем непонятнее он становится. Азот практически одновременно был открыт пятью учёными: шотландцем Даниелем Резерфордом, шведом Карлом Шееле, англичанами Джозефом Пристли и Генри Кавендишем, французом Антуаном Лавуазье. Парадоксально, что именно азоту-элементу, имеющему громадное значение для жизнедеятельности растений и организмов,- Лавуазье приписал «безжизненные» свойства. Противоречивость свойств элемента №7 отразилась даже в его названии. Слово «азот» произведено от греческого «а» -отрицание и «зоэ»-жизнь. Современник и соотечественник Лавуазье Ж .Шапталь предложил называть элемент №7 гибридным латино- греческим именем «нитрогениум», что означает «селитру рождающий». Первое название используется в названиях «азотная кислота», «оксиды азота», «азотсодержащие органические соединения», второе в названиях «нитраты», «нитросоединения». В1824году по предложению химика Соловьёва М.Ф. в России вернулись к термину «азот». Обратитесь к ПСХЭ, что Вы можете рассказать об элементе-азоте? Вопросы-помощники в случае затруднений: -положение в ПСХЭ. -строение атома. -строение электронных оболочек атома. -прогноз валентности и возможных степеней Окисления, исходя из строения атома. | Дают характеристику элемента по положению в ПСХЭ. Азот, №7, Аr(N)=14, находится во II периоде, в V группе, главной подгруппе. Строение атома: 7протонов, 7электронов, 7нейтронов.  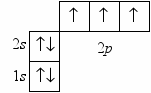 Валентность III, возможные степени окисления -3, 0, +3,+5.Т.к. не имеет d-подуровня, то не имеет возможностей увеличения валентности. Неметалл, высший оксид-N2O5 , кислотный, гидроксид - НNО3-кислота, летучее водородное соединение- NН3 . | |
| Обращаю особое внимание на строение электронной оболочки внешнего энергетического уровня, на наличие 3-х не спаренных электронов, на значение ОЭО. Азот-третий по ОЭО элемент (после фтора и кислорода) Может он существовать в виде одиночных атомов? | Нет, он будет стремиться завершить свой энергетический уровень, образовывать хим. связи с менее электроотрицательными элементами, проявляя при этом отрицательную ст. окисления; и с более электроотрицательными элементами, проявляя при этом положительную ст. окисления. | Прогноз химических свойств. | |
| А возможно ли образование химической связи между двумя атомами азота? | Рассматриваем механизм образования ковалентной неполярной связи в молекуле N2 ,изображаем структурную формулу вещества. | | |
| Что можно сказать о прочности этой молекулы? | Молекула N2 очень прочная, т.к. образована с помощью3-х общих электронных пар и требуется большая энергия, чтобы эту связь разрушить | На основании положения N в ПСХЭ обосновали строение молекулы N2, раскрыли механизм образования связи, прочность молекулы. | |
| А какой тип кристаллической решётки будет Соответствовать? | молекулярная. Следовательно, вещество будет иметь невысокую температуру плавления и кипения. | Прогноз физических свойств. | |
| 4.3 Цель: создать условия для подтверждения теоретических выводов жизненным опытом учащихся. | Исходя из строения атома азота, механизма образования связи в молекуле азота и типа кристаллической решётки, мы предположили, что молекула N2 очень прочная, вещество будет иметь невысокую температуру плавления и кипения. А что Вы знаете о простом веществе-азоте? | Азот входит в состав воздуха-78%, бесцветный, не имеет запаха, малорастворим в воде, не поддерживает горение и дыхание. | |
| Дополнение: в100 объёмах воды при н.у. растворяется 2,5 объёма N2. При температуре-196С азот сжижается, а при -210С превращается в снегоподобную массу. Вопросы-помощники: Азот легче или тяжелее воздуха? Как доказать? | Рассчитывают относительную плотность азота по воздуху Двозд.=  = 0,96 = 0,96Вывод: азот немного легче воздуха. | | |
| Какими методами можно собирать азот? | Методом вытеснения воздуха. | | |
| Как будем держать пробирку? | Донышком вверх. | | |
| Демонстрационный опыт Цель: создать условия для возникновения проблемы подтверждения теоретических выводов | Получаем азот взаимодействием насыщенных растворов нитрита натрия и хлорида аммония при нагревании. Собираем газ. Как доказать, что полученный газ-азот? Приливаем известковую воду, она не мутнеет. | Возможно затруднение. | Практическое подтверждение теоретического прогноза физических свойств. |
| | Как действует азот на организм? Дополнение: азот физиологически инертен при обычных условиях. При повышенном давлении, например, при погружении водолазов, растёт концентрация растворённого азота в белковых и особенно жировых тканях организма. Это приводит к так называемому азотному наркозу. Водолаз словно пьянеет: нарушается координация движений, мутится сознание. В том, что причина этого-азот, учёные окончательно убедились после проведения экспериментов, в которых вместо обычного воздуха в скафандр водолаза подавалась гелио- кислородная смесь. При этом симптомы наркоза исчезали. | Он не поддерживает дыхания, но не ядовит. | |
| «Нью-Йорк ежедневно выбрасывает в воздух 3200 т двуокиси серы, 280 т промышленной пыли, 4200 т углерода, азота и других ядовитых веществ». (Новиков Ю.В., Пивкин В.М. Новосибирск: город для человека. - Новосибирское кн. Изд-во, 1988.-с.39). Какую ошибку допустил автор? | Из текста следует, что простые вещества - углерод и азот ядовиты. Ядовиты же их оксиды (по-видимому, это и имели в виду авторы). | |
| Давайте вернёмся к плану изучения темы «Подгруппа азота», который мы составили.
| Дали общую характеристику подгруппы азота, рассмотрели химический элемент и простое вещество-азот, его физические свойства. | |
| Знание периодического закона и химической связи, умение устанавливать связь между строением, видом хим. связи, типом кристаллической решётки и физическими свойствами вещества. | | |
| Да, нарушится причинно-следственная связь, материал нужно будет заучивать механически. | | |
| | Учащиеся оценивают работу своих одноклассников, дают обоснование оценкам. | |
|
| | |
