Методическая разработка по химии Подгруппа азота
| Вид материала | Методическая разработка |
СодержаниеЭтапы урока |
- Тесты для классов компенсирующего обучения (кко) задание к тесту, 41.19kb.
- Муниципальное Образовательное Учреждение лицей №23 г. Сочи методическая разработка, 233.75kb.
- Дубская Наталья Александровна Челябинск методическая разработка, 101.6kb.
- Учитель Тарачкова Екатерина Владимировна методическая разработка, 107.93kb.
- Разработка программы и определение методики изучения загрязнения почв при использовании, 202.22kb.
- Методическая разработка на тему, 461.38kb.
- Тема урока: Общая характеристика элементов подгруппы азота. Свойства азота, 85.69kb.
- Пояснительная записка. Методическая разработка на тему: «Профессиональная направленность, 187.77kb.
- Пояснительная записка к уроку, 108.58kb.
- Богдановой Татьяны Александровны. Псков, 2010. Уважаемые студенты! Данная методическая, 564.44kb.
Урок № 2
Тема урока: Химические свойства азота.
Тип урока: Урок изучения нового материала.
Цели урока:
Образовательная:
- создание условий для раскрытия особенностей взаимодействия азота с металлами, кислородом и водородом через обоснование инертности его молекул высокой прочностью связей;
- углубить и конкретизировать знания о закономерностях обратимых реакций;
- повторить сущность окислительно-восстановительных процессов.
Развивающая:
- создание условий для развития общеучебных умений и навыков как основы для формирования познавательной компетенции (анализ, сравнение, обобщение, выстраивание причинно-следственных связей на основе строения вещества);
- развитие речи.
Воспитательная:
создание условий для формирования химически-грамотного отношения к окружающей среде.
Оборудование: проекционное оборудование, видеозапись лабораторных опытов «Синтез аммиака», «Окисление азота».
| Этапы урока | Деятельность учителя | Деятельность учащихся | Результат |
| Проверка готовности класса к уроку, приветствие учащихся. | Подготовка к уроку рабочего места: учебник, тетрадь, дневник, пишущие принадлежности; приветствие учителя. | Подготовка класса к уроку |
| 1.Определить, о простом веществе азоте или химическом элементе азоте идёт речь в следующих утверждениях: а) азот - бесцветный газ, без запаха и вкуса; б) минимальная степень окисления азота равна-3; в) в воде газообразный азот растворяется хуже кислорода; г) в земной коре азота всего 0,04%; д) в свободном состоянии азот существует в виде двухатомных молекул; е) максимальная степень окисления азота равна +5; ж) жидкий азот используют в медицине; з) азот входит в состав растительных белков; и) атомы азота содержат на внешнем энергетическом уровне 5 электронов; к) над каждым гектаром земной поверхности постоянно «висят» 8000 т азота; л) азот- третий элемент по электроотрицательности. | Определяют, в каком случае идёт речь о простом веществе азоте, а в каком о химическом элементе азоте. | Повторили физические свойства азота и свойства Химического элемента азота. |
| | 2.В чём причина противоречия между высокой реакционной способностью элемента азота и инертностью молекулярного азота? | Возможные варианты ответов: - в строении молекулы азота; - в характере химической связи между атомами в молекуле; -в механизме образования связи. | |
| | 3.Кто объяснит инертность молекулы азота? | При образовании молекулы азота одиночные атомы связываются за счёт спаривания трёх неспаренных р- электронов от каждого из атомов азота. Это приводит к образованию устойчивой восьмиэлектронной конфигурации в молекуле азота, связи между атомами азота. Связь в молекуле N2 ковалентная неполярная, тройная, очень прочная. | Актуализация необходимых знаний. |
3.1. Цель: создать условия для прогнозирования химических свойств. | Азот по электроотрицательности является третьим элементом (после фтора и кислорода). С какими элементами, образуя соединения, он будет проявлять минимальную степень окисления? | С теми, у которых значение электроотрицательности меньше. Это преимущественно металлы. Значит, с ними азот должен образовывать прочные соединения. | |
| С какими элементами азот будет проявлять положительную степень окисления? | С более электроотрицательным (с кислородом и фтором). | Прогноз химических свойств. | |
| Но в составе земной коры никаких нитридов не обнаруживается!!! Почему? | Возможно затруднение. | | |
| Помощь: представьте себе планету, в химическом составе которой преобладающим элементом является не кислород, а хлор. Могут ли в состав коры такой планеты войти бромиды и йодиды? | Нет, т.к. СI2 более активное вещество и вытеснил бы бром и йод из соединений. СI2+ 2NaI = 2NaCI+I2 | | |
| В таком же положении, в каком на нашей воображаемой планете оказались бы бром и йод, на земном шаре находится азот. Он недостаточно электроположителен, чтобы образовывать прочные соединения с господствующим у нас элементом- кислородом, и недостаточно электроотрицателен, чтобы конкурировать с кислородом в связывании с электроположительными элементами. Итак, мы предполагаем, что азот будет взаимодействовать с металлами, с кислородом, фтором. А ещё? Посмотрите на пересечение граф: Vгруппа и летучие водородные соединения | Азот будет взаимодействовать с водородом | Уточнённый прогноз химических свойств | |
| 3.2. Цель: создать условия для изучения химических свойств азота. | | В тетради записывают тему урока «Химические свойства азота», 1. Взаимодействие азота с металлами. | |
| Уточняю, что при повышенной температуре азот взаимодействует со многими металлами, а при комнатной - только с литием. | 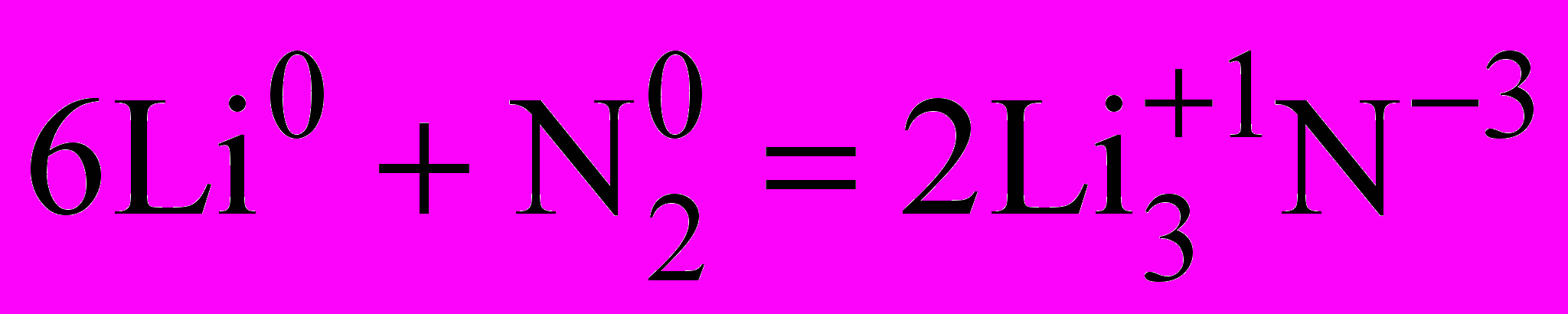 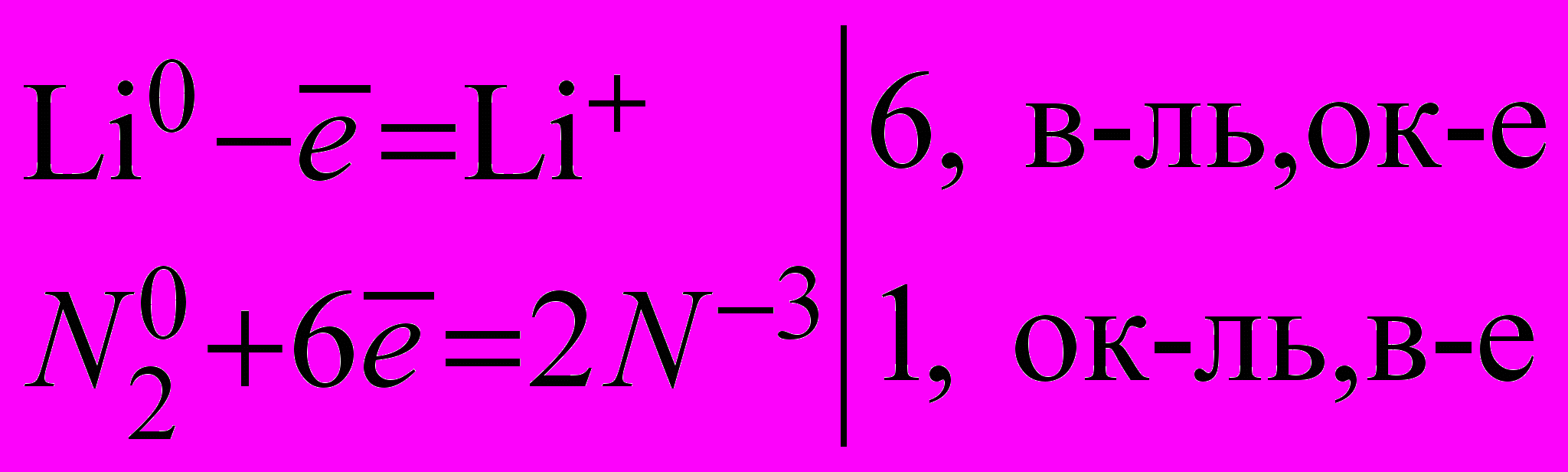 | Вывод: N2 проявляет окислительные свойства. | |
| Дополнение: большинство нитридов металлов - механически, термически и химически стойкие соединения; это позволяет их использовать в качестве высокопрочных материалов. | | | |
| | 2. Взаимодействие азота с неметаллами. а) с кислородом. | | |
| Непосредственно реакцией соединения простых веществ может быть получен лишь NО(II), во всех других случаях существует практически непреодолимый энергетический барьер. При каких условиях можно осуществить эту реакцию? | Требуется большая энергия, чтобы разрушить тройную связь, следовательно, при высоких температурах. | | |
| Запись демонстрационного опыта окисления азота. | 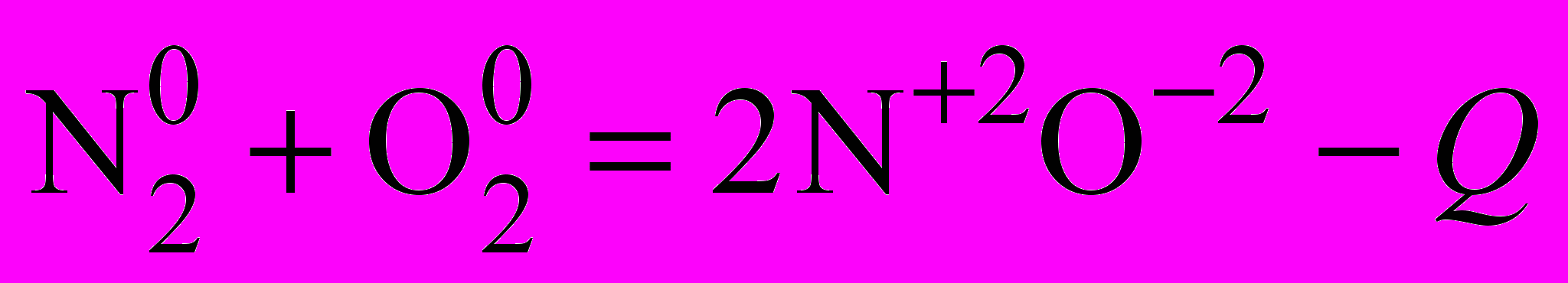 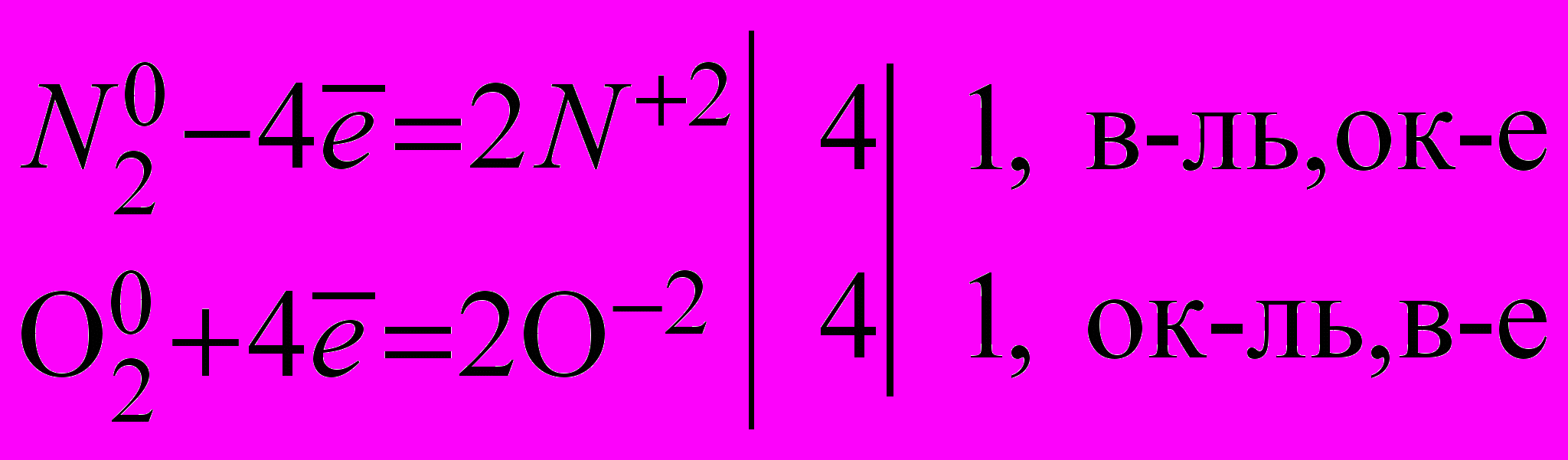 | Вывод: N2 проявляет восстановительные свойства. | |
| Могут ли в природе образовываться оксиды азота? | Возражение: азот и кислород входят в состав воздуха, и азот не реагирует с таким активным окислителем, как кислород! | | |
| Дополнение: NO образуется при грозовом разряде в атмосфере. Статистика утверждает, что в атмосфере нашей планеты ежегодно вспыхивают три с лишним миллиарда молний. Мощность отдельных разрядов достигает 200 млн. киловатт, а воздух разогревается при этом (локально) до 20000К, хотя разряд молнии длится десятитысячную долю секунды. При такой чудовищной температуре молекулы азота и кислорода разрываются на атомы, которые активно и легко соединяются друг с другом, образуя молекулы NO. Молекулы NO быстро окисляются на воздухе до более стабильных молекул NO2 . |  Выделяется бурый газ NO2. | Изучена реакция взаимодействия азота с кислородом. | |
| Почему дождевая вода после грозы имеет кислотную среду? | Наверное, NO2 кислотный оксид, при его растворении в воде образуется кислота. | | |
| Какие превращения при этом происходят? | N2NONO2HNO3 | Подготовка к изучению производства HNO3. | |
| Почему экономически нецелесообразно связывание атмосферного азота путём взаимодействия с кислородом? | Реакция эндотермическая, требует больших затрат электроэнергии, выход NO очень мал. | | |
| Такая простая реакция, если судить по уравнению реакции, не давалась в руки химикам на протяжении всего XIX века. В течение 120 лет предпринимались многократные попытки синтезировать аммиак. Однако они были неудачны вплоть до работ А. Ле Шателье, В.Нернста и Ф. Габера, которые перенесли случайные поиски в разряд систематических научных исследований, за что в 1918году удостоились Нобелевской премии. Открытие условий протекания этой реакции базируется на успехах теоретической химии - на учении о равновесии, кинетике и катализе. | Б) с водородом. 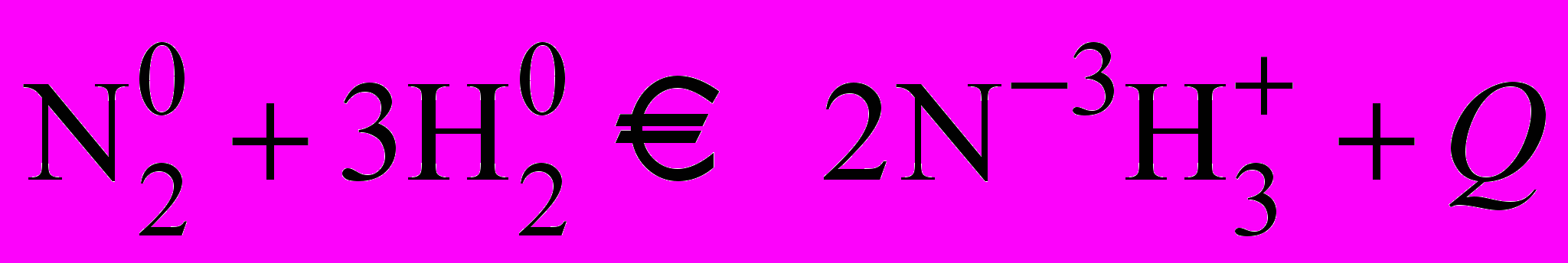 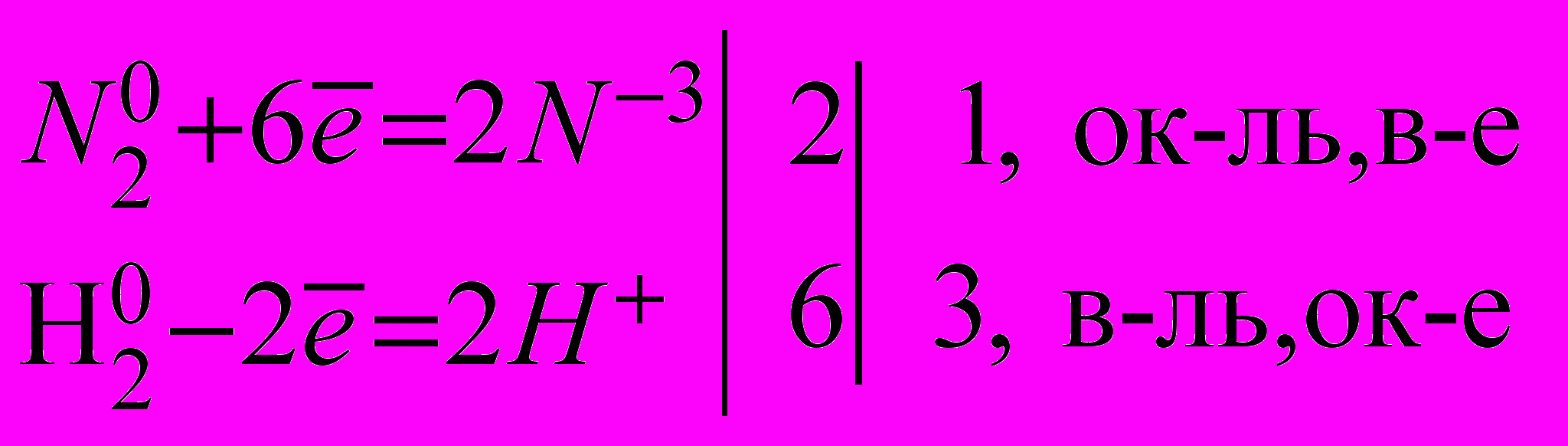 | Вывод: N2 проявляет окислительные свойства. | |
| Какие должны быть созданы условия, чтобы азот соединился с водородом? | Т.к. реакция гомогенная, экзотермическая, то смесь азота и водорода берут в соотношении 1:3, при обычных условиях, т.к. тепло выделяется. | | |
| Опыт показывает, что при обычных условиях реакция не идёт (используем запись лабораторного опыта синтеза аммиака). | Может, реакция каталитическая? | Подтверждаем записью опыта верность предположения. | |
| В присутствии железа при повышенной температуре (400С) образуется аммиак. Но при этих условиях образуется очень мало аммиака. Как бы долго азотооводородная смесь не соприкасалась с катализатором, содержание аммиака и газовой смеси не увеличивается. Почему? | Возможно, данная реакция обратимая? И равновесие смещено при данных условиях в сторону исходных веществ. | | |
| | Верно. И правильно это уравнение записывать так: 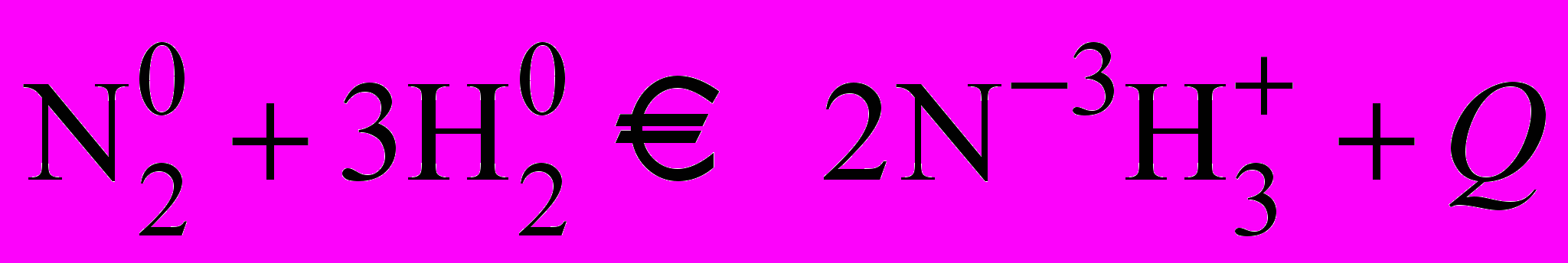 Как сместить равновесие в сторону образования аммиака? | Т.к. реакция экзотермическая, то температуру нужно понижать, но не менее 400 С, иначе реакция не идёт. Т.к. реакция идёт с уменьшением объёма, давление нужно повышать. | Изучена реакция взаимодействия азота с водородом. |
| На протяжении двух уроков мы изучали свойства азота. Перечислите физические свойства. | Газ, без цвета, запаха и вкуса, малорастворим в воде, не ядовит, не поддерживает дыхания, горения, легче воздуха, инертен при обычных условиях. Сжижается при-196 С. | | |
| Перечислите химические свойства. | Взаимодействует с металлами, неметаллами. | | |
| 2.3. Цель: создать условия для выделения свойств, имеющих практическую значимость и определения областей их применения. | Далее по предложению детей: Называется область применения и выделяется свойство или наоборот. Дополнение: азот - самый дешёвый из всех газов, химически инертных в обычных условиях. В химической технологии применяют для создания неокислительных сред, в лабораториях в атмосфере азота хранят легко окисляющиеся соединения. Выдающиеся произведения живописи иногда (при транспортировке) помещают в герметические футляры с азотом,- чтобы предохранить краски от влаги и химически активных компонентов воздуха. | Для создания инертных сред; свойство-инертность при обычных условиях. Жидкий азот в медицине. | |
| | Различные металлы в расплавленном состоянии реагируют на присутствие азота по-разному. Медь инертна, поэтому изделия из меди часто сваривают в струе азота. Магний взаимодействует с азотом. Насыщение азотом поверхности титана придаёт металлу большую прочность и износостойкость - на ней образуется очень прочный и химический инертный нитрид титана. Эта реакция идёт лишь при высоких температурах. | В металлургии, взаимодействие с металлами. Для производства аммиака (взаимодействие с водородом), азотной кислоты, минеральных удобрений. | Определены области практического применения азота. |
| | Как в промышленности получают азот? | Из воздуха, используя различие в температурах кипения азота и кислорода. | |
| | Как объяснить результаты опыта Дж.Рэлея, который установил, что масса 1 л азота, полученного из воздуха, равна 1,2565 г. В то время как масса 1л азота, полученного из аммиака, составляет 1,2507 г. Помощь: вспомните состав воздуха. Масса 0,0058 г, отличающая 1 л атмосферного азота от 1 л азота, полученного из аммиака,- это масса аргона. | | |
| 3. Рефлексивно-оценочный этап. | Подвожу итоги урока, осуществляю обратную связь и выясняю отношение учащихся к уроку. -Что помогло нам успешно изучить новый материал? | Умение мыслить, задавать вопросы и искать ответы, опираясь на ранее изученный материал. | |
| | Что нужно сделать, чтобы знания стали ещё более глубокими и прочными? | Закрепить. | |
| | записывайте домашнее задание: Параграф 30, №4-3, 4-4(задачник) | | |
| | Чья работа заслуживает оценки? | | Учащиеся оценивают работу своих одноклассников, дают обоснование оценкам. |
