Методическая разработка по химии Подгруппа азота
| Вид материала | Методическая разработка |
СодержаниеЭтапы урока Лабораторный опыт. Демонстрационный опыт № 1 Лабораторный опыт. Демонстрационный опыт. |
- Тесты для классов компенсирующего обучения (кко) задание к тесту, 41.19kb.
- Муниципальное Образовательное Учреждение лицей №23 г. Сочи методическая разработка, 233.75kb.
- Дубская Наталья Александровна Челябинск методическая разработка, 101.6kb.
- Учитель Тарачкова Екатерина Владимировна методическая разработка, 107.93kb.
- Разработка программы и определение методики изучения загрязнения почв при использовании, 202.22kb.
- Методическая разработка на тему, 461.38kb.
- Тема урока: Общая характеристика элементов подгруппы азота. Свойства азота, 85.69kb.
- Пояснительная записка. Методическая разработка на тему: «Профессиональная направленность, 187.77kb.
- Пояснительная записка к уроку, 108.58kb.
- Богдановой Татьяны Александровны. Псков, 2010. Уважаемые студенты! Данная методическая, 564.44kb.
Урок № 3.
Тема урока: «Аммиак».
Тип урока: изучение нового материала, форма: урок – исследование.
Цели урока:
Образовательные:
- создание условий для исследования строения молекулы аммиака, его физических свойств и особенностей взаимодействия аммиака с водой и кислотами;
- продолжать формирование знаний о донорно-акцепторном механизме образования ковалентной связи;
- знакомство со структурой исследования на материале темы урока.
Развивающая:
- создание условий для развития общеучебных умений и навыков как основы для формирования познавательной компетенции (анализ, сравнение, обобщение, выстраивание причинно-следственных связей на основе строения вещества);
- развитие речи.
Воспитательная:
- создание условий для формирования исследовательской культуры;
- создание условий для формирования культуры диалога.
Оборудование:
- На демонстрационном столе – лабораторный штатив, спиртовка, спички, чистые пробирки, кристаллизатор с водой, стеклянные палочки, газоотводная трубка, прибор для проверки электрической проводимости раствора.
- Реактивы - хлорид аммония, гидроксид кальция, концентрированная хлороводородная кислота, 10%- ный раствораммиака, фенолфталеин.
- На ученических столах: раствор аммиака, пробирка с водой, фенолфталеиновая бумага.
Проект сценария урока
| Этапы урока | Деятельность учителя | Деятельность учащихся | Результат |
| | | Подготовка класса к уроку |
Цель: создание условий для формирования цели урока с помощью актуализации необходимых знаний | Ребята! Сегодняшний урок мне хотелось начать с чтения небольшого отрывка из повести Н. Огнева « Дневник Коли Рябцева». Послушайте внимательно и попробуйте определить о каком веществе идет речь. « Сегодня Черная Зоя сдавала экзамен за октябрь Алмакфишу и вдруг как шлепнется в обморок! Ну, теперь этим никого не удивишь. Сейчас же опрыскали водой, дали понюхать нашатырю, и она встала. » | Учащиеся слушают отрывок из повести и догадываются, что это вещество нашатырный спирт или водный раствор аммиака. | |
| Учащиеся отвечают, что это нашатырный спирт. | | |
| Выделяющийся из раствора аммиак раздражает нервные окончания верхних дыхательных путей и рефлекторно возбуждает центральную нервную систему – пострадавший приходит в себя. | | |
| Дети отвечают: « Потому что сегодня мы будем изучать аммиак.» | | |
| Совершенно верно, открываем тетради, записываем число и тему урока” Аммиак” (записываю на доске) | | | |
| Возможные варианты ответов: - это вещество обладает резким запахом; - оно растворяется в воде; - вредно действует на организм; | | |
| Возможные варианты ответов: - имеет формулу NH3; - сложное вещество; - летучее водородное соединение, газ; - получается взаимодействием азота и водорода; - используется в медицине; | | |
Вопросы- помощники: - с какими еще веществами реагирует аммиак, кроме воды? - что получается при растворении аммиака в воде? - где он еще используется, кроме медицины? | Возможн. варианты ответов: - все знаем; какими другими свойствами обладает это вещество; - какими другими физическими свойствами обладает; - где еще используется аммиак; - как эти свойства будут связаны со строением аммиака. | | |
| Выяснить строение молекулы аммиака и через строение изучить его свойства. Исходя из свойств, обосновать его применение. | Сформулирована цель урока. | |
Цель: создать условия для формирования умения планировать собственную учебную деятельность. |
| Возможные варианты ответов: - получение аммиака - строение молекулы аммиака - образование связи в молекуле аммиака - физические свойства - химические свойства - где применяется. | Осознание темы и цели урока учащимися. Составили план своей деятельности. |
| Корректирую их предложения и записываю план на полях доски (справа).
| | | |
Цель: Создать условия для теоретического исследования строения молекулы аммиака. | Переходим к первому пункту плана, проводим теоретическое исследование
| Ответы учащихся: Азот имеет порядковый номер 7, следовательно, заряд ядра +7, находится во втором периоде. Отсюда следует, что у него 2 энергетических уровня; в 5 группе, главной подгруппы, следовательно, на внешнем энергетическом уровне будет 5 электронов, на предвнешнем 2.  электронная формула: 1s2 2s2 2p3 графическая формула 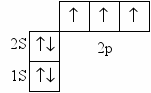 До завершения энергетического уровня не хватает трех электронов, следовательно, низшая степень окисления азота будет – 3. Водород находится в первой группе, главной подгруппе, в первом периоде, порядковый номер 1, следовательно 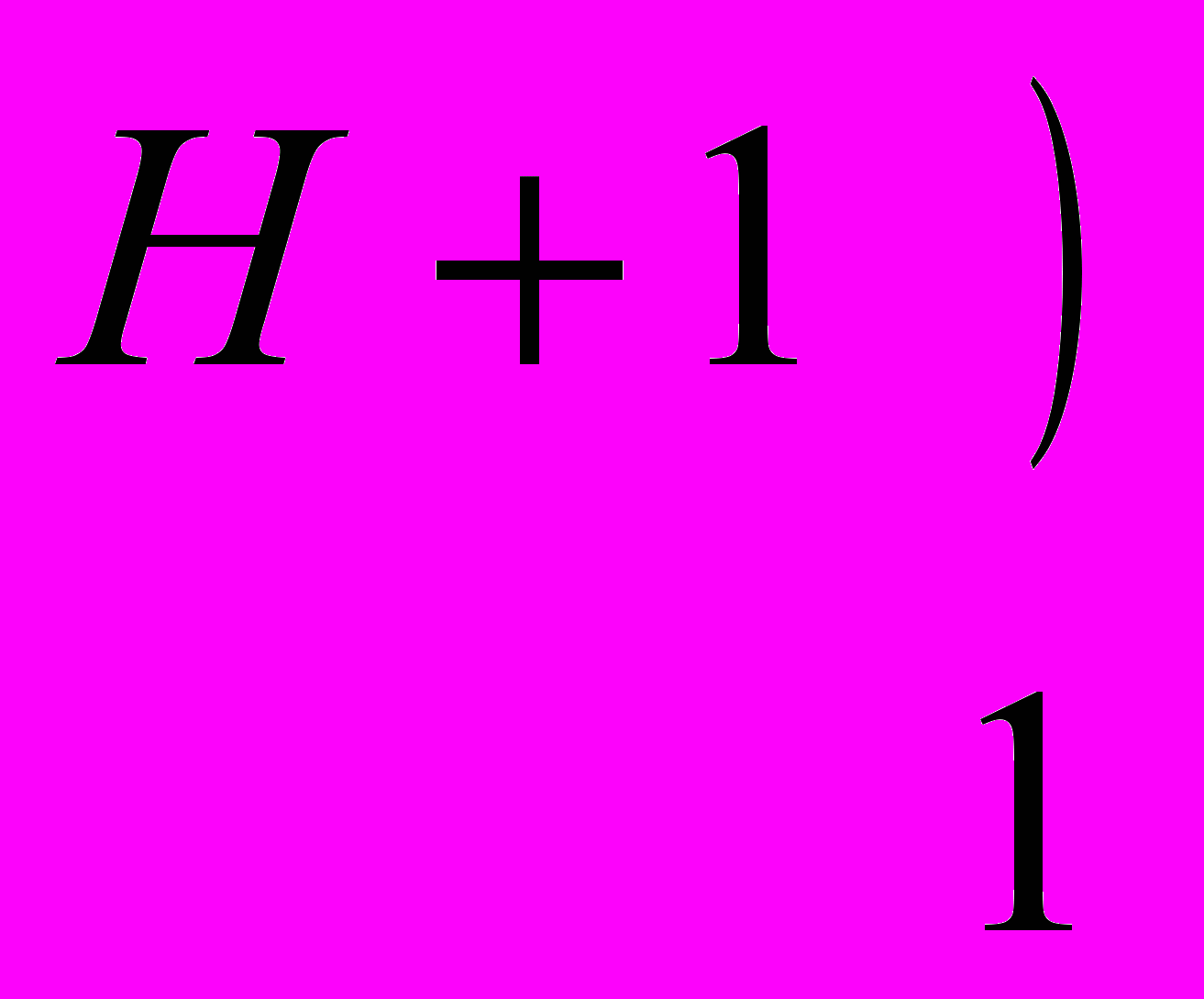 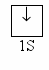 Для приобретения устойчивой электронной конфигурации азот образует три ковалентных связи с тремя атомами водорода. В ходе рассказа появляется запись на доске: 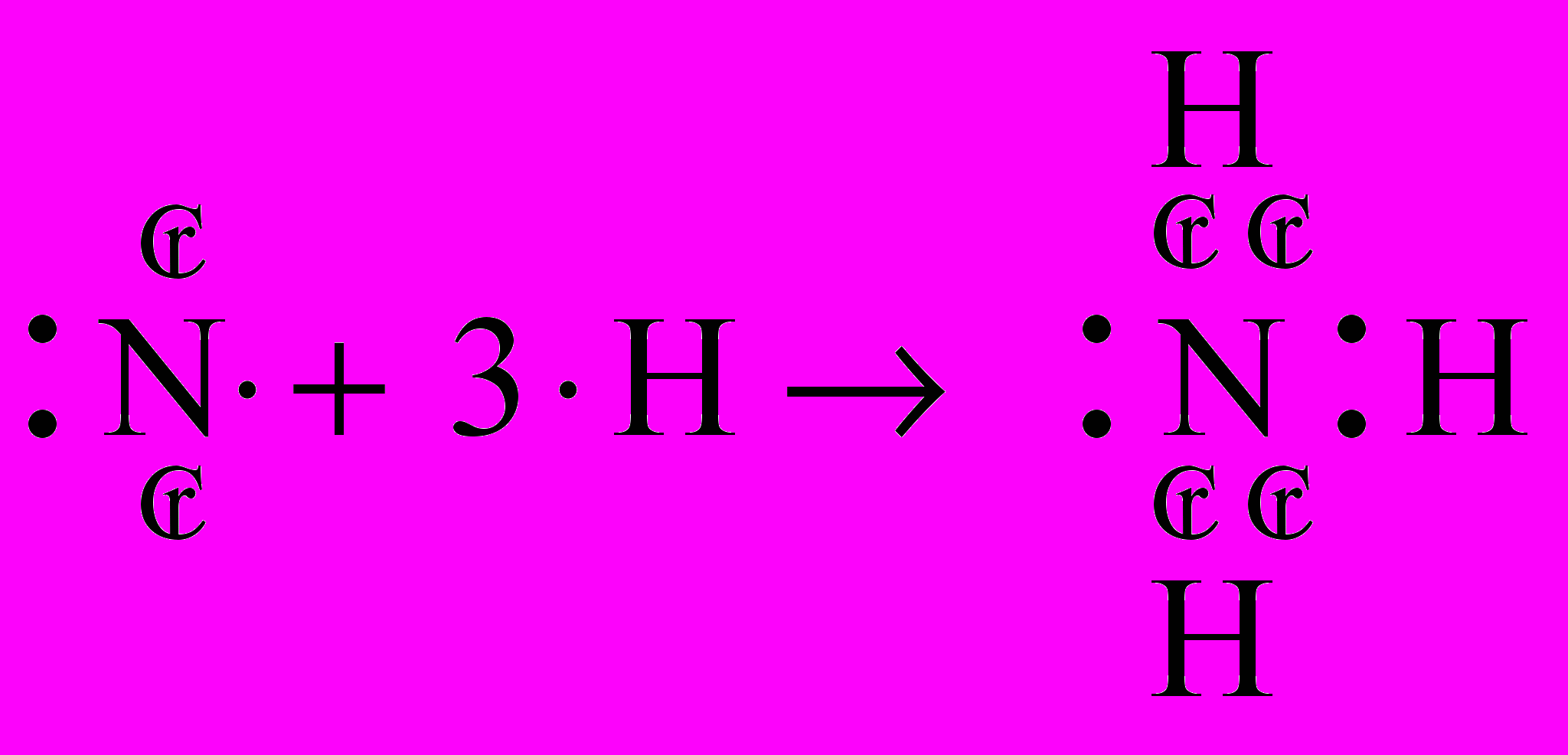 | |
| 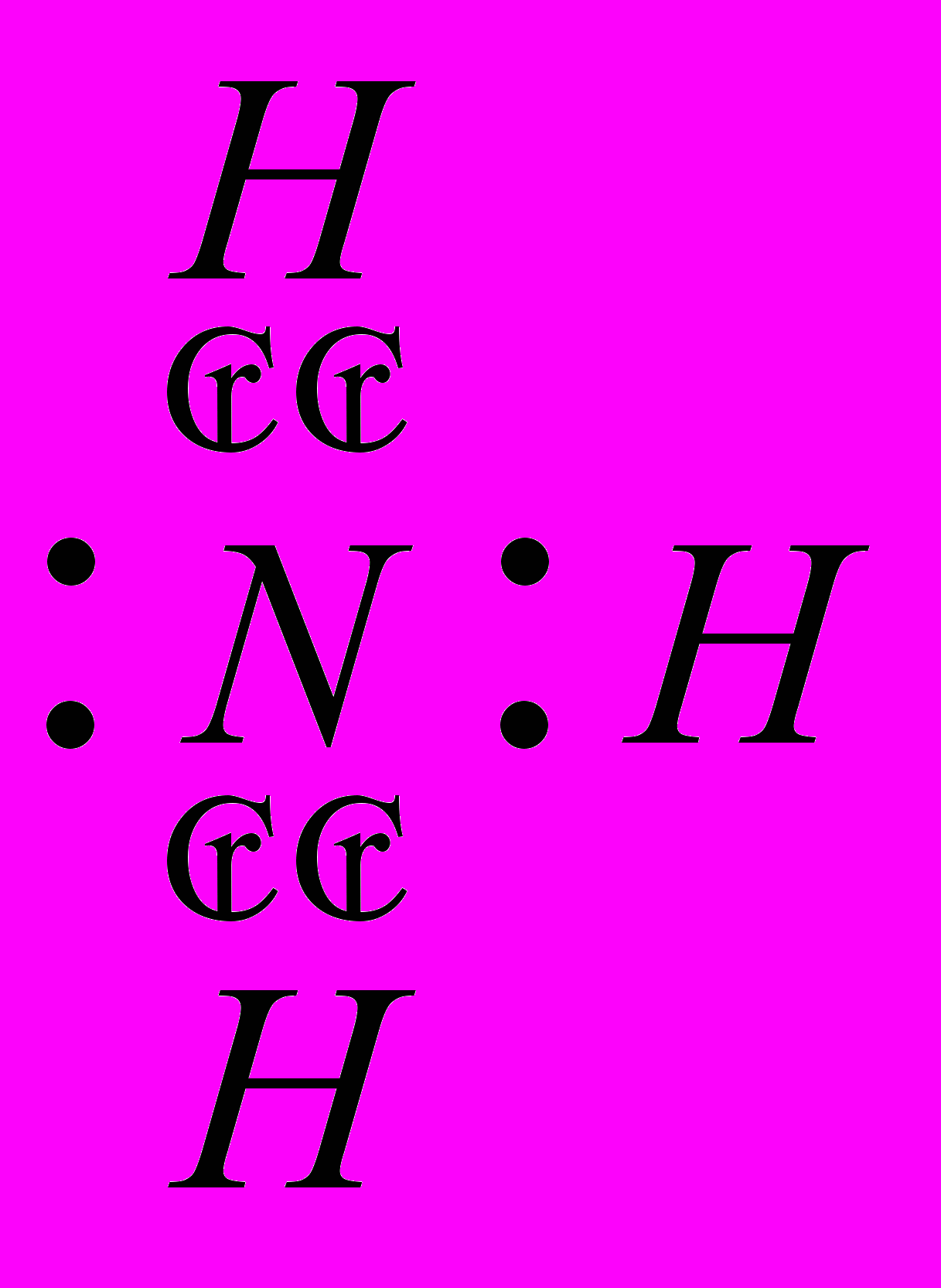 , , 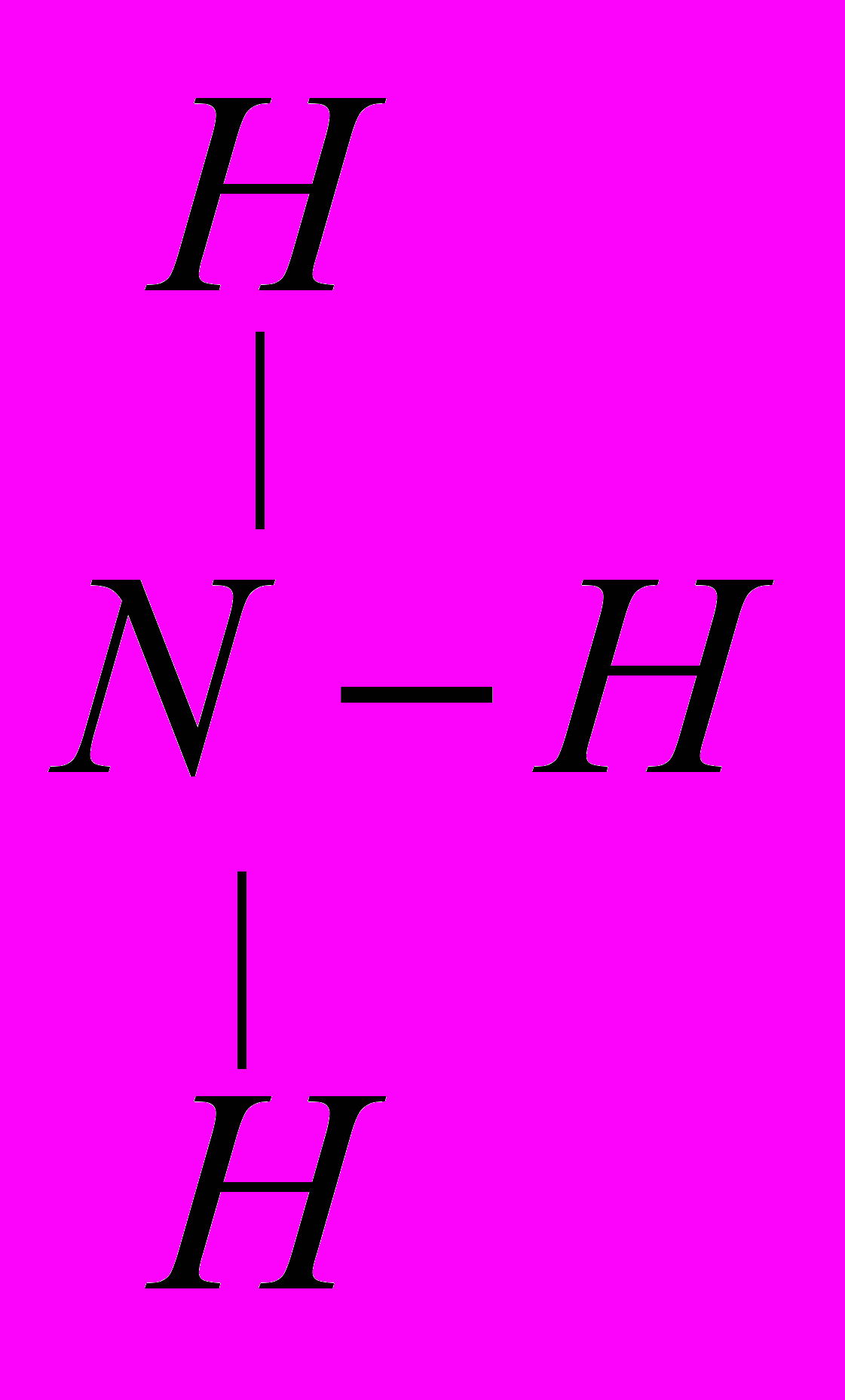 | | |
| 3 | | |
| Ковалентная, полярная, так как образуется по обменному механизму за счет спаривания электронов и образования общих электронных пар. Так как N обладает большой электроотрицательностью, то смещает электронную плотность на себя, приобретая частично отрицательный заряд. У атомов водорода, соответственно, будет частично положительный. | | |
| Дополняю: обратите внимание, что молекула NH3 образуется за счет спаривания трех p – электронов, находящихся на трех p – орбиталях, расположенных взаимно перпендикулярно с тремя s- электронами атомов водорода. Вследствие разницы значений относительной электроотрицательности N и H связи N-H полярны. Общие электронные пары смещены в сторону атома азота, как более электроотрицательного элемента. 3 атома водорода присоединяются к атому азота так, что их связи образуют углы чуть больше 100, то есть молекула NH3 имеет пирамидальную форму. | | На основании положения N и H в ПСХЭ обосновали строение молекулы NH3, раскрыли механизм образования связи, ее полярность. | |
| Откройте рисунок 31 на странице 110. Вы видите, что одна из вершин молекулы NH3 занята неподеленной парой электронов атома азота. Какой делаем вывод? | Работают с учебником Молекула аммиака сильно полярна | | |
| Мы провели теоретическое исследование строения молекулы аммиака, переходим ко второму пункту плана. | | | |
| 4.2. Цель: создать условия для прогнозирования и доказательство практикой физических свойств NH3, исходя из его строения. |
Далее рассматриваем физические свойства NH3 в порядке поступления предложений от учащихся Почему? | | |
| |
Возможн. варианты ответов: - так как в ПСХЭ находится в графе “ летучие водородные соединения”( RH3). - так как связь ковалентная полярная, то следует, что кристаллическая решетка молекулярная, поэтому при н. у. Вещество газообразное. | | |
|
| | |
| Дополняю: Связь N-H полярна, положительный заряд сосредоточен на атомах водорода, отрицательный на атомах азота. Вследствие этого между молекулами аммиака образуется водородная связь (очень непрочная). Благодаря водородным связям, NH3 имеет сравнительно высокие (по сравнению с ранее изученными газами) температурой плавления и температурой кипения, высокую теплоту испарения, при охлаждении NH3 до -33 градусов он сжижается. | Слушают и записывают в тетради: 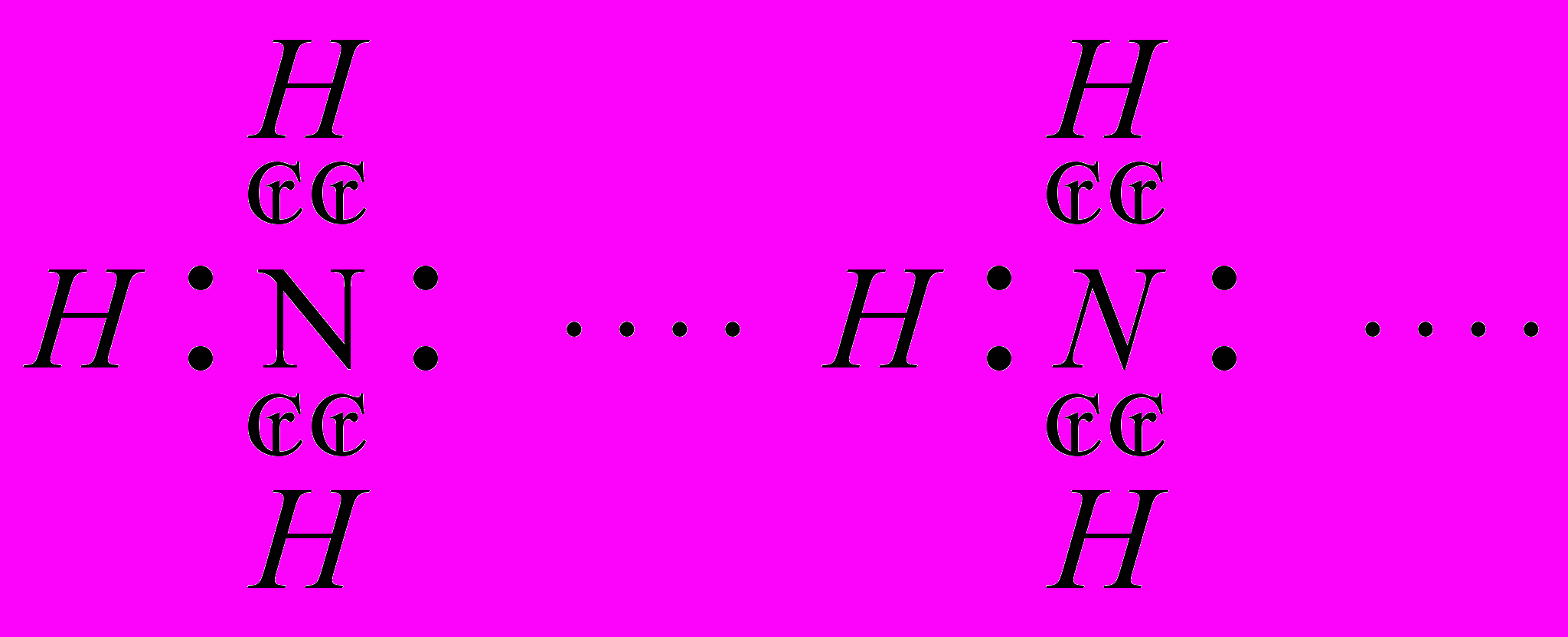 | | |
| Характерный резкий запах | Подтвердили практикой наличие этого свойства у вещества. | |
| Лабораторный опыт. Цель: создать условия для практического изучения свойства NH3. | Запах невозможно прогнозировать, определяется только в процессе эксперимента. У вас на рабочих столах стоит раствор аммиака. Соблюдая правила Т.Б. познакомьтесь с запахом этого вещества | Учащиеся проводят лабораторный опыт: знакомятся с запахом аммиака. | |
| |
| Растворяется в воде | |
| Почему? | - за счет образования водородных связей между молекулами аммиака и воды - вещество, имеющее полярные молекулы хорошо растворяется в подобном. | | |
Докажите расчетом. | - Легкий - Тяжелый Dвозд NH3 = 17:29 = 0,58 Легче воздуха, легкий. | ||
| Что следует?
| В пробирку, перевернутую вверх дном. | ||
| Вытеснения воздуха. | | |
Почему? | Нет. Аммиак растворяется в воде. | ||
| Бесцветный, так как раствор аммиака бесцветный. | ||
| Молодцы! Об этом говорит ваш жизненный опыт. | | | |
| Демонстрационный опыт № 1 Цель: создать условия для возникновения проблемы: каким процессом является растворение аммиака. | Демонстрирую получение NH3 и растворение его в воде. | Учащиеся наблюдают и учитывают все увиденные свойства: - выделяется бесцветный газ; - легкий; - резкий запах; - хорошо растворяется в воде. | Экспериментально доказали физич. свойства вещества, прогнозируемые из строения молекулы, вида химической связи. |
| |
| Возможные варианты отве тов: - физический - химический | |
| Если раствор аммиака оставить открытым на воздухе, аммиак испаряется, запах ослабевает. | | |
| Если учащиеся вспомнят образование ковалентной связи по донорно-акцепторному механизму за счет неподеленной пары азота, доказываем экспериментом и записываем на доске и в тетради. | | |
| Если возникнет затруднение. Давайте полученный раствор аммиака проверим на электропроводность.
| Дети видят, что лампочка загорается. В растворе есть ионы, так как только заряженные частицы проводят электрический ток. | Учащиеся убеждаются, что процесс химический, образуются ионы. | |
какой это процесс? | И физический, и химический. | | |
| | Мы остановились на границе 2 и 3 пунктов плана, разобрали физические свойства, переходим к химическим и не можем разобраться с этим процессом. | | |
| Лабораторный опыт. Цель: подтвердить, что процесс химический, подтвердить проблемную ситуацию. | Возьмите фенолфталеиновую бумажку и опустите в раствор аммиака. Что наблюдаете? Отложите на лоток. | Учащиеся проводят опыт и наблюдают изменение окраски на малиновый, отмечают, что такое изменение цвета фенолфталеина характерно для веществ, при диссоциации дающих ОН– ( щелочей). Делают вывод, что водный раствор аммиака – щелочь. | |
| |
| Так как это произошло в момент растворения NH3 в воде, то, возможно, из воды. | |
| Если возникнет затруднение и учащиеся не вспомнят механизм образования иона гидроксония, обращаю их внимание на неделенную пару азота | Формулировка проблемы: Как аммиак может вступить в реакцию с водой, если все валентные электроны использованы на образование связей, а атомы азота и водорода приобрели устойчивые электронные конфигурации? | | |
| Оставляем 2 строчки и записываем: 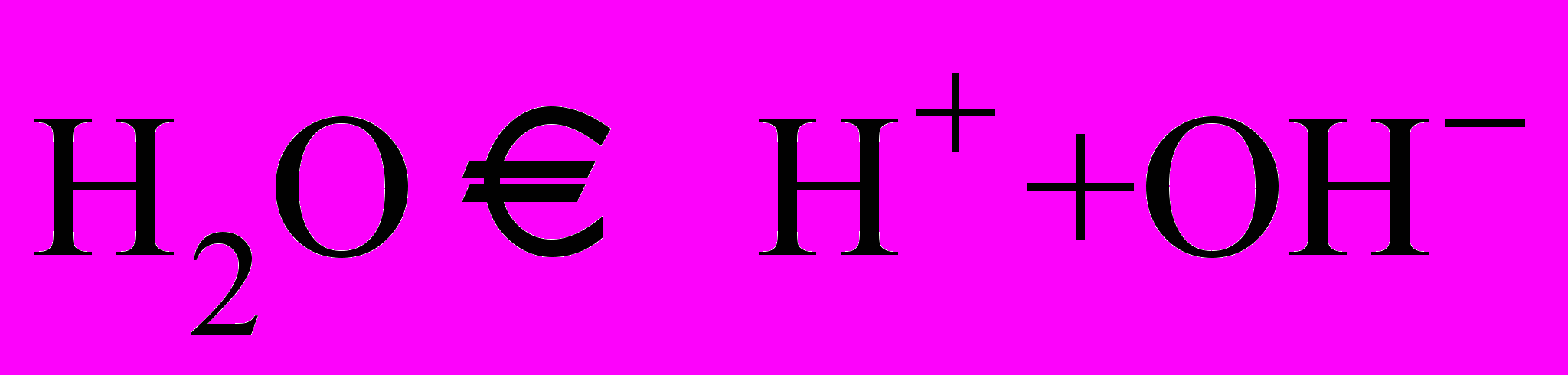 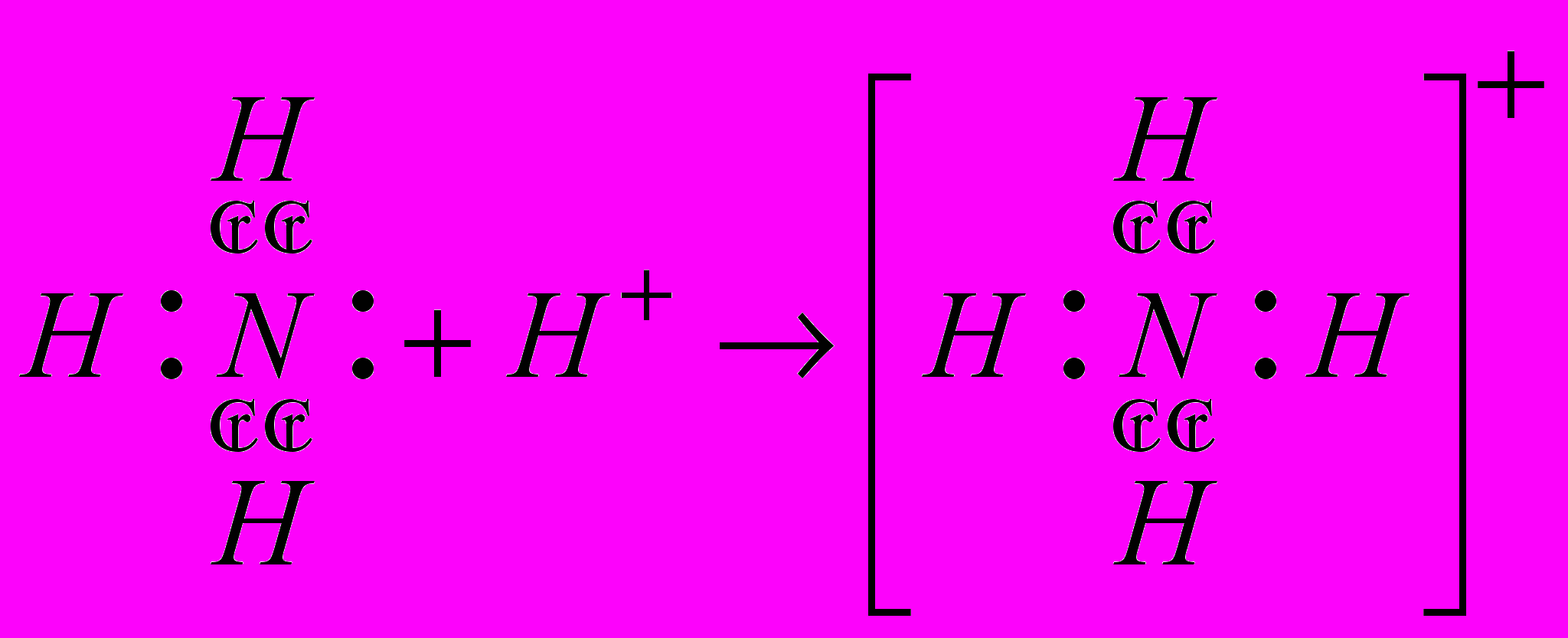 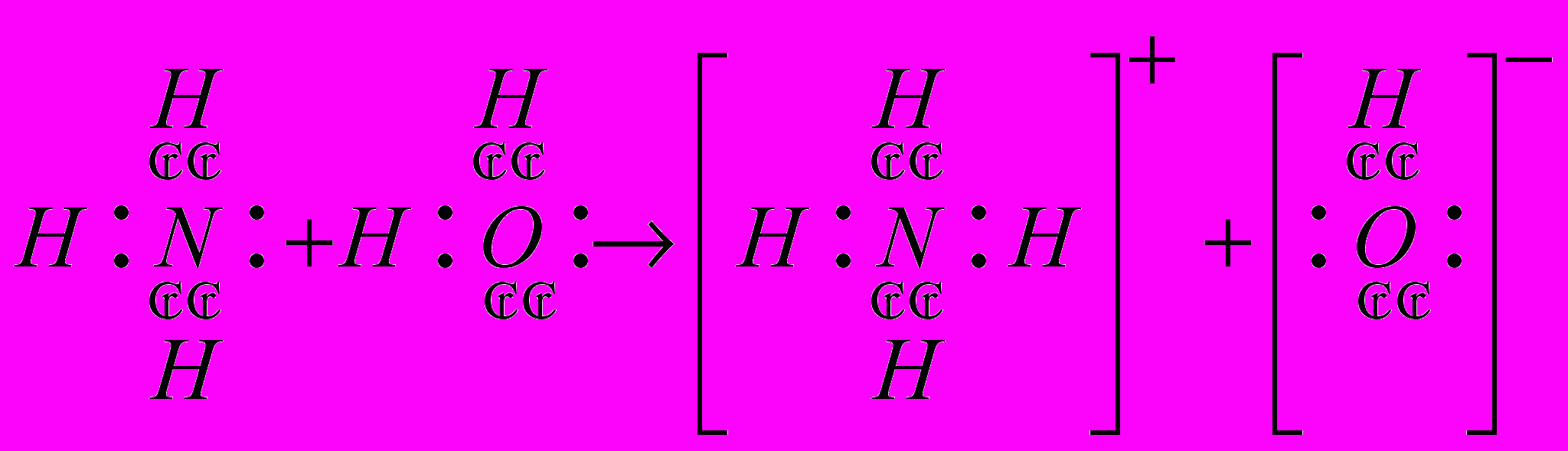 | | ||
| Атом азота в составе аммиака имеет неподеленную пару за счет которой и образуется ковалентная связь между атомом азота и протоном, который отщепляется от молекулы воды. При этом атом азота выступает в роли донора (предоставляет пару электронов в общее пользование), а протон выступает в роли акцептора (принимающего электроны). В водном растворе ион аммония играет роль катиона, а гидроксид – ион воды создает щелочную среду. | Принимают участие в разъяснении противоречия, уточняют, задают вопросы, записывают уравнение в тетрадь. | | |
| Они обесцветились, аммиак испарился. Значит, реакция пошла в обратном направлении. | | |
Дополнение: Эта реакция обратима. Лишь малая доля растворенного аммиака присутствует в растворе в виде ионов  , большая часть его содержится в виде гидратированных молекул , большая часть его содержится в виде гидратированных молекул 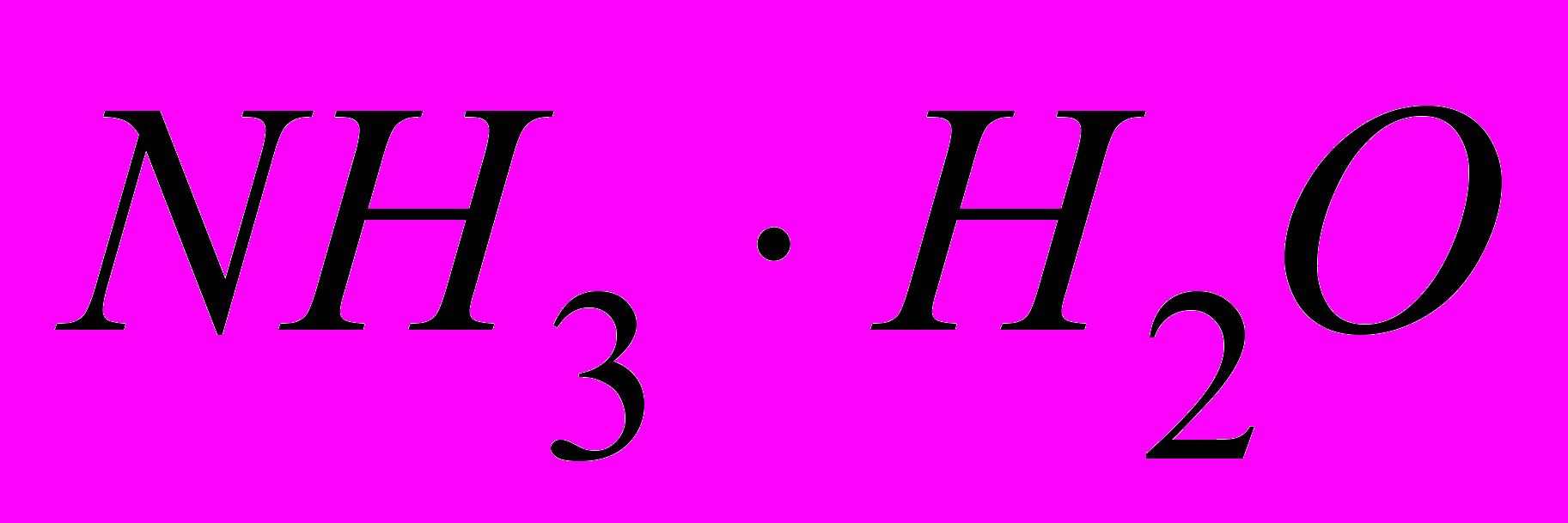 . Поэтому аммиачная вода пахнет аммиаком и при нагревании или стоянии на открытом воздухе NH3 из нее улетучивается. . Поэтому аммиачная вода пахнет аммиаком и при нагревании или стоянии на открытом воздухе NH3 из нее улетучивается. | Записывают уравнение в тетрадь, окончательно убеждаются в том, что процесс растворения NH3 в воде физико – химический. | Доказали и подтвердили практикой, что растворение NH3 в воде физико – химический процесс. | |
| В тетради делают уточняющую запись: 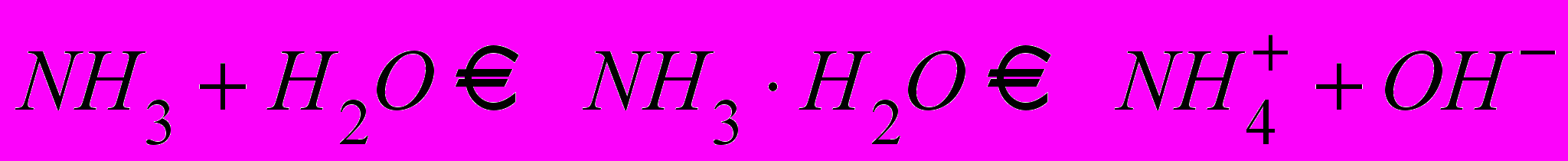 | |||
Перед объяснением механизма ставим I и записываем «реакции присоединения». а) воды. | Правильно оформляют конспект. | | |
Как вы думаете, с какими веществами аммиак будет реагировать по такому же механизму, как с водой? (помощь: то есть с присоединением к его молекулам протонов). | б) С кислотами, так как в их молекулах содержатся слабо связанные протоны. | | |
| Демонстрационный опыт. Цель: практически подтвердить теоретическую гипотезу. | Подносим друг к другу стеклянные палочки, смоченные концентрированными растворами HCl и аммиака. “ Дым” – это взвешенные в воздухе мельчайшие твердые частички продукта реакции. Записываем уравнение NH3 + HCl NH4 Cl | Наблюдаем обильное выделение белого «дыма». | |
| |
Назовем его. Хлорид аммония или техническое название – нашатырь. | Это соль, так как содержит положительный ион  и отрицательный Cl–. и отрицательный Cl–.Хлорид аммония (подписываем). | |
Какую ошибку допустил автор? | Дали понюхать нашатырный спирт. | | |
| Возможные варианты ответов: - да - нет. А могут идти реакции с изменением степени окисления азота в молекуле аммиака? | Сформированы знания о донорно-акцепторном механизме образования ковалентной связи, на основании которого изучены особенности взаимодействия аммиака с водой. | |
| Могут. О них будет разговор на следующем уроке, а в тетради запишите: “ II. Реакции, идущие с изменением степени окисления азота”. А сейчас обратимся к четвертому вопросу. | | | |
Если возникают затруднения открываем схему № 36 на странице 115. Посмотрите, сколько областей применения аммиака остаются пока вне поля нашего зрения, о них мы узнаем позже. | В медицине (нашатырный спирт), в быту, в качестве хладагента, в сельском хозяйстве. | Исходя из изученных свойств выяснили, в каких отраслях народного хозяйства может применяться NH3 и его раствор. | |
| Параграф 31, стр. 113 (донорно-акцепторный механизм образования ковалентной связи в  , реакции присоединения), если останутся вопросы, обращаетесь к тексту всего параграфа; в тетради: записать уравнения взаимодействия аммиака с известными вам, реально существующими кислотами. , реакции присоединения), если останутся вопросы, обращаетесь к тексту всего параграфа; в тетради: записать уравнения взаимодействия аммиака с известными вам, реально существующими кислотами. | Записывают домашнее задание в дневник. | Знают домашнее задание, имеют возможность выбрать объем его выполнения. | |
| 6. Контроль. |
| Название “ аммиачная кислота” - грубая ошибка. Раствор аммиака в воде обладает оснóвными свойствами. | |
| Раствор аммиака в воде обладает основными свойствами, так как при хранении в открытом виде аммиак испаряется, отсюда и название. | | |
| 7. Рефлексия. |
| Возможные варианты ответов: - умение самостоятельно изучать новый материал, опираясь на ранее полученные знания, разрешать противоречия. - подтверждать все практикой. | |
| |
| - эксперимент, знание теории, умение правильно использовать ранее полученные знания. - еще раз убедились в том, что строение, тип связи, физические и химические свойства вещества, а знание свойств помогает определить области применения. - осознание физических и химических свойств через строение вещества и эксперимент, постоянно приходилось мыслить, рассуждать, появилась уверенность, что самостоятельно можем изучать новый материал. | |
| | Помогаю учащимся сделать вывод, что они приобрели опыт проведения теоретического и экспериментального исследования. «Давайте попробуем сформулировать шаги исследования» |
| |
| 8. Выставление и обоснование оценок. Цель: создание условий для формирования умений оценивать собственную учебную деятельность. |
| | Учащиеся оценивают работу своих одноклассников, дают обоснование оценкам. |
Литература
- Васильева Т.К. Семинар по теме «Круговорот азота в природе»// Химия в школе.-2008.- №6.- С. 25-30.
- Габриелян О.С.Химия, 9класс – М.: Дрофа, 2004.
- Городова Н.М. Сборник тестовых заданий по химии для 8-9 классов. –М.:Наука,2000.
- Готовимся к единому государственному экзамену. Химия / Габриелян О.С. и др. –М.: Дрофа 2008.
- Дзудцова Д.Д. Окислительно-восстановительные реакции. М.: Дрофа, 2008.
- Ефимкина А.И. Организация и проведение исследовательского урока // Химия в школе.-2008. №4.- С. 28-33.
- Журин А.А. Элементы медиаобразования на уроках химии // Химия в школе. – 1988. -№4.- с. 20-27.
- Иванова Р.Г. Изучение химии в 9-10 классах. –М.: Просвещение, 1983.
- Кирсанова Н.А. Наш подход к разработке тематических заданий// Химия в школе.-2006.-№7.- С. 38-41.
- Книга для чтения по неорганической химии. – М.: Просвещение, 1984.
- Кузнецова Н.Е. Учебник для 9 класса общеобразовательных учреждений. – М.: Вентана-Граф, 2010.
- Кузнецова Н.Е. Задачник по химии. 9 класс – М.: Вентана-Граф, 2004.
- Куимова О.К. Исследование как метод изучения нового материала.// Химия в школе2001.-№1.
- Панова А.Г. Урок-путешествие по теме «Производство аммиака» // Химия в школе.-2008.-№9.-С. 34-38
- Попова О.А. Тестовые задания для проверки знаний учащихся по химии. – М.: Творческий центр, 2001.
- Популярная библиотека химических элементов. М.: Наука,1983.
- Преподавание неорганической химии в 9 классе. -М.: Просвещение, 1980.
- Радецкий А.М.Смотр знаний по теме «Подгруппа азота» // Химия в школе. – 2001. –№9. – С. 33-38.
- Радецкий А.М. Дидактический материал по химии. -М.: Просвещение. 2005.
- Сборник контрольных работ по химии. 8-9 классы. Методическое пособие для учителя./ Под редакцией А.А.Кавериной. – М.: АРКТИ, 1997.
- Соколова О.Н.Проектирование урока// Химия в школе. – 2006. – №4. – С. 36-38.
- Титова И.М.Дифференцированное обучение химии по двухуровневым учебникам автора Кузнецовой Н.Е. и других. – М. Вентана-Граф, 2002–2003.
- Суровцева Р.П. Система самостоятельных работ учащихся при изучении азота и его соединений.// Химия в школе - 1992.-№3-4. – С. 28 – 31.
- Химия на досуге: учение с развлечением.- М.: Центрхимпресс, 2006.
