«Челябинской государственной медицинской академии Федерального агентства по здравоохранению и социальному развитию»
| Вид материала | Документы |
- «Ставропольской государственной медицинской академии Федерального агентства по здравоохранению, 531.55kb.
- У населения крайнего севера, 1162.99kb.
- «Уральской государственной медицинской академии дополнительного образования Федерального, 748.97kb.
- Мониторинг микробиоценозов влагалища в системе эпидемиологического надзора при инфекционно-воспалительных, 633.15kb.
- Мониторинг микробиоценозов влагалища в системе эпидемиологического надзора при инфекционно-воспалительных, 642.63kb.
- «Пермская государственная медицинская академия имени академии Е. А. Вагнера Федерального, 315.55kb.
- Эпидемиологическая характеристика и лабораторная диагностика урогенитальных инфекций,, 298.26kb.
- Фомин Михаил Владимирович ТоксиколОго-гигиеническая характеристика компонентов производства, 338.79kb.
- Гепатопротекторные свойства флавоноидов (фармакодинамика и перспективы клинического, 671.3kb.
- Особенности кардио-респираторной системы у больных зрелого возраста с воронкообразной, 306.11kb.
Таблица 2.
Оценка курительного статуса обследуемых студентов
| Показатель | M±m |
| ИК | <120 |
| Число выкуриваемых сигарет в сутки | 9,4±1,2 |
| Стаж курения | 5,42±1,36 |
| Средний показатель никотиновой зависимости в баллах | 4,92±0,10 |
| Средний показатель слабой никотиновой зависимости в баллах | 3,5±0,13 |
| Средний показатель умеренной никотиновой зависимости в баллах | 4,82±0,12 |
| Средний показатель высокой никотиновой зависимости в баллах | 7,35±0,06 |
Для детального изучения степени никотиновой зависимости проведен анализ анкеты Фагерстрома, данные приведены на рисунке 2.
Рисунок 2. Распределение курящих студентов по степени никотиновой зависимости.
Опрос студентов показал, что 36% в качестве основной причины развития у них привычки курения указывали «пример окружающих», 30% считали, что курение помогает снять стресс, 22% полагали, что курение вызывает «положительные» эмоции окружающих, 12% курят для «создание имиджа».
Согласно данных теста D. Horn (1976), в большинстве случаев у всех обследованных курящих (n=150) тип курительного поведения носил смешанный характер, преобладающим типом курительного поведения у обследуемых студентов был тип «расслабление», частота которого составляет 39,3% (мужчин – 35%, женщин – 41%). Пациенты курят только в комфортных условиях, с помощью курения получают «дополнительное «удовольствие» к отдыху. Бросают курить долго, много раз возвращаясь к курению (рис. 3).
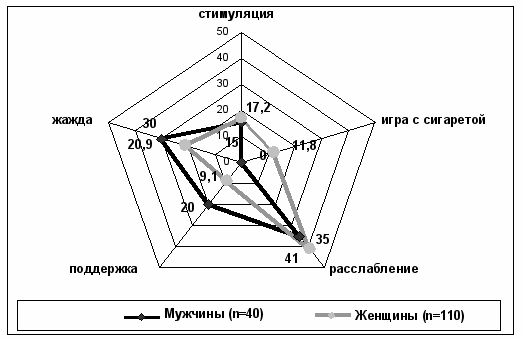
Рисунок 3. Тип курительного поведения обследуемых студентов по тесту Д.Хорна.
Следующими по частоте типами курительного поведения у обследуемых курящих студентов были типы: «жажда» - 23,0% (мужчин – 30%, женщин – 20,9%) и «стимуляция» - 18,0% (мужчин – 15%, женщин – 17,2%), при которых пациент закуривает когда снижается концентрация никотина в крови. В конечном счете, курильщики с данным типом курительного поведения нуждаются в увеличивающихся уровнях никотина, чтобы чувствовать себя «нормально».
Тип курительного поведения «поддержка» установлен у 12% обследуемых (мужчин – 20%, женщин – 9,1%), он связан ситуационно с волнением, эмоциональным напряжением, психологическим дискомфортом.
Тип курительного поведения «игра с сигаретой» наблюдался у 11,8% женщин. Для этого типа характерен низкий индекс курильщика, слабая НЗ или отсутствие ее, курение происходит только в ситуациях общения «за компанию».
Тип курительного поведения «рефлекс», который характеризуется тем, что курят автоматически и много (35 и более сигарет в день), не осознавая причин своего курения, в группе обследованных не наблюдался.
При слабой НЗ (3,5±0,13) у пациентов достоверно преобладал тип курительного поведения типа «расслабление» - 18,7%, «игра с сигаретой» - 8,6%. При умеренной НЗ (4,76±0,12 баллов) существенно чаще выявлялся тип курительного поведения «расслабление» - 21% случаев и «поддержка» - 12%, при высокой НЗ «стимуляция» - 18,0%, «жажда» - 23,0%.
При проведении настоящего исследования со всеми курящими студентами проводились индивидуальные психотерапевтические беседы о необходимости бросить курить. В процессе психотерапевтических бесед поддерживали решение пациентов снизить интенсивность курения вплоть до отказа от курения, подчеркивая, что это решение очень важно для сохранения здоровья.
Согласно проведенного анкетирования, 62% студентов в той или иной степени имели мотивацию к отказу от табакокурения, 38% не желали отказаться от привычки курения, поскольку уже пытались это сделать несколько раз. Процесс отказа от курения сложный и порой волнообразный процесс, с возможными рецидивами и срывами. В связи с этим в рамках прохождения курса лечения в медицинском центре пациенту предлагалась не только психологическая поддержка, но и применение сочетанных физических факторов (ФФ).
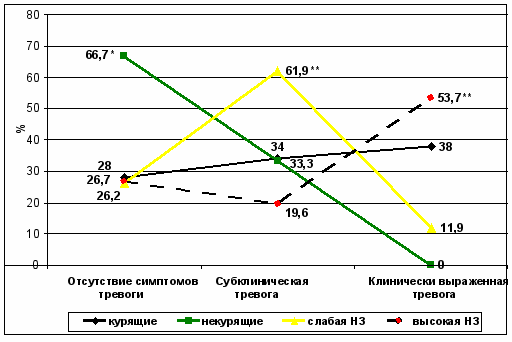
Учитывая, что часто потребность в курении возникает у курильщиков в состоянии тревоги, у всех лиц, включенных в исследование, проводили оценку состояния тревоги по госпитальной шкале Гамильтона (HARS). Результаты представлены на рисунке 4.
Примечание:
* р < 0,05 - достоверность различий между курящими и некурящими у пациентов c отсутствием симптомов тревоги.
** - р < 0,01 – достоверность различий между группами со слабой НЗ и с высокой НЗ у пациентов с субклинической и клинически выраженной тревогой.
Рисунок 4.Оценка состояния тревоги по шкале Гамильтона (HARS) и показатели тревоги при наличии никотиновой зависимости у студентов.
По данным, представленным на рисунке 4 видно, что отсутствие симптомов тревоги среди курящих отмечено достоверно реже (28%), по сравнению с некурящими (66,7%). Субклиническая тревога установлена с равной частотой в обеих группах (34% и 33,3%), но средний балл выраженности тревоги был у курящих достоверно выше, чем у некурящих. Клинически выраженная тревога выявлена только у курящих пациентов (в 38%) и не зарегистрирована ни у одного из некурящих студентов. Клинически чувство тревоги проявлялось в виде внутреннего напряжения, повышения эмоционального фона, в форме психологического дискомфорта.
В целом, как показали представленные данные тревожный синдром достоверно чаще выявляется у курящих, а его выраженные степени регистрируются только у курящих студентов.
В целом анализ клинических симптомов тревоги позволяет заключить, что у курящих студентов с высокой НЗ достоверно чаще выявляется клинически выраженная тревога (53,7%) по сравнению с субклинической тревогой (19,6%) и отсутствием тревоги (26,7%). У курящих со слабой НЗ достоверно чаще выявляется субклиническая тревога (61,9%) по сравнению с клинически выраженной тревогой (11,9%) и отсутствием симптомов тревоги (26,2%). Следовательно это косвенно подтверждает связь табакокурения с развитием стрессовых реакций.
Для точной верификации объективных признаков стрессовых реакций у студентов далее было определено содержание одного из стрессовых гормонов (кортизола) в слюне. Полученные результаты представлены в таблице 3 в виде универсальной средней медианы (Ме) нижних (Q25%) верхних квартилей (Q75%).
Уровень кортизола в слюне у курильщиков в сопоставлении с некурящими студентами повышен более чем в 2 раза.
Таблица 3.
Уровень кортизола в слюне обследуемых студентов
| Показатель | Группа курящих (n=60) | Группа некурящих (n=30) | Р |
| Me (Q25%-Q75%) | Me (Q25%-Q75%) | ||
| Кортизол нг/мл | 170 (131-194) | 64 (40-90) | <0,01 |
Нами был определен уровень кортизола в слюне у курящих студентов с клинически выраженной тревогой в сопоставлении с некурящими студентами, у которых выраженной степени тревоги не было зарегистрировано ни у одного пациента, эти данные приведены в табл.4.
Таблица 4.
Уровень кортизола при клинически выраженной тревоге
| Показатель | Группа курящих с клинически выраженной тревогой (n=57) | Группа некурящих (n=30) | P |
| Me (Q25%-Q75%) | Me (Q25%-Q75%) | ||
| Кортизол нг/мл | 83 (78-89) | 64 (40-90) | <0,01 |
Как следует из таблицы 4 уровень кортизола у курящих студентов с клинически выраженной тревогой кортизол в 1,3 раза выше в сравнении с группой некурящих (р<0,01).
Далее был проведен корреляционный анализ взаимосвязи уровня кортизола в слюне и показателей выраженности тревоги в баллах у курящих студентов, а также показателей, отражающих степень НЗ индивидуума. Установлено, что количественные показатели кортизола в слюне достоверно и положительно коррелировали с клинически выраженной тревогой (r=0,699), а также особенно с высокой НЗ (r= 0,829), что отражает сильную корреляционную взаимозависимость. На основе полученных данных невозможно выявить, какой из процессов первичен, однако ясно, что патогенез формирования высокой степени НЗ, несомненно, связан с гормональными особенностями развития генерализованного адаптационного синдрома и с состоянием высокого уровня тревоги.
Исследование функции внешнего дыхания в данной работе нами проведено в соответствии с рекомендациями Европейского респираторного общества. Оценка спирометрических показателей выполнена по отношению к должным величинам в процентах.
FVC % - форсированная жизненная ёмкость легких;
FEV1 % - объем форсированного выдоха за 1 секунду;
FEV1/FVC – индекс Тиффно;
MEF75, MEF50, MEF25 – средний экспираторный поток, уровень потока на (75%, 50%, 25%) остаточного выдоха.
При определении функции внешнего дыхания отношение FEV1/FVC является чувствительным параметром оценки ограничения воздушного потока. У пациентов, включенных в настоящее исследование, достоверных различий между группой курящих и некурящих по показателям спирографии не установлено, что можно объяснить молодым возрастом обследуемых, относительно небольшим стажем курения, не превышающим 5 лет, индексом курения, не превышающим критической величины 120.
При анализе показателей крови не выявлено каких-либо достоверных различий между группой курящих и некурящих.
Компоненты табачного дыма при курении, могут существенным образом изменять функцию слизистого эпителиального барьера и состояние мукозоассоциированной лимфоидной ткани.
Таблица 5.
Показатели врожденного и приобретенного мукозального иммунитета слюны у обследуемых студентов
| Показатели | Группа курящих n=90 | Группа некурящих n=30 | Р | ||
| Mе | Q25% -Q75% | Mе | Q25% -Q75% | ||
| Белок, мг % | 181,5 | 138-210 | 306 | 230-372 | <0,01 |
| Муцин, мг % | 76 | 40-138 | 46 | 24-88 | <0,05 |
| Лактоферрин нг/мл | 8120 | 7080-9880 | 2860 | 1560-4680 | <0,01 |
| CH50, усл.ед. | 44,9 | 43,8-46,9 | 39,05 | 33,7-42,7 | >0,05 |
| C1, эф. мол. х 108/мл | 2,65 | 1,2-3,9 | 1,8 | 0,1-2,9 | <0,01 |
| C2, эф. мол. х 108/мл | 1,45 | 0,7-2,8 | 1,2 | 0,3-2,2 | >0,05 |
| C3, эф. мол. х 108/мл | 2,1 | 0,4-4 | 2,3 | 0,7-3,1 | >0,05 |
| C4, эф. мол. х 108/мл | 1,75 | 0,5-4,3 | 1,8 | 0,4-2,7 | >0,05 |
| C5, эф. мол. х 108/мл | 1,9 | 0,8-2,7 | 2,2 | 1,3-5,2 | <0,05 |
| IgG,мкг/мл | 1,31 | 0,8-1,9 | 0,6 | 0,4-0,9 | <0,01 |
| SlgA, мкг/мл | 315,2 | 268,8-373,2 | 139,4 | 117,6-178 | <0,01 |
| TNF -α, пг/мл | 6,045 | 3,18-9,81 | 0,01 | 0,01-0,45 | <0,01 |
| IL-8, нг/мл | 64,62 | 50,1-72,5 | 43,84 | 20,5-53,4 | <0,01 |
| NO2, мкМоль/л | 2,15 | 0,2-5,2 | 1,3 | 1-2,3 | <0,05 |
| NOх мкМоль/л | 19,65 | 11-31 | 11,2 | 6,8-15,6 | <0,01 |
| NO3, мкМоль/л | 17,5 | 18,7-30,6 | 9,9 | 6-14 | <0,01 |
Примечание: р - достоверность различий между курящими и некурящими .
Как видно из таблицы 5, имеются статистически значимые различия в количественных характеристиках большинства изучаемых показателей слюны у курящих и некурящих молодых людей. Обнаружено в группе
курящих более низкое содержание общего белка в слюне, что может быть связано с уменьшением уровня продукции белка в составе слюнной жидкости, с усилением саливации под влиянием раздражающих агентов табачного дыма. Анализ состояния показателей врожденного мукозального иммунитета слюны у курящих молодых людей показывает, что на фоне снижения общего белка в слюнной жидкости у них происходит рост таких показателей, как муцин, лактоферрин, меняется активность отдельных компонентов системы комплемента.
Так, у курящих выявлено достоверное повышение содержания муцина в слюне (р <0,05). Продуцентом муцина, как известно, являются бокаловидные клетки слизистых оболочек. Муцин обладает широким спектром защитного действия.
У курящих студентов в сопоставлении с группой некурящих в слюне отмечается рост содержания лактоферрина, источником которого являются нейтрофилы. Почти трехкратный рост уровня лактоферрина может отражать усиление секреции данного биологически активного компонента лейкоцитами, либо в результате активации функции каждой клетки-продуцента, либо вследствие усиления эмиграции нейтрофилов из сосудов в секреты респираторного тракта в результате действия табачного дыма. Лактоферрин, как известно, обладает выраженными антимикробными свойствами в результате осуществления транспортной функции железа, конкурируя за связь с ним с патогенными микробами, но вместе с тем он относится к острофазовым белкам воспаления, является маркером усиления секреторной функции лейкоцитов.
Общая активность системы в слюне у курящих студентов, а также активность таких компонентов, как С3, С4, участвующих в активации системы по классическому пути, достоверно не меняется. Активность С1 компонента, имеющего ключевое значение в инициации активации системы достоверно растет, в то время как один из терминальных компонентов (С5), имеющий ключевую роль в регуляции иммунного ответа, его поляризации в определенном направлении, в развитии эндогенного воспаления, напротив, уменьшается. Формирование дисбаланса активности компонентов классического пути отражает, вероятно, усиление начального этапа активации системы комплемента по классическому пути и потребление образующихся продуктов расщепления С5, которые являются анафилотоксинами и прикрепляются к тучным клеткам, вызывая их дегрануляцию, а также являются хемоаттрактантами, привлекающими в очаг активации лейкоциты.
Нами был проведен анализ состояния цитокин- и нитроксидергической регуляции у курящих молодых людей на основе изучения конечных стабильных метаболитов оксида азота и определения количества провоспалительных цитокинов TNF–α и IL-8 в слюне.
Выявление у курящих молодых людей в сравнении с некурящими роста уровня муцина, продуцируемого бокаловидными клетками, лактоферрина, источником которого являются лейкоциты, изучаемых иммуноглобулинов в слюне, продуцируемых плазматическими клетками МАLТ и других периферических органов иммунной системы, уровня NO, источником которого являются эндотелиоциты и макрофаги, IL-8, продуцируемого эпителиоцитами и макрофагами, позволяет констатировать стимулирующий эффект табакокурения на клетки, обладающие секреторными функциями. При этом многие анализируемые вещества (лактоферрин, белки системы комплемента, NO, TNF–α , IL-8) являются не только микробоцидными факторами, но и общепризнанными медиаторами воспаления, могут оказывать существенное влияние на флогогенный потенциал секретов слизистых оболочек.
Анализ характера взаимосвязей между иммунологическими показателями слюны у некурящих студентов отражает таблица 6.
Таблица 6
Корреляционная зависимость между иммунологическими показателями у некурящих молодых лиц
| Показатели | R Spearman | P |
| Количество белка – SIgA | +0,377 | <0,05 |
| Количество белка – IgG | +0,413 | <0,05 |
| Количество муцина -СН50 | +0,403 | <0,05 |
| Количество муцина - NO2 | -0,403 | <0,05 |
| Активность C3 - C4 | +0,448 | <0,05 |
| Активность C3 – количество лактоферрина | -0,419 | <0,05 |
| Всего достоверных связей | 6 | |
В группе некурящих всего установлено достоверных корреляционных связей средней силы (6), при этом превалировали положительные корреляционные связи (4). Выявлены позитивные корреляционные связи между количеством белка в слюне и уровнями иммуноглобулинов (SIgA, IgG), между количеством муцина и общей активностью комплемента, а также между активностью компонентов комплемента (С3, С4). Отрицательные связи установлены для пар: количество муцина и уровень NO2, а также активность С3 и уровень лактоферрина.
Иной характер корреляционных взаимосвязей выявлен у курящих студентов между иммунологическими показателями слюны, представленный в таблице 7.
Таблица 7.
Корреляционная зависимость между иммунологическими показателями слюны у курящих молодых лиц
| Показатели | R Spearman | P |
| Количество белка – активность С2 | -0,395 | <0,05 |
| Количество белка – активность С4 | -0,683 | <0,05 |
| Количество белка – активность С5 | -0,299 | <0,05 |
| Количество муцина - активность С4 | -0,854 | <0,01 |
| Количество муцина – IgG | -0,746 | <0,01 |
| Количество муцина - IL-8 | -0,385 | <0,05 |
| Количество муцина - TNF-α | -0,708 | <0,01 |
| TNF-α- NO3 | -0,839 | <0,01 |
| TNF-α –кортизол | -0,732 | <0,01 |
| Всего связей | 9 | |
Во-первых, у курящих студентов по сравнению с некурящими несколько увеличилось общее число достоверных корреляционных связей между изучаемыми показателями слюны (9 против 6), во-вторых, появились связи не только слабой и средней силы, но и сильные. В-третьих, все выявленные связи были негативными, в то время как в группе у некурящих встречались и позитивные связи (4 против 2). В-четвертых, появились отсутствующие у некурящих молодых лиц отрицательные корреляционные связи между содержанием общего белка в слюне, с одной стороны, и активностью отдельных компонентов комплемента - с другой. Как следует из определения общего белка слюны и активности комплемента у курящих и некурящих студентов (таблица 5), уровень общего белка у курильщиков снижается, активность С1 белка растет, а С5 достоверно падает. При этом выявлены отрицательные корреляционные связи между уровнем общего белка и активностью С2, С4, С5. Иными словами, чем больше снижается уровень общего белка в слюне у курильщиков, тем больше увеличивается активность С2, С4, С5 компонентов комплемента, что вероятно, отражает локальное усиление продукции этих компонентов макрофагами ротовой полости при действии табачного дыма на клетки.
Выявлена отрицательная достоверная взаимосвязь между уровнем муцина в слюне и активностью компонентов комплемента С4, свидетельствующая о росте активности С4 при снижении количества муцина в слюне и наоборот, о ее снижении при росте количества муцина.
Только у курящих студентов, у которых достоверно растет в слюне количество муцина в сопоставлении с некурящей группой, появляются отрицательные достоверные корреляционные связи между уровнем муцина и количеством в слюне иммуноглобулинов (IgG), а также провоспалительных цитокинов (IL-8 и особенно TNF-α). Негативная связь между количеством муцина и уровнем иммуноглобулинов в слюне, вероятно, определяется ключевой ролью муцина в обеспечении антиколонизационной защиты слизистых оболочек, в результате рост или снижение уровня муцина приводит к колебанию потока антигенов, проникающих через мукосаливарный барьер, и, вероятно, в меньшей степени влияет на проницаемость барьера для обратного тока транспортируемых в слюну иммуноглобулинов.
Колебания продукции муцина бокаловидными клетками слизистых оболочек, вероятно, влияют также на контакт профессиональных антиген-представляющих клеток (АПК), эпителиоцитов ротовой полости с антигенами, для которых муцин является «ловушкой», уменьшающей контакт антигенов с АПК и эпителиоцитами и рецепцию последними внеклеточных сигналов, это может существенно менять уровень продукции цитокинов (IL-8, TNF-α) клетками в зависимости от количества муцина в слюне по обратно пропорциональному принципу.
Только у курящих студентов выявленная достоверная и сильная отрицательная корреляционная связь между уровнями TNF-α и NO3, что подтверждает роль оксида азота, как универсального мессенджера в регуляции функций различных клеток, включая иммуноциты, продуцирующие цитокины. Корреляционный анализ выявил отрицательную корреляционную связь между уровнями TNF-α и кортизола в слюне, что свидетельствует о регулирующей роли стрессовых гормонов в обеспечении функций иммунной системы. Достоверное влияние кортизола на содержание TNF-α в слюне выявлено только у курящих студентов, у которых установлен более высокий уровень данного гормона надпочечников в слюне, чем у некурящих. Эффект кортизола на продукцию TNF-α иммунными клетками ротовой полости может быть опосредован рецепторами для гормона на макрофагах и других АПК, наличие которых установлено на иммуноцитах (Felten D.L., Maida M.E., 2002).
Для анализа взаимосвязи табакокурения и состояния мукозального иммунитета ротовой полости далее был проведен корреляционный анализ иммунных показателей слюны у студентов с высокой степенью НЗ (табл.8).
Из таблицы 8 следует, что число достоверных связей между иммунологическими показателями слюны у студентов с высокой степенью НЗ оказалось равным 23 против 9 в общей группе курящих, все связи положительные.
В целом число связей увеличилось более чем вдвое, что само по себе отражает более выраженное возмущающее действие на мукозальный
иммунный гомеостаз высокой степени табачной зависимости.
Таблица 8.
Корреляционные связи между иммунологическими показателями
слюны у курящих молодых лиц с высокой степенью
никотиновой зависимости
| Показатели | R Spearman | P |
| Количество белка- SIgA | +0,867 | <0,01 |
| Количество белка – IgG | +0,858 | <0,01 |
| Количество белка - IL-8 | +0,768 | <0,01 |
| Количество белка – лактоферрин | +0,256 | <0,05 |
| Лактоферрин – IL-8 | +0,419 | <0,05 |
| Лактоферрин – кортизол | +0,366 | <0,05 |
| Лактоферрин - СН50 | +0,752 | <0,01 |
| NОx - NO2 | +0,352 | <0,05 |
| NОx - NO3 | +0,360 | <0,05 |
| NОx – С1 | +0,284 | <0,05 |
| NОx – С2 | +0,427 | <0,05 |
| NОx –ЛФ | +0,284 | <0,05 |
| TNFα- муцин | +0,393 | <0,05 |
| TNFα –СН50 | +0,366 | <0,05 |
| TNFα - С1 | +0,420 | <0,05 |
| TNFα –IgG | +0,865 | <0,01 |
| TNFα- SIgA | +0,794 | <0,01 |
| TNFα -IL-8 | +0,684 | <0,05 |
| IL-8 - СН50 | +0,733 | <0,01 |
| IL-8 – С1 | +0,320 | <0,05 |
| IL-8 – С5 | +0,528 | <0,05 |
| IL-8 – IgG | +0,726 | <0,01 |
| IL-8 – SIgA | +0,695 | <0,05 |
| Всего связей | 23 | |
Установлены достоверные положительные сильные корреляционные связи между уровнем общего белка в слюне, с одной стороны, и количеством SIgA, IgG, IL-8 – с другой. Слабая, но достоверная позитивная корреляционная связь выявлена при высокой НЗ между количеством белка в слюне и лактоферрина, продуценом которого являются в основном нейтрофилы ротовой полости. Усиление локальной продукции иммунных белков (иммуноглобулинов, IL-8, лактоферрина) способствуют параллельному росту в слюне уровня общего белка.
Логичной представляется также связь между уровнем лактоферрина и IL-8, ибо лактоферрин продуцируется нейтрофилами, а IL-8 относится к хемокинам, которые образуется профессиональными и непрофессиональными антиген - представляющими клетками и усиливают приток и эмиграцию лейкоцитов из кровотока в ткани и биологические жидкости.
Связь между уровнем лактоферрина в слюне и кортизолом также может объясняться усилением миграции лейкоцитов из центральных органов лейкопоэза на периферию под влиянием кортизола и с усилением секреции лактоферрина.
Результаты корреляционного анализа подтверждают значимость систем комплемента, цитокинов и NO в регуляции функции врожденного и адаптивного иммунного ответа, о чем свидетельствуют выявленные связи между: системой NO и активностью компонентов комплемента, лактоферрина; системой цитокинов (IL-8, TNF-α, с одной стороны, и активностью системы комплемента, содержанием в слюне SIgA, IgG – с другой). Для анализа взаимосвязи табакокурения и состояния мукозального иммунитета ротовой полости далее был проведен корреляционный анализ иммунных показателей слюны у студентов с НЗ (таблица 9).
Таблица 9.
Корреляционные связи между иммунологическими показателями слюны у курящих молодых людей и никотиновой зависимостью
| Показатели | R Spearman | P |
| Никотиновая зависимость - С2 | +0,466 | <0,01 |
| Никотиновая зависимость - С4 | +0,464 | <0,01 |
| Никотиновая зависимость – SigA | +0,680 | <0,01 |
| Никотиновая зависимость – IgG | +0,362 | <0,05 |
| Никотиновая зависимость - IL-8 | +0,768 | <0,01 |
| Никотиновая зависимость - TNF-α | +0,827 | <0,01 |
| Никотиновая зависимость - NOx | +0,782 | <0,01 |
| Никотиновая зависимость – ЛФ | +0,817 | <0,01 |
| Никотиновая зависимость - кортизол | +0,829 | <0,01 |
Как видно из данных таблицы 9 выявлена достоверная связь количественных показателей мукозального иммунитета слюны с НЗ у обследуемых молодых людей. Так, достоверная позитивная корреляционная связь слабой силы с уровнем НЗ установлена для активности компонентов комплемента С2 и С4. Выявлена достоверная корреляционная связь между НЗ и уровнем IgG в слюне (r=0,362 при р<0,05).
Более высокий позитивный коэффициент корреляции и при более высокой степени достоверности установлен между степенью НЗ и количеством SIgA в cлюне ( r= 0,680 при р<0,01). Характер связи между степенью НЗ и уровнем IgG в слюне позволяет сделать заключение, что интенсивное табакокурение у молодых лиц, имеющих НЗ, приводит к усилению функции мукозоассоциированной лимфоидной ткани и повышает продукцию SIgA, его активный транспорт через слизистую оболочку в ротовую полость. Менее выраженная связь НЗ с уровнем IgG в слюне позволяет предполагать меньшее влияние табакокурения на проницаемость мукозосаливарного барьера, определяющего пассивное поступление данного класса IgG из крови в слюну. Еще более сильные положительные связи с уровнем НЗ при высоком уровне достоверности (p<0,01) зарегистрированы для цитокинов IL-8 и TNF-α (r=0,768 и r=0,827), терминальных конечных стабильных метаболитов оксида азота (r=0,782), лактоферрина (r=0,817), в совокупности определяющих эндогенный провоспалительный потенциал биологической жидкости. Установленные корреляционные связи свидетельствуют об увеличении провоспалительного потенциала слюны у молодых курильщиков с ростом степени НЗ. Выявленные изменения подтверждают определенные закономерности при повышении степени НЗ у молодых людей: преимущественные изменения характера цитокин-, комплемент- и нитроксидергической регуляции на мукозальном уровне, которые сопряжены не только с определенными типами иммунного ответа, но также с обеспечением высокого уровня флогогенного потенциала слюны.
В таблице 10 приведен коэффициент корреляции для пары никотиновая зависимость – уровень кортизола в слюне, который был самым высоким среди изучаемых пар показателей (r =0,829 при р<0,01). Установленная корреляционная связь свидетельствует о достоверности связи НЗ и уровня данного стрессового гормона в биологических жидкостях.
На первом этапе наших исследований был выбран электросон и электросонфорез (ЭСФ) с препаратом мексидол. В основе эффекта электросна лежит улучшение функционального состояния центральной нервной системы, корково-подкорковых взаимоотношений: таламус, гипоталамус, гипофиз, лимбическая система (Гуляев В.Ю., Оранский И.Е., 1995; Улащик В.С., Лукомский И.В., 2003). Лечебный процесс в виде курсовых воздействий завершается долговременной адаптацией организма с формированием структурно-метаболического следа, благодаря которому эффект лечения сохраняется в длительном периоде последствий (Зубкова С.М., 2006). Для изучения использовалось также сочетание электросонфореза (ЭСФ) с мексидолом.
Мексидол является препаратом нового типа как по механизму, так и по спектру фармакологического действия и обладает существенными преимуществами перед известными нейро-психотропными препаратами.
Молодые курящие пациенты были распределены методом рандомизации на две группы, получавшие разное лечение. В первую группу были включены пациенты (n=24), получавшие процедуры электросна с помощью аппарата «Электросон-10-5» (сила тока – до ощущения покалывания. Электросон проводили ежедневно, время воздействия 20 – 30 минут, с постепенным увеличением продолжительности каждой процедуры. Курс лечения – 6 процедур.
Вторую группу (n=27) составили пациенты, которые получали процедуры ЭСФ с 5% раствором мексидола (2 мл) с помощью аппарата «Электросон - 10-5» в том же режиме, что и в первой группе. Процедуры проводили ежедневно, используя лобно-затылочное воздействие.
Мы проанализировали анкеты, заполняемые студентами с высокой степенью мотивации к отказу от курения. Несомненно, идеальной ситуацией для любого индивидуума было решение отказаться от курения. Самостоятельному решению отказа от курения способствовало занятие спортом (60%), желание добиться успехов в спортивных соревнованиях, а также желание молодых женщин иметь здоровое поколение (25%) при создании семьи в ближайшем будущем. Положительное влияние имел запрет курения в общественных местах в 15%.
Как уже отмечено выше, перед началом лечения проводилась индивидуальная психотерапия, основанная на убеждении и разъяснении риска, которому подвергает свой организм курящий человек, т.к. для получения конечного эффекта очень важны глубокое осознание этого риска и принятие на себя ответственности пациентом за свое здоровье. Оценку курительного поведения студентов проводили до и после лечения.
Тип курительного поведения по анкете Д. Хорна до физиотерапевтического воздействия в большинстве случаев носил смешанный характер, преимущественно «расслабление», «поддержка» (у 42 пациентов), «игра с сигаретой» (у 9 пациентов). Курительные типы поведения «рефлекс» и «жажда», когда курят много, в любых ситуациях, в исследуемых группах не наблюдались. Сравнительная оценка изменения типа курительного поведения курящих студентов по анкете Д. Хорна до и после влияния электросна и электросонфореза с мексидолом показана на рисунке 5.
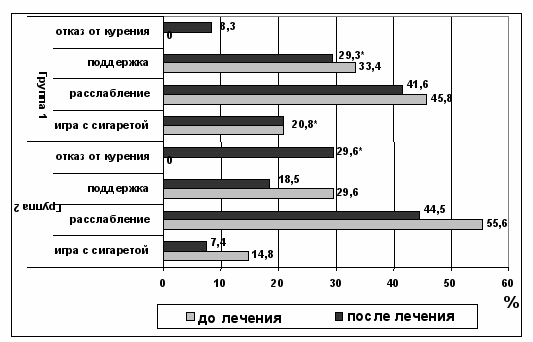
Примечание: * р < 0,05 – достоверность различий между 1-ой и 2-ой группами после лечения.
Рисунок 5. Сравнительная оценка изменения типа курительного поведения курящих студентов по анкете Д. Хорна до и после влияния электросна и электросонфореза с мексидолом.
Анализ данных, приведенных на рисунке 5, показывает, что в целом в 1-ой группе, получавших процедуры электросна, отказ от курения был отмечен лишь у 2 (8,3%) пациентов сразу после окончания курса.
Во 2-ой группе после лечения ЭСФ с мексидолом, отказ от курения отмечался сразу после проведенного курса у 8 (29,6%) пациентов. Изменение курительного поведения в процентном отношении показано на рисунке 5. После проведенного курса в обеих группах через 7 дней 10 человек отказались от курения, у 10 человек изменился тип курительного поведения. У всех бросивших курить синдром отмены нарастал. У 20 человек через 7 дней наблюдался синдром отмены курения в виде: алгий различной локализации, сухости во рту, жажды, головной боли и раздражительности.
Все пациенты 1 и 2 групп отказавшиеся от курения и изменившие тип курительного поведения через 7 дней вновь вернулись к пагубной привычке.
Таким образом, электросон и ЭСФ в комбинации с мексидолом (ЭСФ) не привели к коренному изменению поведенческой модели курящего. В связи с этим, в дальнейшем был выбран метод сочетанного воздействия ФФ установки «Альфамассаж-33», основанный на применении новых технологий немедикаментозной терапии.
Воздействие сочетанных физических факторов на курительное поведение молодых людей осуществлялась с помощью установки «Альфамассаж-33», с выбранной нами программой. В этой программе были использованы следующие основные физические факторы: действие вибромассажа, термических факторов (суховоздушная баня), ароматерапия. Включение в программу вибромассажа основано на том, что механические колебания (вибрация) и их специфические особенности качественно отличают вибрационный фактор от других физических агентов. Массажные вибрации средней интенсивности (50Гц) проводились в капсуле в положении лежа на область спины, поясницы, конечностей, термовоздействие (суховоздушная баня) со средним подогревом – 650С, ароматерапия всего тела (ель, сосна, эвкалипт). Лечение включало 6 процедур ежедневно продолжительностью 30 минут при отсутствии каких-либо побочных негативных эффектов. Термотерапия (суховоздушная баня) повышает активность термозависимых биохимических реакций, усиливает выведение токсинов при учащении дыхательных движений, а также, с потом и через почки (Пономаренко Г.Н., 2002, 2005).
Все включенные в исследование курящие молодые пациенты были разделены на две группы: 1 группа (90 человек) получала сеансы психотерапии с сочетанием ФФ, направленные на активизирование роли самого пациента по избавлению от табакокурения, изменению поведенческой курительной модели, эта группа подвергалась сочетанному воздействию ФФ с помощью аппарата «Альфамассаж-33»; 2 группа курящих (60 человек) получала только сеансы психотерапии. Группы были сопоставимы по полу (в 1-ой группе мужчин-27, женщин-63, во 2-ой группе 13 и 47 соответственно), по возрасту, средний возраст в 1-ой группе (20,67±0,40), во 2-ой группе (20,68±0,55) лет, по стажу курения, индексу курения, числу лиц с разными степенями НЗ. Нами была проведена оценка курительного поведения молодых лиц курильщиков до и после лечения (рис.6).
Примечание: р< 0,05 – достоверность различий до и после лечения.
Рис. 6. Сравнительная оценка типа курительного поведения по Д.Хорна
до и после лечения в группах разных методов лечения.
Согласно анкете Д.Хорна в 1 группе под влиянием сочетанных ФФ наиболее чаще наблюдался тип – «расслабление» - 46,8% и «игра с сигаретой» - 22,3%, что отражает уменьшение количества выкуриваемых сигарет пациентами вплоть до отказа от курения. Во 2 группе после проведения психотерапии тип «расслабление» наблюдался у 40%, «игра с сигаретой» у 8,4%, который остался на том же уровне, отказа от курения не выявлено.
Изменение курительного поведения после лечения в 1 группе отмечено у 59 пациентов (65,5%), отказались от курения 12 человек (13,3%).
Как видно из таблицы 10 после психотерапии, воздействия термовибромассажа и ароматерапии установки «Альфамассаж-33», отмечено достоверное снижение показателей суммарного балла при субклинической и клинически выраженной тревоге, с 9,22±0,11 до 5,46±0,14 и с 12,95±0,16 до 6,70±0,14. Достоверных изменений уровня тревоги при проведении только рациональной психотерапии не было отмечено.
Таблица 10.
Динамика уровня тревоги по шкале Гамильтона (HARS) в баллах
в обследуемых группах
| Показатели Тревоги | Курящие, получающие психотерапию в сочетании с ФФ 1 группа (n=90) | Курящие, получающие психотерапию 2 группа (n=60) | ||
| до Лечения | после лечения | до лечения | после лечения | |
| Субклиническая тревога. 8-10 баллов | 9,22±0,11* | 5,46±0,14* | 8,77±0,33 | 8,67±0,32 |
| Клинически выраженная тревога. 11 и выше | 12,95±0,16* | 6,70±0,14* | 12,08±0,14 | 11,08±0,11 |
Примечание: *р<0,05-достоверность различий в 1-ой группе до и после лечения.
Далее нами проведен анализ уровня НЗ до и после профилактического лечения.
Таблица 11.
Эффект действия психотерапии и сочетанных физических факторов на уровень никотиновой зависимости
| Тест Фагерстрома | Курящие, получающие психотерапию в сочетании с ФФ 1 группа (n=90) | Курящие, получающие психотерапию 2 группа (n=60) | ||
| до лечения | после лечения | до лечения | после лечения | |
| Слабая никотиновая зависимость | 3,5±0,13* | 1,52±0,18* | 3,41±0,12 | 3,31±0,11 |
| Умеренная никотиновая зависимость | 4,82±0,12* | 3,06±0,14* | 4,54±0,15 | 4,41±0,13 |
| Высокая никотиновая зависимость | 7,35±0,10* | 5,73±0,12* | 7,28±0,13 | 7,18±0,12 |
Примечание: * р <0,05 – достоверность различий до и после лечения.
Как следует из таблицы 11 отмечено достоверное снижение никотиновой зависимости в 1-ой группе, особенно высокой НЗ с 7,35±0,10 до 5,73±0,12, что отражает влияние сочетанных физических факторов на снижение табачной интоксикации. Во 2-ой группе изменений НЗ не отмечено.
До проведения лечения «Альфамассаж-33» были выявлены вегетососудистые симптомы: утомляемость (92%), раздражительность (85,3%), снижение настроения (78,6%), возникла необходимость квантифицировать симптомы в баллах (Feinstein A.R., 1983) при различной степени никотиновой зависимости, изучить влияние воздействия сочетанных физических факторов «Альфамассаж-33» на изменение этих симптомов и выявить эффективность лечения в процентах.
Сочетанный метод совместно с психотерапией способствовал ускорению процесса изменения поведенческой модели курящего, восстановлению вегетативных симптомов от 53% до70%.
После проведенного воздействия сочетанных ФФ капсулы «Альфамассаж-33» в таблице 12, отмечено достоверное снижение кортизола в 2 раза, что отражает нормализацию течения генерализованного адаптационного синдрома под влиянием профилактических мероприятий.
Таблица 12.
Изменение уровня кортизола в слюне после курса лечебно-профилактических мероприятий у курильщиков
| Показатель | Группа курящих до лечения (n=60) | Группа курящих после лечения (n=60) | Группа некурящих (n=30) | Р |
| Me (Q25%-Q75%) | Me (Q25%-Q75%) | Me (Q25%-Q75%) | ||
| Кортизол нг/мл | 170 (131-194) | 85 (30-140) | 64 (40-90) | <0,01 |
Примечание: р – достоверность различий до и после лечения
Наши исследования подтверждают возможность эффективного и безопасного применения программ термовибромассажа и ароматерапии капсулы «Альфамассаж-33» в период отказа от курения. Следующим этапом исследования был анализ ранее не изученных эффектов сочетанных ФФ в отношении показателей мукозального иммунитета.
Изучение качественного состава слюнной жидкости, благодаря новым иммунологическим технологиям, позволило исследовать индивидуальные вариации отдельных механизмов мукозального иммунитета при табакокурении. Нами выполнено рандомизированное исследование эффективности сочетанных факторов комплексной установки «Альфамассаж-33» на показатели секреторного иммунитета.
Пациенты были распределены на две сопоставимые по возрастно-половому составу группы. 1-ая группа составила 90 человек, которым проведена индивидуальная психотерапия, рекомендуемая для усиления мотивации отказа от курения, и сочетанное воздействие термовибромассажа и ароматерапии с помощью аппарата «Альфамассаж-33», 2-ая группа составила 60 пациентов, которая получала психотерапию без воздействия сочетанных ФФ и группа некурящих 30 человек. В капсуле «Альфамассаж-33» была выбрана программа: вибротерапия средней интенсивности 50 Гц на область спины, поясницы, конечностей, термовоздействие (суховоздушная баня) со средним подогревом 650С с ароматерапией (ель, сосна, эвкалипт). Нами впервые изучено воздействие факторов «Альфамассаж-33» на показатели мукозального иммунитета при ТК у молодых лиц и проведена сравнительная оценка показателей мукозального иммунитета, до и после проведенного лечения. Результаты представлены в таблице 13.
Как видно из таблицы 13, у курильщиков 1 и 2 групп до начала лечения не выявлено значимых различий ни по одному из анализируемых иммунных показателей. По состоянию отдельных механизмов мукосаливарного барьера пациенты обеих групп были абсолютно сопоставимыми (р < 0,01).
Система лечебно-профилактических мероприятий обеих групп, проводимая на базе медицинского центра профилактики и оздоровления университета, была идентичной по организации рабочего дня студентов, по характеру проводимой групповой психотерапии, пропагандирующей отказ от курения. Отличались обе программы только использованием в 1 группе сочетанного воздействия ФФ с помощью аппарата «Альфамассаж-33» таких как вибромассаж, действие тепла (суховоздушная баня) и влияние ароматических веществ (ель, сосна, эвкалипт).
Как видно из таблицы 13, у курящих студентов первой группы после курса психотерапии, дополненной воздействием ФФ, выявлены достоверные различия до и после лечения изучаемых показателей мукозального иммунитета (по уровню общего белка, лактоферрина, общей активности комплемента, SIgA, IgG, уровню нитратов, цитокинов – TNF-α, IL-8 в слюне). При сопоставлении показателей секреторного иммунитета у студентов 1 и 2 групп после проведения разных курсов профилактических мероприятий установлены достоверные различия по всем без исключения анализируемым показателям слюны.
Таблица 13.
Оценка изменения показателей мукозального иммунитета слюны после лечения у молодых лиц при табакокурении
| Показатели | Курящие, получающие психотерапию в сочетании с ФФ 1-ая группа (n=90) | Курящие, получающие психотерапию 2-ая группа (n=60) | группа некурящие (n=30) | Р | ||
| Me (Q25%-Q75%) | Me (Q25%-Q75%) | Me (Q25%-Q75%) | Me (Q25%-Q75%) | Me (Q25%-Q75%) | ||
| до лечения | после лечения | до лечения | после лечения | |||
| Белок, мг % | 181,5 (138-210) | 401* (300-530) | 179,8 (171-187,7) | 177,4** (170-180,6) | 306 (230-372) | p1<0,05 p2>0,05 |
| Муцин, мг % | 76 (40-138) | 93,5* (36-264) | 74 (70,1-89,31) | 73** (74,2-82,4) | 46 (24-88) | p1<0,05 p2>0,05 |
| IgG,мкг/мл | 1,31 (0,8-1,9) | 2,21* (1,8-3,33) | 1,32 (0,8-2) | 1,24** (0,7-1,8) | 0,6 (0,4-0,9) | p1<0,05 p2>0,05 |
| SlgA, мкг/мл | 315,2 (268,8-373,2) | 506* (446,2-577) | 317,3 (267,5-374) | 314** (280-350) | 139,4 (117,6-178) | p1<0,05 p2>0,05 |
| Лактоферрин нг/мл | 8120 (7080-9880) | 3100* (1200-5200) | 8145 (7085-9885) | 8130** (7080-9984) | 2860 (1560-4680) | p1<0,01 p2>0,05 |
| CH50, усл.ед. | 44,9 (43,8-46,9) | 30,45* (27,2-34,9) | 45 (43,6-46,8) | 43,6** (42-45,5) | 39,05 (33,7-42,7) | p1<0,05 p2>0,05 |
| C1, эф. мол. х 108/мл | 2,65 (1,2-3,9) | 2,4* (1,1-9,3) | 2,50 (1,2-3,8) | 2,38** (1,2-3,6) | 1,8 (0,1-2,9) | p1<0,05 p2>0,05 |
| C2, эф. мол. х 108/мл | 1,45 (0,7-2,8) | 3,35* (2,2-5,8) | 1,43 (1,32-1,64) | 1,38** (1,4-2,72) | 1,2 (0,3-2,2) | p1<0,05 p2>0,05 |
| C3, эф. мол. х 108/мл | 2,1 (0,4-4) | 2,9* (1,7-10,8) | 2,0 (0,4-4) | 1,9** (0,3-4) | 2,3 (0,7-3,1) | p1<0,05 p2>0,05 |
| C4, эф. мол. х 108/мл | 1,75 (0,5-4,3) | 3,1* (2-3,9) | 1,72 (0,4-4,3) | 1,68** (0,4-4,2) | 1,8 (0,4-2,7) | p1<0,05 p2>0,05 |
| C5, эф. мол. х 108/мл | 1,9 (0,8-2,7) | 2,9* (2-5,5) | 1,82 (0,8-2,7) | 1,72** (0,9-2,9) | 2,2 (1,3-5,2) | p1<0,05 p2>0,05 |
| TNF -α, пг/мл | 6,045 (3,18-9,81) | 2,84* (0,68-9,81) | 5,44 (3,1-8,2) | 5,04** (3-7,9) | 0,01 (0,01-0,45) | p1<0,01 p2>0,05 |
| IL-8, нг/мл | 64,62 (50,1-76,8) | 44,64* (20,45-53,4) | 61,78 (51,5-75,6) | 60,17** (50,7-66,44) | 43,84 (20,5-53,4) | p1<0,01 p2>0,05 |
| NO2 мкМоль/л | 2,15 (0,2-5,2) | 0,9* (0-2,3) | 2,40 (0,2-5,4) | 2,18** (0,2-5,2) | 1,3 (1-2,3) | p1<0,01 p2>0,05 |
| NOх мкМоль/л | 19,65 (11-31) | 7,15* (4,6-11,2) | 19,76 (11-31) | 19,71** (11-32) | 11,2 (6,8-15,6) | p1<0,01 p2>0,05 |
| NO3 мкМоль/л | 17,55 (18,7-30,6) | 6,25* (3,7-10,5) | 17,36 (7,7-30,4) | 17,53** (7,4-30) | 9,9 (6-14) | p1<0,01 p2>0,05 |
Примечание:
* р1 – достоверность различий в 1-ой группе до и после лечения;
** р2 – достоверность различий во 2-ой группе до и после лечения.
Во-первых, как следует из таблицы 13, у студентов 1 группы, подвергающихся сочетанному воздействию ФФ, произошло существенное повышение содержания общего белка в слюне до уровня некурящей группы (р<0,05).
Во-вторых, в 1 группе после лечения установлен максимальный уровень муцина в слюне, достоверно более высокий (р<0,05) чем во 2 группе после психотерапии и выше, чем в группе некурящих студентов. Полученные данные позволяют утверждать, что сочетанное воздействие на организм курящих молодых людей термовибромассажа, ароматерапии приводит к усилению антиколонизационного термозащитного барьера организма.
В-третьих, в 1 группе молодых людей после лечения с применением сочетанного воздействия ФФ установлен достоверный максимум в слюне SIgA, IgG в сопоставлении с исходным уровнем показателей в этой группе, в сравнении с 2 группой, а также с контрольной группой некурящих лиц. Следует отметить, что увеличение концентрации IgG и SIgA в слюне после лечения произошло более чем в 1,5 раза.