5 Ионные реакции осаждения, нейтрализации, гидролиза
| Вид материала | Документы |
- Рекомендации к зачёту, 133.1kb.
- Написать краткие ионные и молекулярные уравнения реакций гидролиза карбоната натрия,, 4.27kb.
- Методический пакет учебного курса, 331.54kb.
- Молекулярно-динамическое моделирование осаждения металлического нанокластера на подложку, 66.11kb.
- Наносимые электрохимическими методами на поверхность детали в результате осаждения, 96.3kb.
- Для подготовки к экзамену по общей химии (2 семестр) Кинетика, 73.49kb.
- Программа коллоквиумов по курсу физической химии, 99.84kb.
- Оглавление, 334.79kb.
- Календарный план занятий по физической химии в весеннем семестре 2008/2009 уч года, 32.67kb.
- Отчет 86 с., 34 рис., 15 табл., 53 источника, 2 приложения. Ключевые слова : структура, 56.56kb.
5.5.2. Ионные реакции осаждения, нейтрализации, гидролиза
Ионные реакции часто идут с образованием нерастворимых в воде веществ, газов, улетучивающихся из раствора, или малодиссоциирующих соединений. Такие реакции являются необратимыми. Если малодиссоциирующие соединения есть в левой и правой частях уравнения, то реакция обратимая.
Реакции образования нерастворимого вещества
AgNO3(р-р) + KI(р-р) AgI(т) + KNO3(р-р)
полное ионное уравнение:
Ag+(р-р)+NO3(р-р)+K+(р-р)+I(р-р)AgI(т)+K+(р-р)+NO3(р-р)
ионное уравнение в сокращенном виде:
Ag+(р-р) + I(р-р) AgI(т)
Реакции образования газообразного вещества
СaCO3(т) + 2HCl(р-р) CaCl2(р-р) + CO2(г) + Н2О(ж)
полное ионное уравнение:
СaCO3(т)+2H+(р-р)+2Cl(р-р)Ca2+(р-р) +2Cl(р-р)+CO2(г)+Н2О(ж)
ионное уравнение в сокращенном виде:
СaCO3(т) + 2H+(р-р) Ca2+(р-р) + CO2(г) + Н2О(ж)
Реакции нейтрализации и обратные
реакции гидролиза
Нейтрализация сильной кислоты сильным основанием
НСl(р-р) + КОН(р-р) КСl(р-р) + Н2О(ж)
полное ионное уравнение:
Н+(р-р)+Сl(р-р)+К+(р-р)+ОН(р-р)К+(р-р)+Сl(р-р)+Н2О(ж)
ионное уравнение в сокращенном виде:
Н+(р-р) + ОН(р-р) Н2О(ж)
Реакция среды нейтральная.
Необходимо заметить, что все приведенные выше реакции являются необратимыми. В случае реакции нейтрализации сильной кислоты сильным основанием это связано с тем, что вода – слабо диссоциирующее соединение.
**В нейтральной водной среде существует равновесие:
Н2О ⇄ Н+ + ОН
Константа равновесия К электролитической диссоциации воды выражается уравнением:
 ,
,где
 равновесные концентрации воды и соответствующих ионов. Диссоциация воды настолько мала, что концентрация молекул недиссоциированной воды сохраняется практически постоянной. Произведение двух постоянных
равновесные концентрации воды и соответствующих ионов. Диссоциация воды настолько мала, что концентрация молекул недиссоциированной воды сохраняется практически постоянной. Произведение двух постоянных  называют ионным произведением воды и обозначают символом КW:
называют ионным произведением воды и обозначают символом КW:КW =
или

Ионное произведение воды (КW) при 250С есть величина постоянная, равная 10-14, отсюда следует, что в нейтральной среде
СН+×= СОН- = 10-7 моль/л
Напомним, что концентрацию ионов водорода принято выражать показателем рН, который вычисляется по уравнению:
pН = -lg CH+
Итак, в зависимости от кислотности шкала рН водной среды меняется в широких пределах (рис. 48).
рН 1 2 3 4 5 6 7 8 9 10 11 12 13 14
















C
 H+ 10-1 10-3 10-5 10-7 10-9 10-11 10-13
H+ 10-1 10-3 10-5 10-7 10-9 10-11 10-13Кислая среда, рН< 7 Щелочная среда, рН>7
Единственное значение рН=7, соответствует нейтральной среде
Рис. 48. Шкала рН водной среды
Так как в чистой воде концентрация ионов водорода равна СН+×=10-7 моль/л, то рН нейтральной среды равно 7:
pН = -lg CH+ = -lg 10-7 = -(-7) = 7
Соли, образованные сильными кислотами и сильными основаниями, гидролизу не подвергаются.
Нейтрализация слабой кислоты сильным основанием
Все реакции приведенные ниже являются обратимыми.
НСN (р-р) + КОН(р-р) ⇄ КСN(р-р) + Н2О(ж)
полное ионное уравнение:
НСN(р-р)+К+(р-р)+ОН-(р-р) ⇄ К+(р-р)+СN-(р-р)+Н2О(ж)
ионное уравнение в сокращенном виде:
НСN(р-р) + ОН-(р-р) ⇄ СN-(р-р) + Н2О(ж)
Рассмотрим подробнее гидролиз солей.
Если испытать индикатором растворы таких солей как NaF, КNO3 и АlCl3, то опыт показывает, что растворы солей имеют щелочную, нейтральную и кислую реакцию, хотя в своем составе не содержат ни ионов Н+ , ни ионов ОН–. В растворе, кроме ионов, есть молекулы воды, поэтому причину следует искать в них. Вода – слабый электролит и для нее в равной степени выражены и кислотные, и основные свойства (СН+ = СОН-= 10-7).
Соль – продукт реакции нейтрализации кислот основаниями. Способность соли к гидролизу зависит от химической природы соли. Существующие соли следует разделить на четыре группы:
Соли, образованные слабой кислотой и сильным основанием – например, КСN, NaF, Na2S.
- Соли, образованные сильной кислотой и слабым основанием – например, NH4Cl, АlCl3.
- Соли, образованные сильной кислотой и сильным основанием – например, NaCl, КNO3.
- Соли, образованные слабой кислотой и слабым основанием – например, NH4CN, Fe2(CO3)3.
Раствор фторида натрия NaF имеет щелочную реакцию, что говорит о наличии в растворе гидроксид-ионов ОН–. Каким образом они возникли? Ионы Na+ и ОН– не объединяются, так как NaOH – сильный электролит и в растворе существует только в виде ионов. Анион F– связывает ион Н+, образуя слабый электролит – фтороводородную (плавиковую) кислоту:
Н+ + F– D HF
Молекулы Н2О диссоциируют, поставляя ионы Н+, до тех пор, пока не установится равновесие:
F– + Н2О D НF + ОН–
Так в результате гидролиза в растворе появляются гидроксид-ионы.
Гидролиз соли, образованной слабой кислотой и сильным основанием, является процессом, обратным реакции нейтрализации слабой кислоты сильным основанием.
КСN(р-р) + Н2О(ж) ⇄ НСN (р-р) + КОН(р-р)
полное ионное уравнение:
К+(р-р)+СN-(р-р) + Н2О(ж) ⇄ НСN(р-р) + К+(р-р)+ОН-(р-р)
ионное уравнение в сокращенном виде:
СN-(р-р) + Н2О(ж) ⇄ НСN(р-р) + ОН-(р-р)
Соли, образованные слабыми кислотами и сильными основаниями, гидролизуются с образованием гидроксид-ионов ОН–; среда становится щелочной.
Нейтрализация слабого основания сильной кислотой
HCl(р-р) + NH4OH(р-р) ⇄ NH4Cl(р-р) + H2O(ж)
полное ионное уравнение:
H+(р-р)+Cl-(р-р)+NH4OH(р-р)⇄NH4+(р-р)+Cl-(р-р)+H2O(ж)
ионное уравнение в сокращенном виде:
H+(р-р) + NH4OH(р-р) ⇄ NH4+(р-р) + H2O(ж)
Гидролиз соли, образованной сильной кислотой и слабым основанием, – процесс, обратный реакции нейтрализации слабого основания сильной кислотой.
NH4Cl(р-р) + H2O(ж) ⇄ HCl(р-р) + NH4OH(р-р)
полное ионное уравнение:
NH4+(р-р)+Cl-(р-р)+H2O(ж) ⇄ H+(р-р) + Cl-(р-р) + NH4OH(р-р)
ионное уравнение в сокращенном виде:
NH4+(р-р) + H2O(ж) ⇄ H+(р-р) + NH4OH(р-р)
Соли, образованные сильными кислотами и слабыми основаниями, гидролизуются с образованием ионов водорода Н+, среда становится кислой.
Нейтрализация слабой кислоты слабым основанием
НСN(р-р) + NH4ОН(р-р) ⇄ NH4СN(р-р) + Н2О(ж)
Константа диссоциации синильной кислоты Кд = 5×10-10 намного меньше константы диссоциации гидроксида аммония Кд = 1,8×10-5. Из-за различия силы слабого основания и слабой кислоты среда будет определяться относительно более «сильным» основанием, т. е. будет слабо-щелочная:
полное ионное уравнение:
НСN(р-р)+NH4+(р-р)+ОН-(р-р)⇄NH4+(р-р)+СN-(р-р)+ Н2О(ж)
ионное уравнение в сокращенном виде:
НСN(р-р) + ОН-(р-р) ⇄ СN-(р-р) + Н2О(ж)
Гидролиз соли слабой кислоты и слабого основания
NH4СN(р-р) + Н2О(ж) ⇄ НСN(р-р) + NH4ОН(р-р)
полное ионное уравнение:
NH4+(р-р) +СN-(р-р) + Н2О(ж)⇄НСN(р-р) + NH4+(р-р) + ОН-(р-р)
ионное уравнение в сокращенном виде:
СN-(р-р) + Н2О(ж) ⇄ НСN(р-р) + ОН- (р-р)
Растворение в воде соли слабой кислоты и слабого основания приводит к процессу, противоположному реакции нейтрализации - гидролизу соли. В приведенном выше процессе гидролиза «побеждает» основание, поэтому среда в растворе щелочная.
Итак, гидролиз - это реакция взаимодействия воды с анионом или катионом соли, создающая в растворе кислую или щелочную среду.
Лабораторные работы
Реакции нейтрализации и определение кислотности растворов
Задание. Определите рН растворов с помощью индикаторов, используя интервалы перехода индикаторов и их окраску в соответствующей среде (табл.6).
Т а б л и ц а 6
Интервалы перехода индикаторов
| Индикатор | Интервал перехода окраски в единицах рН | Окраска индикатора |
| Метиловый оранжевый | 3,1 – 4,4 | £ 3,1 розовая, ³ 4,4 желтая |
| Лакмус | 5,0 – 8,0 | £ 5,0 красная, ³ 8,0 синяя |
| Фенолфталеин | 8,0 – 10,0 | £ 8,0 бесцветная, ³ 10,0 малиновая |
Опыт 1. В штатив поставить 9 пробирок по 3 в ряду, в каждую налить 1 мл дистиллированной воды. В три пробирки добавить по 1 капле 1М раствора соляной кислоты, в следующие три ничего не добавлять, а в три последние пробирки добавить по 1 капле 1М раствора гидроксида натрия.
В три пробирки первого ряда внести по 1 капле раствора индикатора: в первую – метилового оранжевого, во вторую – лакмуса, в третью – фенолфталеина и повторить эту операцию в каждом ряду.
На основании окраски индикаторов дать ответы на следующие вопросы:
Можно ли с помощью фенолфталеина различить кислую и нейтральную среду? Нейтральную и слабощелочную, рН~ 8,0?
- Можно ли с помощью метилового оранжевого различить нейтральную и щелочную среду?
- В каком интервале рН метиловый оранжевый имеет желтую окраску, а фенолфталеин бесцветен?
- Какой цвет имеет метиловый оранжевый в интервале рН 3,1 – 4,4? Фенолфталеин в интервале 8,0 – 10,0?
Для определения рН среды часто используют универсальную индикаторную бумагу. Она имеет желтый цвет и изменяет окраску в интервале рН от 1 до 10. Бумага, пропитана раствором, содержащим четыре индикатора: фенолфталеин, метиловый красный, бромметиловый синий и тимоловый синий. Цветная шкала, которая прилагается к индикатору, показывает окраску бумаги при различных значениях рН.
Для определения рН среды удобнее всего пользоваться рН- метром (рис. 49).







5,6




Рис. 49. Быстрое определение кислотности раствора рН-метром: а) рН-метр в нерабочем состоянии; б) рН-метр в рабочем состоянии указывает значение рН раствора
Портативные рН-метры весом 50 г удобны для измерения кислотности среды. На измерение затрачивается всего несколько секунд.
Задание. Проведите реакции нейтрализации (опыты 1–3, см ниже). Напишите уравнения реакций нейтрализации в молекулярном и молекулярно-ионном виде. Укажите, какие реакции протекают практически необратимо, а какие – обратимо. Изменение окраски индикаторов соответствует реакции между кислотами и основаниями в строго эквивалентных количествах.
Опыт. 1. К 10 каплям 0,1 н раствора гидроксида натрия прибавьте 1-2 капли индикатора метилового оранжевого. К подкрашенному раствору добавьте по каплям раствор соляной кислоты той же концентрации до появления оранжево-желтого цвета индикатора.
Опыт 2. Повторите опыт, заменив раствор щелочи раствором аммиака.
Опыт 3. К 10 каплям 0,1 н раствора гидроксида натрия прибавьте 1-2 капли индикатора фенолфталеина. Раствор окрашивается в малиновый цвет. К подкрашенному раствору добавьте по каплям раствор соляной кислоты той же концентрации до появления бледно-розовой окраски раствора. Если к бледно-розовому раствору добавить еще одну каплю кислоты, раствор становится бесцветным.
Практическая работа
Гидролиз солей
Опыт 1. Даны растворы следующих солей: ZnCl2, Na2SO4, Na2SO3. С помощью индикатора определите реакцию среды и приведите объяснение в виде уравнений реакций, отражающих первую ступень гидролиза данных солей.
Опыт 2. Смешайте растворы Na2CO3 и CuSO4. Обратите внимание на цвет осадка. Для сравнения проведите реакцию:
CuSO4+2NaOH=Cu(OH)2¯+Na2SO4
Этот осадок - другого, ярко-голубого цвета. Гидролиз карбоната меди идет с образованием основной соли (CuOH)2CO3. Подобным образом ведут себя по отношению к раствору соды многие соли двухвалентных переходных металлов.
Опыт 3. Смешайте попарно растворы: а) FeCl3 и NaOH; б) FeCl3 и Na2CO3, обратите внимание, что осадки одинаковые. Для трехвалентных катионов (Cr, Fe, Al) гидролиз сопровождается образованием гидроксидов, а не гидроксосолей, как в опыте 2.
Опыт 4. В пробирку с водой поместите ложечку порошка магния – реакция не идет. Добавьте в пробирку несколько кристалликов хлорида аммония: наблюдается бурное выделение газа. Объяснение опыта:
гидролиз хлорида аммония: NH4+ + H2O ⇄ NH4OH + H+;
- в кислой среде растворяется пленка на поверхности магния, состоящая из оксида и гидроксида магния, магний взаимодействует с H+, выделяется водород;
- суммарное уравнение: Mg + 2H2O + 2NH4Cl ® MgCl2 + 2NH4OH + H2
NH4OH частично разлагается, поэтому ощущается запах аммиака, а влажный универсальный индикатор синеет.
Опыт 5. В пять пробирок налейте по 1-2 мл растворов следующих солей: хлорида алюминия, карбоната натрия, хлорида натрия, нитрата свинца (II), сульфита натрия. Индикатором определите реакцию среды в каждом из полученных растворов. Объясните, почему только раствор хлорида натрия нейтрален. Почему раствор карбоната натрия щелочной, а сульфата алюминия – кислый?
*Вопросы для проверки знаний
Гидролиз каких солей приводит к появлению в растворе гидроксид-ионов?
- Гидролиз каких солей приводит к появлению ионов Н+?
- Какие соли при обычных условиях не гидролизуются?
- Гидролиз каких солей идет по катиону?
- Гидролиз каких солей идет по аниону?
- Почему соли, образованные сильной кислотой и сильным основанием, в растворе не подвергаются гидролизу?
- Как влияет нагревание на гидролиз солей?
- Растворы многих солей для лабораторных работ отличаются нестойкостью вследствие гидролиза. В связи с этим растворы подкисляют или подщелачивают. Что вы предпримите для повышения устойчивости растворов следующих солей: Na2S, Pb(NO3)2, FeSO4, SnCl2?
*Упражнения
- Для следующих солей укажите реакцию среды в водном растворе: а) сульфат калия, б) нитрат меди (II), в) хлорид цинка, г) силикат натрия. Напишите сокращенные ионные уравнения первой ступени гидролиза.
- Растворы многих солей не хранятся длительное время. Выскажите предположение, что происходит с растворами: а) сульфида натрия, б) сульфита натрия, в) хлорида олова (II)?
- Напишите уравнения гидролиза солей из задания 2. Укажите, реакцию среды для каждого раствора.
*Задачи
Напишите формулы следующих солей: гидросульфит магния, гидросульфат натрия, дихлорид гидроксоалюминия, гидроксохлорид магния, сульфид алюминия. Укажите кислые и основные соли.
- Укажите группу солей, которые подвергаются гидролизу: 1)NaCl NaNO3; 2)NaCl NaCN; 3)NaNO3 CH3COONa; 4)NaCN CH3COONa.
- Водные растворы каких солей имеют значения рН меньше 7: 1)Na3PO4 K2S 2)FeCl3 K2S 3)BaCl2 FeCl3 4)FeCl3 Cu(NO3)2?
- В водоочистке в качестве коагулянта используется сульфат алюминия, который при взаимодействии с гидрокарбонатом кальция, присутствующим в воде, образует гидролизующуюся соль. Напишите уравнение гидролиза.
- Определите состав солей, образующихся при пропускании 1,568л СО2 (н.у.) через раствор, содержащий 3,2 г NaOH.
Ответ: 5,04г NaHCO3, 1,06г Na2CO3.
- К раствору серной кислоты добавили раствор гидроксида натрия, при этом образовалось 3,6 г кислой и 2,84 г средней соли. Определите исходные массы кислоты и щелочи. Ответ: 4,9 г серной кислоты и 2,8 г едкого натра.
5.6. Окислительно-восстановительные реакции
Атомы в простых веществах неметаллах связаны неполярными ковалентными связями, а электроны, участвующие в образовании химических связей, в равной степени принадлежат обоим атомам.
В простых веществах-металлах электронное облако, охватывающее ионы, также распределено равномерно. Эта равномерность распределения электронной плотности около атомов или ионов простых веществ приводит к тому, что степень окисления простых веществ равна нулю.
Иначе обстоит дело с распределением электронной плотности в соединениях, состоящих из атомов двух или более различных химических элементов. В таких соединениях степень окисления элемента может быть отрицательной, если в ковалентной полярной связи к нему смещаются электроны, или положительной, если от него смещаются электроны. В ионных соединениях неравномерность распределения электронов наибольшая. При образовании веществ с ионной связью валентные электроны почти полностью переходят от атома одного элемента к атому другого. Степень окисления выражает число электронов, смещенных от одного атома к другому.
Степень окисления отличается от валентности. Валентность численно равна количеству связей, образуемых элементом в соединении. Так, в молекулах простых веществ Н2 и N2 степень окисления атомов водорода и азота равна нулю, а валентности этих элементов равны, соответственно, 1 и 3.
В сложных химических соединениях постоянную степень окисления имеют щелочные металлы (+1), щелочноземельные металлы (+2), фтор (-1), водород в большинстве соединений (+1), а в гидридах (-1), кислород (-2). Исключение составляет пероксидный кислород, который имеет степень окисления равную -1, например в пероксиде водорода Н2О2. Этой информации о степенях окисления достаточно, чтобы подсчитать степени окисления многих других элементов в химических соединениях.
Реакции, протекающие с изменением степени окисления атомов, входящих в состав химических соединений, называются окислительно-восстановительными.
Располагая информацией о том, какие соединения выступают в роли окислителей (присоединяют электроны) и восстановителей (отдают электроны), можно успешно справиться с задачей расстановки коэффициентов в окислительно-восстановительных реакциях.
Назовем некоторые соединения, проявляющие окислительные и восстановительные свойства (табл. 7).
В некоторых случаях одно и то же химическое соединение выступает в окислительно-восстановительной реакции и окислителем, и восстановителем
Т а б л и ц а 7
Примеры типичных окислителей и восстановителей
| Окислители | Восстановители |
| Cl2 (Br2, I2) ® HCl (HBr, HI) | HCl (HBr, HI) ® Cl2 (Br2, I2) |
| KClO3 ® KCl | H2S ® S |
| Na2SO3 ® S | Na2SO3 ® Na2SO4 |
| KNO2 (кислая среда) ® NO | KNO2 ® KNO3 |
| K2Cr2O7 (H2SO4) ® Cr2(SO4)3 | CrCl3 (KOH) ® K2CrO4 |
| KMnO4 (кислая среда) ® MnSO4 | MnSO4 ® MnO2 |
| KMnO4 (щелочная среда) ® K2MnO4 | FeCl2 ® FeCl3 |
| KMnO4 (нейтр. среда) ® MnO2 | NH3 ® N2 |
| | С6Н5СН3® С6Н5СООН |
| | С6Н5С2Н5® С6Н5СООН + СО2 |
Такие окислительно-восстановительные реакции называют реакциями окислительно-восстановительного диспропорционирования. Например, при растворении хлора в воде происходит реакция:
Н2О(ж) + Cl2(р-р) = НCl(р-р) + НОCl(р-р)
Напишем уравнение реакции с учетом степеней окисления всех участников процесса:
Н2+1О-2 + Cl20 = Н+1Cl-1 + Н+1О-2Cl+1
Хлор участвует и в восстановительном (отдает электроны), и в окислительном (присоединяет электроны) процессах:
Окисление: Cl2 + Н2О = НОCl + 2Н+ + 2е-
Восстановление: Cl2 + 2е- = 2Cl-
В живых организмах, включая человека, происходят окислительно-восстановительные процессы. Многие промышленные способы производства химических соединений осуществляются как окислительно-восстановительные процессы.
Метод электронного баланса
Пример. Окисление хлорида железа (II) перманганатом калия в кислой среде.
Последовательность действий
- Определить степени окисления атомов, обратив особое внимание на те атомы, степень окисления которых изменяется в ходе реакции, указать окислитель и восстановитель:
F
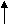
 eCl2 + KMnO4 + HCl ® FeCl3 + Cl2 + MnCl2 + KCl + H2O
eCl2 + KMnO4 + HCl ® FeCl3 + Cl2 + MnCl2 + KCl + H2OВосстановитель
Окислитель
- Записать процессы окисления и восстановления, составить электронный баланс:
5
 Окисление Fe+2 = Fe+3 + e–
Окисление Fe+2 = Fe+3 + e– 2Cl-= Cl2 + 2e–
 Восстановление Mn+7 + 5e– = Mn+2 3
Восстановление Mn+7 + 5e– = Mn+2 3- Поставить коэффициенты сначала перед восстановителем и окислителем, затем перед веществом, определяющим среду реакции (HCl), в последнюю очередь – перед водой.
5FeCl2 + 3KMnO4 + 24HCl ® 5FeCl3 + 5Cl2 + 3MnCl2 + 3KCl + 12H2O
В левой и правой части уравнения устанавливается равное число атомов кислорода, что служит проверкой правильности составления уравнения.
Метод электронно-ионного баланса
Метод электронно-ионного баланса применяют для реакций, протекающих в растворах. В таких случаях в реакциях принимают участие не только окислитель и восстановитель, но и молекулы Н2О, ионы водорода Н+ и гидроксид-ионы ОН-.
Метод основан на уравнивании числа зарядов ионов, реально существующих в растворе. Достоинство метода состоит в том, что при его применении не обязательно знать степени окисления атомов, участвующих в ионной реакции и не обязательно знать все продукты реакции, достаточно знать, что происходит с окислителем и восстановителем в данной среде. Для этого существуют соответствующие таблицы (табл.7).
Последовательность действий
- С помощью табл. 7 установить продукты реакции. Составить уравнения окисления и восстановления реагентов. При этом сильные электролиты записать в виде ионов, а слабые – в виде молекул.
- Уравнять число атомов кислорода и водорода в левой и правой частях реакций окисления и восстановления ионами Н+, ОН– и молекулами воды.
В кислой среде: О–2 + 2Н+ ⇄ Н2О
В нейтральной среде: О–2+Н2О=2ОН– и Н2О=О–2+2Н+.
В щелочной среде: 2ОН– = О–2 + Н2О.
3. Определить суммарный заряд ионов в обеих частях уравнения реакции и компенсировать разницу, прибавляя или вычитая нужное число электронов. Составить электронно-ионный баланс.
4. Подобрать коэффициенты в общем ионно-молекулярном уравнении реакции, при необходимости сокращая ионы и молекулы в левой и правой части уравнения.
5. Прибавить одновременно в обе части ионно-молекулярного уравнения к каждому катиону и аниону соответствующие им ионы противоположного знака.
6. Суммировать ионы противоположного знака и составить уравнение реакции в молекулярной форме.
Пример. Написать уравнение реакции между перманганатом калия и пероксидом водорода Н2О2 в нейтральной среде.
Перманганат калия может быть только окислителем, пероксид водорода в данной реакции является восстановителем, в табл. 7 указаны продукты реакции. Выполняем последовательность операций:
Н2О2 ® О2 + Н2О
MnO4– ® MnO2
- Н2О2 + 2ОН– ® О2 + 2Н2О
MnO4– + 2Н2О ® MnO2 + 4ОН–
- Н
 2О2 + 2ОН–– ® О2 + 2Н2О + 2е- 3
2О2 + 2ОН–– ® О2 + 2Н2О + 2е- 3
 MnO4– + 2Н2О + 3е– ® MnO2 + 4ОН– 2
MnO4– + 2Н2О + 3е– ® MnO2 + 4ОН– 2- 3Н2О2 + 2MnO4– + 6ОН– + 4Н2О ® 3О2 + 6Н2О + 2MnO2 + 8ОН–
3Н2О2 + 2MnO4– ® 3О2 + 2Н2О + 2MnO2 + 2ОН–
2К+ 2К+
- 3Н2О2 + 2КMnO4 ® 3О2 + 2Н2О + 2MnO2 + 2КОН
Метод кислородного баланса
Данный метод, предложенный профессором Климовым Е.С. из Ульяновского государственного университета еще в 90-е годы прошлого века, хорошо зарекомендовал себя при подборе коэффициентов в окислительно-восстановительных реакциях с участием органических соединений. Известно, что кислородсодержащие окислители (KMnO4, K2Cr2O7 и др.) выделяют кислорода столько, сколько необходимо для восстановителя.
Пример 1. Рассмотреть полное окисление глицерина KMnO4 в кислой среде до СО2 и Н2О
С
 Н2ОН
Н2ОНС
 НОН + KMnO4 +Н2SO4 ® CO2 + H2O+K2SO4+MnSO4
НОН + KMnO4 +Н2SO4 ® CO2 + H2O+K2SO4+MnSO4СН2ОН
Сначала для окислителя и восстановителя расставить коэффициенты, не связанные с окислительно-восстановительным процессом.
Затем подбор коэффициентов сводится к балансу количества кислородных атомов [O], отданных окислителем KMnO4 и полученных восстановителем (глицерином).
2
 KMnO4 +3Н2SO4=К2SO4+2MnSO4+3H2O +5[O] х7
KMnO4 +3Н2SO4=К2SO4+2MnSO4+3H2O +5[O] х7СН2ОН-CHOH-СН2ОН +7[O] = 3CO2 + 4H2O х5
2 молекулы KMnO4 отдают 5 атомов кислорода, а глицерин присоединяет 7 атомов кислорода, поэтому при кислородном балансе все коэффициенты первого уравнения следует умножить на 7, а второго – на 5.
Составить общее уравнение реакции:
 СН2ОН
СН2ОН5
 СНОН+14KMnO4+21Н2SO4=15CO2+41H2O+7K2SO4+14MnSO4
СНОН+14KMnO4+21Н2SO4=15CO2+41H2O+7K2SO4+14MnSO4СН2ОН
Пример 2. Составить уравнение окисления толуола перманганатом калия до бензойной кислоты и воды в кислой среде.
С6Н5СН3+KMnO4+Н2SO4®С6Н5СООН+H2O+К2SO4+MnSO4
Записать реакции кислородного баланса, связанные с окислителем KMnO4 и восстановителем С6Н5СН3:
2
 KMnO4 +3Н2SO4 = К2SO4+2MnSO4+3H2O +5[O] х3
KMnO4 +3Н2SO4 = К2SO4+2MnSO4+3H2O +5[O] х3С6Н5СН3+3[O]= С6Н5СООН+H2O х5
2 молекулы KMnO4 отдают 5 атомов кислорода, а молекула толуола принимает 3 атома кислорода.
Составить общее уравнение реакции:
5С6Н5СН3+6KMnO4 +9Н2SO4 =5С6Н5СООН+14H2O+3К2SO4+6 MnSO4
Вопросы для проверки знаний
Какое численное значение имеет степень окисления простых веществ?
- Дайте определения степени окисления и валентности атомов в соединениях и сравните их значения в молекулах О2 и Cl2.
- Необходимо ли знание степеней окисления атомов в соединениях для уравнивания химических реакций по методу электронного баланса? Электронно-ионного баланса?
- Необходимо ли знать степень окисления атомов в соединениях для уравнивания химических реакций по методу кислородного баланса?
Упражнения
Составьте уравнения следующих реакций методом электронно-ионного баланса:
MnO2 + KOH + O2 ® K2MnO4 + H2O
Cu + HNO3(конц.) ® Cu(NO3)2 + NO2 + H2O
As2H3 + HNO3 ® H3AsO4 + NO + H2SO4
- Составьте уравнение реакции методом кислородного баланса:
С6Н5С2Н5+KMnO4+Н2SO4®С6Н5СООН+H2O+К2SO4+MnSO4
Практическая работа
Окислительно-восстановительные реакции
Опыт 1. В три пробирки налейте на 1/3 малиновый раствор перманганата калия. В первую пробирку добавьте 1-2 мл раствора H2SO4(1:5), во вторую – столько же воды, в третью – 2 мл концентрированного раствора гидроксида калия. Во все пробирки добавьте по 5 мл 1М раствора сульфита калия и быстро перемешайте стеклянной палочкой.
В пробирке 1 раствор обесцвечивается:
MnO4– ® Mn2+
В пробирке 2 также происходит обесцвечивание раствора с одновременным появлением буро-желтой окраски, переходящей в хлопьевидный осадок:
MnO4– ® MnО2
В пробирке 3 малиновая окраска раствора переходит в интенсивную зеленую окраску:
MnO4– ® MnО42–
Составьте уравнения реакций методом электронно-ионного баланса.
Опыт 2. Пероксид водорода Н2О2 может выступать, в зависимости от партнера в реакции, либо в роли окислителя, либо в роли восстановителя.
1) Налейте в пробирку на 1/3 0,1М раствор иодида калия, подкислите несколькими каплями раствора H2SO4(1:5), при помешивании добавляйте 3% раствор Н2О2 до появления желтовато-коричневой окраски. Прилейте 1-2 мл органического растворителя (амилового спирта, бензола, эфира) и сильно встряхните. Слой растворителя после отстаивания окрашивается в фиолетовый цвет – это йод. Составьте уравнение реакции методом электронно-ионного баланса:
Н2О2 + I– + H+ ® I2 + H2O
2) В пробирку на 1/3 налейте малиновый раствор KMnO4, подкислите несколькими каплями раствора H2SO4(1:5), при помешивании добавляйте 3% раствор Н2О2 до обесцвечивания раствора. Выделяются пузырьки кислорода. Составьте уравнение реакции методом электронно-ионного баланса:
MnO4– + Н2О2 + Н+ ® Mn2+ + О2 + Н2О
5.7. Электрохимические реакции
Два признака отличают электрохимическую реакцию. Во-первых, в электрохимической реакции реагенты не вступают между собой в непосредственный контакт. Во-вторых, энергия химической реакции в электрохимическом процессе превращается непосредственно в электрическую энергию (гальванический элемент) или электрическая энергия расходуется на химическую реакцию (электролизер).
Поместим в раствор сульфата меди (II) кусочек цинка (рис. 50, а).





а) б)
Рис. 50. Химическая реакция между цинком и cульфатом меди (II):
а) начало реакции; б) окончание процесса
Голубая окраска раствора обусловлена присутствием ионов Cu2+. Электроны атомов цинка переходят к ионам меди в результате непосредственного контакта металлического цинка и ионов меди в растворе. В процессе окислительно-восстановительной реакции образуется бесцветный раствор сульфата цинка, а металлический цинк покрывается желто-красным налетом меди (рис. 50 б):
Zn(т) + CuSO4(р-р) = ZnSO4(р-р) + Сu(т)
2е-

Zn(т) + Cu2+(р-р) = Zn2+(р-р) + Сu(т)
Электрохимическая реакция предполагает разделение реагентов в гальваническом элементе (рис. 51).
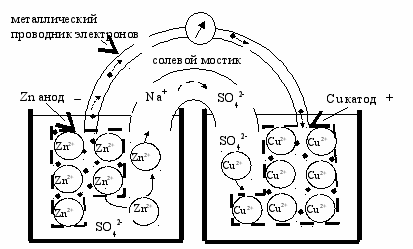
Рис. 51. Модель гальванического элемента. Электрическая цепь замкнута металлическим проводником электронов и солевым мостиком, обеспечивающим движение ионов в растворах электролитов
На цинковом электроде (аноде) идет реакция окисления. Электрод заряжается отрицательно, так как катионы цинка переходят в раствор ZnSO4, оставляя электроны на цинковом электроде.
На медном электроде (катоде) идет реакция восстановления. Этот электрод заряжается положительно, т. к. катионы меди, присоединяя электроны, достраивают кристаллическую решетку и создают некоторый недостаток электронов на медном электроде.
Электроны от атомов цинка переходят к ионам меди по металлическому проводнику.
Анод (окисление): Zn(т)= Zn2+(р-р) + 2е-
Катод (восстановление): Cu2+(р-р) + 2е- = Сu(т)
Суммирование раздельно записанных реакций анодного окисления и катодного восстановления в электрохимическом процессе приводит к тому же самому результату, что и в химической реакции, проведенной в стакане (рис. 50):
Zn(т) + Cu2+(р-р) + 2е- = Zn2+(р-р) + Сu(т) + 2е- или
Zn(т) + Cu2+(р-р) = Zn2+(р-р) + Сu(т)
При окислении металлического цинка электроны остаются на электроде и поступают во внешнюю цепь, а ионы цинка переходят в раствор. Ионы меди получают электроны из внешней цепи, восстанавливаются и осаждаются на катоде красным налетом металлической меди.
Проводниками электрического тока в электролите являются катионы и анионы. Ионы солевого мостика (Na+ и SO42-) участвуют в переносе электрических зарядов, но не вступают в химические реакции с материалом электродов.
Гальванический элемент, представленный на рис. 51, может быть записан в строчку следующим образом:
(-) Zn | ZnSO4(р-р) || CuSO4(р-р) | Cu (+)
Вертикальной чертой обозначается граница между металлом и раствором, двумя вертикальными черточками - граница между электролитами в гальваническом элементе.
Электрохимическое устройство, в котором энергия химической реакции превращается в электрическую энергию, называется гальваническим элементом.
Энергия химической реакции, протекающей в гальваническом элементе, преобразуется в электрическую, т. е. энергию движения электронов по проводнику во внешней цепи. Эта энергия может быть использована для работы электромотора, осветительных приборов и т. д.
Гальванический элемент будет вырабатывать электрическую энергию до тех пор, пока анод полностью не растворится.
Стандартные электродные потенциалы
Когда мы говорим об относительной легкости, с которой металлы отдают электроны, то подразумеваем, что в ряду металлов существует определенный порядок. Свойство металлов отдавать электроны в окислительно-восстановительных реакциях характеризуется значениями их стандартных электродных потенциалов. Электродные потенциалы металлов определяют в гальваническом элементе, устройство которого приведено ниже (рис. 52).
Воспользуемся двумя электродами. Один электрод представляет собой платиновую пластинку, опущенную в водный раствор соляной кислоты, с(HCl) = 1моль/л. Через раствор пропускают пузырьки водорода. Водород обладает свойством растворяться в платине в незначительных количествах. Чтобы растворимость водорода увеличить, платиновую пластинку покрывают пористой платиной (платиновой чернью). Такой электрод называют водородным электродом. Платина в таком электроде играет роль электрического проводника и не участвует в химических реакциях.
Другой электрод представляет собой металл, электродный потенциал которого следует определить. Например, таким металлом может быть медная пластинка, опущенная в раствор соли CuSO4. Электроды соединяют так, как это показано на рис. 52. Цепь замкнута. Течет электрический ток. С помощью гальванометра измеряют разность электродных потенциалов в вольтах (В). Электродвижущую силу гальванического элемента сокращенно обозначают ЭДС или Е и вычисляют по уравнению:
Е= j(Cu) - j(Н2),
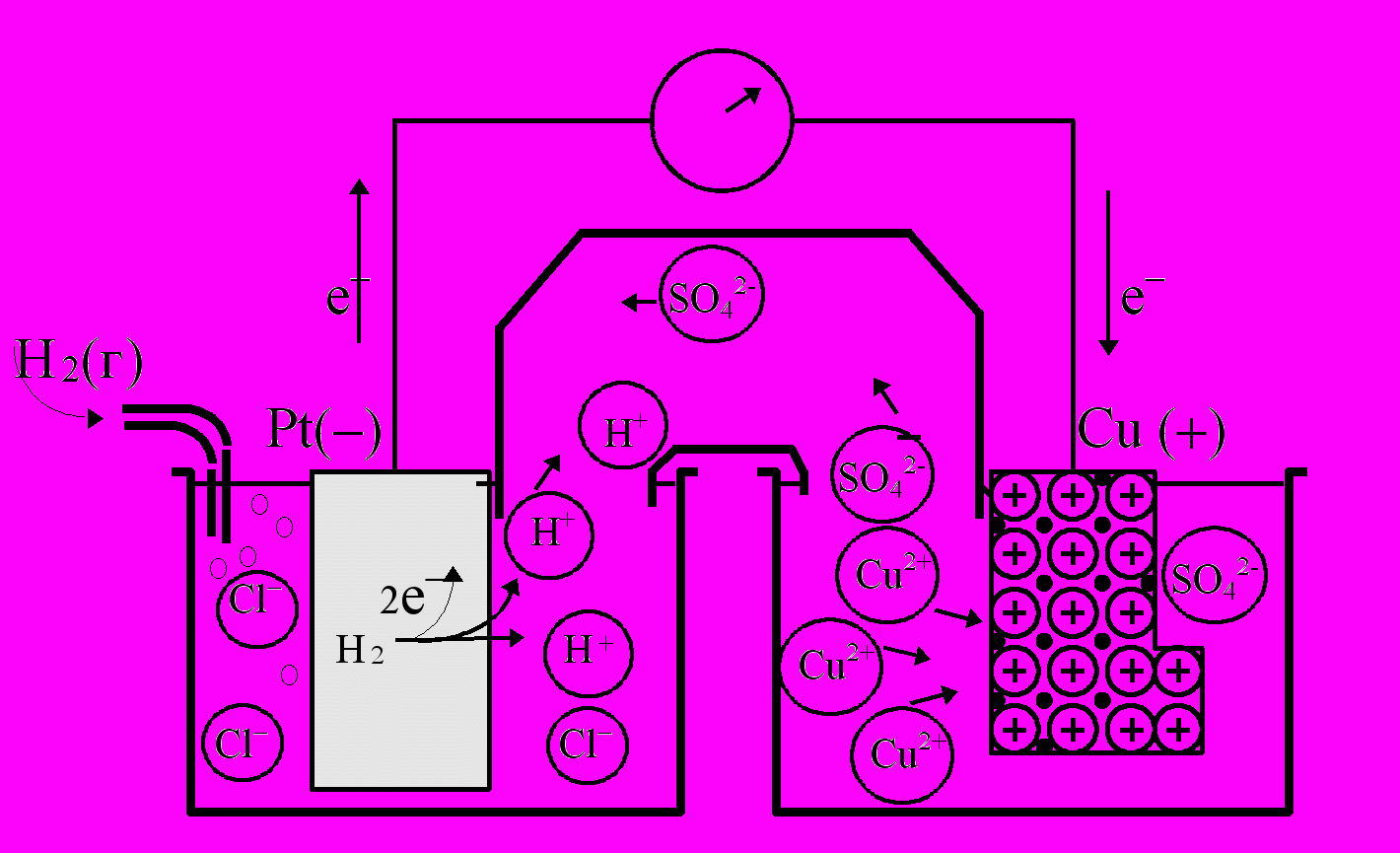
Рис. 52. Гальванический элемент для измерения электродного потенциала меди, составленный из стандартного водородного электрода (слева) и медного электрода (справа). Электроны движутся от водородного электрода к медному (положительному) электроду. Потенциал водородного электрода принят равным нулю
где j(Cu) - потенциал медного, j(Н2) - потенциал водородного электрода.
Условились потенциал водородного электрода j(Н2) считать равным нулю, если концентрация ионов водорода с(Н+) = 1моль/л. Такой электрод называют стандартным водородным электродом.
Стандартный электродный потенциал металла равен электродвижущей силе гальванического элемента, составленного из данного металлического электрода и стандартного водородного электрода.
Значения стандартных электродных потенциалов некоторых металлов приведены в таблице 8.
Т а б л и ц а 8
Стандартные электродные потенциалы металлов, водорода и кислорода при 250С (с = 1 моль/л), Р (для газов) = 1атм
| Электрод | Электродная реакция | Е, вольт |
| Li+| Li | Li+ + е- = Li | - 3,04 |
| K+|K | K+ + е- = K | -2,92 |
| Ca2+|Ca | Ca2+ +2е- = Ca | -2,87 |
| Na+ |Na | Na+ + е- = Na | -2,71 |
| Mg2+|Mg | Mg2+ + - 2е- = Mg | - 2,37 |
| Al3+|Al | Al3+ + 3е- = Al | - 1,66 |
| Mn2+|Mn | Mn2+ + 2е- = Mn | - 1,18 |
| *) | 2Н2О + 2е– = Н2 + 2ОН– | –0,83 |
| Zn2+|Zn | Zn2+ + 2е- = Zn | -0,76 |
| Cr3+|Cr | Cr3+ + 3е- = Cr | -0,74 |
| Fe2+|Fe | Fe2+ +2е- =Fe | -0,44 |
| Ni2+|Ni | Ni2+ +2е- = Ni | -0,25 |
| Sn2+|Sn | Sn2+ + 2е- = Sn | -0,14 |
| Pb2+|Pb | Pb2+ + 2е- = Pb | -0,13 |
| H+|H2 (Pt) | 2H+ + 2е- = Н2 | 0,00 |
| Cu2+|Cu | Cu2+ + 2е- = Cu | + 0,34 |
| Hg22+|Hg | Hg22+ + 2е- = Hg | + 0,79 |
| Ag+|Ag | Ag+ + е- = Ag | + 0,80 |
| Au3+|Au | Au3+ + 3е- = Au | + 1,50 |
*Указан потенциал восстановления воды на электроде и электродная реакция восстановления воды.
Стандартный потенциал медного электрода j(Cu) при концентрации с(Cu2+)=1 моль/л, определенный в гальваническом элементе (рис. 52), оказался равным +0,34В.
Для цинкового электрода значение стандартного электродного потенциала j(Zn) = - 0,76 В. Знак указывает, что цинк заряжается отрицательно по отношению к водородному электроду.
В заключение еще раз подчеркнем, что ряд стандартных электродных потенциалов показывает, в какой последовательности восстанавливаются ионы металлов и окисляются простые вещества металлы. Из данных таблицы 8 следует, что в указанном ряду самый слабый восстановитель золото, а самый сильный литий. И, наоборот, ион золота самый сильный окислитель, а ион лития самый слабый.
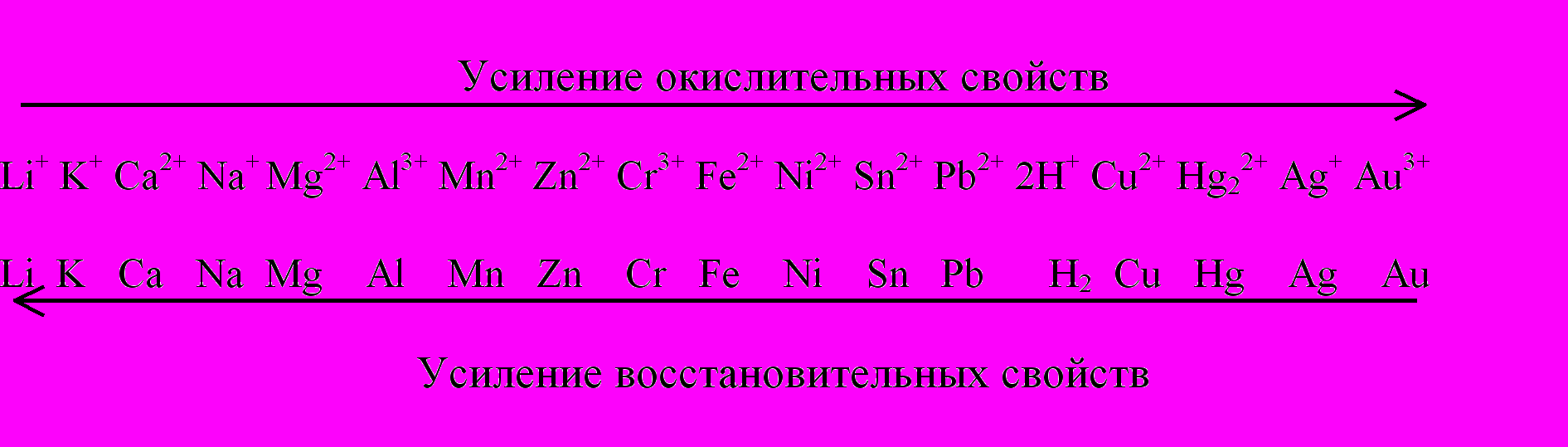
Свойство одних металлов вытеснять ионы других металлов из растворов их солей мы уже наблюдали на примере электрохимической реакции в гальваническом элементе, составленном из медного и цинкового электродов
Электродные потенциалы щелочных металлов невозможно определить в гальваническом элементе, так как щелочные и щелочноземельные металлы реагируют с водой. Для них электродные потенциалы вычислены теоретически.
