5 Ионные реакции осаждения, нейтрализации, гидролиза
| Вид материала | Документы |
- Рекомендации к зачёту, 133.1kb.
- Написать краткие ионные и молекулярные уравнения реакций гидролиза карбоната натрия,, 4.27kb.
- Методический пакет учебного курса, 331.54kb.
- Молекулярно-динамическое моделирование осаждения металлического нанокластера на подложку, 66.11kb.
- Наносимые электрохимическими методами на поверхность детали в результате осаждения, 96.3kb.
- Для подготовки к экзамену по общей химии (2 семестр) Кинетика, 73.49kb.
- Программа коллоквиумов по курсу физической химии, 99.84kb.
- Оглавление, 334.79kb.
- Календарный план занятий по физической химии в весеннем семестре 2008/2009 уч года, 32.67kb.
- Отчет 86 с., 34 рис., 15 табл., 53 источника, 2 приложения. Ключевые слова : структура, 56.56kb.
Очистка природных вод
Ливневые стоки, сточные воды городов с очистных сооружений, отходы сельскохозяйственного производства попадают в реки. Речная вода подвергается специальной очистке (водоподготовке), прежде чем поступить в водопроводную сеть города (рис. 72).
Из реки вода проходит через решетку для очистки от крупного мусора и хлорируется для уничтожения болезнетворных бактерий. На некоторых станциях водоподготовки хлор заменяют озоном, который выполняет ту же функцию, но менее опасен в эксплуатации:
О3 ® О2 + О


















































































Cl2
Al2(SO4)3
Смеситель
Отстойник
Фильтр: песок, гравий
Накопительный резервуар
В городской водопровод

Рис. 72. Схема водоподготовки речной воды
Достоинство озона по сравнению с хлором состоит в том, что он не дает хлорорганических продуктов, которые образуются при взаимодействии атомов хлора с примесями, содержащимися в речной воде.
После обработки хлором (или озоном) речная вода осветляется с помощью коагулянтов. Коагулянты - вещества, которые при растворении в воде подвергаются гидролизу и образуют нерастворимые в воде продукты гидролиза. Для этих целей, как правило, используется сернокислый алюминий:
Al2(SO4)3(р-р)+6Н2О(ж)=2Al(OH)3(т)¯+3H2SO4(р-р)
Хлопья осаждающегося гидроксида алюминия захватывают частички примесей в речной воде и осветляют ее. Окончательное освобождение от механических примесей в воде осуществляют с помощью песчаного фильтра. Вода после гидролиза содержит незначительное количество серной (результат гидролиза) и соляной кислоты, если обеззараживание проводилось хлором. Чтобы повысить рН воды до значений 7-8 ее обрабатывают известью:
H2SO4 + Ca(OH)2 = CaSO4 + 2H2O
Из накопительного резервуара вода поступает в городскую сеть водоснабжения.
7.5. Промышленные способы получения энергии
Промышленное производство энергии необходимо для обеспечения жизнедеятельности людей. Освещение помещений и улиц, поддержание комфортной температуры в жилых помещениях, энергоснабжение промышленных предприятий – все это обеспечивается электростанциями и станциями теплоснабжения. Железнодорожный, авиационный, автомобильный транспорт расходует природные источники топлива в громадных масштабах. Фактически человечество оказалось в условиях возрастающего расхода невозобновляемых природных ресурсов.
Ископаемое топливо образовалось биологическим путем в течение миллиардов лет. Большая часть его израсходована за последние 300 лет. По словам американского эколога Барри Коммонера добыча полезных ископаемых ничего общего не имеет с производством, т. к. о производстве в данном случае можно говорить лишь в том же смысле, в каком мальчик, забравшийся в кладовку, «производит» варенье из открытой банки. И тем не менее, основным источником энергии на Земле являются реакции горения природного газа, каменного угля, продуктов переработки нефти (мазута, дизельного топлива, керосина и бензина):
С + О2 = СО2
СН4 + 2О2 = СО2 + 2Н2О
Мазут (Сх Ну) + О2 = хСО2 + у/2Н2О
Для получения электрической энергии используют нагретый пар высокого давления. Пар подается на турбину, соединенную с генератором. Комплекс турбина - генератор называется турбогенератором. Для получения пара высокого давления можно использовать любой источник тепла.
Применяются также газовые турбогенераторы. Они приводятся в движение газами СО2 и Н2О - продуктами горения природного газа, образующимися при высоким давлением и высокой температуре.
Примерно 40% общего энергопотребления в мире приходится на сжигание нефтепродуктов, еще столько же получают за счет сжигания природного газа и каменного угля. Остальное энергопотребление приходится на ядерное топливо и гидроэлектростанции.
В нефти и угле содержатся серо- и азотсодержащие органические соединения, а также сульфиды и оксиды металлов. Природный газ обычно содержит небольшую примесь серосодержащих органических соединений. Перед использованием природного газа, его очищают от этих примесей.
Содержание серы в нефти и угле может колебаться от 0,5 до 5%. Сера и азот, входящие в состав мазута и угля, сгорают с образованием оксидов:
Серосодержащие соединения S + O2 = SO2
Азотсодержащие соединения N + O2 = 2NO
В условиях реакции горения при высокой температуре (1500—2200 0С) образуется оксид азота из воздуха:
N2 + O2 = 2NO
Продолжительность горения бензина или дизельного топлива в двигателе внутреннего сгорания составляет доли секунды и не обеспечивает полного сгорания топлива до СО2 и Н2О. В результате продукты неполного сгорания выбрасываются в воздух. Это главным образом оксиды азота, серы, оксид углерода (II), альдегиды, органические кислоты, твердые углеродные частицы.
Химическая, нефтеперерабатывающая, металлургическая промышленность добавляет некоторое количество газообразных выбросов в окружающую среду. Основная доля загрязняющих выбросов газов в атмосферу приходится на автотранспорт и электростанции, работающие на природном топливе.
7.6. Превращение энергии химической реакции
в электрическую
Источниками электрической энергии служат гальванические элементы и аккумуляторы (от лат. accumulator - собиратель, накопитель). На каждый автомобиль устанавливается аккумулятор. Масштабы производства аккумуляторов сравнимы с производством автомобилей и других механических устройств, которые используют электрический ток для запуска двигателя. Аккумуляторы - химические источники электрического тока многократного действия.
Кроме аккумуляторов используются гальванические элементы. Их еще называют сухими элементами (в быту - батарейками). В батарейках используется не выливающийся (загущенный) электролит. Гальванические элементы - химические источники электрического тока, предназначенные для однократного (непрерывного или прерывистого) действия. После разряда они не пригодны для дальнейшего использования и выбрасываются. Их мировое производство достигает примерно 10 млрд. штук в год.
Для изготовления электрохимических источников тока применяют углерод (в виде графитовых стержней), такие металлы, как цинк, свинец, серебро, никель, оксиды и гидроксиды металлов, соли, серную кислоту и некоторые органические вещества, устойчивые к кислотам и щелочам.
**Действие марганцево-цинкового
гальванического элемента
Действие гальванического элемента основано на превращении скрытой (потенциальной) энергии химических связей участников реакции в движение электронов (электрический ток). Рассмотрим гетерогенную химическую реакцию:
2MnO2(т) + 2NH4Cl(р-р) + Zn =
2MnO(OH)(т) + 2NH3(г) + ZnCl2(р-р), DHr <0
Реакция экзотермическая (DHr <0), идет с разогреванием веществ. Это означает, что вещества передают выделившуюся энергию в форме тепла окружающей среде. Можно избежать рассеивания энергии в виде тепла. Часть энергии химической реакции удается превратить в энергию движения электронов, т.е. в электрическую энергию. Для этого исключают прямой контакт реагентов. Химическую реакцию проводят в гальваническом элементе (рис. 73).

Рис. 73. Сухой гальванический элемент. В качестве загустителя водного раствора электролита и превращения электролита в пасту может быть использована мука
По сути дела одновременно осуществляют две химические реакции: превращение пиролюзита MnO2 в манганит MnO(OH) на катоде и цинка в ионы цинка на аноде. Вещества, расположенные у катода и анода, между собой не перемешиваются, так как они представляют собой густые пасты. Как в любом жидком электролите, в пастах происходит движение ионов, только с меньшей скоростью, чем в водных растворах. Этой скорости ионов достаточно для проведения электрохимических реакций.
Определим изменение степени окисления атомов химических элементов в веществах – участниках реакции:

Раздельное проведение реакций окисления на аноде и восстановления на катоде позволяет создать разность потенциалов на электродах (рис.74) и преобразовать энергию химической реакции в электрическую энергию гальванического элемента.
Чтобы батарейка не выделяла газообразный аммиак, который образуется в результате химической реакции в гальваническом элементе, ZnCl2 связывает газообразный аммиак в комплексную соль:
4NH3(г) + ZnCl2(р-р) = Zn[(NH3)4]Cl2(р-р)
Реакция окисления металлического цинка происходит на внутренней поверхности цинкового корпуса, выступающего в роли анода. Металлический цинк растворяется и переходит в виде ионов в раствор.

Рис. 74. Работа гальванического элемента. Превращение энергии связей реагирующих веществ в электрическую энергию.
В нерабочем состоянии, когда батарейка не подключена к электрической цепи, химическая реакция не происходит. Как только подключаем к батарейке маломощный электромотор от детского игрушечного автомобиля, тотчас скрытая в химических связях энергия начинает превращаться в работу, в механическое движение электромотора.
Однако энергию химической реакции невозможно полностью преобразовать в работу. На пути движения электронов встают ионы металла, расположенные в узлах кристаллической решетки металлического проводника. В результате столкновений электроны передают часть энергии ионам. Ионы начинают интенсивней двигаться относительно положения равновесия. Возрастание интенсивности движения ионов в проводнике приводит к повышению его температуры.
Следовательно, при движении электронов часть энергии химической реакции расходуется в виде тепла. Ту часть энергии химической реакции, которая никогда не превращается в работу механического движения (в данном случае электромотора), называют иногда связанным теплом.

Батарейка прекратит работу при завершении химической реакции. Это произойдет, когда израсходуется хотя бы один из реагентов, например, пиролюзит MnO2 или растворится цинковая оболочка батарейки. Последний вариант нежелателен, так как в этом случае из батарейки электролит может вытечь, попасть на детали, которые окружают батарейку, и разрушить их.
Кроме приведенного марганцево-цинкового гальванического элемента существует множество модификаций сухих элементов, электролитом в которых служат не только соли, но и щелочи. Наиболее распространенные сухие элементы имеют разность потенциалов между электродами (электродвижущую силу) Е, равную 1,5 В.
**Действие свинцового аккумулятора
Для того чтобы гальванический элемент можно было перезаряжать, продукты химической реакции должны находиться вблизи электродов. Свинцовый аккумулятор обладает таким свойством. Его электроды представляют собой свинцовые пластины. Анод - пористый свинец, а катод - пористый свинец, содержащий в порах оксид свинца (IV) (рис.75). Оба электрода прочно установлены в плоской пластмассовой банке, содержащей электролит. Электролитом является серная кислота, имеющая плотность 1,25-1,30 г/см3 (35-40% раствор). Аккумулятор при работе разряжается.
На катоде идет реакция восстановления. Степень окисления свинца изменяется от +4 в PbO2 до +2 в PbSO4:
Pb+4O2-2(т) + HSO4-(р-р) + 3H+(р-р) + 2e- = Pb+2SO4-2(т) + 2H2O(ж)
На аноде идет реакция окисления. Степень окисления свинца изменяется от 0 в Pb до +2 в PbSO4:
Pb(т) + HSO4-(р-р) = Pb+2SO4-2(т) + H+(р-р) + 2e-
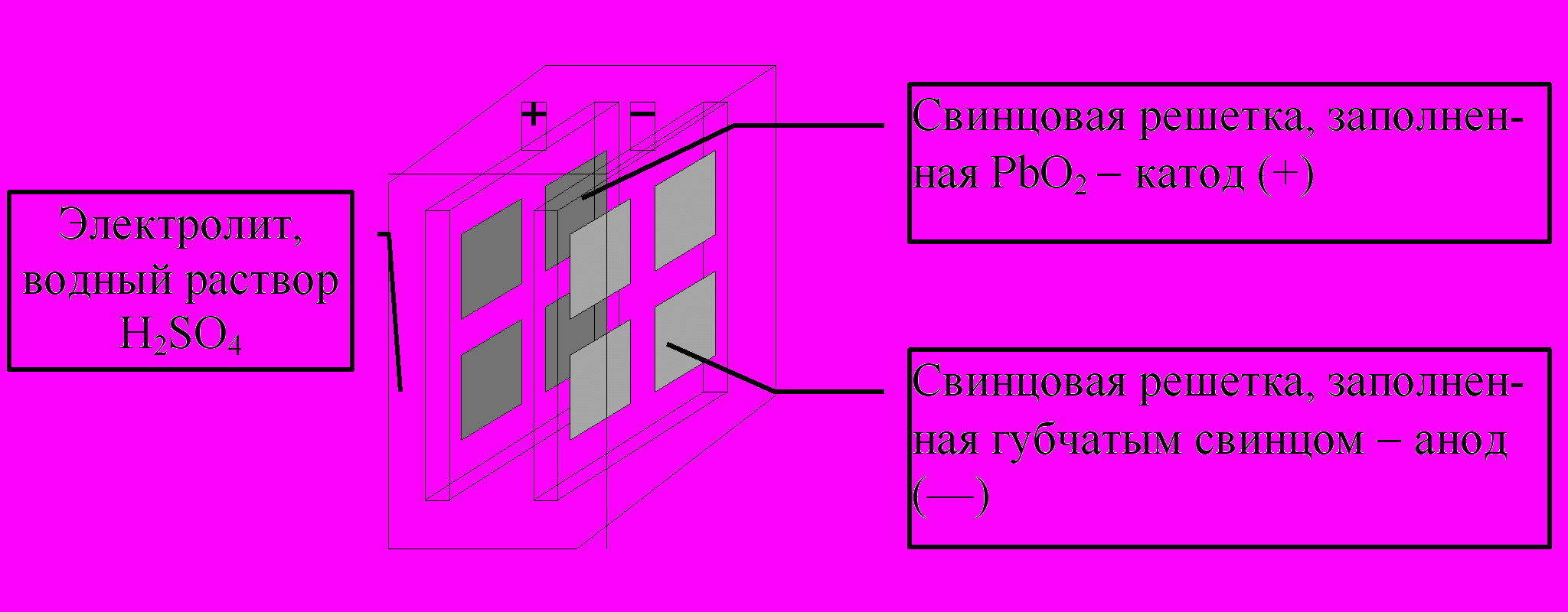
Рис. 75. Свинцовый аккумулятор.
Сложим уравнения реакций окисления и восстановления:
Pb+4O2-2(т) + HSO4-(р-р) + 3H+(р-р) + 2e- + Pb(т) + HSO4-(р-р) =
Pb+2SO4-2(т) + 2H2O(ж) + Pb+2SO4-2(т) + H+(р-р) + 2e-
или

Оба электрода погружены в серную кислоту. В процессе разрядки электродные реакции протекают слева направо, в процессе зарядки - справа налево. При работе аккумулятора происходит изменение состава электродов. На обоих электродах образуется сернокислый свинец PbSO4. Концентрация серной кислоты в растворе уменьшается. Об этом судят по уменьшению плотности электролита до 1,08-1,17г/см3 (12-24%).
Обычно каждая банка аккумулятора дает напряжение примерно 2В. Комплектуют аккумуляторную батарею из 6 банок, соединенных последовательно. Напряжение на концах аккумуляторной батареи 12В. Для зарядки подключают пластины аккумулятора к постоянному источнику электрической энергии. К отрицательному электроду подсоединяют отрицательный полюс, а к положительному - положительный полюс внешнего источника электрической энергии.
Делают это с таким расчетом, чтобы напряжение внешнего источника электрической энергии немного превышало напряжение аккумулятора, равное 12В. Внешний источник электрической энергии приводит к обращению реакции и превращению сульфата свинца в губчатый свинец на одном электроде и в оксид свинца - на другом.
Вопросы для проверки знаний
Какая среда называется искусственной, и чем она отличается от естественной среды обитания живых систем?
- Какие параметры характеризуют качество жизни человека с химической точки зрения?
- Что такое загрязнители?
- Что такое ПДК?
- Какую роль в человеческом организме играют микроэлементы?
- Для каких целей в промышленности производят водород?
- Для каких промышленных целей производят аммиак?
- Почему промышленное производство серной, азотной и соляной кислот является крупнотоннажным?
- Какую роль играет бумага в жизни человека?
- Существуют ли безотходные технологии?
- Почему нельзя пользоваться речной водой без предварительной очистки?
- Почему сточные воды перед сбрасыванием в реку очищаются?
- Можно ли всю энергию химической реакции, протекающей в гальваническом элементе, превратить в работу?
- Можно ли всю энергию химической реакции, протекающей в гальваническом элементе, превратить в теплоту?
- В чем различие между гальваническим элементом и аккумулятором?
Упражнения
Жидкая ртуть испаряется и создает опасную концентрацию паров в воздухе. Какие химические реакции позволяют исключить попадание паров ртути в воздух?
- Для производства бумаги используется щелочь. Приведите примеры промышленного получения щелочи.
- Напишите реакцию взаимодействия хлорида железа (III) с водой. Можно ли использовать хлорид железа в качестве коагулянта?
- Выскажите предположение, почему не осуществляют массовое производство автомобилей, работающих на энергии аккумуляторов.
- Почему на железнодорожных вокзалах и в речных портах для перевозки грузов со складов и ангаров к почтовым вагонам и судам используют автопогрузчики, работающие на энергии аккумуляторов?
- На батарейках имеются надписи: в гальваническом элементе - 0% Hg, 0% Cd. Выскажите предположение, объясняющее необходимость такой надписи.
ХИМИЧЕСКИЕ АСПЕКТЫ ЭКОЛОГИЧЕСКИХ
ПРОБЛЕМ
Тема 8. Химические процессы в живых системах и окружающей среде
**8.1. Биосфера. Возникновение жизни
Биосфера оболочка Земли, в которой осуществляется деятельность живых организмов. Биосфера охватывает нижнюю часть атмосферы (примерно до высоты 1011 км, где еще могут существовать микробы), всю гидросферу и верхнюю часть литосферы. Атмосфера, гидросфера и литосфера связаны сложными биогеохимическими циклами миграции вещества и энергии. Таким образом, биосфера это слой живых организмов, взаимодействующих между собой, с воздухом, водой и земной корой.
В соответствии с теорией, выдвинутой русским биохимиком А. И. Опариным (18941980), возникновение жизни длительный процесс эволюции от неорганических веществ к органическим и далее к живым организмам. В 1924 г. им была опубликована книга «Происхождение жизни», в которой рассматриваются этапы этого процесса. Предположение Опарина и американского физика и химика Г.К. Юри (18931981) о том, что первичная атмосфера Земли имела восстановительные свойства и на определенном этапе своего развития должна была содержать пары воды, молекулярного водорода, аммиака, метана и циана (CN), послужило исходной точкой для прогнозирования появления органических соединений и жизни.
Синтез органических соединений из неорганических соединений в восстановительной среде был доказан в середине ХХ века. В1953 г было установлено, что в восстановительной газообразной среде при электрических разрядах образуются аминокислоты. В этой среде под действием нагревания, ультрафиолетового излучения и других источников энергии происходит образование таких сложных органических веществ, как пурины, пиримидины, моносахариды (1960 г.), белковоподобные вещества (1969 г.), аденозинтрифосфорная кислота (1970 г.), полипептиды. Вопрос о химической эволюции на Земле как первом этапе возникновения живых систем из сложных органических веществ, считается доказанным. Появление сложных органических веществ обеспечило переход к следующему этапу – биологической эволюции.
С момента образования Земли, возраст которой оценивается в 4,6 миллиарда лет, атмосфера Земли постепенно менялась. Появились водоемы, в которых органические вещества участвовали в разнообразных химических превращениях. Энергия солнечного излучения вызывала синтез и распад сложных органических молекул. Образовывались такие молекулы, которые обладали способностью к совместному сосуществованию в каплях-коацерватах (лат. coacervatio собирание в кучу, накопление). Коацервация возможна даже в тех случаях, когда концентрация органических полимерных веществ в воде очень мала. Появление органических капель-коацерватов, нерастворимых в воде органических полимеров, послужило толчком к эволюционному совершенствованию процессов обмена веществ и возникновению простейших клеток (прокариот, эукариот).
Метаболические процессы, проходившие в первичных живых системах, сопровождались изменением состава атмосферы. Выделение кислорода в процессе фотосинтеза в одноклеточных организмах приводило к появлению и накоплению его в атмосфере:
6Н2О + 6СО2 С6Н12О6 + 6О2
Восстановительная атмосфера (Н2О, Н2, NH3, СН4 СN) превратилась в окислительную (О2, N2).
Период возникновения жизни завершился, и условия, которые способствовали этому примерно 34 миллиарда лет тому назад, перестали существовать. Наступил эволюционный этап развития живых систем в условиях окислительной среды. Чередование этапов эволюции и скачков качественного перехода к новому состоянию живых систем привел к той биосфере, которая существует в настоящее время. В биосфере сосредоточена большая часть природных ресурсов. Горючие ископаемые (каменный уголь, нефть, природный газ) и осадочные горные породы в своей основе созданы живыми существами планеты. Монопольное положение человека среди живых организмов особенно мощно проявилось в ХХ веке. Потребление природных ресурсов и накопление отходов человеческой деятельности стало оказывать опасное влияние на круговорот веществ в природе. Деятельность человека приобрела настолько большие масштабы, что поставила под угрозу существование его как вида. Постараемся пояснить это утверждение.
**8.2. Метаболизм
В 1775 г., выступая с докладом во Французской академии наук, Лавуазье сообщил о том, что воздух является смесью двух газов. Одна из этих частей, названная Лавуазье кислородом, соединяется с горящими и ржавеющими предметами, переходит из руд в древесный уголь, соединяясь с ним, а также необходима для жизни. Он был убежден (и, надо сказать, совершенно справедливо), что жизнь поддерживается процессом, сходным с процессом горения. Человек вдыхает воздух, богатый кислородом и бедный углекислым газом, а выдыхает воздух, бедный кислородом и значительно обогащенный углекислым газом.
В 1783 г. Кавендиш выяснил, что при сжигании «горючего воздуха» (так называл он открытый им в 1766 г. водород) в чистом кислороде образуется вода. Лавуазье по достоинству оценил эту работу и назвал «горючий воздух» Кавендиша водородом («образующим воду»). Для Лавуазье было очевидным, что пища и живая ткань представляют собой множество соединений углерода и водорода. Таким образом, при вдыхании воздуха кислород расходуется на образование не только углекислого газа из углерода, но и воды из водорода. В живых организмах непрерывно идут химические реакции. Поэтому живые организмы представляют собой своеобразные химические реакторы, обменивающиеся с окружающей средой веществом, энергией и информацией. Живые организмы (животные, включая человека, растения и микробы) находятся в устойчивом состоянии до тех пор, пока они получают необходимые вещества и энергию из окружающей среды. Прекращение такого обмена означает прекращение жизни. Все виды пищи, независимо от их химического состава обеспечивают устойчивое состояние живой системы.
Метаболизм – это совокупность химических реакций, протекающих в живых клетках и обеспечивающих организм веществами и энергией для его жизнедеятельности, роста и размножения.
Метаболизм включает два типа химических превращений вещества: синтез сложных соединений из более простых (анаболизм) и расщепление сложных соединений до более простых (катаболизм). В зависимости от химической формы углерода, усваиваемого живыми организмами, они делятся на две группы. Для первой группы живых организмов основным источником углерода служит СО2, для второй различные органические соединения. К первой группе относятся зеленые растения и фотосинтезирующие бактерии, ко второй животные и грибы. У растений основным по преимуществу является анаболический процесс питания, у животных катаболический. Поступающие в живой организм питательные вещества превращаются в нем, переносятся внутри организма, а отходы выделяются в окружающую среду. Вместе с питательными веществами поступает энергия в виде солнечного излучения в случае зеленых растений, либо сами питательные вещества являются носителями энергии, скрытой в химических связях соединений, составляющих питательные вещества. Энергия, выделяющаяся в результате превращения питательных веществ, преобразуется в теплоту, мышечную работу, расходуется в процессах биосинтеза.
Главным катаболическим процессом в метаболизме является биологическое окисление в клетках углеводов, белков и жиров. Окисление углеводов и жиров сопровождается образованием СО2 и Н2О. Подавляющая часть белкового азота при окислении белка в организме млекопитающих переходит в мочевину:
О


Н2NСNН2
Главным анаболическим процессом в метаболизме является осуществляемый растениями фотосинтез. Фотосинтез образование зелеными растениями и некоторыми бактериями органических веществ с использованием энергии солнечного света. В основе фотосинтеза лежат окислительно-восстановительные реакции, в которых электроны переносятся от Н2О к СО2 с образованием углеводов и выделением О2. Фотосинтез один из самых распространенных процессов на Земле, он обуславливает круговорот в природе углерода, кислорода и других элементов. В связи с тем, что углеводы составляют основную массу продуктов биосинтетической деятельности растений, химическое уравнение фотосинтеза обычно записывают в виде:
h
СО2 +Н2О [CН2О] + О2
углеводный фрагмент
У высших животных анаболические процессы осуществляются за счет энергии, выделяемой в катаболическом процессе.
Реакции в живых организмах идут с участием катализаторов. Необычным в биохимических реакциях (включая фотохимические реакции в растениях) является то, что многие из них идут с большой скоростью при невысоких температурах. Катализаторами таких реакций служат специальные белки-ферменты. В катализируемой ферментом (ферментативной) реакции могут участвовать и другие важные вещества, называемые коферментами. Например, для действия фермента необходимо присутствие иона Mg2+ или другого металла или участие органической молекулы. Во многих реакциях роль кофермента выполняют витамины. Рассмотрим подробнее действие и роль ферментов в живых системах.
** 8.3. Ферменты. Ферментативные реакции
Для живых организмов, характерна сложная система взаимосвязанных химических реакций, поддерживающих на необходимом уровне концентрации веществ, обеспечивающих устойчивое состояние организма. Ниже приведены свойства ферментов, обеспечивающие это стабильное состояние.
Во-первых, они характеризуются высокой чувствительностью к температуре. Любой фермент проявляет наибольшее каталитическое действие при температуре 40500С. Восходящая ветвь кривой, представленной на рис. 76, отражает рост скорости ферментативной реакции с увеличением температуры в соответствии с правилом Вант-Гоффа, когда скорость реакции возрастает в 24 раза при увеличении температуры на каждые 10 градусов.
V
2

-

1
3
Т0С
40
0
20
60
80
90
Т0С

Рис. 76. Влияние температуры на скорость (V) ферментативной реакции. Кривая 12 отражает рост скорости реакции с увеличением температуры в соответствии с правилом Вант-Гоффа, кривая 3 отражает уменьшение скорости реакции с увеличением температуры, связанное с разрушением белка-фермента
Однако в ферментативный катализ вмешивается неустойчивость белка-фермента. При температурах выше 500С он начинает разрушаться. Концентрация фермента уменьшается, что приводит к уменьшению скорости реакции. Для человека нормальная температура тела соответствует 36370С. При температуре ниже нормальной уменьшаются скорости ферментативных реакций. Например, в воде при температуре 50С человек погибает уже через 1015 минут, т. к. замедляются или полностью прекращаются основные ферментативные реакции. При повышенной температуре разрушаются белки-ферменты, они теряют свою каталитическую активность, скорость ферментативных реакции уменьшается или они полностью прекращаются и организм погибает.
По этим причинам так важен постоянный температурный режим тела человека. Мы одеваемся теплее зимой и стараемся быть в тени жарким летним днем. Переохлаждение, так же как и перегрев, одинаково опасны для нормального функционирования живого организма.
Во-вторых, ферменты чрезвычайно чувствительны к кислотности среды. Это связано со способностью фермента изменять состояние ионизации и каталитическую активность под действием Н+ или ОН ионов.
В третьих, ферменты проявляют избирательную каталитическую активность по отношению к одному соединению, и не проявляют таковую к другим химическим соединениям. Например, существует белок-фермент, который катализирует гидролиз полипептидов, приводящий к образованию аминокислот. Такой фермент атакует часть полипептидной цепи, точнее амидную группу:
 Н О H O H O H O
Н О H O H O H O
 ∥ ∥ Фермент ∥ ∥
∥ ∥ Фермент ∥ ∥ССNCCOH + H2O ССOH + H2NCCOH
R H R R R
Белок-фермент, катализирующий гидролиз полипептидной цепи, не оказывает никакого влияния на гидролиз жиров или расщепление углеводов. У белка-фермента в полимерной цепи расположены активные участки, которые выполняют роль каталитических центров. Эти центры имеют определенную форму точно соответствующую форме определенного участка в структуре полипептида, подвергающегося гидролизу и расщеплению (рис. 77).
В четвертых, скорость ферментативной реакции необычайно высока по сравнению с реакцией в отсутствии фермента.

 В1 В2 В3
В1 В2 В3





 Ф Ф
Ф Ф









Рис. 77. Модель избирательного каталитического действия фермента Ф на расщепление вещества В1. Вещества В2 и В3 катализу не подвергаются, т.к. не подходят по своей структуре к каталитическому центру фермента
Например, разбавленный раствор пероксида водорода (~3%) устойчив в течение года, если хранится в темноте в присутствии стабилизатора (ничтожных количеств фосфорной кислоты) при комнатной температуре. При обработке открытой раны или пореза пероксидом водорода она разлагается буквально в считанные секунды по реакции:
пероксидаза
2 Н2О2(р-р) 2Н2О(ж) + О2(г)
Высокая скорость реакции разложения пероксида водорода на поверхности открытой раны обусловлена каталитическим действием фермента-пероксидазы, содержащимся в организме человека.
Использование лекарственных веществ позволяет уничтожать многие болезнетворные бактерии в человеческом организме. Например, было установлено, что некоторые из таких бактерий используют пара-аминобензойную кислоту в жизненно важной для них ферментативной реакции. Этим обстоятельством воспользовались ученые и синтезировали сульфамидный препарат (пара-аминобензолсульфамид), который блокирует активный центр и не позволяет ферменту участвовать в биохимическом процессе, важном для бактерий.



 Н2N– – SO2NH2 H2N– –C(O)OH
Н2N– – SO2NH2 H2N– –C(O)OHпара-аминобензолсульфамид пара-аминобензойная кислота
(cульфамидный препарат) (вещество, необходимое бактериям)
В результате бактерии погибают. Причина блокировки обусловлена структурным сходством между аминобензойной кислотой и пара-аминобензолсульфамидом:
8.4. Состояние окружающей среды
Наша планета – это большой космический корабль с шестью с лишним миллиардами человек населения. С момента появления жизни на Земле в круговорот веществ на планете включились живые организмы. Они преобразовали поверхность суши, гидросферу и атмосферу. Этот процесс преобразования идет непрерывно и будет продолжаться, пока существует жизнь на Земле.
Все более активную роль в изменении биосферы играет деятельность человека. Масштабы этой деятельности становятся соизмеримыми с природными явлениями. Существует серьезная опасность нарушения устойчивого взаимодействия Человек–Природа. Ответственность за нарушение этого устойчивого состояния лежит на человеке.
Уместно привести четыре закона-афоризма экологии, сформулированные американским экологом Барри Коммонером:
- Все взаимосвязано со всем.
- Все должно куда-то деваться.
- Природа знает лучше.
- Ничто не дается даром или за все надо платить.
В них в краткой форме отражены взаимоотношения человека с окружающей средой. Человек нарушает установившиеся связи и отношения в естественной среде обитания. Он выбрасывает в окружающую среду промышленные и бытовые отходы в возрастающих количествах. Ему приходят в голову идеи преобразования природных ландшафтов, а за такие действия приходится расплачиваться здоровьем, потребляя питьевую воду низкого качества и вдыхая загрязненный воздух.
В состав атмосферы входят устойчивые, неустойчивые и сильно изменяющиеся газы (табл. 13).
Т а б л и ц а 13
Классификация газов, входящих в состав атмосферы
Группа газов | Соединение | Время жизни |
| Устойчивые | N2 O2 Ar и др. благородные газы | Более нескольких тысяч лет |
| Неустойчивые | СО2 Н2 СН4 | Несколько лет (425 лет) |
| Сильно изменяющиеся | Н2О NO2 NO SO2 H2S | Несколько суток (210 дней) |
