Оглавление
| Вид материала | Общие методические указания |
- Кожич Павел Павлович Минск 2010 г Оглавление Оглавление 2 Применение информационных, 302.47kb.
- Оглавление оглавление, 63.5kb.
- Оглавление Оглавление, 1560.65kb.
- Оглавление Оглавление, 259.29kb.
- Ланин Борис Евсеевич Оглавление Оглавление 1 лекция, 810.53kb.
- Оглавление: Оглавление:, 350.3kb.
- Октябрьской Революции Краснознаменной академии (ввиа) имени профессора Н. Е. Жуковского, 1685.68kb.
- Караваева Елена Леонидовна г. Светлый 2008 г. Оглавление оглавление 2 пояснительная, 130.81kb.
- Винарский Владимир Афанасьевич ассистент Шешко Сергей Михайлович Минск 2008 г. Оглавление, 156.88kb.
- Коледа Виктор Антонович, ст преподаватель Пол Кожич Минск 2010 г. Оглавление Оглавление, 340.48kb.
ГОУ СПО «Чапаевский химико-технологический техникум»
ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ
Учебно - методическое пособие
Чапаевск 2011
ОГЛАВЛЕНИЕ
Общие методические указания………………………………………………………….
Примерная программа курса общей и неорганической химии………………………
Библиографический список………………………………………………………………
Контрольные задания……………………………………………………………………..
1. Периодический закон и периодическая система элементов Д.И.Менделеева.
Теория строения вещества.
2. Классы неорганических веществ
3. Растворы. Способы выражения концентрации растворов.
4. Теория электролитической диссоциации. Ионные реакции. Гидролиз солей.
5. Химические реакции. Химическое равновесие. Окислительно-восстановительные реакции
6. Р - элементы ( галогены, халькогены, азот, фосфор, углерод,кремний )
7. S – элементы ( металлы 1 и 11 группы)
8. d – элементы (медь, цинк, ртуть, хром, марганец, железо)
Общие методические указания
Химия является не только общетехнической и общеобразовательной наукой, поэтому техник-технолог должен обладать достаточными знаниями в области современной общей химии.
Изучение курса общей и неорганической химии должно способствовать развитию у обучающихся логического химического мышления и диалектико-материалистического мировоззрения. В результате изучения курса, обучающиеся должны получить современное научное представление о материи и формах её движения, о веществе, как одном из видов движущейся материи, о механизме превращения химических соединений, понимать значение химии в промышленности и жизнедеятельности человека.
Знание курса общей и неорганической химии необходимо для успешного изучения последующих общенаучных и специальных дисциплин. Обучающиеся должны усвоить основные законы и теории химии , овладеть техникой химических расчетов, уяснить значение химических наук для решения прикладных задач .
Основной вид учебных занятий обучающихся заочного отделения – самостоятельная работа над учебным материалом. По курсу общей и неорганической химии она слагается из следующих элементов:
А) изучение материала по учебникам и учебным пособиям;
Б) выполнение контрольных заданий;
В) посещение установочных лекций;
Г) консультации;
Д) экзамен по всему курсу.
РАБОТА С КНИГОЙ. Изучать курс рекомендуется по темам, предварительно ознакомившись с содержанием каждой из них по программе.
Изучая курс, пользуйтесь предметным указателем в конце книги. При первом чтении старайтесь получить общее представление об излагаемых вопросах, отмечайте трудные или неясные места. Внимательно прочитайте текст, напечатанный особым шрифтом. При повторном изучении темы усвойте все теоретические положения, выводы, принципы составления уравнений реакций. Вникайте в сущность того или иного вопроса, а не пытайтесь запомнить отдельные факты и явления, что способствует более глубокому и прочному усвоения материала.
Чтобы лучше запомнить и усвоить изучаемый материал, необходимо конспектировать формулировки законов, основных химических понятий, новые термины и названия, формулы и уравнения реакций. Графики, схемы, таблицы, систематизирующие материал, облегчают запоминание и уменьшают объем конспектируемого материала. Краткий конспект курса будет полезен при повторении материала в период подготовки к экзамену.
КОНТРОЛЬНЫЕ ЗАДАНИЯ. В процессе изучения общей и неорганической химии обучающийся должен выполнить контрольную работу. К выполнению её можно приступить только тогда, когда будет изучена определенная часть курса и тщательно разобраны решения примеров, приведенных перед задачами к соответствующим темам контрольных заданий, или в любом задачнике по общей химии.
Решение задач и ответы на теоретические вопросы должны быть коротко, но четко обоснованы. Номера и условия задач переписывать в том порядке, в каком они указаны в задании. Работы должны быть датированы и подписаны, представлены на проверку в установленные сроки.
Если контрольная работа не зачтена, её нужно ещё раз выполнить в соответствии с замечаниями.
Контрольная работа, выполненная не по своему варианту, преподавателем не рецензируется и не зачитывается.
ЛЕКЦИИ. В помощь обучающимся на установочных сессиях читаются лекции по важнейшим разделам курса.
ЭКЗАМЕН. К сдаче экзамена допускаются студенты, которые выполнили контрольные задания.
ПРИМЕРНАЯ ПРОГРАММА КУРСА ХИМИИ
Тема 1. Современная формулировка периодического закона Д.И.Менделеева в свете строения вещества. Малые и большие периоды, группы и подгруппы периодической системы. Причины изменения свойств элементов. Электронное строение атомов элементов, возбужденное и невозбужденное состояние. Виды химической связи. Электроотрицательность, валентность и степень окисления элементов.
Тема 2. Классификация неорганических веществ. Генетическая связь между классами неорганических веществ.
Тема 3. Растворы. Виды растворов . Способы выражения концентрации растворов.
Тема 4. Основные положения теории электролитической диссоциации. Диссоциация кислот, оснований, солей. Ионные уравнения, полные и сокращенные. Гидролиз солей.
Тема 5. Типы химических реакций, реакции обратимые и необратимые. Скорость химической реакции. Химическое равновесие. Смещение химического равновесия. Принцип Ле-Шателье. Редокс-реакции (ОВР), составление уравнений ОВР.
Тема 6. Характеристика элементов V11группы периодической системы. Важнейшие соединения хлора.
Характеристика элементов V1 группы. Соединения кислорода и серы.
Характеристика элементов V группы. Соединения азота и фосфора.
Характеристика элементов 1V группы. Соединения углерода и кремния
Тема 7. Общая характеристика металлов. Металлы 1 и 11 групп ( натрий, калий, кальций, магний), их соединения ( оксиды, гидроксиды, соли).Жесткость воды.
Тема 8. Металлы побочных подгрупп 1, 11 групп, V1 , V11 , V111 групп (медь, серебро, цинк, ртуть, хром, марганец, железо ), их соединения.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Глинка Н.Л. Общая химия.Л.:Химия,2000.728с.
2. Глинка Н.Л. Задачи и упражнения по общей химии.М.:Высш.шк.,1997.
3. Курс общей химии/ Под ред.Н.В.Коровина.М.:Высш.шк.,1981
4. Хомченко Г.п. Химия для поступающих в ВУЗы: Учеб.пособ.2-е изд.М.: Высш.шк., 1994.447 с.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
Каждый студент выполняет контрольные задания по номеру варианта, совпадающему с номером его фамилии по общему списку.
Варианты контрольных заданий
| Номер варианта | Номера задач, относящиеся к данному заданию |
| 1 | 1, 28,41,95,96,134 ,176,177 |
| 2 | 2, 29,42,94,97,149,175,178 |
| 3 | 3, 30,43,93,98,148,174,179 |
| 4 | 4, 31,44,92,99,147,173,180 |
| 5 | 5, 32,45,91,100,146,172,181 |
| 6 | 6, 33,46,90,101,145,171,182 |
| 7 | 7, 34,47,89,102,144,170,183 |
| 8 | 8, 35,48,88,103,143,169,184 |
| 9 | 9, 36,49,87,104,142,168,185 |
| 10 | 10, 37,50,86,105,141,167,186 |
| 11 | 11, 38,51,85,106,140,166,187 |
| 12 | 12, 36,52,84,107,139,165,188 |
| 13 | 13, 30,53,83,108,138,164,189 |
| 14 | 14, 32,54,82,109,137,163,190 |
| 15 | 15, 40,55,81,110.136,162,197 |
| 16 | 16, 39, 56,80,111,135,161,196 |
| 17 | 17, 38, 57,79,112,133,160,198 |
| 18 | 18, 37,58,78,113,132,159,191 |
| 19 | 19, 36, 60,77,114,131,158,192 |
| 20 | 20, 35, 61,76,115,130,157,193 |
| 21 | 21, 34, 62,75,116,129,156,194 |
| 22 | 22, 33, 63,74,117,128,155,195 |
| 23 | 23, 32, 64,73,118,127,154,196 |
| 24 | 24, 31,65,72,119,126,153,197 |
| 25 | 25, 30, 66,71,120,125,152,198 |
| 26 | 26, 29, 67,70,121,124,151,199 |
| 27 | 27, 28, 68,69,122,123,150,200 |
1. Периодический закон Д.И.Менделеева и строение атома
1. Какую низшую степень окисления проявляют хлор, сера, азот и углерод? Составьте формулы соединений алюминия с данными элементами и назовите их.
2. Составить электронные формулы атомов фосфора и сурьмы. У какого из этих элементов сильнее выражены неметаллические свойства. Ответ мотивируйте.
3. Внешние уровни атомов имеют вид 2S22P1; 4S24P3, в каких периодах и в каких подгруппах находятся эти элементы и к каким семействам они принадлежат?
4. Составьте формулы оксидов и гидроксидов элементов третьего периода в высшей степени их окисления.
5. Как изменяется восстановительная активность s – и p –элементов в группах Периодической системы с увеличением порядкового номера? Почему?
6. Что такое электроотрицательность? Как изменяется электроотрицательность в периодах и группах.
7. Что такое энергия ионизации? В каких единицах она выражается?
8. Что такое сродство к электрону? В каких единицах оно выражается?
9. Какой из элементов –ванадий или мышьяк- обладает более ярко выраженными металлическими свойствами?
10. Внешний и предвнешний уровни атома элемента имеет вид: 4S24P64 d25S2 . В каком периоде и какой подгруппе находится данный элемент? К какому электронному семейству относится?
11. Внешний и предвнешний уровни атома элемента имеет вид: 5d106S26P1 .В каком периоде и какой подгруппе находится данный элемент? Какова его высшая степень окисления? Составьте формулы оксидов.
12. Какие элементы образуют газообразные соединения с водородом? Составьте формулы водородных соединений хлора, теллура и сурьмы.
13. Составьте формулы кислородных соединений хлора, теллура и сурьмы, отвечающие высшим и низшим степеням их окисления.
14. Какую низшую степень окисления проявляют сера и азот? Почему? Составьте формулы соединений кальция с данными элементами. Назовите соединения
15. Современная формулировка Периодического закона. Объясните, почему в Периодической системе элементов аргон помещен перед калием, кобальт перед никелем, хотя и имеют большую атомную массу.
16. Показать электронное строение атома углерода в невозбужденном и возбужденном состоянии. Составить электронные формулы.
17. У какого элемента четвертого периода хрома или селена сильнее выражены металлические свойства. Ответ мотивируйте строением атома хрома и селена.
18. Какая ковалентная связь называется σ-связью, а какая π- связью?
19. Составьте электронные схемы строения молекул N2, , H2O ,HBr . Какие из них являются диполями?
20. Составьте электронные схемы строения молекул Сl2 , H2 Se ,CCl4 . В каких молекулах ковалентная связь является полярной?
21.Какая химическая связь называется водородной? Между молекулами каких веществ она образуется?
22. Какая химическая связь называется ионной? Каков механизм её образования? Какие свойства ионной связи отличают её от ковалентной? Привести примеры типичных ионных соединений.
23. Какой тип связи в молекулах PH3 ,HF ,F2 ,CaO? Объяснить механизм образования связей между атомами в этих молекулах.
24. Что следует понимать под степенью окисления атома? Определить степень окисления атомов в соединениях CaSO3 , H3PO4 ,K2Cr2O7 ,HMnO4 .
25. Какая из следующих связей полярна? В каждой полярной связи указать более электроотрицательный атом: а) Cl – J; б) P – P; в) C – N ; г) O – H; д) F – F.
26. приведите примеры веществ, в которых связи носили бы характер: а) ионный, б) ковалентный – полярный и неполярный; в) донорно- акцепторный. Ответ мотивируйте.
27. Линейное и угловое строение молекул веществ. Примести примеры.
2. Классы неорганических веществ
28. Привести уравнения реакций получения указанных ниже солей из соответствующих кислот и оснований:
хлорид алюминия, сульфат меди (11), нитрат калия, ортофосфат натрия, хлорид бария.
29. Написать уравнения реакций, при помощи которых можно осуществить следующие превращения6
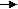 Железо сульфат железа (111)→ гидроксид железа ( 111)→ оксид железа(111)
Железо сульфат железа (111)→ гидроксид железа ( 111)→ оксид железа(111)30. С какими из перечисленных веществ – N2O5 ,Zn(OH)2 , FeO реагирует гидроксид кальция? Составьте уравнения соответствующих реакций.
31. Какие кислоты могут быть получены при непосредственном взаимодействии с водой следующих оксидов:P2O5 , CO2 , SO2 ,CrO3.
32. Как осуществить следующие превращения: Zn→ZnSO4 →Zn(OH)2→Na2ZnO2
33 . Как осуществить следующие превращения: Al →Al2O3→Al(OH)3→Al(NO3)3
34.Какие из указанных газов вступают в химическое взаимодействие с раствором щелочи: HCl ,H2S ,NO2 ,NH3 ?
Написать уравнения возможных реакций.
35. С какими из перечисленных веществ будет реагировать соляная кислота: P2O5 ,Sn(OH)2 ,CoO ,AgNO3? Составить уравнения возможных реакций.
36. С какими из указанных ниже веществ может взаимодействовать раствор гидроксида калия: йодоводородная кислота, нитрат меди (11), хлорид стронция, оксид серы(1V), оксид свинца(11)? Написать уравнения возможных реакций.
37. Составьте уравнения реакций, характеризующие химические свойства соединений: оксид железа (111), гидроксид олова(11), оксид кремния(1V).
38. Составьте уравнения реакций, характеризующие химические свойства соединений: оксида калия, гидроксида кальция, карбоната натрия.
39. Составьте формулы солей кальция и алюминия, образованных : а)соляной кислотой, б)серной кислотой.
40. Напишите уравнения реакций, характеризующих химические свойства указанных соединений: оксид меди (11), оксид азота (V), гидроксид железа (111).
3. Растворы
Раствором называется однородная система переменного состава, состоящая из двух и более компонентов.
Концентрация раствора – это содержание растворенного вещества в определенной массе или определенном объёме раствора или растворителя.
Определение массовой доли вещества в растворе ( в долях единицы или процентах)
Wв = mВ/ m, где mВ – масса растворенного вещества , m – масса раствора
Определение молярной концентрации раствора ( СМ или М)
m = V СМ М, где V- объём (л), М – молярная масса (г/моль)
Определение эквивалентной концентрации( CN или Н)
m = V CN ЭМ, где ЭМ – молярная масса эквивалента растворенного вещества
41. В 220 г воды растворили 30 г хлорида натрия. Вычислить массовую долю хлорида натрия в растворе.
42. Найти массу хлорида натрия, который надо растворить в воде, чтобы получить 115 г 20% раствора.
43.Определить массу нитрата натрия, которая потребуется для приготовления 2 л 0,1М раствора.
44. Какое количество сульфата натрия содержится в 400 мл 0,6Н раствора.
45. Определить процентную концентрацию СuSO4 в растворе, полученном при растворении 50 г медного купороса СuSO4 *Н2О в 450 г воды.
46. Найти массу NaNO3, необходимую для приготовления 300 мл 0,2М раствора.
47. Сколько граммов Na2 CO3 содержится в 500 мл 0,25Н раствора.
48.Сколько граммов SO3 надо растворить в 400 г Н2О, чтобы получить 15% раствор серной кислоты.
49. В каком объёме 0,1Н раствора содержится 8 г СuSO4 .
50. Сколько граммов Na2SO4 * Н2О надо растворить в 800 г воды, чтобы получить 10% раствор сульфата натрия.
51. Для приготовления 5% раствора сульфата магния взято 400 г MgSO4 * Н2О. Найти массу полученного раствора.
52. Сколько граммов гидроксида натрия содержится в растворе массой 250 г с массовой долей NaOH - 0,2.
53.Сколько граммов NaOH содержится в 0,1М растворе объёмом 500 мл.
54. Определить массовую долю КОН в растворе, если 40 г КОН растворен в воде массой 160 г.
55. Определить массовую долю (в%) хлорида натрия, полученного смешением двух растворов хлорида натрия: массой 120 г с массовой долей NaCl 40% и массой 200 г с массовой долей NaCl 15%.
56. Вычислить молярную концентрацию раствора гидроксида натрия, в 500 мл которого содержится 1 г NaOH.
57. К 300 мл раствора гидроксида калия с массовой долей КОН 20% ( плотность 1,2) прибавили КОН массой 40 г. Определить массовую долю КОН в новом растворе.
58. Определить молярную концентрацию раствора Н3РО4 , в 500 мл которого содержится Н3РО4 массой 9,8 г.
59. Сколько граммов Na2 CO3 содержится в 0,1 М растворе объёмом 200 мл.
60. Определить массовую долю (в %) хлорида натрия в растворе, полученном при смешении раствора массой 200 г с массовой долей NaCl 20% и раствора объёмом 100 мл с массовой долей NaCl 30% и плотностью 1,15.
61. При упаривании раствора хлорида натрия массой 500 г и массовой долей NaCl 1% плучен новый раствор массой 150 г. Какова массовая доля (в %) полученного раствора.
62. Определить массу хлорида железа (111), необходимую для приготовления 0,25 Н раствора объемом 150 мл.
63. Определить молярную концентрацию серной кислоты, если в растворе объёмом 200 мл содержится H2SO4 массой 4,9 г.
64. Сколько хлорида магния содержится в 800 мл раствора с массовой долей MgCl2 10% ( пл. 1,06).
65. В каком объёме 0,25Н раствора содержится H2SO4 массой 4,9 г.
66. Сколько граммов Na2 CO3 содержится в 0,1 Н растворе объёмом 1200 мл.
67. Определить массу нитрита натрия, которая потребуется для приготовления 1,2 л 0,1М раствора
68. Найти массу Сa(NO3)2, необходимую для приготовления 300 мл 0,2Н раствора.
4. Теория электролитической диссоциации. Ионные уравнения.
Гидролиз солей.
69. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами :
Na3PO4 и CaCl2 , K2CO3 и BaCl2 ,Zn(OH)2 и KOH.
70. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами :
K2S и HCl , FeSO4 и (NH4)2S, Cr(OH)3 и KOH.
71. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами:
Pb(NO3)2 и KJ, Hg(NO3)2 и NaJ, CdSO4 и Na2S.
72. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами:
NaHCO3 и NaOH , K2SiO3 и HC, BaCl2 и Na2SO4.
73. К каждому из веществ – KHCO3 ,CH3COOH, NiSO4 ,Na2S прибавили раствор серной кислоты. В каких случаях произошли реакции? Выразите их молекулярными и ионными уравнениями.
74. Напишите уравнения ступенчатой диссоциации электролитов: H2CO3 , H3PO4 ,H3AsO3, Ba(OH)2.
75. Написать уравнения ступенчатой диссоциации следующих электролитов: Сa(OH)2 ,H2SeO4 ,NaHCO3 .
76. Написать уравнения ступенчатой диссоциации следующих электролитов: H3AsO4 ,KHS ,Fe(OH)2NO3.
77. Составьте молекулярные и ионные уравнения реакций, которые выражаются ионными уравнениями:
А)Сu2+ + S2- = CuS ; Б) Pb(OH)2 + 2OH - = PbO22- + 2H2O ; В) SiO32- + 2H+ = H2SiO3
78. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами:
Sn(OH)2 и HCl , BeSO4 и KOH. NH4Cl и Ba(OH)2.
79. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами:
CuSO4 и H2S, BaCO3 и HNO3 , FeCl3 и KOH.
80. Составьте молекулярные и ионные уравнения реакций, которые выражаются ионными уравнениями:
А) Zn2+ + H2S = ZnS + 2H+ ; Б) Mg2+ + CO32- = MgCO3 ; В) H+ + OH- = H2O
81. Напишите формулы веществ, в водных растворах которых содержатся следующие ионы: NO3- ,HSO3- MgOH+, PO43- ,OH- , H+.
82. Напишите формулы веществ, в водных растворах которых содержатся следующие ионы: S2- ,H2PO4-
Fe(OH)2+ , CO32- , NH4+.
83. Написать уравнения электролитической диссоциации хлорида алюминия, сульфата железа (11), гидросульфата калия, сульфата натрия, дигидрофосфата бария.
84. Написать уравнения электролитической диссоциации карбоната натрия, силиката калия, хлорида гидроксоцинка, нитрата калия, нитрата дигидроксоалюминия.
85. Что называется гидролизом? Приведите примеры солей , которые подвергаются гидролизу , и солей, которые гидролизу не подвергаются, и объясните почему.
86. Почему раствор нитрата алюминия окрашивается в красный цвет при добавлении лакмуса.
87. Почему раствор сульфида калия окрашивается в малиновый цвет при добавлении фенолфталеина.
88. Как влияют на гидролиз соли температура и концентрация раствора? Ответ поясните.
89. Какая среда будет в водных растворах солей: хлорид алюминия, нитрат калия, сульфид аммония. Написать уравнения реакций гидролиза в полной и сокращенной ионной формах.
90. Какие соли подвергаются гидролизу :BaCl2 ,Pb(NO3)2 ,K3PO4 ,Na2CO3 ,ZnBr2? Написать возможные уравнения гидролиза в ионном виде.
91. В какой цвет будет окрашен лакмус в водных растворах CuSO4 ,K2CO3 ,CaS ,NaNO3 ? Написать уравнения.
92. В какой цвет будет окрашен лакмус в водных растворах K2S ,ZnCl2 ,NaCN , NH4Cl? Написать уравнения.
93. Как можно усилить или ослабить гидролиз? Укажите это на примере гидролиза солей Fe2(SO4)3 ,Zn(NO3)2.
94. Добавление каких из перечисленных ниже реагентов к раствору Fe Cl3 усилит гидролиз соли: HCl ,NaOH ZnCl2 ,NH4Cl ,H2O ?
95. Почему раствор NaHCO3 имеет слабощелочную реакцию, а раствор NaHSO3 - слабокислую?
5. Химические реакции. Химическое равновесие.
Окислительно- восстановительные реакции .
96. Как изменится скорость реакции 2NO + O2 →2NO2 , если объём реакционного сосуда: а) увеличить в 2 раза, б) уменьшить в 8 раз?
97. Чем объяснить повышение скорости реакции при введении в систему катализатора: а) уменьшением энергии активации; б)увеличением средней кинетической энергии молекул; в) возрастанием числа столкновений, г) ростом числа активных молекул?
98. Какие воздействия приведут к изменению константы скорости реакции: давление, температура, концентрация веществ, введение катализатора?
99. Объём закрытого реакционного сосуда, в котором установилось равновесие 2SO2(г.) +О2(г.) ↔ 2SO3(г.) уменьшили в 2 раза, как это повлияет на скорости прямой и обратной реакций?
100.В каком направлении сместиться равновесие в системе 4HCl (г.) + О2(г.) ↔2Cl2(г.) + 2H2O(г.) при повышении давления, увеличении концентрации продуктов реакции?
101. Что называется константой равновесия реакции. Привести уравнение константы, скоростей прямой и обратной реакций следующего взаимодействия 2NO + O2 →2NO2
Задание для задач №№ 102-120
Составить уравнения полуреакций, расставить коэффициенты в уравнении, указать окислитель и
восстановитель.
102. Al + HCL → AlCl3 + H2
103. MnO2 +HCl → MnCl2 + Cl2 + H2O
104 Hg + HNO3( конц. ) → Hg(NO3)2 + NO2 + H2O
105 Zn + H2SO4 →ť ZnSO4 + H2S+ H2O
106. KMnO4 + HCl → MnCl2 + Cl2 +KCl + H2O
107 . Pb + HNO3( разб.) → Pb(NO3)2 + NO + H2O
108. K2Cr2O7 + HCl →CrCl3 + Cl2+ KCl + H2O
109. Fe(OH)2 + O2 +H2O → Fe(OH)3
110. FeCl3 + KJ→ FeCl2 + KCl + J2
111. Fe2O3 + KNO3 + KOH→ K2FeO4 + KNO2 +H2O
112. KBr (тв. ) + H2SO4 (конц. ) → Br2 +SO2 + K2SO4 + H2O
113.KJ(тв. ) + H2SO4 (конц. ) → J2 + S + K2SO4 + H2O
114. KJ( тв.) + H2SO4 (конц. ) → J2 + H2 S + K2SO4 + H2O
115.KMnO4 + NaSO3 + H2SO4→ MnSO4+ Na2SO4 + K2SO4 + H2O
116. KMnO4 + NaSO3+ H2O → MnO2 + Na2SO4 + KOH
117. KMnO4 + NaSO3+ KOH→ Na2SO4 + K2 MnO4 + H2O
118.NH3 + CuO→ N2 + Cu + H2O
119. Cl2 + KOH→ KCl + KClO3 + H2O
120.KOH + P + H2O→ PH3 + KH2PO2
121. PH3 + O2→ P2O5 + H2O
122.Cu(NO3)2→ CuO + NO2 + O2
6. Неметаллы ( р - элементы V111,V11, V1, V, 1V групп
периодической системы)
123. Исходя из строения атомов галогенов, указать, какие валентные состояния характерны для фтора, хлора, брома и йода. Какие степени окисления проявляют галогены в своих соединениях.
124. Написать уравнения реакций взаимодействия галогенов друг с другом. Указать степени окисленности галогенов в продуктах реакций.
125. Написать уравнения реакций взаимодействия галогенов с водой и растворами щелочей(горячими и холодными).
126. Дать сравнительную характеристику свойств галогеноводородов, указав характер изменения: а)температур кипения и плавления; б)термической устойчивости,; в)восстановительных свойств. Объяснить эти закономерности.
127. Из каких материалов можно изготавливать аппаратуру для получения фтороводорода? В каких сосудах хранят водный раствор фтороводорода? Как называется этот раствор?
128. Рассчитать какое количество бертолетовой соли можно получить из 168 г гидроксида калия.
129.Дать характеристику молекулярного кислорода, указав : а)химические свойства , б) строение молекулы. С какими простыми веществами кислород непосредственно не реагирует?
130.Привести примеры реакций получения SO2,которые сопровождаются и не сопровождаются изменением степени окисления серы.
131. Какие водородные соединения образует сера, как они получаются? Каково их строение? Какие степени окисления проявляет сера в этих соединениях?
132. Разбавленная серная кислота реагирует с BaCl2 ,HCl ,Cu(OH)2 ,Al . Составьте уравнения соответствующих реакций.
133. Концентрированная серная кислота взаимодействует с Hg, CO2 , Zn(OH)2 ,K2CO3. Составьте уравнения соответствующих реакций.
134.Оксид серы(1V) реагирует с O2 , CO2 ,H2O , NaOH. Составьте уравнения соответствующих реакций.
135.Один из трех цилиндров наполнен азотом, другой – аммиаком, третий – оксидом азота (11). Как химическим путем определить, какой газ находится в каждом из цилиндров?
136. Описать электронное строение NH3 ,NH4+ ,N2O , HNO3. Какова степень окисления азота в этих соединениях?
137. Привести примеры реакций, в которых азот играет роль окислителя, и пример реакции, в которой он является восстановителем.
138. Привести примеры характерных для аммиака реакций присоединения, замещения водорода и окисления.
139. Указать способы получения оксидов азота. Почему прямым синтезом из азота и кислорода может быть получен только оксид азота (11). Почему его заметный выход наблюдается только при высоких температурах?
140. Привести уравнения реакций получения фосфористой кислоты. Указать степень окисления фосфора в соединениях.
141. Привести уравнения реакций получения метафосфорной кислоты. Указать степень окисления фосфора в соединениях.
142. Исходя из положения фосфора в периодической системе: написать формулу оксида и гидроксида фосфора, указать тип кристаллической решетки фосфора, какие кислоты могут быть образованы кислотными оксидами фосфора?
143. Сколько граммов гидроксида кальция вступит в реакцию с фосфорной кислотой, если при этом образуется преципитат массой 43 г?
144. Вычислить массовую долю (в %) выхода фосфора по отношению к теоретическому, если фосфора получено 24,8 кг из 155 кг фосфата кальция.
145. Описать свойства оксида углерода (11), указав: электронное строение молекулы, отношение к воде и водным растворам кислот и щелочей, окислительно-восстановительные свойства.
146. Как химическим путем можно освободить CO2 от примеси SO2 ?
147.Вычислить массу СаО, необходимую доля получения 6,4 т СаС2 , какой объём СО при этом образуется (н.у.)
148. Какие из перечисленных газов при пропускании их через раствор щелочи вступают в ней в реакцию: CO, CO2 ,HCN ,CF4 ? Написать уравнения реакций
149.Дать краткую характеристику кремния, указав: электронное строение, валентные возможности, химические свойства свободного кремния.
7. Металлы 1 и 11 групп (s – элементы). Жесткость воды
150. С какими из перечисленных веществ будет реагировать гидроксид натрия: с соляной кислотой, оксидом магния, диоксидом углерода, гидроксидом цинка, гидроксидом кальция? Приведите примеры уравнений.
151.Установите истинную формулу вещества с массовой долей углерода 17,9%, кислорода 47,77%, натрия 34,33%. Молярная масса вещества равна 134.
152. Сколько граммов калия прореагировало с водой, если при этом образовался газ объёмом 4,48 л (н.у.)? Сколько граммов гидроксида калия при этом получилось?
153.Металл массой 0,86 г при реакции с водой вытесняет газ объёмом 246,4 мл(н.у.).Какой это металл?
154. Какие соли можно получить при взаимодействии гидроксида натрия с хлором, оксидом серы (1V), сероводородом? Составьте уравнения происходящих реакций.
155.Сколько литров кислорода можно получить при действии на пероксид натрия оксидом углерода(1V) массой 10 г?
156.Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:
Na → Na2O2 → Na2O → NaOH → NaCl
157. Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:
NaNO3→ NaHSO4→ Na2SO4→ NaCl → Na
158. Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:
K → KOH →KHCO3→ K2CO3
159. Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:
KOH → K2ZnO2 → Zn(OH)2 →Zn(HS)2
160. Написать уравнения реакций получения из карбоната натрия: силиката натрия, ацетата натрия, нитрата натрия, гидросульфата натрия, сульфита натрия.
161. Можно ли приготовить раствор калия и натрия в воде, в керосине? Как обнаружить присутствие воды в керосине, располагая одним из щелочных металлов?
162. Какие соединения калия и натрия наиболее распространены в природе? В какой цвет окрашивают пламя горелки соли натрия и калия?
163. Как получить следующие соединения натрия: пероксид, гидрид, гидроксид, гидрокарбонат?
164. При прокаливании 30 г кристаллогидрата сульфата кальция выделяется 6,28 г воды. Какова формула кристаллогидрата?
165. Присутствие каких солей в природной воде обуславливает её жесткость? Какие химические реакции происходят при добавлении к жесткой воде: NaOH , Na2CO3 ,Ca(OH)2 ?
166.Рассмотреть случаи постоянной и временной жесткости воды, пути устранения жесткости.
167.Почему элементы подгруппы кальция называют щелочноземельными металлами? В чем сходство и различие в свойствах щелочных и щелочноземельных металлов
168. Через известковую воду пропускают диоксид углерода. Образовавшийся вначале осадок растворяется при дальнейшем пропускании CO2 . Почему?
169. Как отличить гашеную известь от измельченного порошка известняка? Какими химическими реакциями сопровождается затвердевание извести?
170. Какая жесткость воды называется :общей, временной, карбонатной и некарбонатной? Почему нельзя применять для питания паровых котлов воду, содержащую хлорид магния?
171. Почему CaCO3 и MgCO3 растворяются в природной воде. Какие соли придают воде жесткость?
172. С какими из перечисленных ниже растворов будет реагировать металлический кальций: HNO3 ,KOH ,FeSO4, HBr ? Напишите уравнения происходящих реакций.
173. Сколько литров диоксида углерода можно получить из известняка массой 25 г с массовой долей примесей 20%?
174. Сколько граммов оксида кальция и воды необходимо для получения 0,5 моль гашеной извести.
175. Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:
Ca → Ca(OH)2→CaCO3→ CaHCO3
176. Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:
CaCl2→ Ca(NO3)2→ Ca3(PO4)2→ Ca(H2PO4)2
8. Металлы (d-элементы) 1, 11, V1, V11 , V111 групп периодической
системы
177. Назовите следующие соединения хрома: K2CrO4 , H2Cr2O7 ,CrO4 ,NaCrO2 ,K3CrO3.Какова валентность хрома в этих соединениях?
178. Какие реактивы надо добавить, чтобы получить и гидроксида хрома(111) хромит натрия, сульфат хрома(111)? Какие вещества получатся при прокаливании дихромата калия, дихромата алюминия?
179.Как хром относится к разбавленным и концентрированным кислотам и щелочам. Написать уравнения реакций.
180. Оксид хрома(111) массой 114 кг восстановили алюминием. Определить массу алюминия и массу получившегося хрома.
181. С какими из перечисленных веществ будет взаимодействовать соляная кислота: Zn .Hg ,HgS, Zn(NO3)2,Zn(OH)2.
182. С какими из перечисленных веществ будет взаимодействовать Zn(OH)2 : NaCl, H2SO4 ,NH4OH, KOH, Fe(OH)3.
183. Как получить хром из дихромата натрия? Составьте уравнения реакций.
184. Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:
CrO3→ Cr2O3→Cr→ CrCl3→ Cr(OH)3→NaCrO2
185. Какие свойства проявляет оксид марганца (1V)? Какова прочность образовавшихся при этом солей? Как ведет себя MnO2 в присутствии окислителей? Может ли MnO2 быть окислителем?
186. Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:
Mn → MnSO4 → K2MnO4 →MnO2 →MnO
187. Перечислите наиболее распространенные минералы марганца. Какое место занимает марганец в периодической системе?
188. С какими из перечисленных веществ будет взаимодействовать марганец: H2O , O2 ,KOH. H2 , H2SO4?
189. Для получения металлического марганца применяют три способа: силикотермический, алюминотермический и электролитический. Выразите эти процессы химическими уравнениями.
190. Каким способом можно получить марганец в промышленности? Где применяют марганец и его соединения?
191. Сколько граммов KMnO4 потребуется для окисления Na2 SO3 массой 12,6 г в щелочной и кислой средах?
192. Напишите уравнения реакций, в которых MnO2 проявляет: окислительные свойства, восстановительные свойства, степень окисления не меняется.
193. В каком виде железо встречается в природе? Назовите важнейшие природные соединения. Какое место занимает железо в периодической системе?
194. Как получают железо из руд? Что такое чугун и чем он отличается от стали?.
195. Перечислите методы получения стали, их достоинства и недостатки.
196. С какими растворами будет взаимодействовать железо: KOH ,H3PO4 ,AgNO3 ,MgCl2 ,KCNS. Написать уравнения реакций.
197. С какими веществами будет взаимодействовать оксид железа(111) : H2O , HCl , NaOH , CuCl2. Написать уравнения реакций.
198. С какими веществами будет взаимодействовать гидроксид железа(111) : HNO3 , KOH, ZnSO4 ,H2CO3. Написать уравнения реакций.
199.Перечислить известные вам способы переработки чугуна в сталь. Какие химические процессы протекают при этом.
200. Составьте уравнения реакций, которые надо провести для осуществления следующих превращений:
Cu→ Cu(NO3)2 →Cu(OH)2 →CuCl2 → [Cu(NH3)4]Cl2
