5 Ионные реакции осаждения, нейтрализации, гидролиза
| Вид материала | Документы |
- Рекомендации к зачёту, 133.1kb.
- Написать краткие ионные и молекулярные уравнения реакций гидролиза карбоната натрия,, 4.27kb.
- Методический пакет учебного курса, 331.54kb.
- Молекулярно-динамическое моделирование осаждения металлического нанокластера на подложку, 66.11kb.
- Наносимые электрохимическими методами на поверхность детали в результате осаждения, 96.3kb.
- Для подготовки к экзамену по общей химии (2 семестр) Кинетика, 73.49kb.
- Программа коллоквиумов по курсу физической химии, 99.84kb.
- Оглавление, 334.79kb.
- Календарный план занятий по физической химии в весеннем семестре 2008/2009 уч года, 32.67kb.
- Отчет 86 с., 34 рис., 15 табл., 53 источника, 2 приложения. Ключевые слова : структура, 56.56kb.
Решение
Воспользуемся уравнением:
с1×V1 = с2×V2
с(NaOH)×24 мл× = 0,12 моль/л(НСl)× 20 мл
с(NaOH) = 0,1 моль/л.
Практическая работа
Определение концентрации водных растворов щелочи
При помощи метода нейтрализации или кислотно-основного титрования определяют концентрации кислот и щелочей. Простейшим случаем является титрование сильной кислоты щелочью или сильной щелочи сильной кислотой. Образующаяся в результате реакции соль не гидролизуется, значение рН в конце титрования 7.
Задание. Определить концентрации двух растворов NaOH.
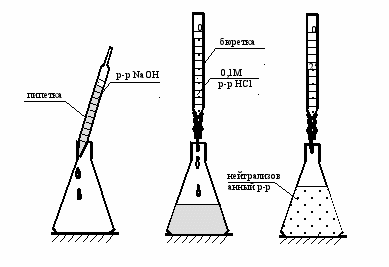
Из мерной колбы, в которой находится анализируемый раствор щелочи, пипеткой отбирают пробу – 20,0 мл раствора и осторожно помещают в коническую колбу для титрования на 100 или 200 мл.
- К щелочи добавляют индикатор (фенолфталеин), раствор приобретает малиновую окраску. Осуществляют титрование раствора. Из бюретки медленно приливают стандартный раствор кислоты до тех пор, пока не установится точка нейтральности: раствор станет бесцветным (рис. 61).
- Рассчитывают концентрацию щелочи по уравнению:
с(NaOH) = с(HCl) . V(HCl) / V(NaOH);
Повторяют измерения со следующим неизвестным раствором (рис. 61).
в)
Рис. 61. Титрование раствора гидроксида натрия неизвестной концентрации стандартным раствором соляной кислоты
Определение некоторых катионов и анионов в растворе
Для проведения качественного анализа используют от 0,5 до 5 мл раствора.
Для определения катионов Ag+ и Pb2+ используют в качестве реагента 2М раствор НСl. К 2-3 каплям раствора нитрата серебра прилейте 1-2 капли 2М раствора НСl – выпадает белый творожистый осадок AgCl.
AgNO3 + HCl ® АgCl¯ + HNO3
На прямом солнечном свету осадок довольно быстро разлагается. Его окраска становится сероватой, затем темно-серой и, наконец, черной:
АgCl¯ ® Ag¯ + Cl×
При определении иона Pb2+ к 3-4 каплям раствора соли свинца добавьте 2-3 капли 2М раствора НСl – выпадает белый творожистый осадок PbCl2. Для более полного осаждения PbCl2 добавляют этанол. Чтобы различить осадки АgCl и PbCl2, используют хорошую растворимость последнего в горячей воде.
Для определения ионов Са2+ и Ва2+ используют 1М раствор H2SO4. К раствору, содержащему катионы Са2+ и Ва2+, добавляют 1М раствор H2SO4 и этанол для более полного осаждения ионов в виде сульфатов:
СaCl2 + H2SO4 ® СaSO4 ¯ + 2HCl
BaCl2 + H2SO4 ® BaSO4 ¯ + 2HCl
Чтобы различить соли кальция и бария, следует помнить, что соли кальция окрашивают пламя горелки в кирпично-красный цвет, а соли бария – в зеленый с оттенком желтого.
Катионы Al3+, Zn2+ осаждаются в виде амфотерных гидроксидов 2М раствором NaOH:
AlCl3 + 3NaOH ®Al(OH)3¯ + 3NaCl
ZnCl2 + 2NaOH ®Zn(OH)2¯ + 2NaCl
Образующиеся гидроксиды легко растворяются в разбавленных кислотах и в избытке щелочи c образованием бесцветных гидроксоалюминатов [Al(OH)4]– и гидроксоцинкатов [Zn(OH)4]2–
При обнаружении галогенид-анионов в качестве реагента используют раствор AgNO3. При добавлении его к хлоридам, бромидам и иодидам образуются осадки солей серебра, нерастворимые в азотной кислоте: AgCl – белого, AgBr – желтоватого, AgI – ярко-желтого цвета.
При обнаружении сульфат анионов используют в качестве реагента раствор BaCl2 в нейтральной или слабощелочной среде. Образуется нерастворимый осадок BaSO4:
Na2SO4 + BaCl2 ® BaSO4¯ + 2NaCl
Тема 6. Законы термодинамики и кинетики
6.1. Законы термодинамики
Твердые, жидкие и газообразные тела, занимающие некоторый объем, могут находиться в относительном покое, но атомы и молекулы тел непрерывно совершают невидимые человеческому глазу движения. Неподвижное тело обладает внутренней энергией U, слагающейся из кинетической (энергии движения микрочастиц) и потенциальной энергии (энергии притяжения и отталкивания микрочастиц).
Первый закон термодинамики и его применение
к химическим реакциям
В соответствии с законом сохранения энергии между теплотой Q, сообщаемой нагревателем, и изменением энергетического состояния газообразного тела существует равенство:
Q = U + А,
где U изменение внутренней энергии газа в результате нагревания, А работа расширения, совершаемая газом при постоянном давлении Р.
Работа расширения вычисляется по уравнению:
А = Р V,
где V изменение объема газа при его расширении.
Уравнение
Q = U + РV
есть математическая форма выражения первого закона термодинамики.
Теплота (Q), сообщаемая системе, расходуется на увеличение внутренней энергии системы (U) и на совершение этой системой работы (A=PV).
Формулировка первого закона термодинамики эквивалентна формулировке закона сохранения энергии: энергия не возникает из ничего и не исчезает бесследно: она лишь превращается из одних видов в другие, причем в строго эквивалентных количествах. В термодинамике рассматривают только две формы передачи энергии теплоту Q и работу А.
Обычно химические реакции проводят при постоянном внешнем давлении Р. Поэтому уравнение первого закона термодинамики:
Q = U + РV
преобразуют следующим образом:
Qp = U2 – U1+ P(V2 – V1) или
Qp = (U2 – РV2) – (U1 – PV1)
Функцию U+PV, которая не зависит от пути процесса, а лишь от начального (оно обозначено цифрой 1) и конечного (оно обозначено цифрой 2) состояний, называют энтальпией и обозначают символом Н. Тогда
Qр = (U + РV) = Н
или
Qр = (Hкон –Ннач) = Н
Уравнение Qр = Н представляет математическую форму основного закона термохимии, который установлен русским академиком Г. И. Гессом в 1836 г.:
энтальпия реакции Нr, протекающей при постоянном давлении Р и температуре Т, не зависит от промежуточных стадий, а определяется лишь начальным и конечным состояниями системы.
Обозначение Н следовало бы называть изменением энтальпии, но для краткости называют энтальпией.
Пример. Вычислить энтальпию реакции (Нr, символ «r» означает reaction реакция) графита с кислородом:
С(гр.) + ½ О2(г) = СО (г),
если известны энтальпии реакций:
1) С(гр.) + О2(г) = СО2 (г); Нr = 393,5 кДж и
2) СО(г) + ½О2(г) = СО2 (г); Нr = 283 кДж
С химическими уравнениями и их энтальпиями можно оперировать так же, как с алгебраическими уравнениями. Интересующую нас реакцию можно получить, если вычесть из уравнения (1) уравнение (2):
С(графит) + О2(г) СО(г) ½О2(г) = СО2 (г) СО2 (г); и Нr(1) Нr(2) = [(393,5) ( 283)]
или
С(графит) + ½ О2(г) = СО (г); Нr = 110,5 кДж
Следовательно, энтальпию этой реакции можно получить вычитая из энтальпии Нr первой реакции энтальпию Нr второй реакции.
Приведенные в примере химические уравнения называются термохимическими. В них указаны физические состояния реагирующих веществ и энтальпии реакций.
Если превращения веществ сопровождаются поглощением энергии, то Нr положительны. Такие реакции называют эндотермическими. Если превращения веществ сопровождаются выделением энергии, то Нr отрицательны. Такие реакции называют экзотермическими.
Стандартное состояние и стандартная
энтальпия образования вещества
Стандартное состояние индивидуального вещества это физическое состояние 1 моль индивидуального химического соединения при внешнем давлении 1 атм (1, 013105 Па) и температуре Т К в том агрегатном состоянии, которое устойчиво в данных условиях. Стандартное состояние индивидуального вещества характеризуется стандартной энтальпией образования Нf 0. Нижний символ «f» означает formation образование, верхний индекс нуль служит указанием стандартного состояния, т.е. значение энтальпии образования определено при внешнем давлении, равном 1 атм. Стандартное состояние и стандартная энтальпия могут относиться к любой температуре. В табл. 10 приведены стандартные энтальпии образования некоторых веществ при 298 К. Энтальпии образования простых веществ равны нулю при любых температуре и давлении.
Вещество, состоящее из атомов одного химического элемента, может быть представлено различными молекулярными структурами, но простому веществу в термодинамике соответствует только одно из них. Например, из двух молекулярных образований кислорода О3(г) и О2(г) только О2(г) отвечает простому веществу, для которого Нf0 принято равным нулю. Из двух химических веществ С(графит) и С(алмаз) только графит рассматривается как простое вещество, для которого Нf0 принято равным нулю.
Т а б л и ц а 10
Стандартные энтальпии образования некоторых веществ при 298 К
| Вещество | Нf0, кДж/моль | Реальные или гипотетические реакции образования, для которых приведены значения Нf0 |
| Al(т) Al2О3(т) | 0 1676,0 | 2Al(т) + 3/2О2(г) = Al2О3(т) |
| О2(г) O3(г) | 0 +142,3 | 3/2О2(г) = О3(г) |
| С(графит) С(алмаз) | 0 1,828 | С(графит) = С(алмаз) |
| Н2(г) СН4(г) | 0 74,9 | С(графит) + 2Н2(г) = СН4(г) |
| С2Н2(г) С2Н5ОН (ж) | + 226,8 277,6 | 2С(графит) + Н2(г) = С2Н2(г) (ацетилен) 2С(графит) + 3Н2(г) + 1/2О2(г) = С2Н5ОН (ж) |
| СО(г) СО2(г) | 110,5 393,5 | С(графит) + 1/2О2(г) = СО(г) С(графит) + О2(г) = СО2(г) |
| Са(т) СаСО3(т) | 0 1207,0 | Са(т) + С(графит) + 3/2О2(г) = СаСО3(т) |
| СаО(т) Са(ОН)2(т) | 635,5 986,6 | Са(т) + 1/2О2(г) = СаО(т) Са(т) + О2(г) + Н2(г) = Са(ОН)2(т) |
| Н2О(г) Н2О(ж) | 241,8 285,8 | Н2(г) + 1/2О2(г) = Н2О(г) Н2(г) + 1/2О2(г) = Н2О(ж) |
| N2(г) NO(г) | 0 +90,25 | 1/2N2(г) + 1/2О2(г) = NO(г) |
| NO2(г) NH3(г) | +33 46,2 | 1/2N2(г) + О2(г) = NO2(г) 1/2N2(г) + 3/2Н2(г) = NH3(г) |
| Au(т) Au2O3(т) | 0 3 | 2Au(т) + 3/2O2(г) = Au2O3(т) |
| Fe(т) Fe2O3(т) | 0 822,2 | 2Fe(т) + 3/2O2(г) = Fe2O3(т) |
Стандартная энтальпия образования сложного вещества это энтальпия реакции синтеза его из простых веществ, при 1 атм. Например, при сжигании углерода (графита) или при сжигании водорода определяют энтальпии образования СО2 и Н2О по реакциям:
С(графит) + О2(г) = СО2(г); Нf0 = 393,5 кДж/моль
Н2(г) + 1/2О2(г) = Н2О(ж) Нf0 = 285,8 кДж/моль
Не всегда значения Нf0 сложных веществ определяют в реакции синтеза этого вещества из простых. Трудно представить, что из одних и тех же простых веществ (водорода и графита) в одном случае можно получить метан, а в другом ацетилен:
С(графит) + 2Н2(г) = СН4(г); Нf0 = 74,9 кДж/моль
2С(графит) + Н2(г) = С2Н2(г); Нf0 = + 226,8 кДж/моль
Метод расчета Нf0 большинства органических соединений основан на измерении количества тепла, выделяющегося при сжигании их в атмосфере кислорода. Например, чтобы определить Нf0 метана, его сжигают в кислороде и определяют количество выделившейся энергии, т. е. энтальпию химической реакции, Нr0:
СН4(г) + 2О2(г) = СО2(г) + 2Н2О(ж); Нr0 = 890,2 кДж
Подобным образом поступают с водородом и углеродом, сжигая их в кислороде:
- С(гр) + О2(г) = СО2(г); Нf0(1) = 393,5 кДж
2. Н2(г) + ½О2(г) = Н2О(ж) Нf0(2) = 285,8 кДж
Результаты сжигания трех веществ позволяют рассчитать энтальпию образования метана. Нетрудно убедиться, что если из суммы уравнений (1) и (2) вычесть уравнение реакции горения метана, то получим, соответственно, энтальпию образования метана из простых веществ.

С(гр) + О2(г) = СО2(г); Нf0(1) = 393,5 кДж
+
2Н2(г) + О2(г) = 2Н2О(ж); Нf0(2) = 2285,8 кДж
 СН4(г) + 2О2(г) = СО2(г) + 2Н2О(ж); Нr0 = 890,2 кДж
СН4(г) + 2О2(г) = СО2(г) + 2Н2О(ж); Нr0 = 890,2 кДж
С(гр) + 2Н2(г) = СН4(г)
Нf0(СН4)=[393,5]+[2285,8][890,2]=74,9 кДж/моль
В соответствии с законом Гесса для расчета энтальпии химической реакции (Нr0) следует из алгебраической суммы энтальпий образования продуктов реакции вычесть сумму энтальпий образования исходных веществ:
Нr0 =[сумма энтальпий образования продуктов реакции] [сумма энтальпий образования исходных веществ]
Вопросы для проверки знаний
- Какая формулировка первого закона термодинамики устанавливает связь между теплотой, работой и внутренней энергией?
- Теплота процесса при постоянном давлении связана с изменением энтальпии процесса равенством: Qp = . Можно ли утверждать на основании этого равенства, что энергия в форме теплоты расходуется на изменение внутренней энергии системы и на совершение этой системой работы?
- Какое состояние вещества в термодинамике называется стандартным?
- *Можно ли утверждать, что закон Гесса это закон сохранения энергии, примененный к химическим реакциям?
*Упражнения
- Объясните, почему энтальпия образования жидкой воды (285,8 кДж/моль) больше энтальпии образования газообразной воды ( 241,8 кДж/моль).
- Докажите, что при сгорании 1 кг этанола теплоты выделиться больше, чем при сгорании 1 кг ацетилена.
**Второй закон термодинамики
Первый закон термодинамики можно выразить всего двумя словами: энергия сохраняется. Добавим, не вдаваясь в детали, что энергия это способность совершать работу. Приведенная характеристика энергии необходима нам, чтобы понять сущность второго закона термодинамики.
Полное количество энергии должно сохраняется в любом процессе. Об этом говорит закон сохранения энергии. Как показывает многовековая практическая деятельность людей, перераспределение энергии между телами происходит необратимым образом. Эта асимметрия в природе позволяет разделить все процессы на два типа:
- самопроизвольные процессы, идущие сами по себе, без какого-либо воздействия извне. Для осуществления этих процессов не требуется совершения работы;
- несамопроизвольные процессы, не идущие сами по себе, требующие для своей реализации определенного воздействия извне, совершения работы.
Расширение газа в пустоту является самопроизвольным процессом, но для того, чтобы газ вернуть в исходное положение, требуется затратить работу на его сжатие. Самопроизвольно сжатие газа не происходит.
Энергия от горячего к холодному телу переходит в форме теплоты самопроизвольно, но обратный процесс требует затраты работы и является несамопроизвольным. Чтобы морозильная камера холодильника работала, отдавая теплоту в окружающую среду, должен совершать работу электромотор.
На гидроэлектростанции вода, самопроизвольно падающая с высоты и вращающая ротор турбины, производит электрическую энергию. Но вода не возвращается самопроизвольно с нижнего на верхний бьеф. Чтобы поднять воду требуется совершить работу. Можно убедиться на ряде примеров в том, что самопроизвольный процесс приводит к рассеянию энергии и увеличению беспорядка в системе.
Взаимодействие металлического натрия с водой представляет собой пример самопроизвольного процесса, результатом которого является образование раствора NaOH и выделение газообразного водорода. Процесс получения металлического натрия из гидроксида натрия – несамороизвольный процесс, чтобы реализовать его надо затратить энергию.
Вывод: единственным результатом любого самопроизвольного процесса в природе является движение к устойчивому состоянию или, как говорят в термодинамике, к состоянию равновесия.
От качественного описания самопроизвольных процессов в системе необходимо перейти к их количественной характеристике. Параметр пригодный для оценки направления самопроизвольного процесса был найден и назван энтропией S. Изменение энтропии системы позволяет определить направление самопроизвольного процесса. В термодинамике доказано, а мы примем в качестве постулатов следующие положения:
- изменение энтропии системы Sсис = Sкон Sнач определяется уравнением:
Sсист = Q/Т,
где Sкон и Sнач – энтропии конечного и начального состояния системы, т.е. изменение энтропии системы определяется количеством теплоты Q, сообщенной системе в равновесном процессе, отнесенное к абсолютной температуре Т;
2. в самопроизвольном процессе:
Sсист Q/Т
3. если система изолирована от окружающей среды, то Q = 0 и
Sсист 0
Из неравенства Sсист 0 следует важный вывод: изменение энтропии системы служит тем параметром, который определяет направление самопроизвольного процесса. Теперь мы можем дать следующую формулировку второго закона термодинамики: в системе самопроизвольный процесс происходит в направлении увеличения энтропии системы.
Таким образом, чем больше беспорядок в системе, чем в большей степени рассеяна энергия между телами её составляющими, тем больше энтропия системы.
Энтропия S оправдывает свое название. Название состоит из греч. еn предлог «в» и trope «превращение». Буквально «превращение в». Имеется в виду направленность превращения энергии во все менее ценные формы, т.е. рассеяние энергии и увеличение беспорядка.
